Method Article
عزل النواقل الفيروسية المرتبطة بالغدي من خلال بروتوكول كروماتوغرافيا تقارب الهيبارين أحادي الخطوة وشبه آلي
* These authors contributed equally
In This Article
Summary
تصف هذه المخطوطة بروتوكولا مفصلا لتوليد وتنقية النواقل الفيروسية المرتبطة بالغدي باستخدام طريقة كروماتوغرافيا تقارب محسنة قائمة على الهيبارين. إنه يقدم نهجا بسيطا وقابلا للتطوير وفعالا من حيث التكلفة ، مما يلغي الحاجة إلى الطرد المركزي الفائق. تظهر النواقل الناتجة درجة نقاء عالية ونشاطا بيولوجيا ، مما يثبت قيمتها في الدراسات قبل السريرية.
Abstract
أصبح الفيروس المرتبط بالغدي (AAV) ناقلا ذا قيمة متزايدة لتوصيل الجينات في الجسم الحي ويخضع حاليا لتجارب سريرية بشرية. ومع ذلك ، فإن الطرق الشائعة الاستخدام لتنقية AAVs تستخدم كلوريد السيزيوم أو الطرد المركزي الفائق لتدرج كثافة اليوديكسانول. على الرغم من مزاياها ، فإن هذه الطرق تستغرق وقتا طويلا ، ولها قابلية محدودة للتوسع ، وغالبا ما تؤدي إلى ناقلات ذات نقاء منخفض. للتغلب على هذه القيود ، يحول الباحثون انتباههم إلى تقنيات الكروماتوغرافيا. هنا ، نقدم بروتوكول كروماتوغرافيا تقارب محسن قائم على الهيبارين يعمل كخطوة التقاط عالمية لتنقية AAVs.
تعتمد هذه الطريقة على التقارب الجوهري للنمط المصلي AAV 2 (AAV2) لبروتيوغليكان كبريتات الهيباران. على وجه التحديد ، يستلزم البروتوكول النقل المشترك للبلازميدات التي تشفر بروتينات قفيصة AAV المرغوبة مع تلك الموجودة في AAV2 ، مما ينتج عنه ناقلات AAV الفسيفسائية التي تجمع بين خصائص كلا النمطين المصليين الأبوين. باختصار ، بعد تحلل الخلايا المنتجة ، يتم تنقية خليط يحتوي على جزيئات AAV مباشرة بعد بروتوكول كروماتوغرافيا تقارب الهيبارين المحسن أحادي الخطوة باستخدام نظام كروماتوغرافيا سائل البروتين السريع القياسي (FPLC). يتم بعد ذلك تركيز جزيئات AAV المنقاة وتخضع لتوصيف شامل من حيث النقاء والنشاط البيولوجي. يقدم هذا البروتوكول نهجا مبسطا وقابلا للتطوير يمكن إجراؤه دون الحاجة إلى الطرد المركزي الفائق والتدرجات ، مما ينتج عنه عيار فيروسي نظيف ومرتفع.
Introduction
يشق ناقل الفيروس المرتبط بالغدي (AAV) طريقه كواحد من أكثر أنظمة التوصيل الواعدة في دراسات العلاج الجيني الحالية. تم تحديد AAV في البداية في عام 19651 ، وهو فيروس صغير غير مغلف ، مع قفيصة بروتين icosahedral يبلغ قطرها حوالي 25 نانومتر ، وتؤوي جينوم DNA أحادي الشريط. تنتمي AAVs إلى عائلة Parvoviridae وإلى جنس Dependoparvovirus نظرا لاعتمادها الفريد على العدوى المشتركة بفيروس مساعد ، مثل فيروس الهربس البسيط أو ، في كثير من الأحيان ، الفيروس الغدي ، لإكمال دورة lytic 2,3.
يتكون الجينوم 4.7 كيلو قاعدة من AAVs من إطارين مفتوحين للقراءة (ORFs) محاطان بتكرارين طرفيين مقلوبين (ITRs) يشكلان نهايات دبوس شعر مميزة على شكل حرف T4. ولوائح الاتصالات الدولية هي العناصر الوحيدة المؤثرة في كومنولث الدول المستقلة والضرورية لتعبئة المركبات AAV وتكرارها وإدماجها، وبالتالي فهي التسلسلات AAV الوحيدة المحتفظ بها في متجهات AAV المؤتلفة (rAAV). في هذا النظام ، يتم توفير الجينات اللازمة لإنتاج النواقل بشكل منفصل ، في trans ، مما يسمح بتعبئة الجين محل الاهتمام داخل القفيصة الفيروسية 5,6.
يقوم كل جين فيروسي بتدوين بروتينات مختلفة من خلال الربط البديل وبدء الكودونات. داخل Rep ORF ، يتم تشفير أربعة بروتينات غير هيكلية (Rep40 و Rep52 و Rep68 و Rep78) ، وتلعب أدوارا حاسمة في النسخ المتماثل والتكامل الخاص بالموقع وتغليف الحمض النووي الفيروسي 7,8. يعمل Cap ORF كقالب للتعبير عن ثلاثة بروتينات هيكلية تختلف عن بعضها البعض في نهايتها N ، (VP1 و VP2 و VP3) ، والتي تتجمع لتشكيل قفيصة فيروسية 60 مير بنسبة 1: 1: 10 4,9. بالإضافة إلى ذلك ، فإن ORF البديل المتداخل في جين Cap مع كودون بدء CUG غير تقليدي يشفر بروتين تنشيط التجميع (AAP). وقد ثبت أن هذا البروتين النووي يتفاعل مع بروتينات القفيصة المركبة حديثا VP1-3 ويعزز تجميع القفيصة10,11.
تمثل الاختلافات في تسلسل الأحماض الأمينية للقفيصة 11 نمطا مصليا AAV تحدث بشكل طبيعي وأكثر من 100 متغير معزول من البشر وأنسجة الرئيسيات غير البشرية7،12،13. تتحكم الاختلافات في تشكيل المناطق المتغيرة هيكليا في خصائص المستضدات المميزة وخصائص ربط المستقبلات للقفيصات من سلالات مختلفة. ينتج عن هذا انتحاء الأنسجة المتميز وكفاءات التنبيغ عبر أعضاء الثدييات المختلفة14.
اعتمدت طرق الإنتاج المبكرة ل rAAVs على عدوى الفيروس الغدي لأغراض مساعدة15،16،17،18،19. على الرغم من كونها فعالة وعادة ما تكون سهلة الإنتاج على نطاق واسع ، تنشأ العديد من المشاكل من هذه العدوى. حتى بعد التنقية وخطوة تغيير طبيعة الحرارة للتعطيل ، قد تظل جزيئات الفيروسات الغدية موجودة في مستحضرات AAV ، مما يشكل مشكلة سلامة غير مرغوب فيها20. علاوة على ذلك ، فإن وجود بروتينات فيروسية غحمية مشوهة أمر غير مقبول للاستخدام السريري. تستفيد استراتيجيات الإنتاج الأخرى من سلالات فيروس الهربس البسيط المؤتلف المصممة لجلب Rep / Cap والجينات المحورة إلى الخلايا المستهدفة21 أو نظام خلية حشرة الفيروس البقعي22. على الرغم من أن هذه الأنظمة توفر مزايا من حيث قابلية التوسع والتوافق مع ممارسات التصنيع الجيدة ، إلا أنها لا تزال تواجه مشكلات مماثلة.
تم اعتماد طريقة النقل الثلاثي لإنتاج rAAV بشكل شائع للتغلب على هذه المشكلات بسهولة. باختصار ، تعتمد مجموعة rAAV على النقل العابر للخلايا بثلاثة بلازميدات مشفرة من أجل: 1) شريط التعبير الجيني المحبأ بين لوائح الاتصالات الدولية من جينوم AAV2 من النوع البري (pITR) ؛ 2) تسلسل Rep / Cap اللازم للنسخ المتماثل وتجميع virion (pAAV-RC) ؛ و 3) الحد الأدنى من بروتينات الفيروسات الغدية (E1A و E1B و E4 و E2A) جنبا إلى جنب مع الحمض النووي الريبي المرتبط بالفيروس الغدي المطلوب لتأثير المساعد (pHelper)6،20،23. بينما توفر طرق نقل البلازميد البساطة والمرونة لإنتاج rAAV في الدراسات قبل السريرية ، فإن هذه الإجراءات لها قيود من حيث قابلية التوسع والتكرار عند تطبيقها على الإنتاج على نطاق واسع. كنهج بديل ، يمكن تحقيق إنتاج rAAV من خلال استخدام خطوط خلايا منتج AAV (لكل من النمو الملتصق والمعلق) ، معبرا بثبات إما عن جينات AAV Rep / Cap أو Rep / Cap بالاشتراك مع تركيبات المتجهات. في هذه الأنظمة ، يتم إدخال الجينات المساعدة الفيروسية الغدية من خلال نقل البلازميد. على الرغم من أن هذه الاستراتيجية تعمل على تحسين قابلية التوسع في عملية زراعة الخلايا ، إلا أنها معقدة تقنيا وتستغرق وقتا طويلا21،24،25.
في كلتا الحالتين ، يتم بعد ذلك تحليل الخلايا المنتجة وتعريضها لخطوة تنقية واحدة أو متعددة. حاليا ، تشمل الطرق الرئيسية لتنقية rAAVs استخدام كلوريد السيزيوم (CsCl) أو الطرد المركزي المتدرج عالي السرعة باليوديكسانول المتبع ، أم لا ، بواسطة تقنيات الكروماتوغرافيا26. استخدم مخطط التنقية الأصلي لهطول الأمطار الفيروسية كبريتات الأمونيوم ، تليها جولتان أو ثلاث جولات من الطرد المركزي الفائق من خلال تدرج CsCl. تشمل المزايا الرئيسية لهذه العملية إمكانية تنقية جميع الأنماط المصلية والقدرة على فصل الجسيمات الكاملة ماديا عن القفيصات الفارغة بناء على كثافاتها المختلفة. ومع ذلك ، فإن هذه الطريقة معقدة وتستغرق وقتا طويلا ولديها قابلية محدودة للتوسع ، مما يؤدي غالبا إلى ضعف العائد وانخفاض جودة العينة27،28،29،30. علاوة على ذلك ، غالبا ما يكون غسيل الكلى ضد المخزن المؤقت الفسيولوجي ضروريا قبل الدراسات في الجسم الحي بسبب التأثيرات السامة التي يمكن أن يمارسها CsCl على الثدييات.
كما تم استخدام يوديكسانول كوسيط تدرج متساوي التناضح بديل لتنقية ناقلات rAAV ، مع مزايا على CsCl من وجهة نظر السلامة وفعالية المتجهات. ومع ذلك ، مثل CsCl ، تقدم طريقة iodixanol بعض العيوب المتعلقة بقدرة تحميل محللات زراعة الخلايا (وبالتالي قابلية التوسع في تنقية rAAV) وتظل طريقة تستغرق وقتا طويلا ومكلفة30,31.
للتغلب على هذه القيود ، حول الباحثون انتباههم إلى تقنيات الكروماتوغرافيا. في هذا الصدد ، تم تطوير العديد من مناهج التنقية التي تتضمن إما طرق كروماتوغرافيا التقارب أو الكارهة للماء أو التبادل الأيوني. تعتمد هذه الطرق على الخصائص الكيميائية الحيوية لنمط مصلي معين ، بما في ذلك مستقبلاتها الطبيعية ، أو خصائص شحنة الجسيم الفيروسي32. على سبيل المثال ، اكتشاف أن AAV2 و AAV3 و AAV6 و AAV13 يفضل الارتباط ببروتيوغليكان كبريتات الهيباران (HSPG) ، فتح إمكانية استخدام الهيبارين وثيق الصلة في تنقية كروماتوغرافيا التقارب. ومع ذلك ، يمكن أن تختلف مواقع الارتباط ب HSPG بين الأنماط المصلية ، وتوسط ارتباط AAV وإصابة الخلايا المستهدفة بطرق مختلفة2،33،34،35،36. من ناحية أخرى ، يرتبط AAV1 و AAV5 و AAV6 بحمض السياليك المرتبط ب N (SA) ، بينما يستخدم AAV4 SA المرتبط ب O 2،14،34. باتباع نفس الأساس المنطقي ، تم أيضا تطوير بروتوكول كروماتوغرافيا تقارب أحادي الخطوة لتنقية rAAV5 بناء على استخدام الميوسين ، وهو بروتين ثديي عالي التخصيب في SA37. مثل التقنيات القائمة على الهيبارين ، يعتمد هذا التنقية أيضا على النمط المصلي المحدد الذي يتم إنشاؤه. بصرف النظر عن الهيبارين والميوسين ، تم استكشاف روابط أخرى لكروماتوغرافيا التقارب ، مثل الجسم المضاد أحادي النسيلة A20 والأجسام المضادة أحادية المجال للإبل (AVB Sepharose و POROS CaptureSelect)22،23،38،39،40،41. تتضمن الاستراتيجيات المبتكرة الأخرى لتحسين طرق التنقية الموجودة سابقا إدخال تعديلات صغيرة في قفيصة rAAV لتقديم حواجز ربط محددة. على سبيل المثال ، يمكن تنقية rAAVs الموسومة بسداسي الهيستيدين أو البيوتينيل باستخدام الروابط التي تستهدف تلك الحواتم (حمض النيكل نيتريلوتريس أسيتيك وراتنجات أفيدين ، على التوالي)42،43،44.
في محاولة لتوسيع الخصائص المرغوبة ل rAAVs ، قام المحققون بارتداء الملابس المتقاطعة للفيروسات عن طريق خلط قفيصاتهم. يتم تحقيق ذلك من خلال توفير جين القفيصة من نمطين مصليين متميزين AAV بنسب متساوية أو مختلفة أثناء الإنتاج ، مما يؤدي إلى ظهور بنية قفيصة تتكون من خليط من الوحدات الفرعية للقفيصة من أنماط مصلية مختلفة34،45،46،47،48،49،50. تقدم الدراسات السابقة دليلا ماديا على أن بروتينات القفيصة المشتركة التعبير من AAV2 مع AAV1 (نسبة 1: 1) و AAV2 مع AAV9 (نسبة 1: 1) تؤدي إلى توليد ناقلات الفسيفساء rAAV1 / 2 و rAAV2 / 9 ، على التوالي45،46،48. تتمثل إحدى الفوائد الرئيسية لتوليد rAAVs الفسيفسائية في القدرة على دمج السمات المفيدة من الأنماط المصلية المختلفة AAV ، مما يؤدي إلى تحسينات تآزرية في التعبير الجيني المحوري والانتحاء ، مع الحفاظ على الخصائص الأخرى المفيدة أثناء إنتاج rAAV. ومن المثير للاهتمام ، أن بعض متغيرات الفسيفساء تظهر خصائص جديدة مختلفة عن أي من الفيروسات الأبوية46،47،49. من خلال الاستفادة من قدرة ربط الهيبارين ل AAV2 ، يمكن توليد ناقلات rAAV الفسيفسائية وتنقيتها عن طريق خلط AAV2 مع قفيصات AAV طبيعية أو جديدة أخرى ناتجة عن التطور الموجه و / أو التصميم العقلاني. ومع ذلك ، فقد أبرزت الدراسات السابقة أهمية توافق الوحدة الفرعية للقفيصة عند محاولة تجميع متجهات الفسيفساء. على سبيل المثال ، أظهر Rabinowitz وزملاؤه أنه على الرغم من أن نقل AAV1 و AAV2 و AAV3 أدى إلى تجميع مشترك فعال لقفيصات الفسيفساء ، إلا أن خلع الملابس المتقاطع لهذه الأنماط المصلية مع AAV4 أعاق توليد virionsمستقرة 34،45،47. بالإضافة إلى ذلك ، أظهر AAV1 و AAV2 و AAV3 توافقا منخفضا مع AAV5 ، نظرا لانخفاض التتر الفيروسي الذي تم الحصول عليه عند خلط هذه القفيصات بنسب مختلفة. ومن المثير للاهتمام ، أن الفسيفساء rAAV2 / 5 أظهرت انخفاض خصائص ربط الهيبارين ، مع الحفاظ على قدرة ربط الميوسين مثل AAV5 الأبوي. ومع ذلك ، حافظ rAAV3 / 5 بنسبة 3: 1 على الارتباط المزدوج بالهيبارين والموسين. بشكل عام ، يمكن أن يستفيد توليد rAAVs الفسيفسائية الجديدة مع النقل المحسن أو الانتحاء المحدد أو المناعة المنخفضة بشكل كبير من فهمنا لتجميع القفيصة وتفاعلات المستقبلات ، مع مجموعات محددة لا تزال تتطلب تحقيقا شاملا وتحسينا.
في العمل الحالي ، وصفنا بروتوكولا خطوة بخطوة لإنتاج وتنقية rAAVs باستخدام طريقة كروماتوغرافيا تقارب الهيبارين المحسنة. يتم إنتاج rAAVs عن طريق النقل العابر ويتم تنقيتها باستخدام نظام كروماتوغرافيا البروتين السائل السريع (FPLC). بعد تركيز الكسور المنقاة المختارة ، تتميز المخزونات الفيروسية الناتجة من حيث العيار والنقاء والخصائص الفيزيائية الجوهرية والنشاط البيولوجي في المختبر وفي الجسم الحي. كدليل على المفهوم ، نوضح التحسينات وقابلية تطبيق هذا البروتوكول لتوليد متجهات الفسيفساء rAAV1 / 2 و rAAV2 / 9. استند اختيار كل نمط مصلي إلى انتحاءاتها المختلفة بشكل لافت للنظر ، مما قد يمنح خصائصها الفريدة لإصدارات الفسيفساء أيضا. النمط المصلي AAV 1 ، مع انتحاء معتدل بشكل عام للجهاز العصبي المركزي (CNS) ، لديه القدرة على تحويل الخلايا العصبية والدبقية (بدرجة أقل) ويخضع للنقل المحوري في الاتجاهين الأمامي والرجعي في الجسم الحي2،7،8. بالإضافة إلى ذلك ، تم اختيار النمط المصلي AAV 9 لقدرته الطبيعية على عبور الحاجز الدموي الدماغي واستهداف الجهاز العصبي المركزي في كل من الفئران حديثي الولادة والبالغين51,52. أخيرا ، تم اختيار النمط المصلي AAV 2 نظرا لقدرته على الارتباط بالهيبارين ، مما يسمح بكروماتوغرافيا التقارب33. تجمع جسيمات rAAV1 / 2 و rAAV2 / 9 المنقاة بين خصائص كل من الأنماط المصلية AAV الأبوية ، وبالتالي تشكل ناقلات مناسبة لنقل الجهاز العصبي المركزي45،46،48،49.
Protocol
ملاحظة: انظر الشكل 1 للحصول على رسم توضيحي يلخص البروتوكول. راجع جدول المواد للحصول على تفاصيل حول جميع المواد والأدوات والكواشف المستخدمة في هذا البروتوكول. وينبغي تنفيذ جميع الأعمال التي تنطوي على الخلايا والفيروسات في خزانات وحاضنات مخصصة للسلامة الأحيائية، منفصلة عن تلك المستخدمة بانتظام لصيانة خطوط الخلايا. يجب أن تكون المعدات والكواشف التي تتلامس مع الخلايا المستزرعة والفيروسات معقمة. من الضروري أن يتم التخلص من الكواشف والمواد الخطرة الملوثة بالفيروسات وفقا لصحائف بيانات سلامة المواد وامتثالا للقوانين والمبادئ التوجيهية الوطنية المقدمة من مكتب الصحة والسلامة البيئية في كل مؤسسة. اعتبارا من أبريل 2019 ، تصنف إرشادات المعاهد الوطنية للصحة للبحوث التي تتضمن جزيئات الحمض النووي المؤتلف أو الاصطناعية على أنها عوامل مجموعة المخاطر 1 (غير المرتبطة بالمرض لدى البشر البالغين الأصحاء) جميع الأنماط المصلية AAV ، وكذلك تركيبات AAV المؤتلفة أو الاصطناعية. ينطبق هذا التصنيف عندما لا يشفر جين التحوير منتجا جينيا يحتمل أن يكون ورميا أو سما ، ويتم إنتاج التركيبات بدون فيروس مساعد.
تم إجراء جميع التجارب التي شملت وفقا لتوجيه الاتحاد الأوروبي (2010/63 / EU) لرعاية واستخدام المختبر ، والتي تم نقلها إلى القانون البرتغالي في عام 2013 (المرسوم بقانون 113/2013). بالإضافة إلى ذلك ، تمت الموافقة على الإجراءات الحيوانية من قبل المنظمة المسؤولة عن رعاية التابعة لكلية الطب ومركز علم الأعصاب وبيولوجيا الخلية التابع لمنشأة المرخصة بجامعة كويمبرا. تلقى الباحثون تدريبا كافيا (دورة معتمدة من FELASA) وشهادة من السلطات البرتغالية (Direcção Geral de Alimentação e Veterinária ، لشبونة ، البرتغال) لإجراء التجارب.
1. يبني البلازميد
- اتبع تعليمات الشركة المصنعة لمجموعة خالية من السموم الداخلية maxiprep لعزل وتنقية كميات كبيرة من الحمض النووي من البلازميدات التالية: ط) pITR: ناقل النقل محل الاهتمام ؛ ب) بلازميد pAAV-RC: pRV1 ، يحتوي على تسلسل AAV2 Rep و Cap 36 ؛ بلازميد pAAV-RC: pH21 ، يحتوي على تسلسل AAV1 Rep و Cap 36 ؛ iv) بلازميد pAAV-RC: pAAV2 / 9n ، يحتوي على تسلسل AAV2 Rep و AAV9 Cap ؛ v) المساعد: pFdelta6 ، البلازميد المساعد للفيروسات الغدية36.
- فحص سلامة البلازميدات المتولدة عن طريق إجراء القيود الأنزيمية الموصى بها36. راقب سلامة بلازميدات pITR عن طريق الهضم باستخدام SmaI ، وهو نوكلياز داخلي مقيد ، والذي يقطع مرتين داخل جزء غير مستقر من لوائح الاتصالات الدولية53,54.
ملاحظة: نظرا لأن لوائح الاتصالات الدولية غير مستقرة إلى حد كبير وعرضة للحذف، يوصى باستخدام خلايا SURE 2 فائقة الكفاءة لتقليل إعادة التركيب في هذه المواقع.
2. ثقافة الخلية
- زراعة الكلى الجنينية البشرية 293 ، معبرة بثبات عن خط خلايا المستضد التائي الكبير SV40 (HEK293T) في نسبة الجلوكوز العالية في Dulbecco Modified Eagle Medium (DMEM) ، مكملة بمصل بقري جنيني بنسبة 10٪ و 1٪ بنسلين ستربتومايسين ، عند 37 درجة مئوية ، تحت جو مرطب يحتوي على 5٪ CO2 ، كنقطة انطلاق للخطوات اللاحقة.
- استزراع الخلايا باستخدام محلول ملحي معقم 1x فوسفات (PBS) ، درجة الحموضة 7.4 ، لغسل الخلايا قبل إضافة 0.05٪ حمض التربسين والإيثيلين ديامينيترايتيك (EDTA).
ملاحظة: تجنب استخدام الخلايا التي خضعت لعدد كبير من الممرات (بحد أقصى 20). اختبار مزارع الخلايا بانتظام لتلوث الميكوبلازما.
3. إنتاج rAAV عن طريق النقل العابر
- اليوم 1: طلاء الخلية
- لكل إنتاج فيروسي ، HEK293T الخلايا في 10 أطباق استزراع معالجة (قطرها 15 سم) في اليوم السابق للنقل ، بكثافة 10.5 × 106 خلايا لكل طبق في 22 مل من وسط الاستزراع المكمل واحتضانها لمدة 24 ساعة حتى تصبح الخلايا متقاربة بنسبة 70٪ -80٪ وجاهزة للنقل.
- اليوم 2: نقل الخلايا باستخدام البولي إيثيلين (PEI)
- لكل إنتاج فيروسي (ما يعادل 10.5 أطباق) ، قم بإعداد خليط النقل التالي في أنبوب طرد مركزي دقيق: 54.6 ميكروغرام من pITR ؛ 45.675 ميكروغرام من pRV1 ؛ 45.675 ميكروغرام من الرقم الهيدروجيني 21 أو pAAV2 / 9n ؛ 109.2 ميكروغرام من pFdelta6. تخلط عن طريق النقر.
- أضف الخليط إلى 4.557 مل من DMEM غير المكمل في أنبوب طرد مركزي سعة 50 مل. تخلط عن طريق النقر.
- أضف 1.365 مل من محلول PEI المعقم عند 1 مجم / مل (درجة الحموضة 7.4) ، قطرة قطرة. تخلط عن طريق النقر. احتضان لمدة 10 دقائق في درجة حرارة الغرفة للسماح بتكوين مجمعات DNA-PEI.
- أضف هذا الخليط إلى 231 مل من DMEM المكمل المسخن مسبقا. استبدل وسط الاستزراع الكامل لكل طبق ب 22 مل من خليط النقل هذا. احتضان الخلايا لمدة 48 ساعة.
ملاحظة: يجب تنفيذ هذه الخطوة بعناية لتجنب انفصال الخلايا.
- اليوم 4: حصاد الخلايا
- عندما يقوم pITR بتشفير مراسل الفلورسنت ، تصور الخلايا المنقولة تحت مجهر مضان.
- اجمع الوسط من كل طبق في أنابيب طرد مركزي سعة 50 مل وجهاز طرد مركزي عند 800 × جم لمدة 10 دقائق. تخلص من المادة الطافية.
ملاحظة: هذه الخطوة اختيارية وتهدف إلى استعادة الخلايا المنقولة التي قد تكون انفصلت بسبب التقاء عال جدا. - أضف 10 مل من برنامج تلفزيوني مسخن مسبقا إلى كل طبق. قم بإزالة الخلايا برفق باستخدام مكشطة الخلايا واجمع التعليق في أنابيب الطرد المركزي سعة 50 مل من الخطوة 3.3.2.
- اغسل 5 أطباق في المرة الواحدة ب 10 مل إضافية من PBS وانقل التعليق إلى أنابيب الطرد المركزي سعة 50 مل من الخطوة 3.3.3. حبيبات الخلايا في 800 × غرام لمدة 10 دقائق وتجاهل طف.
- قم بتجميد كريات الخلية عند -80 درجة مئوية.
ملاحظة: قد يتم تخزين الكريات الخلوية لعدة أشهر (نقطة التوقف).
4. استخراج rAAV وتنقية FPLC
- اليوم 5: تحضير محلول الخلايا
- قم بإذابة كريات الخلية في درجة حرارة الغرفة. أعد تعليق الخلايا التي تم جمعها من 10 أطباق في 100 مل من مخزن مؤقت معقم يحتوي على 150 مللي مول كلوريد الصوديوم (NaCl) و 20 مللي متر تريس ، درجة الحموضة 8.0 ، في ماء عالي النقاء (النوع الأول). امزج التعليق عن طريق السحب لأعلى ولأسفل ، لضمان تعليق متجانس.
- أضف 12.5 مل من محلول معقم طازج من 10٪ ديوكسي كولات الصوديوم في ماء عالي النقاء للحث على تحلل الخلايا. تخلط عن طريق سحب السحب لأعلى ولأسفل.
ملاحظة: تخلص من ديوكسي كولات الصوديوم ، وكذلك المواد الملامسة لها ، وفقا لورقة بيانات سلامة المواد والإرشادات المقدمة من مكتب الصحة والسلامة البيئية بالمؤسسة. يوصى أيضا بارتداء قناع الوجه أثناء التعامل مع هذا المسحوق. بعد الخلط ، يصبح المحلول شديد اللزوجة. - أضف 27 ميكرولتر من نوكلياز البنزوناز إلى الخليط السابق. امزج جيدا عن طريق السحب لأعلى ولأسفل حتى تصبح العينة غير لزجة. احتضان في 37 درجة مئوية لمدة 1 ساعة ، أداء دوامة كل 10 دقائق.
ملاحظة: هذا endonuclease قادر على تحلل جميع أشكال الحمض النووي والحمض النووي الريبي بكفاءة دون إظهار أي نشاط بروتيني. - قم بإزالة الحطام الخلوي عن طريق الطرد المركزي للخليط عند 3000 × جم لمدة 60 دقيقة عند 25 درجة مئوية. قم بتصفية المادة الطافية باستخدام مرشح حقنة معقم من مادة البولي فينيليدين ثنائي فلوريد (PVDF) 0.45 ميكرومتر وانقله إلى حاوية معقمة جديدة.
ملاحظة: تضمن هذه الخطوة المهمة إزالة معظم الحطام الخلوي ، وبالتالي منع انسداد أعمدة الكروماتوغرافيا. احفظ حصة صغيرة من هذا الخليط للتحليل (خطوة اختيارية).
- اليوم 5 (تابع): تنقية عمود الهيبارين من rAAVs
ملاحظة: يمكن إجراء تطبيق العينة باستخدام مضخة عينة أو 50 مل أو 150 مل سوبرلوب كجزء من النظام. نظرا لأنه يتم إذابة المزيد من الهواء في درجات حرارة منخفضة ، فمن المهم إتاحة الوقت الكافي للمخازن المؤقتة والمحاليل (عادة ما يتم تخزينها عند 4 درجات مئوية) للتأقلم مع درجة حرارة الغرفة قبل استخدامها في نظام FPLC.- اختياري: إذا تم تخزين النظام لفترات طويلة ، فقم بملء النظام وجميع المداخل بمحلول تخزين طازج (20٪ إيثانول) باستخدام التعليمات اليدوية أو طريقة تنظيف النظام المحددة مسبقا (CIP) للنظام.
- اغسل مسار تدفق السائل تماما بماء معقم عالي النقاء باستخدام التعليمات اليدوية أو طريقة CIP للنظام المحددة مسبقا.
- قم بتوصيل عمود هيبارين معبأ مسبقا سعة 1 مل ، واضبط منبه الضغط ، واغسله بخمسة أحجام أعمدة (CVs) من الماء عالي النقاء بمعدل تدفق 1 مل / دقيقة.
- قم بتبديل المحاليل في الدرج العازل من الماء عالي النقاء إلى المخزن المؤقت A (محلول معقم 100 مللي مول كلوريد الصوديوم و 20 مللي متر تريس ، درجة الحموضة 8 ، في ماء عالي النقاء) للمدخل A (مضخة النظام A) وإلى المخزن المؤقت B (محلول معقم 500 مللي مول كلوريد الصوديوم و 20 مللي مول تريس ، درجة الحموضة 8 ، في ماء عالي النقاء) للمدخل B (مضخة النظام B). إذا كان النظام يحتوي على مضخة عينة ، فضع مدخل المخزن المؤقت لصمام مدخل العينة في المخزن المؤقت A.
- اغسل مضخة النظام B بالمخزن المؤقت B واملأ بقية مسار تدفق السائل بالمخزن المؤقت A.
ملاحظة: إذا لزم الأمر، افصل العمود عن مسار التدفق وأعد توصيله بعد ذلك. - أدخل أنبوب مدخل عينة من صمام مدخل العينة ، على سبيل المثال ، S1 ، في الحاوية مع المستحضر الفيروسي الذي تم الحصول عليه في الخطوة 4.1.4. (من إعداد خلية المحللة). قم بتجهيز مسار التدفق من مدخل العينة S1 إلى صمام الحقن باستخدام محلول العينة. بدلا من ذلك ، املأ 50 مل أو 150 مل سوبرلوب بالعينة التي تحتوي على rAAVs باستخدام حقنة 50 مل.
- قم بموازنة العمود بحجم إجمالي يبلغ خمس سير ذاتية باستخدام 12.5٪ من المخزن المؤقت B بمعدل 1 مل / دقيقة.
- ضع الحجم الكلي للعينة في العمود باستخدام مضخة العينة (حدد حقن كل العينة باستخدام مستشعر الهواء) أو superloop عند 0.5 مل / دقيقة واجمع التدفق باستخدام منفذ المخرج في حاوية معقمة جديدة.
ملاحظة: عند تمكين ميزة التحكم في التدفق لمنع الضغط الزائد ، سينخفض التدفق تلقائيا في حالة انسداد العمود. إذا انخفض معدل التدفق بشكل ملحوظ إلى أقل من 0.5 مل / دقيقة ، فقم بإيقاف تطبيق العينة ، وقم بإجراء غسل باستخدام 2-5 CVs من المخزن المؤقت A ، ثم استأنف تطبيق العينة. - اغسل العمود بمعدل 1 مل / دقيقة باستخدام 20 سيرة ذاتية من المخزن المؤقت A ، وجمع التدفق باستخدام منفذ المخرج.
- قم بسحب العينة عند 1 مل / دقيقة باستخدام المخطط التالي: i) التدرج الخطي بهدف 50٪ من المخزن المؤقت B لخمس سير ذاتية ؛ ب) خطوة مع هدف 90٪ من المخزن المؤقت B خلال خمس سير ذاتية ؛ ج) خطوة مع هدف 100٪ من المخزن المؤقت B خلال خمس سير ذاتية.
- اجمع العينة المستخلصة في كسور سعة 1 مل باستخدام مجمع الكسور وأنابيب الطرد المركزي الدقيقة منخفضة الاحتفاظ (2 مل) وقم بتخزينها في -20 درجة مئوية.
ملاحظة: قد يتم تخزين كسور rAAV لعدة أسابيع (نقطة الإيقاف المؤقت). - أعد توازن العمود عند 1 مل / دقيقة مع 12.5٪ من المخزن المؤقت B لخمس سير ذاتية.
- قم بتبديل المداخل من المحاليل العازلة إلى الماء عالي النقاء واغسل العمود بمعدل 1 مل / دقيقة لخمس سير ذاتية.
- قم بتبديل المداخل من الماء عالي النقاء إلى 20٪ إيثانول واغسل العمود بمعدل 1 مل / دقيقة لمدة خمس سير ذاتية. افصل العمود وقم بتخزينه في درجة حرارة 4 درجات مئوية.
ملاحظة: يمكن إعادة استخدام الأعمدة عدة مرات دون أي إجراءات تنظيف وتعقيم رئيسية أخرى إذا تم استخدام نفس النمط المصلي rAAV وجين التحوير. - اغسل مسار تدفق السائل تماما باستخدام 20٪ من الإيثانول باستخدام التعليمات اليدوية أو طريقة CIP للنظام المحددة مسبقا.
5. تركيز rAAVs المنقى
- يوم 6: التركيز الخطوة 1
- ركز rAAVs باستخدام وحدة تصفية طرد مركزي سعة 15 مل مع قطع الوزن الجزيئي 100 كيلو دالتون. قم بتحميل الكسور المطلوبة التي تحتوي على rAAVs (كسور FPLC من 7 إلى 16) في وحدة مرشح الطرد المركزي سعة 15 مل وجهاز طرد مركزي عند 2000 × جم لمدة دقيقتين في درجة حرارة الغرفة. تأكد من أن الحجم المركز في وحدة المرشح حوالي 500 ميكرولتر. إذا تجاوز الحجم المركز إلى حد كبير 500 ميكرولتر ، كرر خطوات الطرد المركزي في فترات 1 دقيقة حتى يصل إلى الحجم المطلوب.
- اليوم 6 (تابع): تبادل المخزن المؤقت
- أضف 1 مل من PBS المعقم إلى وحدة مرشح الطرد المركزي التي تحتوي على rAAVs. ماصة بعناية صعودا وهبوطا لغسل الفلتر. أجهزة الطرد المركزي في 2000 × غرام في 1 دقيقة فواصل زمنية حتى يتم الوصول إلى الحجم النهائي من 500 ميكرولتر.
- اليوم 6 (تابع): خطوة التركيز 2
- نقل 500 ميكرولتر من rAAVs المركزة التي تم الحصول عليها في الخطوة السابقة إلى وحدة مرشح الطرد المركزي 0.5 مل مع قطع الوزن الجزيئي 100 كيلو دالتون وأجهزة الطرد المركزي عند 6000 × غرام لمدة 1 دقيقة. إذا لزم الأمر ، كرر خطوة الطرد المركزي حتى يتم الوصول إلى حجم نهائي أقل من 100 ميكرولتر.
- اليوم 6 (تابع): التعافي
- لاستعادة rAAV المركز ، ضع جهاز المرشح رأسا على عقب في أنبوب تجميع جديد لأجهزة الطرد المركزي الدقيقة. ضع الأنبوب في جهاز طرد مركزي دقيق مع الغطاء باتجاه المركز وقم بإجراء دوران طويل داخل غرفة التدفق لنقل rAAVs المركزة من الجهاز إلى أنبوب الطرد المركزي الدقيق. بدلا من ذلك ، أجهزة الطرد المركزي في 1000 × غرام لمدة 2 دقيقة.
- ملحق مع F-68 Pluronic المعقمة 0.001٪ (اختياري).
ملاحظة: Pluronic F-68 هو خافض للتوتر السطحي غير أيوني معتمد للاستخدام البشري من قبل إدارة الغذاء والدواء وهو قادر على التخفيف من خسائر rAAVs عن طريق منع تفاعلاتها مع أسطح المواد (البلاستيك) المستخدمة أثناء تحضير التخفيف وتحميل المحاقن ومعدات التسليم55,56. - قسمة rAAVs في أنابيب الطرد المركزي الدقيقة منخفضة الاحتفاظ وتخزينها في -80 درجة مئوية (نقطة التوقف).
6. القياس الكمي ل rAAVs المنقى
- اليوم 6 (تابع): تحديد عيار مستحضرات rAAV ، معبرا عنها في الجينومات الفيروسية / ميكرولتر (vg / μL) ، عن طريق تفاعل البوليميراز الكمي المتسلسل في الوقت الفعلي (RT-qPCR) باستخدام مجموعة تجارية واتباع تعليمات الشركة المصنعة.
- احتضان محلول جسيمات rAAV باستخدام DNase I عند 37 درجة مئوية لمدة 20 دقيقة.
ملاحظة: يعزز هذا الإجراء هضم الحمض النووي الجينومي الحر والحمض النووي البلازميد المشتق من الخلايا المضيفة ، وبالتالي ضمان الحفاظ على تسلسل الحمض النووي فقط داخل جزيئات rAAV السليمة. - DNase I المعطل بالحرارة عند 95 درجة مئوية لمدة 10 دقائق.
- يضاف Lysis Buffer ويحتضن لمدة 10 دقائق عند 70 درجة مئوية لتعزيز تمسخ الحرارة لبروتينات جزيئات rAAV.
- قم بتخفيف محلول جينوم rAAV الذي تم الحصول عليه في محلول التخفيف قبل الانتقال إلى RT-qPCR. قم بإعداد مجموعة من المعايير المخففة بشكل متسلسل للتحكم الإيجابي (من 2 × 107 vg / μL إلى 2 × 102 vg / μL) المقدمة مع المجموعة.
- قم بإجراء خليط تفاعل يحتوي على 12.5 ميكرولتر من مزيج Taq II ، و 0.5 ميكرولتر من مزيج التمهيدي المخفف ، و 7 ميكرولتر من الماء ، و 5 ميكرولتر من الحمض النووي rAAV المخفف (عينة AAV غير معروفة والمعايير من الخطوة 6.1.4.).
- قم بإجراء RT-qPCR في نظام الكشف عن تفاعل البوليميراز المتسلسل في الوقت الفعلي ، باستخدام البروتوكول التالي: دورة واحدة عند 95 درجة مئوية لمدة 2 دقيقة (تمسخ أولي) و 40 دورة عند 95 درجة مئوية لمدة 5 ثوان (تمسخ) و 60 درجة مئوية لمدة 30 ثانية (التلدين والتمديد وقراءة اللوحة) ، متبوعة بتحليل منحنى الذوبان.
- احسب تركيز العينة المطلق من المنحنى القياسي (خط الانحدار الخطي) ، مع الأخذ في الاعتبار عامل التخفيف الناتج عن تحضير عينة rAAV.
ملاحظة: يتحقق التحديد الكمي لعدد الجينومات الفيروسية من خلال تضخيم تسلسل لوائح الاتصالات الدولية ل AAV2 (التسلسل المستهدف للبادئات التي توفرها المجموعة).
- احتضان محلول جسيمات rAAV باستخدام DNase I عند 37 درجة مئوية لمدة 20 دقيقة.
7. SDS-PAGE ، تلطيخ أزرق كوماسي ، وبقعة غربية
- قم بتشويه 40 ميكرولتر من كل عينة (كل جزء FPLC ؛ التدفق ؛ عينات ما قبل العمود ، وما مجموعه 2.3 × 1010 vg من المنتج المركز النهائي) عن طريق إضافة 6x عينة عازلة (0.5 M Tris-HCl / 0.4٪ كبريتات دوديسيل الصوديوم (SDS) درجة الحموضة 6.8 ، 30٪ الجلسرين ، 10٪ SDS ، 0.6 M ثنائي ثيوثريتول (DTT) ، 0.012٪ بروموفينول الأزرق) واحتضان العينات لمدة 5 دقائق عند 95 درجة مئوية.
- قم بتحميل العينات المشوهة (48 ميكرولتر) في جل SDS-polyacrylamide (4٪ تكديس و 10٪ جل حل) وقم بإجراء الفصل الكهربائي عند 100 فولت لمدة 70 دقيقة ، بجوار سلم البروتين.
- تحليل البروتين
ملاحظة: يمكن إجراء تلطيخ أزرق كوماسي أو نشاف غربي.- تلطيخ أزرق كوماسي
- لتصور أشرطة البروتين ، قم بتلطيخ الجل لمدة 10 دقائق بمحلول Coomassie blue G250 بنسبة 0.25٪ مذاب في 50٪ ميثانول و 10٪ حمض أسيتيك جليدي.
- قم بإزالة بقع الجل عن طريق غسله عدة مرات بمحلول يحتوي على 25٪ ميثانول و 5٪ حمض الخليك الجليدي حتى تصبح العصابات الشفافة ذات الخلفية المنخفضة مرئية.
- التقط الصور باستخدام نظام تصوير مناسب.
- لطخة غربية
- نقل البروتينات إلى غشاء PVDF وفقا للبروتوكولات القياسية.
- سد الغشاء عن طريق الحضانة في 5٪ حليب خالي الدسم مخفف في TBS-T (0.1٪ توين 20 في محلول ملحي مخزن تريس) لمدة 1 ساعة في درجة حرارة الغرفة.
- استخدم الأجسام المضادة الأولية التالية (المخففة في محلول الحظر) للحضانة الليلية عند 4 درجات مئوية: الأجسام المضادة أحادية النسيلة للفأر AAV ، VP1 ، VP2 ، VP3 (B1 ، 1: 1000) ، أو الأجسام المضادة أحادية النسيلة للفأر AAV ، VP1 ، VP2 (A69 ، 1: 1000).
- اغسل الأغشية لمدة 3 × 15 دقيقة في TBS-T واحتضانها بجسم مضاد ثانوي مضاد للفأر مرتبط بالفوسفاتيز القلوي (1: 10000) ، لمدة 2 ساعة في درجة حرارة الغرفة.
- اغسل الأغشية لمدة 3 × 15 دقيقة في TBS-T. أضف الركيزة الكيميائية الفلورية المحسنة (ECF) وتصور نطاقات البروتين عن طريق التصوير الكيميائي الفلوري.
- تلطيخ أزرق كوماسي
8. المجهر الإلكتروني النافذ (TEM)
- ضع شبكة 200 شبكة مطلية بالكربون Formvar رأسا على عقب فوق قطرة من عينة rAAV واتركها تستقر لمدة 1 دقيقة.
- اغسل الشبكات في قطرة ماء وجفف السائل الزائد بورق الترشيح.
- قم بتلطيخ الشبكات سلبا بمحلول أسيتات اليورانيل 1٪ (درجة الحموضة 7) لمدة دقيقة واحدة لإصلاح الجسيمات الفيروسية وتباينها.
- اغسل الشبكات في قطرة ماء وجفف السائل الزائد بورق الترشيح.
- فحص العينات في المجهر الإلكتروني النافذ.
ملاحظة: قد تؤثر تركيزات الملح العالية بشكل مباشر على ارتباط rAAVs بالشبكة وتؤدي إلى تصور الهياكل الشبيهة بالبلورات.
9. امتصاص الضوء فوق المرئي على التوالي ، تشتت الضوء الثابت ، وتحليل تشتت الضوء الديناميكي
- على لوحة قياس كمية 96 بئرا ، قم بتحميل 2 ميكرولتر من عينة rAAV و 2 ميكرولتر من PBS لاستخدامها كمخزن مؤقت فارغ (قم بذلك في التكرارات).
- استخدم تطبيق AAV Quant في برنامج تحليل العميل ، ضع أسماء العينات في الموقع الصحيح للوحة ، وحدد النمط المصلي AAV ، وانقر فوق التالي.
- قم بتحميل لوحة القياس الكمي المكونة من 96 بئرا في المعدات المخصصة وتابع قراءة اللوحة للحصول على البيانات.
10. مقايسات التنبيغ في المختبر
- يمكن استخدام خطوط خلايا مختلفة لتحليل كفاءة نقل rAAVs بسرعة.
- قم بزرع الخلايا HEK293T بالتساوي في 24 صفيحة بئر (بكثافة 137500 خلية / بئر) وخط خلايا الورم الأرومي العصبي 2A (Neuro2a) للفأر إما في 24 صفيحة بئر (50000 خلية / بئر) أو في شريحة حجرة ذات 8 آبار (27000 خلية / بئر) ، باستخدام DMEM عالي الجلوكوز ، مكمل بمصل بقري جنيني بنسبة 10٪ و 1٪ بنسلين ستربتومايسين ، كما هو موضح أعلاه. اسمح للخلايا بالالتصاق طوال الليل عند 37 درجة مئوية في جو مرطب يحتوي على 5٪ CO2.
- اجمع الوسط المكيف من كل بئر (250 ميكرولتر من 24 لوحة بئر و 50 ميكرولتر من شريحة الغرفة المكونة من 8 آبار) وقم بتخزينها في درجة حرارة 4 درجات مئوية لاستخدامها لاحقا.
- أضف مستحضرات rAAV التالية إلى كل بئر واحتضن الخلايا لمدة 24 ساعة عند 37 درجة مئويةفي جو CO 2 بنسبة 5٪.
- أضف 50 ميكرولتر من الكسور التي تم جمعها بواسطة FPLC F2-F16 وتدفق إلى خلايا HEK293T مطلية في 24 لوحة بئر.
- أضف ما مجموعه 5.5 × 109 vg من rAAVs المركزة المخففة في 50 ميكرولتر من PBS إلى خلايا Neuro2a المطلية في 24 لوحة جيدة (تشمل بئر تحكم سلبي ، عن طريق إضافة 50 ميكرولتر من PBS إلى الخلايا).
- أضف ما مجموعه 2.75 × 109 vg من rAAVs المركزة المخففة في 25 ميكرولتر من PBS إلى خلايا Neuro2a المطلية في شريحة حجرة ذات 8 آبار (بما في ذلك حالة التحكم السلبية ، عن طريق إضافة 50 ميكرولتر من PBS إلى الخلايا).
- أضف الوسط المكيف المخزن مسبقا (الخطوة 10.1.2) إلى كل بئر واحتضانه لمدة 24 ساعة.
- تجاهل الوسط وغسل الخلايا 2x مع برنامج تلفزيوني.
- أضف محلول بارافورمالدهايد (PFA) بنسبة 4٪ ، مع استكمال السكروز بنسبة 4٪ في برنامج تلفزيوني ، مسخن مسبقا إلى 37 درجة مئوية ، إلى كل بئر واحتضانه في درجة حرارة الغرفة لمدة 20 دقيقة.
- اغسل 2x باستخدام PBS واحفظه في درجة حرارة 4 درجات مئوية حتى يتم إجراء التصوير (نقطة الإيقاف المؤقت).
- احصل على صور على مجهر مضان مقلوب مجهز بهدف 10x / 0.30 ، أو مجهر متحد البؤر مقلوب مزود بهدف 40x / 1.4 Oil DIC.
- للحصول على نموذج أكثر صلة وعاكسة للبيئة في الجسم الحي ، استخدم الثقافات العصبية الأولية على النحو التالي:
- إعداد الثقافات الأولية للخلايا العصبية القشرية كما وصفها سانتوس وآخرون سابقا.57. باختصار ، قم بزرع 200000 خلية / مل في 12 لوحة بئر والحفاظ عليها في الثقافة حتى يوم في المختبر 16.
- اجمع وسطا مكيف من كل بئر (100 ميكرولتر) واحفظه في درجة حرارة 4 درجات مئوية لاستخدامه لاحقا.
- أضف rAAVs المراد اختبارها إلى كل بئر: ما مجموعه 2.75 × 109 vg من rAAVs المركزة المخففة في 25 ميكرولتر من PBS (بما في ذلك التحكم السلبي: 25 ميكرولتر من PBS). احتضان لمدة 24 ساعة عند 37 درجة مئويةفي جو CO 2 5٪.
- أضف الوسط المشروط الذي سبق تخزينه واحتضانه لمدة 24 ساعة.
- تخلص من الوسط في كل بئر واغسل 2x باستخدام برنامج تلفزيوني.
- قم بإصلاح الخلايا التي تحتوي على 4٪ PFA / 4٪ سكروز في برنامج تلفزيوني ، كما هو موضح في الخطوة 10.1.6. اغسل 2x مع برنامج تلفزيوني.
- احتضن كل بئر ب 5 ميكروغرام / مل من تراص جنين القمح (WGA) مترافق مع Alexa Fluor 633 لمدة 10 دقائق في درجة حرارة الغرفة (خطوة اختيارية: إجراء الكيمياء المناعية بدلا من ذلك). اغسل 2x مع برنامج تلفزيوني.
- احتضان في 0.25٪ Triton X-100 في برنامج تلفزيوني لمدة 5 دقائق في درجة حرارة الغرفة. يغسل مع برنامج تلفزيوني.
- احتضان مع 4',6-دياميدينو-2-فينيليندول (DAPI) لمدة 5 دقائق في درجة حرارة الغرفة. اغسل 2x مع برنامج تلفزيوني.
- احصل على صور على مجهر مضان مقلوب مجهز بهدف 40x / 0.95 ، أو مجهر متحد البؤر مقلوب مجهز بهدف 40x / 1.4 Oil DIC.
11. في تجارب الجسم الحي
ملاحظة: تم إيواء في غرفة يتم التحكم في درجة حرارتها ، ويتم الحفاظ عليها في دورة ضوء / ظلام لمدة 12 ساعة. تم توفير الطعام والماء حسب الطلب. بذلت كل الجهود لتقليل معاناة.
- الحقن التجسيمي في المخيخ
- تخدير C57BL / 6 البالغة من العمر 9 أسابيع عن طريق استنشاق 2٪ إيزوفلوران في وجود الأكسجين (0.8 لتر / دقيقة) في غرفة متصلة بجهاز تبخير.
- ضع المخدر في الجهاز التجسيمي (على وسادة دافئة 35 درجة مئوية) وضع قناع الأيزوفلوران في أنف. اخفض مستوى الأيزوفلوران إلى 1.3-1.7٪.
ملاحظة: تأكد من تخدير بشكل صحيح قبل المتابعة (فقدان المنعكس للثني في كلا الطرفين الخلفيين). - ضع مرهم العين المزلق لتجنب جفاف القرنيات وحقن بمسكن معتمد.
ملاحظة: يجب تنفيذ جميع الخطوات اللاحقة في ظروف معقمة. - بعد حلق فرو رأس وتطهير المنطقة الجراحية ، فضح الجمجمة ووضع طرف إبرة حقن حادة 30 جيجا ، متصلة بحقنة هاملتون 10 ميكرولتر ، مباشرة فوق bregma (استخدم bregma كصفر لحساب الإحداثيات المجسمة).
- حرك الإبرة إلى الإحداثيات المقصودة وحفر حفرة عبر الجمجمة حيث ستدخل الإبرة.
ملاحظة: في إطار هذه الدراسة ، تم إجراء حقنة واحدة مركزيا في المخيخ. - حقن 4 ميكرولتر من محلول rAAVs يحتوي على ما مجموعه 8 × 109 vg ، مخفف في PBS ، بمعدل تسريب 0.5 ميكرولتر / دقيقة باستخدام حاقن أوتوماتيكي. استخدم الإحداثيات التالية ، المحسوبة من bregma ، لإجراء حقنة واحدة مركزيا في مخيخ فأر C57BL / 6 بالغ: الأمامي الخلفي: -6.5 مم ؛ الجانبي: 0 مم ؛ البطني: -2.9 ملم.
ملاحظة: قد تختلف هذه الإحداثيات وفقا لسلالة الفأر والجنس وعمر المستخدمة. - لتقليل التدفق العكسي والسماح بانتشار الناقل الفيروسي ، بمجرد اكتمال التسريب ، اترك إبرة المحقنة عند هذه الإحداثيات لمدة 3 دقائق ، ثم اسحبها ببطء بمقدار 0.3 مم ، واتركها تبقى في مكانها لمدة 2 دقيقة إضافية قبل إزالتها بالكامل من دماغ الفأر.
- أغلق الشق ونظفه بعامل مطهر (على سبيل المثال ، 10٪ بوفيدون اليود).
- اسمح للحيوانات بالتعافي من التخدير قبل إعادتها إلى أقفاصها المنزلية.
- جمع الأنسجة وإعدادها
ملاحظة: في هذه التجربة ، لوحظت مستويات التنبيط بعد 12 أسبوعا من الحقن ، ولكن يمكن تقييم نفس الإجراء في أقرب وقت بعد 4 أسابيع من الحقن.- تخدير بشكل نهائي عن طريق إعطاء جرعة زائدة من الزيلازين/الكيتامين داخل الصفاق (8/160 ملغ/كغ من وزن الجسم).
- قم بتغذية عبر القلب باستخدام برنامج تلفزيوني بارد لمدة 6 دقائق بمعدل 2.5 مل / دقيقة ، يليه التروية بمحلول PFA بارد طازج 4٪ لمدة 10 دقائق بنفس المعدل.
- قم بإصلاح الأدمغة المستأصلة في 4٪ PFA طوال الليل في درجة حرارة الغرفة ثم انقلها إلى محلول 25٪ سكروز / PBS للحماية من التبريد. بمجرد غرق الأدمغة (بعد حوالي 48 ساعة) ، قم بتخزينها في -80 درجة مئوية.
- قطع المقاطع السهمية التسلسلية بسمك 30 ميكرومتر باستخدام cryostat عند -21 درجة مئوية. لكل ، اجمع 96 قسما سهميا من نصف الكرة المخية في سلسلة تشريحية كأقسام عائمة حرة في PBS مكملة ب 0.05٪ أزيد الصوديوم. يحفظ في درجة حرارة 4 درجات مئوية حتى تتم معالجته مرة أخرى.
- الكيمياء الهيستولوجية المناعية الفلورية القياسية
- حدد ثمانية أقسام سهمية لكل ، على مسافة 240 ميكرومتر عن بعضها البعض.
- احتضان المقاطع العائمة الحرة في محلول الحجب / النفاذية (0.1٪ Triton X-100 يحتوي على 10٪ مصل الماعز العادي (NGS) في PBS) لمدة 1 ساعة في درجة حرارة الغرفة.
- احتضان الأقسام طوال الليل عند 4 درجات مئوية مع الجسم المضاد الأولي متعدد النسيلة المضاد ل GFP (1: 1000).
- اغسل لمدة 3 × 15 دقيقة في برنامج تلفزيوني واحتضن الأقسام لمدة 2 ساعة في درجة حرارة الغرفة باستخدام الجسم المضاد الثانوي متعدد النسيلة للماعز المضاد للدجاج المترافق مع Alexa Fluor 488 fluorophore (1: 200).
- يغسل لمدة 3 × 15 دقيقة في برنامج تلفزيوني. احتضان مع DAPI لمدة 5 دقائق في درجة حرارة الغرفة.
- يغسل لمدة 3 × 15 دقيقة في برنامج تلفزيوني. ضع الأقسام في شرائح مغلفة بالجيلاتين وغطاء مع وسيط تثبيت مضان.
- احصل على صور على مجهر مضان ماسح ضوئي للشرائح مزود بهدف 20x / 0.8.
النتائج
في هذا العمل ، نقدم بروتوكولا مفصلا لإنتاج وتنقية وتوصيف rAAVs الفسيفسائية (ملخصة في الشكل 1) ، والتي لديها القدرة على استهداف وتحويل الجهاز العصبي المركزي (مثل AAV1 و AAV9) ، كونها مناسبة في وقت واحد لتنقية كروماتوغرافيا تقارب الهيبارين (AAV2). لتحقيق ذلك ، تم استخدام قفيصات من الأنماط المصلية الطبيعية AAV 1 و 2 و 9 لتطوير متجهات الفسيفساء rAAV1 / 2 و rAAV2 / 9.
قبل البدء ، تم فحص مستحضرات البلازميد للتأكد من سلامتها الهيكلية. وبالإضافة إلى عمليات الهضم اللازمة للتحقق من صحة الإدخال الصحيح لشظايا الاستنساخ، من الضروري فحص بلازميدات pITR باستمرار للكشف عن عمليات الحذف/الإدراج المحتملة للوائح الاتصالات الدولية. وكمثال على ذلك، رصدت سلامة لوائح الاتصالات الدولية في مختلف مستنسخات بلازميد pITR بعد هضم البلازميد باستخدام إنزيم التقييد SmaI (الشكل التكميلي S1).
تم إنشاء كلا النوعين من ناقلات الفسيفساء عن طريق النقل المشترك لبلازميدات قفيصة AAV المعنية بنسبة 1: 1 ، وفقا لطرق النقل القياسية6. باختصار ، تم نقل HEK293T الخلايا باستخدام i) بلازميد يحتوي على جين التحوير محل الاهتمام معبأ بين تسلسلات ITR (pITR) ، ii) بلازميد يحتوي على جينوم AAV من النوع البري Rep و Cap ORFs من AAV2 و AAV1 أو AAV9 (بلازميدات pAAV-RC) و iii) بلازميد يقنن بروتينات الفيروسات الغدية (E1A و E1B و E4 و E2A) بالإضافة إلى الحمض النووي الريبي المرتبط بالفيروس الغدي الضروري للوظائف المساعدة (pHelper). بعد ثمان وأربعين ساعة ، تم حصاد الخلايا 6,36 ، وتم تنقية rAAVs من تجانس الخلية عن طريق كروماتوغرافيا التقارب باستخدام نظام FPLC. كما هو موضح في الشكل 2 أ ، بعد توازن العمود (خطوة التوازن) ، تم تطبيق تحلل الخلية الذي يحتوي على rAAVs على العمود (تحميل العينة). نظرا للتقارب الطبيعي ل rAAV2 للهيبارين33 ، ترتبط rAAVs براتنج العمود ، بينما تم تنفيذ مكونات أخرى في المخزن المؤقت الجاري وتم اكتشافها بواسطة جهاز مراقبة الأشعة فوق البنفسجية (التدفق) ، مما أدى إلى زيادة الامتصاص. تم غسل العمود لاحقا (خطوة الغسيل) وتم استخلاص rAAVs أخيرا عن طريق زيادة تركيز كلوريد الصوديوم (خطوة الشطف). تم الكشف عن الفيروسات المستخلصة بواسطة جهاز مراقبة الأشعة فوق البنفسجية وتم جمعها في كسور 1 مل.
يظهر ملف تعريف ذروة الشطف التمثيلي ل rAAV1 / 2 و rAAV2 / 9 في الشكل 2B والشكل التكميلي S2A ، على التوالي ، مع دفعات فيروسية مختلفة تقدم باستمرار ذروة واحدة تبدأ من الكسر F7 حتى F16. ارتفاع الذروة متغير بين إنتاجات rAAV ، حيث تؤدي القمم الأعلى عادة إلى ارتفاع عوائد rAAV. تم تمييز كل جزء من rAAV1/2 و rAAV2/9 المنتج لاحقا بواسطة RT-qPCR لتقييم التتر الفيروسي (الشكل 2C والشكل التكميلي S2B).
لتوصيف نقاء المادة المستخلصة ، تم فحص 40 ميكرولتر من كل جزء والتدفق ذي الصلة بواسطة 10٪ SDS-polyacrylamide gel electrophoresis (الشكل 2D ل rAAV1 / 2 والشكل التكميلي S2C ل rAAV2 / 9). كشف تلطيخ Coomassie الأزرق عن ثلاثة نطاقات رئيسية في الكسور F7-F16 ، مع أوزان جزيئية مقابلة لبروتينات قفيصة VP1 (87 كيلو دالتون) و VP2 (72 كيلو دالتون) و VP3 (62 كيلو دالتون) من AAVs بالنسب المناسبة 1: 1: 10 ، كما وصفه سابقا Van Vliet وزملاؤه14. في كلتا الحالتين ، واستنادا إلى امتصاص الأشعة فوق البنفسجية ، RT-qPCR ، وشدة شريط الهلام ، من الواضح أن غالبية rAAVs الفسيفسائية موجودة في الكسور F7 و F8 وتبدأ في الانخفاض تدريجيا في الكسور F9-F16. بالإضافة إلى بروتينات القفيصة الفيروسية الثلاثة ، تم اكتشاف بروتين آخر (أو بروتينات) بحجم 17 كيلو دالتون تقريبا في الكسور F8-F16.
للقضاء على بروتين (بروتينات) التنقية المشتركة ، تم بعد ذلك ترشيح الكسور F7-16 وتركيزها باستخدام وحدات مرشح طرد مركزي 100 KDa وتم تحديد عيار rAAV النهائي بواسطة RT-qPCR (كما هو موضح في الشكل 3A ، B ل rAAV1 / 2). ويعتمد العائد النهائي لإنتاج rAAV على طول وتعقيد pITR، وسلامة تسلسلات لوائح الاتصالات الدولية، وظروف زراعة الخلايا (مثل عدد ممرات الخلايا)، وكفاءة النقل24،58،59،60،61. ومع ذلك ، يمكن ضبط العيار النهائي عن طريق إجراء عمليات طرد مركزي متعددة لإعداد rAAV باستخدام وحدات مرشح الطرد المركزي 0.5 مل (خطوة التركيز 2). وباتباع هذا البروتوكول، بالنسبة للحجم النهائي في حدود 50 إلى 100 ميكرولتر، تتكون التركيزات عادة بين 2 × 109 و5 × 1010 vg/μL (يتم إجراء القياس الكمي باستخدام مجموعة المعايرة المرجعية (يتم إجراء القياس الكمي باستخدام مجموعة المعايرة بالتحليل الحجمي المرجعية).
ثم تم تقييم نقاء تحضيرات rAAV النهائية على جل SDS-polyacrylamide بنسبة 10٪. كما هو موضح في الشكل 3C ، لوحظت ثلاثة نطاقات فقط تمثل بروتينات قفيصة rAAVs لإعداد rAAV1 / 2 ولم يتم تحديد بروتينات تنقية مشتركة يمكن اكتشافها. وكانت هذه النتائج متسقة مع تلك التي تم الحصول عليها ل rAAV2/9 (الشكل التكميلي S2C). لتأكيد الهوية وتوصيف نقاء ناقلات rAAV1 / 2 و rAAV2 / 9 ، تم تحليل الكسور الفيروسية والمخزونات المركزة بواسطة اللطخة الغربية ، مع الأجسام المضادة المحددة B1 (الشكل التكميلي S3A والشكل التكميلي S4A) و A69 (الشكل التكميلي S3B والشكل التكميلي S4B). بينما يتعرف الجسم المضاد B1 على حاتم C-terminal مشترك بين جميع بروتينات VP لمعظم الأنماط المصلية AAV62 ، فإن الاستنساخ A69 يتعرف فقط على حواتم VP1 و VP263. ومع ذلك ، يمكن أيضا اكتشاف بعض النطاقات الخافتة ذات الأوزان الجزيئية الأقل من VP3 (<62 كيلو دالتون) عند وضع العلامات B1 و A69.
لتوصيف التشكل الهيكلي وتقييم نقاء rAAVs ، تم تصور الجسيمات الفيروسية مباشرة بواسطة TEM. كانت هذه التقنية هي الإجراء القياسي لتقييم سلامة العينة ونقاوتها في العينات الفيروسية ، لأنها تسمح بالقياس الكمي لجزيئات rAAV الفارغة والكاملة ، وكذلك تقييم التلوث في عينة29،64،65،66،67. كما هو موضح في الشكل 3D ، يمكن ملاحظة كميات كبيرة من جزيئات rAAV ، بقطر ~ 25 نانومتر ، على خلفية نظيفة. يمكن أيضا ملاحظة الجسيمات الفارغة (السهم الأسود) ذات المركز الكثيف للإلكترون ، وكذلك المتجهات الكاملة (السهم الأبيض) في جميع أنحاء حقل العينة.
أجرينا أيضا مراقبة جودة rAAVs المنقاة باستخدام Stunner ، وهي منصة تجمع بين التحليل الطيفي للأشعة فوق البنفسجية المرئية (UV-Vis) ، وتشتت الضوء الثابت (SLS) ، وتشتت الضوء الديناميكي (DLS) 68. لكل عينة ، تم قياس الكمية الإجمالية للبروتين ، ssDNA ، وكذلك امتصاص الشوائب وتعكر الخلفية ، بواسطة التحليل الطيفي للأشعة المرئية وفوق البنفسجية (الشكل 3E والشكل التكميلي S5A). ثم تم تطبيق SLS و DLS لتقييم سلوك تشتت الضوء لقفيصات rAAV. بالنظر إلى أن متوسط قطر AAVs يبلغ 25 نانومتر ، فإن الجسيمات ضمن نطاق قطر 15-45 نانومتر تعتبر سليمة. تمثل الجسيمات الأكبر عادة مجاميع فيروسية ، وكل شيء أصغر يشتمل على الأرجح على جزيئات صغيرة ، بما في ذلك بروتينات القفيصة غير المجمعة68. بالنسبة ل rAAV1 / 2 ، لوحظت قمة واحدة تقابل جزيئات القفيصة السليمة عند 30 نانومتر (الشكل 3F) ، مع 0٪ من الكثافة الكلية و 0٪ من شدة الجسيمات الصغيرة. بالنسبة لإعداد rAAV2 / 9 ، تم أيضا اكتشاف ذروة عند 30 نانومتر تمثل كثافة قفيصة بنسبة 78٪ (الشكل التكميلي S5B). على الرغم من أن كثافة الجسيمات الصغيرة كانت 0٪ ، لهذه العينة ، تم قياس كثافة إجمالية بنسبة 22٪ (موضحة باللون الرمادي) ، مع المساهمة الرئيسية (19.9٪) من الركام الكبير بمتوسط قطر 620 نانومتر (الشكل التكميلي S5B). من خلال الجمع بين التحليل الطيفي للأشعة المرئية وفوق البنفسجية مع معلومات SLS و DLS ، كشف Stunner عن عيار القفيصة الكلي الكلي ، وعيار القفيصة الكامل ، والبروتين الحر والمجمعة ، بالإضافة إلى ssDNA الحر والمجمعة للمستحضرين الفيروسيين ، كما هو موضح في الشكل 3G والشكل التكميلي S5C (القيم المحددة المشار إليها في كل وسيلة إيضاح الشكل).
في موازاة ذلك ، لتقييم النشاط البيولوجي لناقلات AAV الفسيفسائية المطورة ، أصيبت خلايا HEK293T ب 50 ميكرولتر من كل جزء تم الحصول عليه من FPLC (F2-F16) إما من إعداد rAAV1 / 2 أو rAAV2 / 9. نظرا لأن ناقل rAAV1 / 2 يشفر بروتين فلوري أخضر أحادي الشريط (GFP) ، تحت سيطرة مروج CMV (pAAV-CMV-ssGFP) ، ويقوم ناقل rAAV2 / 9 بتشفير GFP مكمل ذاتيا ، تحت سيطرة مروج CMV (pAAV-CMV-scGFP53) ، تم فحص مضان GFP المباشر في هذه الخلايا بعد 48 ساعة من الإصابة (الشكل التكميلي S6 والشكل التكميلي S7). واتساقا مع الملاحظات السابقة للبقع RT-qPCR والأزرق كوماسي واللطخة الغربية، تم تحقيق أعلى مستوى للعدوى للكسور الفيروسية F7 وF8، وانخفض تدريجيا في الكسور من F9 إلى F16.
لتأكيد ما إذا كان النشاط البيولوجي ل rAAVs قد تم الحفاظ عليه بعد خطوات الترشيح الفائق والتركيز ، أصيبت خلايا Neuro2A ، المطلية في كل من الألواح المكونة من 24 بئرا وشريحة غرفة 8 آبار ، بناقل rAAV1 / 2 المركز ، مما أدى إلى ترميز scGFP تحت سيطرة مروج CMV (pAAV-CMV-scGFP53). تم الحصول على صور برايتفيلد والتألق بعد 48 ساعة من الإصابة (الشكل 4 أ ، ب للحصول على صور عالية الدقة).
بهدف استكشاف القدرة المعدية ل rAAVs المنتجة في نموذج خلية أكثر صلة وعاكسة ، تم زرع الثقافات العصبية الأولية شبه الكثيفة من القشرة على صفيحة من 12 بئرا وإصابتها ب rAAV1 / 2 - CMV-scGFP المستخدم سابقا. بعد ثمان وأربعين ساعة من الإصابة ، تم إصلاح الخلايا ووسمها ب DAPI و WGA مترافقة مع Alexa Fluor 633 ، محاضرات تستخدم على نطاق واسع لتسمية الخلايا الثابتة. تم الحصول على الصور الموضحة في الشكل 4C ، D باستخدام Zeiss Axio Observer Z1 وعلى Zeiss متحد البؤر LSM 710. كما هو موضح في هذه الأشكال من خلال مضان GFP المباشر ، تحافظ فيروسات الفسيفساء المركزة على خصائص نقل الجينات للخلايا العصبية.
بعد أن قمنا بتوصيف rAAVs الفسيفسائية من حيث النقاء والخصائص الفيزيائية والوظائف في المختبر ، قمنا بعد ذلك بتقييم إمكانية استخدام ناقلات الفسيفساء rAAV1 / 2 المنقاة لتحويل مخيخ الفئران C57BL / 6. لذلك ، تم إجراء حقن مجسمة في الفئران البالغة من العمر 9 أسابيع وتم تقييم تعبير GFP بعد 12 أسبوعا. كما هو متوقع ، لم تظهر المحقونة ب PBS أي مضان عند وضع العلامات المناعية ل GFP. كشفت صور التألق من الفئران المحقونة بناقلات rAAV1 / 2 التي تشفر GFP تحت سيطرة مروج المشابك 1 (rAAV1 / 2 - Syn-ssGFP) أن ناقلات rAAV1 / 2 نجحت في تحويل عدة مناطق من المخيخ ، وهي منطقة نوى المخيخ العميقة (DCN) ، وكذلك الفصيصات المختلفة للمخيخ (الشكل 5). توضح هذه النتائج التعبير المطول لجين التحوير في دماغ الثدييات (12 أسبوعا).
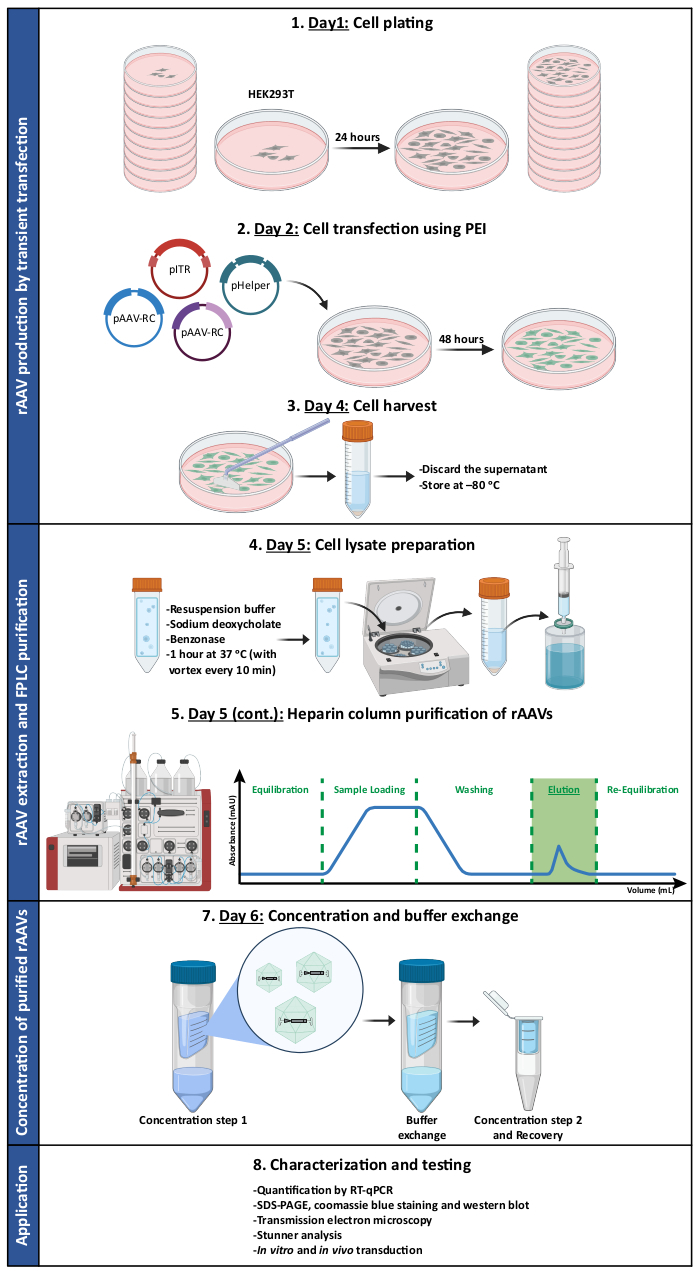
الشكل 1: تمثيل تخطيطي لبروتوكول إنتاج وتنقية rAAV. يتم إنتاج rAAVs عن طريق النقل العابر للخلايا HEK293T باستخدام البولي إيثيلين (PEI). بعد ذلك ، يتم حصاد الخلايا وتحليلها ، ويتم تنقية rAAVs من تجانس الخلية عن طريق كروماتوغرافيا التقارب. ثم يتم تركيز الكسور المجمعة التي تحتوي على rAAVs ، وتتميز المخزونات الفيروسية النهائية من حيث العيار والنقاء والخصائص المورفولوجية والنشاط البيولوجي. الاختصارات: rAAV = فيروس غدي مؤتلف. PEI = بولي إيثيلينيمين. RT-qPCR = تفاعل البلمرة الكمي المتسلسل في الوقت الفعلي ؛ SDS-PAGE = الصوديوم دوديسيل كبريتات بولي أكريلاميد هلام الكهربائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
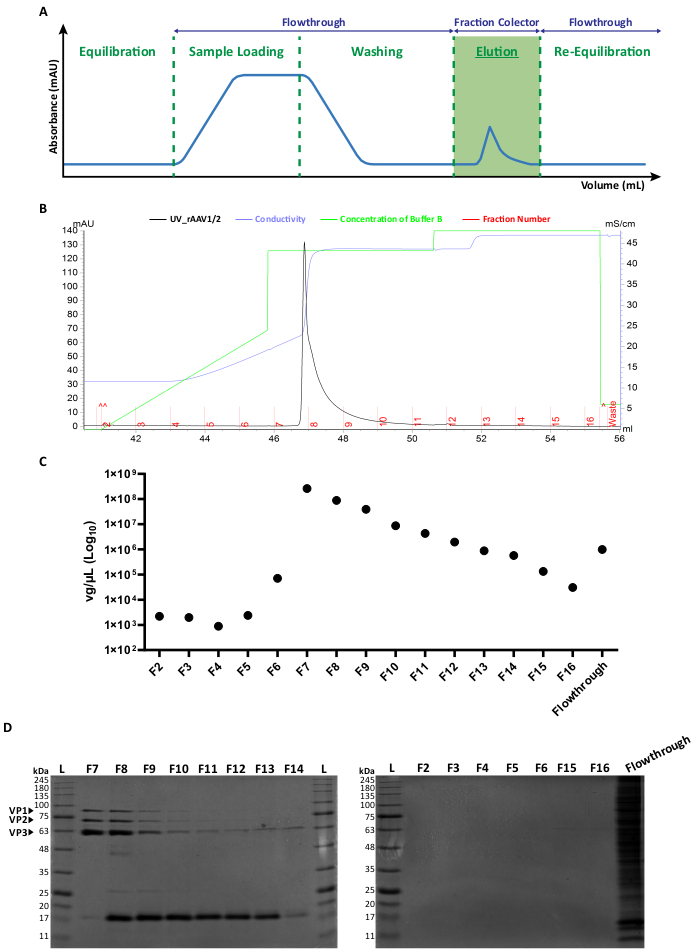
الشكل 2: بروتوكول تنقية FPLC وملف تعريف الشطف التمثيلي ل rAAV1 / 2. (أ) تمثيل تخطيطي لملف تعريف كروماتوجرام كامل ، يوضح المراحل المختلفة لعملية تنقية rAAV. بعد خطوة توازن العمود ، يتم تطبيق العينة. ثم يتم غسل العمود ، ويتم إجراء الشطف بتركيزات متزايدة من كلوريد الصوديوم. يتم جمع المواد غير المنضمة (التدفق) وكسور 1 مل من الفيروسات المستخلصة للتحليل. يتم التعبير عن الامتصاص عند 280 نانومتر بالميغا AU ويشير المحور السيني إلى الحجم بالمل. (B) مخطط كروماتوجرام جزئي موسع يظهر ذروة شطف rAAV1/2 (باللون الأسود) ، مع أرقام الكسور المقابلة (F2-F16) والنفايات (المشار إليها باللون الأحمر). يظهر التركيز الصادر للمخزن المؤقت B والموصلية (معبرا عنها بالمللي ثانية / سم) أيضا باللون الأخضر والأرجواني ، على التوالي. (C) RT-qPCR لكل جزء تم جمعه أثناء تنقية التقارب (F2-F16) والتدفق. يتم تمثيل العيار في vg / μL على مقياس لوغاريتمي. (د) تحليل SDS-PAGE للكسور الفيروسية التي تم جمعها. تم تحميل أحجام متساوية (40 ميكرولتر) لكل كسر من خطوة الشطف (F2-F16) ، والتدفق ذي الصلة وحلها على جل SDS-polyacrylamide بنسبة 10٪. تم تصور عصابات البروتين بواسطة تلطيخ كوماسي الأزرق. يشار إلى النطاقات المقابلة لبروتينات قفيصة AAV VP1 و VP2 و VP3. يتم تعيين سلم حجم البروتين القياسي على أنه (L) ويشار أيضا إلى الأوزان الجزيئية المقابلة. الاختصارات: rAAV = فيروس غدي مؤتلف. RT-qPCR = تفاعل البلمرة الكمي المتسلسل في الوقت الفعلي ؛ SDS-PAGE = الصوديوم دوديسيل كبريتات بولي أكريلاميد هلام الكهربائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
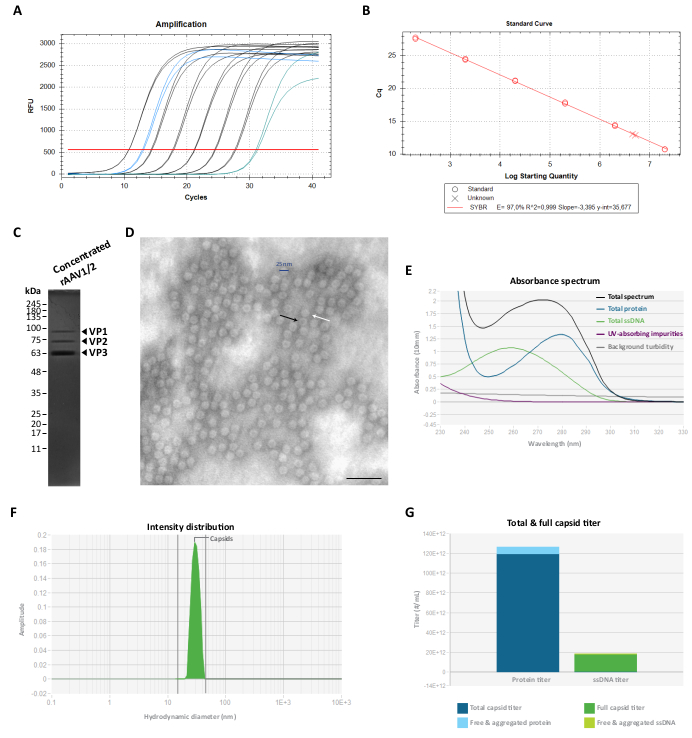
الشكل 3: توصيف متجهات rAAV1/2 المركزة. (أ) منحنيات تضخيم لعينة rAAV1/2 مركزة (باللون الأزرق)، ومعايير مخففة متسلسلا من 2 × 107 vg/μL إلى 2 × 102 vg/μL (باللون الأسود) وعنصر تحكم بدون قالب (باللون الأخضر)، تم الحصول عليه أثناء RT-qPCR. (B) منحنى قياسي (انحدار خطي) لتحديد عيار عينة rAAV ب vg / μL. (ج) تحليل SDS-PAGE للجسيمات الفيروسية المركزة. تم تجميع ما مجموعه 2.3 × 1010 vg من المخزون المركز على الهلام. (د) صورة المجهر الإلكتروني النافذ لجسيمات rAAV1 / 2 التي يبلغ قطرها ~ 25-30 نانومتر. يمكن تمييز الجسيمات الفارغة ذات المركز الكثيف للإلكترون (كما يتضح من الأسهم السوداء) عن القفيصات الكاملة (كما يتضح من الأسهم البيضاء). شريط المقياس = 100 نانومتر. (ه) طيف الامتصاص لتحضير rAAV1 / 2 المقاس بواسطة Stunner (باللون الأسود). كما يتم عرض مساهمة البروتينات (باللون الأزرق) ، و ssDNA (باللون الأخضر) ، والمركبات أو الشوائب الأخرى الممتصة للأشعة فوق البنفسجية (باللون الأرجواني) ، وتعكر الخلفية (باللون الرمادي). (F) توزيع شدة DLS ل rAAV1 / 2 مع ذروة واحدة عند 30 نانومتر ، مقاسة بواسطة Stunner. تم تحديد شدة تشتت القفيصة بنسبة 100٪ عن طريق قياس المنطقة تحت المنحنى من 15 إلى 45 نانومتر (مظلل باللون الأخضر). (ز) تحليل مذهل لمستحضر متجه rAAV1/2 يظهر عيار قفيصة كلي قدره 1.19 × 1014 cp/mL (أزرق غامق) وعيار قفيصة كامل يبلغ 1.73 × 1013 vg/mL (أخضر داكن). كما تم قياس بروتين حر ومجمع من مكافئات 7.16 ×10 12 cp / mL (أزرق فاتح) ، بالإضافة إلى ssDNA حر ومجمع من 1.04 × 1012 vg / mL مكافئات (أخضر فاتح). الاختصارات: rAAV = فيروس غدي مؤتلف. RT-qPCR = تفاعل البلمرة الكمي المتسلسل في الوقت الفعلي ؛ SDS-PAGE = الصوديوم دوديسيل كبريتات بولي أكريلاميد هلام الكهربائي. ssDNA = الحمض النووي الذي تقطعت به السبل ؛ DLS = تشتت الضوء الديناميكي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
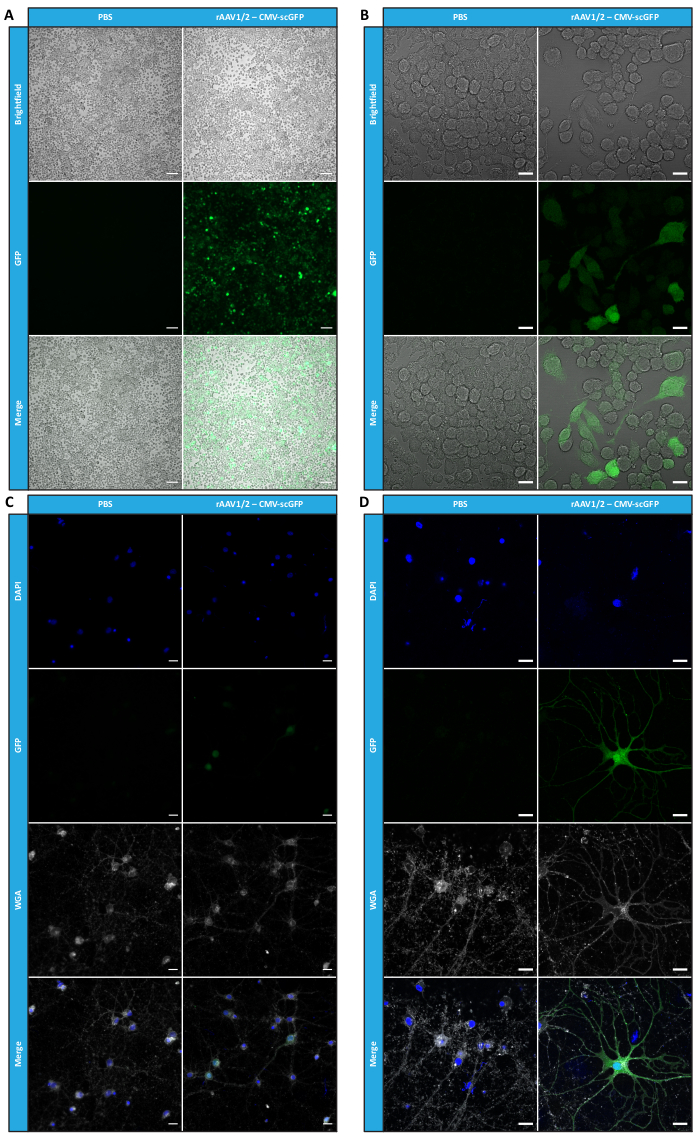
الشكل 4: تقييم العدوى في المختبر لعينة rAAV1 / 2 المركزة. (أ) أصيبت خلايا Neuro2A ب rAAV1 / 2 - CMV-scGFP أو تم تحضينها بحجم مكافئ من PBS ، كعنصر تحكم سلبي. صور برايتفيلد ومضان للخلايا التي تم تصويرها بعد 48 ساعة من الإصابة. تم الحصول على الصور في Zeiss Axio Observer Z1 (هدف 10x). قضبان المقياس = 100 ميكرومتر. (ب) صور مفصلة لخلايا Neuro2A بعد 48 ساعة من الإصابة ب rAAV1 / 2 - CMV-scGFP. تم الحصول على الصور في Zeiss LSM 710 (هدف 40x). قضبان المقياس = 20 ميكرومتر. (ج) مزارع عصبية أولية شبه كثيفة مصابة ب rAAV1 / 2 - CMV-scGFP أو محتضنة بحجم مكافئ من PBS ، تعمل كعنصر تحكم سلبي. تم تمييز الخلايا بصبغة نووية (DAPI باللون الأزرق) وبقعة غشاء (WGA باللون الأبيض). تم الحصول على الصور في Zeiss Axio Observer Z1 (هدف 40x). قضبان المقياس = 20 ميكرومتر. (د) صور مفصلة للمزارع العصبية الأولية شبه الكثيفة بعد 48 ساعة من الإصابة ب rAAV1 / 2 - CMV-scGFP. تم الحصول على الصور في Zeiss LSM 710 (هدف 40x). قضبان المقياس = 20 ميكرومتر. الاختصارات: rAAV = فيروس غدي مؤتلف. CMV = الفيروس المضخم للخلايا. scGFP = بروتين الفلورسنت الأخضر التكميلي ذاتيا ؛ PBS = محلول ملحي مخزن بالفوسفات ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ WGA = جرثومة القمح agglutinin. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
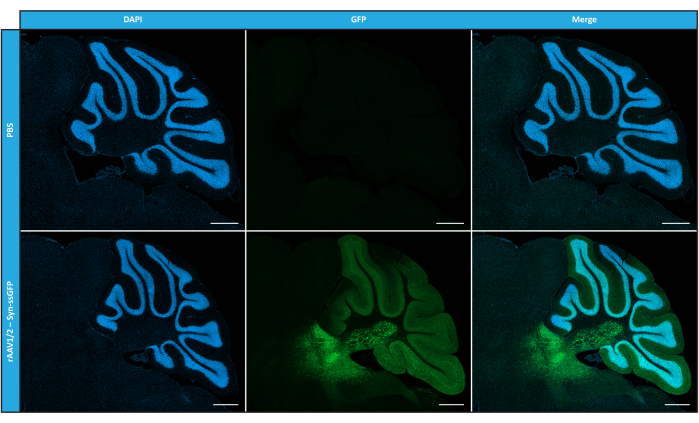
الشكل 5: كفاءة نقل rAAV1 / 2 في الجسم الحي بعد الحقن داخل المتني .صور تألق مناعي تمثيلية تظهر تعبير GFP الواسع الانتشار (باللون الأخضر) في جميع أنحاء المخيخ عند الحقن المركزي ل rAAV1 / 2 - Syn-ssGFP في المخيخ. كانت النوى ملطخة ب DAPI (باللون الأزرق). قضبان المقياس = 500 ميكرومتر. الاختصارات: rAAV = فيروس غدي مؤتلف. Syn = المشبك 1 ؛ ssGFP = بروتين الفلورسنت الأخضر أحادي الخيط ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ PBS = محلول ملحي مخزن بالفوسفات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: تحليل هلام الأغاروز لبلازميد ناقل rAAV مهضوم مع SmaI. تم هضم ستة مستنسخات (C1-C6) من pITR باستخدام إنزيم تقييد SmaI (الممرات 2 و 4 و 6 و 8 و 10 و 12) ، والذي يقطع مرتين داخل كل تكرار طرفي مقلوب. في هذه الحالة ، من المتوقع أن يؤدي الهضم الكامل لهذا pITR إلى توليد نطاقين (3,796 bp و 3,013 bp). في المستحضرات الناجحة (C1 و C3 و C4 و C5) ، لا يزال شريط 6809 bp ، الناتج عن الهضم الجزئي مرئيا (~ 5٪ من الإجمالي). في الاستعدادات مع إعادة تركيب ITR ، يتم عكس النسب (C2) ، أو لم يحدث الهضم (C6). يتم أيضا عرض المستنسخة غير المهضومة (الممرات 3 ، 5 ، 7 ، 9 ، 11 ، 13). الاختصارات: rAAV = فيروس غدي مؤتلف. ITR = تكرار المحطة المقلوبة. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S2: تنقية rAAV2 / 9 بواسطة كروماتوغرافيا التقارب القائمة على الهيبارين. (أ) ملف تعريف الشطف ل rAAV2/9 الذي يظهر قمة واحدة (باللون الأسود) ، بعد زيادة تركيز كلوريد الصوديوم. يشار إلى الكسور المجمعة بالأرقام (2-16) باللون الأحمر في أسفل الرسم البياني ، ويتم التعبير عن الامتصاص عند 280 نانومتر بالمللي أمبير ، ويتم التعبير عن الموصلية بالمللي ثانية / سم ، ويشير المحور السيني إلى الحجم بالملل. (B) عيار rAAV تم قياسه كميا بواسطة RT-qPCR لكل كسر مجمع (F2-F16) وتدفق. يتم تمثيل القيم على مقياس لوغاريتمي. (ج) مقايسة النقاء بواسطة SDS-PAGE وتلطيخ Coomassie الأزرق. تم تحميل أحجام متساوية (40 ميكرولتر) من كل كسر (F2-F16) والتدفق المعني وحلها على صفحة SDS بنسبة 10٪. تم تحديد كمية المخزون المركز بواسطة RT-qPCR وتم تخفيف 2.3 × 1010 vg في 40 ميكرولتر من PBS وتجميعها على الهلام. تم تصور عصابات البروتين بواسطة تلطيخ كوماسي الأزرق. يشار إلى بروتينات قفيصة AAV (VP1 و VP2 و VP3). يتم تعيين سلم حجم البروتين القياسي ب (L) ويشار أيضا إلى الأوزان الجزيئية المقابلة. الاختصارات: rAAV = فيروس غدي مؤتلف. RT-qPCR = تفاعل البلمرة الكمي المتسلسل في الوقت الفعلي ؛ SDS-PAGE = الصوديوم دوديسيل كبريتات بولي أكريلاميد هلام الكهربائي. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S3: تحليل اللطخة الغربية لناقلات rAAV1 / 2 المنقاة بواسطة FPLC. (أ) تم تحليل الكسور المجمعة وناقلات rAAV1 / 2 المركزة على هلام SDS-PAGE وتم فحصها باستخدام الجسم المضاد أحادي النسيلة المضاد ل AAV (B1) الذي يتعرف على بروتينات قفيصة VP1 و VP2 و VP3. (ب) تم تحليل الكسور المجمعة وناقلات rAAV1 / 2 المركزة على هلام SDS-PAGE وتم فحصها باستخدام الجسم المضاد أحادي النسيلة المضاد ل AAV (A69) الذي يتعرف على بروتينات قفيصة VP1 و VP2. الاختصارات: rAAV = فيروس غدي مؤتلف. FPLC = كروماتوغرافيا سائلة سريعة البروتين ؛ SDS-PAGE = الصوديوم دوديسيل كبريتات بولي أكريلاميد هلام الكهربائي. L = سلم حجم البروتين القياسي. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S4: تحليل اللطخة الغربية لناقلات rAAV2 / 9 المنقاة بواسطة FPLC. (أ) تم تحليل الكسور المجمعة وناقلات rAAV2 / 9 المركزة على هلام SDS-PAGE وتم فحصها باستخدام الجسم المضاد أحادي النسيلة المضاد ل AAV (B1) الذي يتعرف على بروتينات قفيصة VP1 و VP2 و VP3. (ب) تم تحليل الكسور المجمعة وناقلات rAAV2 / 9 المركزة على هلام SDS-PAGE وتم فحصها باستخدام الجسم المضاد أحادي النسيلة المضاد ل AAV (A69) الذي يتعرف على بروتينات قفيصة VP1 و VP2. الاختصارات: rAAV = فيروس غدي مؤتلف. FPLC = كروماتوغرافيا سائلة سريعة البروتين ؛ SDS-PAGE = الصوديوم دوديسيل كبريتات بولي أكريلاميد هلام الكهربائي. L = سلم حجم البروتين القياسي. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S5: القياس الكمي للتجه rAAV2 / 9 والتوصيف عبر Stunner. (أ) طيف الامتصاص (أسود) لمتجه rAAV2/9 المقاس بواسطة Stunner. كما تم تصوير مساهمة البروتينات (الأزرق) ، ssDNA (الأخضر) ، المركبات الأخرى الممتصة للأشعة فوق البنفسجية أو الشوائب (الأرجواني) ، وتعكر الخلفية (الرمادي). (ب) توزيع شدة DLS ل rAAV2 / 9 مع ذروة رئيسية عند 30 نانومتر تقابل شدة تشتت قفيصة بنسبة 78٪ ، كما هو محدد بقياس المنطقة تحت المنحنى من 15 إلى 45 نانومتر (مظلل باللون الأخضر). كما تم قياس إجمالي كثافة إجمالية بنسبة 22٪ (مظللة باللون الرمادي) بمساهمة رئيسية من الركام الكبير (19.9٪) بمتوسط قطر 620 نانومتر. (ج) تحليل مذهل لمستحضر متجه rAAV2 / 9 يظهر عيار قفيصة إجمالي قدره 2.18 × 1014 cp / mL (أزرق غامق) وعيار قفيصة كامل يبلغ 2.35 × 1013 vg / mL (أخضر داكن). كما تم قياس بروتين حر ومجمع من 2.92 × 1013 cp / mL مكافئ (أزرق فاتح) ، بالإضافة إلى ssDNA حر ومجمع من 3.14 × 1012 مكافئ vg / mL (أخضر فاتح) ، في هذا المستحضر. الاختصارات: rAAV = فيروس غدي مؤتلف. ssDNA = الحمض النووي الذي تقطعت به السبل ؛ DLS = تشتت الضوء الديناميكي. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S6: كفاءة النقل في المختبر وصلاحية الكسور المنقاة من rAAV1 / 2. HEK293T الخلايا التي تعبر عن GFP (مضان مباشر) بعد 48 ساعة من التحويل مع 50 ميكرولتر من كسور FPLC لترميز متجه rAAV1 / 2 ssGFP (rAAV1 / 2 - CMV-ssGFP). قضبان المقياس = 100 ميكرومتر. الاختصارات: rAAV = فيروس غدي مؤتلف. FPLC = كروماتوغرافيا سائلة سريعة البروتين ؛ ssGFP = بروتين فلوري أخضر أحادي الجديل. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S7: كفاءة النقل في المختبر وصلاحية الأجزاء المنقاة من rAAV2 / 9. أصيبت HEK293T الخلايا ب 50 ميكرولتر من كل جزء FPLC (F2-F16) أو تدفق من خلال تشفير متجه rAAV2 / 9 scGFP تحت سيطرة مروج CMV. تم تصوير الخلايا المعبرة عن GFP بعد 48 ساعة من الإصابة. قضبان المقياس = 100 ميكرومتر. الاختصارات: rAAV = فيروس غدي مؤتلف. FPLC = كروماتوغرافيا سائلة سريعة البروتين ؛ scGFP = بروتين الفلورسنت الأخضر التكميلي ذاتيا ؛ CMV = الفيروس المضخم للخلايا. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
أصبحت مجموعة أدوات ناقلات AAV سريعة التوسع واحدة من أكثر أنظمة توصيل الجينات الواعدة لمجموعة واسعة من أنواع الخلايا من خلال طرق مختلفة للإدارة. في هذا العمل ، كنا نهدف إلى تطوير بروتوكول محسن لإنتاج وتنقية وتوصيف ناقلات rAAV الفسيفسائية التي يمكن أن تثبت قيمتها في الدراسات قبل السريرية. لهذا الغرض ، يتم وصف توليد متجهات الفسيفساء rAAV1 / 2 و rAAV2 / 9 هنا ، ولكن يمكن أيضا تطبيق الإجراء لتنقية متجهات rAAV2 القياسية (البيانات غير معروضة).
تم إنتاج الفسيفساء rAAVs باتباع طريقة نقل محسنة باستخدام PEI ككاشف نقل. تم اختيار طريقة النقل العابر نظرا لمرونتها وسرعتها الأكبر ، وهي مزايا كبيرة في الدراسات قبل السريرية في المراحل المبكرة. بمجرد التحقق من صحة جين التحوير والنمط المصلي المعين ، يمكن ضبط نظام الإنتاج لتحقيق قابلية أفضل للتوسع وفعالية التكلفة من خلال إنشاء خط خلية منقولة مستقر يعبر عن مجموعة فرعية من جينات Rep / Cap المحددة ، مع جينات إضافية توفرها عملية العدوى24. بالمقارنة مع نقل الكالسيوم والفوسفات ، يقدم PEI العديد من المزايا. إنه كاشف نقل مستقر وفعال من حيث التكلفة يعمل بفعالية ضمن نطاق أوسع من الأس الهيدروجيني. بالإضافة إلى ذلك ، فإنه يلغي الحاجة إلى تغيير وسيط الخلية بعد النقل ، مما يؤدي إلى انخفاض كبير في كل من التكلفة وعبء العمل69.
في محاولة للتحايل على بعض القيود التي تفرضها تدرجات CsCl أو iodixanol ، تم حصاد rAAVs المنتجة وتنقيتها بواسطة كروماتوغرافيا التقارب. تقدم هذه الاستراتيجية نهجا مبسطا وقابلا للتطوير يمكن تنفيذه دون الحاجة إلى الطرد المركزي الفائق والتدرجات ، مما ينتج عنه عيار فيروسي نظيف ومرتفع. في الواقع ، يمكن أتمتة تقنيات الكروماتوغرافيا التي تستخدم نظام FPLC وتوسيع نطاقها عن طريق تعبئة المزيد من حجم الراتنج في عمود بارتفاع سرير أعلى. يمكن تكييف البروتوكول الموضح هنا بسهولة لدمج أعمدة HiTrap Heparin HP سعة 5 مل (البيانات غير معروضة). بالإضافة إلى ذلك ، يمكن إعادة استخدام أعمدة الهيبارين عدة مرات ، مما يساهم في فعالية تكلفة هذه الطريقة.
ثم تم وصف rAAVs المنقى من حيث العيار والنقاء والخصائص المورفولوجية والنشاط البيولوجي. ومن المثير للاهتمام ، في تلطيخ Coomassie الأزرق ، تم اكتشاف شريط يحتوي على حوالي 17 كيلو دالتون في الكسور F8-F16 بالإضافة إلى بروتينات القفيصة الفيروسية الثلاثة النموذجية. ومع ذلك ، لم يعد هذا النطاق موجودا بعد خطوة تركيز rAAVs. علاوة على ذلك ، يمكن أيضا اكتشاف بعض النطاقات الخافتة ذات الأوزان الجزيئية الأقل من VP3 (<62 كيلو دالتون) عند وضع العلامات B1 و A69 ، مما يشير إلى أن هذه يمكن أن تكون شظايا من بروتينات قفيصة VP1 و VP2 و VP370. الاحتمال الآخر هو أن هذه في الواقع بروتينات تنقية مشتركة أخرى مثل الفيريتين أو البروتينات الخلوية الأخرى مع الببتيدات التي تشترك في بصمات بروتينية مماثلة مع بروتينات قفيصة AAV ويمكن أن تشارك في بيولوجيا AAV ، كما اقترح سابقا26،71،72.
كما كشف تحليل TEM والتحليل المذهل عن وجود جزيئات فارغة بمستويات متغيرة عبر عمليات إنتاج مختلفة. وبالمثل ، أبلغت دراسات أخرى سابقا عن توليد مستويات متغيرة وعالية (>65٪) من القفيصات الفارغة ل rAAVs المحضرة بطرق النقل أو العدوى24,73. تبدأ الآلية الكامنة وراء توليد rAAV بالتكوين السريع للقفيصات الفارغة من بروتينات VP المركبة حديثا ، تليها خطوة بطيئة تحد من معدل تعبئة الجينوم في القفيصات المشكلة مسبقا بوساطة بروتينات Rep74,75. لذلك ، يتم إنشاء قفيصات فارغة في إنتاج rAAV ، على الرغم من أن نسبة القفيصات الفارغة والكاملة يمكن أن تختلف اعتمادا على حجم وتسلسل الجينات المحورة ذات الأهمية وظروف زراعة الخلايا58,73. تثير القفيصات الفارغة بعض المخاوف لأنها ، بسبب افتقارها إلى الجينوم محل الاهتمام ، غير قادرة على توفير تأثير علاجي وقد تزيد أيضا من الاستجابة المناعية الفطرية أو التكيفية. ومع ذلك ، فقد أظهرت بعض التقارير أيضا أنه من خلال تعديل نسبتها ، قد تكون قفيصات AAV الفارغة بمثابة أفخاخ فعالة للغاية للأجسام المضادة المعادلة الخاصة ب AAV ، وبالتالي تزيد من كفاءة النقل60،76،77. إذا كان وجود القفيصات الفارغة ضارا للغاية وبالنظر إلى الطابع الأنيوني الأقل قليلا للجسيمات الفارغة مقارنة بالنواقل الكاملة ، فقد يتضمن الحل المحتمل إجراء خطوة تنقية تلميع ثانية باستخدام تقنيات كروماتوغرافيا تبادل الأنيون64.
تقدم هذه الدراسة أيضا دليلا مقنعا على أن rAAVs الفسيفسائية المتولدة قادرة على التحويل بكفاءة ليس فقط في الثقافات العصبية المختبرية ولكن أيضا الجهاز العصبي المركزي عند الحقن داخل الجمجمة ل rAAV1 / 2. بشكل عام ، تشير هذه النتائج إلى أن بروتوكول الإنتاج والتنقية الموصوف يجعل rAAVs عالية النقاء والنشطة بيولوجيا جاهزة للاستخدام في 6 أيام ، وتقدم نفسها كطريقة متعددة الاستخدامات وفعالة من حيث التكلفة لتوليد rAAVs في الدراسات قبل السريرية.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نحن ممتنون للتعاون والرؤى والمساعدة الفنية التي قدمتها الدكتورة مونيكا زوزارتي ، في معهد كويمبرا للبحوث السريرية والطبية الحيوية (iCBR) ومركز الطب الحيوي المبتكر والتكنولوجيا الحيوية (CIBB) ، فيما يتعلق بتحليل TEM ل rAAVs. نعرب عن تقديرنا للدكتورة دومينيك فرنانديز ، في مركز علم الأعصاب وبيولوجيا الخلية بجامعة كويمبرا (CNC-UC) ومعهد البحوث متعددة التخصصات بجامعة كويمبرا (IIIUC) ، لمساعدتها الفنية التي لا تقدر بثمن وأفكارها فيما يتعلق بتجارب الثقافة العصبية الأولية. تم توفير بلازميدات pRV1 و pH21 و pFdelta6 ، الضرورية لهذه الدراسة ، بسخاء من قبل الدكتورة كريستينا مكلور ، في كلية العلوم الطبية ، كلية علوم الحياة والطب ، جامعة أبردين ، ونحن ممتنون لها. تم تمويل هذا العمل من قبل الصندوق الأوروبي للتنمية الإقليمية (ERDF) ، من خلال برنامج التشغيل الإقليمي Centro 2020. من خلال COMPETITION 2020 - البرنامج التشغيلي للقدرة التنافسية والتدويل ، والصناديق الوطنية البرتغالية عبر FCT - Fundação para a Ciência e a Tecnologia ، في إطار المشاريع: UIDB / 04539/2020 ، UIDP / 04539/2020 ، LA / P / 0058/2020 ، ViraVector (CENTRO-01-0145-FEDER-022095) ، Imagene (PTDC / BBB-NAN / 0932/2014 | POCI-01-0145-FEDER-016807) ، إعادة تعيين - IDT-COP (CENTRO-01-0247-FEDER-070162) ، محاربة SARS-CoV-2 (CENTRO-01-01D2-FEDER-000002) ، BDforMJD (CENTRO-01-0145-FEDER-181240) ، ModelPolyQ2.0 (CENTRO-01-0145-FEDER-181258) ، MJDEDIT (CENTRO-01-0145-FEDER-181266) ؛ من قبل الصندوق الأمريكي البرتغالي للبحوث الطبية الحيوية (APBRF) وصندوق ريتشارد تشين وليلي لوك ماتشادو جوزيف لأبحاث الأمراض ، ARDAT بموجب اتفاقية منحة IMI2 JU رقم 945473 بدعم من الاتحاد الأوروبي و EFPIA ؛ 101059981 دعم مشروع GeneT- Teaming من قبل برنامج Horizon Europe التابع للاتحاد الأوروبي. م. م. ل. بدعم من 2021.05776.BD. تم دعم C.H. من قبل 2021.06939.BD. وحظيت شركة A.C.S. بدعم 2020.07721.BD؛ و D.D.L. مدعوم من قبل 2020.09668.BD تم إنشاء الشكل 1 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 10% povidone-iodine | Medline | MDS093943 | |
| 12-well plates | Thermo Scientific | 11889684 | |
| 24-well plates | VWR | 734-2325 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen | D1306 | |
| 96-well Stunner plate | Unchained Labs | 701-2025 | 96-well quantification plate for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| AAVpro Titration Kit (for Real-Time PCR) Ver.2 | Takara | 6233 | For determining the titer of AAV using RT-qPCR. This kit contains DNase I, Lysis Buffer, Dilution Buffer, positive control, Taq II mix, primer forward, primer reverse, water |
| Acetic acid glacial | Fisher Chemical | A/0360/PB17 | |
| ÄKTA pure 25 | Cytiva | 29018224 | FPLC system controlled by UNICORN software, version 6.3 |
| Alkaline phosphatase-linked goat anti-mouse | Invitrogen | 31328 | |
| Amicon ultra-0.5 centrifugal filter unit | Merck Millipore | UFC5100 | |
| Amicon ultra-15 centrifugal filter unit | Merck Millipore | UFC9100 | |
| Benzonase Nuclease | Merck Millipore | E1014 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| CFX96 Real-Time PCR detection system | Biorad | 184-5096 | |
| ChemiDoc Touch Imaging System | Bio-Rad Laboratories | 1708370 | |
| Chicken polyclonal anti-GFP primary antibody | Abcam | ab13970 | |
| Coomassie Blue G250 | Fisher Chemical | C/P541/46 | |
| Dithiothreitol (DTT) | Fisher Bioreagents | BP17225 | |
| DMEM | Sigma-Aldrich | D5796 | |
| ECF Substrate for Western Blotting | Cytiva | RPN5785 | |
| FastDigest SmaI | Thermo Scientific | FD0663 | |
| FEI-Tecnai G2 Spirit Biotwin | FEI | Biotwin | Transmission electron microscope |
| Fetal bovine serum | Biowest | S1810 | |
| Fluorescence mounting medium | Dako | S3023 | |
| Formvar-carbon coated 200 mesh grid | TAAB Laboratories Equipment | F077/025 | |
| Gas evacuation apparatus | RWD | R546W | |
| Glycerol | Fisher BioReagents | 10021083 | |
| Goat polyclonal anti-chicken antibody, Alexa Fluor 488 | Invitrogen | A-11039 | |
| Hamilton needle 30G, Small Hub RN Needle, 25 mm, PST3 | Hamilton | 7803-07 | |
| Hamilton syringe (10 µL) | Hamilton | 7653-01 | |
| HEK293T | American Type Culture Collection | CRL-11268 | |
| HiTrap Heparin HP 1 x 5 mL | Cytiva | 17040701 | Pre-packed heparin column |
| HiTrap Heparin HP 5 x 1 mL | Cytiva | 17040601 | Pre-packed heparin column |
| Immobilon-P PVDF Membrane | Merck Millipore | IPVH00010 | |
| Isoflurane | Braun | 469860 | |
| Ketamine | Dechra Pharmaceuticals | N/A | Nimatek |
| Low-retention microcentrifuge tubes (2 mL) | Fisher Scientific | 11906965 | |
| Lunatic & Stunner Client software | Unchained Labs | N/A | Client analysis software version 8.0.1.235. Software for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Methanol | Fisher Chemical | M/4000/FP21 | |
| Mouse monoclonal anti-AAV, VP1, VP2 antibody (A69) | American Research Products | 03-61057 | |
| Mouse monoclonal anti-AAV, VP1, VP2, VP3 antibody (B1) | American Research Products | 03-61058 | |
| Neuro2a | American Type Culture Collection | CCL-131 | |
| Normal goat serum | Gibco | 16210064 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 12738422 | |
| NZYColour Protein Marker II | NZYtech | MB09002 | |
| pAAV-CMV-scGFP | Addgene | 32396 | Addgene plasmid # 32396; http://n2t.net/addgene:32396; RRID:Addgene_32396 |
| pAAV-CMV-ssGFP | Addgene | 105530 | Addgene plasmid # 105530; http://n2t.net/addgene:105530; RRID:Addgene_105530 |
| pAAV2/9n | Addgene | 112865 | Addgene plasmid # 112865; http://n2t.net/addgene:112865; RRID:Addgene_112865 |
| Paraformaldehyde | Acros Organics | 10342243 | |
| PBS | Fisher BioReagents | BP2438 | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Pluronic F-68 Non-ionic Surfactant (100x) | Gibco | 24040032 | |
| Polyethylenimine MAX, MW 40,000 | Polysciences Europe | 24765 | |
| R500 Series Compact Small Animal Anesthesia Machine - Isoflurane | RWD | N/A | |
| Sample Inlet Valve V9-IS | Cytiva | 29027746 | |
| Sample pump P9-S | Cytiva | 29027745 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium chloride | Fisher Scientific | 10428420 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dodecyl sulfate (SDS) | Fisher Bioreagents | BP166 | |
| Sterile PVDF syringe filter | Fisher Scientific | 15191499 | |
| Stunner Platform | Unchained Labs | 700-2002 | Equipment for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Superloop 150 mL | Cytiva | 18-1023-85 | |
| Superloop 50 mL | Cytiva | 18-1113-82 | |
| SURE 2 supercompetent cells | Stratagene, Agilent Technologies | HPA200152 | |
| Treated culture dishes | Corning | 734-1711 | |
| Tris base | Fisher BioReagents | BP152 | |
| Tris hydrochloride | Fisher BioReagents | BP153 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin-EDTA | Gibco | 25200-072 | |
| Wheat Germ Agglutinin (WGA) conjugated with Alexa Fluor 633 | Invitrogen | W21404 | |
| Xylazine | Dechra Pharmaceuticals | N/A | Sedaxylan |
| Zeiss Axio Observer Z1 | Carl Zeiss Microscopy GmbH | N/A | Inverted fluorescence microscope equiped with an EC Plan-Neofluar 10x/0.30 objective and a Plan-Apochromat 40x/0.95 objective |
| Zeiss Axio Scan.Z1 | Carl Zeiss Microscopy GmbH | N/A | Slide scanner fluorescence microscope equipped with a Plan-Apochromat 20x/0.8 objective |
| Zeiss LSM 710 | Carl Zeiss Microscopy GmbH | N/A | Inverted confocal microscope equipped with a Plan-Apochromat 40x/1.4 Oil DIC objective |
| µ-Slide 8 well Ibidi | Ibidi | 80826 | 8-well chamber slide |
References
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Front Mol Neurosci. 7, 1-9 (2014).
- Muzyczka, N. Use of Adeno-Associated Virus as a General Transduction Vector for Mammalian Cells. Viral Expression Vectors. 158, 97-129 (1992).
- Goncalves, M. A. F. V Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43(2005).
- Flotte, T. R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 11 (10), 805-810 (2004).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Ojala, D. S., Amara, D. P., Schaffer, D. V Adeno-Associated Virus Vectors and Neurological Gene Therapy. Neuroscientist. 21 (1), 84-98 (2014).
- Saraiva, J., Nobre, R. J., Pereira de Almeida, L. Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. Journal of Controlled Release. 241, 94-109 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods Mol Biol. 807, 47-92 (2011).
- Sonntag, F., Schmidt, K., Kleinschmidt, J. A. A viral assembly factor promotes AAV2 capsid formation in the nucleolus. Proc Natl Acad Sci U S A. 107 (22), 10220-10225 (2010).
- Sonntag, F., et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes. J Virol. 85 (23), 12686-12697 (2011).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol. 78 (12), 6381-6388 (2004).
- Gao, G., Vandenberghe, L. H., Wilson, J. M. New recombinant serotypes of AAV vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The role of the adeno-associated virus capsid in gene transfer. Methods Mol Biol. 437, 51-91 (2008).
- Clark, K. R., Voulgaropoulou, F., Fraley, D. M., Johnson, P. R. Cell lines for the production of recombinant adeno-associated virus. Hum Gene Ther. 6 (10), 1329-1341 (1995).
- Inoue, N., Russell, D. W. Packaging cells based on inducible gene amplification for the production of adeno-associated virus vectors. J Virol. 72 (9), 7024-7031 (1998).
- Liu, X., Voulgaropoulou, F., Chen, R., Johnson, P. R., Clark, K. R. Selective Rep-Cap gene amplification as a mechanism for high-titer recombinant AAV production from stable cell lines. Mol Ther. 2 (4), 394-403 (2000).
- Mathews, L. C., Gray, J. T., Gallagher, M. R., Snyder, R. O. [23] Recombinant adeno-associated viral vector production using stable packaging and producer cell lines. Methods Enzymol. 346, 393-413 (2002).
- Gao, G., et al. Purification of recombinant adeno-associated virus vectors by column chromatography and its performance in vivo. Hum Gene Ther. 11 (15), 2079-2091 (2000).
- Xiao, X., Li, J., Samulski, R. J. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus. J Virol. 72 (3), 2224-2232 (1998).
- Aponte-Ubillus, J. J., et al. Molecular design for recombinant adeno-associated virus (rAAV) vector production. Appl Microbiol Biotechnol. 102 (3), 1045-1054 (2018).
- Smith, R. H., Levy, J. R., Kotin, R. M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells. Mol Ther. 17 (11), 1888-1896 (2009).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Wright, J. F. Transient transfection methods for clinical adeno-associated viral vector production. Hum Gene Ther. 20 (7), 698-706 (2009).
- Yuan, Z., Qiao, C., Hu, P., Li, J., Xiao, X. A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes. Hum Gene Ther. 22 (5), 613-624 (2011).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Hum Gene Ther Methods. 26 (4), 147-157 (2015).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Anderson, R., Macdonald, I., Corbett, T., Whiteway, A., Prentice, H. G. A method for the preparation of highly purified adeno-associated virus using affinity column chromatography, protease digestion and solvent extraction. J Virol Methods. 85 (1-2), 23-34 (2000).
- Okada, T., et al. Scalable purification of adeno-associated virus serotype 1 (AAV1) and AAV8 vectors, using dual ion-exchange adsorptive membranes. Hum Gene Ther. 20 (9), 1013-1021 (2009).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. J Virol Methods. 183 (2), 139-146 (2012).
- Lock, M., et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale. Hum Gene Ther. 21 (10), 1259-1271 (2010).
- Wang, L., Blouin, V., Brument, N., Bello-Roufai, M., Francois, A. Production and Purification of Recombinant Adeno-Associated Vectors. Adeno-Associated Virus: Methods and Protocols. 807, 361-404 (2011).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated Virus Serotypes: Vector Toolkit for Human Gene Therapy. Molecular Therapy. 14 (3), 316-327 (2006).
- Mietzsch, M., Broecker, F., Reinhardt, A., Seeberger, P. H., Heilbronn, R. Differential adeno-associated virus serotype-specific interaction patterns with synthetic heparins and other glycans. J Virol. 88 (5), 2991-3003 (2014).
- McClure, C., Cole, K. L. H., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. JoVE. (57), e3348(2011).
- Auricchio, A., O’Connor, E., Hildinger, M., Wilson, J. M. A single-step affinity column for purification of serotype-5 based adeno-associated viral vectors. Mol Ther. 4 (4), 372-374 (2001).
- Wang, Q., et al. Identification of an adeno-associated virus binding epitope for AVB sepharose affinity resin. Mol Ther Methods Clin Dev. 2, 15040(2015).
- Mietzsch, M., et al. OneBac: platform for scalable and high-titer production of adeno-associated virus serotype 1–12 vectors for gene therapy. Hum Gene Ther. 25 (3), 212-222 (2014).
- Mietzsch, M., et al. Characterization of AAV-specific affinity ligands: consequences for vector purification and development strategies. Mol Ther Methods Clin Dev. 19, 362-373 (2020).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2023).
- Koerber, J. T., Jang, J. -H., Yu, J. H., Kane, R. S., Schaffer, D. V. Engineering adeno-associated virus for one-Step purification via immobilized metal affinity chromatography. Hum Gene Ther. 18 (4), 367-378 (2007).
- Zhang, H. -G., et al. Addition of six-His-tagged peptide to the C terminus of adeno-associated virus VP3 does not affect viral tropism or production. J Virol. 76 (23), 12023-12031 (2002).
- Arnold, G. S., Sasser, A. K., Stachler, M. D., Bartlett, J. S. Metabolic biotinylation provides a unique platform for the purification and targeting of multiple AAV vector serotypes. Mol Ther. 14 (1), 97-106 (2006).
- Rabinowitz, J. E., et al. Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol. 78 (9), 4421-4432 (2004).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Mol Ther. 7 (3), 419-425 (2003).
- Choi, V., McCarty, D., Samulski, R. AAV hybrid serotypes: improved vectors for gene delivery. Curr Gene Ther. 5 (3), 299-310 (2005).
- Nonnenmacher, M., van Bakel, H., Hajjar, R. J., Weber, T. High capsid–genome correlation facilitates creation of AAV libraries for directed evolution. Mol Ther. 23 (4), 675-682 (2015).
- Kimura, K., et al. A mosaic adeno-associated virus vector as a versatile tool that exhibits high levels of transgene expression and neuron specificity in primate brain. Nat Commun. 14 (1), 4762(2023).
- Issa, S. S., Shaimardanova, A. A., Solovyeva, V. V., Rizvanov, A. A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 12 (5), 785(2023).
- Foust, K. D., et al. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27 (1), 59-65 (2009).
- Lopes, M. M., et al. A new protocol for whole-brain biodistribution analysis of AAVs by tissue clearing, light-sheet microscopy and semi-automated spatial quantification. Gene Ther. 29 (12), 665-679 (2022).
- Gray, J. T., Zolotukhin, S. Design and construction of functional AAV vectors. Methods Mol Biol. 807, 25-46 (2011).
- Choi, V. W., Asokan, A., Haberman, R. A., Samulski, R. J. Production of recombinant adeno-associated viral vectors. Curr Protoc Hum Genet. , Chapter 12, Unit 12.9-12.9.21 (2007).
- Bennicelli, J., et al. Reversal of blindness in animal models of leber congenital amaurosis using optimized AAV2-mediated gene transfer. Mol Ther. 16 (3), 458-465 (2008).
- Fischer, M. D., Hickey, D. G., Singh, M. S., MacLaren, R. E. Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods. 27 (4), 150-158 (2016).
- Santos, S. D., et al. Contactin-associated protein 1 (Caspr1) regulates the traffic and synaptic content of α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-type glutamate receptors. J Biol Chem. 287 (9), 6868-6877 (2012).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 7 (1), 122-128 (2003).
- Dong, B., Nakai, H., Xiao, W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther. 18 (1), 87-92 (2010).
- Wright, J. F. AAV empty capsids: For better or for worse. Mol Ther. 22 (1), 1-2 (2014).
- Asaad, W., et al. AAV genome modification for efficient AAV production. Heliyon. 9 (4), e15071(2023).
- Wobus, C. E., et al. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J Virol. 74 (19), 9281-9293 (2000).
- Wistuba, A., Kern, A., Weger, S., Grimm, D., Kleinschmidt, J. A. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol. 71 (2), 1341-1352 (1997).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J Virol Methods. 140 (1-2), 183-192 (2007).
- Brument, N., et al. A versatile and scalable two-step ion-exchange chromatography process for the purification of recombinant adeno-associated virus serotypes-2 and -5. Mol Ther. 6 (5), 678-686 (2002).
- Potter, M., et al. A simplified purification protocol for recombinant adeno-associated virus vectors. Mol Ther Methods Clin Dev. 1, 14034(2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570(2019).
- Yang, Q. -E., et al. Rapid quality control assessment of adeno-associated virus vectors via Stunner. GEN Biotechnology. 1 (3), 300-310 (2022).
- Huang, X., et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 193 (2), 270-277 (2013).
- Salganik, M., et al. Evidence for pH-dependent protease activity in the adeno-associated virus capsid. J Virol. 86 (21), 11877-11885 (2012).
- Dong, B., et al. Proteomics analysis of co-purifying cellular proteins associated with rAAV vectors. PLoS One. 9 (2), e86453(2014).
- Grieger, J. C., Soltys, S. M., Samulski, R. J. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 24 (2), 287-297 (2016).
- Wright, J. Product-related impurities in clinical-grade recombinant AAV vectors: characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Bennett, A., Mietzsch, M., Agbandje-McKenna, M. Understanding capsid assembly and genome packaging for adeno-associated viruses. Future Virol. 12 (6), 283-297 (2017).
- Myers, M. W., Carter, B. J. Assembly of adeno-associated virus. Virology. 102 (1), 71-82 (1980).
- Mingozzi, F., et al. Overcoming preexisting humoral immunity to AAV using capsid decoys. Sci Transl Med. 5 (194), (2013).
- Hoffman, B. E., Herzog, R. W. Covert warfare against the immune system: decoy capsids, stealth genomes, and suppressors. Mol Ther. 21 (9), 1648-1650 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved