Method Article
Isolierung von Adeno-assoziierten viralen Vektoren durch ein einstufiges und halbautomatisches Heparin-Affinitätschromatographie-Protokoll
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt ein detailliertes Protokoll zur Erzeugung und Reinigung von Adeno-assoziierten viralen Vektoren unter Verwendung einer optimierten Heparin-basierten Affinitätschromatographie-Methode. Es stellt einen einfachen, skalierbaren und kostengünstigen Ansatz dar, der die Notwendigkeit einer Ultrazentrifugation eliminiert. Die daraus resultierenden Vektoren weisen eine hohe Reinheit und biologische Aktivität auf, was ihren Wert in präklinischen Studien unter Beweis stellt.
Zusammenfassung
Das Adeno-assoziierte Virus (AAV) hat sich zu einem immer wertvolleren Vektor für die In-vivo-Genübertragung entwickelt und befindet sich derzeit in klinischen Studien am Menschen. Die häufig verwendeten Methoden zur Aufreinigung von AAVs verwenden jedoch die Cäsiumchlorid- oder Iodixanol-Dichtegradienten-Ultrazentrifugation. Trotz ihrer Vorteile sind diese Methoden zeitaufwändig, haben eine begrenzte Skalierbarkeit und führen oft zu Vektoren mit geringer Reinheit. Um diese Einschränkungen zu überwinden, wenden sich die Forscher den Chromatographietechniken zu. Hier stellen wir ein optimiertes Heparin-basiertes Affinitätschromatographie-Protokoll vor, das als universeller Erfassungsschritt für die Aufreinigung von AAVs dient.
Diese Methode beruht auf der intrinsischen Affinität des AAV-Serotyps 2 (AAV2) zu Heparansulfat-Proteoglykanen. Konkret beinhaltet das Protokoll die Co-Transfektion von Plasmiden, die für die gewünschten AAV-Kapsidproteine kodieren, mit denen von AAV2, wodurch Mosaik-AAV-Vektoren entstehen, die die Eigenschaften beider elterlicher Serotypen kombinieren. Kurz gesagt, nach der Lyse von Produzentenzellen wird ein Gemisch, das AAV-Partikel enthält, direkt nach einem optimierten einstufigen Heparin-Affinitätschromatographie-Protokoll unter Verwendung eines Standard-FPLC-Systems (Fast Protein Liquid Chromatographie) gereinigt. Gereinigte AAV-Partikel werden anschließend konzentriert und einer umfassenden Charakterisierung in Bezug auf Reinheit und biologische Aktivität unterzogen. Dieses Protokoll bietet einen vereinfachten und skalierbaren Ansatz, der ohne Ultrazentrifugation und Gradienten durchgeführt werden kann und saubere und hohe Virustiter liefert.
Einleitung
Der Adeno-assoziierte Virusvektor (AAV) erobert seinen Weg als eines der vielversprechendsten Verabreichungssysteme in aktuellen Gentherapie-Studien. AAV wurde erstmals 19651 identifiziert und ist ein kleines, unbehülltes Virus mit einem ikosaedrischen Proteinkapsid von etwa 25 nm Durchmesser, das ein einzelsträngiges DNA-Genom beherbergt. AAVs gehören zur Familie der Parvoviridae und zur Gattung der Dependoparvoviren, da sie in einzigartiger Weise auf eine Koinfektion mit einem Helfervirus, wie z. B. dem Herpes-simplex-Virus oder, häufiger dem Adenovirus, angewiesen sind, um ihren lytischen Zyklus zu vervollständigen 2,3.
Das 4,7 Kilobasen große Genom von AAVs besteht aus zwei offenen Leserahmen (ORFs), die von zwei invertierten terminalen Wiederholungen (ITRs) flankiert werden, die charakteristische T-förmige Haarnadelendenbilden 4. ITRs sind die einzigen cis-wirkenden Elemente, die für die AAV-Verpackung, -Replikation und -Integration entscheidend sind, und daher die einzigen AAV-Sequenzen, die in rekombinanten AAV-Vektoren (rAAV) beibehalten werden. In diesem System werden die für die Vektorproduktion notwendigen Gene getrennt in trans zugeführt, so dass das interessierende Gen in das virale Kapsid 5,6 verpackt werden kann.
Jedes virale Gen kodiert unterschiedliche Proteine durch alternatives Spleißen und Startcodons. Im Rep ORF sind vier Nichtstrukturproteine (Rep40, Rep52, Rep68 und Rep78) kodiert, die eine entscheidende Rolle bei der Replikation, der ortsspezifischen Integration und der Verkapselung der viralen DNA spielen 7,8. Das Cap ORF dient als Template für die Expression von drei Strukturproteinen, die sich an ihrem N-Terminus voneinander unterscheiden (VP1, VP2 und VP3), die sich in einem Verhältnis von 1:1:10 zu einem 60-mer-viralen Kapsid zusammensetzen 4,9. Zusätzlich kodiert ein alternativer ORF, der im Cap-Gen mit einem unkonventionellen CUG-Startcodon eingebettet ist, für ein Assemblierungs-aktivierendes Protein (AAP). Es wurde gezeigt, dass dieses Kernprotein mit den neu synthetisierten Kapsidproteinen VP1-3 interagiert und die Kapsidassemblierung fördert10,11.
Unterschiede in der Aminosäuresequenz des Kapsids sind für die 11 natürlich vorkommenden AAV-Serotypen und über 100 Varianten verantwortlich, die aus menschlichen und nicht-menschlichen Primatengeweben isoliert wurden 7,12,13. Variationen in der Konformation strukturell variabler Regionen bestimmen die unterschiedlichen antigenen Eigenschaften und Rezeptorbindungsspezifitäten von Kapsiden aus verschiedenen Stämmen. Dies führt zu unterschiedlichen Gewebetropismen und Transduktionseffizienzen über verschiedene Säugetierorganehinweg 14.
Frühe Produktionsmethoden von rAAVs beruhten auf einer Adenovirus-Infektion zu Helferzwecken 15,16,17,18,19. Obwohl sie effizient und in der Regel einfach in großem Maßstab herzustellen ist, ergeben sich aus dieser Infektion mehrere Probleme. Selbst nach der Reinigung und einem hitzedenaturierenden Schritt zur Inaktivierung können adenovirale Partikel immer noch in AAV-Präparaten vorhanden sein, die ein unerwünschtes Sicherheitsproblem darstellen20. Darüber hinaus ist das Vorhandensein von denaturierten adenoviralen Proteinen für den klinischen Einsatz nicht akzeptabel. Andere Produktionsstrategien nutzen rekombinante Herpes-simplex-Virusstämme, die so konstruiert wurden, dass sie das Rep/Cap und das Transgen in die Zielzellen21 oder in das Baculovirus-Insekten-Zellsystem22 bringen. Obwohl diese Systeme Vorteile in Bezug auf Skalierbarkeit und GMP-Kompatibilität bieten, stehen sie immer noch vor ähnlichen Problemen.
Die dreifache Transfektionsmethode für die rAAV-Produktion wurde häufig eingesetzt, um diese Probleme leicht zu überwinden. Kurz gesagt, die rAAV-Assemblierung beruht auf der transienten Transfektion von Zellen mit drei Plasmiden, die für Folgendes kodieren: 1) die Transgen-Expressionskassette, die zwischen den ITRs aus dem Wildtyp-AAV2-Genom (pITR) gepackt ist; 2) die Rep/Cap-Sequenzen, die für die Replikation und Virionenassemblierung (pAAV-RC) erforderlich sind; und 3) die minimalen adenoviralen Proteine (E1A, E1B, E4 und E2A) zusammen mit den Adenovirusvirus-assoziierten RNAs, die für den Helfereffekt (pHelper) erforderlich sind6,20,23. Während Plasmidtransfektionsmethoden in präklinischen Studien Einfachheit und Flexibilität für die rAAV-Produktion bieten, haben diese Verfahren Einschränkungen in Bezug auf Skalierbarkeit und Reproduzierbarkeit, wenn sie auf die Produktion im großen Maßstab angewendet werden. Als alternativer Ansatz kann die rAAV-Produktion durch die Verwendung von AAV-Produzentenzelllinien (sowohl des adhärenten als auch des Suspensionswachstums) erreicht werden, die entweder AAV-Rep/Cap-Gene oder Rep/Cap in Kombination mit Vektorkonstrukten stabil exprimieren. In diesen Systemen werden die adenoviralen Helfergene durch Plasmidtransfektion eingebracht. Obwohl diese Strategie die Skalierbarkeit des Zellkulturprozesses verbessert, ist sie technisch komplex und zeitaufwändig 21,24,25.
In beiden Fällen werden die Produzentenzellen dann lysiert und einem oder mehreren Reinigungsschritten unterzogen. Gegenwärtig umfassen die Hauptmethoden zur Aufreinigung von rAAVs die Verwendung von Cäsiumchlorid (CsCl) oder Iodixanol mit ultrahoher Dichtegradientenzentrifugation, gefolgt von Chromatographietechniken26. Das ursprüngliche Reinigungsschema für die Virusfällung verwendete Ammoniumsulfat, gefolgt von zwei oder drei Runden Ultrazentrifugation durch einen CsCl-Gradienten. Zu den Hauptvorteilen dieses Verfahrens gehören die Möglichkeit, alle Serotypen zu reinigen, und die Möglichkeit, vollständige Partikel von leeren Kapsiden anhand ihrer unterschiedlichen Dichten physikalisch zu trennen. Diese Methode ist jedoch aufwendig, zeitaufwändig und nur begrenzt skalierbar, was oft zu einer schlechten Ausbeute und einer geringen Probenqualität führt 27,28,29,30. Darüber hinaus ist eine Dialyse gegen einen physiologischen Puffer aufgrund der toxischen Wirkungen, die CsCl auf Säugetiere ausüben kann, häufig vor In-vivo-Studien erforderlich.
Jodixanol wurde auch als alternatives isoosmotisches Gradientenmedium zur Aufreinigung von rAAV-Vektoren verwendet, mit Vorteilen gegenüber CsCl sowohl unter dem Gesichtspunkt der Sicherheit als auch der Vektorpotenz. Wie CsCl weist die Iodixanol-Methode jedoch einige Nachteile im Zusammenhang mit der Ladekapazität von Zellkulturlysat (und damit der Skalierbarkeit der rAAV-Reinigung) auf und bleibt eine zeitaufwändige und teure Methode30,31.
Um diese Einschränkungen zu überwinden, wandten sich die Forscher den Chromatographietechniken zu. In diesem Zusammenhang wurden mehrere Aufreinigungsansätze entwickelt, die entweder Affinitäts-, hydrophobe oder Ionenaustauschchromatographie-Methoden umfassen. Diese Verfahren beruhen auf den biochemischen Eigenschaften eines bestimmten Serotyps, einschließlich ihrer natürlichen Rezeptoren, oder den Ladungseigenschaften des Viruspartikels32. So eröffnete beispielsweise die Entdeckung, dass AAV2, AAV3, AAV6 und AAV13 bevorzugt an Heparansulfat-Proteoglykane (HSPG) binden, die Möglichkeit, das eng verwandte Heparin in der Affinitätschromatographie-Aufreinigung zu verwenden. Die Bindungsstellen an HSPG können sich jedoch zwischen den Serotypen unterscheiden und vermitteln die AAV-Bindung und die Infektion der Zielzellen auf unterschiedliche Weise 2,33,34,35,36. Auf der anderen Seite binden AAV1, AAV5 und AAV6 an N-verknüpfte Sialinsäure (SA), während AAV4 O-verknüpftes SA 2,14,34 verwendet. Dem gleichen Gedanken folgend wurde auch ein einstufiges Affinitätschromatographie-Protokoll für die Aufreinigung von rAAV5 entwickelt, das auf der Verwendung von Mucin basiert, einem Säugetierprotein, das stark mit SA37 angereichert ist. Wie bei heparinbasierten Techniken hängt auch diese Reinigung von dem spezifischen Serotyp ab, der erzeugt wird. Neben Heparin und Mucin wurden auch andere Liganden für die Affinitätschromatographie untersucht, wie z. B. der monoklonale A20-Antikörper und Kameliden-Einzeldomänen-Antikörper (AVB-Sepharose und POROS CaptureSelect)22,23,38,39,40,41. Weitere innovative Strategien zur Verbesserung der bisher bestehenden Aufreinigungsmethoden beinhalten die Einführung kleiner Modifikationen im rAAV-Kapsid, um spezifische Bindungsepitope zu präsentieren. Beispielsweise können Hexa-Histidin-markierte oder biotinylierte rAAVs mit Liganden gereinigt werden, die auf diese Epitope abzielen (Nickelnitrilotriacetinsäure bzw. Avidinharze)42,43,44.
In dem Bemühen, die gewünschten Eigenschaften von rAAVs zu erweitern, haben die Forscher die Virionen durch Mischen ihrer Kapside gekreuzt. Dies wird erreicht, indem das Kapsid-Gen von zwei verschiedenen AAV-Serotypen in äquimolaren oder unterschiedlichen Verhältnissen während der Produktion zugeführt wird, wodurch eine Kapsidstruktur entsteht, die aus einer Mischung von Kapsid-Untereinheiten verschiedener Serotypen 34,45,46,47,48,49,50 besteht. Frühere Studien liefern physikalische Beweise dafür, dass die Co-Expression von Kapsidproteinen aus AAV2 mit AAV1 (1:1-Verhältnis) und AAV2 mit AAV9 (1:1-Verhältnis) zur Erzeugung von Mosaik-rAAV1/2- bzw. rAAV2/9-Vektoren führt 45,46,48. Ein großer Vorteil der Erzeugung von Mosaik-rAAVs ist die Fähigkeit, vorteilhafte Merkmale aus verschiedenen AAV-Serotypen zu integrieren, was zu synergistischen Verbesserungen der Transgenexpression und des Tropismus führt, während andere Eigenschaften, die während der rAAV-Produktion nützlich sind, erhalten bleiben. Interessanterweise weisen bestimmte Mosaikvarianten sogar neuartige Eigenschaften auf, die sich von den beiden Elternviren unterscheiden 46,47,49. Durch die Ausnutzung der Heparin-Bindungsfähigkeit von AAV2 könnten Mosaik-rAAV-Vektoren möglicherweise erzeugt und gereinigt werden, indem AAV2 mit anderen natürlichen oder neuen AAV-Kapsiden gemischt wird, die durch gerichtete Evolution und/oder rationales Design erzeugt werden. Nichtsdestotrotz haben frühere Studien die Bedeutung der Kompatibilität von Kapsid-Untereinheiten beim Versuch hervorgehoben, Mosaikvektoren zusammenzusetzen. Zum Beispiel zeigten Rabinowitz und Kollegen, dass die Transkapsidation von AAV1, AAV2 und AAV3 zwar zu einer effizienten Co-Assemblierung von Mosaik-Kapsiden führte, das Cross-Dressing dieser Serotypen mit AAV4 jedoch die Bildung stabiler Virionen behinderte 34,45,47. Darüber hinaus zeigten AAV1, AAV2 und AAV3 eine geringe Verträglichkeit mit AAV5, da die Virustiter reduziert waren, wenn diese Kapside in unterschiedlichen Verhältnissen gemischt wurden. Interessanterweise zeigte Mosaik-rAAV2/5 eine verminderte Heparin-Bindungsfähigkeit, während die Mucin-Bindungsfähigkeit wie bei elterlichem AAV5 erhalten blieb. rAAV3/5 im Verhältnis 3:1 bewahrte jedoch die duale Bindung an Heparin und Mucin. Insgesamt könnte die Generierung neuer Mosaik-rAAVs mit verbesserter Transduktion, spezifischem Tropismus oder geringer Immunogenität stark von unserem Verständnis der Kapsidassemblierung und der Rezeptorinteraktionen profitieren, wobei spezifische Kombinationen noch einer gründlichen Untersuchung und Optimierung bedürfen.
In der vorliegenden Arbeit beschreiben wir ein Schritt-für-Schritt-Protokoll für die Herstellung und Aufreinigung von rAAVs unter Verwendung einer optimierten Heparin-Affinitätschromatographie-Methode. rAAVs werden durch transiente Transfektion hergestellt und mit einem schnellen Proteinflüssigkeitschromatographie-System (FPLC) gereinigt. Nach der Konzentration ausgewählter gereinigter Fraktionen werden die resultierenden Virusstämme in Bezug auf Titer, Reinheit, intrinsische physikalische Eigenschaften und biologische Aktivität in vitro und in vivo charakterisiert. Als Proof of Concept demonstrieren wir die Verbesserungen und die Anwendbarkeit dieses Protokolls für die Generierung von Mosaik-rAAV1/2- und rAAV2/9-Vektoren. Die Wahl der einzelnen Serotypen basierte auf ihren auffallend unterschiedlichen Tropismen, die ihre einzigartigen Eigenschaften möglicherweise auch den Mosaikversionen verliehen. Der AAV-Serotyp 1 mit einem insgesamt moderaten Tropismus für das Zentralnervensystem (ZNS) hat die Fähigkeit, Neuronen und Gliazellen (in geringerem Maße) zu transduzieren und durchläuft in vivo einen axonalen Transport in anterograder und retrograder Richtung 2,7,8. Darüber hinaus wurde der AAV-Serotyp 9 aufgrund seiner natürlichen Fähigkeit ausgewählt, die Blut-Hirn-Schranke zu überwinden und das ZNS sowohl bei neonatalen als auch bei adulten Mäusen zu bekämpfen51,52. Schließlich wurde der AAV-Serotyp 2 ausgewählt, da er an Heparin binden kann, was eine Affinitätschromatographie ermöglicht33. Die gereinigten rAAV1/2- und rAAV2/9-Partikel vereinen die Eigenschaften beider elterlicher AAV-Serotypen und stellen daher geeignete Vektoren für die Transduktion des ZNSdar 45,46,48,49.
Protokoll
HINWEIS: In Abbildung 1 finden Sie eine Abbildung, die das Protokoll zusammenfasst. In der Materialtabelle finden Sie Einzelheiten zu allen Materialien, Instrumenten und Reagenzien, die in diesem Protokoll verwendet werden. Alle Arbeiten, die mit Zellen und Viren zu tun haben, sollten in speziellen Biosicherheitswerkbänken und Inkubatoren durchgeführt werden, die von denen getrennt sind, die regelmäßig für die Erhaltung von Zelllinien verwendet werden. Die Geräte und Reagenzien, die mit kultivierten Zellen und Viren in Kontakt kommen, sollten steril sein. Es ist von wesentlicher Bedeutung, dass die Entsorgung von gefährlichen Reagenzien und mit Viren kontaminierten Materialien in Übereinstimmung mit den Sicherheitsdatenblättern und in Übereinstimmung mit den nationalen Gesetzen und Richtlinien erfolgt, die von den Umwelt-, Gesundheits- und Sicherheitsbüros der einzelnen Institutionen bereitgestellt werden. Seit April 2019 kategorisieren die NIH-Richtlinien für die Forschung mit rekombinanten oder synthetischen Nukleinsäuremolekülen alle AAV-Serotypen sowie rekombinante oder synthetische AAV-Konstrukte als Wirkstoffe der Risikogruppe 1 (die bei gesunden erwachsenen Menschen nicht mit einer Erkrankung in Verbindung gebracht werden). Diese Einteilung ist der Fall, wenn das Transgen nicht für ein potenziell tumorigenes Genprodukt oder ein Toxin kodiert und die Konstrukte ohne ein Helfervirus hergestellt werden.
Alle Tierversuche wurden in Übereinstimmung mit der Richtlinie der Europäischen Union (2010/63/EU) über die Pflege und Verwendung von Labortieren durchgeführt, die 2013 in portugiesisches Recht umgesetzt wurde (Gesetzesdekret 113/2013). Darüber hinaus wurden die Tierversuche von der Responsible Organization for the Animal Welfare der Medizinischen Fakultät und dem Zentrum für Neurowissenschaften und Zellbiologie der Universität Coimbra genehmigt. Die Forscher erhielten eine angemessene Ausbildung (FELASA-zertifizierter Kurs) und eine Zertifizierung durch die portugiesischen Behörden (Direcção Geral de Alimentação e Veterinária, Lissabon, Portugal), um die Experimente durchzuführen.
1. Plasmid-Konstrukte
- Befolgen Sie die Anweisungen des Herstellers für ein endotoxinfreies Maxiprep-Kit, um erhebliche DNA-Mengen der folgenden Plasmide zu isolieren und zu reinigen: i) pITR: der interessierende Transfervektor; ii) pAAV-RC-Plasmid: pRV1, enthaltend die AAV2 Rep- und Cap-Sequenzen 36; iii) pAAV-RC-Plasmid: pH21, enthält die AAV1 Rep- und Cap-Sequenzen 36; iv) pAAV-RC-Plasmid: pAAV2/9n, bestehend aus den Sequenzen AAV2 Rep und AAV9 Cap; v) pHelper: pFdelta6, Adenovirus-Helfer-Plasmid36.
- Die Integrität der erzeugten Plasmide wird durch Durchführung der empfohlenen enzymatischen Restriktionen36 überprüft. Die Integrität von pITR-Plasmiden wird durch Aufschluss mit SmaI überwacht, einer Restriktionsendonukleasorte, die in einem instabilen Teil der ITRs zweimal schneidet53,54.
HINWEIS: Da die ITRs sehr instabil und anfällig für Deletionen sind, wird die Verwendung von SURE 2 superkompetenten Zellen empfohlen, um die Rekombination an diesen Stellen zu minimieren.
2. Zellkultur
- Eine humane embryonale Niere 293, die die SV40-Zelllinie des großen T-Antigens (HEK293T) stabil exprimiert, wird in Dulbecco's Modified Eagle Medium (DMEM) hoher Glukose, ergänzt mit 10 % fötalem Rinderserum und 1 % Penicillin-Streptomycin, bei 37 °C unter einer befeuchteten Atmosphäre, die 5 % CO2 enthält, als Ausgangspunkt für die nachfolgenden Schritte kultiviert.
- Subkultur der Zellen mit steriler 1x phosphatgepufferter Kochsalzlösung (PBS), pH 7,4, um die Zellen zu waschen, bevor 0,05% Trypsin-Ethylendiamintetraessigsäure (EDTA) hinzugefügt werden.
HINWEIS: Vermeiden Sie die Verwendung von Zellen, die eine übermäßige Anzahl von Passagen (maximal 20) durchlaufen haben. Testen Sie regelmäßig Zellkulturen auf Mykoplasmenkontamination.
3. rAAV-Produktion durch transiente Transfektion
- Tag 1: Zellbeschichtung
- Für jede Virusproduktion HEK293T Zellen am Tag vor der Transfektion in 10 behandelte Kulturschalen (15 cm Durchmesser) mit einer Dichte von 10,5 × 10 10Zellen pro Schale in 22 ml supplementiertes Kulturmedium geben und 24 Stunden lang inkubieren, bis die Zellen zu 70 % bis 80 % konfluent und bereit für die Transfektion sind.
- Tag 2: Zelltransfektion mit Polyethylenimin (PEI)
- Für jede Virusproduktion (entspricht 10,5 Schalen) wird die folgende Transfektionsmischung in ein Mikrozentrifugenröhrchen gegeben: 54,6 μg pITR; 45,675 μg pRV1; 45,675 μg pH21 oder pAAV2/9n; 109,2 μg pFdelta6. Mischen durch Klopfen.
- Geben Sie die Mischung zu 4,557 mL nicht supplementiertem DMEM in einem 50 mL Zentrifugenröhrchen. Mischen durch Klopfen.
- 1,365 ml sterile PEI-Lösung mit 1 mg/ml (pH 7,4) tropfenweise hinzufügen. Mischen durch Klopfen. 10 Minuten bei Raumtemperatur inkubieren, um die Bildung von DNA-PEI-Komplexen zu ermöglichen.
- Fügen Sie diese Mischung zu 231 mL vorgewärmtem supplementiertem DMEM hinzu. Ersetzen Sie das gesamte Nährmedium jeder Schale durch 22 mL dieser Transfektionsmischung. Inkubieren Sie die Zellen für 48 Stunden.
HINWEIS: Dieser Schritt muss mit Vorsicht durchgeführt werden, um eine Zellablösung zu vermeiden.
- Tag 4: Zellernte
- Wenn das pITR einen Fluoreszenzreporter kodiert, visualisieren Sie die transfizierten Zellen unter einem Fluoreszenzmikroskop.
- Sammeln Sie das Medium aus jeder Schale in 50 mL Zentrifugenröhrchen und zentrifugieren Sie diese bei 800 × g für 10 min. Entsorgen Sie den Überstand.
HINWEIS: Dieser Schritt ist optional und zielt darauf ab, transfizierte Zellen zu gewinnen, die sich aufgrund einer sehr hohen Konfluenz abgelöst haben könnten. - Geben Sie 10 ml vorgewärmtes PBS auf jede Platte. Entfernen Sie die Zellen vorsichtig mit einem Zellschaber und sammeln Sie die Suspension in den 50 mL Zentrifugenröhrchen aus Schritt 3.3.2.
- Waschen Sie jeweils 5 Geschirr mit zusätzlichen 10 mL PBS und geben Sie die Suspension in die 50 mL Zentrifugenröhrchen aus Schritt 3.3.3. Die Zellen werden 10 Minuten lang bei 800 × g pelletiert und der Überstand wird entsorgt.
- Frieren Sie die Zellpellets bei -80 °C ein.
HINWEIS: Zellpellets können mehrere Monate gelagert werden (Pausenpunkt).
4. rAAV-Extraktion und FPLC-Reinigung
- Tag 5: Vorbereitung des Zelllysats
- Tauen Sie die Zellpellets bei Raumtemperatur auf. Resuspendieren Sie die aus den 10 Schalen entnommenen Zellen in 100 mL eines sterilen Puffers, der 150 mM Natriumchlorid (NaCl) und 20 mM Tris, pH 8,0, in ultrareinem Wasser (Typ I) enthält. Mischen Sie die Suspension durch Auf- und Abpipettieren, um eine homogene Suspension zu gewährleisten.
- 12,5 ml einer frisch zubereiteten sterilen Lösung von 10 % Natriumdesoxycholat in Reinstwasser geben, um die Zelllyse zu induzieren. Mischen Sie, indem Sie auf und ab pipettieren.
HINWEIS: Entsorgen Sie Natriumdesoxycholat sowie die Materialien, die damit in Berührung kommen, gemäß dem Sicherheitsdatenblatt und den Richtlinien des Umwelt-, Gesundheits- und Sicherheitsbüros der Einrichtung. Es wird auch empfohlen, beim Umgang mit diesem Pulver eine Gesichtsmaske zu tragen. Nach dem Mischen wird die Lösung hochviskos. - Fügen Sie der vorherigen Mischung 27 μl Benzonase-Nuklease hinzu. Gründlich mischen, indem Sie auf und ab pipettieren, bis die Probe nicht mehr viskos ist. Inkubieren Sie 1 h lang bei 37 °C und führen Sie alle 10 Minuten einen Wirbel durch.
HINWEIS: Diese Endonuklease ist in der Lage, alle Formen von DNA und RNA effizient abzubauen, ohne eine proteolytische Aktivität zu zeigen. - Entfernen Sie Zellreste, indem Sie das Gemisch 60 Minuten lang bei 3.000 × g bei 25 °C zentrifugieren. Filtrieren Sie den Überstand mit einem 0,45 μm sterilen Spritzenvorsatzfilter aus Polyvinylidendifluorid (PVDF) und füllen Sie ihn in einen neuen sterilen Behälter um.
HINWEIS: Dieser wichtige Schritt stellt sicher, dass der größte Teil der zellulären Trümmer entfernt wird, wodurch das Verstopfen der Chromatographiesäulen verhindert wird. Speichern Sie ein kleines Aliquot dieser Mischung für die Analyse (optionaler Schritt).
- Tag 5 (Fortsetzung): Aufreinigung von rAAVs mit Heparin-Säule
HINWEIS: Die Probenapplikation kann mit einer Probenpumpe oder einem 50 mL oder 150 mL Superloop als Teil des Systems durchgeführt werden. Da bei niedrigeren Temperaturen mehr Luft gelöst wird, ist es wichtig, den Puffern und Lösungen (die in der Regel bei 4 °C gelagert werden) ausreichend Zeit zu geben, sich an Raumtemperatur zu gewöhnen, bevor sie im FPLC-System verwendet werden.- Optional: Wenn das System über einen längeren Zeitraum gelagert wurde, füllen Sie das System und alle Einläufe mit frisch zubereiteter Lagerlösung (20 % Ethanol) nach manuellen Anweisungen oder einer vordefinierten System-Cleaning-in-Place-Methode (System CIP).
- Waschen Sie den Flüssigkeitsströmungsweg vollständig mit sterilem Reinstwasser unter Verwendung manueller Anweisungen oder einer vordefinierten CIP-Methode des Systems.
- Schließen Sie eine vorgepackte 1-ml-Heparinsäule an, stellen Sie den Druckalarm ein und waschen Sie mit fünf Säulenvolumina (CVs) Reinstwasser bei einer Durchflussrate von 1 mL/min.
- Schalten Sie die Lösungen in der Pufferschale von Reinstwasser auf Puffer A (sterile Lösung von 100 mM NaCl und 20 mM Tris, pH 8, in Reinstwasser) für Einlass A (Systempumpe A) und auf Puffer B (sterile Lösung von 500 mM NaCl und 20 mM Tris, pH 8, in Reinstwasser) für Einlass B (Systempumpe B) um. Wenn das System über eine Probenpumpe verfügt, platzieren Sie den Puffereinlass des Probeneinlassventils in Puffer A.
- Waschen Sie die Systempumpe B mit Puffer B und füllen Sie den restlichen Flüssigkeitsströmungsweg mit Puffer A.
HINWEIS: Trennen Sie die Säule bei Bedarf vom Strömungsweg und schließen Sie sie anschließend wieder an. - Ein Probeneinlassschlauch aus dem Probeneinlassventil, z. B. S1, wird in den Behälter mit dem in Schritt 4.1.4 erhaltenen Viruspräparat eingeführt. (aus der Zelllysatpräparation). Den Strömungsweg vom Probeneinlass S1 zum Injektionsventil mit der Probenlösung anfüllen. Alternativ können Sie einen 50 mL oder 150 mL Superloop mit einer 50 mL Spritze mit der Probe befüllen, die rAAVs enthält.
- Die Säule wird mit einem Gesamtvolumen von fünf CVs unter Verwendung von 12,5 % Puffer B bei einer Geschwindigkeit von 1 ml/min äquilibriert.
- Geben Sie das Gesamtvolumen der Probe mit der Probenpumpe (wählen Sie die Option "Alle Probe mit Luftsensor injizieren") oder dem Superloop mit 0,5 mL/min in die Säule und sammeln Sie den Durchfluss über die Auslassöffnung in einem neuen sterilen Behälter.
HINWEIS: Wenn die Durchflussregelung zur Vermeidung von Überdruck aktiviert ist, verringert sich der Durchfluss automatisch, wenn die Säule verstopft. Wenn die Flussrate deutlich unter 0,5 ml/min fällt, stoppen Sie die Probenapplikation, führen Sie eine Wäsche mit 2-5 CVs Puffer A durch und setzen Sie dann die Probenapplikation fort. - Waschen Sie die Säule bei 1 ml/min mit 20 CVs Puffer A und sammeln Sie den Durchfluss über den Auslassanschluss.
- Eluieren Sie die Probe bei 1 ml/min nach folgendem Schema: i) linearer Gradient mit einem Ziel von 50 % des Puffers B für fünf CVs; ii) Schritt mit einem Ziel von 90 % des Puffers B während fünf CVs; iii) Schritt mit einem Ziel von 100 % des Puffers B während fünf CVs.
- Sammeln Sie die eluierte Probe in 1-ml-Fraktionen mit einem Fraktionssammler und Mikrozentrifugenröhrchen mit geringer Retention (2 mL) und lagern Sie sie bei -20 °C.
HINWEIS: Die rAAV-Fraktionen können mehrere Wochen gelagert werden (Pausenpunkt). - Die Säule wird bei 1 ml/min mit 12,5 % des Puffers B für fünf CVs wieder ausgeglichen.
- Schalten Sie die Einlässe von den Pufferlösungen auf Reinstwasser um und waschen Sie die Säule mit 1 mL/min für fünf CVs.
- Schalten Sie die Einlässe von Reinstwasser auf 20 % Ethanol um und waschen Sie die Säule bei 1 ml/min für fünf CVs. Trennen Sie die Säule und lagern Sie sie bei 4 °C.
HINWEIS: Säulen können ohne weitere größere Reinigungs- und Desinfektionsverfahren mehrmals wiederverwendet werden, wenn derselbe rAAV-Serotyp und dasselbe Transgen verwendet werden. - Waschen Sie den Flüssigkeitsströmungsweg vollständig mit 20 % Ethanol unter Verwendung manueller Anweisungen oder einer vordefinierten CIP-Methode des Systems.
5. Konzentration der gereinigten rAAV
- Tag 6: Konzentrationsschritt 1
- Konzentrieren Sie rAAVs unter Verwendung einer 15-ml-Zentrifugalfiltereinheit mit einem Molekulargewichts-Cutoff von 100 kDa. Laden Sie die gewünschten Fraktionen, die rAAVs enthalten (FPLC-Fraktionen 7 bis 16), in die 15 mL Zentrifugalfiltereinheit und zentrifugieren Sie diese bei 2.000 × g für 2 min bei Raumtemperatur. Stellen Sie sicher, dass das konzentrierte Volumen in der Filtereinheit ca. 500 μl beträgt. Wenn das konzentrierte Volumen 500 μl stark übersteigt, wiederholen Sie die Zentrifugationsschritte in 1-Minuten-Intervallen, bis das gewünschte Volumen erreicht ist.
- Tag 6 (Fortsetzung): Austausch von Puffern
- Geben Sie 1 ml steriles PBS in die Zentrifugalfiltereinheit, die die rAAVs enthält. Pipettieren Sie vorsichtig auf und ab, um den Filter zu waschen. Zentrifugieren Sie bei 2.000 × g in 1-min-Intervallen, bis das endgültige Volumen von 500 μl erreicht ist.
- Tag 6 (Fortsetzung): Konzentrationsschritt 2
- Die im vorherigen Schritt erhaltenen 500 μl konzentrierter rAAVs werden in eine 0,5-ml-Zentrifugalfiltereinheit mit einem Molekulargewichts-Cutoff von 100 kDa überführt und 1 min lang bei 6.000 × g zentrifugiert. Wiederholen Sie gegebenenfalls den Zentrifugationsschritt, bis ein Endvolumen von weniger als 100 μl erreicht ist.
- Tag 6 (Fortsetzung): Erholung
- Um das konzentrierte rAAV zurückzugewinnen, stellen Sie das Filtergerät kopfüber in ein neues Mikrozentrifugen-Sammelröhrchen. Legen Sie das Röhrchen mit der Kappe zur Mitte hin in eine Mikrozentrifuge und drehen Sie es länger in der Durchflusskammer, um konzentrierte rAAVs vom Gerät auf das Mikrozentrifugenröhrchen zu übertragen. Alternativ bei 1.000 × g für 2 min zentrifugieren.
- Ergänzen Sie mit sterilem Pluronic F-68 0,001% (optional).
HINWEIS: Pluronic F-68 ist ein nichtionisches Tensid, das von der Food and Drug Administration für den menschlichen Gebrauch zugelassen ist und in der Lage ist, die Verluste von rAAVs zu mildern, indem es ihre Wechselwirkungen mit den Oberflächen von Materialien (Kunststoffen) verhindert, die während der Verdünnungsvorbereitung, der Spritzenbeladung und der Verabreichungsausrüstung verwendet werden55,56. - Aliquot rAAVs in Mikrozentrifugenröhrchen mit geringer Retention und Lagerung bei -80 °C (Pausenpunkt).
6. Quantifizierung von gereinigten rAAVs
- Tag 6 (Fortsetzung): Bestimmung des Titers von rAAV-Präparaten, exprimiert in viralen Genomen/μl (vg/μL), durch quantitative Polymerase-Kettenreaktion in Echtzeit (RT-qPCR) unter Verwendung eines kommerziellen Kits und gemäß den Anweisungen des Herstellers.
- Die rAAV-Partikellösung mit DNase I bei 37 °C für 20 min inkubieren.
HINWEIS: Dieses Verfahren fördert die Verdauung von freier genomischer DNA und Plasmid-DNA, die aus Wirtszellen stammen, und stellt so sicher, dass nur die Nukleinsäuresequenz in intakten rAAV-Partikeln erhalten bleibt. - DNase I bei 95 °C für 10 min hitzeinaktivieren.
- Lysis Buffer zugeben und 10 min bei 70 °C inkubieren, um die Hitzedenaturierung der Proteine von rAAV-Partikeln zu fördern.
- Verdünnen Sie die erhaltene rAAV-Genomlösung in einem Verdünnungspuffer, bevor Sie mit der RT-qPCR fortfahren. Bereiten Sie einen Satz seriell verdünnter Standards der Positivkontrolle (von 2 × 107 vg/μl bis 2 × 102 vg/μl) vor, die mit dem Kit geliefert werden.
- Es wird ein Reaktionsgemisch durchgeführt, das 12,5 μl Taq II-Mix, 0,5 μl verdünnte Primer-Mix, 7 μl Wasser und 5 μl verdünnte rAAV-DNA enthält (unbekannte AAV-Probe und Standards aus Schritt 6.1.4.).
- Führen Sie die RT-qPCR in einem Echtzeit-PCR-Nachweissystem unter Verwendung des folgenden Protokolls durch: 1 Zyklus bei 95 °C für 2 Minuten (Erstdenaturierung) und 40 Zyklen bei 95 °C für 5 s (Denaturierung) und 60 °C für 30 s (Glühen, Dehnen und Plattenlesen), gefolgt von einer Schmelzkurvenanalyse.
- Berechnen Sie die absolute Probenkonzentration aus der Standardkurve (lineare Regressionslinie) unter Berücksichtigung des Verdünnungsfaktors, der sich aus der rAAV-Probenvorbereitung ergibt.
HINWEIS: Die Quantifizierung der Anzahl der viralen Genome erfolgt durch die Amplifikation der ITR-Sequenz von AAV2 (Zielsequenz der im Kit enthaltenen Primer).
- Die rAAV-Partikellösung mit DNase I bei 37 °C für 20 min inkubieren.
7. SDS-PAGE, Coomassie-Blaufärbung und Western Blot
- Denaturieren Sie 40 μl jeder Probe (jede FPLC-Fraktion, den Durchfluss, die Vorsäulenproben und insgesamt 2,3 × 1010 vg des konzentrierten Endprodukts) durch Zugabe von 6x Probenpuffer (0,5 M Tris-HCl/0,4 % Natriumdodecylsulfat (SDS) pH 6,8, 30 % Glycerin, 10 % SDS, 0,6 M Dithiothreitol (DTT), 0,012 % Bromphenolblau) und Inkubieren der Proben für 5 Minuten bei 95 °C.
- Laden Sie die denaturierten Proben (48 μl) in ein SDS-Polyacrylamid-Gel (4 % Stapel- und 10 % Auflösungsgel) und führen Sie die elektrophoretische Trennung bei 100 V für 70 Minuten neben einer Proteinleiter durch.
- Proteinanalytik
HINWEIS: Es kann entweder eine Coomassie-Blaufärbung oder ein Western-Blotting durchgeführt werden.- Coomassie-Blau-Färbung
- Um Proteinbanden sichtbar zu machen, färben Sie das Gel 10 Minuten lang mit einer 0,25%igen Coomassie-blauen G250-Lösung, die in 50 % Methanol und 10 % Essigsäure Glacial gelöst ist.
- Führen Sie die Gelentfärbung durch, indem Sie es mehrmals mit einer Lösung waschen, die 25 % Methanol und 5 % Essigsäure Eiszeit enthält, bis klare Streifen mit niedrigem Hintergrund sichtbar werden.
- Erfassen Sie Bilder mit einem geeigneten Bildgebungssystem.
- Western-Blot
- Übertragen Sie die Proteine gemäß den Standardprotokollen auf eine PVDF-Membran.
- Blockieren Sie die Membran durch Inkubation in 5 % fettfreier Milch, verdünnt in TBS-T (0,1 % Tween 20 in Tris-gepufferter Kochsalzlösung) für 1 h bei Raumtemperatur.
- Für die Inkubation über Nacht bei 4 °C sind die folgenden Primärantikörper (in Blockierungslösung verdünnt) zu verwenden: monoklonaler Maus-Anti-AAV-Antikörper VP1, VP2, VP3 (B1, 1:1.000) oder monoklonaler Maus-Anti-AAV-Antikörper VP1, VP2 (A69, 1:1.000).
- Die Membranen 3 x 15 min in TBS-T waschen und mit einem alkalischen Phosphatase-gekoppelten Ziegen-Anti-Maus-Sekundärantikörper (1:10.000) 2 h bei Raumtemperatur inkubieren.
- Waschen Sie die Membranen 3 x 15 min in TBS-T. Fügen Sie ein verbessertes Chemifluoreszenzsubstrat (ECF) hinzu und visualisieren Sie Proteinbanden durch Chemifluoreszenzbildgebung.
- Coomassie-Blau-Färbung
8. Transmissionselektronenmikroskopie (TEM)
- Legen Sie ein mit Formvar-Kohlenstoff beschichtetes 200-Mesh-Gitter kopfüber auf einen Tropfen einer rAAV-Probe und lassen Sie es 1 Minute lang absetzen.
- Waschen Sie die Gitter in einem Tropfen Wasser und trocknen Sie den Flüssigkeitsüberschuss mit Filterpapier ab.
- Färben Sie die Gitter 1 Minute lang negativ mit 1%iger Uranylacetatlösung (pH 7), um die Viruspartikel zu fixieren und zu kontrastieren.
- Waschen Sie die Gitter in einem Tropfen Wasser und trocknen Sie den Flüssigkeitsüberschuss mit Filterpapier ab.
- Untersuchen Sie die Proben in einem Transmissionselektronenmikroskop.
HINWEIS: Hohe Salzkonzentrationen können sich direkt auf die Bindung von rAAVs an das Gitter auswirken und zur Visualisierung kristallartiger Strukturen führen.
9. Konsekutive Absorption von ultraviolettem und sichtbarem Licht, statische Lichtstreuung und dynamische Lichtstreuanalyse
- Laden Sie auf eine 96-Well-Quantifizierungsplatte 2 μl einer rAAV-Probe und 2 μl PBS, um sie als Pufferrohling zu verwenden (führen Sie dies in Duplikaten durch).
- Verwenden Sie die AAV Quant-Anwendung in der Client-Analysesoftware, platzieren Sie die Namen der Proben an der richtigen Stelle der Platte, wählen Sie den AAV-Serotyp aus und klicken Sie auf Weiter.
- Legen Sie die 96-Well-Quantifizierungsplatte in das spezielle Gerät ein und fahren Sie mit der Plattenablesung für die Datenerfassung fort.
10. In-vitro-Transduktionsassays
- Verschiedene Zelllinien können verwendet werden, um die Transduktionseffizienz von rAAVs schnell zu analysieren.
- Gleichmäßige Aussaat HEK293T Zellen in 24-Well-Platten (bei einer Dichte von 137.500 Zellen/Well) und eine Maus-Neuroblastom-2A (Neuro2a)-Zelllinie entweder in 24-Well-Platten (50.000 Zellen/Well) oder in einem 8-Well-Kammerobjektträger (27.000 Zellen/Well) unter Verwendung von DMEM mit hohem Glukosegehalt, ergänzt mit 10 % fötalem Rinderserum und 1 % Penicillin-Streptomycin, wie oben beschrieben. Lassen Sie die Zellen über Nacht bei 37 °C in einer befeuchteten Atmosphäre mit 5 % CO2 anhaften.
- Sammeln Sie konditioniertes Medium aus jeder Vertiefung (250 μl von 24-Well-Platten und 50 μl von der 8-Well-Kammer) und lagern Sie es bei 4 °C für die spätere Verwendung.
- Geben Sie die folgenden rAAV-Präparate in jede Vertiefung und inkubieren Sie die Zellen 24 Stunden lang bei 37 °C in einer 5 % CO2 -Atmosphäre.
- 50 μl der FPLC-gesammelten Fraktionen F2-F16 zugeben und in HEK293T Zellen durchfließen, die in 24-Well-Platten plattiert sind.
- Geben Sie insgesamt 5,5 × 109 vg der konzentrierten rAAVs, verdünnt in 50 μl PBS, zu Neuro2a-Zellen, die in 24-Well-Platten plattiert sind, (fügen Sie eine Negativkontrollvertiefung hinzu, indem Sie den Zellen 50 μl PBS zusetzen).
- Geben Sie insgesamt 2,75 × 109 vg der konzentrierten rAAVs, verdünnt in 25 μl PBS, zu Neuro2a-Zellen, die in einem 8-Well-Kammerobjektträger plattiert sind (schließen Sie die negative Kontrollbedingung ein, indem Sie den Zellen 50 μl PBS zusetzen).
- Das zuvor gelagerte konditionierte Medium (Schritt 10.1.2) wird in jede Vertiefung gegeben und 24 Stunden lang inkubiert.
- Entsorgen Sie das Medium und waschen Sie die Zellen 2x mit PBS.
- Eine 4%ige Paraformaldehyd (PFA)-Lösung, ergänzt mit 4% Saccharose in PBS, vorgewärmt auf 37 °C, in jede Vertiefung geben und 20 Minuten bei Raumtemperatur inkubieren.
- 2x mit PBS waschen und bei 4 °C lagern, bis die Bildgebung durchgeführt wird (Pausenpunkt).
- Erfassen Sie Bilder mit einem inversen Fluoreszenzmikroskop, das mit einem 10x/0,30-Objektiv ausgestattet ist, oder einem inversen konfokalen Mikroskop, das mit einem 40x/1,4 Öl-DIC-Objektiv ausgestattet ist.
- Um ein relevanteres und reflektierenderes Modell der In-vivo-Umgebung zu erhalten, verwenden Sie primäre neuronale Kulturen wie folgt:
- Bereiten Sie Primärkulturen von kortikalen Neuronen vor, wie zuvor von Santos et al. beschrieben.57. Kurz gesagt, 200.000 Zellen/ml in 12-Well-Platten aussäen und bis zum Tag in vitro in Kultur aufbewahren 16.
- Sammeln Sie konditioniertes Medium aus jeder Vertiefung (100 μl) und lagern Sie es bei 4 °C für die spätere Verwendung.
- In jede Vertiefung werden die zu testenden rAAV gegeben: insgesamt 2,75 × 109 vg der konzentrierten rAAVs, verdünnt in 25 μl PBS (einschließlich der Negativkontrolle: 25 μl PBS). 24 h bei 37 °C in einer Atmosphäre mit 5 % CO2 inkubieren.
- Fügen Sie das zuvor gelagerte konditionierte Medium hinzu und inkubieren Sie es 24 Stunden lang.
- Entsorgen Sie das Medium in jeder Vertiefung und waschen Sie es 2x mit PBS.
- Fixieren Sie die Zellen mit 4 % PFA/4 % Saccharose in PBS, wie in Schritt 10.1.6 beschrieben. 2x mit PBS waschen.
- Inkubieren Sie jede Vertiefung 10 Minuten lang bei Raumtemperatur mit 5 μg/ml Weizenkeimaggglutinin (WGA), konjugiert mit Alexa Fluor 633 (optionaler Schritt: stattdessen Immunzytochemie durchführen). 2x mit PBS waschen.
- In 0,25% Triton X-100 in PBS 5 min bei Raumtemperatur inkubieren. Mit PBS waschen.
- Inkubieren Sie mit 4',6-Diamidino-2-phenylindol (DAPI) für 5 min bei Raumtemperatur. 2x mit PBS waschen.
- Erfassen Sie Bilder mit einem inversen Fluoreszenzmikroskop, das mit einem 40x/0,95-Objektiv ausgestattet ist, oder einem inversen konfokalen Mikroskop, das mit einem 40x/1,4 Öl-DIC-Objektiv ausgestattet ist.
11. In-vivo-Experimente
HINWEIS: Die Tiere wurden in einem klimatisierten Raum untergebracht, der in einem 12-stündigen Hell-Dunkel-Zyklus gehalten wurde. Nahrung und Wasser wurden ad libitum zur Verfügung gestellt. Es wurden alle Anstrengungen unternommen, um das Leid der Tiere so gering wie möglich zu halten.
- Stereotaktische Injektion in das Kleinhirn
- Betäubung von 9 Wochen alten C57BL/6-Tieren durch Inhalation von 2 % Isofluran in Gegenwart von Sauerstoff (0,8 l/min) in einer Kammer, die mit einem Verdampfer verbunden ist.
- Legen Sie das anästhesierte Tier in den stereotaktischen Apparat (auf ein 35 °C erwärmtes Pad) und setzen Sie die Isofluranmaske in die Nase des Tieres ein. Senken Sie den Isofluranspiegel auf 1,3-1,7%.
HINWEIS: Vergewissern Sie sich, dass das Tier korrekt betäubt ist, bevor Sie fortfahren (Verlust des Beugereflexes in beiden Hintergliedmaßen). - Tragen Sie eine Gleitaugensalbe auf, um ein Austrocknen der Hornhaut zu vermeiden, und injizieren Sie dem Tier ein zugelassenes Analgetikum.
HINWEIS: Alle nachfolgenden Schritte müssen unter sterilen Bedingungen durchgeführt werden. - Nach der Rasur des Kopffells des Tieres und der Desinfektion des Operationsbereichs legen Sie den Schädel frei und platzieren Sie die Spitze einer 30-G-Injektionsnadel mit stumpfer Spitze, die mit einer 10-μl-Hamilton-Spritze verbunden ist, direkt über Bregma (verwenden Sie Bregma als Null für die Berechnung der stereotaktischen Koordinaten).
- Bewegen Sie die Nadel auf die vorgesehene Koordinate und bohren Sie ein Loch durch den Schädel, in das die Nadel eintritt.
HINWEIS: Im Rahmen dieser Studie wurde eine einzelne Injektion zentral im Kleinhirn durchgeführt. - Injizieren Sie 4 μl einer rAAV-Lösung, die insgesamt 8 × 109 vg, verdünnt in PBS, mit einer Infusionsrate von 0,5 μl/min unter Verwendung eines automatischen Injektors. Verwenden Sie die folgenden, aus Bregma berechneten Koordinaten, um eine einzelne Injektion zentral in das Kleinhirn einer erwachsenen C57BL/6-Maus durchzuführen: antero-posterior: -6,5 mm; seitlich: 0 mm; Bauch: -2,9 mm.
HINWEIS: Diese Koordinaten können je nach Mausstamm, Geschlecht und Alter der verwendeten Tiere variieren. - Um den Rückfluss zu minimieren und die Diffusion des viralen Vektors zu ermöglichen, belassen Sie die Spritzennadel nach Abschluss der Infusion 3 Minuten lang an diesen Koordinaten, ziehen Sie sie dann langsam um 0,3 mm zurück und lassen Sie sie weitere 2 Minuten an Ort und Stelle bleiben, bevor sie vollständig aus dem Gehirn der Maus entfernt wird.
- Schließen Sie den Schnitt und reinigen Sie ihn mit einem Desinfektionsmittel (z. B. 10% Povidon-Jod).
- Lassen Sie die Tiere sich von der Narkose erholen, bevor Sie sie in ihre Käfige zurückbringen.
- Gewebeentnahme und -aufbereitung
HINWEIS: In diesem Experiment wurden die Transduktionsniveaus 12 Wochen nach der Injektion beobachtet, aber das gleiche Verfahren konnte bereits 4 Wochen nach der Injektion evaluiert werden.- Betäubung der Tiere durch intraperitoneale Verabreichung einer Überdosis Xylazin/Ketamin (8/160 mg/kg Körpergewicht).
- Die Tiere werden transkardial für 6 min mit eiskaltem PBS mit einer Geschwindigkeit von 2,5 mL/min perfundiert, gefolgt von der Perfusion mit einer frisch zubereiteten eiskalten 4%igen PFA-Lösung für 10 min mit der gleichen Rate.
- Das herausgeschnittene Gehirn wird über Nacht bei Raumtemperatur in 4 % PFA fixiert und dann zur Kryoprotektion in eine 25 %ige Saccharose/PBS-Lösung überführt. Sobald das Gehirn absinkt (ca. 48 h später), lagern Sie es bei -80 °C.
- Schneiden Sie serielle sagittale Schnitte mit einer Dicke von 30 μm mit einem Kryostaten bei -21 °C. Sammeln Sie für jedes Tier 96 sagittale Schnitte einer Gehirnhalbkugel in anatomischen Reihen als frei schwebende Schnitte in PBS, ergänzt mit 0,05 % Natriumazid. Bis zur weiteren Verarbeitung bei 4 °C lagern.
- Standard-Fluoreszenz-Immunhistochemie
- Wählen Sie acht sagittale Schnitte pro Tier in einem Abstand von 240 μm zueinander.
- Die frei schwebenden Abschnitte werden 1 h lang bei Raumtemperatur in Blockierungs-/Permeabilisierungslösung (0,1 % Triton X-100 mit 10 % normalem Ziegenserum (NGS) in PBS) inkubiert.
- Die Schnitte werden über Nacht bei 4 °C mit einem polyklonalen Anti-GFP-Primärantikörper (1:1.000) inkubiert.
- 3 x 15 min in PBS waschen und die Schnitte 2 h lang bei Raumtemperatur mit dem sekundären Antikörper polyklonaler Anti-Hühner-Antikörper inkubieren, der an Alexa Fluor 488 Fluorophor (1:200) konjugiert ist.
- 3 x 15 min in PBS waschen. Mit DAPI 5 Minuten bei Raumtemperatur inkubieren.
- 3 x 15 min in PBS waschen. Legen Sie die Schnitte in gelatinebeschichtete Objektträger und Deckglas mit Fluoreszenzeindeckmedium.
- Erfassen Sie Bilder mit einem Dia-Scanner-Fluoreszenzmikroskop, das mit einem 20x/0,8-Objektiv ausgestattet ist.
Ergebnisse
In dieser Arbeit stellen wir ein detailliertes Protokoll für die Herstellung, Reinigung und Charakterisierung von Mosaik-rAAVs vor (zusammengefasst in Abbildung 1), die das Potenzial haben, das ZNS zu beeinflussen und zu transduzieren (z.B. AAV1 und AAV9) und gleichzeitig für die Aufreinigung der Heparinaffinitätschromatographie (AAV2) geeignet sind. Um dies zu erreichen, wurden Kapside aus natürlichen AAV-Serotypen 1, 2 und 9 verwendet, um Mosaik-rAAV1/2- und rAAV2/9-Vektoren zu entwickeln.
Vor dem Start wurden die Plasmidpräparate auf ihre strukturelle Integrität untersucht. Zusätzlich zu den Aufbrüchen, die zur Validierung der korrekten Insertion von Klonierungsfragmenten erforderlich sind, ist es wichtig, pITR-Plasmide konsistent zu screenen, um potenzielle ITR-Deletionen/Insertionen nachzuweisen. Als Beispiel wurde die Integrität von ITRs in verschiedenen Klonen eines pITR-Plasmids nach dem Plasmidverdau mit dem Restriktionsenzym SmaI überwacht (Ergänzende Abbildung S1).
Beide Arten von Mosaikvektoren wurden durch die Co-Transfektion der jeweiligen AAV-Kapsidplasmide im Verhältnis 1:1 nach Standard-Transfektionsmethoden6 erzeugt. Kurz gesagt, HEK293T Zellen wurden transfiziert mit i) einem Plasmid, das das Transgen von Interesse enthielt, das zwischen den ITR-Sequenzen (pITR) gepackt war, ii) einem Plasmid, das das Wildtyp-AAV-Genom Rep und die Cap-ORFs von AAV2 und AAV1 oder AAV9 (pAAV-RC-Plasmide) enthielt, und iii) einem Plasmid, das die adenoviralen Proteine (E1A, E1B, E4 und E2A) sowie die Adenovirusvirus-assoziierten RNAs kodiert, die für die Helferfunktionen essentiell sind (pHelper). Achtundvierzig Stunden später wurden die Zellengeerntet 6,36, und die rAAVs wurden durch Affinitätschromatographie unter Verwendung eines FPLC-Systems aus dem Zellhomogenat aufgereinigt. Wie in Abbildung 2A dargestellt, wurde nach der Säulenäquilibrierung (Äquilibrierungsschritt) das Zelllysat, das die rAAVs enthält, auf die Säule aufgebracht (Probenbeladung). Aufgrund der natürlichen Affinität von rAAV2 zu Heparin33 wurden rAAVs an das Harz der Säule gebunden, während andere Komponenten im laufenden Puffer durchgeführt und vom UV-Monitor detektiert wurden (Flowthrough), was zu einer Erhöhung der Absorption führte. Die Säule wurde anschließend gewaschen (Waschschritt) und die rAAVs wurden schließlich durch eine Erhöhung der NaCl-Konzentration (Elutionsschritt) eluiert. Die eluierten Viren wurden mit dem UV-Monitor detektiert und in 1 mL-Fraktionen gesammelt.
Ein repräsentatives Elutionspeakprofil von rAAV1/2 und rAAV2/9 ist in Abbildung 2B bzw. Ergänzende Abbildung S2A dargestellt, wobei verschiedene Viruschargen konsistent einen einzigen Peak von der Fraktion F7 bis F16 aufweisen. Die Peakhöhe ist bei rAAV-Produktionen unterschiedlich, wobei höhere Peaks in der Regel zu höheren rAAV-Erträgen führen. Jede Fraktion der produzierten rAAV1/2 und rAAV2/9 wurde anschließend mittels RT-qPCR charakterisiert, um die Virustiter zu bestimmen (Abbildung 2C und ergänzende Abbildung S2B).
Um die Reinheit des eluierten Materials zu charakterisieren, wurden 40 μL jeder Fraktion und des jeweiligen Durchflusses mittels 10%iger SDS-Polyacrylamid-Gelelektrophorese untersucht (Abbildung 2D für rAAV1/2 und Ergänzende Abbildung S2C für rAAV2/9). Die Coomassie-Blau-Färbung zeigte drei Hauptbanden in den Fraktionen F7-F16, mit Molekulargewichten, die den Kapsidproteinen VP1 (87 kDa), VP2 (72 kDa) und VP3 (62 kDa) von AAVs im entsprechenden Verhältnis 1:1:10 entsprachen, wie zuvor von Van Vliet und Kollegenbeschrieben 14. In beiden Fällen und basierend auf der UV-Absorption, der RT-qPCR und der Gelbandenintensität ist klar, dass die Mehrheit der Mosaik-rAAVs in den Fraktionen F7 und F8 vorhanden ist und in den Fraktionen F9-F16 allmählich abnimmt. Zusätzlich zu den drei viralen Kapsidproteinen wurde/wurden in den Fraktionen F8-F16 ein weiteres Protein (oder Proteine) mit einer Größe von etwa 17 kDa nachgewiesen.
Um diese co-reinigenden Proteine zu eliminieren, wurden die Fraktionen F7-16 anschließend filtriert und mit 100 KDa-Zentrifugalfiltereinheiten konzentriert, und der endgültige rAAV-Titer wurde durch RT-qPCR bestimmt (wie in Abbildung 3A, B für rAAV1/2 gezeigt). Die endgültige Ausbeute einer rAAV-Produktion hängt von der Länge und Komplexität der pITR, der Integrität der ITR-Sequenzen, den Zellkulturbedingungen (z. B. der Anzahl der Zellpassagen) und der Transfektionseffizienzab 24,58,59,60,61. Nichtsdestotrotz kann der endgültige Titer eingestellt werden, indem mehrere Zentrifugationen des rAAV-Präparats mit 0,5-mL-Zentrifugalfiltereinheiten durchgeführt werden (Konzentrationsschritt 2). Nach diesem Protokoll werden für ein Endvolumen im Bereich von 50 bis 100 μl in der Regel Konzentrationen zwischen 2 × 109 und 5 × 1010 vg/μl zusammengefasst (Quantifizierung unter Verwendung des referenzierten Titrationskits).
Die Reinheit der finalen rAAV-Präparate wurde dann an einem 10%igen SDS-Polyacrylamid-Gel bewertet. Wie in Abbildung 3C dargestellt, wurden für das rAAV1/2-Präparat nur drei Banden beobachtet, die die rAAVs-Kapsidproteine repräsentieren, und es wurden keine nachweisbaren co-reinigenden Proteine identifiziert. Diese Ergebnisse stimmten mit denen für rAAV2/9 überein (Ergänzende Abbildung S2C). Um die Identität zu bestätigen und die Reinheit der rAAV1/2- und rAAV2/9-Vektoren weiter zu charakterisieren, wurden die Virusfraktionen und die konzentrierten Stämme mittels Western Blot mit den spezifischen Antikörpern B1 (Ergänzende Abbildung S3A und Ergänzende Abbildung S4A) und A69 (Ergänzende Abbildung S3B und Ergänzende Abbildung S4B) analysiert. Während der Antikörper B1 ein C-terminales Epitop erkennt, das allen VP-Proteinen der meisten AAV-Serotypen62 gemeinsam ist, erkennt der Klon A69 nur Epitope von VP1 und VP263. Nichtsdestotrotz können auch einige schwache Banden mit einem Molekulargewicht kleiner als VP3 (<62 kDa) bei der Markierung von B1 und A69 nachgewiesen werden.
Um die strukturelle Morphologie zu charakterisieren und die Reinheit von rAAVs weiter zu bewerten, wurden die Viruspartikel direkt mittels TEM visualisiert. Diese Technik ist das Standardverfahren zur Beurteilung der Probenintegrität und -reinheit in viralen Proben, da sie die Quantifizierung von leeren und vollen rAAV-Partikeln sowie die Beurteilung der Kontamination in einer Probeermöglicht 29,64,65,66,67. Wie in Abbildung 3D gezeigt, konnten große Mengen an rAAV-Partikeln mit einem Durchmesser von ~25 nm auf einem sauberen Hintergrund beobachtet werden. Leere Teilchen (schwarzer Pfeil) mit einem elektronendichten Zentrum sowie vollständige Vektoren (weißer Pfeil) konnten ebenfalls im gesamten Probenfeld beobachtet werden.
Wir führten auch eine Qualitätskontrolle der gereinigten rAAVs mit Stunner durch, einer Plattform, die ultraviolett-sichtbare (UV-Vis) Spektroskopie, statische Lichtstreuung (SLS) und dynamische Lichtstreuung (DLS) kombiniert68. Für jede Probe wurden die Gesamtmenge an Protein, ssDNA sowie die absorbierenden Verunreinigungen und die Hintergrundtrübung mittels UV-Vis-Spektroskopie gemessen (Abbildung 3E und ergänzende Abbildung S5A). SLS und DLS wurden dann angewendet, um das Lichtstreuverhalten von rAAV-Kapsiden zu bewerten. Da AAVs einen mittleren Durchmesser von 25 nm haben, gelten Partikel in einem Durchmesserbereich von 15-45 nm als intakt. Größere Partikel stellen typischerweise virale Aggregate dar, und alles, was kleiner ist, besteht höchstwahrscheinlich aus kleinen Partikeln, einschließlich unzusammengesetzter Kapsidproteine68. Für rAAV1/2 wurde bei 30 nm (Abbildung 3F) ein einzelner Peak, der intakten Kapsidpartikeln entsprach, mit 0 % der Aggregatintensität und 0 % der Intensität kleiner Partikel beobachtet. Für die rAAV2/9-Präparation wurde auch ein Peak bei 30 nm nachgewiesen, der einer Kapsidintensität von 78% entspricht (Ergänzende Abbildung S5B). Obwohl die Intensität der kleinen Partikel 0 % betrug, wurde für diese Probe eine Aggregatintensität von 22 % gemessen (grau dargestellt), wobei der größte Beitrag (19,9 %) von großen Aggregaten mit einem mittleren Durchmesser von 620 nm geleistet wurde (Ergänzende Abbildung S5B). Durch die Kombination von UV-Vis-Spektroskopie mit SLS- und DLS-Informationen enthüllte Stunner den Gesamtkapsidtiter, den Vollkapsidtiter, das freie und aggregierte Protein sowie die freie und aggregierte ssDNA für die beiden viralen Präparate, die in Abbildung 3G und ergänzender Abbildung S5C dargestellt sind (spezifische Werte sind in jeder Abbildungslegende angegeben).
Parallel dazu wurden zur Bewertung der biologischen Aktivität der entwickelten Mosaik-AAV-Vektoren HEK293T Zellen mit 50 μl jeder FPLC-erhaltenen Fraktion (F2-F16) entweder des rAAV1/2- oder rAAV2/9-Präparats infiziert. Da der rAAV1/2-Vektor unter der Kontrolle eines CMV-Promotors (pAAV-CMV-ssGFP) für ein einzelsträngiges grün fluoreszierendes Protein (GFP) kodiert und der rAAV2/9-Vektor für ein selbstkomplementäres GFP kodiert, wurde unter der Kontrolle des CMV-Promotors (pAAV-CMV-scGFP53) die direkte GFP-Fluoreszenz in diesen Zellen 48 Stunden nach der Infektion untersucht (Ergänzende Abbildung S6 und Ergänzende Abbildung S7). In Übereinstimmung mit den vorherigen Beobachtungen für RT-qPCR, Coomassie Blue und Western Blot wurde die höchste Infektiosität für die viralen Fraktionen F7 und F8 erreicht, die in den Fraktionen F9 bis F16 allmählich abnahmen.
Um zu bestätigen, ob die biologische Aktivität von rAAVs nach Ultrafiltration und Konzentrationsschritten aufrechterhalten wurde, wurden Neuro2A-Zellen, die sowohl in 24-Well-Platten als auch in einem 8-Well-Kammer-Objektträger plattiert waren, mit dem konzentrierten rAAV1/2-Vektor infiziert, der für scGFP unter der Kontrolle des CMV-Promotors (pAAV-CMV-scGFP53) kodiert. Hellfeld- und Fluoreszenzbilder wurden 48 Stunden nach der Infektion aufgenommen (Abbildung 4A,B für Bilder mit höherer Auflösung).
Mit dem Ziel, die infektiöse Kapazität der produzierten rAAVs in einem relevanteren und reflektierenderen Zellmodell zu untersuchen, wurden semidichte primäre neuronale Kulturen aus dem Kortex auf eine 12-Well-Platte gesät und mit dem zuvor verwendeten rAAV1/2 - CMV-scGFP - infiziert. Achtundvierzig Stunden nach der Infektion wurden die Zellen fixiert und mit DAPI und WGA markiert, die mit Alexa Fluor 633 konjugiert waren. Ein weit verbreitetes Lektin zur Markierung fixierter Zellen. Die in Abbildung 4C,D gezeigten Bilder wurden mit einem Zeiss Axio Observer Z1 und mit einem konfokalen Zeiss LSM 710 aufgenommen. Wie in diesen Abbildungen durch direkte GFP-Fluoreszenz dargestellt, behalten konzentrierte Mosaikviren ihre Gentransfereigenschaften für neuronale Zellen bei.
Nachdem wir Mosaik-rAAVs in Bezug auf Reinheit, physikalische Eigenschaften und Funktionalität in vitro charakterisiert hatten, untersuchten wir als Nächstes die Möglichkeit, die gereinigten rAAV1/2-Mosaikvektoren zur Transduktion des Kleinhirns von C57BL/6-Mäusen zu verwenden. Zu diesem Zweck wurde eine stereotaktische Injektion bei 9 Wochen alten Mäusen durchgeführt und die GFP-Expression 12 Wochen später ausgewertet. Wie erwartet zeigten Tiere, denen PBS injiziert wurde, bei der GFP-Immunmarkierung keine Fluoreszenz. Epifluoreszenzbilder von Mäusen, die unter der Kontrolle des Synapsin-1-Promotors (rAAV1/2 - Syn-ssGFP) mit rAAV1/2-Vektoren, die für GFP kodieren, injiziert wurden, zeigten, dass rAAV1/2-Vektoren mehrere Regionen des Kleinhirns erfolgreich transduzierten, nämlich die Region der tiefen Kleinhirnkerne (DCN) sowie die verschiedenen Läppchen des Kleinhirns (Abbildung 5). Diese Ergebnisse zeigen die verlängerte Expression des Transgens im Gehirn von Säugetieren (12 Wochen).
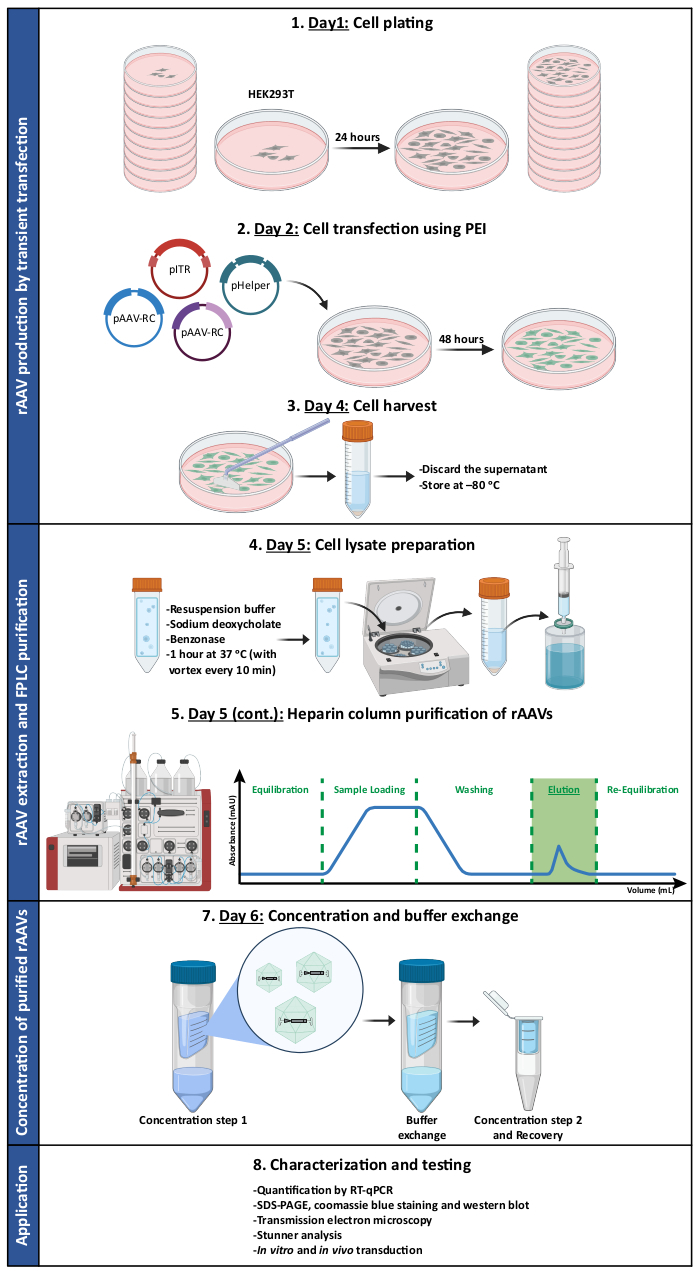
Abbildung 1: Schematische Darstellung des rAAV-Produktions- und Aufreinigungsprotokolls. rAAVs werden durch transiente Transfektion von HEK293T Zellen unter Verwendung von Polyethylenimin (PEI) hergestellt. Anschließend werden die Zellen geerntet und lysiert, und die rAAVs werden mittels Affinitätschromatographie aus dem Zellhomogenat aufgereinigt. Die gesammelten Fraktionen, die rAAVs enthalten, werden dann konzentriert, und die endgültigen Virusstämme werden in Bezug auf Titer, Reinheit, morphologische Merkmale und biologische Aktivität charakterisiert. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; PEI = Polyethylenimin; RT-qPCR = quantitative Polymerase-Kettenreaktion in Echtzeit; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
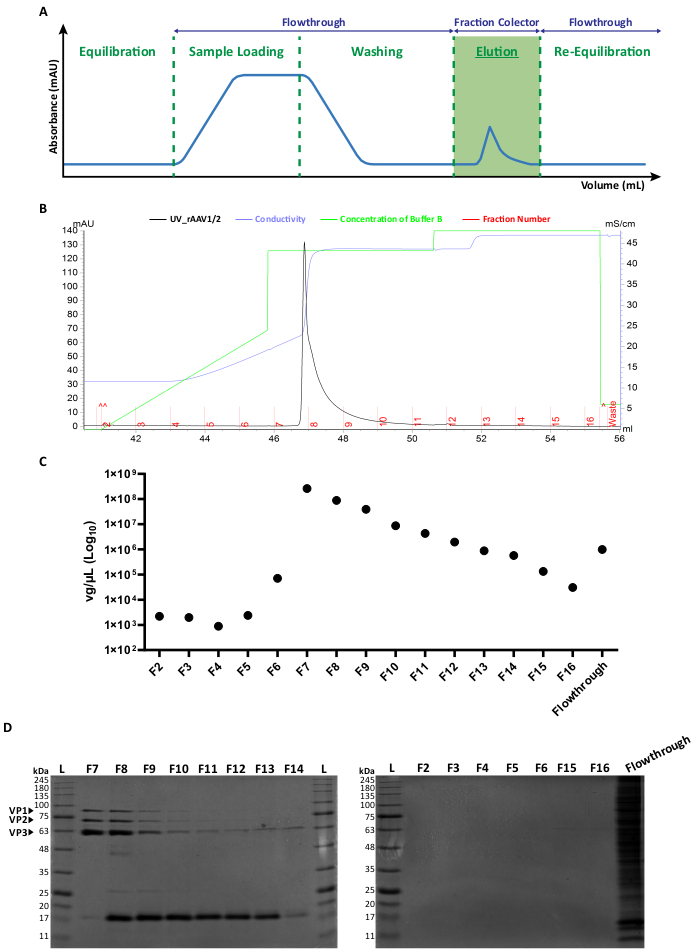
Abbildung 2: FPLC-Aufreinigungsprotokoll und repräsentatives Elutionsprofil von rAAV1/2. (A) Schematische Darstellung eines vollständigen Chromatogrammprofils, das die verschiedenen Stadien des rAAV-Aufreinigungsprozesses zeigt. Nach einem Schritt der Säulenäquilibrierung wird die Probe angewendet. Die Säule wird dann gewaschen und die Elution mit steigenden Konzentrationen von NaCl durchgeführt. Das ungebundene Material (Durchfluss) und 1 mL Fraktionen der eluierten Viren werden für die Analyse gesammelt. Die Extinktion bei 280 nm wird in mAU ausgedrückt und die x-Achse gibt das Volumen in mL an. (B) Vergrößertes partielles Chromatogramm mit einem rAAV1/2-Elutionspeak (in schwarz) mit den entsprechenden Fraktionsnummern (F2-F16) und Abfall (rot dargestellt). Die ausgegebene Konzentration von Puffer B und die Leitfähigkeit (ausgedrückt in mS/cm) sind ebenfalls grün bzw. violett dargestellt. (C) RT-qPCR jeder Fraktion, die während der Affinitätsreinigung (F2-F16) und des Durchflusses gesammelt wurde. Der Titer in vg/μL wird auf einer logarithmischen Skala dargestellt. (D) SDS-PAGE-Analyse der gesammelten Virusfraktionen. Gleiche Volumina (40 μl) jeder Fraktion aus dem Elutionsschritt (F2-F16) und dem jeweiligen Durchfluss wurden auf ein 10%iges SDS-Polyacrylamid-Gel geladen und aufgelöst. Die Proteinbanden wurden durch Coomassie-Blau-Färbung sichtbar gemacht. Banden, die den AAV-Kapsidproteinen VP1, VP2 und VP3 entsprechen, sind angegeben. Die Leiter für die Standardproteingröße wird als (L) bezeichnet und die entsprechenden Molekulargewichte sind ebenfalls angegeben. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; RT-qPCR = quantitative Polymerase-Kettenreaktion in Echtzeit; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
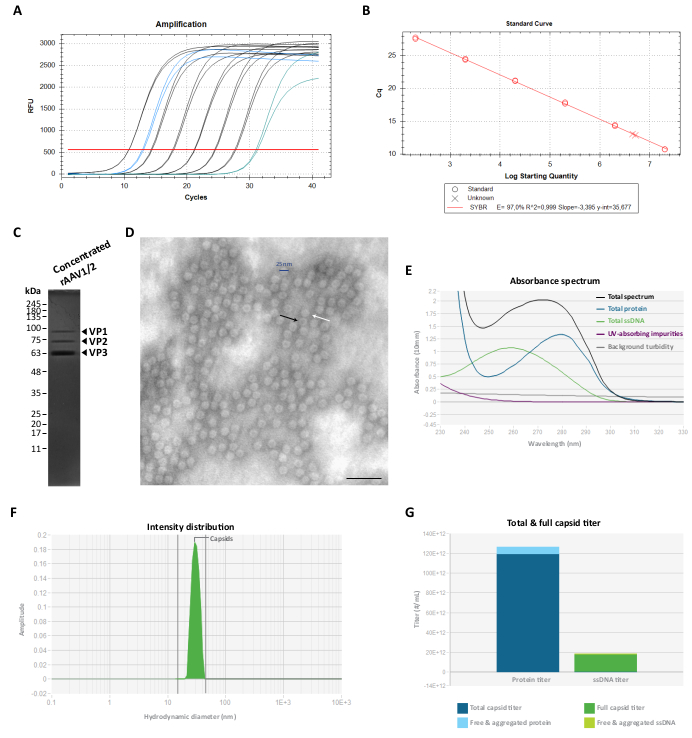
Abbildung 3: Charakterisierung der konzentrierten rAAV1/2-Vektoren. (A) Amplifikationskurven einer konzentrierten rAAV1/2-Probe (in blau), seriell verdünnter Standards von 2 × 107 vg/μL bis 2 × 102 vg/μL (in schwarz) und einer No-Template-Kontrolle (in grün), erhalten während der RT-qPCR. (B) Standardkurve (lineare Regression) zur Bestimmung des Titers einer rAAV-Probe in vg/μL. (C) SDS-PAGE-Analyse der konzentrierten Viruspartikel. Insgesamt wurden 2,3 × 1010 vg des konzentrierten Stoffes auf dem Gel gepoolt. (D) Transmissionselektronenmikroskopische Aufnahme von rAAV1/2-Partikeln mit einem Durchmesser von ~25-30 nm. Leere Teilchen mit einem elektronendichten Zentrum (erkennbar durch schwarze Pfeile) können von vollständigen Kapsiden (erkennbar an weißen Pfeilen) unterschieden werden. Maßstabsleiste = 100 nm. (E) Absorptionsspektrum eines rAAV1/2-Präparats, gemessen mit Stunner (in schwarz). Der Beitrag von Proteinen (in blau), ssDNA (in grün), anderen UV-absorbierenden Verbindungen oder Verunreinigungen (in violett) und der Hintergrundtrübung (in grau) wird ebenfalls dargestellt. (F) DLS-Intensitätsverteilung von rAAV1/2 mit einem einzigen Peak bei 30 nm, gemessen mit Stunner. Eine Kapsidstreuintensität von 100% wurde durch Messung der Fläche unter der Kurve von 15 bis 45 nm (grün schattiert) bestimmt. (G) Stunner-Analyse eines rAAV1/2-Vektorpräparats mit einem Gesamtkapsidtiter von 1,19 ×10 14 cp/ml (dunkelblau) und einem Vollkapsidtiter von 1,73 × 1013 vg/ml (dunkelgrün). Ein freies und aggregiertes Protein von 7,16 × 1012 cp/ml-Äquivalenten (hellblau) sowie eine freie und aggregierte ssDNA von 1,04 × 1012 vg/ml-Äquivalenten (hellgrün) wurden ebenfalls gemessen. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; RT-qPCR = quantitative Polymerase-Kettenreaktion in Echtzeit; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese; ssDNA = einzelsträngige DNA; DLS = dynamische Lichtstreuung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
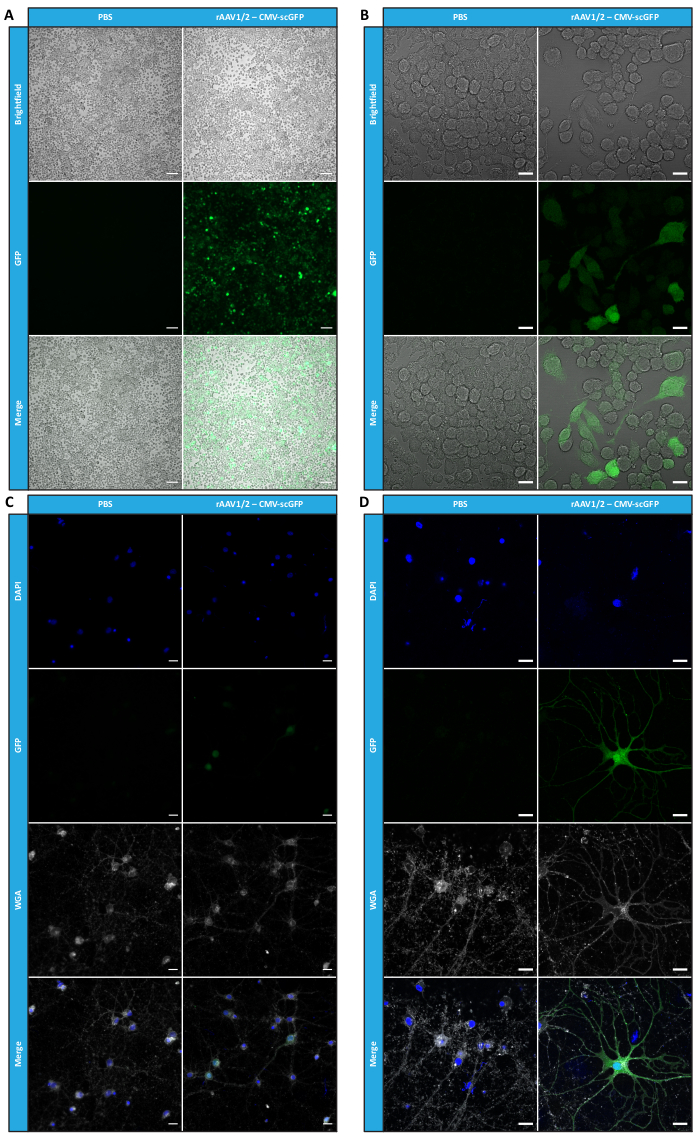
Abbildung 4: In-vitro-Infektiositätsbeurteilung einer konzentrierten rAAV1/2-Probe. (A) Neuro2A-Zellen wurden als Negativkontrolle mit rAAV1/2 - CMV-scGFP infiziert oder mit einem äquivalenten PBS-Volumen inkubiert. Hellfeld- und Fluoreszenzbilder von Zellen, die 48 Stunden nach der Infektion abgebildet wurden. Die Bilder wurden mit einem Zeiss Axio Observer Z1 (10x Objektiv) aufgenommen. Maßstabsbalken = 100 μm. (B) Detaillierte Bilder von Neuro2A-Zellen 48 h nach der Infektion mit rAAV1/2 - CMV-scGFP. Die Bilder wurden mit einem Zeiss LSM 710 (40x Objektiv) aufgenommen. Maßstabsbalken = 20 μm. (C) Halbdichte primäre neuronale Kulturen, die mit rAAV1/2 - CMV-scGFP infiziert oder mit einem äquivalenten PBS-Volumen inkubiert wurden und als Negativkontrolle dienen. Die Zellen wurden mit einer Kernfärbung (DAPI in blau) und einer Membranfärbung (WGA in weiß) markiert. Die Bilder wurden mit einem Zeiss Axio Observer Z1 (40x Objektiv) aufgenommen. Maßstabsbalken = 20 μm. (D) Detaillierte Bilder von semidichten primären neuronalen Kulturen 48 h nach der Infektion mit rAAV1/2 - CMV-scGFP. Die Bilder wurden mit einem Zeiss LSM 710 (40x Objektiv) aufgenommen. Maßstabsleisten = 20 μm. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; CMV = Cytomegalievirus; scGFP = selbstkomplementäres grün fluoreszierendes Protein; PBS = phosphatgepufferte Kochsalzlösung; DAPI = 4',6-diamidino-2-phenylindol; WGA = Weizenkeim-Agglutinin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
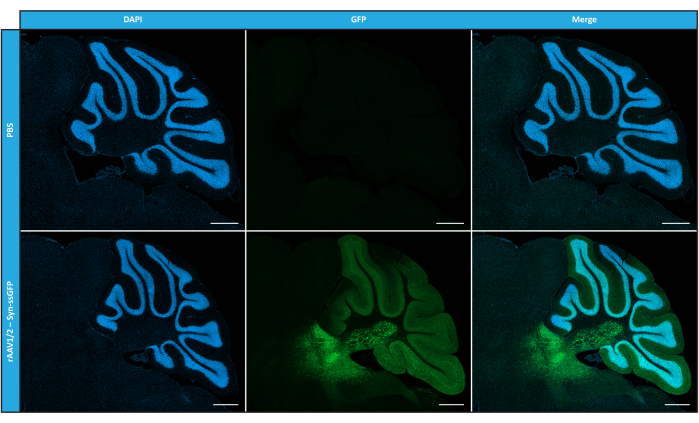
Abbildung 5: In vivo Transduktionseffizienz von rAAV1/2 nach einer intraparenchymalen Injektion. Repräsentative Immunfluoreszenzbilder, die die weit verbreitete GFP-Expression (in grün) im gesamten Kleinhirn nach einer zentralen Injektion von rAAV1/2 - Syn-ssGFP in das Kleinhirn zeigen. Die Zellkerne wurden mit DAPI (in blau) angefärbt. Maßstabsleisten = 500 μm. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; Syn = Synapsin 1; ssGFP = einzelsträngiges grün fluoreszierendes Protein; DAPI = 4',6-diamidino-2-phenylindol; PBS = phosphatgepufferte Kochsalzlösung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung S1: Agarose-Gel-Analyse eines mit SmaI verdauten rAAV-Vektorplasmids. Sechs Klone (C1-C6) eines pITR wurden mit dem SmaI-Restriktionsenzym (Lanes 2, 4, 6, 8, 10 und 12) verdaut, das innerhalb jeder invertierten terminalen Wiederholung zweimal schneidet. In diesem Fall wäre zu erwarten, dass ein vollständiger Aufschluss dieser pITR zwei Banden (3.796 bp und 3.013 bp) erzeugt. In erfolgreichen Präparaten (C1, C3, C4 und C5) ist immer noch eine Bande von 6809 bp sichtbar, die aus einem partiellen Aufschluss resultiert (~5% der Gesamtmenge). Bei Präparaten mit ITR-Rekombination sind die Verhältnisse umgekehrt (C2) oder der Aufschluss ist nicht erfolgt (C6). Die jeweiligen unverdauten Klone werden ebenfalls vorgestellt (Lanes 3, 5, 7, 9, 11, 13). Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; ITR = invertierte Terminalwiederholung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S2: rAAV2/9-Aufreinigung durch Heparin-basierte Affinitätschromatographie. (A) Elutionsprofil von rAAV2/9 mit einem einzigen Peak (in schwarz) nach einem Anstieg der NaCl-Konzentration. Die gesammelten Fraktionen werden durch Zahlen (2-16) in Rot am unteren Rand des Diagramms angezeigt, die Extinktion bei 280 nm wird in mAU ausgedrückt, die Leitfähigkeit wird in mS/cm ausgedrückt und die x-Achse zeigt das Volumen in mL an. (B) rAAV-Titer, quantifiziert durch RT-qPCR für jede gepoolte Fraktion (F2-F16) und jeden Durchfluss. Die Werte werden auf einer logarithmischen Skala dargestellt. (C) Reinheitstest durch SDS-PAGE und Coomassie-Blau-Färbung. Gleiche Volumina (40 μl) jeder Fraktion (F2-F16) und des jeweiligen Durchflusses wurden auf einer 10% SDS-PAGE geladen und aufgelöst. Die konzentrierte Brühe wurde mittels RT-qPCR quantifiziert und 2,3 × 1010 vg wurden in 40 μl PBS verdünnt und auf dem Gel gepoolt. Die Proteinbanden wurden durch Coomassie-Blau-Färbung sichtbar gemacht. Die AAV-Kapsidproteine (VP1, VP2 und VP3) sind indiziert. Die Leiter der Standardproteingröße wird mit (L) bezeichnet und die entsprechenden Molekulargewichte sind ebenfalls angegeben. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; RT-qPCR = quantitative Polymerase-Kettenreaktion in Echtzeit; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S3: Western-Blot-Analyse von rAAV1/2-Vektoren, die durch FPLC aufgereinigt wurden. (A) Die gesammelten Fraktionen und konzentrierten rAAV1/2-Vektoren wurden auf einem SDS-PAGE-Gel aufgelöst und mit einem monoklonalen Maus-Anti-AAV-Antikörper (B1) untersucht, der VP1-, VP2- und VP3-Kapsidproteine erkennt. (B) Die gesammelten Fraktionen und konzentrierten rAAV1/2-Vektoren wurden auf einem SDS-PAGE-Gel aufgelöst und mit einem monoklonalen Maus-Anti-AAV-Antikörper (A69) untersucht, der VP1- und VP2-Kapsidproteine erkennt. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; FPLC = schnelle Proteinflüssigkeitschromatographie; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese; L = Leiter der Standardproteingröße. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S4: Western-Blot-Analyse von rAAV2/9-Vektoren, die durch FPLC aufgereinigt wurden. (A) Die gesammelten Fraktionen und konzentrierten rAAV2/9-Vektoren wurden auf einem SDS-PAGE-Gel aufgelöst und mit einem monoklonalen Maus-Anti-AAV-Antikörper (B1) untersucht, der VP1-, VP2- und VP3-Kapsidproteine erkennt. (B) Die gesammelten Fraktionen und konzentrierten rAAV2/9-Vektoren wurden auf einem SDS-PAGE-Gel aufgelöst und mit einem monoklonalen Maus-Anti-AAV-Antikörper (A69) untersucht, der VP1- und VP2-Kapsidproteine erkennt. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; FPLC = schnelle Proteinflüssigkeitschromatographie; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese; L = Leiter der Standardproteingröße. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S5: Quantifizierung und Charakterisierung von rAAV2/9-Vektoren mittels Stunner. (A) Absorptionsspektrum (schwarz) eines rAAV2/9-Vektors, gemessen mit Stunner. Der Beitrag von Proteinen (blau), ssDNA (grün), anderen UV-absorbierenden Verbindungen oder Verunreinigungen (violett) und der Hintergrundtrübung (grau) wird ebenfalls dargestellt. (B) DLS-Intensitätsverteilung von rAAV2/9 mit einem Hauptpeak bei 30 nm, was einer Kapsidstreuintensität von 78 % entspricht, bestimmt durch Messung der Fläche unter der Kurve von 15 bis 45 nm (grün schattiert). Es wurde auch eine Gesamtaggregatintensität von 22 % (grau schattiert) gemessen, wobei der Hauptbeitrag von großen Aggregaten (19,9 %) mit einem mittleren Durchmesser von 620 nm geleistet wurde. (C) Stunner-Analyse eines rAAV2/9-Vektorpräparats mit einem Gesamtkapsidtiter von 2,18 ×10 14 cp/ml (dunkelblau) und einem Vollkapsidtiter von 2,35 × 1013 vg/ml (dunkelgrün). Ein freies und aggregiertes Protein von 2,92 ×10 13 cp/ml-Äquivalenten (hellblau) sowie eine freie und aggregierte ssDNA von 3,14 × 1012 vg/ml-Äquivalenten (hellgrün) wurden ebenfalls in diesem Präparat gemessen. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; ssDNA = einzelsträngige DNA; DLS = dynamische Lichtstreuung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S6: In-vitro-Transduktionseffizienz und Lebensfähigkeit der gereinigten Fraktionen von rAAV1/2. HEK293T Zellen, die GFP (direkte Fluoreszenz) exprimieren, 48 h nach der Transduktion mit 50 μl FPLC-Fraktionen eines rAAV1/2-Vektors, der für ssGFP (rAAV1/2 - CMV-ssGFP) kodiert. Maßstabsleisten = 100 μm. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; FPLC = schnelle Proteinflüssigkeitschromatographie; ssGFP = einzelsträngiges grün fluoreszierendes Protein. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S7: In-vitro-Transduktionseffizienz und Lebensfähigkeit der gereinigten Fraktionen von rAAV2/9. HEK293T Zellen wurden unter der Kontrolle des CMV-Promotors mit 50 μl jeder FPLC-Fraktion (F2-F16) oder einem Durchfluss eines rAAV2/9-Vektors, der für scGFP kodiert, infiziert. Die GFP-exprimierenden Zellen wurden 48 h nach der Infektion sichtbar gemacht. Maßstabsleisten = 100 μm. Abkürzungen: rAAV = rekombinantes Adeno-assoziiertes Virus; FPLC = schnelle Proteinflüssigkeitschromatographie; scGFP = selbstkomplementäres grün fluoreszierendes Protein; CMV = Cytomegalievirus. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das schnell wachsende AAV-Vektor-Toolkit hat sich zu einem der vielversprechendsten Genverabreichungssysteme für eine Vielzahl von Zelltypen über verschiedene Verabreichungswege entwickelt. In dieser Arbeit haben wir uns zum Ziel gesetzt, ein verbessertes Protokoll für die Herstellung, Reinigung und Charakterisierung von Mosaik-rAAV-Vektoren zu entwickeln, das sich in präklinischen Studien bewähren könnte. Zu diesem Zweck wird hier die Erzeugung von rAAV1/2- und rAAV2/9-Mosaikvektoren beschrieben, aber das Verfahren kann auch zur Aufreinigung von Standard-rAAV2-Vektoren angewendet werden (Daten nicht gezeigt).
Mosaik-rAAVs wurden nach einer optimierten Transfektionsmethode unter Verwendung von PEI als Transfektionsreagenz hergestellt. Eine transiente Transfektionsmethode wurde aufgrund ihrer größeren Flexibilität und Geschwindigkeit gewählt, was in frühen präklinischen Studien erhebliche Vorteile bietet. Sobald ein bestimmtes Transgen und ein bestimmter Serotyp validiert wurden, kann das Produktionssystem fein abgestimmt werden, um eine bessere Skalierbarkeit und Kosteneffizienz zu erreichen, indem eine stabile transfizierte Zelllinie etabliert wird, die eine Untergruppe der spezifischen Rep/Cap-Gene exprimiert, wobei zusätzliche Gene durch einen Infektionsprozess bereitgestellt werden24. Im Vergleich zur Calcium-Phosphat-Transfektion bietet PEI mehrere Vorteile. Es handelt sich um ein stabiles und kostengünstiges Transfektionsreagenz, das in einem breiteren pH-Bereich effektiv arbeitet. Darüber hinaus entfällt die Notwendigkeit, das Zellmedium nach der Transfektion zu wechseln, was zu einer erheblichen Reduzierung der Kosten und des Arbeitsaufwands führt69.
In einem Versuch, einige der Einschränkungen durch CsCl- oder Iodixanol-Gradienten zu umgehen, wurden die hergestellten rAAVs geerntet und durch Affinitätschromatographie gereinigt. Diese Strategie bietet einen vereinfachten und skalierbaren Ansatz, der ohne Ultrazentrifugation und Gradienten durchgeführt werden kann und saubere und hohe Virustiter liefert. Tatsächlich können Chromatographietechniken mit einem FPLC-System automatisiert und skaliert werden, indem mehr Harzvolumen in eine Säule mit höherer Betthöhe gepackt wird. Das hierin beschriebene Protokoll kann leicht angepasst werden, um 5 mL HiTrap Heparin HP Säulen aufzunehmen (Daten nicht gezeigt). Darüber hinaus können Heparinsäulen mehrfach wiederverwendet werden, was zur Wirtschaftlichkeit dieser Methode beiträgt.
Die gereinigten rAAVs wurden dann in Bezug auf Titer, Reinheit, morphologische Merkmale und biologische Aktivität charakterisiert. Interessanterweise wurde bei der Coomassie-Blau-Färbung eine Bande mit etwa 17 kDa in den Fraktionen F8-F16 zusätzlich zu den drei typischen viralen Kapsidproteinen nachgewiesen. Diese Bande ist jedoch nach dem Konzentrationsschritt von rAAVs nicht mehr vorhanden. Darüber hinaus können auch einige schwache Banden mit einem Molekulargewicht unterhalb von VP3 (<62 kDa) bei der Markierung von B1 und A69 nachgewiesen werden, was darauf hindeutet, dass es sich um Fragmente der Kapsidproteine VP1, VP2 und VP3 handeln könnte70. Eine andere Möglichkeit besteht darin, dass es sich tatsächlich um andere co-reinigende Proteine wie Ferritin oder andere zelluläre Proteine mit Polypeptiden handelt, die ähnliche Proteinfingerabdrücke mit den AAV-Kapsidproteinen aufweisen und an der AAV-Biologie beteiligt sein könnten, wie zuvor vorgeschlagenwurde 26,71,72.
TEM- und Betäubungsanalysen zeigten auch das Vorhandensein leerer Partikel in unterschiedlichen Mengen bei verschiedenen Produktionen. In ähnlicher Weise berichteten andere Studien zuvor über die Bildung variabler und hoher Spiegel (>65%) leerer Kapside für rAAVs, die durch Transfektions- oder Infektionsmethoden hergestellt wurden24,73. Der Mechanismus hinter der rAAV-Generierung beginnt mit der schnellen Bildung leerer Kapside aus neu synthetisierten VP-Proteinen, gefolgt von einem langsamen geschwindigkeitsbegrenzenden Schritt der Genomverpackung in die vorgeformten Kapside, der durch Rep-Proteine vermittelt wird74,75. Daher werden in rAAV-Produktionen leere Kapside erzeugt, obwohl der Anteil an leeren und vollen Kapsiden je nach Größe und Sequenz des interessierenden Transgens und den Zellkulturbedingungen variieren kann58,73. Leere Kapside geben Anlass zur Sorge, da sie aufgrund des Fehlens des interessierenden Genoms keine therapeutische Wirkung entfalten können und möglicherweise auch eine angeborene oder adaptive Immunantwort verstärken können. Einige Berichte haben jedoch auch gezeigt, dass leere AAV-Kapside durch Anpassung ihres Verhältnisses als hochwirksame Köder für AAV-spezifische neutralisierende Antikörper dienen und daher die Transduktionseffizienz erhöhenkönnen 60,76,77. Wenn das Vorhandensein leerer Kapside kritisch schädlich ist und angesichts des etwas geringeren anionischen Charakters leerer Partikel im Vergleich zu vollständigen Vektoren, könnte eine mögliche Lösung darin bestehen, einen zweiten Polierreinigungsschritt unter Verwendung von Anionenaustauschchromatographietechnikendurchzuführen 64.
Diese Studie liefert auch überzeugende Beweise dafür, dass die generierten Mosaik-rAAVs in der Lage sind, nicht nur in vitro neuronale Kulturen, sondern auch das ZNS nach intrakranieller Injektion von rAAV1/2 effizient zu transduzieren. Insgesamt deuten diese Ergebnisse darauf hin, dass das beschriebene Produktions- und Aufreinigungsprotokoll hochreine und biologisch aktive rAAVs in 6 Tagen gebrauchsfertig macht, was sich in präklinischen Studien als vielseitige und kostengünstige Methode zur Erzeugung von rAAVs präsentiert.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir sind dankbar für die Zusammenarbeit, die Einblicke und die technische Unterstützung von Dr. Mónica Zuzarte vom Coimbra Institute for Clinical and Biomedical Research (iCBR) und dem Center for Innovative Biomedicine and Biotechnology (CIBB) bei der TEM-Analyse von rAAVs. Wir danken Dr. Dominique Fernandes vom Zentrum für Neurowissenschaften und Zellbiologie der Universität Coimbra (CNC-UC) und dem Institut für interdisziplinäre Forschung der Universität Coimbra (IIIUC) für ihre unschätzbare technische Unterstützung und ihre Erkenntnisse in Bezug auf die primären neuronalen Kulturexperimente. Die für diese Studie wesentlichen Plasmide pRV1, pH21 und pFdelta6 wurden uns großzügig von Dr. Christina McClure von der School of Medical Sciences, College of Life Sciences and Medicine, University of Aberdeen, zur Verfügung gestellt, wofür wir dankbar sind. Diese Arbeit wurde aus Mitteln des Europäischen Fonds für regionale Entwicklung (EFRE) im Rahmen des Regionalen Operationellen Programms Centro 2020 finanziert. über das operationelle Programm für Wettbewerbsfähigkeit und Internationalisierung COMPETE 2020 und portugiesische nationale Fonds über FCT - Fundação para a Ciência e a Tecnologia im Rahmen der Projekte: UIDB/04539/2020, UIDP/04539/2020, LA/P/0058/2020, ViraVector (CENTRO-01-0145-FEDER-022095), Imagene (PTDC/BBB-NAN/0932/2014 | POCI-01-0145-FEDER-016807), ReSet - IDT-COP (CENTRO-01-0247-FEDER-070162), Bekämpfung von Sars-CoV-2 (CENTRO-01-01D2-FEDER-000002), BDforMJD (CENTRO-01-0145-FEDER-181240), ModelPolyQ2.0 (CENTRO-01-0145-FEDER-181258), MJDEDIT (CENTRO-01-0145-FEDER-181266); durch den American Portuguese Biomedical Research Fund (APBRF) und den Richard Chin and Lily Lock Machado-Joseph Disease Research Fund, ARDAT, im Rahmen der IMI2 JU Grant Agreement No 945473 unterstützt von der EU und der EFPIA; Das GeneT-Teaming-Projekt 101059981 durch das Horizon Europe-Programm der Europäischen Union unterstützt. M.M.L. wurde unterstützt von 2021.05776.BD; C.H. wurde unterstützt von 2021.06939.BD; A.C.S. wurde unterstützt von 2020.07721.BD; und D.D.L. wurde von 2020.09668.BD unterstützt. Abbildung 1 wurde mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 10% povidone-iodine | Medline | MDS093943 | |
| 12-well plates | Thermo Scientific | 11889684 | |
| 24-well plates | VWR | 734-2325 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen | D1306 | |
| 96-well Stunner plate | Unchained Labs | 701-2025 | 96-well quantification plate for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| AAVpro Titration Kit (for Real-Time PCR) Ver.2 | Takara | 6233 | For determining the titer of AAV using RT-qPCR. This kit contains DNase I, Lysis Buffer, Dilution Buffer, positive control, Taq II mix, primer forward, primer reverse, water |
| Acetic acid glacial | Fisher Chemical | A/0360/PB17 | |
| ÄKTA pure 25 | Cytiva | 29018224 | FPLC system controlled by UNICORN software, version 6.3 |
| Alkaline phosphatase-linked goat anti-mouse | Invitrogen | 31328 | |
| Amicon ultra-0.5 centrifugal filter unit | Merck Millipore | UFC5100 | |
| Amicon ultra-15 centrifugal filter unit | Merck Millipore | UFC9100 | |
| Benzonase Nuclease | Merck Millipore | E1014 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| CFX96 Real-Time PCR detection system | Biorad | 184-5096 | |
| ChemiDoc Touch Imaging System | Bio-Rad Laboratories | 1708370 | |
| Chicken polyclonal anti-GFP primary antibody | Abcam | ab13970 | |
| Coomassie Blue G250 | Fisher Chemical | C/P541/46 | |
| Dithiothreitol (DTT) | Fisher Bioreagents | BP17225 | |
| DMEM | Sigma-Aldrich | D5796 | |
| ECF Substrate for Western Blotting | Cytiva | RPN5785 | |
| FastDigest SmaI | Thermo Scientific | FD0663 | |
| FEI-Tecnai G2 Spirit Biotwin | FEI | Biotwin | Transmission electron microscope |
| Fetal bovine serum | Biowest | S1810 | |
| Fluorescence mounting medium | Dako | S3023 | |
| Formvar-carbon coated 200 mesh grid | TAAB Laboratories Equipment | F077/025 | |
| Gas evacuation apparatus | RWD | R546W | |
| Glycerol | Fisher BioReagents | 10021083 | |
| Goat polyclonal anti-chicken antibody, Alexa Fluor 488 | Invitrogen | A-11039 | |
| Hamilton needle 30G, Small Hub RN Needle, 25 mm, PST3 | Hamilton | 7803-07 | |
| Hamilton syringe (10 µL) | Hamilton | 7653-01 | |
| HEK293T | American Type Culture Collection | CRL-11268 | |
| HiTrap Heparin HP 1 x 5 mL | Cytiva | 17040701 | Pre-packed heparin column |
| HiTrap Heparin HP 5 x 1 mL | Cytiva | 17040601 | Pre-packed heparin column |
| Immobilon-P PVDF Membrane | Merck Millipore | IPVH00010 | |
| Isoflurane | Braun | 469860 | |
| Ketamine | Dechra Pharmaceuticals | N/A | Nimatek |
| Low-retention microcentrifuge tubes (2 mL) | Fisher Scientific | 11906965 | |
| Lunatic & Stunner Client software | Unchained Labs | N/A | Client analysis software version 8.0.1.235. Software for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Methanol | Fisher Chemical | M/4000/FP21 | |
| Mouse monoclonal anti-AAV, VP1, VP2 antibody (A69) | American Research Products | 03-61057 | |
| Mouse monoclonal anti-AAV, VP1, VP2, VP3 antibody (B1) | American Research Products | 03-61058 | |
| Neuro2a | American Type Culture Collection | CCL-131 | |
| Normal goat serum | Gibco | 16210064 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 12738422 | |
| NZYColour Protein Marker II | NZYtech | MB09002 | |
| pAAV-CMV-scGFP | Addgene | 32396 | Addgene plasmid # 32396; http://n2t.net/addgene:32396; RRID:Addgene_32396 |
| pAAV-CMV-ssGFP | Addgene | 105530 | Addgene plasmid # 105530; http://n2t.net/addgene:105530; RRID:Addgene_105530 |
| pAAV2/9n | Addgene | 112865 | Addgene plasmid # 112865; http://n2t.net/addgene:112865; RRID:Addgene_112865 |
| Paraformaldehyde | Acros Organics | 10342243 | |
| PBS | Fisher BioReagents | BP2438 | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Pluronic F-68 Non-ionic Surfactant (100x) | Gibco | 24040032 | |
| Polyethylenimine MAX, MW 40,000 | Polysciences Europe | 24765 | |
| R500 Series Compact Small Animal Anesthesia Machine - Isoflurane | RWD | N/A | |
| Sample Inlet Valve V9-IS | Cytiva | 29027746 | |
| Sample pump P9-S | Cytiva | 29027745 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium chloride | Fisher Scientific | 10428420 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dodecyl sulfate (SDS) | Fisher Bioreagents | BP166 | |
| Sterile PVDF syringe filter | Fisher Scientific | 15191499 | |
| Stunner Platform | Unchained Labs | 700-2002 | Equipment for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Superloop 150 mL | Cytiva | 18-1023-85 | |
| Superloop 50 mL | Cytiva | 18-1113-82 | |
| SURE 2 supercompetent cells | Stratagene, Agilent Technologies | HPA200152 | |
| Treated culture dishes | Corning | 734-1711 | |
| Tris base | Fisher BioReagents | BP152 | |
| Tris hydrochloride | Fisher BioReagents | BP153 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin-EDTA | Gibco | 25200-072 | |
| Wheat Germ Agglutinin (WGA) conjugated with Alexa Fluor 633 | Invitrogen | W21404 | |
| Xylazine | Dechra Pharmaceuticals | N/A | Sedaxylan |
| Zeiss Axio Observer Z1 | Carl Zeiss Microscopy GmbH | N/A | Inverted fluorescence microscope equiped with an EC Plan-Neofluar 10x/0.30 objective and a Plan-Apochromat 40x/0.95 objective |
| Zeiss Axio Scan.Z1 | Carl Zeiss Microscopy GmbH | N/A | Slide scanner fluorescence microscope equipped with a Plan-Apochromat 20x/0.8 objective |
| Zeiss LSM 710 | Carl Zeiss Microscopy GmbH | N/A | Inverted confocal microscope equipped with a Plan-Apochromat 40x/1.4 Oil DIC objective |
| µ-Slide 8 well Ibidi | Ibidi | 80826 | 8-well chamber slide |
Referenzen
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Front Mol Neurosci. 7, 1-9 (2014).
- Muzyczka, N. Use of Adeno-Associated Virus as a General Transduction Vector for Mammalian Cells. Viral Expression Vectors. 158, 97-129 (1992).
- Goncalves, M. A. F. V Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43(2005).
- Flotte, T. R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 11 (10), 805-810 (2004).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Ojala, D. S., Amara, D. P., Schaffer, D. V Adeno-Associated Virus Vectors and Neurological Gene Therapy. Neuroscientist. 21 (1), 84-98 (2014).
- Saraiva, J., Nobre, R. J., Pereira de Almeida, L. Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. Journal of Controlled Release. 241, 94-109 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods Mol Biol. 807, 47-92 (2011).
- Sonntag, F., Schmidt, K., Kleinschmidt, J. A. A viral assembly factor promotes AAV2 capsid formation in the nucleolus. Proc Natl Acad Sci U S A. 107 (22), 10220-10225 (2010).
- Sonntag, F., et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes. J Virol. 85 (23), 12686-12697 (2011).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol. 78 (12), 6381-6388 (2004).
- Gao, G., Vandenberghe, L. H., Wilson, J. M. New recombinant serotypes of AAV vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The role of the adeno-associated virus capsid in gene transfer. Methods Mol Biol. 437, 51-91 (2008).
- Clark, K. R., Voulgaropoulou, F., Fraley, D. M., Johnson, P. R. Cell lines for the production of recombinant adeno-associated virus. Hum Gene Ther. 6 (10), 1329-1341 (1995).
- Inoue, N., Russell, D. W. Packaging cells based on inducible gene amplification for the production of adeno-associated virus vectors. J Virol. 72 (9), 7024-7031 (1998).
- Liu, X., Voulgaropoulou, F., Chen, R., Johnson, P. R., Clark, K. R. Selective Rep-Cap gene amplification as a mechanism for high-titer recombinant AAV production from stable cell lines. Mol Ther. 2 (4), 394-403 (2000).
- Mathews, L. C., Gray, J. T., Gallagher, M. R., Snyder, R. O. [23] Recombinant adeno-associated viral vector production using stable packaging and producer cell lines. Methods Enzymol. 346, 393-413 (2002).
- Gao, G., et al. Purification of recombinant adeno-associated virus vectors by column chromatography and its performance in vivo. Hum Gene Ther. 11 (15), 2079-2091 (2000).
- Xiao, X., Li, J., Samulski, R. J. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus. J Virol. 72 (3), 2224-2232 (1998).
- Aponte-Ubillus, J. J., et al. Molecular design for recombinant adeno-associated virus (rAAV) vector production. Appl Microbiol Biotechnol. 102 (3), 1045-1054 (2018).
- Smith, R. H., Levy, J. R., Kotin, R. M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells. Mol Ther. 17 (11), 1888-1896 (2009).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Wright, J. F. Transient transfection methods for clinical adeno-associated viral vector production. Hum Gene Ther. 20 (7), 698-706 (2009).
- Yuan, Z., Qiao, C., Hu, P., Li, J., Xiao, X. A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes. Hum Gene Ther. 22 (5), 613-624 (2011).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Hum Gene Ther Methods. 26 (4), 147-157 (2015).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Anderson, R., Macdonald, I., Corbett, T., Whiteway, A., Prentice, H. G. A method for the preparation of highly purified adeno-associated virus using affinity column chromatography, protease digestion and solvent extraction. J Virol Methods. 85 (1-2), 23-34 (2000).
- Okada, T., et al. Scalable purification of adeno-associated virus serotype 1 (AAV1) and AAV8 vectors, using dual ion-exchange adsorptive membranes. Hum Gene Ther. 20 (9), 1013-1021 (2009).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. J Virol Methods. 183 (2), 139-146 (2012).
- Lock, M., et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale. Hum Gene Ther. 21 (10), 1259-1271 (2010).
- Wang, L., Blouin, V., Brument, N., Bello-Roufai, M., Francois, A. Production and Purification of Recombinant Adeno-Associated Vectors. Adeno-Associated Virus: Methods and Protocols. 807, 361-404 (2011).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated Virus Serotypes: Vector Toolkit for Human Gene Therapy. Molecular Therapy. 14 (3), 316-327 (2006).
- Mietzsch, M., Broecker, F., Reinhardt, A., Seeberger, P. H., Heilbronn, R. Differential adeno-associated virus serotype-specific interaction patterns with synthetic heparins and other glycans. J Virol. 88 (5), 2991-3003 (2014).
- McClure, C., Cole, K. L. H., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. JoVE. (57), e3348(2011).
- Auricchio, A., O’Connor, E., Hildinger, M., Wilson, J. M. A single-step affinity column for purification of serotype-5 based adeno-associated viral vectors. Mol Ther. 4 (4), 372-374 (2001).
- Wang, Q., et al. Identification of an adeno-associated virus binding epitope for AVB sepharose affinity resin. Mol Ther Methods Clin Dev. 2, 15040(2015).
- Mietzsch, M., et al. OneBac: platform for scalable and high-titer production of adeno-associated virus serotype 1–12 vectors for gene therapy. Hum Gene Ther. 25 (3), 212-222 (2014).
- Mietzsch, M., et al. Characterization of AAV-specific affinity ligands: consequences for vector purification and development strategies. Mol Ther Methods Clin Dev. 19, 362-373 (2020).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2023).
- Koerber, J. T., Jang, J. -H., Yu, J. H., Kane, R. S., Schaffer, D. V. Engineering adeno-associated virus for one-Step purification via immobilized metal affinity chromatography. Hum Gene Ther. 18 (4), 367-378 (2007).
- Zhang, H. -G., et al. Addition of six-His-tagged peptide to the C terminus of adeno-associated virus VP3 does not affect viral tropism or production. J Virol. 76 (23), 12023-12031 (2002).
- Arnold, G. S., Sasser, A. K., Stachler, M. D., Bartlett, J. S. Metabolic biotinylation provides a unique platform for the purification and targeting of multiple AAV vector serotypes. Mol Ther. 14 (1), 97-106 (2006).
- Rabinowitz, J. E., et al. Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol. 78 (9), 4421-4432 (2004).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Mol Ther. 7 (3), 419-425 (2003).
- Choi, V., McCarty, D., Samulski, R. AAV hybrid serotypes: improved vectors for gene delivery. Curr Gene Ther. 5 (3), 299-310 (2005).
- Nonnenmacher, M., van Bakel, H., Hajjar, R. J., Weber, T. High capsid–genome correlation facilitates creation of AAV libraries for directed evolution. Mol Ther. 23 (4), 675-682 (2015).
- Kimura, K., et al. A mosaic adeno-associated virus vector as a versatile tool that exhibits high levels of transgene expression and neuron specificity in primate brain. Nat Commun. 14 (1), 4762(2023).
- Issa, S. S., Shaimardanova, A. A., Solovyeva, V. V., Rizvanov, A. A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 12 (5), 785(2023).
- Foust, K. D., et al. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27 (1), 59-65 (2009).
- Lopes, M. M., et al. A new protocol for whole-brain biodistribution analysis of AAVs by tissue clearing, light-sheet microscopy and semi-automated spatial quantification. Gene Ther. 29 (12), 665-679 (2022).
- Gray, J. T., Zolotukhin, S. Design and construction of functional AAV vectors. Methods Mol Biol. 807, 25-46 (2011).
- Choi, V. W., Asokan, A., Haberman, R. A., Samulski, R. J. Production of recombinant adeno-associated viral vectors. Curr Protoc Hum Genet. , Chapter 12, Unit 12.9-12.9.21 (2007).
- Bennicelli, J., et al. Reversal of blindness in animal models of leber congenital amaurosis using optimized AAV2-mediated gene transfer. Mol Ther. 16 (3), 458-465 (2008).
- Fischer, M. D., Hickey, D. G., Singh, M. S., MacLaren, R. E. Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods. 27 (4), 150-158 (2016).
- Santos, S. D., et al. Contactin-associated protein 1 (Caspr1) regulates the traffic and synaptic content of α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-type glutamate receptors. J Biol Chem. 287 (9), 6868-6877 (2012).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 7 (1), 122-128 (2003).
- Dong, B., Nakai, H., Xiao, W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther. 18 (1), 87-92 (2010).
- Wright, J. F. AAV empty capsids: For better or for worse. Mol Ther. 22 (1), 1-2 (2014).
- Asaad, W., et al. AAV genome modification for efficient AAV production. Heliyon. 9 (4), e15071(2023).
- Wobus, C. E., et al. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J Virol. 74 (19), 9281-9293 (2000).
- Wistuba, A., Kern, A., Weger, S., Grimm, D., Kleinschmidt, J. A. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol. 71 (2), 1341-1352 (1997).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J Virol Methods. 140 (1-2), 183-192 (2007).
- Brument, N., et al. A versatile and scalable two-step ion-exchange chromatography process for the purification of recombinant adeno-associated virus serotypes-2 and -5. Mol Ther. 6 (5), 678-686 (2002).
- Potter, M., et al. A simplified purification protocol for recombinant adeno-associated virus vectors. Mol Ther Methods Clin Dev. 1, 14034(2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570(2019).
- Yang, Q. -E., et al. Rapid quality control assessment of adeno-associated virus vectors via Stunner. GEN Biotechnology. 1 (3), 300-310 (2022).
- Huang, X., et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 193 (2), 270-277 (2013).
- Salganik, M., et al. Evidence for pH-dependent protease activity in the adeno-associated virus capsid. J Virol. 86 (21), 11877-11885 (2012).
- Dong, B., et al. Proteomics analysis of co-purifying cellular proteins associated with rAAV vectors. PLoS One. 9 (2), e86453(2014).
- Grieger, J. C., Soltys, S. M., Samulski, R. J. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 24 (2), 287-297 (2016).
- Wright, J. Product-related impurities in clinical-grade recombinant AAV vectors: characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Bennett, A., Mietzsch, M., Agbandje-McKenna, M. Understanding capsid assembly and genome packaging for adeno-associated viruses. Future Virol. 12 (6), 283-297 (2017).
- Myers, M. W., Carter, B. J. Assembly of adeno-associated virus. Virology. 102 (1), 71-82 (1980).
- Mingozzi, F., et al. Overcoming preexisting humoral immunity to AAV using capsid decoys. Sci Transl Med. 5 (194), (2013).
- Hoffman, B. E., Herzog, R. W. Covert warfare against the immune system: decoy capsids, stealth genomes, and suppressors. Mol Ther. 21 (9), 1648-1650 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten