Method Article
通过单步法和半自动肝素亲和层析方案分离腺相关病毒载体
* 这些作者具有相同的贡献
摘要
该手稿描述了使用优化的基于肝素的亲和色谱方法生成和纯化腺相关病毒载体的详细方案。它提供了一种简单、可扩展且具有成本效益的方法,无需超速离心。所得载体表现出高纯度和生物活性,证明了它们在临床前研究中的价值。
摘要
腺相关病毒(AAV)已成为一种越来越有价值的 体内 基因递送载体,目前正在进行人体临床试验。然而,纯化AAV的常用方法利用氯化铯或碘克沙醇密度梯度超速离心。尽管这些方法具有优点,但这些方法非常耗时,可扩展性有限,并且通常会导致纯度低的载体。为了克服这些限制,研究人员正在将注意力转向色谱技术。在这里,我们提出了一种优化的基于肝素的亲和层析方案,该方案可作为纯化AAV的通用捕获步骤。
该方法依赖于 AAV 血清型 2 (AAV2) 对硫酸乙酰肝素蛋白聚糖的内在亲和力。具体来说,该方案需要将编码所需 AAV 衣壳蛋白的质粒与 AAV2 的质粒共转染,从而产生结合了两种亲本血清型特性的镶嵌 AAV 载体。简而言之,在生产细胞裂解后,按照使用标准快速蛋白液相色谱 (FPLC) 系统的优化单步肝素亲和层析方案直接纯化含有 AAV 颗粒的混合物。纯化的AAV颗粒随后被浓缩,并在纯度和生物活性方面进行全面表征。该协议提供了一种简化且可扩展的方法,无需超速离心和梯度即可执行,从而产生干净且高病毒滴度。
引言
腺相关病毒(AAV)载体正在成为当前基因治疗研究中最有前途的递送系统之一。AAV 最初于 19651 年被发现,是一种小型无包膜病毒,其二十面体蛋白衣壳直径约 25 nm,含有单链 DNA 基因组。AAV 属于细小病毒科和依赖细小病毒属,因为它们独特地依赖于与辅助病毒(如单纯疱疹病毒或更常见的腺病毒)共同感染以完成其裂解周期 2,3。
AAV 的 4.7 千碱基基因组由两个开放阅读框 (ORF) 组成,两侧是两个倒置末端重复序列 (ITR),形成特征性的 T 形发夹末端4。ITR 是唯一对 AAV 包装、复制和整合至关重要的顺式作用元件,因此是重组 AAV (rAAV) 载体中唯一保留的 AAV 序列。在该系统中,载体生产所需的基因以反式形式单独提供,允许将目的基因包装在病毒衣壳内 5,6。
每个病毒基因通过选择性剪接和起始密码子编码不同的蛋白质。在 Rep ORF 中,编码四种非结构蛋白(Rep40、Rep52、Rep68 和 Rep78),在病毒 DNA 的复制、位点特异性整合和包封中起着至关重要的作用 7,8。Cap ORF 用作在其 N 末端(VP1、VP2 和 VP3)表达彼此不同的三种结构蛋白的模板,这些结构蛋白以 1:1:10 的比例组装形成 60 聚体病毒衣壳 4,9。此外,嵌套在 Cap 基因中的替代 ORF 具有非常规 CUG 起始密码子,编码组装激活蛋白 (AAP)。这种核蛋白已被证明与新合成的衣壳蛋白 VP1-3 相互作用并促进衣壳组装10,11。
衣壳氨基酸序列的差异导致了 11 种天然存在的 AAV 血清型和从人类和非人类灵长类动物组织中分离出的 100 多种变体 7,12,13。结构可变区域构象的变化决定了来自不同菌株的衣壳的不同抗原特性和受体结合特异性。这导致不同哺乳动物器官的不同组织趋向性和转导效率14.
rAAV的早期生产方法依赖于腺病毒感染作为辅助目的15,16,17,18,19。尽管这种感染效率高且通常易于大规模生产,但这种感染仍会出现一些问题。即使在纯化和热变性步骤灭活之后,腺病毒颗粒仍可能存在于AAV制剂中,构成不必要的安全性问题20。此外,变性腺病毒蛋白的存在对于临床使用是不可接受的。其他生产策略利用重组单纯疱疹病毒株,这些病毒株经过工程改造,可将 Rep/Cap 和转基因带入靶细胞21 或杆状病毒-昆虫细胞系统22。尽管这些系统在可扩展性和GMP兼容性方面具有优势,但它们仍然面临类似的问题。
用于 rAAV 生产的三重转染方法已被普遍采用,以轻松克服这些问题。简而言之,rAAV 组装依赖于具有三个质粒的细胞的瞬时转染,这些质粒编码:1) 来自野生型 AAV2 基因组 (pITR) 的 ITR 之间的转基因表达盒;2) 复制和病毒粒子组装所需的 Rep/Cap 序列 (pAAV-RC);3)最小的腺病毒蛋白(E1A、E1B、E4和E2A)以及辅助效应(pHelper)所需的腺病毒病毒相关RNA(6,20,23)。虽然质粒转染方法在临床前研究中为rAAV生产提供了简单性和灵活性,但当应用于大规模生产时,这些程序在可扩展性和可重复性方面存在局限性。作为一种替代方法,rAAV 生产可以通过使用 AAV 生产细胞系(贴壁和悬浮生长)来实现,稳定表达 AAV Rep/Cap 基因或 Rep/Cap 与载体构建体结合。在这些系统中,腺病毒辅助基因是通过质粒转染引入的。尽管这种策略提高了细胞培养过程的可扩展性,但它在技术上既复杂又耗时 21,24,25。
在任何一种情况下,生产细胞随后被裂解并进行一个或多个纯化步骤。目前,纯化rAAVs的主要方法包括使用氯化铯(CsCl)或碘克沙醇进行超高速密度梯度离心,然后或不使用色谱技术26。原始的病毒沉淀纯化方案使用硫酸铵,然后通过CsCl梯度进行两轮或三轮超速离心。该工艺的主要优点包括可以纯化所有血清型,并且能够根据其不同的密度从空衣壳中物理分离全颗粒。然而,这种方法复杂、耗时且可扩展性有限,往往导致产量低和样品质量低下 27,28,29,30。此外,由于 CsCl 可能对哺乳动物产生毒性作用,因此在体内研究之前通常需要对生理缓冲液进行透析。
碘克沙醇还被用作替代等渗梯度培养基来纯化 rAAV 载体,从安全性和载体效力的角度来看,碘克沙醇比 CsCl 更具优势。然而,与 CsCl 一样,碘克沙醇方法存在一些与细胞培养裂解物的负载能力相关的缺点(因此也存在 rAAV 纯化的可扩展性),并且它仍然是一种耗时且昂贵的方法30,31。
为了克服这些限制,研究人员将注意力转向了色谱技术。在这方面,已经开发了几种纯化方法,这些方法要么结合了亲和、疏水或离子交换色谱方法。这些方法依赖于特定血清型的生化特性,包括它们的天然受体,或病毒颗粒的电荷特性32。例如,AAV2、AAV3、AAV6 和 AAV13 优选与硫酸乙酰肝素蛋白聚糖 (HSPG) 结合的发现,为在亲和层析纯化中使用密切相关的肝素提供了可能性。然而,与HSPG的结合位点可能因血清型而异,以不同的方式介导AAV附着和靶细胞的感染2,33,34,35,36。另一方面,AAV1、AAV5 和 AAV6 与 N-连接的唾液酸 (SA) 结合,而 AAV4 使用 O 连接的 SA 2,14,34。遵循相同的原理,还基于粘蛋白(一种在 SA37 中高度富集的哺乳动物蛋白质)的使用开发了用于纯化 rAAV5 的单步亲和色谱方案。与基于肝素的技术一样,这种纯化也取决于所产生的特定血清型。除肝素和粘蛋白外,还探索了其他配体用于亲和层析,例如 A20 单克隆抗体和骆驼类单域抗体(AVB Sepharose 和 POROS CaptureSelect)22,23,38,39,40,41。改进先前现有纯化方法的其他创新策略包括在 rAAV 衣壳中引入小修饰以呈现特定的结合表位。例如,可以使用靶向这些表位的配体(分别为次氮基三乙酸镍和亲和素树脂)纯化六组氨酸标记或生物素化的 rAAV 42,43,44。
为了扩大rAAVs的预期特性,研究人员通过混合它们的衣壳来杂装病毒粒子。这是通过在生产过程中以等摩尔或不同比例提供来自两种不同AAV血清型的衣壳基因来实现的,从而产生由来自不同血清型的衣壳亚基混合物组成的衣壳结构34,45,46,47,48,49,50.先前的研究提供了物理证据,表明 AAV2 与 AAV1(1:1 比例)和 AAV2 与 AAV9(1:1 比例)共表达衣壳蛋白可分别产生镶嵌 rAAV1/2 和 rAAV2/9 载体45、46、48。产生花叶 rAAV 的一个主要好处是能够整合来自不同 AAV 血清型的有利性状,从而协同改善转基因表达和趋向性,同时保持 rAAV 生产过程中有用的其他特性。有趣的是,某些花叶变体甚至表现出与亲本病毒不同的新特性 46,47,49。通过利用 AAV2 的肝素结合能力,通过将 AAV2 与定向进化和/或合理设计产生的其他天然或新 AAV 衣壳混合,有可能产生和纯化镶嵌 rAAV 载体。尽管如此,以前的研究强调了在尝试组装镶嵌载体时衣壳亚基兼容性的重要性。例如,Rabinowitz 及其同事证明,尽管 AAV1、AAV2 和 AAV3 的转囊化导致了花叶衣壳的有效共组装,但这些血清型与 AAV4 的杂交阻碍了稳定病毒粒子的产生 34,45,47。此外,AAV1、AAV2 和 AAV3 与 AAV5 的相容性较低,因为以不同比例混合这些衣壳时获得的病毒滴度降低。有趣的是,镶嵌 rAAV2/5 显示出肝素结合特性降低,同时保持了与亲本 AAV5 一样的粘蛋白结合能力。然而,rAAV3/5 以 3:1 的比例保留了与肝素和粘蛋白的双重结合。总体而言,具有增强转导、特异性趋向性或低免疫原性的新镶嵌 rAAV 的生成可以从我们对衣壳组装和受体相互作用的理解中受益匪浅,而特定组合仍需要深入的研究和优化。
在本工作中,我们描述了使用优化的肝素亲和色谱法生产和纯化rAAVs的分步方案。rAAV 通过瞬时转染产生,并使用快蛋白液相色谱 (FPLC) 系统进行纯化。在对选定的纯化馏分进行浓缩后,所得病毒储备液在体外和体内的滴度、纯度、特性物理性质和生物活性方面进行了表征。作为概念验证,我们展示了该协议在生成镶嵌 rAAV1/2 和 rAAV2/9 载体方面的改进和适用性。每种血清型的选择都是基于它们截然不同的趋向性,这可能也赋予了马赛克版本独特的特征。AAV 血清型 1 对中枢神经系统 (CNS) 具有总体中等趋向性,具有转导神经元和神经胶质细胞的能力(在较小程度上),并在体内顺行和逆行方向进行轴突转运 2,7,8。此外,AAV 血清型 9 因其在新生儿和成年小鼠中具有穿过血脑屏障并靶向中枢神经系统的自然能力51,52。最后,鉴于 AAV 血清型 2 能够与肝素结合,因此选择其亲和层析33。纯化的 rAAV1/2 和 rAAV2/9 颗粒结合了两种亲本 AAV 血清型的特性,因此构成了 CNS 转导的合适载体 45,46,48,49。
研究方案
注意:请参阅 图 1 中总结协议的插图。有关本协议中使用的所有材料、仪器和试剂的详细信息,请参阅 材料表 。所有涉及细胞和病毒的工作都应在专用的生物安全柜和培养箱中进行,与通常用于维持细胞系的柜子和培养箱分开。与培养细胞和病毒接触的设备和试剂应该是无菌的。必须按照材料安全数据表以及每个机构的环境、健康和安全办公室提供的国家法律和指南对被病毒污染的有害试剂和材料进行处置。截至 2019 年 4 月,美国国立卫生研究院 (NIH) 涉及重组或合成核酸分子的研究指南将所有 AAV 血清型以及重组或合成 AAV 构建体归类为风险组 1 病原体(与健康成年人的疾病无关)。当转基因不编码可能致瘤的基因产物或毒素,并且构建体是在没有辅助病毒的情况下产生的,则这种分类适用。
所有涉及动物的实验均按照欧盟共同体关于实验动物护理和使用的指令(2010/63/EU)进行,该指令于2013年被纳入葡萄牙法律(第113/2013号法令)。此外,动物程序还获得了科英布拉大学医学院动物福利责任组织以及科英布拉大学神经科学和细胞生物学中心许可的动物设施的批准。研究人员接受了足够的培训(FELASA认证课程)和葡萄牙当局(Direcção Geral de Alimentação e Veterinária,葡萄牙里斯本)的认证,以进行实验。
1. 质粒构建体
- 按照制造商的 maxiprep 无内毒素试剂盒说明,分离和纯化以下质粒的大量 DNA:i) pITR:目标转移载体;ii) pAAV-RC 质粒:pRV1,包含 AAV2 Rep 和 Cap 序列36;iii) pAAV-RC质粒:pH21,包含AAV1 Rep 和 Cap 序列36;iv) pAAV-RC质粒:pAAV2/9n,包含AAV2 Rep 和AAV9 Cap 序列;v) pHelper:pFdelta6,腺病毒-辅助质粒36。
- 通过执行推荐的酶限制来筛选生成的质粒的完整性36.通过使用 SmaI(一种限制性核酸内切酶)消化来监测 pITR 质粒的完整性,该内切酶在 ITR 的不稳定部分内切割两次53,54。
注意:由于 ITR 高度不稳定且易缺失,因此建议使用 SURE 2 超感受态细胞以尽量减少这些位点的重组。
2. 细胞培养
- 在含有5%CO2的潮湿气氛下,在Dulbecco改良的Eagle培养基(DMEM)高葡萄糖中稳定表达SV40大T抗原(HEK293T)细胞系的人胚胎肾293,在37°C下,作为后续步骤的起点。
- 使用无菌 1x 磷酸盐缓冲盐水 (PBS)(pH 7.4)对细胞进行传代培养,以洗涤细胞,然后加入 0.05% 胰蛋白酶-乙二胺四乙酸 (EDTA)。
注意:避免使用传代次数过多(最多 20 次)的细胞。定期检测细胞培养物的支原体污染。
3. 通过瞬时转染产生 rAAV
- 第 1 天:细胞铺板
- 对于每种病毒产生,在转染前一天将HEK293T细胞接种到 10 个处理过的培养皿(直径 15 cm)中,密度为 10.5 × 106 个细胞,每培养皿在 22 mL 补充培养基中孵育 24 小时,直到细胞汇合 70%-80% 并准备好转染。
- 第 2 天:使用聚乙烯亚胺 (PEI) 进行细胞转染
- 对于每种病毒产生(相当于 10.5 个培养皿),在微量离心管中设置以下转染混合物:54.6 μg pITR;45.675μgpRV1;45.675μgpH21或pAAV2 / 9n;109.2μgpFdelta6。通过敲击混合。
- 在 50 mL 离心管中将混合物加入 4.557 mL 未补充的 DMEM 中。通过敲击混合。
- 逐滴加入 1.365 mL 无菌 PEI 溶液,浓度为 1 mg/mL (pH 7.4)。通过敲击混合。在室温下孵育 10 分钟,以形成 DNA-PEI 复合物。
- 将该混合物加入 231 mL 预热的补充 DMEM 中。用 22 mL 该转染混合物替换每个培养皿的整个培养基。将细胞孵育48小时。
注意:此步骤必须小心执行,以避免细胞脱离。
- 第 4 天:细胞收获
- 当 pITR 编码荧光报告基因时,在荧光显微镜下观察转染细胞。
- 将每个培养皿中的培养基收集到 50 mL 离心管中,并以 800 × g 离心 10 分钟。丢弃上清液。
注意:此步骤是可选的,旨在恢复可能由于汇合度非常高而脱落的转染细胞。 - 向每个板中加入 10 mL 预热的 PBS。用细胞刮刀轻轻取出细胞,并将悬浮液收集到步骤 3.3.2 中的 50 mL 离心管中。
- 一次用额外的 10 mL PBS 洗涤 5 个培养皿,并将悬浮液转移到步骤 3.3.3 中的 50 mL 离心管中。以 800 × g 沉淀细胞 10 分钟并弃去上清液。
- 将细胞沉淀在-80°C下冷冻。
注意:细胞沉淀可储存数月(暂停点)。
4. rAAV提取和FPLC纯化
- 第 5 天:细胞裂解物制备
- 在室温下解冻细胞沉淀。将从 10 个培养皿中收集的细胞重悬于 100 mL 含有 150 mM 氯化钠 (NaCl) 和 20 mM Tris(pH 8.0)的超纯(I 型)水中。通过上下移液混合悬浮液,以确保均匀的悬浮液。
- 在超纯水中加入 12.5 mL 新鲜制备的 10% 脱氧胆酸钠无菌溶液,以诱导细胞裂解。通过上下移液进行混合。
注意: 根据材料安全数据表和机构环境健康与安全办公室提供的指南处理脱氧胆酸钠以及与其接触的材料。还建议在处理这种粉末时戴上口罩。混合后,溶液变得高度粘稠。 - 向先前的混合物中加入 27 μL 苯佐酶核酸酶。通过上下移液彻底混合,直到样品不再粘稠。在37°C孵育1小时,每10分钟进行一次涡旋。
注意:这种核酸内切酶能够有效地降解所有形式的 DNA 和 RNA,而不会表现出任何蛋白水解活性。 - 通过在25°C下以3,000× g 离心混合物60分钟来去除细胞碎片。 用0.45μm无菌聚偏二氟乙烯(PVDF)注射器过滤器过滤上清液,并将其转移到新的无菌容器中。
注意:这一重要步骤可确保去除大部分细胞碎片,从而防止色谱柱堵塞。保存该混合物的一小份等分试样用于分析(可选步骤)。
- 第 5 天(续):rAAV 的肝素柱纯化
注:样品应用可以使用样品泵或 50 mL 或 150 mL 超级循环作为系统的一部分进行。由于更多的空气在较低温度下溶解,因此在FPLC系统中使用缓冲液和溶液(通常储存在4°C)之前,必须留出足够的时间适应室温。- 可选:如果系统已长时间储存,请使用手动说明或预定义的系统就地清洁(系统 CIP)方法用新鲜制备的储存溶液(20% 乙醇)填充系统和所有入口。
- 使用手动说明或预定义的系统 CIP 方法,使用无菌超纯水完全清洗液体流路。
- 连接 1 mL 预填充肝素柱,设置压力警报,并以 1 mL/min 的流速用 5 柱体积 (CV) 的超纯水洗涤。
- 将缓冲液托盘中的溶液从超纯水切换到入口 A(系统泵 A)的缓冲液 A(100 mM NaCl 和 20 mM Tris,pH 8,在超纯水中的无菌溶液),以及入口 B(系统泵 B)的缓冲液 B(500 mM NaCl 和 20 mM Tris,pH 8,超纯水中的无菌溶液)。如果系统有样品泵,则将样品入口阀的缓冲液入口置于缓冲液 A 中。
- 用缓冲液 B 清洗系统泵 B,并用缓冲液 A 填充剩余的液体流路。
注意:如有必要,请断开色谱柱与流路的连接,然后重新连接。 - 从样品入口阀(例如S1)将样品入口管插入装有步骤4.1.4中获得的病毒制剂的容器中。(来自细胞裂解物制备)。用样品溶液灌注从样品入口 S1 到进样阀的流路。或者,使用 50 mL 注射器将含有 rAAV 的样品填充 50 mL 或 150 mL 超级循环。
- 使用 12.5% 的缓冲液 B 以 1 mL/min 的速率平衡总体积为 5 个 CV 的色谱柱。
- 使用样品泵(选择 使用空气传感器注入所有样品)或超级循环以 0.5 mL/min 的速度将样品的总体积施加到色谱柱中,并使用出口在新的无菌容器中收集流出物。
注意: 当启用防止 超压的流量控制 功能时,如果色谱柱堵塞,流量将自动减少。如果流速明显低于 0.5 mL/min,则停止样品应用,用 2-5 CV 缓冲液 A 进行洗涤,然后恢复样品应用。 - 用 20 CVs 缓冲液 A 以 1 mL/min 的速度洗涤色谱柱,使用出口收集流出物。
- 使用以下方案以 1 mL/min 洗脱样品:i) 线性梯度,目标缓冲液 B 为 50%,用于 5 个 CV;ii) 在五次 CV 期间,目标缓冲液 B 为 90%;iii) 在五次 CV 期间以 100% 缓冲液 B 为目标步骤。
- 使用馏分收集器和低保留微量离心管(2mL)收集1mL馏分中的洗脱样品,并将其储存在-20°C。
注意:rAAV 分数可以储存数周(暂停点)。 - 用 12.5% 的缓冲液 B 以 1 mL/min 的速度重新平衡色谱柱,获得 5 个 CV。
- 将缓冲溶液的入口切换到超纯水,并以 1 mL/min 的速度洗涤色谱柱 5 CV。
- 将入口从超纯水切换到20%乙醇,并以1 mL / min洗涤色谱柱五次CV。 断开色谱柱并将其储存在4°C。
注:如果使用相同的 rAAV 血清型和转基因,则色谱柱可以重复使用多次,而无需任何其他主要的清洁和消毒程序。 - 使用手动说明或预定义的系统 CIP 方法用 20% 乙醇完全清洗液体流路。
5. 纯化rAAVs的浓度
- 第 6 天:专注第 1 步
- 使用 15 mL 离心过滤装置浓缩 rAAV,截留分子量为 100 kDa。将含有 rAAV 的所需馏分(FPLC 馏分 7 至 16)加载到 15 mL 离心过滤装置中,并在室温下以 2,000 × g 离心 2 分钟。确保过滤器单元中的浓缩体积约为 500 μL。如果浓缩体积大部分超过 500 μL,则以 1 分钟的间隔重复离心步骤,直至达到所需体积。
- 第 6 天(续):缓冲液置换
- 将 1 mL 无菌 PBS 添加到含有 rAAV 的离心过滤装置中。小心地上下移液以清洗过滤器。以 2,000 × g 的间隔以 1 分钟的速度离心,直至达到 500 μL 的最终体积。
- 第 6 天(续):专注第 2 步
- 将上一步获得的 500 μL 浓缩 rAAV 转移到截留分子量为 100 kDa 的 0.5 mL 离心过滤装置中,并以 6,000 × g 离心 1 分钟。如有必要,重复离心步骤,直到达到小于 100 μL 的最终体积。
- 第 6 天(续):恢复
- 为了回收浓缩的 rAAV,将过滤装置倒置在新的微量离心机收集管中。将试管放入微量离心机中,盖子朝向中心,并在流速室内进行长时间旋转,以将浓缩的 rAAV 从设备转移到微量离心管。或者,以 1,000 × g 离心 2 分钟。
- 补充无菌 Pluronic F-68 0.001%(可选)。
注:Pluronic F-68 是一种非离子表面活性剂,被美国食品和药物管理局批准用于人类,能够通过防止它们与稀释制备、注射器装载和输送设备中使用的材料(塑料)表面的相互作用来减轻 rAAV 的损失55,56。 - 将rAAV分装到低保留微量离心管中,并储存在-80°C(暂停点)。
6. 纯化 rAAV 的定量
- 第 6 天(续):使用商业试剂盒并按照制造商的说明,通过实时定量聚合酶链反应 (RT-qPCR) 确定在病毒基因组/μL (vg/μL) 中表达的 rAAV 制剂的滴度。
- 将rAAV颗粒溶液与DNase I在37°C孵育20分钟。
注:此程序可促进源自宿主细胞的游离基因组DNA和质粒DNA的消化,从而确保仅保留完整rAAV颗粒内的核酸序列。 - 在95°C下热灭活DNase I10分钟。
- 加入裂解缓冲液并在70°C下孵育10分钟,以促进rAAV颗粒蛋白质的热变性。
- 在进行 RT-qPCR 之前,在稀释缓冲液中稀释获得的 rAAV 基因组溶液。 制备一组连续稀释的阳性对照标准品(从 2 × 107 vg/μL 到 2 × 102 vg/μL),随试剂盒提供。
- 进行含有 12.5 μL Taq II 混合物、0.5 μL 稀释引物混合物、7 μL 水和 5 μL 稀释 rAAV DNA(未知 AAV 样品和步骤 6.1.4 中的标准品)的反应混合物。
- 在实时荧光定量PCR检测系统中执行RT-qPCR,使用以下方案:在95°C下进行1个循环2分钟(初始变性),在95°C下进行40个循环5秒(变性)和60°C下进行30秒(退火,延伸和板读数),然后进行熔解曲线分析。
- 根据标准曲线(线性回归线)计算绝对样品浓度,同时考虑 rAAV 样品制备产生的稀释因子。
注:病毒基因组数量的定量是通过扩增AAV2的ITR序列(试剂盒提供的引物的靶序列)来实现的。
- 将rAAV颗粒溶液与DNase I在37°C孵育20分钟。
7. SDS-PAGE、考马斯蓝染色和蛋白质印迹
- 通过加入6x样品缓冲液(0.5M Tris-HCl / 0.4%十二烷基硫酸钠(SDS)pH 6.8,30%甘油,10%SDS,0.6M二硫苏糖醇(DTT),0.012%溴酚蓝)并在95°C下孵育5分钟,使每个样品(每个FPLC级分;流出;柱前样品,以及总共2.3×10 10vg 最终浓缩产物)变性40μL。
- 将变性样品(48μL)加载到SDS-聚丙烯酰胺凝胶(4%堆积和10%分离凝胶)中,并在100V下进行电泳分离70分钟,靠近蛋白质分子量标准。
- 蛋白质分析
注:可以进行考马斯蓝染色或蛋白质印迹。- 考马斯蓝染色
- 为了可视化蛋白质条带,用溶解在50%甲醇和10%冰醋酸中的0.25%考马斯蓝G250溶液将凝胶染色10分钟。
- 用含有25%甲醇和5%冰醋酸的溶液洗涤数次进行凝胶脱色,直到看到低背景的透明条带。
- 使用适当的成像系统捕获图像。
- 蛋白质印迹
- 根据标准方案将蛋白质转移到 PVDF 膜上。
- 通过在TBS-T(0.1%吐温20在Tris缓冲盐水中稀释)稀释的5%脱脂牛奶中孵育1小时来封闭膜,在室温下。
- 使用以下一抗(在封闭溶液中稀释)在4°C下孵育过夜:小鼠单克隆抗AAV,VP1,VP2,VP3抗体(B1,1:1,000)或小鼠单克隆抗AAV,VP1,VP2抗体(A69,1:1,000)。
- 在 TBS-T 中洗涤膜 3 x 15 分钟,并与碱性磷酸酶连接的山羊抗小鼠二抗 (1:10,000) 在室温下孵育 2 小时。
- 在 TBS-T 中洗涤膜 3 x 15 分钟。添加增强型化学荧光底物 (ECF) 并通过化学荧光成像可视化蛋白质条带。
- 考马斯蓝染色
8. 透射电子显微镜(TEM)
- 将 Formvar 碳涂层的 200 目网格倒置在一滴 rAAV 样品的顶部,并使其沉淀 1 分钟。
- 用一滴水清洗网格,然后用滤纸擦干多余的液体。
- 用1%醋酸铀酰溶液(pH 7)对网格进行负染1分钟,以固定和对比病毒颗粒。
- 用一滴水清洗网格,然后用滤纸擦干多余的液体。
- 在透射电子显微镜中检查样品。
注:高盐浓度可能会直接影响rAAVs与网格的结合,并导致晶体状结构的可视化。
9. 连续紫外-可见光吸收、静态光散射、动态光散射分析
- 在 96 孔定量板上,加载 2 μL rAAV 样品和 2 μL PBS 用作缓冲液空白(一式两份)。
- 在客户端分析软件中使用 AAV Quant 应用程序,将样品名称放在板的正确位置,选择 AAV 血清型,然后单击 下一步。
- 将 96 孔定量板加载到专用设备中,然后继续进行板读取以进行数据采集。
10. 体外 转导试验
- 不同的细胞系可用于快速分析rAAVs的转导效率。
- 将HEK293T细胞均匀接种在 24 孔板(密度为 137,500 个细胞/孔)中,并将小鼠神经母细胞瘤-2A (Neuro2a) 细胞系均匀接种在 24 孔板(50,000 个细胞/孔)或 8 孔室载玻片中,使用 DMEM 高葡萄糖,补充有 10% 胎牛血清和 1% 青霉素 - 链霉素,如上所述。让细胞在含有5%CO2的潮湿气氛中在37°C下粘附过夜。
- 从每个孔中收集条件培养基(24孔板250μL,8孔室载玻片50μL),并将其储存在4°C以备后用。
- 向每个孔中加入以下rAAV制剂,并将细胞在37°C的5%CO2 气氛中孵育24小时。
- 加入 50 μL FPLC 收集的馏分 F2-F16 并流入接种在 24 孔板中的HEK293T细胞中。
- 将总共 5.5 × 109 vg 在 50 μL PBS 中稀释的浓缩 rAAV 添加到接种在 24 孔板中的 Neuro2a 细胞中(包括阴性对照孔,通过向细胞中加入 50 μL PBS)。
- 将总共 2.75 × 109 vg 在 25 μL PBS 中稀释的浓缩 rAAV 添加到接种在 8 孔室载玻片中的 Neuro2a 细胞中(包括阴性对照条件,通过向细胞中加入 50 μL PBS)。
- 将先前储存的条件培养基(步骤10.1.2)添加到每个孔中,并孵育24小时。
- 弃去培养基并用 PBS 洗涤细胞 2 次。
- 向每个孔中加入4%多聚甲醛(PFA)溶液,补充有4%蔗糖的PBS,预热至37°C,并在室温下孵育20分钟。
- 用PBS洗涤2次,并储存在4°C下,直到进行成像(暂停点)。
- 在配备 10x/0.30 物镜的倒置荧光显微镜或配备 40x/1.4 Oil DIC 物镜的倒置共聚焦显微镜上采集图像。
- 为了获得更相关和反映的 体内 环境模型,请按如下方式使用原代神经元培养物:
- 如Santos等人先前所述,制备皮质神经元的原代培养物。57. 简而言之,将 200,000 个细胞/mL 接种到 12 孔板中,并在 体外 将其在培养物中维持至白天 16.
- 从每个孔(100μL)收集条件培养基,并将其储存在4°C以备后用。
- 将待测的 rAAV 添加到每个孔中:总共 2.75 × 109 vg 浓缩的 rAAV 稀释在 25 μL PBS 中(包括阴性对照:25 μL PBS)。在37°C的5%CO2 气氛中孵育24小时。
- 加入先前储存的条件培养基并孵育 24 小时。
- 丢弃每个孔中的培养基,并用 PBS 洗涤 2 次。
- 如步骤10.1.6所述,用PBS中的4%PFA / 4%蔗糖固定细胞。用 PBS 洗涤 2 次。
- 在室温下用 5 μg/mL 与 Alexa Fluor 633 偶联的小麦胚芽凝集素 (WGA) 孵育每个孔 10 分钟(可选步骤:改为进行免疫细胞化学)。用 PBS 洗涤 2 次。
- 在室温下在 PBS 中的 0.25% Triton X-100 中孵育 5 分钟。用PBS清洗。
- 在室温下与 4',6-二脒基-2-苯基吲哚 (DAPI) 孵育 5 分钟。用 PBS 洗涤 2 次。
- 在配备 40x/0.95 物镜的倒置荧光显微镜或配备 40x/1.4 Oil DIC 物镜的倒置共聚焦显微镜上采集图像。
11. 体内 实验
注意:动物被饲养在温度受控的房间里,保持12小时的光/暗循环。食物和水是 随意提供的。我们尽一切努力将动物的痛苦降到最低。
- 小脑立体定向注射
- 通过在连接到蒸发器的腔室中,在氧气(0.8L / min)存在下吸入2%异氟醚来麻醉9周龄的C57BL / 6动物。
- 将麻醉的动物置于立体定位装置(在35°C加热的垫上)中,并将异氟烷面罩放入动物的鼻子中。将异氟烷水平降至1.3-1.7%。
注意:在继续进行之前,请确保动物已正确麻醉(双后肢屈曲反射丧失)。 - 涂抹润滑剂眼膏以避免角膜干燥,并给动物注射经批准的镇痛药。
注意:所有后续步骤必须在无菌条件下进行。 - 剃掉动物头部的皮毛并对手术区域进行消毒后,暴露颅骨并将连接到 10 μL Hamilton 注射器的 30 G 钝尖注射针的尖端直接放在囟骨上(使用囟作为零来计算立体定位坐标)。
- 将针头移动到预定的坐标,并在头骨上钻一个孔,针头将进入该孔。
注意:在这项研究的框架内,在小脑中央进行单次注射。 - 使用自动注射器以 0.5 μL/min 的输注速率注射 4 μL 含有总共 8 × 109 vg 的 rAAV 溶液,在 PBS 中稀释。使用以下坐标,从前乳计算,在成年C57BL / 6小鼠的小脑中央进行单次注射:前后:-6.5mm;横向:0 mm;腹侧:-2.9毫米。
注意:这些坐标可能会根据小鼠品系、性别和所用动物的年龄而有所不同。 - 为了尽量减少回流并允许病毒载体扩散,一旦输注完成,将注射器针头留在这些坐标处3分钟,然后缓慢地将其缩回0.3mm,并让它保持在原位2分钟,然后再从小鼠大脑中完全取出。
- 闭合切口并用消毒剂(例如 10% 聚维酮碘)清洁。
- 让动物从麻醉中恢复过来,然后再将它们送回家笼子。
- 组织采集和制备
注意:在该实验中,在注射后 12 周观察转导水平,但相同的程序可以在注射后 4 周进行评估。- 通过腹膜内给予过量的甲苯噻嗪/氯胺酮(8/160mg / kg体重)对动物进行终末麻醉。
- 以 2.5 mL/min 的速率用冰冷的 PBS 经心灌注动物 6 分钟,然后用新鲜制备的冰冷的 4% PFA 溶液以相同的速率灌注 10 分钟。
- 在室温下将切除的大脑置于 4% PFA 中过夜,然后将它们转移到 25% 蔗糖/PBS 溶液中进行冷冻保护。一旦大脑下沉(约48小时后),将它们储存在-80°C。
- 在-21°C下使用低温恒温器切割厚度为30μm的连续矢状切片。 对于每只动物,在解剖系列中收集脑半球的96个矢状切片作为补充有0.05%叠氮化钠的PBS中的自由浮动切片。储存在4°C直至进一步加工。
- 标准荧光免疫组化
- 每只动物选择八个矢状切片,彼此相距 240 μm。
- 在室温下将自由浮动部分在封闭/透化溶液(0.1%Triton X-100,含有10%正常山羊血清(NGS)的PBS溶液)中孵育1小时。
- 将切片在4°C下用鸡多克隆抗GFP一抗(1:1,000)孵育过夜。
- 在 PBS 中洗涤 3 x 15 分钟,并在室温下将切片与与 Alexa Fluor 488 荧光基团 (1:200) 偶联的二抗山羊多克隆抗鸡抗体孵育 2 小时。
- 在 PBS 中洗涤 3 x 15 分钟。在室温下与DAPI孵育5分钟。
- 在 PBS 中洗涤 3 x 15 分钟。将切片放入明胶包被的载玻片中,并用荧光封固剂盖玻片盖玻片。
- 在配备 20x/0.8 物镜的载玻片扫描仪荧光显微镜上采集图像。
结果
在这项工作中,我们提出了用于花叶 rAAV 的生产、纯化和表征的详细方案( 如图 1 中总结),其具有靶向和转导中枢神经系统(例如 AAV1 和 AAV9),同时适用于肝素亲和色谱纯化 (AAV2)。为了实现这一目标,使用来自天然 AAV 血清型 1、2 和 9 的衣壳来开发镶嵌 rAAV1/2 和 rAAV2/9 载体。
在开始之前,对质粒制备物进行结构完整性筛选。除了验证克隆片段正确插入所需的酶切外,还必须持续筛选 pITR 质粒以检测潜在的 ITR 缺失/插入。例如,在用限制性内切酶SmaI消化质粒后,监测pITR质粒不同克隆中ITR的完整性(补充图S1)。
根据标准转染方法,两种类型的镶嵌载体均通过以 1:1 的比例共转染各自的 AAV 衣壳质粒产生6。简而言之,HEK293T细胞转染 i) 一种含有填充在 ITR (pITR) 序列之间的目的转基因的质粒,ii) 含有 AAV2 和 AAV1 或 AAV9 的野生型 AAV 基因组 Rep 和 Cap ORF(pAAV-RC 质粒)的质粒,以及 iii) 编码腺病毒蛋白(E1A、E1B、E4 和 E2A)的质粒以及辅助功能所必需的腺病毒相关 RNA (pHelper)。48小时后,收获细胞6,36,并使用FPLC系统通过亲和色谱法从细胞匀浆中纯化rAAV。如图2A所示,在色谱柱平衡(平衡步骤)之后,将含有rAAVs的细胞裂解物应用于色谱柱(上样)。由于 rAAV2 对肝素33 具有天然亲和力,因此 rAAV 与色谱柱的树脂结合,而其他组分则在电泳缓冲液中进行并由 UV 监测器(流通)检测,从而导致吸光度增加。随后对色谱柱进行洗涤(洗涤步骤),最后通过增加NaCl浓度(洗脱步骤)洗脱rAAV。通过UV监测仪检测洗脱的病毒,并以1 mL馏分收集。
rAAV1/2 和 rAAV2/9 的代表性洗脱峰曲线分别显示在 图 2B 和 补充图 S2A 中,不同批次的病毒从馏分 F7 开始一直呈现单一峰,直至 F16。rAAV生产的峰高是可变的,峰越高通常会导致rAAV产量越高。随后通过RT-qPCR对产生的rAAV1/2和rAAV2/9的每个部分进行表征,以评估病毒滴度(图2C 和 补充图S2B)。
为了表征洗脱材料的纯度,通过10%SDS-聚丙烯酰胺凝胶电泳检查每个馏分的40μL和相应的流出物(rAAV1/2的图2D 和rAAV2/9的 补充图S2C )。考马斯蓝染色显示 F7-F16 级分中有三个主要条带,分子量对应于 AAV 的 VP1 (87 kDa)、VP2 (72 kDa) 和 VP3 (62 kDa) 衣壳蛋白,适当比例为 1:1:10,如 Van Vliet 及其同事先前所述 14。在这两种情况下,根据紫外线吸光度、RT-qPCR 和凝胶条带强度,很明显,大部分镶嵌 rAAV 存在于组分 F7 和 F8 中,并开始在组分 F9-F16 中逐渐减少。除了三种病毒衣壳蛋白外,在F8-F16级分中还检测到另一种大小约为17 kDa的蛋白质(或蛋白质)。
为了消除这种共纯化蛋白,随后使用 100 KDa 离心过滤装置过滤和浓缩馏分 F7-16,并通过 RT-qPCR 测定最终的 rAAV 滴度(如图 3A、B 所示的 rAAV1/2)。rAAV 生产的最终产量取决于 pITR 的长度和复杂性、ITR 序列的完整性、细胞培养条件(例如细胞传代次数)和转染效率 24,58,59,60,61。尽管如此,可以通过使用 0.5 mL 离心过滤装置(浓缩步骤 2)对 rAAV 制剂进行多次离心来调整最终滴度。按照该方案,对于 50 至 100 μL 范围内的最终体积,浓度通常在 2 × 109 和 5 × 1010 vg/μL(使用参考滴定试剂盒进行定量)之间。
然后在 10% SDS-聚丙烯酰胺凝胶上评估最终 rAAV 制备物的纯度。 如图 3C 所示,在 rAAV1/2 制备中仅观察到代表 rAAVs 衣壳蛋白的三个条带,并且未检测到共纯化蛋白。这些结果与rAAV2/9的结果一致(补充图S2C)。为了确认rAAV1/2和rAAV2/9载体的身份并进一步表征纯度,通过蛋白质印迹法分析病毒组分和浓缩储备液,使用特异性抗体B1(补充图S3A 和 补充图S4A)和A69(补充图S3B 和 补充图S4B)。抗体 B1 可识别大多数 AAV 血清型62 的所有 VP 蛋白共有的 C 端表位,而克隆 A69 仅可识别 VP1 和 VP263 的表位。尽管如此,在 B1 和 A69 标记时也可以检测到一些分子量低于 VP3 (<62 kDa) 的微弱条带。
为了表征rAAVs的结构形态并进一步评估其纯度,通过TEM直接观察病毒颗粒。该技术一直是评估病毒样品中样品完整性和纯度的标准程序,因为它允许量化空的和完整的rAAV颗粒,以及评估样品中的污染29,64,65,66,67。如图 3D 所示,在干净的背景下可以观察到直径为 ~25 nm 的大量 rAAV 颗粒。在整个样品场中也可以观察到具有电子致密中心的空粒子(黑色箭头)以及全向量(白色箭头)。
我们还使用 Stunner 对纯化的 rAAV 进行了质量控制,Stunner 是一种结合了紫外-可见 (UV-Vis) 光谱、静态光散射 (SLS) 和动态光散射 (DLS)68 的平台。对于每个样品,通过紫外-可见光谱法测量蛋白质、ssDNA的总量,以及吸收杂质和背景浊度(图3E 和 补充图S5A)。然后应用SLS和DLS来评估rAAV衣壳的光散射行为。鉴于 AAV 的平均直径为 25 nm,因此 15-45 nm 直径范围内的颗粒被认为是完整的。较大的颗粒通常代表病毒聚集体,而所有较小的颗粒都包含最有可能的小颗粒,包括未组装的衣壳蛋白68。对于rAAV1/2,在30nm处观察到对应于完整衣壳颗粒的单个峰(图3F),聚集体强度为0%,小颗粒强度为0%。对于rAAV2/9制备,在30nm处还检测到一个峰,代表78%的衣壳强度(补充图S5B)。尽管小颗粒强度为0%,但对于该样品,测得的聚集强度为22%(以灰色表示),主要贡献(19.9%)来自平均直径为620nm的大聚集体(补充图S5B)。通过将紫外-可见光谱与SLS和DLS信息相结合,Stunner揭示了两种病毒制剂的总衣壳滴度、完整衣壳滴度、游离和聚集蛋白,以及游离和聚集的ssDNA,如图 3G 和 补充图S5C 所示(具体值显示在每个图例中)。
同时,为了评估开发的镶嵌 AAV 载体的生物活性,用 50 μL 的 rAAV1/2 或 rAAV2/9 制剂的每种 FPLC 获得的级分 (F2-F16) 感染 HEK293T 细胞。由于rAAV1/2载体在CMV启动子(pAAV-CMV-ssGFP)的控制下编码单链绿色荧光蛋白(GFP),而rAAV2/9载体在CMV启动子(pAAV-CMV-scGFP53)的控制下编码自互补GFP,因此在感染后48小时在这些细胞中检查直接GFP荧光(补充图S6 和 补充图S7).与先前对 RT-qPCR、考马斯蓝和蛋白质印迹的观察结果一致,病毒组分 F7 和 F8 的感染性水平最高,组分 F9 至 F16 的感染性逐渐降低。
为了确认超滤和浓缩步骤后 rAAV 的生物活性是否保持,在 24 孔板和 8 孔室载玻片中接种的 Neuro2A 细胞被浓缩的 rAAV1/2 载体感染,在 CMV 启动子的控制下编码 scGFP (pAAV-CMV-scGFP53)。在感染后48小时采集明场和荧光图像(图4A,B用于更高分辨率的图像)。
旨在在更相关和反射的细胞模型中探索产生的 rAAV 的感染能力,将来自皮层的半致密原代神经元培养物接种在 12 孔板上,并用先前使用的 rAAV1/2 - CMV-scGFP 感染。 感染后 48 小时,将细胞固定并用与 Alexa Fluor 633 偶联的 DAPI 和 WGA 标记, 一种广泛使用的凝集素,用于标记固定细胞。图4C,D中显示的图像是使用蔡司Axio Observer Z1和蔡司共聚焦LSM 710采集的。如这些图中通过直接GFP荧光所描绘的那样,浓缩花叶病毒保留了其对神经元细胞的基因转移特性。
在 体外表征了镶嵌 rAAV 的纯度、物理性质和功能性后,我们接下来评估了使用纯化的 rAAV1/2 镶嵌载体转导 C57BL/6 小鼠小脑的可能性。为此,在 9 周龄的小鼠中进行立体定向注射,并在 12 周后评估 GFP 表达。正如预期的那样,注射PBS的动物在GFP免疫标记时没有表现出荧光。在突触蛋白 1 启动子 (rAAV1/2 - Syn-ssGFP) 的控制下注射编码 GFP 的 rAAV1/2 载体的小鼠的落射荧光图像显示,rAAV1/2 载体成功转导了小脑的几个区域,即小脑深核 (DCN) 区域,以及小脑的不同小叶(图 5)。这些结果表明转基因在哺乳动物大脑中的表达延长(12周)。
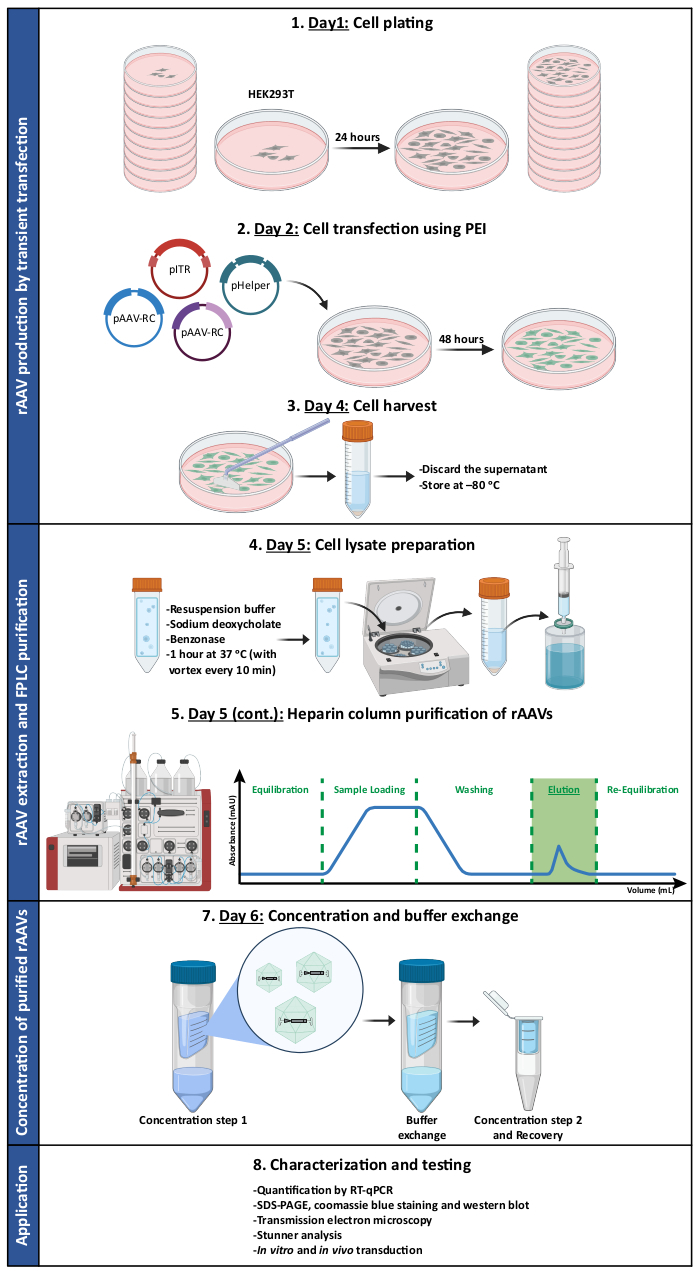
图 1:rAAV 生产和纯化方案的示意图。rAAV 是通过使用聚乙烯亚胺 (PEI) 瞬时转染 HEK293T 细胞产生的。随后,收获并裂解细胞,并通过亲和色谱法从细胞匀浆中纯化 rAAV。然后浓缩收集的含有 rAAV 的馏分,并根据滴度、纯度、形态特征和生物活性对最终病毒储备液进行表征。缩写:rAAV = 重组腺相关病毒;PEI = 聚乙烯亚胺;RT-qPCR = 实时定量聚合酶链反应;SDS-PAGE = 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。 请点击这里查看此图的较大版本.
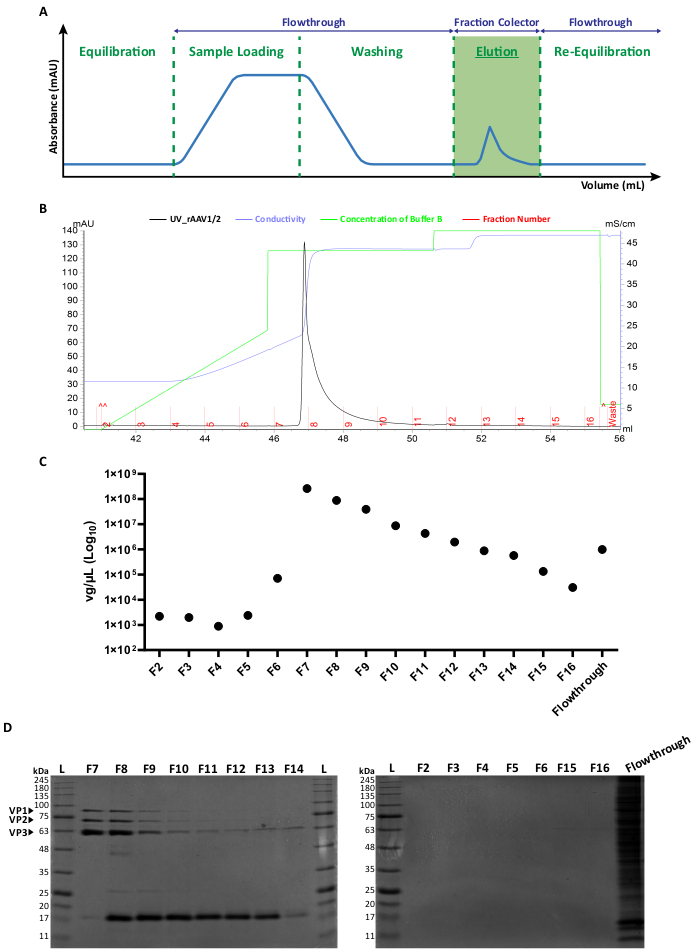
图 2:rAAV1/2 的 FPLC 纯化方案和代表性洗脱曲线。 (A) 完整色谱图的示意图,显示了 rAAV 纯化过程的不同阶段。在色谱柱平衡步骤之后,应用样品。然后洗涤色谱柱,并使用浓度增加的NaCl进行洗脱。收集未结合的材料(流出)和洗脱病毒的 1 mL 馏分进行分析。280nm处的吸光度以mAU表示,x轴表示体积,以mL为单位。(B) 放大的部分色谱图显示 rAAV1/2 洗脱峰(黑色)、相应的馏分号 (F2-F16) 和废液(红色表示)。缓冲液 B 的发出浓度和电导率(以 mS/cm 表示)也分别以绿色和紫色显示。(C) 亲和纯化 (F2-F16) 和流出过程中收集的每种馏分的 RT-qPCR。以 vg/μL 为单位的滴度以对数刻度表示。(D) 收集的病毒组分的SDS-PAGE分析。将洗脱步骤 (F2-F16) 中每个馏分的等体积 (40 μL) 和相应的流出物上样并分离到 10% SDS-聚丙烯酰胺凝胶上。通过考马斯蓝染色观察蛋白质条带。对应于 AAV 衣壳蛋白 VP1、VP2 和 VP3 的条带被指示。标准蛋白质大小分子量标准指定为 (L),并且还标明了相应的分子量。缩写:rAAV = 重组腺相关病毒;RT-qPCR = 实时定量聚合酶链反应;SDS-PAGE = 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。 请点击这里查看此图的较大版本.
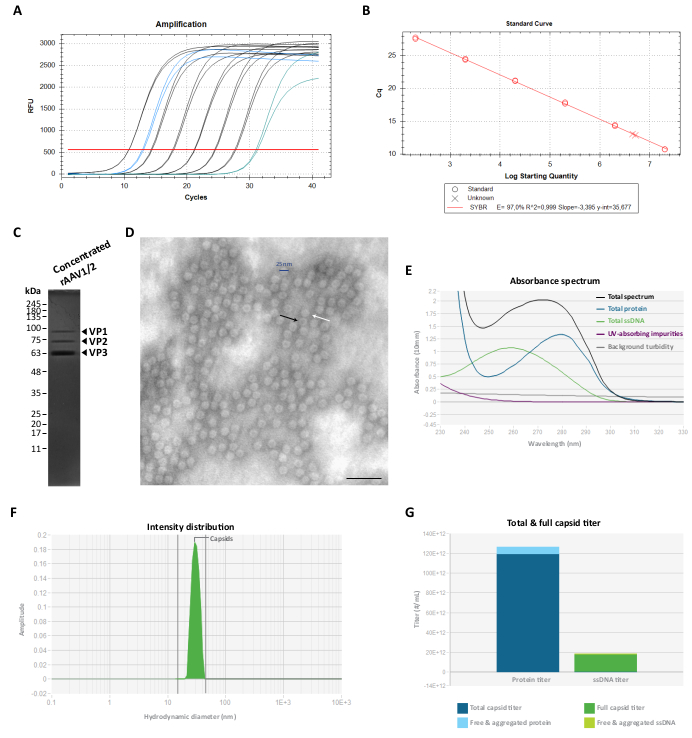
图 3:浓缩 rAAV1/2 载体的表征。 (A) 浓缩 rAAV1/2 样品(蓝色)、2 × 10 7 vg/μL 至 2 × 102 vg/μL(黑色)和无模板对照(绿色)的扩增曲线,在 RT-qPCR 期间获得。 (B) 测定 rAAV 样品滴度的标准曲线(线性回归),单位为 vg/μL。)浓缩病毒颗粒的SDS-PAGE分析。总共有2.3 × 1010 vg的浓缩原液汇集在凝胶上。(D)直径~25-30 nm的rAAV1/2颗粒的透射电子显微镜图像。具有电子致密中心的空粒子(由黑色箭头表示)可以与完整的衣壳(由白色箭头表示)区分开来。比例尺 = 100 nm。(E) 通过 Stunner 测量的 rAAV1/2 制剂的吸光度光谱(黑色)。还显示了蛋白质(蓝色)、ssDNA(绿色)、其他紫外线吸收化合物或杂质(紫色)以及背景浊度(灰色)的贡献。(F) rAAV1/2 的 DLS 强度分布,在 30 nm 处有一个单峰,通过 Stunner 测量。通过测量 15 至 45 nm 的曲线下面积(绿色阴影)来确定衣壳散射强度为 100%。(G) rAAV1/2 载体制备的眩晕分析显示总衣壳滴度为 1.19 ×10 14 cp/mL(深蓝色),完整衣壳滴度为 1.73 × 1013 vg/mL(深绿色)。还测量了 7.16 × 1012 cp/mL 当量(浅蓝色)的游离和聚集蛋白,以及 1.04 × 1012 vg/mL 当量(浅绿色)的游离和聚集 ssDNA。缩写:rAAV = 重组腺相关病毒;RT-qPCR = 实时定量聚合酶链反应;SDS-PAGE=十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;ssDNA = 单链 DNA;DLS = 动态光散射。请点击这里查看此图的较大版本.
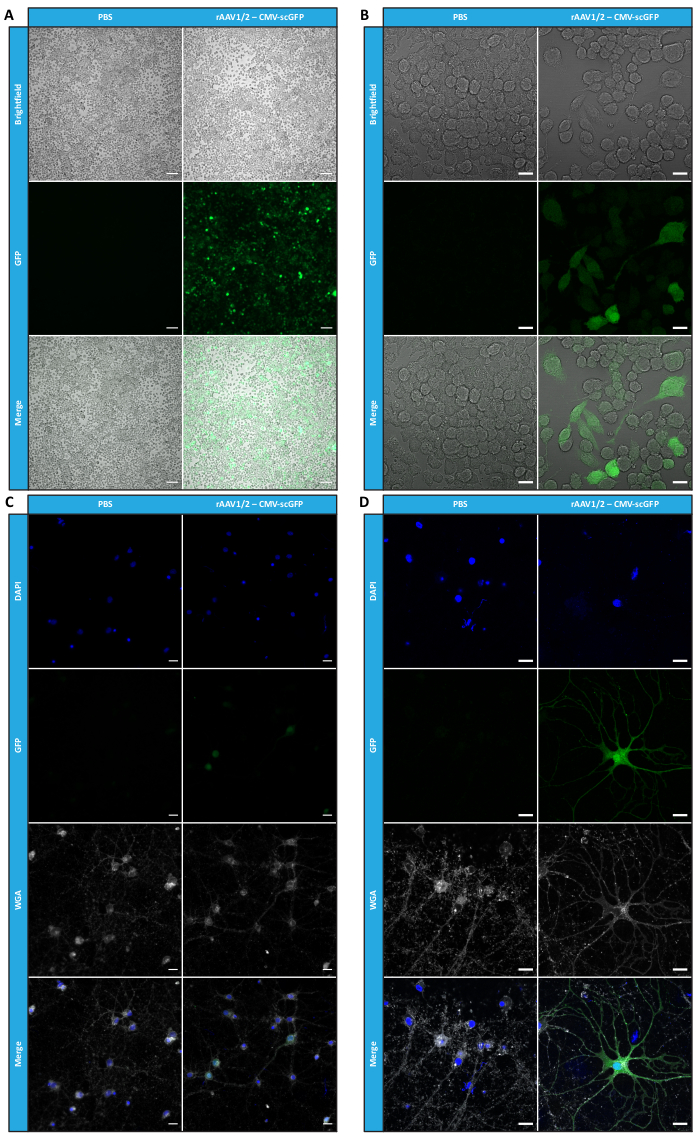
图 4:浓缩 rAAV1/2 样本的 体外 感染性评估。 (A) Neuro2A 细胞用 rAAV1/2 - CMV-scGFP 感染或与等体积的 PBS 一起孵育,作为阴性对照。感染后 48 小时成像的细胞的明场和荧光图像。图像是在蔡司Axio Observer Z1(10倍物镜)中采集的。比例尺 = 100 μm。 (B) 感染 rAAV1/2 - CMV-scGFP 后 48 小时 Neuro2A 细胞的详细图像。 图像是在蔡司LSM 710(40倍物镜)中采集的。比例尺 = 20 μm。 (C) 用 rAAV1/2 - CMV-scGFP 感染或与等体积的 PBS 孵育的半致密原代神经元培养物,作为阴性对照。用核染色剂(蓝色的DAPI)和膜染色剂(白色的WGA)标记细胞。图像是在蔡司Axio Observer Z1(40倍物镜)中采集的。比例尺 = 20 μm。 (D) 用 rAAV1/2 - CMV-scGFP 感染后 48 小时半致密原代神经元培养物的详细图像。 图像是在蔡司LSM 710(40倍物镜)中采集的。比例尺 = 20 μm。缩写:rAAV = 重组腺相关病毒;CMV = 巨细胞病毒;scGFP = 自补绿色荧光蛋白;PBS = 磷酸盐缓冲盐水;DAPI = 4',6-二脒基-2-苯基吲哚;WGA = 小麦胚芽凝集素。 请点击这里查看此图的较大版本.
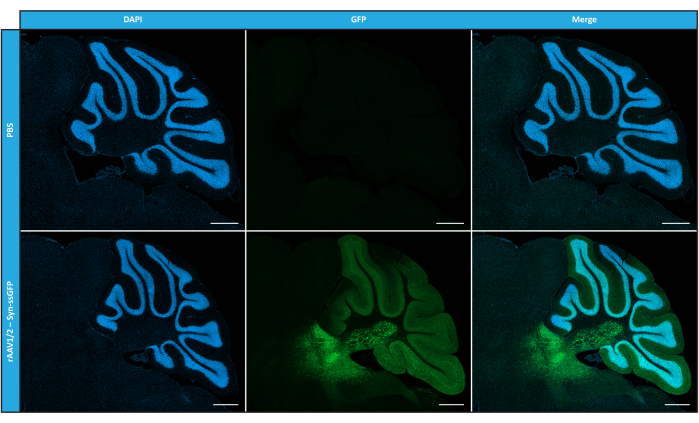
图 5:脑实质内注射后 rAAV1/2 的 体内 转导效率。 代表性免疫荧光图像显示,在小脑中枢注射 rAAV1/2 - Syn-ssGFP 后,整个小脑的广泛 GFP 表达(绿色)。用DAPI(蓝色)染色细胞核。比例尺 = 500 μm。缩写:rAAV = 重组腺相关病毒;Syn = 突触蛋白 1;ssGFP = 单链绿色荧光蛋白;DAPI = 4',6-二脒基-2-苯基吲哚;PBS = 磷酸盐缓冲盐水。 请点击这里查看此图的较大版本.
补充图S1:用SmaI消化的rAAV载体质粒的琼脂糖凝胶分析。 用 SmaI 限制性内切酶(泳道 2、4、6、8、10 和 12)消化 pITR 的 6 个克隆 (C1-C6),该内切酶在每个倒置末端重复序列内切割两次。在这种情况下,该pITR的完全消化预计将产生两个条带(3,796 bp和3,013 bp)。在成功的制剂(C1、C3、C4 和 C5)中,由部分消化产生的 6809 bp 条带仍然可见(占总数的 ~5%)。在具有ITR重组的制剂中,比例相反(C2),或者没有发生消化(C6)。还显示了相应的非消化克隆(泳道 3、5、7、9、11、13)。缩写:rAAV = 重组腺相关病毒;ITR = 倒置终端重复。 请点击这里下载此文件。
附图S2:通过基于肝素的亲和层析法纯化rAAV2/9。 (A) 随着 NaCl 浓度的增加,rAAV2/9 的洗脱曲线显示单个峰(黑色)。收集的馏分在图底部用红色数字(2-16)表示,280nm处的吸光度以mAU表示,电导率以mS/cm表示,x轴表示体积,以mL为单位。(B) 通过 RT-qPCR 定量的每种混合馏分 (F2-F16) 和流出的 rAAV 滴度。值以对数刻度表示。(C)SDS-PAGE和考马斯蓝染色纯度测定。将等体积(40 μL)的每种馏分(F2-F16)和相应的流出物上样并在10%SDS-PAGE上分离。通过 RT-qPCR 定量浓缩储备液,并在 40 μL PBS 中稀释 2.3 ×10 10 vg 并混合在凝胶上。通过考马斯蓝染色观察蛋白质条带。指示 AAV 衣壳蛋白(VP1、VP2 和 VP3)。标准蛋白质大小阶梯用 (L) 表示,并且还标明了相应的分子量。缩写:rAAV = 重组腺相关病毒;RT-qPCR = 实时定量聚合酶链反应;SDS-PAGE = 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。 请点击这里下载此文件。
补充图S3:FPLC纯化的rAAV1/2载体的蛋白质印迹分析。 (A) 将收集的馏分和浓缩的 rAAV1/2 载体在 SDS-PAGE 凝胶上分离,并用识别 VP1、VP2 和 VP3 衣壳蛋白的小鼠单克隆抗 AAV 抗体 (B1) 进行探测。(B) 将收集的馏分和浓缩的 rAAV1/2 载体在 SDS-PAGE 凝胶上分离,并用识别 VP1 和 VP2 衣壳蛋白的小鼠单克隆抗 AAV 抗体 (A69) 进行探测。缩写:rAAV = 重组腺相关病毒;FPLC = 快速蛋白液相色谱法;SDS-PAGE=十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;L = 标准蛋白质大小分子量标准。 请点击这里下载此文件。
补充图S4:FPLC纯化的rAAV2/9载体的蛋白质印迹分析。 (A) 将收集的馏分和浓缩的 rAAV2/9 载体在 SDS-PAGE 凝胶上分离,并用识别 VP1、VP2 和 VP3 衣壳蛋白的小鼠单克隆抗 AAV 抗体 (B1) 进行探测。(B) 将收集的馏分和浓缩的 rAAV2/9 载体在 SDS-PAGE 凝胶上分离,并用识别 VP1 和 VP2 衣壳蛋白的小鼠单克隆抗 AAV 抗体 (A69) 进行探测。缩写:rAAV = 重组腺相关病毒;FPLC = 快速蛋白液相色谱法;SDS-PAGE=十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;L = 标准蛋白质大小分子量标准。 请点击这里下载此文件。
补充图S5:通过Stunner进行rAAV2/9载体定量和表征。 (A) Stunner 测量的 rAAV2/9 载体的吸光度光谱(黑色)。还描绘了蛋白质(蓝色)、ssDNA(绿色)、其他紫外线吸收化合物或杂质(紫色)以及背景浊度(灰色)的贡献。(B) rAAV2/9 的 DLS 强度分布,主峰位于 30 nm,对应衣壳散射强度为 78%,通过测量 15 至 45 nm 的曲线下面积(绿色阴影)确定。还测量到总聚集体强度为22%(灰色阴影),主要贡献来自大聚集体(19.9%),平均直径为620 nm。(C) rAAV2/9 载体制备的眩晕器分析显示总衣壳滴度为 2.18 ×10 14 cp/mL(深蓝色),完整衣壳滴度为 2.35 × 1013 vg/mL(深绿色)。在该制备物中,还测量了 2.92 × 1013 cp/mL 当量(浅蓝色)的游离和聚集蛋白,以及 3.14 × 1012 vg/mL 当量(浅绿色)的游离和聚集 ssDNA。缩写:rAAV = 重组腺相关病毒;ssDNA = 单链 DNA;DLS = 动态光散射。 请点击这里下载此文件。
补充图S6:rAAV1/2纯化组分的 体外 转导效率和活力。 HEK293T用编码 ssGFP (rAAV1/2 - CMV-ssGFP) 的 rAAV1/2 载体的 50 μL FPLC 组分转导 48 小时后 48 小时表达 GFP(直接荧光)的细胞。比例尺 = 100 μm。缩写:rAAV = 重组腺相关病毒;FPLC = 快速蛋白液相色谱法;ssGFP = 单链绿色荧光蛋白。 请点击这里下载此文件。
补充图S7:rAAV2/9纯化组分的 体外 转导效率和活力。 HEK293T细胞用 50 μL 的每种 FPLC 馏分 (F2-F16) 感染,或在 CMV 启动子的控制出编码 scGFP 的 rAAV2/9 载体。GFP表达细胞在感染后48小时可见。比例尺 = 100 μm。缩写:rAAV = 重组腺相关病毒;FPLC = 快速蛋白液相色谱法;scGFP = 自补绿色荧光蛋白;CMV = 巨细胞病毒。 请点击这里下载此文件。
讨论
快速扩展的AAV载体工具包已成为通过不同给药途径为多种细胞类型提供的最有前途的基因递送系统之一。在这项工作中,我们旨在开发一种改进的方案,用于花叶 rAAV 载体的生产、纯化和表征,以证明它们在临床前研究中的价值。为此,本文描述了 rAAV1/2 和 rAAV2/9 镶嵌载体的生成,但该过程也可用于纯化标准 rAAV2 载体(数据未显示)。
镶嵌 rAAV 是按照使用 PEI 作为转染试剂的优化转染方法生产的。选择瞬时转染方法是因为其具有更大的灵活性和速度,在早期临床前研究中具有相当大的优势。一旦特定转基因和血清型得到验证,就可以对生产系统进行微调,通过建立稳定的转染细胞系来实现更好的可扩展性和成本效益,该细胞系表达特定 Rep/Cap 基因的一个子集,以及感染过程提供的其他基因24。与磷酸钙转染相比,PEI具有几个优点。它是一种稳定且经济高效的转染试剂,可在更宽的 pH 范围内有效运行。此外,它还消除了转染后更换细胞培养基的需要,从而显著降低了成本和工作量69。
为了规避 CsCl 或碘克沙醇梯度带来的一些限制,通过亲和色谱法收获和纯化产生的 rAAV。该策略提供了一种简化且可扩展的方法,无需超速离心和梯度即可执行,从而产生干净且高的病毒滴度。事实上,使用FPLC系统的色谱技术可以通过在具有更高柱床高度的色谱柱中填充更多的填料体积来实现自动化和放大。本文中描述的方案可以很容易地适应以纳入 5 mL HiTrap 肝素 HP 柱(数据未显示)。此外,肝素柱可以多次重复使用,从而有助于提高该方法的成本效益。
然后对纯化的rAAVs进行滴度、纯度、形态特征和生物活性的表征。有趣的是,在考马斯蓝染色中,除了三种典型的病毒衣壳蛋白外,在 F8-F16 级分中还检测到了大约 17 kDa 的条带。然而,在rAAV的浓缩步骤之后,该条带不再存在。此外,在 B1 和 A69 标记时也可以检测到一些分子量低于 VP3 (<62 kDa) 的微弱条带,表明这些可能是 VP1、VP2 和 VP3 衣壳蛋白的片段70。另一种可能性是,这些实际上是其他共纯化的蛋白质,例如铁蛋白或其他具有多肽的细胞蛋白,这些多肽与AAV衣壳蛋白具有相似的蛋白质指纹图谱,并且可能参与AAV生物学,如前所述26,71,72。
透射电镜和电击器分析还揭示了不同产品中不同水平的空颗粒的存在。同样,其他研究先前报告了通过转染或感染方法制备的 rAAV 产生可变和高水平的 (>65%) 空衣壳24,73。rAAV 产生的机制始于新合成的 VP 蛋白快速形成空衣壳,然后是基因组包装到由 Rep 蛋白介导的预形成衣壳中的缓慢限速步骤74,75。因此,在rAAV生产中会产生空衣壳,尽管空衣壳和完整衣壳的比例可能因目标转基因的大小和序列以及细胞培养条件而变化58,73。空衣壳引起了一些担忧,因为由于缺乏感兴趣的基因组,它们无法提供治疗效果,并且还可能增加先天性或适应性免疫反应。然而,一些报告还表明,通过调整其比例,空的 AAV 衣壳可以作为 AAV 特异性中和抗体的高效诱饵,因此可以提高转导效率 60,76,77。如果空衣壳的存在是非常有害的,并且考虑到空颗粒的阴离子特性与全载体相比略少,则可能的解决方案可能涉及使用阴离子交换色谱技术进行第二次精纯纯化步骤64。
这项研究还提供了令人信服的证据,表明生成的镶嵌 rAAV 不仅能够有效地转导体 外 神经元培养物,而且在颅内注射 rAAV1/2 时也能有效地转导中枢神经系统。总体而言,这些结果表明,所描述的生产和纯化方案可在 6 天内获得高纯度和生物活性的 rAAV,从而在临床前研究中成为生成 rAAV 的通用且具有成本效益的方法。
披露声明
作者声明没有利益冲突。
致谢
我们感谢科英布拉临床和生物医学研究所 (iCBR) 和创新生物医学与生物技术中心 (CIBB) 的 Mónica Zuzarte 博士在 rAAV 的 TEM 分析方面提供的合作、见解和技术援助。我们感谢科英布拉大学神经科学和细胞生物学中心(CNC-UC)和科英布拉大学跨学科研究所(IIIUC)的Dominique Fernandes博士,感谢她关于初级神经元培养实验的宝贵技术援助和见解。本研究所必需的 pRV1、pH21 和 pFdelta6 质粒由阿伯丁大学生命科学与医学院医学院的 Christina McClure 博士慷慨提供,我们对此表示感谢。这项工作由欧洲区域发展基金 (ERDF) 通过 Centro 2020 区域运营计划资助;通过COMPETE 2020--竞争力和国际化业务计划,以及通过FCT - Fundação para a Ciência e a Tecnologia的葡萄牙国家基金,在以下项目下:UIDB/04539/2020、UIDP/04539/2020、LA/P/0058/2020、ViraVector(CENTRO-01-0145-FEDER-022095)、Imagene (PTDC/BBB-NAN/0932/2014 |POCI-01-0145-FEDER-016807)、重置 - IDT-COP (CENTRO-01-0247-FEDER-070162)、抗击 Sars-CoV-2 (CENTRO-01-01D2-FEDER-000002)、BDforMJD (CENTRO-01-0145-FEDER-181240)、ModelPolyQ2.0 (CENTRO-01-0145-FEDER-181258)、MJDEDIT (CENTRO-01-0145-FEDER-181266);由美国葡萄牙生物医学研究基金 (APBRF) 和 Richard Chin 和 Lily Lock Machado-Joseph 疾病研究基金、ARDAT 根据 IMI2 JU 赠款协议第 945473 号,由欧盟和 EFPIA 支持;GeneT-Teaming Project 101059981欧盟的 Horizon Europe 计划提供支持。M.M.L.得到了 2021.05776.BD 的支持;C.H. 得到了 2021.06939.BD 的支持;A.C.S.得到了 2020.07721.BD 的支持;D.D.L.得到了 2020.09668.BD 的支持。 图1 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 10% povidone-iodine | Medline | MDS093943 | |
| 12-well plates | Thermo Scientific | 11889684 | |
| 24-well plates | VWR | 734-2325 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen | D1306 | |
| 96-well Stunner plate | Unchained Labs | 701-2025 | 96-well quantification plate for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| AAVpro Titration Kit (for Real-Time PCR) Ver.2 | Takara | 6233 | For determining the titer of AAV using RT-qPCR. This kit contains DNase I, Lysis Buffer, Dilution Buffer, positive control, Taq II mix, primer forward, primer reverse, water |
| Acetic acid glacial | Fisher Chemical | A/0360/PB17 | |
| ÄKTA pure 25 | Cytiva | 29018224 | FPLC system controlled by UNICORN software, version 6.3 |
| Alkaline phosphatase-linked goat anti-mouse | Invitrogen | 31328 | |
| Amicon ultra-0.5 centrifugal filter unit | Merck Millipore | UFC5100 | |
| Amicon ultra-15 centrifugal filter unit | Merck Millipore | UFC9100 | |
| Benzonase Nuclease | Merck Millipore | E1014 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| CFX96 Real-Time PCR detection system | Biorad | 184-5096 | |
| ChemiDoc Touch Imaging System | Bio-Rad Laboratories | 1708370 | |
| Chicken polyclonal anti-GFP primary antibody | Abcam | ab13970 | |
| Coomassie Blue G250 | Fisher Chemical | C/P541/46 | |
| Dithiothreitol (DTT) | Fisher Bioreagents | BP17225 | |
| DMEM | Sigma-Aldrich | D5796 | |
| ECF Substrate for Western Blotting | Cytiva | RPN5785 | |
| FastDigest SmaI | Thermo Scientific | FD0663 | |
| FEI-Tecnai G2 Spirit Biotwin | FEI | Biotwin | Transmission electron microscope |
| Fetal bovine serum | Biowest | S1810 | |
| Fluorescence mounting medium | Dako | S3023 | |
| Formvar-carbon coated 200 mesh grid | TAAB Laboratories Equipment | F077/025 | |
| Gas evacuation apparatus | RWD | R546W | |
| Glycerol | Fisher BioReagents | 10021083 | |
| Goat polyclonal anti-chicken antibody, Alexa Fluor 488 | Invitrogen | A-11039 | |
| Hamilton needle 30G, Small Hub RN Needle, 25 mm, PST3 | Hamilton | 7803-07 | |
| Hamilton syringe (10 µL) | Hamilton | 7653-01 | |
| HEK293T | American Type Culture Collection | CRL-11268 | |
| HiTrap Heparin HP 1 x 5 mL | Cytiva | 17040701 | Pre-packed heparin column |
| HiTrap Heparin HP 5 x 1 mL | Cytiva | 17040601 | Pre-packed heparin column |
| Immobilon-P PVDF Membrane | Merck Millipore | IPVH00010 | |
| Isoflurane | Braun | 469860 | |
| Ketamine | Dechra Pharmaceuticals | N/A | Nimatek |
| Low-retention microcentrifuge tubes (2 mL) | Fisher Scientific | 11906965 | |
| Lunatic & Stunner Client software | Unchained Labs | N/A | Client analysis software version 8.0.1.235. Software for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Methanol | Fisher Chemical | M/4000/FP21 | |
| Mouse monoclonal anti-AAV, VP1, VP2 antibody (A69) | American Research Products | 03-61057 | |
| Mouse monoclonal anti-AAV, VP1, VP2, VP3 antibody (B1) | American Research Products | 03-61058 | |
| Neuro2a | American Type Culture Collection | CCL-131 | |
| Normal goat serum | Gibco | 16210064 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 12738422 | |
| NZYColour Protein Marker II | NZYtech | MB09002 | |
| pAAV-CMV-scGFP | Addgene | 32396 | Addgene plasmid # 32396; http://n2t.net/addgene:32396; RRID:Addgene_32396 |
| pAAV-CMV-ssGFP | Addgene | 105530 | Addgene plasmid # 105530; http://n2t.net/addgene:105530; RRID:Addgene_105530 |
| pAAV2/9n | Addgene | 112865 | Addgene plasmid # 112865; http://n2t.net/addgene:112865; RRID:Addgene_112865 |
| Paraformaldehyde | Acros Organics | 10342243 | |
| PBS | Fisher BioReagents | BP2438 | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Pluronic F-68 Non-ionic Surfactant (100x) | Gibco | 24040032 | |
| Polyethylenimine MAX, MW 40,000 | Polysciences Europe | 24765 | |
| R500 Series Compact Small Animal Anesthesia Machine - Isoflurane | RWD | N/A | |
| Sample Inlet Valve V9-IS | Cytiva | 29027746 | |
| Sample pump P9-S | Cytiva | 29027745 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium chloride | Fisher Scientific | 10428420 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dodecyl sulfate (SDS) | Fisher Bioreagents | BP166 | |
| Sterile PVDF syringe filter | Fisher Scientific | 15191499 | |
| Stunner Platform | Unchained Labs | 700-2002 | Equipment for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Superloop 150 mL | Cytiva | 18-1023-85 | |
| Superloop 50 mL | Cytiva | 18-1113-82 | |
| SURE 2 supercompetent cells | Stratagene, Agilent Technologies | HPA200152 | |
| Treated culture dishes | Corning | 734-1711 | |
| Tris base | Fisher BioReagents | BP152 | |
| Tris hydrochloride | Fisher BioReagents | BP153 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin-EDTA | Gibco | 25200-072 | |
| Wheat Germ Agglutinin (WGA) conjugated with Alexa Fluor 633 | Invitrogen | W21404 | |
| Xylazine | Dechra Pharmaceuticals | N/A | Sedaxylan |
| Zeiss Axio Observer Z1 | Carl Zeiss Microscopy GmbH | N/A | Inverted fluorescence microscope equiped with an EC Plan-Neofluar 10x/0.30 objective and a Plan-Apochromat 40x/0.95 objective |
| Zeiss Axio Scan.Z1 | Carl Zeiss Microscopy GmbH | N/A | Slide scanner fluorescence microscope equipped with a Plan-Apochromat 20x/0.8 objective |
| Zeiss LSM 710 | Carl Zeiss Microscopy GmbH | N/A | Inverted confocal microscope equipped with a Plan-Apochromat 40x/1.4 Oil DIC objective |
| µ-Slide 8 well Ibidi | Ibidi | 80826 | 8-well chamber slide |
参考文献
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Front Mol Neurosci. 7, 1-9 (2014).
- Muzyczka, N. Use of Adeno-Associated Virus as a General Transduction Vector for Mammalian Cells. Viral Expression Vectors. 158, 97-129 (1992).
- Goncalves, M. A. F. V Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43 (2005).
- Flotte, T. R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 11 (10), 805-810 (2004).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Ojala, D. S., Amara, D. P., Schaffer, D. V Adeno-Associated Virus Vectors and Neurological Gene Therapy. Neuroscientist. 21 (1), 84-98 (2014).
- Saraiva, J., Nobre, R. J., Pereira de Almeida, L. Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. Journal of Controlled Release. 241, 94-109 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods Mol Biol. 807, 47-92 (2011).
- Sonntag, F., Schmidt, K., Kleinschmidt, J. A. A viral assembly factor promotes AAV2 capsid formation in the nucleolus. Proc Natl Acad Sci U S A. 107 (22), 10220-10225 (2010).
- Sonntag, F., et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes. J Virol. 85 (23), 12686-12697 (2011).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol. 78 (12), 6381-6388 (2004).
- Gao, G., Vandenberghe, L. H., Wilson, J. M. New recombinant serotypes of AAV vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The role of the adeno-associated virus capsid in gene transfer. Methods Mol Biol. 437, 51-91 (2008).
- Clark, K. R., Voulgaropoulou, F., Fraley, D. M., Johnson, P. R. Cell lines for the production of recombinant adeno-associated virus. Hum Gene Ther. 6 (10), 1329-1341 (1995).
- Inoue, N., Russell, D. W. Packaging cells based on inducible gene amplification for the production of adeno-associated virus vectors. J Virol. 72 (9), 7024-7031 (1998).
- Liu, X., Voulgaropoulou, F., Chen, R., Johnson, P. R., Clark, K. R. Selective Rep-Cap gene amplification as a mechanism for high-titer recombinant AAV production from stable cell lines. Mol Ther. 2 (4), 394-403 (2000).
- Mathews, L. C., Gray, J. T., Gallagher, M. R., Snyder, R. O. [23] Recombinant adeno-associated viral vector production using stable packaging and producer cell lines. Methods Enzymol. 346, 393-413 (2002).
- Gao, G., et al. Purification of recombinant adeno-associated virus vectors by column chromatography and its performance in vivo. Hum Gene Ther. 11 (15), 2079-2091 (2000).
- Xiao, X., Li, J., Samulski, R. J. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus. J Virol. 72 (3), 2224-2232 (1998).
- Aponte-Ubillus, J. J., et al. Molecular design for recombinant adeno-associated virus (rAAV) vector production. Appl Microbiol Biotechnol. 102 (3), 1045-1054 (2018).
- Smith, R. H., Levy, J. R., Kotin, R. M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells. Mol Ther. 17 (11), 1888-1896 (2009).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Wright, J. F. Transient transfection methods for clinical adeno-associated viral vector production. Hum Gene Ther. 20 (7), 698-706 (2009).
- Yuan, Z., Qiao, C., Hu, P., Li, J., Xiao, X. A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes. Hum Gene Ther. 22 (5), 613-624 (2011).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Hum Gene Ther Methods. 26 (4), 147-157 (2015).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Anderson, R., Macdonald, I., Corbett, T., Whiteway, A., Prentice, H. G. A method for the preparation of highly purified adeno-associated virus using affinity column chromatography, protease digestion and solvent extraction. J Virol Methods. 85 (1-2), 23-34 (2000).
- Okada, T., et al. Scalable purification of adeno-associated virus serotype 1 (AAV1) and AAV8 vectors, using dual ion-exchange adsorptive membranes. Hum Gene Ther. 20 (9), 1013-1021 (2009).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. J Virol Methods. 183 (2), 139-146 (2012).
- Lock, M., et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale. Hum Gene Ther. 21 (10), 1259-1271 (2010).
- Wang, L., Blouin, V., Brument, N., Bello-Roufai, M., Francois, A. Production and Purification of Recombinant Adeno-Associated Vectors. Adeno-Associated Virus: Methods and Protocols. 807, 361-404 (2011).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated Virus Serotypes: Vector Toolkit for Human Gene Therapy. Molecular Therapy. 14 (3), 316-327 (2006).
- Mietzsch, M., Broecker, F., Reinhardt, A., Seeberger, P. H., Heilbronn, R. Differential adeno-associated virus serotype-specific interaction patterns with synthetic heparins and other glycans. J Virol. 88 (5), 2991-3003 (2014).
- McClure, C., Cole, K. L. H., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. JoVE. (57), e3348 (2011).
- Auricchio, A., O’Connor, E., Hildinger, M., Wilson, J. M. A single-step affinity column for purification of serotype-5 based adeno-associated viral vectors. Mol Ther. 4 (4), 372-374 (2001).
- Wang, Q., et al. Identification of an adeno-associated virus binding epitope for AVB sepharose affinity resin. Mol Ther Methods Clin Dev. 2, 15040 (2015).
- Mietzsch, M., et al. OneBac: platform for scalable and high-titer production of adeno-associated virus serotype 1–12 vectors for gene therapy. Hum Gene Ther. 25 (3), 212-222 (2014).
- Mietzsch, M., et al. Characterization of AAV-specific affinity ligands: consequences for vector purification and development strategies. Mol Ther Methods Clin Dev. 19, 362-373 (2020).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2023).
- Koerber, J. T., Jang, J. -. H., Yu, J. H., Kane, R. S., Schaffer, D. V. Engineering adeno-associated virus for one-Step purification via immobilized metal affinity chromatography. Hum Gene Ther. 18 (4), 367-378 (2007).
- Zhang, H. -. G., et al. Addition of six-His-tagged peptide to the C terminus of adeno-associated virus VP3 does not affect viral tropism or production. J Virol. 76 (23), 12023-12031 (2002).
- Arnold, G. S., Sasser, A. K., Stachler, M. D., Bartlett, J. S. Metabolic biotinylation provides a unique platform for the purification and targeting of multiple AAV vector serotypes. Mol Ther. 14 (1), 97-106 (2006).
- Rabinowitz, J. E., et al. Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol. 78 (9), 4421-4432 (2004).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Mol Ther. 7 (3), 419-425 (2003).
- Choi, V., McCarty, D., Samulski, R. AAV hybrid serotypes: improved vectors for gene delivery. Curr Gene Ther. 5 (3), 299-310 (2005).
- Nonnenmacher, M., van Bakel, H., Hajjar, R. J., Weber, T. High capsid–genome correlation facilitates creation of AAV libraries for directed evolution. Mol Ther. 23 (4), 675-682 (2015).
- Kimura, K., et al. A mosaic adeno-associated virus vector as a versatile tool that exhibits high levels of transgene expression and neuron specificity in primate brain. Nat Commun. 14 (1), 4762 (2023).
- Issa, S. S., Shaimardanova, A. A., Solovyeva, V. V., Rizvanov, A. A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 12 (5), 785 (2023).
- Foust, K. D., et al. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27 (1), 59-65 (2009).
- Lopes, M. M., et al. A new protocol for whole-brain biodistribution analysis of AAVs by tissue clearing, light-sheet microscopy and semi-automated spatial quantification. Gene Ther. 29 (12), 665-679 (2022).
- Gray, J. T., Zolotukhin, S. Design and construction of functional AAV vectors. Methods Mol Biol. 807, 25-46 (2011).
- Choi, V. W., Asokan, A., Haberman, R. A., Samulski, R. J. Production of recombinant adeno-associated viral vectors. Curr Protoc Hum Genet. , (2007).
- Bennicelli, J., et al. Reversal of blindness in animal models of leber congenital amaurosis using optimized AAV2-mediated gene transfer. Mol Ther. 16 (3), 458-465 (2008).
- Fischer, M. D., Hickey, D. G., Singh, M. S., MacLaren, R. E. Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods. 27 (4), 150-158 (2016).
- Santos, S. D., et al. Contactin-associated protein 1 (Caspr1) regulates the traffic and synaptic content of α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-type glutamate receptors. J Biol Chem. 287 (9), 6868-6877 (2012).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 7 (1), 122-128 (2003).
- Dong, B., Nakai, H., Xiao, W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther. 18 (1), 87-92 (2010).
- Wright, J. F. AAV empty capsids: For better or for worse. Mol Ther. 22 (1), 1-2 (2014).
- Asaad, W., et al. AAV genome modification for efficient AAV production. Heliyon. 9 (4), e15071 (2023).
- Wobus, C. E., et al. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J Virol. 74 (19), 9281-9293 (2000).
- Wistuba, A., Kern, A., Weger, S., Grimm, D., Kleinschmidt, J. A. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol. 71 (2), 1341-1352 (1997).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J Virol Methods. 140 (1-2), 183-192 (2007).
- Brument, N., et al. A versatile and scalable two-step ion-exchange chromatography process for the purification of recombinant adeno-associated virus serotypes-2 and -5. Mol Ther. 6 (5), 678-686 (2002).
- Potter, M., et al. A simplified purification protocol for recombinant adeno-associated virus vectors. Mol Ther Methods Clin Dev. 1, 14034 (2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570 (2019).
- Yang, Q. -. E., et al. Rapid quality control assessment of adeno-associated virus vectors via Stunner. GEN Biotechnology. 1 (3), 300-310 (2022).
- Huang, X., et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 193 (2), 270-277 (2013).
- Salganik, M., et al. Evidence for pH-dependent protease activity in the adeno-associated virus capsid. J Virol. 86 (21), 11877-11885 (2012).
- Dong, B., et al. Proteomics analysis of co-purifying cellular proteins associated with rAAV vectors. PLoS One. 9 (2), e86453 (2014).
- Grieger, J. C., Soltys, S. M., Samulski, R. J. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 24 (2), 287-297 (2016).
- Wright, J. Product-related impurities in clinical-grade recombinant AAV vectors: characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Bennett, A., Mietzsch, M., Agbandje-McKenna, M. Understanding capsid assembly and genome packaging for adeno-associated viruses. Future Virol. 12 (6), 283-297 (2017).
- Myers, M. W., Carter, B. J. Assembly of adeno-associated virus. Virology. 102 (1), 71-82 (1980).
- Mingozzi, F., et al. Overcoming preexisting humoral immunity to AAV using capsid decoys. Sci Transl Med. 5 (194), (2013).
- Hoffman, B. E., Herzog, R. W. Covert warfare against the immune system: decoy capsids, stealth genomes, and suppressors. Mol Ther. 21 (9), 1648-1650 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。