Method Article
בידוד של וקטורים נגיפיים הקשורים לאדנו באמצעות פרוטוקול כרומטוגרפיית זיקה הפרין חד-שלבי וחצי אוטומטי
* These authors contributed equally
In This Article
Summary
כתב יד זה מתאר פרוטוקול מפורט ליצירה וטיהור של וקטורים נגיפיים הקשורים לאדנו באמצעות שיטת כרומטוגרפיית זיקה אופטימלית מבוססת הפרין. הוא מציג גישה פשוטה, ניתנת להרחבה וחסכונית, ומבטל את הצורך באולטרה-צנטריפוגה. הווקטורים המתקבלים מפגינים טוהר גבוה ופעילות ביולוגית, מה שמוכיח את ערכם במחקרים פרה-קליניים.
Abstract
וירוס הקשור לאדנו (AAV) הפך לווקטור בעל ערך הולך וגדל עבור העברת גנים in vivo ונמצא כעת בניסויים קליניים בבני אדם. עם זאת, השיטות הנפוצות לטיהור AAVs עושות שימוש בצזיום כלוריד או באולטרה-צנטריפוגה הדרגתית של צפיפות יודיקסנול. למרות יתרונותיהן, שיטות אלה גוזלות זמן, יש להן יכולת הרחבה מוגבלת, ולעתים קרובות גורמות לווקטורים עם טוהר נמוך. כדי להתגבר על אילוצים אלה, חוקרים מפנים את תשומת לבם לטכניקות כרומטוגרפיה. כאן, אנו מציגים פרוטוקול כרומטוגרפיית זיקה אופטימלי מבוסס הפרין המשמש כשלב לכידה אוניברסלי לטיהור AAVs.
שיטה זו מסתמכת על הזיקה הפנימית של סרוטיפ AAV 2 (AAV2) עבור פרוטאוגליקנים של הפראן סולפט. באופן ספציפי, הפרוטוקול כולל טרנספקציה משותפת של פלסמידים המקודדים את חלבוני הקפסיד הרצויים AAV עם אלה של AAV2, ומניבים וקטורי AAV פסיפס המשלבים את התכונות של שני הסרוטיפים ההורים. בקצרה, לאחר ליזה של תאי יצרן, תערובת המכילה חלקיקי AAV מטוהרת ישירות בעקבות פרוטוקול כרומטוגרפיה אופטימלי של זיקה הפרין חד-שלבי באמצעות מערכת כרומטוגרפיה נוזלית סטנדרטית של חלבון מהיר (FPLC). חלקיקי AAV מטוהרים מרוכזים לאחר מכן ועוברים אפיון מקיף מבחינת טוהר ופעילות ביולוגית. פרוטוקול זה מציע גישה פשוטה וניתנת להרחבה שניתן לבצע ללא צורך באולטרה-צנטריפוגה ובשיפועים, ומניב טיטרים נגיפיים נקיים וגבוהים.
Introduction
וקטור וירוס הקשור לאדנו (AAV) כובש את דרכו כאחת ממערכות ההעברה המבטיחות ביותר במחקרי הריפוי הגנטי הנוכחיים. AAV, שזוהה לראשונה בשנת 19651, הוא נגיף קטן, לא עטוף, עם קפסיד חלבון איקוסהדרלי בקוטר של כ -25 ננומטר, בעל גנום DNA חד-גדילי. AAVs שייכים למשפחת Parvoviridae ולסוג Dependoparvovirus בשל התלות הייחודית שלהם בהדבקה משותפת עם וירוס עוזר, כגון וירוס הרפס סימפלקס או, בתדירות גבוהה יותר, אדנווירוס, כדי להשלים את המחזור הליטי שלהם 2,3.
הגנום בן 4.7 קילו-הבסיס של AAVs מורכב משתי מסגרות קריאה פתוחות (ORFs) שמשני צדדיהן שתי חזרות טרמינליות הפוכות (ITR) היוצרות קצוות סיכות ראש אופייניים בצורת T4. ITR הם האלמנטים היחידים הפועלים CIS קריטיים עבור אריזה, שכפול ואינטגרציה של AAV, ולכן הם רצפי AAV היחידים הנשמרים בווקטורים רקומביננטיים AAV (rAAV). במערכת זו, הגנים הדרושים לייצור וקטורי מסופקים בנפרד, בטרנס, מה שמאפשר לארוז את הגן המעניין בתוך הקפסיד הנגיפי 5,6.
כל גן נגיפי מקודד חלבונים שונים באמצעות שחבור חלופי ומתחיל קודונים. בתוך Rep ORF, ארבעה חלבונים לא מבניים (Rep40, Rep52, Rep68 ו-Rep78) מקודדים, וממלאים תפקידים מכריעים בשכפול, אינטגרציה ספציפית לאתר ואנקפסידציה של DNA נגיפי 7,8. ה-Cap ORF משמש כתבנית לביטוי של שלושה חלבונים מבניים השונים זה מזה ב-N-terminus שלהם (VP1, VP2 ו-VP3), המתכנסים ליצירת קפסיד נגיפי של 60 מטר ביחס של 1:1:10 4,9. בנוסף, ORF חלופי המקונן בגן Cap עם קודון התחלה CUG לא קונבנציונלי מקודד חלבון מפעיל הרכבה (AAP). חלבון גרעיני זה הוכח כמקיים אינטראקציה עם חלבוני הקפסיד המסונתזים החדשים VP1-3 ומקדם הרכבת קפסיד10,11.
הבדלים ברצף חומצות האמינו של הקפסיד מסבירים את 11 הסרוטיפים הטבעיים של AAV ויותר מ-100 גרסאות שבודדו מבני אדם ומרקמות פרימטים לא אנושיות 7,12,13. וריאציות בקונפורמציה של אזורים משתנים מבחינה מבנית שולטות בתכונות האנטיגניות המובהקות ובתכונות קשירת הקולטן של קפסידים מזנים שונים. התוצאה היא טרופיזמים ברורים של רקמות ויעילות התמרה על פני איברי יונקים שונים14.
שיטות הייצור המוקדמות של rAAV הסתמכו על זיהום אדנווירוס למטרות עזר 15,16,17,18,19. למרות היותו יעיל ובדרך כלל קל לייצר בקנה מידה גדול, מספר בעיות נובעות זיהום זה. גם לאחר הטיהור ושלב הפחתת חום לנטרול, חלקיקים אדנו-ויראליים עדיין עשויים להיות נוכחים בהכנות AAV, המהווים בעיית בטיחות לא רצויה20. יתר על כן, נוכחות של חלבונים אדנו-ויראליים deproductd אינו מקובל לשימוש קליני. אסטרטגיות ייצור אחרות מנצלות זני וירוס הרמביננטי הרמביננטי סימפלקס שהונדסו להביא את ה- Rep/Cap והטרנסגן לתאי היעד21 או למערכת תאי הבקולווירוס-חרק22. למרות שמערכות אלה מציעות יתרונות במונחים של מדרגיות ותאימות GMP, הן עדיין מתמודדות עם בעיות דומות.
שיטת הטרנספקציה המשולשת לייצור rAAV אומצה בדרך כלל כדי להתגבר בקלות על בעיות אלה. בקצרה, הרכבת rAAV מסתמכת על טרנספקציה חולפת של תאים עם שלושה פלסמידים המקודדים עבור: 1) קלטת ביטוי טרנסגנים ארוז בין ITR מהגנום הפראי AAV2 (pITR); 2) רצפי Rep/Cap הדרושים לשכפול והרכבת נגיפים (pAAV-RC); ו-3) חלבוני אדנו-ויראלי מינימליים (E1A, E1B, E4 ו-E2A) יחד עם הרנ"א הקשור לווירוס אדנו-וירוס הדרושים לאפקט העוזר (pHelper)6,20,23. בעוד ששיטות טרנספקציה פלסמיד מספקות פשטות וגמישות לייצור rAAV במחקרים פרה-קליניים, להליכים אלה יש מגבלות במונחים של מדרגיות ויכולת שחזור כאשר הם מיושמים בייצור בקנה מידה גדול. כגישה חלופית, ניתן להשיג ייצור rAAV באמצעות שימוש בקווי תאים יצרניים של AAV (הן של צמיחה דבקה והן של צמיחה מתרחפת), המבטאים ביציבות גנים AAV Rep/Cap או Rep/Cap בשילוב עם מבנים וקטוריים. במערכות אלה, הגנים המסייעים אדנו-ויראליים מוצגים באמצעות טרנספקציה פלסמיד. למרות שאסטרטגיה זו משפרת את יכולת ההרחבה של תהליך תרבית התא, היא מורכבת מבחינה טכנית וגוזלת זמןרב 21,24,25.
בכל מקרה, תאי היצרן עוברים ליזה ועוברים שלב טיהור אחד או יותר. נכון לעכשיו, השיטות העיקריות לטיהור rAAV כוללות שימוש בצזיום כלוריד (CsCl) או יודיקסנול צנטריפוגה הדרגתית בצפיפות אולטרה גבוהה ואחריו טכניקות כרומטוגרפיה26. תוכנית הטיהור המקורית למשקעים נגיפיים השתמשה באמוניום גופרתי, ואחריו שניים או שלושה סבבים של אולטרה-צנטריפוגה דרך שיפוע CsCl. היתרונות העיקריים של תהליך זה כוללים את האפשרות לטהר את כל הסרוטיפים ואת היכולת להפריד פיזית חלקיקים מלאים מקפסידים ריקים בהתבסס על צפיפויותיהם השונות. שיטה זו, לעומת זאת, היא משוכללת, גוזלת זמן רב, ויש לה מדרגיות מוגבלת, ולעתים קרובות התוצאה היא תפוקה ירודה ואיכות מדגם נמוכה 27,28,29,30. יתר על כן, דיאליזה כנגד חיץ פיזיולוגי נחוצה לעתים קרובות לפני מחקרי in vivo בשל ההשפעות הרעילות ש- CsCl יכול להפעיל על יונקים.
יודיקסנול שימש גם כמדיום שיפוע איזו-אוסמוטי חלופי לטיהור וקטורי rAAV, עם יתרונות על פני CsCl הן מבחינת בטיחות והן מבחינת עוצמה וקטורית. עם זאת, כמו CsCl, שיטת יודיקסנול מציגה כמה חסרונות הקשורים ליכולת הטעינה של ליזט תרבית תאים (ובכך את המדרגיות של טיהור rAAV) והיא נותרה שיטה גוזלת זמן ויקרה30,31.
כדי להתגבר על אילוצים אלה, החוקרים הפנו את תשומת לבם לטכניקות כרומטוגרפיה. בהקשר זה פותחו מספר גישות טיהור המשלבות שיטות כרומטוגרפיה של זיקה, הידרופוביה או החלפת יונים. שיטות אלה מסתמכות על התכונות הביוכימיות של סרוטיפ מסוים, כולל הקולטנים הטבעיים שלהם, או על מאפייני המטען של חלקיק נגיפי32. לדוגמה, התגלית כי AAV2, AAV3, AAV6 ו- AAV13 עדיף להיקשר לפרוטאוגליקנים של הפראן סולפט (HSPG), פתחה את האפשרות להשתמש בהפרין הקרוב לטיהור כרומטוגרפיה של זיקה. עם זאת, אתרי הקישור ל-HSPG יכולים להיות שונים בין הסרוטיפים, ומתווכים התקשרות AAV והדבקה של תאי מטרה בדרכים שונות 2,33,34,35,36. מצד שני, AAV1, AAV5 ו-AAV6 נקשרים לחומצה סיאלית N-linked (SA), בעוד AAV4 משתמש ב-O-linked SA 2,14,34. בעקבות אותו רציונל, פותח גם פרוטוקול כרומטוגרפיית זיקה חד-שלבית לטיהור rAAV5 המבוסס על שימוש במוצין, חלבון יונקים המועשר מאוד בחומצה סליצילית37. כמו טכניקות מבוססות הפרין, טיהור זה תלוי גם בסרוטיפ הספציפי שנוצר. מלבד הפרין ומוצין, ליגנדות אחרות נבדקו עבור כרומטוגרפיית זיקה, כגון נוגדן חד שבטי A20 ונוגדנים חד-תחומיים של גמלים (AVB Sepharose ו- POROS CaptureSelect)22,23,38,39,40,41. אסטרטגיות חדשניות אחרות לשיפור שיטות הטיהור הקיימות בעבר כוללות הכנסת שינויים קטנים בקפסיד rAAV כדי להציג אפיטופים מחייבים ספציפיים. לדוגמה, ניתן לטהר rAAV עם תווית הקסה-היסטידין או ביוטינילציה באמצעות ליגנדות המכוונות לאפיטופים אלה (חומצה ניקל ניטרילוטריאצטית ושרף אבידין, בהתאמה)42,43,44.
במאמץ להרחיב את המאפיינים הרצויים של rAAVs, החוקרים הלבישו את הנגיפים על ידי ערבוב הקפסידים שלהם. זה מושג על ידי אספקת גן הקפסיד משני סרוטיפים AAV שונים ביחסים שווי ערך או שונים במהלך הייצור, מה שיוצר מבנה קפסיד המורכב מתערובת של תת-יחידות קפסיד מסרוטיפים שונים 34,45,46,47,48,49,50. מחקרים קודמים מספקים ראיות פיזיקליות לכך שביטוי משותף של חלבוני קפסיד מ-AAV2 עם AAV1 (יחס של 1:1) ו-AAV2 עם AAV9 (יחס של 1:1) מביא ליצירת וקטורים של פסיפס rAAV1/2 ו-rAAV2/9, בהתאמה 45,46,48. יתרון מרכזי של יצירת rAAV פסיפס הוא היכולת לשלב תכונות יתרון מסרוטיפים שונים של AAV, וכתוצאה מכך שיפורים סינרגטיים בביטוי טרנסגנים ובטרופיזם, תוך שמירה על תכונות אחרות שימושיות במהלך ייצור rAAV. באופן מעניין, וריאנטים מסוימים של פסיפס אפילו מציגים תכונות חדשות שונות מכל וירוס הורי 46,47,49. על ידי ניצול יכולת קשירת הפרין של AAV2, וקטורי rAAV פסיפס יכולים להיווצר ולהיות מטוהרים על ידי ערבוב AAV2 עם קפסידים AAV טבעיים או חדשים אחרים שנוצרו על ידי אבולוציה מכוונת ו / או תכנון רציונלי. עם זאת, מחקרים קודמים הדגישו את החשיבות של תאימות תת-יחידות קפסיד כאשר מנסים להרכיב וקטורי פסיפס. לדוגמה, רבינוביץ' ועמיתיו הראו כי למרות שהטרנסקפסידציה של AAV1, AAV2 ו- AAV3 הובילה להרכבה משותפת יעילה של קפסידים פסיפס, ההלבשה ההדדית של סרוטיפים אלה עם AAV4 עיכבה את יצירת הנגיפים היציבים 34,45,47. בנוסף, AAV1, AAV2 ו-AAV3 הראו תאימות נמוכה עם AAV5, בהתחשב בטיטרים הנגיפיים המופחתים שהתקבלו בעת ערבוב הקפסידים הללו ביחסים שונים. באופן מעניין, פסיפס rAAV2/5 הראה ירידה בתכונות קשירת הפרין, תוך שמירה על יכולת קשירת מוצין כמו AAV5 הורי. עם זאת, rAAV3/5 ביחס של 3:1 שמר על הקישור הכפול להפרין ולמוצין. בסך הכל, הדור של rAAV פסיפס חדש עם התמרה משופרת, טרופיזם ספציפי, או אימונוגניות נמוכה יכול להפיק תועלת רבה מההבנה שלנו של הרכבה קפסיד ואינטראקציות קולטן, עם שילובים ספציפיים שעדיין דורשים חקירה יסודית ואופטימיזציה.
בעבודה הנוכחית, אנו מתארים פרוטוקול שלב אחר שלב לייצור וטיהור של rAAV באמצעות שיטת כרומטוגרפיה אופטימלית של זיקה הפרין. rAAV מיוצרים על ידי טרנספקציה חולפת ומטוהרים באמצעות מערכת כרומטוגרפיה נוזלית חלבונית מהירה (FPLC). לאחר ריכוז של שברים מטוהרים נבחרים, המניות הנגיפיות המתקבלות מאופיינות במונחים של טיטר, טוהר, תכונות פיזיות מהותיות ופעילות ביולוגית במבחנה וב- in vivo. כהוכחת היתכנות, אנו מדגימים את השיפורים והישימות של פרוטוקול זה ליצירת וקטורים rAAV1/2 ו- rAAV2/9 פסיפס. הבחירה בכל סרוטיפ התבססה על הטרופיזמים השונים להפליא שלהם, מה שעשוי להעניק את המאפיינים הייחודיים שלהם גם לגרסאות הפסיפס. סרוטיפ AAV 1, עם טרופיזם מתון כללי למערכת העצבים המרכזית (CNS), יש את היכולת להתמיר נוירונים וגליה (במידה פחותה) ועובר הובלה אקסונלית בכיוונים אנטרוגרדיים ומדרדרים in vivo 2,7,8. בנוסף, סרוטיפ AAV 9 נבחר בשל יכולתו הטבעית לחצות את מחסום הדם-מוח ולכוון למערכת העצבים המרכזית הן בעכברים בוגרים והן בעכברים בוגרים51,52. לבסוף, סרוטיפ AAV 2 נבחר לאור יכולתו להיקשר להפרין, מה שמאפשר כרומטוגרפיית זיקה33. חלקיקי rAAV1/2 ו-rAAV2/9 מטוהרים משלבים את התכונות של שני הסרוטיפים AAV ההוריים, ולכן מהווים וקטורים מתאימים להתמרה של מערכת העצבים המרכזית 45,46,48,49.
Protocol
הערה: ראה איור 1 להמחשה המסכמת את הפרוטוקול. עיין בטבלת החומרים לקבלת פרטים על כל החומרים, המכשירים והריאגנטים המשמשים בפרוטוקול זה. כל עבודה המערבת תאים ונגיפים צריכה להתבצע בארונות בטיחות ביולוגית ייעודיים ובאינקובטורים, בנפרד מאלה המשמשים באופן קבוע לתחזוקת קווי תאים. הציוד והריאגנטים הבאים במגע עם תאים ווירוסים בתרבית צריכים להיות סטריליים. חיוני כי סילוק ריאגנטים מסוכנים וחומרים מזוהמים בנגיפים יבוצע בהתאם לגיליונות נתוני בטיחות החומרים ובהתאם לחוקים ולהנחיות הלאומיים הניתנים על ידי המשרד לבריאות ובטיחות סביבתית של כל מוסד. נכון לאפריל 2019, הנחיות NIH למחקר הכולל מולקולות רקומביננטיות או חומצות גרעין סינתטיות מסווגות כגורמי קבוצת סיכון 1 (שאינם קשורים למחלות בבני אדם בוגרים בריאים) את כל הסרוטיפים של AAV, כמו גם מבני AAV רקומביננטיים או סינתטיים. סיווג זה חל כאשר הטרנסגן אינו מקודד תוצר גן שעלול להיות גידולי או רעלן, והמבנים מיוצרים ללא וירוס עוזר.
כל הניסויים בבעלי חיים בוצעו בהתאם לדירקטיבת הקהילה של האיחוד האירופי (2010/63/EU) לטיפול ושימוש בחיות מעבדה, שהועתקה לחוק הפורטוגלי בשנת 2013 (צו חוק 113/2013). בנוסף, נהלי בעלי חיים אושרו על ידי הארגון האחראי לרווחת בעלי חיים של הפקולטה לרפואה והמרכז למדעי המוח וביולוגיה של התא של מתקן בעלי חיים מורשה באוניברסיטת קוימברה. החוקרים קיבלו הכשרה מתאימה (קורס מוסמך FELASA) והסמכה מהרשויות הפורטוגליות (Direcção Geral de Alimentação e Veterinária, ליסבון, פורטוגל) לביצוע הניסויים.
1. מבני פלסמיד
- עקוב אחר הוראות היצרן של ערכה נטולת אנדוטוקסין maxiprep כדי לבודד ולטהר כמויות DNA משמעותיות של הפלסמידים הבאים: i) pITR: וקטור ההעברה של עניין; ii) פלסמיד pAAV-RC: pRV1, המכיל את רצפי AAV2 Rep ו-Cap 36; iii) פלסמיד pAAV-RC: pH21, המכיל את רצפי AAV1 Rep ו-Cap 36; iv) פלסמיד pAAV-RC: pAAV2/9n, המכיל את רצפי AAV2 Rep ו-AAV9 Cap ; v) pHelper: pFdelta6, Adenovirus-helper plasmid36.
- מסך את שלמות הפלסמידים שנוצרו על ידי ביצוע ההגבלות האנזימטיות המומלצות36. עקוב אחר שלמות פלסמידים pITR על ידי עיכול עם SmaI, אנדונוקלאז הגבלה, אשר חותך פעמיים בתוך חלק לא יציב של ITR53,54.
הערה: מכיוון שה-ITR מאוד לא יציבים ורגישים למחיקות, מומלץ להשתמש בתאים סופר-מוכשרים של SURE 2 כדי למזער רקומבינציה באתרים אלה.
2. תרבית תאים
- תרבית כליה עוברית אנושית 293, המבטאת ביציבות את קו תאי האנטיגן הגדול SV40 מסוג T (HEK293T) בגלוקוז הגבוה DMEM (Modified Eagle Medium) של דולבקו, בתוספת 10% נסיוב בקר עוברי ו-1% פניצילין-סטרפטומיצין, בטמפרטורה של 37°C, תחת אטמוספירה לחה המכילה 5%CO2, כנקודת מוצא לצעדים הבאים.
- תרבית משנה של התאים באמצעות מלח סטרילי 1x פוספט חוצץ (PBS), pH 7.4, כדי לשטוף את התאים לפני הוספת 0.05% חומצה טריפסין-ethylenediaminetetraacetic (EDTA).
הערה: הימנע משימוש בתאים שעברו מספר מעברים מוגזם (מקסימום 20). לבדוק באופן קבוע תרביות תאים עבור זיהום מיקופלסמה.
3. ייצור rAAV על ידי טרנספקציה חולפת
- יום 1: ציפוי תאים
- עבור כל ייצור ויראלי, צלחת HEK293T תאים לתוך 10 צלחות תרבית מטופלות (15 ס"מ קוטר) יום לפני transfection, בצפיפות של 10.5 × 106 תאים לכל צלחת ב 22 מ"ל של מדיום תרבית תוספת לדגור במשך 24 שעות עד התאים הם 70%-80% confluent ומוכן transfection.
- יום 2: טרנספקציה של תאים באמצעות פוליאתילנימין (PEI)
- עבור כל ייצור ויראלי (שווה ערך ל -10.5 מנות), הגדר את תערובת הטרנספקציה הבאה בצינור מיקרוצנטריפוגה: 54.6 מיקרוגרם של pITR; 45.675 מיקרוגרם של pRV1; 45.675 מיקרוגרם של pH21 או pAAV2/9n; 109.2 מיקרוגרם של pFdelta6. ערבב על-ידי הקשה.
- הוסף את התערובת ל 4.557 מ"ל של DMEM ללא תוספת בצינור צנטריפוגה 50 מ"ל. ערבב על-ידי הקשה.
- הוסף 1.365 מ"ל של תמיסת PEI סטרילית במינון של 1 מ"ג/מ"ל (pH 7.4), טיפה אחר טיפה. ערבב על-ידי הקשה. דגירה במשך 10 דקות בטמפרטורת החדר כדי לאפשר היווצרות של מתחמי DNA-PEI.
- הוסף תערובת זו ל 231 מ"ל של DMEM שחומם מראש. החלף את כל מדיום התרבות של כל מנה עם 22 מ"ל של תערובת transfection זו. לדגור על התאים במשך 48 שעות.
הערה: שלב זה חייב להתבצע בזהירות כדי למנוע ניתוק תאים.
- יום 4: קציר תאים
- כאשר pITR מקודד כתב פלואורסצנטי, דמיינו את התאים הנגועים תחת מיקרוסקופ פלואורסצנטי.
- אספו את המדיום מכל צלחת לתוך צינורות צנטריפוגות של 50 מ"ל וצנטריפוגו אותם ב 800 × גרם למשך 10 דקות. השליכו את הסופרנטנט.
הערה: שלב זה הוא אופציונלי ומטרתו לשחזר תאים נגועים שאולי התנתקו עקב מפגש גבוה מאוד. - הוסיפו 10 מ"ל PBS שחומם מראש לכל צלחת. הסר בעדינות את התאים עם מגרד תאים ואסוף את התרחיף לתוך צינורות הצנטריפוגות 50 מ"ל משלב 3.3.2.
- שטפו 5 כלים בכל פעם עם תוספת של 10 מ"ל PBS והעבירו את המתלה לצינורות הצנטריפוגות של 50 מ"ל משלב 3.3.3. מטילים את התאים ב 800 × גרם במשך 10 דקות ומשליכים את supernatant.
- להקפיא את כדורי התא ב -80 ° C.
הערה: ניתן לאחסן כדורי תאים למשך מספר חודשים (נקודת השהיה).
4. מיצוי rAAV וטיהור FPLC
- יום 5: הכנת תאים ליזט
- הפשירו את כדורי התא בטמפרטורת החדר. להשהות מחדש את התאים שנאספו מ -10 הכלים ב -100 מ"ל של חיץ סטרילי המכיל 150 mM נתרן כלורי (NaCl) ו 20 mM Tris, pH 8.0, במים טהורים במיוחד (סוג I). ערבבו את המתלים על ידי פיפטציה למעלה ולמטה, כדי להבטיח מתלה הומוגני.
- הוסף 12.5 מ"ל של תמיסה סטרילית טרייה של 10% נתרן deoxycholate במים טהורים במיוחד כדי לגרום ליזה התא. מערבבים על ידי פיטינג למעלה ולמטה.
הערה: יש להשליך נתרן דאוקסיכולאט, כמו גם את החומרים הבאים איתו במגע, בהתאם לגיליון נתוני בטיחות החומרים ולהנחיות המסופקות על ידי המשרד לבריאות ובטיחות סביבתית של המוסד. מומלץ גם ללבוש מסכת פנים בזמן הטיפול באבקה זו. לאחר ערבוב, הפתרון הופך צמיג מאוד. - הוסף 27 μL של נוקלאז בנזונאז לתערובת הקודמת. מערבבים היטב על ידי פיפטוף למעלה ולמטה עד שהדגימה כבר לא צמיגה. דגירה ב 37 ° C במשך 1 שעה, ביצוע מערבולת כל 10 דקות.
הערה: אנדונוקלאז זה מסוגל לפרק ביעילות את כל צורות הדנ"א והרנ"א מבלי להפגין פעילות פרוטאוליטית כלשהי. - הסר פסולת תאית על ידי צנטריפוגה של התערובת ב 3,000 × גרם במשך 60 דקות ב 25 ° C. מסננים את הסופרנאטנט עם מסנן מזרק סטרילי פוליווינילידן דיפלואוריד (PVDF) 0.45 מיקרומטר ומעבירים אותו למיכל סטרילי חדש.
הערה: שלב חשוב זה מבטיח שרוב הפסולת התאית תוסר, ובכך מונע סתימה של עמודות הכרומטוגרפיה. שמור aliquot קטן של תערובת זו לניתוח (צעד אופציונלי).
- יום 5 (המשך): טיהור טור הפרין של rAAVs
הערה: יישום לדוגמה יכול להתבצע באמצעות משאבה לדוגמה או סופרלופ 50 מ"ל או 150 מ"ל כחלק מהמערכת. מכיוון שיותר אוויר מומס בטמפרטורות נמוכות יותר, חשוב לאפשר מספיק זמן למאגרים ולתמיסות (המאוחסנים בדרך כלל ב -4 מעלות צלזיוס) להתאקלם לטמפרטורת החדר לפני השימוש בהם במערכת FPLC.- אופציונלי: אם המערכת אוחסנה לפרקי זמן ארוכים, מלא את המערכת ואת כל הפתחים בתמיסת אחסון טרייה (20% אתנול) באמצעות הוראות ידניות או שיטת ניקוי מערכת מוגדרת מראש במקום (system CIP).
- שטפו לחלוטין את נתיב זרימת הנוזל במים סטריליים טהורים במיוחד באמצעות הוראות ידניות או שיטת CIP מוגדרת מראש.
- חבר עמודת הפרין ארוזה מראש של 1 מ"ל, הגדר את אזעקת הלחץ ושטוף עם חמישה נפחי עמודות (CVs) של מים טהורים במיוחד בקצב זרימה של 1 מ"ל/דקה.
- החלף את התמיסות במגש החיץ ממים טהורים במיוחד לחיץ A (תמיסה סטרילית של 100 mM NaCl ו- 20 mM Tris, pH 8, במים טהורים במיוחד) עבור כניסה A (משאבת מערכת A) ולמאגר B (תמיסה סטרילית של 500 mM NaCl ו- 20 mM Tris, pH 8, במים טהורים במיוחד) עבור כניסה B (משאבת מערכת B). אם למערכת יש משאבת דגימה, מקם את כניסת החיץ של שסתום כניסת הדגימה במאגר A.
- שטפו את משאבת המערכת B בחיץ B ומלאו את שאר נתיב זרימת הנוזלים בחיץ A.
הערה: במידת הצורך, נתק את העמודה מנתיב הזרימה וחבר אותה מחדש לאחר מכן. - הכנס צינור כניסה לדוגמה משסתום הכניסה לדוגמה, לדוגמה, S1, במיכל עם ההכנה הוויראלית המתקבלת בשלב 4.1.4. (מתוך הכנת התא ליזט). הגדילו את נתיב הזרימה מכניסת הדגימה S1 לשסתום ההזרקה עם תמיסת הדגימה. לחלופין, מלא סופרלופ של 50 מ"ל או 150 מ"ל בדגימה המכילה rAAV באמצעות מזרק של 50 מ"ל.
- אזנו את העמודה לנפח כולל של חמישה קורות חיים באמצעות 12.5% ממאגר B בקצב של 1 מ"ל/דקה.
- החל את הנפח הכולל של הדגימה לתוך העמודה באמצעות משאבת הדגימה (בחר הזרקת כל הדגימה באמצעות חיישן אוויר) או הסופרלופ במהירות של 0.5 מ"ל/דקה ואסוף את הזרימה באמצעות יציאת היציאה במיכל סטרילי חדש.
הערה: כאשר תכונת בקרת הזרימה למניעת לחץ יתר מופעלת, הזרימה תפחת באופן אוטומטי במקרה של סתימת עמודות. אם קצב הזרימה יורד משמעותית מתחת ל-0.5 מ"ל/דקה, עצרו את יישום הדגימה, בצעו שטיפה עם 2-5 קורות חיים של חיץ A ולאחר מכן חדשו את יישום הדגימה. - שטפו את העמוד ב-1 מ"ל/דקה עם 20 קורות חיים של חיץ A, ואספו את הזרימה באמצעות יציאת השקע.
- הקצה את המדגם ב- 1 מ"ל לדקה עם התוכנית הבאה: i) שיפוע ליניארי עם יעד של 50% של חיץ B עבור חמישה קורות חיים; 2) צעד עם יעד של 90% של חיץ B במהלך חמישה קורות חיים; iii) צעד עם יעד של 100% של חיץ B במהלך חמישה קורות חיים.
- אסוף את הדגימה המדוללת בשברים של 1 מ"ל באמצעות אספן שברים ושפופרות מיקרוצנטריפוגות בעלות שימור נמוך (2 מ"ל) ואחסן אותן בטמפרטורה של -20 מעלות צלזיוס.
הערה: ניתן לאחסן את שברי rAAV למשך מספר שבועות (נקודת השהיה). - אזנו מחדש את העמודה ב-1 מ"ל/דקה עם 12.5% חיץ B עבור חמישה קורות חיים.
- החלף את הפתחים מתמיסות החיץ למים טהורים במיוחד ושטוף את העמוד ב 1 מ"ל / דקה במשך חמישה קורות חיים.
- החליפו את הפתחים ממים טהורים במיוחד לאתנול 20% ושטפו את העמוד ב-1 מ"ל/דקה במשך חמישה קורות חיים. נתקו את העמוד ואחסנו אותו בטמפרטורה של 4°C.
הערה: ניתן לעשות שימוש חוזר בעמודות מספר פעמים ללא הליכי ניקוי וחיטוי גדולים אחרים אם נעשה שימוש באותו סרוטיפ rAAV וטרנסגן. - שטפו לחלוטין את נתיב זרימת הנוזל עם 20% אתנול באמצעות הוראות ידניות או שיטת CIP מוגדרת מראש.
5. ריכוז rAAV מטוהרים
- יום 6: ריכוז שלב 1
- רכז rAAV באמצעות יחידת מסנן צנטריפוגלית של 15 מ"ל עם חיתוך משקל מולקולרי של 100 kDa . טען את השברים הרצויים המכילים rAAV (שברי FPLC 7 עד 16) ליחידת המסנן הצנטריפוגלי של 15 מ"ל וצנטריפוגה אותו במהירות של 2,000 × גרם למשך 2 דקות בטמפרטורת החדר. ודא שהנפח המרוכז ביחידת המסנן הוא כ- 500 μL. אם הנפח המרוכז עולה במידה רבה על 500 μL, חזור על שלבי הצנטריפוגה במרווחים של דקה אחת עד שהיא מגיעה לנפח הרצוי.
- יום 6 (המשך): חילופי חיץ
- הוסף 1 מ"ל של PBS סטרילי ליחידת המסנן הצנטריפוגלית המכילה את rAAVs. בזהירות פיפטה למעלה ולמטה כדי לשטוף את המסנן. צנטריפוגה ב-2,000 × גרם במרווחים של דקה אחת עד להגעה לנפח הסופי של 500 מיקרוליטר.
- יום 6 (המשך): שלב ריכוז 2
- העבר את 500 μL של rAAV מרוכזים שהתקבלו בשלב הקודם ליחידת מסנן צנטריפוגלית של 0.5 מ"ל עם חיתוך משקל מולקולרי של 100 kDa וצנטריפוגה ב 6,000 × גרם למשך דקה אחת. במידת הצורך, חזור על שלב הצנטריפוגה עד שתגיע לנפח סופי של פחות מ -100 μL.
- יום 6 (המשך): התאוששות
- כדי לשחזר את rAAV מרוכז, הנח את התקן המסנן הפוך בצינור איסוף מיקרוצנטריפוגות חדש. מניחים את הצינור במיקרו-צנטריפוגה עם המכסה לכיוון המרכז ומבצעים סיבוב ממושך בתוך תא הזרימה כדי להעביר rAAV מרוכזים מהמכשיר לצינור המיקרוצנטריפוגה. לחלופין, צנטריפוגה ב 1,000 × גרם למשך 2 דקות.
- תוסף עם F-68 פלורוני סטרילי 0.001% (אופציונלי).
הערה: F-68 פלורוני הוא חומר פעילי שטח לא יוני שאושר לשימוש בבני אדם על ידי מנהל המזון והתרופות האמריקאי, המסוגל להפחית הפסדים של rAAV על ידי מניעת האינטראקציות שלהם עם פני השטח של חומרים (פלסטיק) המשמשים במהלך הכנת דילול, העמסת מזרקים וציוד משלוח55,56. - Aliquot rAAVs לתוך צינורות מיקרוצנטריפוגות בעלות שימור נמוך ולאחסן ב -80 ° C (נקודת השהיה).
6. כימות של rAAV מטוהרים
- יום 6 (המשך): לקבוע את הטיטר של תכשירי rAAV, המתבטאים בגנומים נגיפיים/μL (vg/μL), על ידי תגובת שרשרת כמותית בזמן אמת של פולימראז (RT-qPCR) באמצעות ערכה מסחרית ובהתאם להוראות היצרן.
- דגור על תמיסת חלקיקי rAAV עם DNase I בטמפרטורה של 37°C למשך 20 דקות.
הערה: הליך זה מקדם עיכול של DNA גנומי חופשי ודנ"א פלסמיד שמקורו בתאים מארחים, ובכך מבטיח שרק רצף חומצות הגרעין בתוך חלקיקי rAAV שלמים יישמר. - DNase I מושבת בחום ב-95°C למשך 10 דקות.
- הוסף חיץ ליזיס ודגור במשך 10 דקות ב 70 ° C כדי לקדם דנטורציה חום של חלבונים של חלקיקי rAAV.
- דלל את תמיסת הגנום rAAV המתקבלת במאגר דילול לפני שתמשיך ל- RT-qPCR. הכן קבוצה של סטנדרטים מדוללים סדרתית של הבקרה החיובית (מ 2 × 107 vg / μL ל 2 × 102 vg / μL) שסופק עם הערכה.
- בצע תערובת תגובה המכילה 12.5 μL של תערובת Taq II, 0.5 μL של תערובת פריימר מדולל, 7 μL של מים ו- 5 μL של DNA rAAV מדולל (דגימת AAV לא ידועה ותקנים משלב 6.1.4).
- בצע את RT-qPCR במערכת זיהוי PCR בזמן אמת, באמצעות הפרוטוקול הבא: מחזור אחד ב- 95 ° C למשך 2 דקות (דנטורציה ראשונית) ו- 40 מחזורים ב- 95 ° C עבור 5 שניות (דנטורציה) ו- 60 ° C במשך 30 שניות (חישול, הרחבה וקריאת לוחות), ולאחר מכן ניתוח עקומת התכה.
- חישוב ריכוז המדגם המוחלט מהעקומה הסטנדרטית (קו רגרסיה ליניארית), בהתחשב בגורם הדילול הנובע מהכנת הדגימה rAAV.
הערה: כימות מספר הגנומים הנגיפיים מושג באמצעות הגברה של רצף ITR של AAV2 (רצף המטרה של הפריימרים המסופקים על ידי הערכה).
- דגור על תמיסת חלקיקי rAAV עם DNase I בטמפרטורה של 37°C למשך 20 דקות.
7. SDS-PAGE, כתמים כחולים של קומאסי וכתם מערבי
- נטרול 40 μL מכל דגימה (כל חלק FPLC; הזרימה; דגימות קדם-עמודה, וסך של 2.3 ×10 10 ק"ג של המוצר המרוכז הסופי) על ידי הוספת מאגר דגימה 6x (0.5 M Tris-HCl/0.4% נתרן דודציל סולפט (SDS) pH 6.8, 30% גליצרול, 10% SDS, 0.6 M dithiothreitol (DTT), 0.012% ברומופנול כחול) ודגירת הדגימות במשך 5 דקות ב-95°C.
- טען את הדגימות שעברו דנטורציה (48 μL) לתוך ג'ל SDS-polyacrylamide (4% ערימה ו-10% ג'ל מפענח) ובצע את ההפרדה האלקטרופורטית במתח של 100 וולט למשך 70 דקות, בצמוד לסולם חלבונים.
- ניתוח חלבונים
הערה: ניתן לבצע צביעה כחולה של קומאסי או כתמים מערביים.- כתמים כחולים של קומאסי
- כדי להמחיש רצועות חלבון, הכתימו את הג'ל למשך 10 דקות בתמיסת G250 כחולה קומאסי 0.25% מומסת ב-50% מתנול ו-10% חומצה אצטית קרחונית.
- בצע עיכוב ג'ל על ידי שטיפתו מספר פעמים עם תמיסה המכילה 25% מתנול ו 5% חומצה אצטית קרחונית עד להקות שקופות עם רקע נמוך להיות גלוי.
- צלם תמונות באמצעות מערכת הדמיה מתאימה.
- כתם מערבי
- מעבירים את החלבונים לקרום PVDF על פי פרוטוקולים סטנדרטיים.
- לחסום את הממברנה על ידי דגירה בחלב 5% ללא שומן מדולל TBS-T (0.1% Tween 20 במי מלח חוצצים Tris) למשך שעה אחת בטמפרטורת החדר.
- השתמש בנוגדנים העיקריים הבאים (מדוללים בתמיסת חסימה) לדגירת לילה ב -4 מעלות צלזיוס: נוגדן חד-שבטי עכבר נגד AAV, VP1, VP2, נוגדן VP3 (B1, 1:1,000), או נוגדן חד-שבטי עכבר נגד AAV, VP1, VP2 (A69, 1:1,000).
- שטפו את הממברנות במשך 3X15 דקות ב-TBS-T ודגרו עם נוגדן משני נגד עכבר נגד עכברים המקושר לפוספטאז אלקליין (1:10,000), למשך שעתיים בטמפרטורת החדר.
- שטפו את הממברנות במשך 3X15 דקות ב-TBS-T. הוסף מצע כימיפלואורסצנטי משופר (ECF) והצג באופן חזותי רצועות חלבונים באמצעות הדמיה כימיפלואורסצנטית.
- כתמים כחולים של קומאסי
8. מיקרוסקופ אלקטרונים שידור (TEM)
- הניחו רשת רשת 200 מצופה פחמן Formvar הפוכה על גבי טיפה של דגימת rAAV ואפשרו לה להסתפק בדקה אחת.
- שטפו את הרשתות בטיפת מים וייבשו את עודפי הנוזלים בנייר פילטר.
- הכתימו לרעה את הרשתות בתמיסת אורניל אצטט 1% (pH 7) למשך דקה אחת כדי לתקן ולהנגיד את החלקיקים הנגיפיים.
- שטפו את הרשתות בטיפת מים וייבשו את עודפי הנוזלים בנייר פילטר.
- בחנו את הדגימות במיקרוסקופ אלקטרונים תמסורת.
הערה: ריכוזי מלח גבוהים עשויים להשפיע ישירות על הקישור של rAAV לרשת ולהוביל להדמיה של מבנים דמויי גביש.
9. בליעת אור אולטרה סגול נראה ברציפות, פיזור אור סטטי וניתוח פיזור אור דינמי
- על לוח כימות של 96 בארות, טען 2 μL של דגימת rAAV ו- 2 μL של PBS שישמשו כחיץ ריק (בצע זאת בכפילויות).
- השתמש ביישום AAV Quant בתוכנת ניתוח הלקוח, מקם את שמות הדגימות במיקום הנכון של הלוח, בחר את סרוטיפ AAV ולחץ על הבא.
- טען את לוחית הכימות של 96 בארות לתוך הציוד הייעודי והמשך בקריאת לוחות לרכישת נתונים.
10. בדיקות התמרה חוץ גופית
- ניתן להשתמש בקווי תאים שונים כדי לנתח במהירות את יעילות ההמרה של rAAVs.
- זרעו באופן שווה תאי HEK293T בצלחות של 24 בארות (בצפיפות של 137,500 תאים / באר) וקו תאי נוירובלסטומה-2A (Neuro2a) של עכבר בצלחות של 24 בארות (50,000 תאים / באר) או בשקופית של 8 בארות (27,000 תאים / באר), באמצעות גלוקוז גבוה DMEM, בתוספת 10% נסיוב בקר עוברי ו -1% פניצילין-סטרפטומיצין, כמתואר לעיל. אפשרו לתאים להיצמד למשך הלילה לטמפרטורה של 37°C (75 °F) באטמוספירה לחה המכילה 5% CO2.
- אספו מדיום מותנה מכל באר (250 μL מצלחות 24 בארות ו-50 μL משקופית תא 8 בארות) ואחסנו אותו בטמפרטורה של 4°C לשימוש מאוחר יותר.
- הוסף את תכשירי rAAV הבאים לכל באר ודגר על התאים במשך 24 שעות ב 37 ° C באטמוספירה 5% CO2 .
- הוסף 50 μL של שברים שנאספו FPLC F2-F16 וזרם לתאים HEK293T המצופים בלוחות של 24 בארות.
- הוסף סך של 5.5 × 109 ק"ג של rAAV מרוכז מדולל ב 50 μL של PBS לתאי Neuro2a המצופים בלוחות 24 בארות (כולל באר בקרה שלילית, על ידי הוספת 50 μL של PBS לתאים).
- הוסף סך של 2.75 × 109 ק"ג של rAAV מרוכז מדולל ב 25 μL של PBS לתאי Neuro2a המצופים בשקופית תא 8 בארות (כלול את תנאי הבקרה השלילית, על ידי הוספת 50 μL של PBS לתאים).
- הוסף את המדיום המותנה שאוחסן בעבר (שלב 10.1.2) לכל באר ודגרה במשך 24 שעות.
- השליכו את המדיום ושטפו את התאים 2x עם PBS.
- הוסיפו לכל באר תמיסת פרפורמלדהיד (PFA) 4%, בתוספת 4% סוכרוז ב-PBS, שחוממה מראש ל-37°C, ודגרו בטמפרטורת החדר למשך 20 דקות.
- יש לשטוף פעמיים עם PBS ולאחסן בטמפרטורה של 4°C עד לביצוע ההדמיה (נקודת השהיה).
- קבל תמונות במיקרוסקופ פלואורסצנטי הפוך המצויד במטרה 10x/0.30, או במיקרוסקופ קונפוקלי הפוך המצויד במטרה 40x/1.4 Oil DIC.
- כדי לקבל מודל רלוונטי יותר רפלקטיבי של הסביבה in vivo, השתמש בתרבויות עצביות ראשוניות כדלקמן:
- להכין תרביות ראשוניות של נוירונים קליפת המוח כפי שתואר בעבר על ידי סנטוס ואחרים.57. בקצרה, זרעו 200,000 תאים/מ"ל בצלחות 12 בארות ושמרו אותם בתרבית עד היום במבחנה 16.
- אספו מדיום מותנה מכל באר (100 מיקרוליטר) ואחסנו אותו בטמפרטורה של 4°C לשימוש מאוחר יותר.
- הוסף את rAAVs להיבדק לכל באר: סך של 2.75 × 109 vg של rAAV מרוכז מדולל ב 25 μL של PBS (כולל הבקרה השלילית: 25 μL של PBS). יש לדגור במשך 24 שעות בטמפרטורה של 37°C באטמוספירה של 5% CO2 .
- מוסיפים את המדיום המותנה שאוחסן קודם לכן ודוגרים במשך 24 שעות.
- יש להשליך את המדיום בכל באר ולשטוף 2x עם PBS.
- תקן את התאים עם 4% PFA / 4% סוכרוז ב- PBS, כמתואר בשלב 10.1.6. יש לשטוף פעמיים עם PBS.
- לדגור על כל באר עם 5 מיקרוגרם/מ"ל של אגלוטינין נבט חיטה (WGA) מצומד עם Alexa Fluor 633 למשך 10 דקות בטמפרטורת החדר (שלב אופציונלי: לבצע אימונוציטוכימיה במקום). יש לשטוף פעמיים עם PBS.
- יש לדגור ב-0.25% Triton X-100 ב-PBS למשך 5 דקות בטמפרטורת החדר. יש לשטוף עם PBS.
- יש לדגור עם 4',6-diamidino-2-phenylindole (DAPI) למשך 5 דקות בטמפרטורת החדר. יש לשטוף פעמיים עם PBS.
- קבל תמונות במיקרוסקופ פלואורסצנטי הפוך המצויד במטרה 40x/0.95, או במיקרוסקופ קונפוקלי הפוך המצויד במטרה 40x/1.4 Oil DIC.
11. ניסויי In vivo
הערה: בעלי החיים שוכנו בחדר מבוקר טמפרטורה, מתוחזק על מחזור אור / חושך של 12 שעות. מזון ומים סופקו עד לליביטום. כל המאמצים נעשו כדי למזער את סבלם של בעלי החיים.
- הזרקה סטריאוטקסית במוח הקטן
- יש להרדים בעלי חיים C57BL/6 בני 9 שבועות על ידי שאיפה של 2% איזופלורן בנוכחות חמצן (0.8 ליטר/דקה) בתא המחובר לוופורייזר.
- הניחו את בעל החיים המורדם במנגנון הסטריאוטקסי (על פד מחומם בטמפרטורה של 35 מעלות צלזיוס) והניחו את מסכת האיזופלורן באפו של בעל החיים. הורידו את רמת האיזופלורן ל-1.3-1.7%.
הערה: ודא כי בעל החיים מורדם כראוי לפני המשך (אובדן רפלקס לכיפוף בשתי הגפיים האחוריות). - החל משחת עיניים סיכה כדי למנוע ייבוש של הקרניות ולהזריק את החיה עם משכך כאבים מאושר.
הערה: כל השלבים הבאים חייבים להתבצע בתנאים סטריליים. - לאחר גילוח פרוות ראשו של בעל החיים וחיטוי אזור הניתוח, חושפים את הגולגולת ומניחים את קצה מחט הזרקת 30 גרם קהה, המחוברת למזרק המילטון 10 מיקרוליטר, ישירות מעל ברגמה (השתמש בברגמה כאפס לחישוב קואורדינטות סטריאוטקסיות).
- הזיזו את המחט לקואורדינטה המיועדת וקדחו חור דרך הגולגולת שאליו תיכנס המחט.
הערה: במסגרת מחקר זה בוצעה זריקה בודדת במרכז המוח הקטן. - הזריקו 4 μL של תמיסה של rAAV המכילה סך של 8 × 109 vg, מדוללת ב-PBS, בקצב עירוי של 0.5 μL/min באמצעות מזרק אוטומטי. השתמש בקואורדינטות הבאות, המחושבות מברגמה, כדי לבצע זריקה יחידה במרכז המוח הקטן של עכבר C57BL/6 בוגר: אנטרו-אחורי: -6.5 מ"מ; לרוחב: 0 מ"מ; גחון: -2.9 מ"מ.
הערה: קואורדינטות אלה עשויות להשתנות בהתאם לזן העכבר, המין והגיל של בעלי החיים שבשימוש. - כדי למזער את הזרימה החוזרת ולאפשר את הדיפוזיה הווקטורית הנגיפית, לאחר השלמת העירוי, השאירו את מחט המזרק בקואורדינטות אלה למשך 3 דקות, ואז משכו אותה לאט ב-0.3 מ"מ, ואפשרו לה להישאר במקומה למשך 2 דקות נוספות לפני הוצאתה המלאה ממוח העכבר.
- סגרו את החתך ונקו אותו עם חומר חיטוי (למשל, 10% פובידון-יוד).
- אפשרו לבעלי החיים להתאושש מההרדמה לפני החזרתם לכלובים הביתיים שלהם.
- איסוף רקמות והכנתן
הערה: בניסוי זה, רמות ההתמרה נצפו 12 שבועות לאחר ההזרקה, אך ניתן להעריך את אותו הליך כבר 4 שבועות לאחר ההזרקה.- הרדמה סופנית של בעלי החיים על ידי מתן תוך צפקי של מנת יתר של קסילזין/קטמין (8/160 מ"ג/ק"ג משקל גוף).
- יש לנקב את בעלי החיים עם PBS קר כקרח למשך 6 דקות בקצב של 2.5 מ"ל/דקה, ולאחר מכן את הזילוח עם תמיסת 4% PFA טרייה שהוכנה כקרח למשך 10 דקות באותו קצב.
- לאחר תיקון המוחות שנכרתו ב-4% PFA למשך הלילה בטמפרטורת החדר ולאחר מכן העבר אותם לתמיסת 25% סוכרוז/PBS להגנה קריו-הגנה. ברגע שהמוח שוקע (כ-48 שעות מאוחר יותר), אחסנו אותם בטמפרטורה של -80°C.
- חותכים חתכים טוריים sagittal עם עובי של 30 מיקרומטר באמצעות cryostat ב -21 ° C. עבור כל בעל חיים, אספו 96 מקטעים של חצי כדור המוח בסדרה אנטומית כמקטעים צפים חופשיים ב-PBS בתוספת 0.05% נתרן אזיד. יש לאחסן בטמפרטורה של 4°C עד לעיבוד נוסף.
- אימונוהיסטוכימיה פלואורסצנטית סטנדרטית
- בחר שמונה קטעי קשת לכל חיה, במרחק של 240 מיקרומטר זה מזה.
- יש לדגור על החלקים הצפים בחופשיות בתמיסת חסימה/חדירה (0.1% Triton X-100 המכיל 10% סרום עיזים רגיל (NGS) ב-PBS) למשך שעה אחת בטמפרטורת החדר.
- יש לדגור על החלקים למשך הלילה בטמפרטורה של 4°C עם נוגדן ראשוני רב-שבטי נגד GFP עוף (1:1,000).
- יש לשטוף במשך 3 x 15 דקות ב-PBS ולדגור על המקטעים במשך שעתיים בטמפרטורת החדר עם נוגדן הנוגדן המשני עז רב-שבטי אנטי-עוף מצומד לפלואורופור אלקסה פלואור 488 (1:200).
- יש לכבס במשך 3 x 15 דקות ב-PBS. יש לדגור עם DAPI במשך 5 דקות בטמפרטורת החדר.
- יש לכבס במשך 3 x 15 דקות ב-PBS. מניחים את המקטעים במגלשות מצופות ג'לטין ומכסים באמצעי הרכבה פלואורסצנטיים.
- קבל תמונות במיקרוסקופ פלואורסצנטי של סורק שקופיות המצויד במטרה של 20x/0.8.
תוצאות
בעבודה זו אנו מציגים פרוטוקול מפורט לייצור, טיהור ואפיון של rAAV פסיפס (מסוכם באיור 1), שיש להם פוטנציאל לכוון ולהתמיר את מערכת העצבים המרכזית (למשל AAV1 ו-AAV9), בהיותם מתאימים בו זמנית לטיהור כרומטוגרפיית זיקה הפרין (AAV2). כדי להשיג זאת, קפסידים מסרוטיפים טבעיים של AAV 1, 2 ו-9 שימשו לפיתוח וקטורי פסיפס rAAV1/2 ו-rAAV2/9.
לפני שמתחילים, תכשירי פלסמיד נבדקו לשלמות מבנית. בנוסף לעיכול הדרוש כדי לאמת את ההכנסה הנכונה של מקטעי שיבוט, חיוני לסנן באופן עקבי פלסמידים pITR כדי לזהות מחיקות/החדרות ITR פוטנציאליות. לדוגמה, שלמות ITR בשיבוטים שונים של פלסמיד pITR נוטרה לאחר עיכול הפלסמיד באמצעות אנזים ההגבלה SmaI (איור משלים S1).
שני סוגי וקטורי הפסיפס נוצרו על ידי טרנספקציה משותפת של פלסמידים קפסידים AAV בהתאמה ביחס של 1:1, על פי שיטות טרנספקציה סטנדרטיות6. בקצרה, תאי HEK293T הודבקו ב-i) פלסמיד המכיל את הטרנסגן המעניין הדחוס בין רצפי ה-ITR (pITR), ב) פלסמיד המכיל את גנום ה-AAV הפראי Rep ו-Cap ORFs של AAV2 ו-AAV1 או AAV9 (פלסמידים pAAV-RC) ו-iii) פלסמיד המקודד את חלבוני האדנו-ויראלי (E1A, E1B, E4 ו-E2A) וכן את ה-RNA הקשור לווירוס אדנו-וירוס החיוני לתפקודי עזר (pHelper). ארבעים ושמונה שעות לאחר מכן, התאים נקצרו 6,36, ו-rAAV טוהרו מההומוגנט של התא על ידי כרומטוגרפיית זיקה באמצעות מערכת FPLC. כפי שמתואר באיור 2A, לאחר שיווי משקל עמודה (שלב שיווי משקל), התא ליזט המכיל את rAAVs הוחל על העמודה (טעינת דגימה). בשל הזיקה הטבעית של rAAV2 עבור הפרין33, rAAV נקשרו לשרף העמודה, בעוד רכיבים אחרים בוצעו בחיץ הריצה וזוהו על ידי צג UV (flowthrough), וכתוצאה מכך עלייה בספיגה. לאחר מכן נשטף העמוד (שלב שטיפה) ו-rAAV דולל לבסוף על ידי עלייה בריכוז NaCl (שלב אלוציה). הנגיפים המדוללים זוהו על ידי צג UV ונאספו בשברים של 1 מ"ל.
פרופיל שיא אלוציה מייצג של rAAV1/2 ו-rAAV2/9 מוצג באיור 2B ובאיור המשלים S2A, בהתאמה, כאשר אצוות נגיפיות שונות מציגות באופן עקבי שיא יחיד החל משבריר F7 ועד F16. גובה שיא משתנה בין הפקות rAAV, כאשר פסגות גבוהות יותר מובילות בדרך כלל לתשואות rAAV גבוהות יותר. כל חלק של rAAV1/2 ו-rAAV2/9 שהופקו אופיין לאחר מכן על-ידי RT-qPCR כדי להעריך טיטרים נגיפיים (איור 2C ואיור משלים S2B).
כדי לאפיין את טוהר החומר המדולל, נבדקו 40 μL מכל שבר ומהזרימה המתאימה באמצעות אלקטרופורזה של ג'ל SDS-polyacrylamide 10% (איור 2D עבור rAAV1/2 ואיור משלים S2C עבור rAAV2/9). צביעה כחולה של קומאסי חשפה שלושה פסים עיקריים בשברים F7-F16, עם משקלים מולקולריים המתאימים לחלבוני הקפסיד VP1 (87 kDa), VP2 (72 kDa) ו-VP3 (62 kDa) של AAVs ביחס המתאים 1:1:10, כפי שתואר קודם לכן על ידי ואן ולייט ועמיתיו14. בשני המקרים, ובהתבסס על ספיגת UV, RT-qPCR ועוצמת רצועת הג'ל, ברור שרוב rAAV פסיפס קיים בשברים F7 ו- F8 ומתחיל לרדת בהדרגה בשברים F9-F16. בנוסף לשלושת חלבוני הקפסיד הנגיפי, חלבון נוסף (או חלבונים) בגודל של כ-17 kDa זוהה/זוהה בשברים F8-F16.
כדי לסלק חלבונים מטהרים משותפים אלה, שברים F7-16 סוננו ורוכזו לאחר מכן באמצעות 100 יחידות סינון צנטריפוגליות של KDa, וטיטר rAAV הסופי נקבע על-ידי RT-qPCR (כפי שמוצג באיור 3A,B עבור rAAV1/2). התפוקה הסופית של ייצור rAAV תלויה באורך ובמורכבות של pITR, שלמות רצפי ITR, תנאי תרבית תאים (למשל, מספר מעברי תאים) ויעילות הטרנספקציה 24,58,59,60,61. עם זאת, ניתן לכוונן את הטיטר הסופי על ידי ביצוע מספר צנטריפוגות של הכנת rAAV באמצעות יחידות סינון צנטריפוגליות 0.5 מ"ל (שלב ריכוז 2). בהתאם לפרוטוקול זה, עבור נפח סופי בטווח של 50 עד 100 μL, הריכוזים מורכבים בדרך כלל בין 2 × 109 ו- 5 × 1010 vg/μL (כימות המבוצע באמצעות ערכת הטיטרציה המוזכרת).
טוהר מכיני ה-rAAV הסופיים הוערך לאחר מכן על ג'ל 10% SDS-polyacrylamide. כפי שמתואר באיור 3C, רק שלושה פסים המייצגים את חלבוני הקפסיד rAAVs נצפו עבור הכנת rAAV1/2 ולא זוהו חלבוני טיהור משותף הניתנים לזיהוי. תוצאות אלה היו עקביות עם אלה שהתקבלו עבור rAAV2/9 (איור משלים S2C). כדי לאשש את הזהות ולאפיין עוד יותר את הטוהר של וקטורי rAAV1/2 ו-rAAV2/9, נותחו שברים נגיפיים ומלאי מרוכז על ידי Western Blot, עם הנוגדנים הספציפיים B1 (איור משלים S3A ואיור משלים S4A) ו-A69 (איור משלים S3B ואיור משלים S4B). בעוד הנוגדן B1 מזהה אפיטופ C-terminal המשותף לכל חלבוני VP של רוב הסרוטיפים AAV62, השיבוט A69 מזהה רק אפיטופים של VP1 ו- VP263. עם זאת, ניתן לזהות כמה רצועות חלשות עם משקל מולקולרי נמוך מ-VP3 (<62 kDa) גם בתיוג B1 ו-A69.
כדי לאפיין את המורפולוגיה המבנית ולהעריך עוד יותר את הטוהר של rAAVs, החלקיקים הנגיפיים הודגמו ישירות על ידי TEM. טכניקה זו הייתה ההליך הסטנדרטי להערכת שלמות הדגימה וטוהר הדגימות בדגימות ויראליות, שכן היא מאפשרת כימות של חלקיקי rAAV ריקים ומלאים, כמו גם הערכת זיהום במדגם 29,64,65,66,67. כפי שניתן לראות באיור 3D, ניתן היה לצפות בכמויות גדולות של חלקיקי rAAV בקוטר ~25 ננומטר על רקע נקי. חלקיקים ריקים (חץ שחור) עם מרכז צפוף אלקטרונים, כמו גם וקטורים מלאים (חץ לבן) ניתן היה לראות גם בכל שדה הדגימה.
כמו כן, ביצענו בקרת איכות של ה-rAAV המטוהרים באמצעות Stunner, פלטפורמה המשלבת ספקטרוסקופיה אולטרה-סגולה-גלויה (UV-Vis), פיזור אור סטטי (SLS) ופיזור אור דינמי (DLS)68. עבור כל דגימה, הכמות הכוללת של חלבון, ssDNA, כמו גם ספיגת זיהומים ועכירות רקע, נמדדו באמצעות ספקטרוסקופיית UV-Vis (איור 3E ואיור משלים S5A). לאחר מכן יושמו SLS ו-DLS כדי להעריך את התנהגות פיזור האור של קפסידים rAAV. בהתחשב בכך של-AAV יש קוטר ממוצע של 25 ננומטר, חלקיקים בטווח קוטר של 15-45 ננומטר נחשבים שלמים. חלקיקים גדולים יותר מייצגים בדרך כלל אגרגטים נגיפיים, וכל דבר קטן יותר כולל ככל הנראה חלקיקים קטנים, כולל חלבוני קפסיד לא מורכבים68. עבור rAAV1/2, נצפתה פסגה יחידה המתאימה לחלקיקי קפסיד שלמים ב-30 ננומטר (איור 3F), עם 0% מעוצמת המצרפית ו-0% מעוצמת החלקיקים הקטנים. עבור תכשיר rAAV2/9, זוהה גם שיא של 30 ננומטר המייצג עוצמת קפסיד של 78% (איור משלים S5B). למרות שעוצמת החלקיקים הקטנים הייתה 0%, במדגם זה נמדדה עוצמה מצרפית של 22% (מתוארת באפור), כאשר התרומה העיקרית (19.9%) הגיעה מצברים גדולים בקוטר ממוצע של 620 ננומטר (איור משלים S5B). באמצעות השילוב של ספקטרוסקופיית UV-Vis עם מידע SLS ו-DLS, Stunner חשף את ה-total capsid titer, titer קפסיד מלא, חלבון חופשי וצבור, כמו גם ssDNA חופשי ומצטבר עבור שני התכשירים הנגיפיים, כפי שניתן לראות באיור 3G ובאיור המשלים S5C (ערכים ספציפיים המצוינים בכל מקרא איור).
במקביל, כדי להעריך את הפעילות הביולוגית של וקטורי הפסיפס AAV המפותחים, תאי HEK293T היו נגועים ב-50 μL מכל חלק שהתקבל על ידי FPLC (F2-F16) של הכנת rAAV1/2 או rAAV2/9. מאחר שווקטור rAAV1/2 מקודד חלבון פלואורסצנטי ירוק חד-גדילי (GFP), תחת בקרה של מקדם CMV (pAAV-CMV-ssGFP), ווקטור rAAV2/9 מקודד GFP משלים עצמי, תחת בקרה של מקדם CMV (pAAV-CMV-scGFP53), נבדקה פלואורסצנטיות ישירה של GFP בתאים אלה 48 שעות לאחר ההדבקה (איור משלים S6 ואיור משלים S7). באופן עקבי עם התצפיות הקודמות עבור RT-qPCR, כחול קומאסי וכתם מערבי, רמת ההדבקה הגבוהה ביותר הושגה עבור שברים נגיפיים F7 ו- F8, וירדה בהדרגה בשברים F9 עד F16.
כדי לאשר אם הפעילות הביולוגית של rAAVs נשמרה לאחר שלבי אולטרה-סינון וריכוז, תאי Neuro2A, המצופים הן בלוחות 24 בארות והן בשקופית תא של 8 בארות, הודבקו בווקטור rAAV1/2 מרוכז, המקודד scGFP תחת בקרה של מקדם CMV (pAAV-CMV-scGFP53). תמונות ברייטפילד ופלואורסצנטיות נרכשו 48 שעות לאחר ההדבקה (איור 4A,B עבור תמונות ברזולוציה גבוהה יותר).
במטרה לחקור את יכולת ההדבקה של rAAVs המיוצרים במודל תאים רלוונטי ומחזיר יותר, תרביות עצביות ראשוניות צפופות למחצה מקליפת המוח נזרעו על צלחת בת 12 בארות והודבקו ב- rAAV1/2 - CMV-scGFP שהיה בשימוש בעבר. ארבעים ושמונה שעות לאחר ההדבקה, התאים תוקנו ותויגו עם DAPI ו-WGA מצומדים עם Alexa Fluor 633, לקטין בשימוש נרחב כדי לתייג תאים קבועים. התמונות המוצגות באיור 4C,D נרכשו באמצעות Zeiss Axio Observer Z1 ובאמצעות LSM 710 קונפוקלי של Zeiss. כפי שמתואר באיורים אלה על ידי פלואורסצנטיות ישירה של GFP, נגיפי פסיפס מרוכזים משמרים את תכונות העברת הגנים שלהם עבור תאים עצביים.
לאחר שאפיינו rAAV פסיפס במונחים של טוהר, תכונות פיזיקליות ופונקציונליות במבחנה, הערכנו בשלב הבא את האפשרות להשתמש בווקטורי הפסיפס rAAV1/2 מטוהרים כדי להתמיר את המוח הקטן של עכברי C57BL/6. לשם כך, זריקה סטריאוטקסית בוצעה בעכברים בני 9 שבועות וביטוי GFP הוערך 12 שבועות לאחר מכן. כצפוי, בעלי חיים שהוזרקו להם PBS לא הפגינו פלואורסצנטיות בסימון החיסוני של GFP. תמונות אפיפלואורסצנטיות מעכברים שהוזרקו להם וקטורים rAAV1/2 המקודדים GFP תחת הבקרה של מקדם סינפסין 1 (rAAV1/2 - Syn-ssGFP) גילו כי וקטורים rAAV1/2 התמירו בהצלחה מספר אזורים במוח הקטן, כלומר אזור גרעיני המוח הקטן העמוק (DCN), כמו גם את האונות השונות של המוח הקטן (איור 5). תוצאות אלה מדגימות את הביטוי הממושך של הטרנסגן במוח היונקים (12 שבועות).
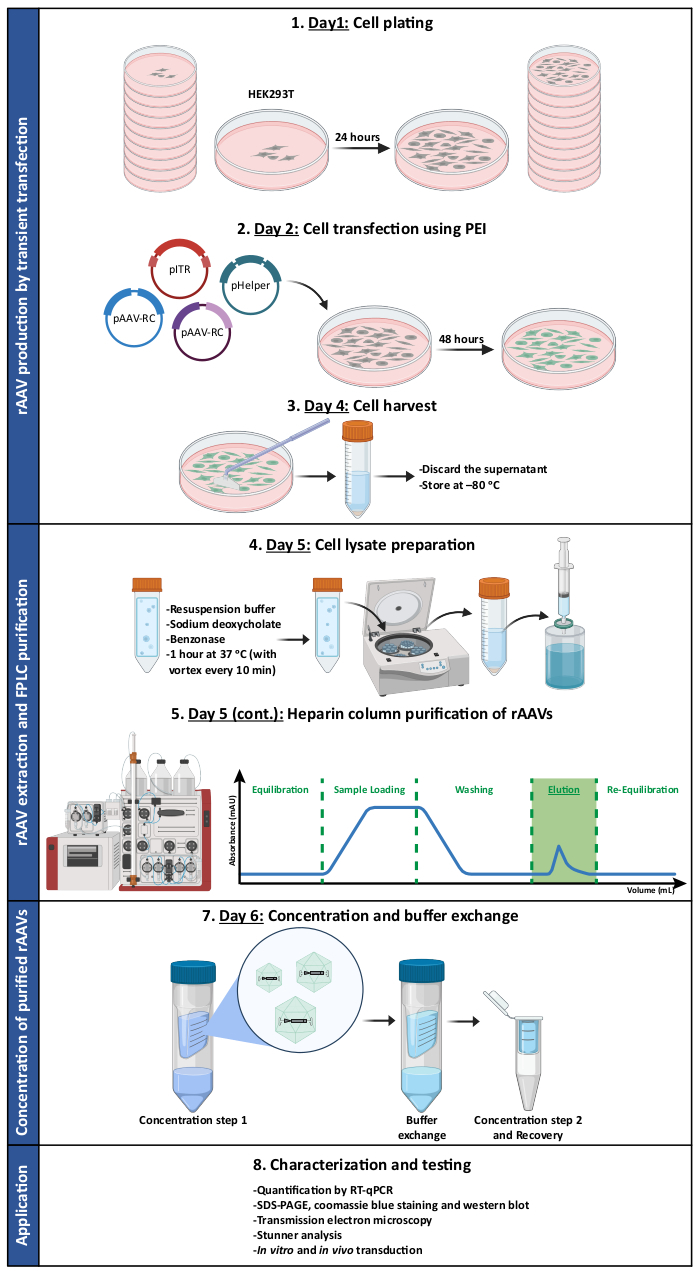
איור 1: ייצוג סכמטי של פרוטוקול הייצור והטיהור של rAAV. rAAVs מיוצרים על ידי טרנספקציה חולפת של תאי HEK293T באמצעות פוליאתילנימין (PEI). לאחר מכן, תאים נקצרים ו lysed, rAAV מטוהרים מן התא homogenate באמצעות כרומטוגרפיה זיקה. לאחר מכן מרוכזים השברים הנאספים המכילים rAAVs, ומלאי הנגיפים הסופי מאופיין במונחים של טיטר, טוהר, תכונות מורפולוגיות ופעילות ביולוגית. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; PEI = פוליאתילן; RT-qPCR = תגובת שרשרת פולימראז כמותית בזמן אמת; SDS-PAGE = נתרן דודציל סולפט-פוליאקרילאמיד ג'ל אלקטרופורזה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
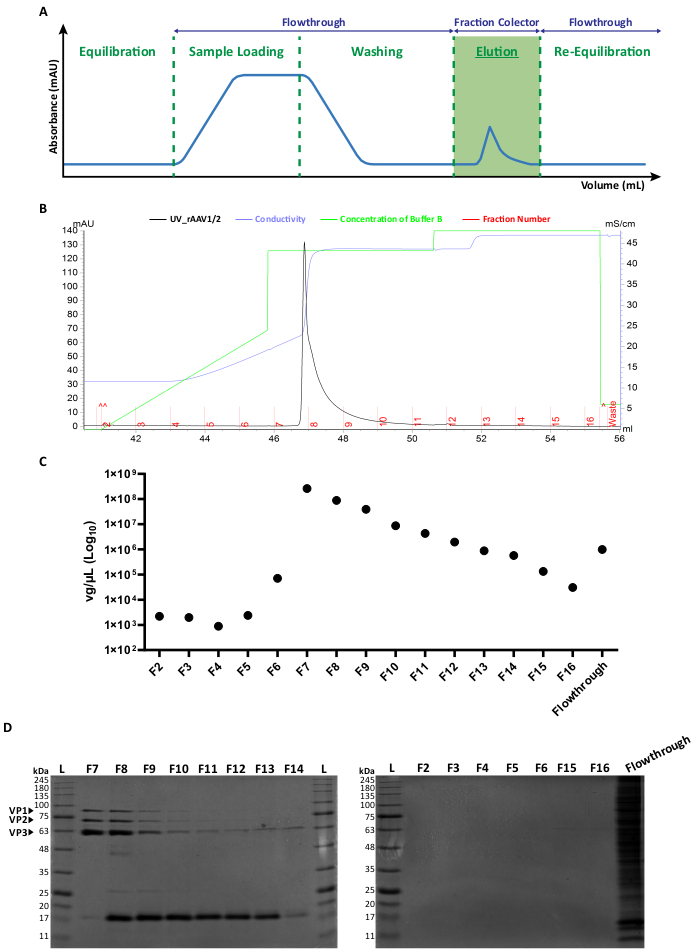
איור 2: פרוטוקול טיהור FPLC ופרופיל אלוציה מייצג של rAAV1/2. (A) ייצוג סכמטי של פרופיל כרומטוגרמה שלם, המראה את השלבים השונים של תהליך טיהור rAAV. לאחר שלב שיווי משקל עמודות, מוחלת הדגימה. לאחר מכן שוטפים את העמוד, וההדחה מתבצעת בריכוזים הולכים וגדלים של NaCl. החומר הלא מאוגד (flowthrough) ושברים של 1 מ"ל של הנגיפים המדוללים נאספים לניתוח. הספיגה ב-280 ננומטר מבוטאת ב-mAU וציר ה-x מציין את הנפח ב-mL. (B) כרומטוגרמה חלקית מוגדלת המציגה שיא אלוציה rAAV1/2 (בשחור), עם מספרי השברים המתאימים (F2-F16) ופסולת (מסומנת באדום). הריכוז המונפק של חיץ B ומוליכות (מבוטא ב-mS/cm) מוצגים גם בירוק ובסגול, בהתאמה. (C) RT-qPCR של כל חלק שנאסף במהלך טיהור זיקה (F2-F16) וזרימה. הטיטר ב- vg/μL מיוצג בסולם לוגריתמי. (D) ניתוח SDS-PAGE של השברים הנגיפיים שנאספו. נפחים שווים (40 μL) של כל שבר משלב האלוציה (F2-F16), וזרימה בהתאמה הועמסו ונפתרו על ג'ל 10% SDS-polyacrylamide. להקות חלבון הודגמו על ידי צביעה כחולה של קומאסי. רצועות המקבילות לחלבוני קפסיד AAV VP1, VP2 ו- VP3 מסומנים. סולם גודל חלבון סטנדרטי מסומן כ- (L) ומשקלים מולקולריים מתאימים מצוינים גם הם. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; RT-qPCR = תגובת שרשרת פולימראז כמותית בזמן אמת; SDS-PAGE = נתרן דודציל סולפט-פוליאקרילאמיד ג'ל אלקטרופורזה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
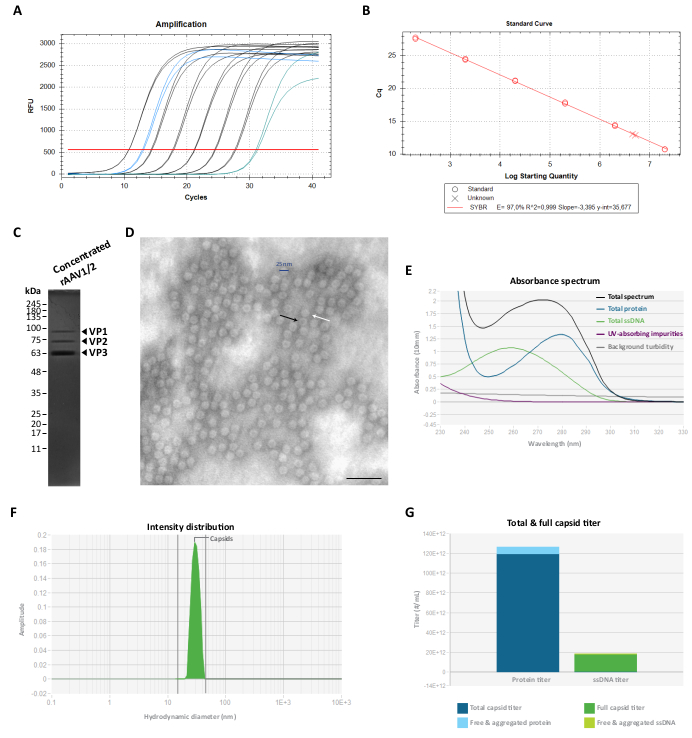
איור 3: אפיון וקטורי rAAV1/2 מרוכזים. (A) עקומות הגברה של מדגם rAAV1/2 מרוכז (בכחול), תקנים בדילול סדרתי מ-2 × 107 vg/μL עד 2 × 102 vg/μL (בשחור) ופקד ללא תבנית (בירוק), המתקבל במהלך RT-qPCR. (B) עקומה סטנדרטית (רגרסיה ליניארית) לקביעת הטיטר של דגימת rAAV ב-vg/μL. (ג) ניתוח SDS-PAGE של החלקיקים הנגיפיים המרוכזים. סה"כ 2.3 ×10 10 ק"ג של המלאי המרוכז אוגמו על הג'ל. (D) תמונת מיקרוסקופ אלקטרונים תמסורת של חלקיקי rAAV1/2 בקוטר ~25-30 ננומטר. ניתן להבדיל בין חלקיקים ריקים בעלי מרכז צפוף אלקטרונים (המעידים על חיצים שחורים) לבין קפסידים מלאים (המעידים על כך חיצים לבנים). סרגל קנה מידה = 100 ננומטר. (E) ספקטרום ספיגה של תכשיר rAAV1/2 שנמדד על ידי Stunner (בשחור). תרומתם של חלבונים (בכחול), ssDNA (בירוק), תרכובות אחרות סופגות UV או זיהומים (בסגול), ועכירות רקע (באפור) מוצגים גם. (F) התפלגות עוצמת DLS של rAAV1/2 עם שיא יחיד של 30 ננומטר, שנמדדה על ידי Stunner. עוצמת פיזור קפסיד של 100% נקבעה על ידי מדידת השטח מתחת לעקומה בין 15 ל 45 ננומטר (ירוק מוצלל). (G) ניתוח מדהים של הכנה וקטורית rAAV1/2 המציגה טיטר קפסיד כולל של 1.19 × 1014 cp/mL (כחול כהה) וטיטר קפסיד מלא של 1.73 × 1013 vg/mL (ירוק כהה). כמו כן נמדדו חלבון חופשי ומצטבר של 7.16 × 1012 cp/mL שווה ערך (כחול בהיר), כמו גם ssDNA חופשי ומצטבר של 1.04 × 1012 vg/mL שווה ערך (ירוק בהיר). קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; RT-qPCR = תגובת שרשרת פולימראז כמותית בזמן אמת; SDS-PAGE = נתרן דודציל סולפט-פוליאקרילאמיד ג'ל אלקטרופורזה; ssDNA = DNA חד-גדילי; DLS = פיזור אור דינמי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
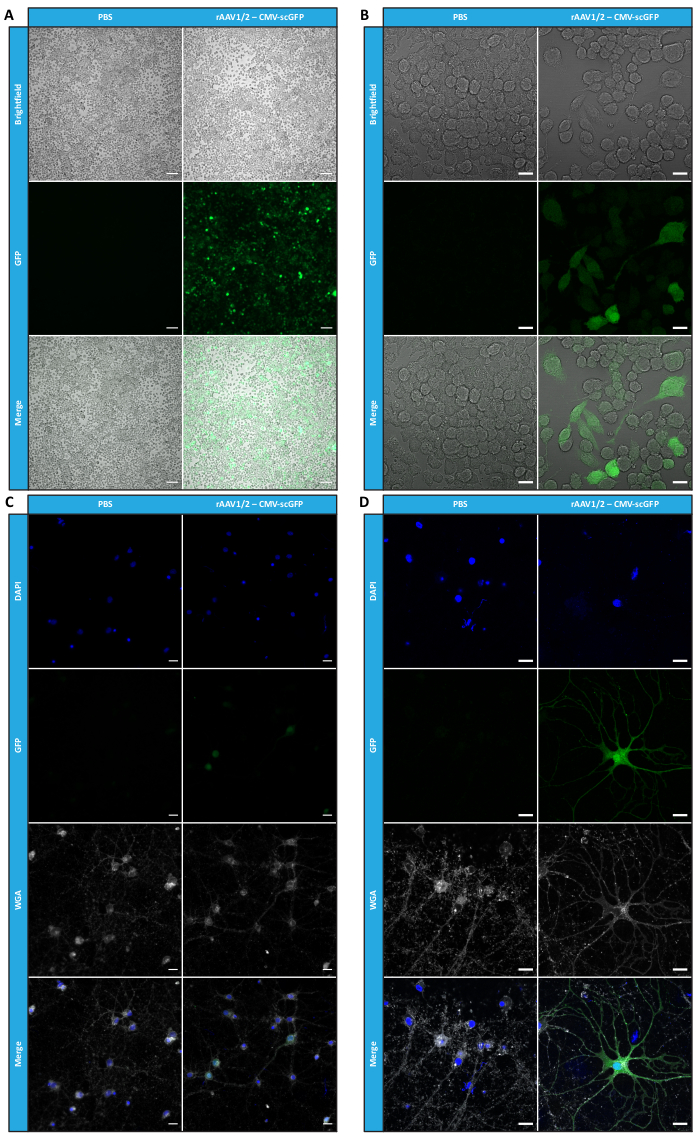
איור 4: הערכת זיהומיות חוץ גופית של דגימת rAAV1/2 מרוכזת. (A) תאי Neuro2A היו נגועים ב-rAAV1/2 - CMV-scGFP או הודגרו בנפח שווה ערך של PBS, כביקורת שלילית. תמונות ברייטפילד ופלואורסצנטיות של תאים שצולמו 48 שעות לאחר ההדבקה. התמונות נרכשו ב-Zeiss Axio Observer Z1 (מטרה פי 10). פסי קנה מידה = 100 מיקרומטר. (B) תמונות מפורטות של תאי Neuro2A 48 שעות לאחר ההדבקה ב-rAAV1/2 - CMV-scGFP. התמונות נרכשו ב-Zeiss LSM 710 (40x objective). פסי קנה מידה = 20 מיקרומטר. (C) תרביות עצביות ראשוניות צפופות למחצה הנגועות ב- rAAV1/2 - CMV-scGFP או מודגרות בנפח שווה ערך של PBS, המשמשות כבקרה שלילית. התאים סומנו בכתם גרעיני (DAPI בכחול) וכתם קרום (WGA בלבן). התמונות נרכשו ב-Zeiss Axio Observer Z1 (40x objective). פסי קנה מידה = 20 מיקרומטר. (D) תמונות מפורטות של תרביות עצביות ראשוניות צפופות למחצה 48 שעות לאחר ההדבקה עם rAAV1/2 - CMV-scGFP. התמונות נרכשו ב-Zeiss LSM 710 (40x objective). פסי קנה מידה = 20 מיקרומטר. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; CMV = cytomegalovirus; scGFP = חלבון פלואורסצנטי ירוק משלים עצמי; PBS = מלח חוצץ פוספט; DAPI = 4',6-diamidino-2-phenylindole; WGA = נבט חיטה agglutinin. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
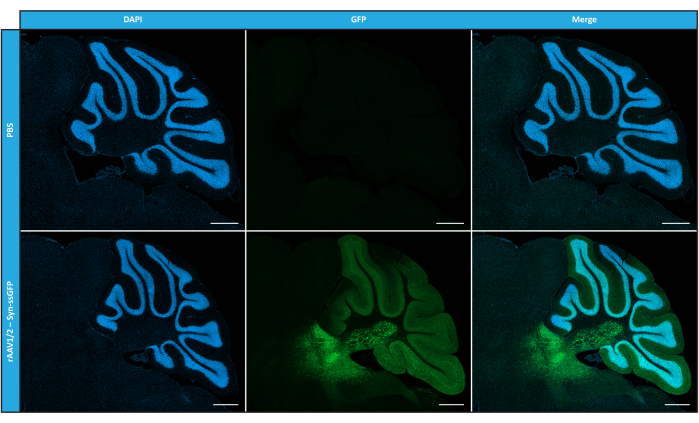
איור 5: יעילות התמרת In vivo של rAAV1/2 לאחר הזרקה תוך פרנכימלית. תמונות אימונופלואורסנציה מייצגות המראות את ביטוי ה-GFP הנפוץ (בירוק) ברחבי המוח הקטן בהזרקה מרכזית של rAAV1/2 - Syn-ssGFP במוח הקטן. גרעינים הוכתמו ב-DAPI (בכחול). פסי קנה מידה = 500 מיקרומטר. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; syn = סינאפסין 1; ssGFP = חלבון פלואורסצנטי ירוק חד-גדילי; DAPI = 4',6-diamidino-2-phenylindole; PBS = מלח חוצץ פוספט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים S1: ניתוח ג'ל אגרוז של פלסמיד וקטורי rAAV מעוכל עם SmaI. שישה שיבוטים (C1-C6) של pITR עוכלו באמצעות אנזים הגבלת SmaI (נתיבים 2, 4, 6, 8, 10 ו-12), אשר חותך פעמיים בתוך כל חזרה טרמינלית הפוכה. במקרה זה, עיכול מלא של pITR זה צפוי לייצר שני פסים (3,796 bp ו 3,013 bp). בהכנות מוצלחות (C1, C3, C4 ו- C5) עדיין ניתן לראות רצועה של 6809 bp, הנובעת מעיכול חלקי (~ 5% מכלל הכולל). בהכנות עם רקומבינציה ITR, הפרופורציות הפוכות (C2), או העיכול לא התרחש (C6). מוצגים גם השיבוטים הלא מעוכלים בהתאמה (נתיבים 3, 5, 7, 9, 11, 13). קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; ITR = חזרה על מסוף הפוך. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S2: טיהור rAAV2/9 על ידי כרומטוגרפיית זיקה מבוססת הפרין. (A) פרופיל אלוציה של rAAV2/9 המציג שיא יחיד (בשחור), בעקבות עלייה בריכוז NaCl. השברים הנאספים מסומנים על ידי מספרים (2-16) באדום בתחתית הגרף, הבליעה ב 280 ננומטר מבוטאת ב- mAU, מוליכות מבוטאת ב- mS/cm, וציר x מציין את הנפח ב- mL. (B) טיטרים rAAV המכומתים על ידי RT-qPCR עבור כל חלק מאוגד (F2-F16) וזרימה. הערכים מיוצגים בקנה מידה לוגריתמי. (C) בדיקת טוהר על ידי SDS-PAGE וצביעה כחולה של קומאסי. נפחים שווים (40 μL) של כל שבר (F2-F16) והזרימה המתאימה נטענו ונפתרו ב- SDS-PAGE של 10%. מלאי מרוכז כומת על ידי RT-qPCR ו 2.3 ×10 10 vg היו מדוללים ב 40 μL של PBS ו איגום על הג'ל. להקות חלבון הודגמו על ידי צביעה כחולה של קומאסי. חלבוני קפסיד AAV (VP1, VP2 ו- VP3) מסומנים. סולם גודל חלבון סטנדרטי מסומן עם (L) ואת המשקלים המולקולריים המתאימים מסומנים גם. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; RT-qPCR = תגובת שרשרת פולימראז כמותית בזמן אמת; SDS-PAGE = נתרן דודציל סולפט-פוליאקרילאמיד ג'ל אלקטרופורזה. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S3: ניתוח כתמים מערביים של וקטורים rAAV1/2 שטוהרו על ידי FPLC. (A) השברים שנאספו ווקטורי rAAV1/2 מרוכזים נפתרו על ג'ל SDS-PAGE ונבדקו באמצעות נוגדן חד-שבטי נגד AAV (B1) של עכבר המזהה חלבוני קפסיד VP1, VP2 ו-VP3. (B) השברים שנאספו ווקטורי rAAV1/2 המרוכזים נפתרו על ג'ל SDS-PAGE ונבדקו באמצעות נוגדן חד-שבטי נגד AAV של עכבר (A69) המזהה חלבוני קפסיד VP1 ו-VP2. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; FPLC = כרומטוגרפיה נוזלית מהירה של חלבון; SDS-PAGE = נתרן דודציל סולפט-פוליאקרילאמיד ג'ל אלקטרופורזה; L = סולם גודל חלבון סטנדרטי. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S4: ניתוח כתמים מערביים של וקטורי rAAV2/9 שטוהרו על ידי FPLC. (A) השברים שנאספו ווקטורי rAAV2/9 המרוכזים נפתרו על ג'ל SDS-PAGE ונבדקו באמצעות נוגדן חד-שבטי נגד AAV (B1) של עכבר המזהה חלבוני קפסיד VP1, VP2 ו-VP3. (B) השברים שנאספו ווקטורי rAAV2/9 המרוכזים נפתרו על ג'ל SDS-PAGE ונבדקו באמצעות נוגדן חד-שבטי נגד AAV של עכבר (A69) המזהה חלבוני קפסיד VP1 ו-VP2. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; FPLC = כרומטוגרפיה נוזלית מהירה של חלבון; SDS-PAGE = נתרן דודציל סולפט-פוליאקרילאמיד ג'ל אלקטרופורזה; L = סולם גודל חלבון סטנדרטי. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S5: כימות וקטור rAAV2/9 ואפיון באמצעות Stunner. (A) ספקטרום בליעה (שחור) של וקטור rAAV2/9 שנמדד על ידי Stunner. תרומתם של חלבונים (כחול), ssDNA (ירוק), תרכובות אחרות סופגות UV או זיהומים (סגול), ועכירות רקע (אפור) מתוארים גם. (B) התפלגות עוצמת DLS של rAAV2/9 עם שיא עיקרי של 30 ננומטר המתאים לעוצמת פיזור קפסיד של 78%, כפי שנקבע על ידי מדידת השטח מתחת לעקומה מ-15 עד 45 ננומטר (ירוק מוצלל). עוצמת מצרף כוללת של 22% (מוצללת באפור) נמדדה גם היא עם תרומה עיקרית מאגרגטים גדולים (19.9%) בקוטר ממוצע של 620 ננומטר. (C) ניתוח מדהים של הכנה וקטורית rAAV2/9 המציגה טיטר קפסיד כולל של 2.18 × 1014 cp/mL (כחול כהה) וטיטר קפסיד מלא של 2.35 × 1013 vg/mL (ירוק כהה). חלבון חופשי ומצטבר של 2.92 ×10 13 cp/mL שווה ערך (כחול בהיר), כמו גם ssDNA חופשי ומצטבר של 3.14 × 1012 vg / mL שווה ערך (ירוק בהיר), נמדדו גם הם בהכנה זו. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; ssDNA = DNA חד-גדילי; DLS = פיזור אור דינמי. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S6: יעילות התמרה חוץ גופית וכדאיות של השברים המטוהרים של rAAV1/2. HEK293T תאים המבטאים GFP (פלואורסצנטיות ישירה) 48 שעות לאחר הטרנסדוקציה עם 50 μL של שברי FPLC של וקטור rAAV1/2 המקודד ssGFP (rAAV1/2 - CMV-ssGFP). פסי קנה מידה = 100 מיקרומטר. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; FPLC = כרומטוגרפיה נוזלית מהירה של חלבון; ssGFP = חלבון פלואורסצנטי ירוק חד-גדילי. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S7: יעילות התמרה חוץ גופית וכדאיות של השברים המטוהרים של rAAV2/9. HEK293T התאים היו נגועים ב-50 מיקרוליטר של כל חלק FPLC (F2-F16) או בזרימה של וקטור rAAV2/9 המקודד scGFP תחת שליטתו של מקדם CMV. התאים המבטאים GFP הודגמו 48 שעות לאחר ההדבקה. פסי קנה מידה = 100 מיקרומטר. קיצורים: rAAV = וירוס רקומביננטי הקשור אדנו; FPLC = כרומטוגרפיה נוזלית מהירה של חלבון; scGFP = חלבון פלואורסצנטי ירוק משלים עצמי; CMV = cytomegalovirus. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
ערכת הכלים הווקטורית AAV המתרחבת במהירות הפכה לאחת ממערכות העברת הגנים המבטיחות ביותר עבור מגוון רחב של סוגי תאים באמצעות נתיבי מתן שונים. בעבודה זו שאפנו לפתח פרוטוקול משופר לייצור, טיהור ואפיון של וקטורי rAAV פסיפס שיוכלו להוכיח את ערכם במחקרים פרה-קליניים. לשם כך מתואר כאן יצירת וקטורי פסיפס rAAV1/2 ו-rAAV2/9, אך ניתן ליישם את ההליך גם לטיהור וקטורי rAAV2 סטנדרטיים (נתונים שאינם מוצגים).
rAAV פסיפס יוצרו בשיטת טרנספקציה אופטימלית תוך שימוש ב- PEI כמגיב טרנספקציה. שיטת טרנספקציה חולפת נבחרה בשל גמישותה ומהירותה הרבה יותר, יתרונות ניכרים במחקרים פרה-קליניים בשלב מוקדם. לאחר אימות טרנסגן וסרוטיפ מסוימים, ניתן לכוונן את מערכת הייצור כדי להשיג מדרגיות טובה יותר וחסכוניות יותר על ידי הקמת קו תאים יציב נגוע המבטא תת-קבוצה של הגנים הספציפיים Rep/Cap , עם גנים נוספים המסופקים על ידי תהליך זיהום24. בהשוואה להעברת סידן-פוספט, PEI מציג מספר יתרונות. זהו מגיב טרנספקציה יציב וחסכוני הפועל ביעילות בטווח pH רחב יותר. בנוסף, הוא מבטל את הדרישה לשנות את תווך התא לאחר טרנספקציה, וכתוצאה מכך הפחתה משמעותית הן בעלות והן בעומס העבודה69.
בניסיון לעקוף חלק מהמגבלות שהוטלו על ידי CsCl או יודיקסנול שיפועים, rAAV המיוצרים נקצרו וטוהרו על ידי כרומטוגרפיית זיקה. אסטרטגיה זו מציעה גישה פשוטה וניתנת להרחבה שניתן לבצע ללא צורך באולטרה-צנטריפוגה ובשיפועים, ומניבה טיטרים נגיפיים נקיים וגבוהים. ואכן, טכניקות כרומטוגרפיה באמצעות מערכת FPLC יכולות להיות אוטומטיות ומוגברות על ידי אריזת נפח שרף גדול יותר בטור עם גובה מיטה גבוה יותר. ניתן להתאים בקלות את הפרוטוקול המתואר כאן כך שישלב 5 מ"ל HiTrap Heparin עמודות HP (הנתונים אינם מוצגים). בנוסף, ניתן לעשות שימוש חוזר בעמודי הפרין מספר פעמים, ובכך לתרום לעלות-תועלת של שיטה זו.
ה-rAAV המטוהרים אופיינו אז במונחים של טיטר, טוהר, תכונות מורפולוגיות ופעילות ביולוגית. באופן מעניין, בצביעה הכחולה של קומאסי, זוהתה רצועה עם כ-17 kDa בשברים F8-F16 בנוסף לשלושת חלבוני הקפסיד הנגיפיים הטיפוסיים. עם זאת, רצועה זו אינה קיימת עוד לאחר שלב הריכוז של rAAVs. יתר על כן, כמה רצועות חלשות עם משקל מולקולרי נמוך מ- VP3 (<62 kDa) יכולות להיות מזוהות גם על תיוג B1 ו- A69, מה שמרמז כי אלה יכולים להיות מקטעים של חלבוני VP1, VP2 ו- VP3 capsid70. אפשרות נוספת היא שמדובר למעשה בחלבונים אחרים לטיהור משותף כגון פריטין או חלבונים תאיים אחרים עם פוליפפטידים החולקים טביעות אצבע חלבוניות דומות עם חלבוני הקפסיד AAV ויכולים להיות מעורבים בביולוגיה של AAV, כפי שהוצע קודם לכן 26,71,72.
ניתוח TEM ו stunner גילה גם נוכחות של חלקיקים ריקים ברמות משתנות על פני הפקות שונות. באופן דומה, מחקרים אחרים דיווחו בעבר על יצירת רמות משתנות וגבוהות (>65%) של קפסידים ריקים עבור rAAVs שהוכנו בשיטות העברה או זיהום24,73. המנגנון מאחורי יצירת rAAV מתחיל בהיווצרות מהירה של קפסידים ריקים מחלבוני VP שזה עתה סונתזו, ולאחר מכן שלב הגבלת קצב איטי של אריזת הגנום לתוך הקפסידים המוכנים בתיווך חלבוני Rep74,75. לכן, קפסידים ריקים נוצרים בהפקות rAAV, אם כי חלקם של קפסידים ריקים ומלאים יכול להשתנות בהתאם לגודל ולרצף של טרנסגן העניין ותנאי תרבית התא58,73. קפסידים ריקים מעוררים חששות מסוימים, שכן בהיעדר הגנום המעניין, הם אינם מסוגלים לספק השפעה טיפולית ועלולים גם להגביר תגובה חיסונית מולדת או נרכשת. עם זאת, כמה דיווחים הראו גם כי, על ידי התאמת היחס שלהם, קפסידים AAV ריקים עשויים לשמש כפיתיונות יעילים ביותר עבור נוגדנים מנטרלים ספציפיים AAV ולכן, להגדיל את יעילות התמרה 60,76,77. אם נוכחותם של קפסידים ריקים מזיקה באופן קריטי ובהינתן האופי המעט פחות אניוני של חלקיקים ריקים בהשוואה לווקטורים מלאים, פתרון אפשרי יכול לכלול ביצוע שלב טיהור ליטוש שני באמצעות טכניקות כרומטוגרפיה של חילופי אניונים64.
מחקר זה מספק גם ראיות משכנעות לכך שפסיפס rAAV שנוצר מסוגל להתמיר ביעילות לא רק תרביות עצביות חוץ גופיות אלא גם את מערכת העצבים המרכזית עם הזרקה תוך גולגולתית של rAAV1/2. בסך הכל, תוצאות אלה מצביעות על כך שפרוטוקול הייצור והטיהור המתואר הופך rAAV טהורים מאוד ופעילים ביולוגית מוכנים לשימוש תוך 6 ימים, ומציג את עצמו כשיטה רב-תכליתית וחסכונית לייצור rAAV במחקרים פרה-קליניים.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
אנו אסירי תודה על שיתוף הפעולה, התובנות והסיוע הטכני הניתנים על ידי ד"ר מוניקה זוזרטה, במכון קוימברה למחקר קליני וביו-רפואי (iCBR) והמרכז לביו-רפואה וביוטכנולוגיה חדשניים (CIBB), בנוגע לניתוח TEM של rAAVs. אנו מביעים את הערכתנו לד"ר דומיניק פרננדס, במרכז למדעי המוח וביולוגיה של התא באוניברסיטת קוימברה (CNC-UC) ובמכון למחקר בינתחומי של אוניברסיטת קוימברה (IIIUC), על עזרתה הטכנית רבת הערך ותובנותיה בנוגע לניסויים העיקריים בתרבית עצבית. פלסמידים pRV1, pH21 ו-pFdelta6, החיוניים למחקר זה, סופקו בנדיבות על ידי ד"ר כריסטינה מקלור, בבית הספר למדעי הרפואה, המכללה למדעי החיים והרפואה, אוניברסיטת אברדין, ועל כך אנו אסירי תודה. עבודה זו מומנה על ידי הקרן האירופית לפיתוח אזורי (ERDF), באמצעות התוכנית התפעולית האזורית Centro 2020; באמצעות COMPETE 2020 - תוכנית תפעולית לתחרותיות ובינאום, וקרנות לאומיות פורטוגליות באמצעות FCT - Fundação para a Ciência e a Tecnologia, תחת הפרויקטים: UIDB/04539/2020, UIDP/04539/2020, LA/P/0058/2020, ViraVector (CENTRO-01-0145-FEDER-022095), Imagene (PTDC/BBB-NAN/0932/2014 | POCI-01-0145-FEDER-016807), איפוס מחדש - IDT-COP (CENTRO-01-0247-FEDER-070162), לחימה Sars-CoV-2 (CENTRO-01-01D2-FEDER-000002), BDforMJD (CENTRO-01-0145-FEDER-181240), ModelPolyQ2.0 (CENTRO-01-0145-FEDER-181258), MJDEDIT (CENTRO-01-0145-FEDER-181266); על ידי קרן המחקר הביו-רפואי הפורטוגזית האמריקאית (APBRF) וקרן המחקר למחלות ע"ש ריצ'רד צ'ין ולילי לוק מצ'אדו-ג'וזף, ARDAT במסגרת הסכם המענק מס' 945473 של IMI2 JU הנתמך על ידי האיחוד האירופי ו-EFPIA; GeneT- Teaming Project 101059981 נתמך על ידי תוכנית Horizon Europe של האיחוד האירופי. מ.מ.ל. נתמכה על ידי 2021.05776.BD; סי' ה' נתמך על ידי 2021.06939.BD; א.ק.ס. נתמכה על ידי 2020.07721.BD; ו-D.D.L. נתמך על-ידי 2020.09668.BD. איור 1 נוצר באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 10% povidone-iodine | Medline | MDS093943 | |
| 12-well plates | Thermo Scientific | 11889684 | |
| 24-well plates | VWR | 734-2325 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen | D1306 | |
| 96-well Stunner plate | Unchained Labs | 701-2025 | 96-well quantification plate for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| AAVpro Titration Kit (for Real-Time PCR) Ver.2 | Takara | 6233 | For determining the titer of AAV using RT-qPCR. This kit contains DNase I, Lysis Buffer, Dilution Buffer, positive control, Taq II mix, primer forward, primer reverse, water |
| Acetic acid glacial | Fisher Chemical | A/0360/PB17 | |
| ÄKTA pure 25 | Cytiva | 29018224 | FPLC system controlled by UNICORN software, version 6.3 |
| Alkaline phosphatase-linked goat anti-mouse | Invitrogen | 31328 | |
| Amicon ultra-0.5 centrifugal filter unit | Merck Millipore | UFC5100 | |
| Amicon ultra-15 centrifugal filter unit | Merck Millipore | UFC9100 | |
| Benzonase Nuclease | Merck Millipore | E1014 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| CFX96 Real-Time PCR detection system | Biorad | 184-5096 | |
| ChemiDoc Touch Imaging System | Bio-Rad Laboratories | 1708370 | |
| Chicken polyclonal anti-GFP primary antibody | Abcam | ab13970 | |
| Coomassie Blue G250 | Fisher Chemical | C/P541/46 | |
| Dithiothreitol (DTT) | Fisher Bioreagents | BP17225 | |
| DMEM | Sigma-Aldrich | D5796 | |
| ECF Substrate for Western Blotting | Cytiva | RPN5785 | |
| FastDigest SmaI | Thermo Scientific | FD0663 | |
| FEI-Tecnai G2 Spirit Biotwin | FEI | Biotwin | Transmission electron microscope |
| Fetal bovine serum | Biowest | S1810 | |
| Fluorescence mounting medium | Dako | S3023 | |
| Formvar-carbon coated 200 mesh grid | TAAB Laboratories Equipment | F077/025 | |
| Gas evacuation apparatus | RWD | R546W | |
| Glycerol | Fisher BioReagents | 10021083 | |
| Goat polyclonal anti-chicken antibody, Alexa Fluor 488 | Invitrogen | A-11039 | |
| Hamilton needle 30G, Small Hub RN Needle, 25 mm, PST3 | Hamilton | 7803-07 | |
| Hamilton syringe (10 µL) | Hamilton | 7653-01 | |
| HEK293T | American Type Culture Collection | CRL-11268 | |
| HiTrap Heparin HP 1 x 5 mL | Cytiva | 17040701 | Pre-packed heparin column |
| HiTrap Heparin HP 5 x 1 mL | Cytiva | 17040601 | Pre-packed heparin column |
| Immobilon-P PVDF Membrane | Merck Millipore | IPVH00010 | |
| Isoflurane | Braun | 469860 | |
| Ketamine | Dechra Pharmaceuticals | N/A | Nimatek |
| Low-retention microcentrifuge tubes (2 mL) | Fisher Scientific | 11906965 | |
| Lunatic & Stunner Client software | Unchained Labs | N/A | Client analysis software version 8.0.1.235. Software for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Methanol | Fisher Chemical | M/4000/FP21 | |
| Mouse monoclonal anti-AAV, VP1, VP2 antibody (A69) | American Research Products | 03-61057 | |
| Mouse monoclonal anti-AAV, VP1, VP2, VP3 antibody (B1) | American Research Products | 03-61058 | |
| Neuro2a | American Type Culture Collection | CCL-131 | |
| Normal goat serum | Gibco | 16210064 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 12738422 | |
| NZYColour Protein Marker II | NZYtech | MB09002 | |
| pAAV-CMV-scGFP | Addgene | 32396 | Addgene plasmid # 32396; http://n2t.net/addgene:32396; RRID:Addgene_32396 |
| pAAV-CMV-ssGFP | Addgene | 105530 | Addgene plasmid # 105530; http://n2t.net/addgene:105530; RRID:Addgene_105530 |
| pAAV2/9n | Addgene | 112865 | Addgene plasmid # 112865; http://n2t.net/addgene:112865; RRID:Addgene_112865 |
| Paraformaldehyde | Acros Organics | 10342243 | |
| PBS | Fisher BioReagents | BP2438 | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Pluronic F-68 Non-ionic Surfactant (100x) | Gibco | 24040032 | |
| Polyethylenimine MAX, MW 40,000 | Polysciences Europe | 24765 | |
| R500 Series Compact Small Animal Anesthesia Machine - Isoflurane | RWD | N/A | |
| Sample Inlet Valve V9-IS | Cytiva | 29027746 | |
| Sample pump P9-S | Cytiva | 29027745 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium chloride | Fisher Scientific | 10428420 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dodecyl sulfate (SDS) | Fisher Bioreagents | BP166 | |
| Sterile PVDF syringe filter | Fisher Scientific | 15191499 | |
| Stunner Platform | Unchained Labs | 700-2002 | Equipment for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Superloop 150 mL | Cytiva | 18-1023-85 | |
| Superloop 50 mL | Cytiva | 18-1113-82 | |
| SURE 2 supercompetent cells | Stratagene, Agilent Technologies | HPA200152 | |
| Treated culture dishes | Corning | 734-1711 | |
| Tris base | Fisher BioReagents | BP152 | |
| Tris hydrochloride | Fisher BioReagents | BP153 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin-EDTA | Gibco | 25200-072 | |
| Wheat Germ Agglutinin (WGA) conjugated with Alexa Fluor 633 | Invitrogen | W21404 | |
| Xylazine | Dechra Pharmaceuticals | N/A | Sedaxylan |
| Zeiss Axio Observer Z1 | Carl Zeiss Microscopy GmbH | N/A | Inverted fluorescence microscope equiped with an EC Plan-Neofluar 10x/0.30 objective and a Plan-Apochromat 40x/0.95 objective |
| Zeiss Axio Scan.Z1 | Carl Zeiss Microscopy GmbH | N/A | Slide scanner fluorescence microscope equipped with a Plan-Apochromat 20x/0.8 objective |
| Zeiss LSM 710 | Carl Zeiss Microscopy GmbH | N/A | Inverted confocal microscope equipped with a Plan-Apochromat 40x/1.4 Oil DIC objective |
| µ-Slide 8 well Ibidi | Ibidi | 80826 | 8-well chamber slide |
References
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Front Mol Neurosci. 7, 1-9 (2014).
- Muzyczka, N. Use of Adeno-Associated Virus as a General Transduction Vector for Mammalian Cells. Viral Expression Vectors. 158, 97-129 (1992).
- Goncalves, M. A. F. V Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43(2005).
- Flotte, T. R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 11 (10), 805-810 (2004).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Ojala, D. S., Amara, D. P., Schaffer, D. V Adeno-Associated Virus Vectors and Neurological Gene Therapy. Neuroscientist. 21 (1), 84-98 (2014).
- Saraiva, J., Nobre, R. J., Pereira de Almeida, L. Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. Journal of Controlled Release. 241, 94-109 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods Mol Biol. 807, 47-92 (2011).
- Sonntag, F., Schmidt, K., Kleinschmidt, J. A. A viral assembly factor promotes AAV2 capsid formation in the nucleolus. Proc Natl Acad Sci U S A. 107 (22), 10220-10225 (2010).
- Sonntag, F., et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes. J Virol. 85 (23), 12686-12697 (2011).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol. 78 (12), 6381-6388 (2004).
- Gao, G., Vandenberghe, L. H., Wilson, J. M. New recombinant serotypes of AAV vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The role of the adeno-associated virus capsid in gene transfer. Methods Mol Biol. 437, 51-91 (2008).
- Clark, K. R., Voulgaropoulou, F., Fraley, D. M., Johnson, P. R. Cell lines for the production of recombinant adeno-associated virus. Hum Gene Ther. 6 (10), 1329-1341 (1995).
- Inoue, N., Russell, D. W. Packaging cells based on inducible gene amplification for the production of adeno-associated virus vectors. J Virol. 72 (9), 7024-7031 (1998).
- Liu, X., Voulgaropoulou, F., Chen, R., Johnson, P. R., Clark, K. R. Selective Rep-Cap gene amplification as a mechanism for high-titer recombinant AAV production from stable cell lines. Mol Ther. 2 (4), 394-403 (2000).
- Mathews, L. C., Gray, J. T., Gallagher, M. R., Snyder, R. O. [23] Recombinant adeno-associated viral vector production using stable packaging and producer cell lines. Methods Enzymol. 346, 393-413 (2002).
- Gao, G., et al. Purification of recombinant adeno-associated virus vectors by column chromatography and its performance in vivo. Hum Gene Ther. 11 (15), 2079-2091 (2000).
- Xiao, X., Li, J., Samulski, R. J. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus. J Virol. 72 (3), 2224-2232 (1998).
- Aponte-Ubillus, J. J., et al. Molecular design for recombinant adeno-associated virus (rAAV) vector production. Appl Microbiol Biotechnol. 102 (3), 1045-1054 (2018).
- Smith, R. H., Levy, J. R., Kotin, R. M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells. Mol Ther. 17 (11), 1888-1896 (2009).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Wright, J. F. Transient transfection methods for clinical adeno-associated viral vector production. Hum Gene Ther. 20 (7), 698-706 (2009).
- Yuan, Z., Qiao, C., Hu, P., Li, J., Xiao, X. A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes. Hum Gene Ther. 22 (5), 613-624 (2011).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Hum Gene Ther Methods. 26 (4), 147-157 (2015).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Anderson, R., Macdonald, I., Corbett, T., Whiteway, A., Prentice, H. G. A method for the preparation of highly purified adeno-associated virus using affinity column chromatography, protease digestion and solvent extraction. J Virol Methods. 85 (1-2), 23-34 (2000).
- Okada, T., et al. Scalable purification of adeno-associated virus serotype 1 (AAV1) and AAV8 vectors, using dual ion-exchange adsorptive membranes. Hum Gene Ther. 20 (9), 1013-1021 (2009).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. J Virol Methods. 183 (2), 139-146 (2012).
- Lock, M., et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale. Hum Gene Ther. 21 (10), 1259-1271 (2010).
- Wang, L., Blouin, V., Brument, N., Bello-Roufai, M., Francois, A. Production and Purification of Recombinant Adeno-Associated Vectors. Adeno-Associated Virus: Methods and Protocols. 807, 361-404 (2011).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated Virus Serotypes: Vector Toolkit for Human Gene Therapy. Molecular Therapy. 14 (3), 316-327 (2006).
- Mietzsch, M., Broecker, F., Reinhardt, A., Seeberger, P. H., Heilbronn, R. Differential adeno-associated virus serotype-specific interaction patterns with synthetic heparins and other glycans. J Virol. 88 (5), 2991-3003 (2014).
- McClure, C., Cole, K. L. H., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. JoVE. (57), e3348(2011).
- Auricchio, A., O’Connor, E., Hildinger, M., Wilson, J. M. A single-step affinity column for purification of serotype-5 based adeno-associated viral vectors. Mol Ther. 4 (4), 372-374 (2001).
- Wang, Q., et al. Identification of an adeno-associated virus binding epitope for AVB sepharose affinity resin. Mol Ther Methods Clin Dev. 2, 15040(2015).
- Mietzsch, M., et al. OneBac: platform for scalable and high-titer production of adeno-associated virus serotype 1–12 vectors for gene therapy. Hum Gene Ther. 25 (3), 212-222 (2014).
- Mietzsch, M., et al. Characterization of AAV-specific affinity ligands: consequences for vector purification and development strategies. Mol Ther Methods Clin Dev. 19, 362-373 (2020).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2023).
- Koerber, J. T., Jang, J. -H., Yu, J. H., Kane, R. S., Schaffer, D. V. Engineering adeno-associated virus for one-Step purification via immobilized metal affinity chromatography. Hum Gene Ther. 18 (4), 367-378 (2007).
- Zhang, H. -G., et al. Addition of six-His-tagged peptide to the C terminus of adeno-associated virus VP3 does not affect viral tropism or production. J Virol. 76 (23), 12023-12031 (2002).
- Arnold, G. S., Sasser, A. K., Stachler, M. D., Bartlett, J. S. Metabolic biotinylation provides a unique platform for the purification and targeting of multiple AAV vector serotypes. Mol Ther. 14 (1), 97-106 (2006).
- Rabinowitz, J. E., et al. Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol. 78 (9), 4421-4432 (2004).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Mol Ther. 7 (3), 419-425 (2003).
- Choi, V., McCarty, D., Samulski, R. AAV hybrid serotypes: improved vectors for gene delivery. Curr Gene Ther. 5 (3), 299-310 (2005).
- Nonnenmacher, M., van Bakel, H., Hajjar, R. J., Weber, T. High capsid–genome correlation facilitates creation of AAV libraries for directed evolution. Mol Ther. 23 (4), 675-682 (2015).
- Kimura, K., et al. A mosaic adeno-associated virus vector as a versatile tool that exhibits high levels of transgene expression and neuron specificity in primate brain. Nat Commun. 14 (1), 4762(2023).
- Issa, S. S., Shaimardanova, A. A., Solovyeva, V. V., Rizvanov, A. A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 12 (5), 785(2023).
- Foust, K. D., et al. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27 (1), 59-65 (2009).
- Lopes, M. M., et al. A new protocol for whole-brain biodistribution analysis of AAVs by tissue clearing, light-sheet microscopy and semi-automated spatial quantification. Gene Ther. 29 (12), 665-679 (2022).
- Gray, J. T., Zolotukhin, S. Design and construction of functional AAV vectors. Methods Mol Biol. 807, 25-46 (2011).
- Choi, V. W., Asokan, A., Haberman, R. A., Samulski, R. J. Production of recombinant adeno-associated viral vectors. Curr Protoc Hum Genet. , Chapter 12, Unit 12.9-12.9.21 (2007).
- Bennicelli, J., et al. Reversal of blindness in animal models of leber congenital amaurosis using optimized AAV2-mediated gene transfer. Mol Ther. 16 (3), 458-465 (2008).
- Fischer, M. D., Hickey, D. G., Singh, M. S., MacLaren, R. E. Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods. 27 (4), 150-158 (2016).
- Santos, S. D., et al. Contactin-associated protein 1 (Caspr1) regulates the traffic and synaptic content of α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-type glutamate receptors. J Biol Chem. 287 (9), 6868-6877 (2012).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 7 (1), 122-128 (2003).
- Dong, B., Nakai, H., Xiao, W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther. 18 (1), 87-92 (2010).
- Wright, J. F. AAV empty capsids: For better or for worse. Mol Ther. 22 (1), 1-2 (2014).
- Asaad, W., et al. AAV genome modification for efficient AAV production. Heliyon. 9 (4), e15071(2023).
- Wobus, C. E., et al. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J Virol. 74 (19), 9281-9293 (2000).
- Wistuba, A., Kern, A., Weger, S., Grimm, D., Kleinschmidt, J. A. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol. 71 (2), 1341-1352 (1997).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J Virol Methods. 140 (1-2), 183-192 (2007).
- Brument, N., et al. A versatile and scalable two-step ion-exchange chromatography process for the purification of recombinant adeno-associated virus serotypes-2 and -5. Mol Ther. 6 (5), 678-686 (2002).
- Potter, M., et al. A simplified purification protocol for recombinant adeno-associated virus vectors. Mol Ther Methods Clin Dev. 1, 14034(2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570(2019).
- Yang, Q. -E., et al. Rapid quality control assessment of adeno-associated virus vectors via Stunner. GEN Biotechnology. 1 (3), 300-310 (2022).
- Huang, X., et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 193 (2), 270-277 (2013).
- Salganik, M., et al. Evidence for pH-dependent protease activity in the adeno-associated virus capsid. J Virol. 86 (21), 11877-11885 (2012).
- Dong, B., et al. Proteomics analysis of co-purifying cellular proteins associated with rAAV vectors. PLoS One. 9 (2), e86453(2014).
- Grieger, J. C., Soltys, S. M., Samulski, R. J. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 24 (2), 287-297 (2016).
- Wright, J. Product-related impurities in clinical-grade recombinant AAV vectors: characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Bennett, A., Mietzsch, M., Agbandje-McKenna, M. Understanding capsid assembly and genome packaging for adeno-associated viruses. Future Virol. 12 (6), 283-297 (2017).
- Myers, M. W., Carter, B. J. Assembly of adeno-associated virus. Virology. 102 (1), 71-82 (1980).
- Mingozzi, F., et al. Overcoming preexisting humoral immunity to AAV using capsid decoys. Sci Transl Med. 5 (194), (2013).
- Hoffman, B. E., Herzog, R. W. Covert warfare against the immune system: decoy capsids, stealth genomes, and suppressors. Mol Ther. 21 (9), 1648-1650 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved