Method Article
Isolamento di vettori virali adeno-associati attraverso un protocollo cromatografico di affinità con eparina a passaggio singolo e semiautomatico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo manoscritto descrive un protocollo dettagliato per la generazione e la purificazione di vettori virali adeno-associati utilizzando un metodo cromatografico di affinità ottimizzato a base di eparina. Presenta un approccio semplice, scalabile ed economico, eliminando la necessità di ultracentrifugazione. I vettori risultanti mostrano un'elevata purezza e attività biologica, dimostrando il loro valore negli studi preclinici.
Abstract
Il virus adeno-associato (AAV) è diventato un vettore sempre più prezioso per la consegna genica in vivo ed è attualmente in fase di sperimentazione clinica sull'uomo. Tuttavia, i metodi comunemente usati per purificare gli AAV utilizzano l'ultracentrifugazione a gradiente di densità di cloruro di cesio o iodixanolo. Nonostante i loro vantaggi, questi metodi richiedono molto tempo, hanno una scalabilità limitata e spesso producono vettori con bassa purezza. Per superare questi vincoli, i ricercatori stanno rivolgendo la loro attenzione alle tecniche cromatografiche. Qui presentiamo un protocollo cromatografico di affinità ottimizzato a base di eparina che funge da fase di cattura universale per la purificazione degli AAV.
Questo metodo si basa sull'affinità intrinseca del sierotipo 2 di AAV (AAV2) per i proteoglicani dell'eparan solfato. In particolare, il protocollo comporta la co-trasfezione di plasmidi che codificano per le proteine del capside AAV desiderate con quelle di AAV2, producendo vettori AAV a mosaico che combinano le proprietà di entrambi i sierotipi parentali. In breve, dopo la lisi delle cellule produttrici, una miscela contenente particelle AAV viene purificata direttamente seguendo un protocollo di cromatografia di affinità con eparina a fase singola ottimizzato utilizzando un sistema standard di cromatografia liquida proteica veloce (FPLC). Le particelle di AAV purificate vengono successivamente concentrate e sottoposte a una caratterizzazione completa in termini di purezza e attività biologica. Questo protocollo offre un approccio semplificato e scalabile che può essere eseguito senza la necessità di ultracentrifugazione e gradienti, producendo titoli virali puliti e elevati.
Introduzione
Il vettore del virus adeno-associato (AAV) si sta affermando come uno dei sistemi di somministrazione più promettenti negli attuali studi di terapia genica. Inizialmente identificato nel 19651, AAV è un piccolo virus senza involucro, con un capside proteico icosaedrico di circa 25 nm di diametro, che ospita un genoma di DNA a singolo filamento. Gli AAV appartengono alla famiglia Parvoviridae e al genere Dependoparvovirus a causa della loro dipendenza unica dalla co-infezione con un virus helper, come il virus dell'herpes simplex o, più frequentemente, l'adenovirus, per completare il loro ciclo litico 2,3.
Il genoma di 4,7 kilobasi degli AAV è costituito da due telai di lettura aperti (ORF) affiancati da due ripetizioni terminali invertite (ITR) che formano caratteristiche estremità a forcina a forma di T4. Gli ITR sono gli unici elementi ad azione cis critici per l'impacchettamento, la replicazione e l'integrazione di AAV, essendo quindi le uniche sequenze AAV mantenute nei vettori AAV ricombinanti (rAAV). In questo sistema, i geni necessari per la produzione del vettore sono forniti separatamente, in trans, consentendo al gene di interesse di essere impacchettato all'interno del capside virale 5,6.
Ogni gene virale codifica proteine diverse attraverso splicing alternativo e codoni di avvio. All'interno dell'ORF Rep, sono codificate quattro proteine non strutturali (Rep40, Rep52, Rep68 e Rep78), che svolgono ruoli cruciali nella replicazione, nell'integrazione sito-specifica e nell'incapsidazione del DNA virale 7,8. L'ORF del Cap funge da stampo per l'espressione di tre proteine strutturali diverse tra loro al loro N-terminale, (VP1, VP2 e VP3), che si assemblano per formare un capside virale da 60 mer in un rapporto di 1:1:10 4,9. Inoltre, un ORF alternativo annidato nel gene Cap con un codone di inizio CUG non convenzionale codifica per una proteina attivante l'assemblaggio (AAP). È stato dimostrato che questa proteina nucleare interagisce con le proteine del capside VP1-3 di nuova sintesi e promuove l'assemblaggio del capside10,11.
Le differenze nella sequenza aminoacidica del capside spiegano gli 11 sierotipi di AAV presenti in natura e oltre 100 varianti isolate da esseri umani e tessuti di primati non umani 7,12,13. Le variazioni nella conformazione delle regioni strutturalmente variabili governano le distinte proprietà antigeniche e le specificità di legame con i recettori dei capsidi di diversi ceppi. Ciò si traduce in distinti tropismi tissutali ed efficienze di trasduzione tra diversi organi di mammifero14.
I primi metodi di produzione di rAAV si basavano sull'infezione da adenovirus per scopi di aiuto 15,16,17,18,19. Nonostante sia efficiente e di solito facile da produrre su larga scala, da questa infezione derivano diversi problemi. Anche dopo la purificazione e una fase di denaturazione del calore per l'inattivazione, le particelle adenovirali possono essere ancora presenti nei preparati AAV, costituendo un problema di sicurezza indesiderato20. Inoltre, la presenza di proteine adenovirali denaturate è inaccettabile per l'uso clinico. Altre strategie di produzione sfruttano i ceppi di virus dell'herpes simplex ricombinanti ingegnerizzati per portare il Rep/Cap e il transgene nelle cellule bersaglio21 o del sistema di cellule baculovirus-insetto22. Sebbene questi sistemi offrano vantaggi in termini di scalabilità e compatibilità GMP, devono ancora affrontare problemi simili.
Il metodo della tripla trasfezione per la produzione di rAAV è stato comunemente adottato per superare facilmente questi problemi. In breve, l'assemblaggio di rAAV si basa sulla trasfezione transitoria di cellule con tre plasmidi codificanti per: 1) la cassetta di espressione transgenica impacchettata tra gli ITR dal genoma AAV2 wild-type (pITR); 2) le sequenze Rep/Cap necessarie per la replicazione e l'assemblaggio del virione (pAAV-RC); e 3) le proteine adenovirali minime (E1A, E1B, E4 ed E2A) insieme agli RNA associati al virus adenovirale necessari per l'effetto helper (pHelper)6,20,23. Sebbene i metodi di trasfezione plasmidica forniscano semplicità e flessibilità per la produzione di rAAV negli studi preclinici, queste procedure presentano limitazioni in termini di scalabilità e riproducibilità se applicate alla produzione su larga scala. Come approccio alternativo, la produzione di rAAV può essere ottenuta attraverso l'uso di linee cellulari produttrici di AAV (sia di crescita aderente che in sospensione), esprimendo stabilmente i geni AAV Rep/Cap o Rep/Cap in combinazione con costrutti vettoriali. In questi sistemi, i geni helper adenovirali vengono introdotti attraverso la trasfezione plasmidica. Anche se questa strategia migliora la scalabilità del processo di coltura cellulare, è tecnicamente complessa e richiede tempo 21,24,25.
In entrambi i casi, le cellule produttrici vengono quindi lisate e sottoposte a una o più fasi di purificazione. Attualmente, i metodi principali per purificare i rAAV includono l'uso di cloruro di cesio (CsCl) o la centrifugazione in gradiente di densità ad altissima velocità di iodixanolo seguita, o meno, da tecniche cromatografiche26. Lo schema di purificazione originale per la precipitazione virale utilizzava solfato di ammonio, seguito da due o tre cicli di ultracentrifugazione attraverso un gradiente di CsCl. I principali vantaggi di questo processo includono la possibilità di purificare tutti i sierotipi e la capacità di separare fisicamente le particelle piene dai capsidi vuoti in base alle loro diverse densità. Questo metodo, tuttavia, è elaborato, richiede tempo e ha una scalabilità limitata, spesso con conseguente scarsa resa e bassa qualità del campione 27,28,29,30. Inoltre, la dialisi contro un tampone fisiologico è spesso necessaria prima degli studi in vivo a causa degli effetti tossici che CsCl può esercitare sui mammiferi.
Lo iodixanolo è stato anche utilizzato come mezzo alternativo a gradiente iso-osmotico per purificare i vettori rAAV, con vantaggi rispetto al CsCl sia dal punto di vista della sicurezza che della potenza del vettore. Tuttavia, come il CsCl, il metodo dello iodixanolo presenta alcuni inconvenienti legati alla capacità di carico del lisato di coltura cellulare (e quindi alla scalabilità della purificazione di rAAV) e rimane un metodo lungo e costoso30,31.
Per superare questi vincoli, i ricercatori hanno rivolto la loro attenzione alle tecniche cromatografiche. A questo proposito, sono stati sviluppati diversi approcci di purificazione che incorporano metodi di cromatografia di affinità, idrofobica o a scambio ionico. Questi metodi si basano sulle proprietà biochimiche di un particolare sierotipo, compresi i loro recettori naturali, o sulle caratteristiche di carica della particella virale32. Ad esempio, la scoperta che AAV2, AAV3, AAV6 e AAV13 si legano preferibilmente ai proteoglicani dell'eparan solfato (HSPG), ha aperto la possibilità di utilizzare l'eparina strettamente correlata nella purificazione cromatografica di affinità. Tuttavia, i siti di legame all'HSPG possono differire tra i sierotipi, mediando l'attaccamento dell'AAV e l'infezione delle cellule bersaglio in modi diversi 2,33,34,35,36. D'altra parte, AAV1, AAV5 e AAV6 si legano all'acido sialico N-legato (SA), mentre AAV4 utilizza SA 2,14,34 legato all'O. Seguendo lo stesso razionale, è stato sviluppato anche un protocollo cromatografico di affinità a singolo step per la purificazione di rAAV5 basato sull'uso della mucina, una proteina di mammifero altamente arricchita in SA37. Come le tecniche a base di eparina, anche questa purificazione dipende dal sierotipo specifico generato. Oltre all'eparina e alla mucina, altri ligandi sono stati esplorati per la cromatografia di affinità, come l'anticorpo monoclonale A20 e gli anticorpi a dominio singolo camelide (AVB Sepharose e POROS CaptureSelect)22,23,38,39,40,41. Altre strategie innovative per migliorare i metodi di purificazione precedentemente esistenti prevedono l'introduzione di piccole modifiche nel capside rAAV per presentare specifici epitopi leganti. Ad esempio, i rAAV marcati con esa-istidina o biotinilati possono essere purificati utilizzando ligandi che hanno come bersaglio quegli epitopi (rispettivamente acido nitrilotriacetico di nichel e resine avidina)42,43,44.
Nel tentativo di ampliare le caratteristiche desiderate dei rAAV, i ricercatori hanno travestito i virioni mescolando i loro capsidi. Ciò si ottiene fornendo il gene del capside da due distinti sierotipi AAV in rapporti equimolari o diversi durante la produzione, dando origine a una struttura del capside composta da una miscela di subunità del capside di diversi sierotipi 34,45,46,47,48,49,50. Studi precedenti forniscono prove fisiche che co-esprimono proteine del capside da AAV2 con AAV1 (rapporto 1:1) e AAV2 con AAV9 (rapporto 1:1) si traduce nella generazione di vettori a mosaico rAAV1/2 e rAAV2/9, rispettivamente 45,46,48. Uno dei principali vantaggi della generazione di rAAV a mosaico è la capacità di integrare tratti vantaggiosi da diversi sierotipi di AAV, con conseguenti miglioramenti sinergici nell'espressione e nel tropismo dei transgeni, pur mantenendo altre proprietà utili durante la produzione di rAAV. È interessante notare che alcune varianti del mosaico mostrano persino nuove proprietà diverse da entrambi i virus parentali 46,47,49. Sfruttando la capacità di legare l'eparina di AAV2, i vettori rAAV a mosaico potrebbero potenzialmente essere generati e purificati mescolando AAV2 con altri capsidi AAV naturali o nuovi generati dall'evoluzione diretta e/o dal disegno razionale. Tuttavia, studi precedenti hanno evidenziato l'importanza della compatibilità delle subunità del capside quando si tenta di assemblare vettori di mosaico. Ad esempio, Rabinowitz e colleghi hanno dimostrato che, sebbene la transcapsidazione di AAV1, AAV2 e AAV3 abbia portato a un efficiente co-assemblaggio di capsidi a mosaico, il travestimento di questi sierotipi con AAV4 ha ostacolato la generazione di virioni stabili 34,45,47. Inoltre, AAV1, AAV2 e AAV3 hanno mostrato una bassa compatibilità con AAV5, dati i titoli virali ridotti ottenuti mescolando questi capsidi a rapporti diversi. È interessante notare che il mosaico rAAV2/5 ha mostrato una diminuzione delle proprietà leganti l'eparina, pur mantenendo la capacità di legare la mucina come l'AAV5 parentale. Tuttavia, rAAV3/5 in un rapporto 3:1 ha preservato il doppio legame con eparina e mucina. Nel complesso, la generazione di nuovi rAAV a mosaico con trasduzione migliorata, tropismo specifico o bassa immunogenicità potrebbe trarre grande beneficio dalla nostra comprensione dell'assemblaggio del capside e delle interazioni recettoriali, con combinazioni specifiche che richiedono ancora indagini approfondite e ottimizzazione.
Nel presente lavoro, descriviamo un protocollo passo-passo per la produzione e la purificazione di rAAV utilizzando un metodo cromatografico di affinità con eparina ottimizzato. Gli rAAV sono prodotti per trasfezione transitoria e vengono purificati utilizzando un sistema di cromatografia liquida proteica veloce (FPLC). Dopo la concentrazione di frazioni purificate selezionate, gli stock virali risultanti vengono caratterizzati in termini di titolo, purezza, proprietà fisiche intrinseche e attività biologica in vitro e in vivo. Come prova di concetto, dimostriamo i miglioramenti e l'applicabilità di questo protocollo per la generazione di vettori a mosaico rAAV1/2 e rAAV2/9. La scelta di ciascun sierotipo si è basata sui loro tropismi sorprendentemente diversi, conferendo potenzialmente le loro caratteristiche uniche anche alle versioni a mosaico. AAV sierotipo 1, con un tropismo complessivamente moderato per il sistema nervoso centrale (SNC), ha la capacità di trasdurre neuroni e glia (in misura minore) e subisce trasporto assonale in direzione anterograda e retrograda in vivo 2,7,8. Inoltre, il sierotipo 9 di AAV è stato scelto per la sua naturale capacità di attraversare la barriera emato-encefalica e colpire il SNC sia nei topi neonatali che in quelli adulti51,52. Infine, è stato selezionato il sierotipo 2 di AAV data la sua capacità di legarsi all'eparina, consentendo la cromatografia di affinità33. Le particelle purificate di rAAV1/2 e rAAV2/9 combinano le proprietà di entrambi i sierotipi AAV parentali e, pertanto, costituiscono vettori adatti per la trasduzione del SNC 45,46,48,49.
Protocollo
NOTA: Vedere la Figura 1 per un'illustrazione che riassume il protocollo. Vedere la Tabella dei materiali per i dettagli su tutti i materiali, gli strumenti e i reagenti utilizzati in questo protocollo. Tutti i lavori che coinvolgono cellule e virus devono essere eseguiti in apposite cappe di biosicurezza e incubatori, separati da quelli regolarmente utilizzati per la manutenzione delle linee cellulari. Le apparecchiature e i reagenti che entrano in contatto con le cellule in coltura e i virus devono essere sterili. È essenziale che lo smaltimento dei reagenti pericolosi e dei materiali contaminati da virus sia eseguito in conformità con le schede di sicurezza dei materiali e in conformità con le leggi e le linee guida nazionali fornite dall'ufficio per la salute e la sicurezza ambientale di ciascuna istituzione. A partire da aprile 2019, le linee guida NIH per la ricerca che coinvolge molecole di acido nucleico ricombinanti o sintetiche classificano come agenti del gruppo di rischio 1 (non associati alla malattia negli esseri umani adulti sani) tutti i sierotipi di AAV, nonché i costrutti AAV ricombinanti o sintetici. Questa classificazione si applica quando il transgene non codifica per un prodotto genico potenzialmente tumorigenico o una tossina e i costrutti sono prodotti senza un virus helper.
Tutti gli esperimenti sugli animali sono stati condotti in conformità alla direttiva comunitaria dell'Unione Europea (2010/63/UE) per la cura e l'uso degli animali da laboratorio, recepita nella legge portoghese nel 2013 (D.Lgs. 113/2013). Inoltre, le procedure per animali sono state approvate dall'Organizzazione responsabile per il benessere degli animali della Facoltà di Medicina e dal Centro di Neuroscienze e Biologia Cellulare dell'Università di Coimbra con licenza per animali. I ricercatori hanno ricevuto una formazione adeguata (corso certificato FELASA) e una certificazione dalle autorità portoghesi (Direcção Geral de Alimentação e Veterinária, Lisbona, Portogallo) per eseguire gli esperimenti.
1. Costrutti plasmidici
- Seguire le istruzioni del produttore di un kit maxiprep privo di endotossine per isolare e purificare quantità sostanziali di DNA dei seguenti plasmidi: i) pITR: il vettore di trasferimento di interesse; ii) plasmide pAAV-RC: pRV1, contenente le sequenze AAV2 Rep e Cap 36; iii) plasmide pAAV-RC: pH21, contenente le sequenze AAV1 Rep e Cap 36; iv) plasmide pAAV-RC: pAAV2/9n, contenente le sequenze AAV2 Rep e AAV9 Cap ; v) pHelper: pFdelta6, plasmide36 adenovirus-helper.
- Esaminare l'integrità dei plasmidi generati eseguendo le restrizioni enzimatiche raccomandate36. Monitorare l'integrità dei plasmidi pITR mediante digestione con SmaI, un'endonucleasi di restrizione, che taglia due volte all'interno di una porzione instabile degli ITR53,54.
NOTA: Poiché gli ITR sono altamente instabili e suscettibili di delezioni, si raccomanda l'uso di cellule supercompetenti SURE 2 per ridurre al minimo la ricombinazione in questi siti.
2. Coltura cellulare
- Coltura del rene embrionale umano 293, che esprime stabilmente la linea cellulare SV40 dell'antigene T grande (HEK293T) nell'alto glucosio Modified Eagle Medium (DMEM) di Dulbecco, integrato con il 10% di siero fetale bovino e l'1% di penicillina-streptomicina, a 37 °C, in atmosfera umidificata contenente il 5% di CO2, come punto di partenza per le fasi successive.
- Subcoltura delle cellule utilizzando 1x soluzione salina tamponata con fosfato (PBS) sterile, pH 7,4, per lavare le cellule prima di aggiungere acido tripsina-etilendiamminotetraacetico allo 0,05% (EDTA).
NOTA: Evitare di utilizzare cellule che hanno subito un numero eccessivo di passaggi (massimo 20). Testare regolarmente le colture cellulari per la contaminazione da micoplasma.
3. Produzione di rAAV per trasfezione transitoria
- Giorno 1: Placcatura cellulare
- Per ogni produzione virale, le cellule HEK293T vengono distribuite in 10 piastre di coltura trattate (15 cm di diametro) il giorno prima della trasfezione, a una densità di 10,5 × 106 cellule per piastra in 22 mL di terreno di coltura integrato e incubano per 24 ore fino a quando le cellule sono confluenti al 70%-80% e pronte per la trasfezione.
- Giorno 2: Trasfezione cellulare mediante polietilenimmina (PEI)
- Per ogni produzione virale (equivalente a 10,5 piatti), preparare la seguente miscela di trasfezione in una provetta da microcentrifuga: 54,6 μg di pITR; 45,675 μg di pRV1; 45,675 μg di pH21 o pAAV2/9n; 109,2 μg di pFdelta6. Mescolare picchiettando.
- Aggiungere la miscela a 4,557 mL di DMEM non integrato in una provetta da centrifuga da 50 mL. Mescolare picchiettando.
- Aggiungere 1,365 mL di soluzione sterile di PEI a 1 mg/mL (pH 7,4), goccia a goccia. Mescolare picchiettando. Incubare per 10 minuti a temperatura ambiente per consentire la formazione di complessi DNA-PEI.
- Aggiungere questa miscela a 231 ml di DMEM integrato preriscaldato. Sostituire l'intero terreno di coltura di ciascuna piastra con 22 mL di questa miscela di trasfezione. Incubare le cellule per 48 ore.
NOTA: Questo passaggio deve essere eseguito con cura per evitare il distacco delle cellule.
- Giorno 4: Raccolta delle cellule
- Quando il pITR codifica un reporter fluorescente, visualizzare le cellule trasfettate al microscopio a fluorescenza.
- Raccogliere il terreno da ogni piatto in provette da centrifuga da 50 ml e centrifugarle a 800 × g per 10 minuti. Scartare il surnatante.
NOTA: Questo passaggio è facoltativo e mira a recuperare le cellule trasfettate che potrebbero essersi staccate a causa di una confluenza molto elevata. - Aggiungere 10 ml di PBS preriscaldato a ciascuna piastra. Rimuovere delicatamente le cellule con un raschietto cellulare e raccogliere la sospensione nelle provette da centrifuga da 50 mL del passaggio 3.3.2.
- Lavare 5 piatti alla volta con altri 10 mL di PBS e trasferire la sospensione nelle provette da centrifuga da 50 mL del passaggio 3.3.3. Pellettare le cellule a 800 × g per 10 minuti e scartare il surnatante.
- Congelare i pellet cellulari a -80 °C.
NOTA: I pellet cellulari possono essere conservati per diversi mesi (punto di pausa).
4. Estrazione rAAV e purificazione FPLC
- Giorno 5: preparazione del lisato cellulare
- Scongelare i pellet cellulari a temperatura ambiente. Risospendere le cellule raccolte dalle 10 piastre in 100 mL di un tampone sterile contenente 150 mM di cloruro di sodio (NaCl) e 20 mM di Tris, pH 8,0, in acqua ultrapura (tipo I). Miscelare la sospensione pipettando su e giù, per garantire una sospensione omogenea.
- Aggiungere 12,5 ml di una soluzione sterile appena preparata di sodio desossicolato al 10% in acqua ultrapura per indurre la lisi cellulare. Mescolare pipettando su e giù.
NOTA: Smaltire il desossicolato di sodio, nonché i materiali a contatto con esso, in conformità con la scheda di sicurezza dei materiali e le linee guida fornite dall'ufficio per la salute e la sicurezza ambientale dell'istituto. Si consiglia inoltre di indossare una maschera facciale durante la manipolazione di questa polvere. Dopo la miscelazione, la soluzione diventa altamente viscosa. - Aggiungere 27 μl di nucleasi benzonasi alla miscela precedente. Miscelare accuratamente pipettando su e giù fino a quando il campione non è più viscoso. Incubare a 37 °C per 1 ora, eseguendo un vortice ogni 10 min.
NOTA: Questa endonucleasi è in grado di degradare efficacemente tutte le forme di DNA e RNA senza mostrare alcuna attività proteolitica. - Rimuovere i detriti cellulari centrifugando la miscela a 3.000 × g per 60 minuti a 25 °C. Filtrare il surnatante con un filtro per siringa sterile in polivinilidene difluoruro (PVDF) da 0,45 μm e trasferirlo in un nuovo contenitore sterile.
NOTA: Questo importante passaggio garantisce che la maggior parte dei detriti cellulari venga rimossa, prevenendo così l'intasamento delle colonne cromatografiche. Conservare una piccola aliquota di questa miscela per l'analisi (passaggio facoltativo).
- Giorno 5 (continua): Purificazione della colonna di eparina dei rAAV
NOTA: L'applicazione del campione può essere eseguita utilizzando una pompa del campione o un superloop da 50 mL o 150 mL come parte del sistema. Poiché a temperature più basse viene disciolta più aria, è importante lasciare un tempo sufficiente affinché i tamponi e le soluzioni (solitamente conservati a 4 °C) si acclimatino a temperatura ambiente prima del loro utilizzo nel sistema FPLC.- Opzionale: se il sistema è stato immagazzinato per lunghi periodi, riempire il sistema e tutti gli ingressi con una soluzione di conservazione appena preparata (etanolo al 20%) utilizzando istruzioni manuali o un metodo predefinito di pulizia del sistema in loco (CIP del sistema).
- Lavare completamente il percorso del flusso del liquido con acqua ultrapura sterile utilizzando istruzioni manuali o un metodo CIP di sistema predefinito.
- Collegare una colonna di eparina preconfezionata da 1 mL, impostare l'allarme di pressione e lavare con cinque volumi di colonna (CV) di acqua ultrapura a una portata di 1 mL/min.
- Commutare le soluzioni nel vassoio tampone da acqua ultrapura a tampone A (soluzione sterile di 100 mM NaCl e 20 mM Tris, pH 8, in acqua ultrapura) per l'ingresso A (pompa del sistema A) e al tampone B (soluzione sterile di 500 mM di NaCl e 20 mM Tris, pH 8, in acqua ultrapura) per l'ingresso B (pompa del sistema B). Se il sistema dispone di una pompa di campionamento, posizionare l'ingresso del tampone della valvola di ingresso del campione nel tampone A.
- Lavare la pompa del sistema B con il tampone B e riempire il resto del percorso del flusso del liquido con il tampone A.
NOTA: Se necessario, scollegare la colonna dal percorso di flusso e ricollegarla successivamente. - Inserire un tubo di ingresso del campione dalla valvola di ingresso del campione, ad esempio S1, nel contenitore con la preparazione virale ottenuta al punto 4.1.4. (da preparazione di lisato cellulare). Adescare il percorso del flusso dall'ingresso del campione S1 alla valvola di iniezione con la soluzione del campione. In alternativa, riempire un superloop da 50 mL o 150 mL con il campione contenente rAAV utilizzando una siringa da 50 mL.
- Equilibrare la colonna con un volume totale di cinque CV utilizzando il 12,5% del tampone B a una velocità di 1 mL/min.
- Applicare il volume totale del campione nella colonna utilizzando la pompa del campione (selezionare iniettare tutto il campione utilizzando il sensore dell'aria) o il superloop a 0,5 mL/min e raccogliere il flusso utilizzando la porta di uscita in un nuovo contenitore sterile.
NOTA: Quando la funzione di controllo del flusso per prevenire la sovrapressione è abilitata, il flusso diminuirà automaticamente in caso di intasamento della colonna. Se la portata scende significativamente al di sotto di 0,5 ml/min, interrompere l'applicazione del campione, eseguire un lavaggio con 2-5 CV del tampone A, quindi riprendere l'applicazione del campione. - Lavare la colonna a 1 mL/min con 20 CV di tampone A, raccogliendo il flusso utilizzando la porta di uscita.
- Eluire il campione a 1 mL/min con il seguente schema: i) gradiente lineare con un target del 50% del tampone B per cinque CV; ii) passo con un obiettivo del 90% del buffer B durante cinque CV; iii) passo con un obiettivo del 100% del buffer B durante cinque CV.
- Raccogliere il campione eluito in frazioni da 1 mL utilizzando un collettore di frazioni e provette per microcentrifuga a bassa ritenzione (2 mL) e conservarle a -20 °C.
NOTA: Le frazioni rAAV possono essere conservate per diverse settimane (punto di pausa). - Riequilibrare la colonna a 1 mL/min con il 12,5% del tampone B per cinque CV.
- Passare gli ingressi dalle soluzioni tampone all'acqua ultrapura e lavare la colonna a 1 mL/min per cinque CV.
- Commutare gli ingressi da acqua ultrapura a etanolo al 20% e lavare la colonna a 1 mL/min per cinque CV. Scollegare la colonna e conservarla a 4 °C.
NOTA: Le colonne possono essere riutilizzate più volte senza altre importanti procedure di pulizia e sanificazione se vengono utilizzati lo stesso sierotipo rAAV e lo stesso transgene. - Lavare completamente il percorso del flusso del liquido con etanolo al 20% utilizzando istruzioni manuali o un metodo CIP di sistema predefinito.
5. Concentrazione di rAAV purificati
- Giorno 6: Fase di concentrazione 1
- Concentrare gli rAAV utilizzando un'unità filtrante centrifuga da 15 mL con un cutoff del peso molecolare di 100 kDa. Caricare le frazioni desiderate contenenti rAAV (frazioni FPLC da 7 a 16) nell'unità filtro centrifugo da 15 mL e centrifugarla a 2.000 × g per 2 minuti a temperatura ambiente. Assicurarsi che il volume concentrato nell'unità filtro sia di circa 500 μl. Se il volume concentrato supera ampiamente i 500 μl, ripetere le fasi di centrifugazione a intervalli di 1 minuto fino a raggiungere il volume desiderato.
- Giorno 6 (continua): Scambio di buffer
- Aggiungere 1 mL di PBS sterile all'unità filtro centrifugo contenente gli rAAV. Pipettare con cura su e giù per lavare il filtro. Centrifugare a 2.000 × g a intervalli di 1 minuto fino a raggiungere il volume finale di 500 μl.
- Giorno 6 (continua): Fase di concentrazione 2
- Trasferire i 500 μL di rAAV concentrati ottenuti nella fase precedente in un'unità filtrante centrifuga da 0,5 mL con un cutoff di peso molecolare di 100 kDa e centrifugare a 6.000 × g per 1 min. Se necessario, ripetere la fase di centrifugazione fino a raggiungere un volume finale inferiore a 100 μl.
- Giorno 6 (continua): Recupero
- Per recuperare l'rAAV concentrato, posizionare il dispositivo filtrante capovolto in una nuova provetta di raccolta per microcentrifuga. Posizionare la provetta in una microcentrifuga con il tappo rivolto verso il centro ed eseguire una rotazione prolungata all'interno della camera di flusso per trasferire i rAAV concentrati dal dispositivo alla provetta della microcentrifuga. In alternativa, centrifugare a 1.000 × g per 2 min.
- Integrare con Pluronic F-68 sterile 0,001% (opzionale).
NOTA: Pluronic F-68 è un tensioattivo non ionico approvato per uso umano dalla Food and Drug Administration che è in grado di mitigare le perdite di rAAV prevenendo le loro interazioni con le superfici dei materiali (plastica) utilizzati durante la preparazione della diluizione, il caricamento della siringa e l'attrezzatura di somministrazione55,56. - Aliquotare gli rAAV in provette per microcentrifuga a bassa ritenzione e conservarli a -80 °C (punto di pausa).
6. Quantificazione di rAAV purificati
- Giorno 6 (continua): determinare il titolo dei preparati di rAAV, espressi in genomi virali/μL (vg/μL), mediante reazione a catena quantitativa della polimerasi in tempo reale (RT-qPCR) utilizzando un kit commerciale e seguendo le istruzioni del produttore.
- Incubare la soluzione di particelle di rAAV con DNasi I a 37 °C per 20 minuti.
NOTA: Questa procedura promuove la digestione del DNA genomico libero e del DNA plasmidico derivato dalle cellule ospiti, garantendo così che venga preservata solo la sequenza di acido nucleico all'interno delle particelle di rAAV intatte. - Inattivare a caldo la DNasi I a 95 °C per 10 min.
- Aggiungere il tampone di lisi e incubare per 10 minuti a 70 °C per favorire la denaturazione termica delle proteine delle particelle rAAV.
- Diluire la soluzione del genoma rAAV ottenuta in tampone di diluizione prima di procedere alla RT-qPCR. Preparare una serie di standard diluiti in serie del controllo positivo (da 2 × 107 vg/μL a 2 × 102 vg/μL) forniti con il kit.
- Eseguire una miscela di reazione contenente 12,5 μl di miscela Taq II, 0,5 μl di miscela di primer diluita, 7 μl di acqua e 5 μl di DNA rAAV diluito (campione AAV sconosciuto e standard del passaggio 6.1.4.).
- Eseguire la RT-qPCR in un sistema di rilevamento PCR in tempo reale, utilizzando il seguente protocollo: 1 ciclo a 95 °C per 2 min (denaturazione iniziale) e 40 cicli a 95 °C per 5 s (denaturazione) e 60 °C per 30 s (ricottura, estensione e lettura della piastra), seguiti da un'analisi della curva di fusione.
- Calcolare la concentrazione assoluta del campione dalla curva standard (linea di regressione lineare), considerando il fattore di diluizione risultante dalla preparazione del campione rAAV.
NOTA: La quantificazione del numero di genomi virali si ottiene attraverso l'amplificazione della sequenza ITR di AAV2 (sequenza target dei primer forniti dal kit).
- Incubare la soluzione di particelle di rAAV con DNasi I a 37 °C per 20 minuti.
7. SDS-PAGE, colorazione blu di Coomassie e western blot
- Denaturare 40 μl di ciascun campione (ogni frazione FPLC, il flusso continuo, i campioni precolonna e un totale di 2,3 × 1010 vg del prodotto concentrato finale) aggiungendo 6 tamponi campione (0,5 M Tris-HCl/0,4% di sodio dodecil solfato (SDS) pH 6,8, 30% di glicerolo, 10% di SDS, 0,6 M di ditiotreitolo (DTT), 0,012% di blu di bromofenolo) e incubando i campioni per 5 minuti a 95 °C.
- Caricare i campioni denaturati (48 μL) in un gel di poliacrilammide SDS (4% di impilamento e 10% di gel risolutivo) ed eseguire la separazione elettroforetica a 100 V per 70 minuti, adiacente a una scala proteica.
- Analisi delle proteine
NOTA: È possibile eseguire la colorazione blu di Coomassie o il western blotting.- Colorazione blu Coomassie
- Per visualizzare le bande proteiche, colorare il gel per 10 minuti con una soluzione di blu Coomassie G250 allo 0,25% disciolta in metanolo al 50% e acido acetico glaciale al 10%.
- Eseguire la decolorazione in gel lavandolo più volte con una soluzione contenente il 25% di metanolo e il 5% di acido acetico glaciale fino a quando non diventano visibili bande chiare con fondo basso.
- Acquisire immagini utilizzando un sistema di imaging appropriato.
- Western blot
- Trasferire le proteine su una membrana in PVDF secondo protocolli standard.
- Bloccare la membrana mediante incubazione in latte scremato al 5% diluito in TBS-T (0,1% Tween 20 in soluzione salina tamponata con Tris) per 1 ora a temperatura ambiente.
- Utilizzare i seguenti anticorpi primari (diluiti in soluzione bloccante) per l'incubazione notturna a 4 °C: anticorpi monoclonali di topo anti-AAV, anticorpi VP1, VP2, VP3 (B1, 1:1.000) o anticorpi monoclonali di topo anti-AAV, VP1, VP2 (A69, 1:1.000).
- Lavare le membrane per 3 x 15 minuti in TBS-T e incubare con un anticorpo secondario di capra anti-topo legato alla fosfatasi alcalina (1:10.000), per 2 ore a temperatura ambiente.
- Lavare le membrane per 3 x 15 minuti in TBS-T. Aggiungi un substrato chemifluorescente potenziato (ECF) e visualizza le bande proteiche mediante imaging a chemifluorescenza.
- Colorazione blu Coomassie
8. Microscopia elettronica a trasmissione (TEM)
- Posizionare una griglia da 200 mesh rivestita in carbonio Formvar capovolta sopra una goccia di un campione rAAV e lasciarla riposare per 1 minuto.
- Lavare le griglie in una goccia d'acqua e asciugare il liquido in eccesso con carta da filtro.
- Colorare negativamente le griglie con una soluzione di acetato di uranile all'1% (pH 7) per 1 minuto per fissare e contrastare le particelle virali.
- Lavare le griglie in una goccia d'acqua e asciugare il liquido in eccesso con carta da filtro.
- Esaminare i campioni in un microscopio elettronico a trasmissione.
NOTA: Alte concentrazioni di sale possono avere un impatto diretto sul legame degli rAAV alla griglia e portare alla visualizzazione di strutture cristalline.
9. Analisi consecutiva dell'assorbimento della luce ultravioletto-visibile, della diffusione statica della luce e della diffusione dinamica della luce
- Su una piastra di quantificazione a 96 pozzetti, caricare 2 μL di un campione rAAV e 2 μL di PBS da utilizzare come bianco tampone (eseguire questa operazione in duplicati).
- Utilizzare l'applicazione AAV Quant nel software di analisi del cliente, posizionare i nomi dei campioni nella posizione corretta della piastra, selezionare il sierotipo AAV e fare clic su Avanti.
- Caricare la piastra di quantificazione a 96 pozzetti nell'apparecchiatura dedicata e procedere con la lettura della piastra per l'acquisizione dei dati.
10. Saggi di trasduzione in vitro
- Diverse linee cellulari possono essere utilizzate per analizzare rapidamente l'efficienza di trasduzione degli rAAV.
- Seminare uniformemente HEK293T cellule in piastre a 24 pozzetti (a una densità di 137.500 cellule/pozzetto) e una linea cellulare di neuroblastoma-2A (Neuro2a) di topo in piastre a 24 pozzetti (50.000 cellule/pozzetto) o in un vetrino a 8 pozzetti (27.000 cellule/pozzetto), utilizzando DMEM ad alto glucosio, integrato con il 10% di siero fetale bovino e l'1% di penicillina-streptomicina, come descritto sopra. Lasciare aderire le celle per una notte a 37 °C in un'atmosfera umidificata contenente il 5% di CO2.
- Raccogliere il terreno condizionato da ciascun pozzetto (250 μl da piastre a 24 pozzetti e 50 μl dal vetrino della camera a 8 pozzetti) e conservarlo a 4 °C per un uso successivo.
- Aggiungere i seguenti preparati rAAV a ciascun pozzetto e incubare le cellule per 24 ore a 37 °C in un'atmosfera di CO2 al 5%.
- Aggiungere 50 μl delle frazioni F2-F16 raccolte da FPLC e fluire in HEK293T le cellule piastrate in piastre a 24 pozzetti.
- Aggiungere un totale di 5,5 × 109 vg di rAAV concentrati diluiti in 50 μL di PBS alle cellule Neuro2a piastrate in piastre a 24 pozzetti (includere un pozzetto di controllo negativo, aggiungendo 50 μL di PBS alle cellule).
- Aggiungere un totale di 2,75 × 109 vg di rAAV concentrati diluiti in 25 μL di PBS alle cellule Neuro2a piastrate in un vetrino a 8 pozzetti (includere la condizione di controllo negativo, aggiungendo 50 μL di PBS alle cellule).
- Aggiungere il terreno condizionato precedentemente conservato (fase 10.1.2) in ciascun pozzetto e incubare per 24 ore.
- Scartare il terreno e lavare le celle 2 volte con PBS.
- Aggiungere una soluzione di paraformaldeide (PFA) al 4%, integrata con saccarosio al 4% in PBS, preriscaldata a 37 °C, in ciascun pozzetto e incubare a temperatura ambiente per 20 minuti.
- Lavare 2 volte con PBS e conservare a 4 °C fino all'esecuzione dell'imaging (punto di pausa).
- Acquisizione di immagini su un microscopio a fluorescenza invertito dotato di un obiettivo 10x/0,30 o su un microscopio confocale invertito dotato di un obiettivo DIC a olio 40x/1,4.
- Per avere un modello più rilevante e riflessivo dell'ambiente in vivo , utilizzare colture neuronali primarie come segue:
- Preparare colture primarie di neuroni corticali come precedentemente descritto da Santos et al.57. In breve, seminare 200.000 cellule/mL in piastre a 12 pozzetti e mantenerle in coltura fino al giorno in vitro 16.
- Raccogliere il terreno condizionato da ciascun pozzetto (100 μL) e conservarlo a 4 °C per un uso successivo.
- Aggiungere i rAAV da testare a ciascun pozzetto: un totale di 2,75 × 109 vg di rAAV concentrati diluiti in 25 μL di PBS (includere il controllo negativo: 25 μL di PBS). Incubare per 24 ore a 37 °C in atmosfera di CO2 al 5%.
- Aggiungere il terreno condizionato precedentemente conservato e incubare per 24 ore.
- Scartare il terreno in ogni pozzetto e lavare 2 volte con PBS.
- Fissare le celle con il 4% di PFA/4% di saccarosio nel PBS, come descritto al punto 10.1.6. Lavare 2 volte con PBS.
- Incubare ogni pozzetto con 5 μg/mL di agglutinina di germe di grano (WGA) coniugata con Alexa Fluor 633 per 10 minuti a temperatura ambiente (passaggio opzionale: eseguire invece l'immunocitochimica). Lavare 2 volte con PBS.
- Incubare in Triton X-100 allo 0,25% in PBS per 5 minuti a temperatura ambiente. Lavare con PBS.
- Incubare con 4',6-diamidino-2-fenilindolo (DAPI) per 5 minuti a temperatura ambiente. Lavare 2 volte con PBS.
- Acquisisci immagini su un microscopio a fluorescenza invertito dotato di un obiettivo 40x/0,95 o su un microscopio confocale invertito dotato di un obiettivo 40x/1,4 Oil DIC.
11. Esperimenti in vivo
NOTA: Gli animali sono stati alloggiati in una stanza a temperatura controllata, mantenuta su un ciclo luce/buio di 12 ore. Cibo e acqua sono stati forniti ad libitum. Sono stati fatti tutti gli sforzi per ridurre al minimo la sofferenza degli animali.
- Iniezione stereotassica nel cervelletto
- Anestetizzare animali C57BL/6 di 9 settimane mediante inalazione di isoflurano al 2% in presenza di ossigeno (0,8 L/min) in una camera collegata a un vaporizzatore.
- Posizionare l'animale anestetizzato nell'apparato stereotassico (su un tampone riscaldato a 35 °C) e posizionare la maschera di isoflurano nel naso dell'animale. Abbassa il livello di isoflurano all'1,3-1,7%.
NOTA: Assicurarsi che l'animale sia correttamente anestetizzato prima di procedere (perdita del riflesso per flessione in entrambi gli arti posteriori). - Applicare un unguento lubrificante per gli occhi per evitare l'essiccazione delle cornee e iniettare all'animale un analgesico approvato.
NOTA: Tutti i passaggi successivi devono essere eseguiti in condizioni sterili. - Dopo aver rasato il pelo della testa dell'animale e disinfettato l'area chirurgica, esporre il cranio e posizionare la punta di un ago per iniezione a punta smussata da 30 G, collegato a una siringa Hamilton da 10 μL, direttamente sopra il bregma (utilizzare il bregma come zero per il calcolo delle coordinate stereotassiche).
- Sposta l'ago nella coordinata prevista e pratica un foro attraverso il cranio dove entrerà l'ago.
NOTA: Nell'ambito di questo studio, una singola iniezione è stata eseguita centralmente nel cervelletto. - Iniettare 4 μL di una soluzione di rAAV contenente un totale di 8 × 109 vg, diluita in PBS, ad una velocità di infusione di 0,5 μL/min utilizzando un iniettore automatico. Utilizzare le seguenti coordinate, calcolate da bregma, per eseguire una singola iniezione centralmente nel cervelletto di un topo adulto C57BL/6: antero-posteriore: -6,5 mm; laterale: 0 mm; ventrale: -2,9 mm.
NOTA: Queste coordinate possono variare in base al ceppo del topo, al sesso e all'età degli animali in uso. - Per ridurre al minimo il riflusso e consentire la diffusione del vettore virale, una volta completata l'infusione, lasciare l'ago della siringa a queste coordinate per 3 minuti, quindi ritrarlo lentamente di 0,3 mm e lasciarlo rimanere in posizione per altri 2 minuti prima della sua completa rimozione dal cervello del topo.
- Chiudere l'incisione e pulirla con un agente disinfettante (ad es. 10% di iodio povidone).
- Consenti agli animali di riprendersi dall'anestesia prima di riportarli nelle gabbie di casa.
- Raccolta e preparazione dei tessuti
NOTA: In questo esperimento, i livelli di trasduzione sono stati osservati 12 settimane dopo l'iniezione, ma la stessa procedura potrebbe essere valutata già 4 settimane dopo l'iniezione.- Anestetizzare terminalmente gli animali mediante somministrazione intraperitoneale di un sovradosaggio di xilazina/ketamina (8/160 mg/kg di peso corporeo).
- Perfondere transcardicamente gli animali con PBS ghiacciato per 6 minuti a una velocità di 2,5 ml/min, seguito dalla perfusione con una soluzione di PFA al 4% ghiacciata appena preparata per 10 minuti alla stessa velocità.
- Postfissare i cervelli asportati in PFA al 4% per una notte a temperatura ambiente e poi trasferirli in una soluzione di saccarosio/PBS al 25% per la crioprotezione. Una volta che il cervello affonda (circa 48 ore dopo), conservalo a -80 °C.
- Tagliare sezioni sagittali seriali con uno spessore di 30 μm utilizzando un criostato a -21 °C. Per ogni animale, raccogliere 96 sezioni sagittali di un emisfero cerebrale in serie anatomiche come sezioni flottanti in PBS integrate con azoturo di sodio allo 0,05%. Conservare a 4 °C fino a nuova lavorazione.
- Immunoistochimica a fluorescenza standard
- Selezionare otto sezioni sagittali per animale, a una distanza di 240 μm l'una dall'altra.
- Incubare le sezioni flottanti in una soluzione bloccante/permeabilizzante (0,1% Triton X-100 contenente il 10% di siero normale di capra (NGS) in PBS) per 1 ora a temperatura ambiente.
- Incubare le sezioni per una notte a 4 °C con anticorpo primario policlonale anti-GFP di pollo (1:1.000).
- Lavare per 3 x 15 minuti in PBS e incubare le sezioni per 2 ore a temperatura ambiente con l'anticorpo policlonale secondario capra anticorpo anti-pollo coniugato al fluoroforo Alexa Fluor 488 (1:200).
- Lavare per 3 x 15 min in PBS. Incubare con DAPI per 5 minuti a temperatura ambiente.
- Lavare per 3 x 15 min in PBS. Posizionare le sezioni in vetrini rivestiti di gelatina e vetrino coprioggetti con mezzo di montaggio a fluorescenza.
- Acquisizione di immagini su un microscopio a fluorescenza con scanner per vetrini dotato di obiettivo 20x/0,8.
Risultati
In questo lavoro, presentiamo un protocollo dettagliato per la produzione, la purificazione e la caratterizzazione di rAAV a mosaico (riassunti in Figura 1), che hanno il potenziale per colpire e trasdurre il SNC (ad es. AAV1 e AAV9), essendo contemporaneamente adatti per la purificazione cromatografica di affinità dell'eparina (AAV2). Per raggiungere questo obiettivo, sono stati utilizzati capsidi dei sierotipi 1, 2 e 9 di AAV naturale per sviluppare vettori a mosaico rAAV1/2 e rAAV2/9.
Prima di iniziare, le preparazioni plasmidiche sono state sottoposte a screening per l'integrità strutturale. Oltre alle digestioni necessarie per convalidare il corretto inserimento dei frammenti di clonazione, è essenziale eseguire costantemente lo screening dei plasmidi pITR per rilevare potenziali delezioni/inserzioni ITR. Ad esempio, l'integrità degli ITR in diversi cloni di un plasmide pITR è stata monitorata dopo la digestione del plasmide con l'enzima di restrizione SmaI (Figura supplementare S1).
Entrambi i tipi di vettori a mosaico sono stati generati dalla co-trasfezione dei rispettivi plasmidi del capside AAV in un rapporto 1:1, secondo i metodi di trasfezione standard6. In breve, HEK293T cellule sono state trasfettate con i) un plasmide contenente il transgene di interesse impacchettato tra le sequenze ITR (pITR), ii) un plasmide contenente il genoma AAV wild-type Rep e Cap ORF di AAV2 e AAV1 o AAV9 (plasmidi pAAV-RC) e iii) un plasmide codificante le proteine adenovirali (E1A, E1B, E4 ed E2A) e gli RNA associati al virus adenovirus essenziali per le funzioni helper (pHelper). Quarantotto ore dopo, le cellule sono state raccolte 6,36 e gli rAAV sono stati purificati dall'omogenato cellulare mediante cromatografia di affinità utilizzando un sistema FPLC. Come illustrato nella Figura 2A, dopo l'equilibrio della colonna (fase di equilibrio), il lisato cellulare contenente gli rAAV è stato applicato alla colonna (caricamento del campione). A causa della naturale affinità di rAAV2 per l'eparina33, gli rAAV si sono legati alla resina della colonna, mentre altri componenti sono stati trasportati nel buffer di corsa e rilevati dal monitor UV (flowthrough), con conseguente aumento dell'assorbanza. La colonna è stata successivamente lavata (fase di lavaggio) e gli rAAV sono stati infine eluiti mediante un aumento della concentrazione di NaCl (fase di eluizione). I virus eluiti sono stati rilevati dal monitor UV e raccolti in frazioni di 1 mL.
Un profilo rappresentativo del picco di eluizione di rAAV1/2 e rAAV2/9 è mostrato rispettivamente nella Figura 2B e nella Figura S2A supplementare, con diversi lotti virali che presentano costantemente un singolo picco a partire dalla frazione F7 fino a F16. L'altezza del picco è variabile tra le produzioni di rAAV, con picchi più alti che di solito portano a rese rAAV più elevate. Ogni frazione dei rAAV1/2 e rAAV2/9 prodotti è stata successivamente caratterizzata mediante RT-qPCR per valutare i titoli virali (Figura 2C e Figura supplementare S2B).
Per caratterizzare la purezza del materiale eluito, 40 μL di ciascuna frazione e del rispettivo flusso sono stati esaminati mediante elettroforesi su gel di poliacrilammide SDS al 10% (Figura 2D per rAAV1/2 e Figura supplementare S2C per rAAV2/9). La colorazione blu di Coomassie ha rivelato tre bande principali nelle frazioni F7-F16, con pesi molecolari corrispondenti alle proteine del capside VP1 (87 kDa), VP2 (72 kDa) e VP3 (62 kDa) degli AAV nei rapporti appropriati 1:1:10, come precedentemente descritto da Van Vliet e colleghi14. In entrambi i casi, e in base all'assorbanza UV, alla RT-qPCR e all'intensità della banda di gel, è chiaro che la maggior parte dei rAAV a mosaico è presente nelle frazioni F7 e F8 e inizia a diminuire gradualmente nelle frazioni F9-F16. Oltre alle tre proteine del capside virale, un'altra proteina (o proteine) di circa 17 kDa è stata rilevata nelle frazioni F8-F16.
Per eliminare questa proteina co-purificante, le frazioni F7-16 sono state successivamente filtrate e concentrate utilizzando unità filtranti centrifughe da 100 KDa e il titolo finale di rAAV è stato determinato mediante RT-qPCR (come mostrato nella Figura 3A, B per rAAV1/2). La resa finale di una produzione di rAAV dipende dalla lunghezza e dalla complessità del pITR, dall'integrità delle sequenze ITR, dalle condizioni di coltura cellulare (ad esempio, numero di passaggi cellulari) e dall'efficienza di trasfezione 24,58,59,60,61. Tuttavia, il titolo finale può essere regolato eseguendo più centrifugazioni della preparazione rAAV utilizzando unità filtranti centrifughe da 0,5 mL (fase di concentrazione 2). Seguendo questo protocollo, per un volume finale compreso tra 50 e 100 μL, le concentrazioni sono generalmente comprese tra 2 × 109 e 5 × 1010 vg/μL (quantificazione eseguita utilizzando il kit di titolazione di riferimento).
La purezza delle preparazioni finali di rAAV è stata quindi valutata su un gel di poliacrilammide SDS al 10%. Come illustrato nella Figura 3C, sono state osservate solo tre bande che rappresentano le proteine del capside rAAV per la preparazione di rAAV1/2 e non sono state identificate proteine co-purificanti rilevabili. Questi risultati sono stati coerenti con quelli ottenuti per rAAV2/9 (Figura supplementare S2C). Per confermare l'identità e caratterizzare ulteriormente la purezza dei vettori rAAV1/2 e rAAV2/9, le frazioni virali e gli stock concentrati sono stati analizzati mediante western blot, con gli anticorpi specifici B1 (Figura supplementare S3A e Figura supplementare S4A) e A69 (Figura supplementare S3B e Figura supplementare S4B). Mentre l'anticorpo B1 riconosce un epitopo C-terminale comune a tutte le proteine VP della maggior parte dei sierotipi AAV62, il clone A69 riconosce solo gli epitopi di VP1 e VP263. Tuttavia, alcune bande deboli con pesi molecolari inferiori a VP3 (<62 kDa) possono essere rilevate anche dopo la marcatura di B1 e A69.
Per caratterizzare la morfologia strutturale e valutare ulteriormente la purezza degli rAAV, le particelle virali sono state visualizzate direttamente mediante TEM. Questa tecnica è stata la procedura standard per valutare l'integrità e la purezza del campione nei campioni virali, in quanto consente la quantificazione delle particelle rAAV vuote e piene, nonché la valutazione della contaminazione in un campione 29,64,65,66,67. Come mostrato nella Figura 3D, grandi quantità di particelle rAAV, ~25 nm di diametro, potrebbero essere osservate su uno sfondo pulito. In tutto il campo campione si possono osservare anche particelle vuote (freccia nera) con un centro denso di elettroni, così come vettori pieni (freccia bianca).
Abbiamo anche eseguito il controllo di qualità degli rAAV purificati utilizzando Stunner, una piattaforma che combina spettroscopia ultravioletto-visibile (UV-Vis), diffusione statica della luce (SLS) e diffusione dinamica della luce (DLS)68. Per ogni campione, la quantità totale di proteine, ssDNA, nonché l'assorbimento delle impurità e la torbidità di fondo, sono stati misurati mediante spettroscopia UV-Vis (Figura 3E e Figura supplementare S5A). SLS e DLS sono stati quindi applicati per valutare il comportamento di diffusione della luce dei capsidi rAAV. Dato che gli AAV hanno un diametro medio di 25 nm, le particelle entro un intervallo di diametro 15-45 nm sono considerate intatte. Le particelle più grandi rappresentano tipicamente aggregati virali e tutto ciò che è più piccolo comprende molto probabilmente particelle piccole, comprese le proteine del capside non assemblate68. Per rAAV1/2, è stato osservato un singolo picco corrispondente a particelle di capside intatte a 30 nm (Figura 3F), con 0% di intensità aggregata e 0% di intensità di piccole particelle. Per la preparazione di rAAV2/9, è stato rilevato anche un picco a 30 nm che rappresenta un'intensità del capside del 78% (Figura supplementare S5B). Anche se l'intensità delle piccole particelle era dello 0%, per questo campione è stata misurata un'intensità aggregata del 22% (raffigurata in grigio), con il contributo maggiore (19,9%) dei grandi aggregati con un diametro medio di 620 nm (Figura supplementare S5B). Attraverso la combinazione della spettroscopia UV-Vis con le informazioni SLS e DLS, Stunner ha rivelato il titolo totale complessivo del capside, il titolo completo del capside, la proteina libera e aggregata, nonché l'ssDNA libero e aggregato per le due preparazioni virali, mostrate nella Figura 3G e nella Figura S5C supplementare (valori specifici indicati nella legenda di ciascuna figura).
Parallelamente, per valutare l'attività biologica dei vettori AAV a mosaico sviluppati, HEK293T cellule sono state infettate con 50 μL di ciascuna frazione ottenuta da FPLC (F2-F16) della preparazione rAAV1/2 o rAAV2/9. Poiché il vettore rAAV1/2 codifica per una proteina fluorescente verde a singolo filamento (GFP), sotto il controllo di un promotore del CMV (pAAV-CMV-ssGFP), e il vettore rAAV2/9 codifica per una GFP autocomplementare, sotto il controllo del promotore del CMV (PAAV-CMV-SCGFP53), LA FLUORESCENZA DIRETTA DELLA GFP È STATA ESAMINATA IN QUESTE CELLULE 48 ORE DOPO L'INFEZIONE (Figura S6 e Figura S7). Coerentemente con le precedenti osservazioni per RT-qPCR, blu di Coomassie e western blot, il livello di infettività più alto è stato raggiunto per le frazioni virali F7 e F8, diminuendo gradualmente nelle frazioni da F9 a F16.
Per confermare se l'attività biologica degli rAAV fosse mantenuta dopo l'ultrafiltrazione e le fasi di concentrazione, le cellule Neuro2A, piastrate sia in piastre a 24 pozzetti che in un vetrino a 8 pozzetti, sono state infettate con il vettore rAAV1/2 concentrato, codificante scGFP sotto il controllo del promotore del CMV (pAAV-CMV-scGFP53). Le immagini in campo chiaro e in fluorescenza sono state acquisite 48 ore dopo l'infezione (Figura 4A, B per immagini a risoluzione più elevata).
Con l'obiettivo di esplorare la capacità infettiva dei rAAV prodotti in un modello cellulare più rilevante e riflettente, colture neuronali primarie semi-dense della corteccia sono state seminate su una piastra a 12 pozzetti e infettate con rAAV1/2 - CMV-scGFP precedentemente utilizzato. Quarantotto ore dopo l'infezione, le cellule sono state fissate e marcate con DAPI e WGA coniugate con Alexa Fluor 633, una lectina ampiamente utilizzata per marcare le cellule fisse. Le immagini mostrate in Figura 4C,D sono state acquisite con uno Zeiss Axio Observer Z1 e su un LSM 710 confocale Zeiss. Come raffigurato in queste figure dalla fluorescenza diretta della GFP, i virus a mosaico concentrati conservano le loro proprietà di trasferimento genico per le cellule neuronali.
Dopo aver caratterizzato i rAAV a mosaico in termini di purezza, proprietà fisiche e funzionalità in vitro, abbiamo successivamente valutato la possibilità di utilizzare i vettori a mosaico rAAV1/2 purificati per trasdurre il cervelletto di topi C57BL/6. Per questo, è stata eseguita un'iniezione stereotassica in topi di 9 settimane e l'espressione di GFP è stata valutata 12 settimane dopo. Come anticipato, gli animali iniettati con PBS non hanno mostrato fluorescenza all'immunomarcatura GFP. Le immagini di epifluorescenza di topi iniettati con vettori rAAV1/2 che codificano per GFP sotto il controllo del promotore della sinapsina 1 (rAAV1/2 - Syn-ssGFP) hanno rivelato che i vettori rAAV1/2 hanno trasdotto con successo diverse regioni del cervelletto, vale a dire la regione dei nuclei cerebellari profondi (DCN), nonché i diversi lobuli del cervelletto (Figura 5). Questi risultati dimostrano l'espressione prolungata del transgene nel cervello dei mammiferi (12 settimane).
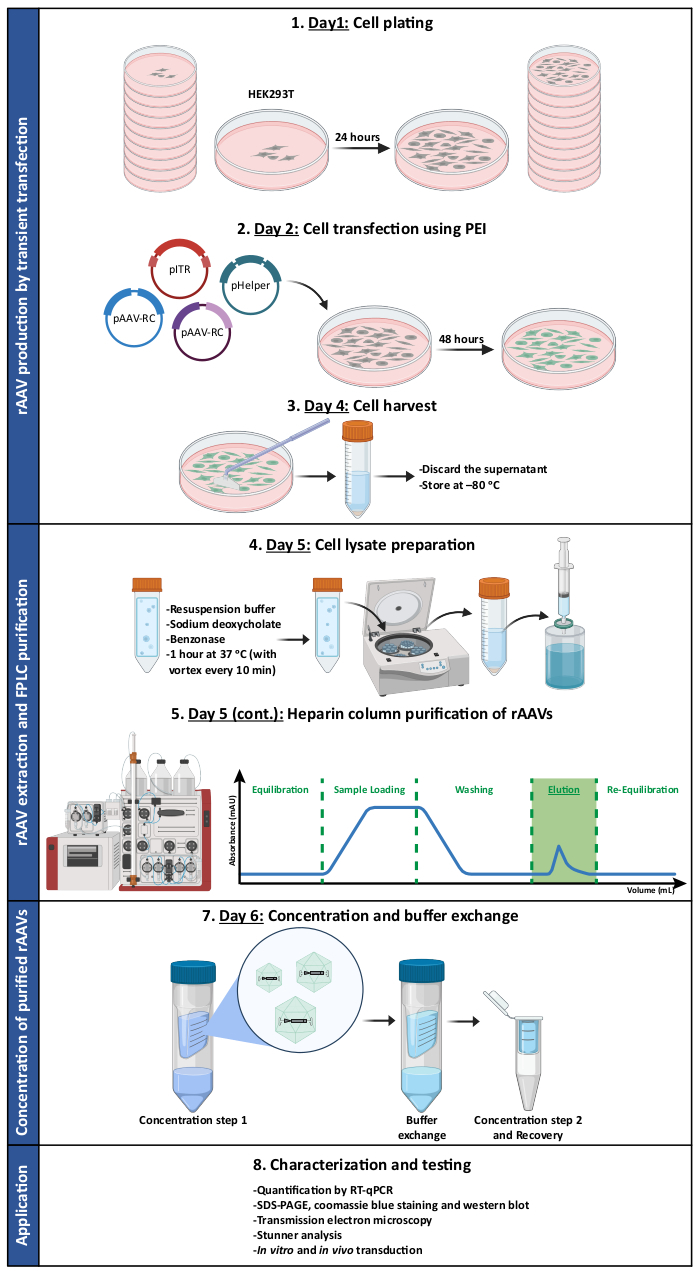
Figura 1: Rappresentazione schematica del protocollo di produzione e purificazione di rAAV. Gli rAAV sono prodotti dalla trasfezione transitoria di cellule HEK293T utilizzando polietilenimmina (PEI). Successivamente, le cellule vengono raccolte e lisate e gli rAAV vengono purificati dall'omogenato cellulare tramite cromatografia di affinità. Le frazioni raccolte contenenti rAAV vengono quindi concentrate e gli stock virali finali vengono caratterizzati in termini di titolo, purezza, caratteristiche morfologiche e attività biologica. Abbreviazioni: rAAV = virus adeno-associato ricombinante; PEI = polietilenimmina; RT-qPCR = reazione quantitativa a catena della polimerasi in tempo reale; SDS-PAGE = elettroforesi su gel di sodio dodecil solfato-poliacrilammide. Fare clic qui per visualizzare una versione più grande di questa figura.
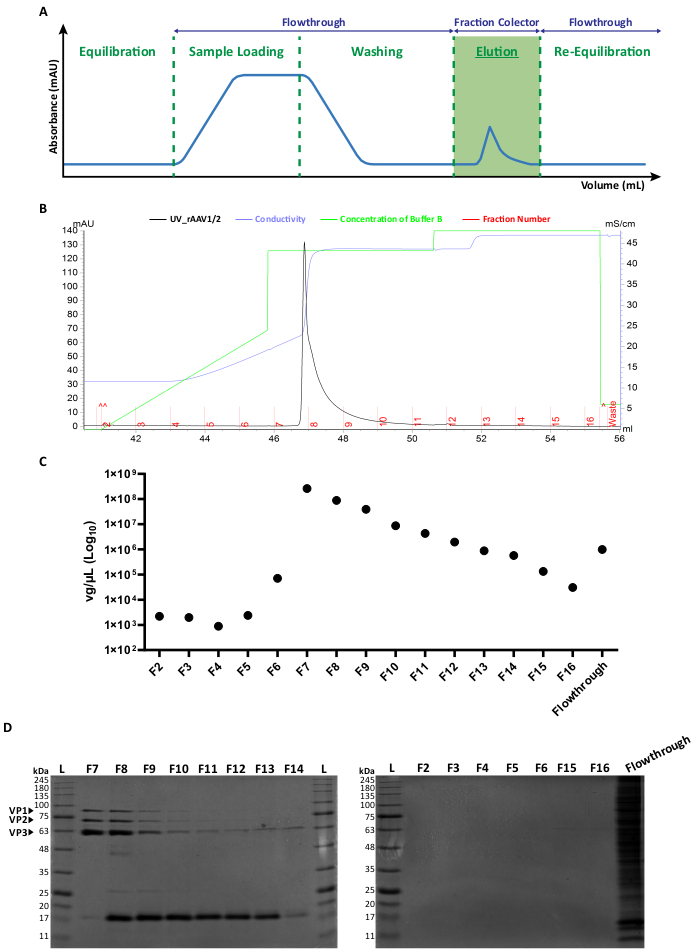
Figura 2: Protocollo di purificazione FPLC e profilo di eluizione rappresentativo di rAAV1/2. (A) Rappresentazione schematica di un profilo cromatografico completo, che mostra le diverse fasi del processo di purificazione di rAAV. Dopo una fase di equilibrio della colonna, viene applicato il campione. La colonna viene quindi lavata e l'eluizione viene eseguita con concentrazioni crescenti di NaCl. Il materiale non legato (flowthrough) e le frazioni da 1 mL dei virus eluiti vengono raccolti per l'analisi. L'assorbanza a 280 nm è espressa in mAU e l'asse x indica il volume in mL. (B) Cromatogramma parziale ingrandito che mostra un picco di eluizione rAAV1/2 (in nero), con i corrispondenti numeri di frazione (F2-F16) e rifiuti (indicati in rosso). La concentrazione emessa del tampone B e la conducibilità (espressa in mS/cm) sono mostrate rispettivamente in verde e viola. (C) RT-qPCR di ciascuna frazione raccolta durante la purificazione per affinità (F2-F16) e il flowthrough. Il titolo in vg/μL è rappresentato su una scala logaritmica. (D) Analisi SDS-PAGE delle frazioni virali raccolte. Volumi uguali (40 μL) di ciascuna frazione dalla fase di eluizione (F2-F16) e il rispettivo flusso sono stati caricati e risolti su un gel di poliacrilammide SDS al 10%. Le bande proteiche sono state visualizzate mediante colorazione blu di Coomassie. Sono indicate le bande corrispondenti alle proteine del capside AAV VP1, VP2 e VP3. La scala delle dimensioni standard delle proteine è designata come (L) e sono indicati anche i pesi molecolari corrispondenti. Abbreviazioni: rAAV = virus adeno-associato ricombinante; RT-qPCR = reazione quantitativa a catena della polimerasi in tempo reale; SDS-PAGE = elettroforesi su gel di sodio dodecil solfato-poliacrilammide. Fare clic qui per visualizzare una versione più grande di questa figura.
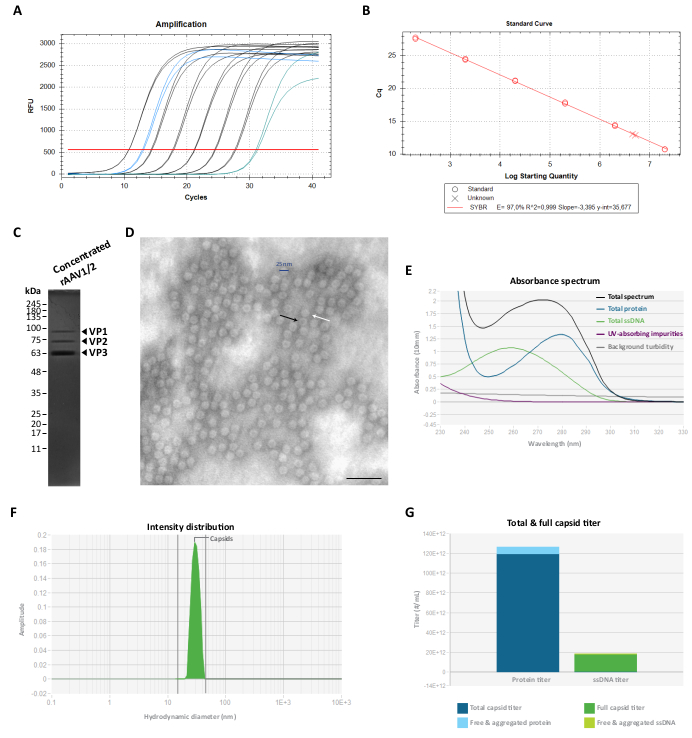
Figura 3: Caratterizzazione dei vettori rAAV1/2 concentrati. (A) Curve di amplificazione di un campione concentrato di rAAV1/2 (in blu), standard diluiti in serie da 2 × 107 vg/μL a 2 × 102 vg/μL (in nero) e un controllo senza stampo (in verde), ottenuti durante RT-qPCR. (B) Curva standard (regressione lineare) per la determinazione del titolo di un campione di rAAV in vg/μL. (C) Analisi SDS-PAGE delle particelle virali concentrate. Un totale di 2,3 × 1010 vg dello stock concentrato sono stati raggruppati sul gel. (D) Immagine al microscopio elettronico a trasmissione di particelle rAAV1/2 con ~25-30 nm di diametro. Le particelle vuote con un centro denso di elettroni (evidenziato da frecce nere) possono essere distinte dai capsidi pieni (evidenziati da frecce bianche). Barra di scala = 100 nm. (E) Spettro di assorbanza di un preparato rAAV1/2 misurato mediante stordimento (in nero). Vengono inoltre mostrati il contributo di proteine (in blu), ssDNA (in verde), altri composti o impurità che assorbono i raggi UV (in viola) e torbidità di fondo (in grigio). (F) Distribuzione dell'intensità DLS di rAAV1/2 con un singolo picco a 30 nm, misurata mediante Stunner. Un'intensità di scattering del capside del 100% è stata determinata misurando l'area sotto la curva da 15 a 45 nm (ombreggiata in verde). (G) Analisi dello stordimento di una preparazione di vettore rAAV1/2 che mostra un titolo totale del capside di 1,19 × 1014 cp/mL (blu scuro) e un titolo completo del capside di 1,73 × 1013 vg/mL (verde scuro). Sono state misurate anche una proteina libera e aggregata di 7,16 × 1012 cp/mL equivalenti (azzurro), nonché un ssDNA libero e aggregato di 1,04 × 1012 vg/mL equivalenti (verde chiaro). Abbreviazioni: rAAV = virus adeno-associato ricombinante; RT-qPCR = reazione quantitativa a catena della polimerasi in tempo reale; SDS-PAGE = elettroforesi su gel di sodio dodecil solfato-poliacrilammide; ssDNA = DNA a filamento singolo; DLS = diffusione dinamica della luce. Fare clic qui per visualizzare una versione più grande di questa figura.
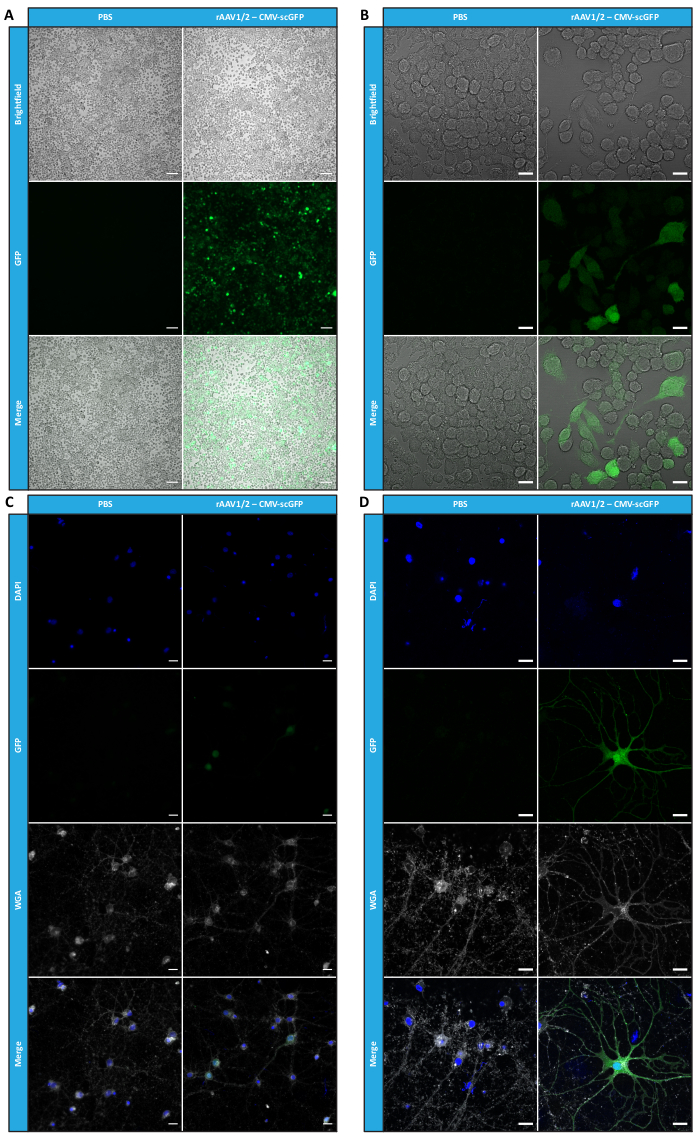
Figura 4: Valutazione dell'infettività in vitro di un campione concentrato di rAAV1/2. (A) Le cellule Neuro2A sono state infettate con rAAV1/2 - CMV-scGFP o incubate con un volume equivalente di PBS, come controllo negativo. Immagini in campo chiaro e a fluorescenza di cellule visualizzate 48 ore dopo l'infezione. Le immagini sono state acquisite in uno Zeiss Axio Observer Z1 (obiettivo 10x). Barre della scala = 100 μm. (B) Immagini dettagliate delle cellule Neuro2A 48 ore dopo l'infezione con rAAV1/2 - CMV-scGFP. Le immagini sono state acquisite in uno Zeiss LSM 710 (obiettivo 40x). Barre della scala = 20 μm. (C) Colture neuronali primarie semidense infettate con rAAV1/2 - CMV-scGFP o incubate con un volume equivalente di PBS, che fungono da controllo negativo. Le cellule sono state etichettate con una colorazione nucleare (DAPI in blu) e una colorazione di membrana (WGA in bianco). Le immagini sono state acquisite in uno Zeiss Axio Observer Z1 (obiettivo 40x). Barre della scala = 20 μm. (D) Immagini dettagliate di colture neuronali primarie semidense 48 ore dopo l'infezione con rAAV1/2 - CMV-scGFP. Le immagini sono state acquisite in uno Zeiss LSM 710 (obiettivo 40x). Barre di scala = 20 μm. Abbreviazioni: rAAV = virus adeno-associato ricombinante; CMV = citomegalovirus; scGFP = proteina fluorescente verde autocomplementare; PBS = soluzione salina tamponata con fosfato; DAPI = 4',6-diamidino-2-fenilindo; WGA = agglutinina del germe di grano. Fare clic qui per visualizzare una versione più grande di questa figura.
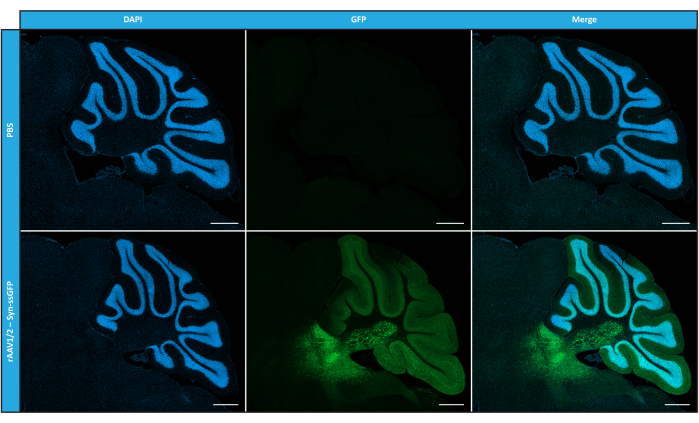
Figura 5: Efficienza di trasduzione in vivo di rAAV1/2 dopo un'iniezione intraparenchimale. Immagini rappresentative in immunofluorescenza che mostrano l'espressione diffusa di GFP (in verde) in tutto il cervelletto dopo un'iniezione centrale di rAAV1/2 - Syn-ssGFP nel cervelletto. I nuclei sono stati colorati con DAPI (in blu). Barre di scala = 500 μm. Abbreviazioni: rAAV = virus adeno-associato ricombinante; Syn = sinapsina 1; ssGFP = proteina fluorescente verde a singolo filamento; DAPI = 4',6-diamidino-2-fenilindo; PBS = soluzione salina tamponata con fosfato. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura S1 supplementare: Analisi su gel di agarosio di un plasmide vettore rAAV digerito con SmaI. Sei cloni (C1-C6) di un pITR sono stati digeriti con l'enzima di restrizione SmaI (corsie 2, 4, 6, 8, 10 e 12), che taglia due volte all'interno di ciascuna ripetizione terminale invertita. In questo caso, una digestione completa di questo pITR dovrebbe generare due bande (3.796 pb e 3.013 pb). Nelle preparazioni di successo (C1, C3, C4 e C5) è ancora visibile una banda di 6809 bp, derivante dalla digestione parziale (~5% del totale). Nelle preparazioni con ricombinazione ITR, le proporzioni sono invertite (C2) o la digestione non è avvenuta (C6). Vengono presentati anche i rispettivi cloni non digeriti (corsie 3, 5, 7, 9, 11, 13). Abbreviazioni: rAAV = virus adeno-associato ricombinante; ITR = ripetizione terminale invertita. Fare clic qui per scaricare questo file.
Figura S2 supplementare: purificazione di rAAV2/9 mediante cromatografia di affinità a base di eparina. (A) Profilo di eluizione di rAAV2/9 che mostra un singolo picco (in nero), a seguito di un aumento della concentrazione di NaCl. Le frazioni raccolte sono indicate dai numeri (2-16) in rosso nella parte inferiore del grafico, l'assorbanza a 280 nm è espressa in mAU, la conducibilità è espressa in mS/cm e l'asse x indica il volume in mL. (B) titoli rAAV quantificati mediante RT-qPCR per ciascuna frazione aggregata (F2-F16) e flowthrough. I valori sono rappresentati su una scala logaritmica. (C) Saggio di purezza mediante SDS-PAGE e colorazione blu di Coomassie. Volumi uguali (40 μL) di ciascuna frazione (F2-F16) e il rispettivo flusso sono stati caricati e risolti su una SDS-PAGE al 10%. Lo stock concentrato è stato quantificato mediante RT-qPCR e 2,3 × 1010 vg sono stati diluiti in 40 μL di PBS e raggruppati sul gel. Le bande proteiche sono state visualizzate mediante colorazione blu di Coomassie. Sono indicate le proteine del capside AAV (VP1, VP2 e VP3). La scala delle dimensioni standard delle proteine è designata con (L) e sono indicati anche i pesi molecolari corrispondenti. Abbreviazioni: rAAV = virus adeno-associato ricombinante; RT-qPCR = reazione quantitativa a catena della polimerasi in tempo reale; SDS-PAGE = elettroforesi su gel di sodio dodecil solfato-poliacrilammide. Fare clic qui per scaricare questo file.
Figura S3 supplementare: Analisi Western blot di vettori rAAV1/2 purificati mediante FPLC. (A) Le frazioni raccolte e i vettori concentrati di rAAV1/2 sono stati risolti su un gel SDS-PAGE e sondati con anticorpo monoclonale anti-AAV di topo (B1) che riconosce le proteine del capside VP1, VP2 e VP3. (B) Le frazioni raccolte e i vettori concentrati di rAAV1/2 sono stati risolti su un gel SDS-PAGE e sondati con anticorpo monoclonale di topo anti-AAV (A69) che riconosce le proteine del capside VP1 e VP2. Abbreviazioni: rAAV = virus adeno-associato ricombinante; FPLC = cromatografia liquida di proteine veloci; SDS-PAGE = elettroforesi su gel di sodio dodecil solfato-poliacrilammide; L = scala delle dimensioni standard delle proteine. Fare clic qui per scaricare questo file.
Figura S4 supplementare: Analisi Western blot di vettori rAAV2/9 purificati mediante FPLC. (A) Le frazioni raccolte e i vettori rAAV2/9 concentrati sono stati risolti su un gel SDS-PAGE e sondati con anticorpo monoclonale anti-AAV (B1) di topo che riconosce le proteine del capside VP1, VP2 e VP3. (B) Le frazioni raccolte e i vettori concentrati di rAAV2/9 sono stati risolti su un gel SDS-PAGE e sondati con anticorpo monoclonale di topo anti-AAV (A69) che riconosce le proteine del capside VP1 e VP2. Abbreviazioni: rAAV = virus adeno-associato ricombinante; FPLC = cromatografia liquida di proteine veloci; SDS-PAGE = elettroforesi su gel di sodio dodecil solfato-poliacrilammide; L = scala delle dimensioni standard delle proteine. Fare clic qui per scaricare questo file.
Figura S5 supplementare: quantificazione e caratterizzazione del vettore rAAV2/9 tramite Stunner. (A) Spettro di assorbanza (nero) di un vettore rAAV2/9 misurato mediante Stunner. Sono inoltre raffigurati il contributo di proteine (blu), ssDNA (verde), altri composti o impurità che assorbono i raggi UV (viola) e torbidità di fondo (grigio). (B) Distribuzione dell'intensità DLS di rAAV2/9 con un picco maggiore a 30 nm corrispondente a un'intensità di scattering del capside del 78%, determinata misurando l'area sotto la curva da 15 a 45 nm (ombreggiata in verde). È stata misurata anche un'intensità totale dell'aggregato del 22% (ombreggiata in grigio) con un contributo principale di aggregati di grandi dimensioni (19,9%) con un diametro medio di 620 nm. (C) Analisi dello stordimento di una preparazione di vettore rAAV2/9 che mostra un titolo totale del capside di 2,18 × 1014 cp/mL (blu scuro) e un titolo completo del capside di 2,35 × 1013 vg/mL (verde scuro). In questa preparazione sono stati misurati anche una proteina libera e aggregata di 2,92 × 1013 cp/mL equivalenti (azzurro), nonché un ssDNA libero e aggregato di 3,14 × 1012 vg/mL equivalenti (verde chiaro). Abbreviazioni: rAAV = virus adeno-associato ricombinante; ssDNA = DNA a filamento singolo; DLS = diffusione dinamica della luce. Fare clic qui per scaricare questo file.
Figura supplementare S6: Efficienza di trasduzione in vitro e vitalità delle frazioni purificate di rAAV1/2. HEK293T cellule che esprimono GFP (fluorescenza diretta) 48 ore dopo la trasduzione con 50 μL di frazioni FPLC di un vettore rAAV1/2 che codifica per ssGFP (rAAV1/2 - CMV-ssGFP). Barre di scala = 100 μm. Abbreviazioni: rAAV = virus adeno-associato ricombinante; FPLC = cromatografia liquida di proteine veloci; ssGFP = proteina fluorescente verde a filamento singolo. Fare clic qui per scaricare questo file.
Figura supplementare S7: Efficienza di trasduzione in vitro e vitalità delle frazioni purificate di rAAV2/9. HEK293T cellule sono state infettate con 50 μL di ciascuna frazione FPLC (F2-F16) o flowthrough di un vettore rAAV2/9 che codifica scGFP sotto il controllo del promotore del CMV. Le cellule che esprimono GFP sono state visualizzate 48 ore dopo l'infezione. Barre di scala = 100 μm. Abbreviazioni: rAAV = virus adeno-associato ricombinante; FPLC = cromatografia liquida di proteine veloci; scGFP = proteina fluorescente verde autocomplementare; CMV = citomegalovirus. Fare clic qui per scaricare questo file.
Discussione
Il toolkit di vettori AAV in rapida espansione è diventato uno dei sistemi di consegna genica più promettenti per un'ampia gamma di tipi di cellule attraverso diverse vie di somministrazione. In questo lavoro, abbiamo mirato a sviluppare un protocollo migliorato per la produzione, la purificazione e la caratterizzazione di vettori rAAV a mosaico che potessero dimostrare il loro valore negli studi preclinici. A tale scopo, la generazione di vettori mosaico rAAV1/2 e rAAV2/9 è descritta qui, ma la procedura può essere applicata anche per purificare i vettori rAAV2 standard (dati non mostrati).
I rAAV a mosaico sono stati prodotti seguendo un metodo di trasfezione ottimizzato utilizzando PEI come reagente di trasfezione. È stato scelto un metodo di trasfezione transitoria per la sua maggiore flessibilità e velocità, notevoli vantaggi negli studi preclinici in fase iniziale. Una volta che un particolare transgene e sierotipo sono stati convalidati, il sistema di produzione può essere messo a punto per ottenere una migliore scalabilità ed economicità stabilendo una linea cellulare trasfettata stabile che esprime un sottoinsieme dei geni specifici Rep/Cap , con geni aggiuntivi forniti da un processo di infezione24. Rispetto alla trasfezione calcio-fosfato, il PEI presenta diversi vantaggi. È un reagente di trasfezione stabile ed economico che funziona efficacemente all'interno di un intervallo di pH più ampio. Inoltre, elimina la necessità di cambiare il mezzo cellulare dopo la trasfezione, con conseguente riduzione significativa sia dei costi che del carico di lavoro69.
Nel tentativo di aggirare alcune delle limitazioni imposte dai gradienti di CsCl o iodixanolo, gli rAAV prodotti sono stati raccolti e purificati mediante cromatografia di affinità. Questa strategia offre un approccio semplificato e scalabile che può essere eseguito senza la necessità di ultracentrifugazione e gradienti, producendo titoli virali puliti e elevati. In effetti, le tecniche cromatografiche che utilizzano un sistema FPLC possono essere automatizzate e scalate impacchettando più volume di resina in una colonna con un'altezza del letto maggiore. Il protocollo qui descritto può essere facilmente adattato per incorporare colonne HiTrap Heparin HP da 5 ml (dati non mostrati). Inoltre, le colonne di eparina possono essere riutilizzate più volte, contribuendo così all'economicità di questo metodo.
Gli rAAV purificati sono stati quindi caratterizzati in termini di titolo, purezza, caratteristiche morfologiche e attività biologica. È interessante notare che, nella colorazione blu di Coomassie, è stata rilevata una banda con circa 17 kDa nelle frazioni F8-F16 oltre alle tre tipiche proteine del capside virale. Tuttavia, questa banda non è più presente dopo la fase di concentrazione dei rAAV. Inoltre, alcune bande deboli con pesi molecolari inferiori a VP3 (<62 kDa) possono essere rilevate anche dopo la marcatura di B1 e A69, suggerendo che potrebbero essere frammenti delle proteine del capside VP1, VP2 e VP370. Un'altra possibilità è che si tratti in realtà di altre proteine co-purificanti come la ferritina o altre proteine cellulari con polipeptidi che condividono impronte proteiche simili alle proteine del capside AAV e potrebbero essere coinvolte nella biologia dell'AAV, come precedentemente suggerito 26,71,72.
L'analisi TEM e dello storditore ha anche rivelato la presenza di particelle vuote a livelli variabili tra le diverse produzioni. Allo stesso modo, altri studi hanno precedentemente riportato la generazione di livelli variabili e alti (>65%) di capsidi vuoti per rAAV preparati con metodi di trasfezione o infezione24,73. Il meccanismo alla base della generazione di rAAV inizia con la rapida formazione di capsidi vuoti da proteine VP di nuova sintesi, seguita da una lenta fase di limitazione della velocità di impacchettamento del genoma nei capsidi preformati mediata dalle proteine Rep74,75. Pertanto, i capsidi vuoti vengono generati nelle produzioni di rAAV, sebbene la proporzione di capsidi vuoti e pieni possa variare a seconda delle dimensioni e della sequenza del transgene di interesse e delle condizioni di coltura cellulare58,73. I capsidi vuoti sollevano alcune preoccupazioni poiché, mancando del genoma di interesse, non sono in grado di fornire un effetto terapeutico e possono anche potenzialmente aumentare una risposta immunitaria innata o adattativa. Tuttavia, alcuni rapporti hanno anche dimostrato che, regolando il loro rapporto, i capsidi AAV vuoti possono fungere da esche altamente efficaci per gli anticorpi neutralizzanti specifici per AAV e, quindi, aumentare l'efficienza di trasduzione 60,76,77. Se la presenza di capsidi vuoti è criticamente dannosa e dato il carattere leggermente meno anionico delle particelle vuote rispetto ai vettori pieni, una potenziale soluzione potrebbe comportare l'esecuzione di una seconda fase di purificazione di lucidatura utilizzando tecniche di cromatografia a scambio anionico64.
Questo studio fornisce anche prove convincenti che gli rAAV a mosaico generati sono in grado di trasdurre in modo efficiente non solo le colture neuronali in vitro, ma anche il sistema nervoso centrale dopo l'iniezione intracranica di rAAV1/2. Nel complesso, questi risultati suggeriscono che il protocollo di produzione e purificazione descritto rende rAAV altamente puri e biologicamente attivi pronti all'uso in 6 giorni, presentandosi come un metodo versatile ed economico per la generazione di rAAV negli studi preclinici.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Siamo grati per la collaborazione, le intuizioni e l'assistenza tecnica fornite dalla dott.ssa Mónica Zuzarte, presso l'Istituto di ricerca clinica e biomedica di Coimbra (iCBR) e il Centro di biomedicina e biotecnologia innovativa (CIBB), per quanto riguarda l'analisi TEM dei rAAV. Estendiamo il nostro apprezzamento alla dott.ssa Dominique Fernandes, del Centro di Neuroscienze e Biologia Cellulare dell'Università di Coimbra (CNC-UC) e dell'Istituto di Ricerca Interdisciplinare dell'Università di Coimbra (IIIUC), per la sua preziosa assistenza tecnica e le sue intuizioni riguardanti gli esperimenti di coltura neuronale primaria. I plasmidi pRV1, pH21 e pFdelta6, essenziali per questo studio, sono stati generosamente forniti dalla dott.ssa Christina McClure, presso la School of Medical Sciences, College of Life Sciences and Medicine, Università di Aberdeen, per la quale siamo grati. Questo lavoro è stato finanziato dal Fondo Europeo di Sviluppo Regionale (FESR), attraverso il Programma Operativo Regionale Centro 2020; attraverso il programma operativo per la competitività e l'internazionalizzazione COMPETE 2020 e i fondi nazionali portoghesi tramite FCT - Fundação para a Ciência e a Tecnologia, nell'ambito dei progetti: UIDB/04539/2020, UIDP/04539/2020, LA/P/0058/2020, ViraVector (CENTRO-01-0145-FEDER-022095), Imagene (PTDC/BBB-NAN/0932/2014 | POCI-01-0145-FEDER-016807), ReSet - IDT-COP (CENTRO-01-0247-FEDER-070162), Fighting Sars-CoV-2 (CENTRO-01-01D2-FEDER-000002), BDforMJD (CENTRO-01-0145-FEDER-181240), ModelPolyQ2.0 (CENTRO-01-0145-FEDER-181258), MJDEDIT (CENTRO-01-0145-FEDER-181266); dal Fondo americano portoghese per la ricerca biomedica (APBRF) e dal Fondo per la ricerca sulla malattia Richard Chin e Lily Lock Machado-Joseph, ARDAT nell'ambito della convenzione di sovvenzione IMI2 JU n. 945473 sostenuta dall'UE e dall'EFPIA; Il progetto GeneT- Teaming 101059981 supportato dal programma Horizon Europe dell'Unione Europea. M.M.L. è stato sostenuto da 2021.05776.BD; C.H. era sostenuto da 2021.06939.BD; A.C.S. era sostenuta da 2020.07721.BD; e D.D.L. è stato supportato da 2020.09668.BD. La Figura 1 è stata creata utilizzando BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 10% povidone-iodine | Medline | MDS093943 | |
| 12-well plates | Thermo Scientific | 11889684 | |
| 24-well plates | VWR | 734-2325 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen | D1306 | |
| 96-well Stunner plate | Unchained Labs | 701-2025 | 96-well quantification plate for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| AAVpro Titration Kit (for Real-Time PCR) Ver.2 | Takara | 6233 | For determining the titer of AAV using RT-qPCR. This kit contains DNase I, Lysis Buffer, Dilution Buffer, positive control, Taq II mix, primer forward, primer reverse, water |
| Acetic acid glacial | Fisher Chemical | A/0360/PB17 | |
| ÄKTA pure 25 | Cytiva | 29018224 | FPLC system controlled by UNICORN software, version 6.3 |
| Alkaline phosphatase-linked goat anti-mouse | Invitrogen | 31328 | |
| Amicon ultra-0.5 centrifugal filter unit | Merck Millipore | UFC5100 | |
| Amicon ultra-15 centrifugal filter unit | Merck Millipore | UFC9100 | |
| Benzonase Nuclease | Merck Millipore | E1014 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| CFX96 Real-Time PCR detection system | Biorad | 184-5096 | |
| ChemiDoc Touch Imaging System | Bio-Rad Laboratories | 1708370 | |
| Chicken polyclonal anti-GFP primary antibody | Abcam | ab13970 | |
| Coomassie Blue G250 | Fisher Chemical | C/P541/46 | |
| Dithiothreitol (DTT) | Fisher Bioreagents | BP17225 | |
| DMEM | Sigma-Aldrich | D5796 | |
| ECF Substrate for Western Blotting | Cytiva | RPN5785 | |
| FastDigest SmaI | Thermo Scientific | FD0663 | |
| FEI-Tecnai G2 Spirit Biotwin | FEI | Biotwin | Transmission electron microscope |
| Fetal bovine serum | Biowest | S1810 | |
| Fluorescence mounting medium | Dako | S3023 | |
| Formvar-carbon coated 200 mesh grid | TAAB Laboratories Equipment | F077/025 | |
| Gas evacuation apparatus | RWD | R546W | |
| Glycerol | Fisher BioReagents | 10021083 | |
| Goat polyclonal anti-chicken antibody, Alexa Fluor 488 | Invitrogen | A-11039 | |
| Hamilton needle 30G, Small Hub RN Needle, 25 mm, PST3 | Hamilton | 7803-07 | |
| Hamilton syringe (10 µL) | Hamilton | 7653-01 | |
| HEK293T | American Type Culture Collection | CRL-11268 | |
| HiTrap Heparin HP 1 x 5 mL | Cytiva | 17040701 | Pre-packed heparin column |
| HiTrap Heparin HP 5 x 1 mL | Cytiva | 17040601 | Pre-packed heparin column |
| Immobilon-P PVDF Membrane | Merck Millipore | IPVH00010 | |
| Isoflurane | Braun | 469860 | |
| Ketamine | Dechra Pharmaceuticals | N/A | Nimatek |
| Low-retention microcentrifuge tubes (2 mL) | Fisher Scientific | 11906965 | |
| Lunatic & Stunner Client software | Unchained Labs | N/A | Client analysis software version 8.0.1.235. Software for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Methanol | Fisher Chemical | M/4000/FP21 | |
| Mouse monoclonal anti-AAV, VP1, VP2 antibody (A69) | American Research Products | 03-61057 | |
| Mouse monoclonal anti-AAV, VP1, VP2, VP3 antibody (B1) | American Research Products | 03-61058 | |
| Neuro2a | American Type Culture Collection | CCL-131 | |
| Normal goat serum | Gibco | 16210064 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 12738422 | |
| NZYColour Protein Marker II | NZYtech | MB09002 | |
| pAAV-CMV-scGFP | Addgene | 32396 | Addgene plasmid # 32396; http://n2t.net/addgene:32396; RRID:Addgene_32396 |
| pAAV-CMV-ssGFP | Addgene | 105530 | Addgene plasmid # 105530; http://n2t.net/addgene:105530; RRID:Addgene_105530 |
| pAAV2/9n | Addgene | 112865 | Addgene plasmid # 112865; http://n2t.net/addgene:112865; RRID:Addgene_112865 |
| Paraformaldehyde | Acros Organics | 10342243 | |
| PBS | Fisher BioReagents | BP2438 | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Pluronic F-68 Non-ionic Surfactant (100x) | Gibco | 24040032 | |
| Polyethylenimine MAX, MW 40,000 | Polysciences Europe | 24765 | |
| R500 Series Compact Small Animal Anesthesia Machine - Isoflurane | RWD | N/A | |
| Sample Inlet Valve V9-IS | Cytiva | 29027746 | |
| Sample pump P9-S | Cytiva | 29027745 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium chloride | Fisher Scientific | 10428420 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dodecyl sulfate (SDS) | Fisher Bioreagents | BP166 | |
| Sterile PVDF syringe filter | Fisher Scientific | 15191499 | |
| Stunner Platform | Unchained Labs | 700-2002 | Equipment for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Superloop 150 mL | Cytiva | 18-1023-85 | |
| Superloop 50 mL | Cytiva | 18-1113-82 | |
| SURE 2 supercompetent cells | Stratagene, Agilent Technologies | HPA200152 | |
| Treated culture dishes | Corning | 734-1711 | |
| Tris base | Fisher BioReagents | BP152 | |
| Tris hydrochloride | Fisher BioReagents | BP153 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin-EDTA | Gibco | 25200-072 | |
| Wheat Germ Agglutinin (WGA) conjugated with Alexa Fluor 633 | Invitrogen | W21404 | |
| Xylazine | Dechra Pharmaceuticals | N/A | Sedaxylan |
| Zeiss Axio Observer Z1 | Carl Zeiss Microscopy GmbH | N/A | Inverted fluorescence microscope equiped with an EC Plan-Neofluar 10x/0.30 objective and a Plan-Apochromat 40x/0.95 objective |
| Zeiss Axio Scan.Z1 | Carl Zeiss Microscopy GmbH | N/A | Slide scanner fluorescence microscope equipped with a Plan-Apochromat 20x/0.8 objective |
| Zeiss LSM 710 | Carl Zeiss Microscopy GmbH | N/A | Inverted confocal microscope equipped with a Plan-Apochromat 40x/1.4 Oil DIC objective |
| µ-Slide 8 well Ibidi | Ibidi | 80826 | 8-well chamber slide |
Riferimenti
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Front Mol Neurosci. 7, 1-9 (2014).
- Muzyczka, N. Use of Adeno-Associated Virus as a General Transduction Vector for Mammalian Cells. Viral Expression Vectors. 158, 97-129 (1992).
- Goncalves, M. A. F. V Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43(2005).
- Flotte, T. R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 11 (10), 805-810 (2004).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Ojala, D. S., Amara, D. P., Schaffer, D. V Adeno-Associated Virus Vectors and Neurological Gene Therapy. Neuroscientist. 21 (1), 84-98 (2014).
- Saraiva, J., Nobre, R. J., Pereira de Almeida, L. Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. Journal of Controlled Release. 241, 94-109 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods Mol Biol. 807, 47-92 (2011).
- Sonntag, F., Schmidt, K., Kleinschmidt, J. A. A viral assembly factor promotes AAV2 capsid formation in the nucleolus. Proc Natl Acad Sci U S A. 107 (22), 10220-10225 (2010).
- Sonntag, F., et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes. J Virol. 85 (23), 12686-12697 (2011).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol. 78 (12), 6381-6388 (2004).
- Gao, G., Vandenberghe, L. H., Wilson, J. M. New recombinant serotypes of AAV vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The role of the adeno-associated virus capsid in gene transfer. Methods Mol Biol. 437, 51-91 (2008).
- Clark, K. R., Voulgaropoulou, F., Fraley, D. M., Johnson, P. R. Cell lines for the production of recombinant adeno-associated virus. Hum Gene Ther. 6 (10), 1329-1341 (1995).
- Inoue, N., Russell, D. W. Packaging cells based on inducible gene amplification for the production of adeno-associated virus vectors. J Virol. 72 (9), 7024-7031 (1998).
- Liu, X., Voulgaropoulou, F., Chen, R., Johnson, P. R., Clark, K. R. Selective Rep-Cap gene amplification as a mechanism for high-titer recombinant AAV production from stable cell lines. Mol Ther. 2 (4), 394-403 (2000).
- Mathews, L. C., Gray, J. T., Gallagher, M. R., Snyder, R. O. [23] Recombinant adeno-associated viral vector production using stable packaging and producer cell lines. Methods Enzymol. 346, 393-413 (2002).
- Gao, G., et al. Purification of recombinant adeno-associated virus vectors by column chromatography and its performance in vivo. Hum Gene Ther. 11 (15), 2079-2091 (2000).
- Xiao, X., Li, J., Samulski, R. J. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus. J Virol. 72 (3), 2224-2232 (1998).
- Aponte-Ubillus, J. J., et al. Molecular design for recombinant adeno-associated virus (rAAV) vector production. Appl Microbiol Biotechnol. 102 (3), 1045-1054 (2018).
- Smith, R. H., Levy, J. R., Kotin, R. M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells. Mol Ther. 17 (11), 1888-1896 (2009).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Wright, J. F. Transient transfection methods for clinical adeno-associated viral vector production. Hum Gene Ther. 20 (7), 698-706 (2009).
- Yuan, Z., Qiao, C., Hu, P., Li, J., Xiao, X. A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes. Hum Gene Ther. 22 (5), 613-624 (2011).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Hum Gene Ther Methods. 26 (4), 147-157 (2015).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Anderson, R., Macdonald, I., Corbett, T., Whiteway, A., Prentice, H. G. A method for the preparation of highly purified adeno-associated virus using affinity column chromatography, protease digestion and solvent extraction. J Virol Methods. 85 (1-2), 23-34 (2000).
- Okada, T., et al. Scalable purification of adeno-associated virus serotype 1 (AAV1) and AAV8 vectors, using dual ion-exchange adsorptive membranes. Hum Gene Ther. 20 (9), 1013-1021 (2009).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. J Virol Methods. 183 (2), 139-146 (2012).
- Lock, M., et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale. Hum Gene Ther. 21 (10), 1259-1271 (2010).
- Wang, L., Blouin, V., Brument, N., Bello-Roufai, M., Francois, A. Production and Purification of Recombinant Adeno-Associated Vectors. Adeno-Associated Virus: Methods and Protocols. 807, 361-404 (2011).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated Virus Serotypes: Vector Toolkit for Human Gene Therapy. Molecular Therapy. 14 (3), 316-327 (2006).
- Mietzsch, M., Broecker, F., Reinhardt, A., Seeberger, P. H., Heilbronn, R. Differential adeno-associated virus serotype-specific interaction patterns with synthetic heparins and other glycans. J Virol. 88 (5), 2991-3003 (2014).
- McClure, C., Cole, K. L. H., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. JoVE. (57), e3348(2011).
- Auricchio, A., O’Connor, E., Hildinger, M., Wilson, J. M. A single-step affinity column for purification of serotype-5 based adeno-associated viral vectors. Mol Ther. 4 (4), 372-374 (2001).
- Wang, Q., et al. Identification of an adeno-associated virus binding epitope for AVB sepharose affinity resin. Mol Ther Methods Clin Dev. 2, 15040(2015).
- Mietzsch, M., et al. OneBac: platform for scalable and high-titer production of adeno-associated virus serotype 1–12 vectors for gene therapy. Hum Gene Ther. 25 (3), 212-222 (2014).
- Mietzsch, M., et al. Characterization of AAV-specific affinity ligands: consequences for vector purification and development strategies. Mol Ther Methods Clin Dev. 19, 362-373 (2020).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2023).
- Koerber, J. T., Jang, J. -H., Yu, J. H., Kane, R. S., Schaffer, D. V. Engineering adeno-associated virus for one-Step purification via immobilized metal affinity chromatography. Hum Gene Ther. 18 (4), 367-378 (2007).
- Zhang, H. -G., et al. Addition of six-His-tagged peptide to the C terminus of adeno-associated virus VP3 does not affect viral tropism or production. J Virol. 76 (23), 12023-12031 (2002).
- Arnold, G. S., Sasser, A. K., Stachler, M. D., Bartlett, J. S. Metabolic biotinylation provides a unique platform for the purification and targeting of multiple AAV vector serotypes. Mol Ther. 14 (1), 97-106 (2006).
- Rabinowitz, J. E., et al. Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol. 78 (9), 4421-4432 (2004).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Mol Ther. 7 (3), 419-425 (2003).
- Choi, V., McCarty, D., Samulski, R. AAV hybrid serotypes: improved vectors for gene delivery. Curr Gene Ther. 5 (3), 299-310 (2005).
- Nonnenmacher, M., van Bakel, H., Hajjar, R. J., Weber, T. High capsid–genome correlation facilitates creation of AAV libraries for directed evolution. Mol Ther. 23 (4), 675-682 (2015).
- Kimura, K., et al. A mosaic adeno-associated virus vector as a versatile tool that exhibits high levels of transgene expression and neuron specificity in primate brain. Nat Commun. 14 (1), 4762(2023).
- Issa, S. S., Shaimardanova, A. A., Solovyeva, V. V., Rizvanov, A. A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 12 (5), 785(2023).
- Foust, K. D., et al. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27 (1), 59-65 (2009).
- Lopes, M. M., et al. A new protocol for whole-brain biodistribution analysis of AAVs by tissue clearing, light-sheet microscopy and semi-automated spatial quantification. Gene Ther. 29 (12), 665-679 (2022).
- Gray, J. T., Zolotukhin, S. Design and construction of functional AAV vectors. Methods Mol Biol. 807, 25-46 (2011).
- Choi, V. W., Asokan, A., Haberman, R. A., Samulski, R. J. Production of recombinant adeno-associated viral vectors. Curr Protoc Hum Genet. , Chapter 12, Unit 12.9-12.9.21 (2007).
- Bennicelli, J., et al. Reversal of blindness in animal models of leber congenital amaurosis using optimized AAV2-mediated gene transfer. Mol Ther. 16 (3), 458-465 (2008).
- Fischer, M. D., Hickey, D. G., Singh, M. S., MacLaren, R. E. Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods. 27 (4), 150-158 (2016).
- Santos, S. D., et al. Contactin-associated protein 1 (Caspr1) regulates the traffic and synaptic content of α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-type glutamate receptors. J Biol Chem. 287 (9), 6868-6877 (2012).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 7 (1), 122-128 (2003).
- Dong, B., Nakai, H., Xiao, W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther. 18 (1), 87-92 (2010).
- Wright, J. F. AAV empty capsids: For better or for worse. Mol Ther. 22 (1), 1-2 (2014).
- Asaad, W., et al. AAV genome modification for efficient AAV production. Heliyon. 9 (4), e15071(2023).
- Wobus, C. E., et al. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J Virol. 74 (19), 9281-9293 (2000).
- Wistuba, A., Kern, A., Weger, S., Grimm, D., Kleinschmidt, J. A. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol. 71 (2), 1341-1352 (1997).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J Virol Methods. 140 (1-2), 183-192 (2007).
- Brument, N., et al. A versatile and scalable two-step ion-exchange chromatography process for the purification of recombinant adeno-associated virus serotypes-2 and -5. Mol Ther. 6 (5), 678-686 (2002).
- Potter, M., et al. A simplified purification protocol for recombinant adeno-associated virus vectors. Mol Ther Methods Clin Dev. 1, 14034(2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570(2019).
- Yang, Q. -E., et al. Rapid quality control assessment of adeno-associated virus vectors via Stunner. GEN Biotechnology. 1 (3), 300-310 (2022).
- Huang, X., et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 193 (2), 270-277 (2013).
- Salganik, M., et al. Evidence for pH-dependent protease activity in the adeno-associated virus capsid. J Virol. 86 (21), 11877-11885 (2012).
- Dong, B., et al. Proteomics analysis of co-purifying cellular proteins associated with rAAV vectors. PLoS One. 9 (2), e86453(2014).
- Grieger, J. C., Soltys, S. M., Samulski, R. J. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 24 (2), 287-297 (2016).
- Wright, J. Product-related impurities in clinical-grade recombinant AAV vectors: characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Bennett, A., Mietzsch, M., Agbandje-McKenna, M. Understanding capsid assembly and genome packaging for adeno-associated viruses. Future Virol. 12 (6), 283-297 (2017).
- Myers, M. W., Carter, B. J. Assembly of adeno-associated virus. Virology. 102 (1), 71-82 (1980).
- Mingozzi, F., et al. Overcoming preexisting humoral immunity to AAV using capsid decoys. Sci Transl Med. 5 (194), (2013).
- Hoffman, B. E., Herzog, R. W. Covert warfare against the immune system: decoy capsids, stealth genomes, and suppressors. Mol Ther. 21 (9), 1648-1650 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon