Method Article
Выделение аденоассоциированных вирусных векторов с помощью одноэтапного и полуавтоматического протокола гепариновой аффинной хроматографии
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной рукописи описан подробный протокол генерации и очистки аденоассоциированных вирусных векторов с использованием оптимизированного метода аффинной хроматографии на основе гепарина. Он представляет собой простой, масштабируемый и экономичный подход, устраняющий необходимость в ультрацентрифугировании. Полученные векторы проявляют высокую чистоту и биологическую активность, доказывая свою ценность в доклинических исследованиях.
Аннотация
Аденоассоциированный вирус (AAV) становится все более ценным вектором для доставки генов in vivo и в настоящее время проходит клинические испытания на людях. Однако обычно используемые методы очистки AAV используют ультрацентрифугирование с градиентом плотности хлорида цезия или йодиксанола. Несмотря на свои преимущества, эти методы требуют много времени, имеют ограниченную масштабируемость и часто приводят к созданию векторов с низкой чистотой. Чтобы преодолеть эти ограничения, исследователи обращают свое внимание на методы хроматографии. Здесь мы представляем оптимизированный протокол аффинной хроматографии на основе гепарина, который служит универсальным этапом захвата для очистки AAV.
Этот метод основан на внутреннем сродстве AAV серотипа 2 (AAV2) к гепарансульфатным протеогликанам. В частности, протокол влечет за собой котрансфекцию плазмид, кодирующих желаемые капсидные белки AAV, с плазмидами AAV2, в результате чего получаются мозаичные AAV-векторы, которые сочетают в себе свойства обоих родительских серотипов. Вкратце, после лизиса клеток-продуцентов смесь, содержащую частицы AAV, непосредственно очищают в соответствии с оптимизированным одноэтапным протоколом гепариновой аффинной хроматографии с использованием стандартной системы быстрой белковой жидкостной хроматографии (FPLC). Очищенные частицы AAV впоследствии концентрируются и подвергаются всесторонней характеристике с точки зрения чистоты и биологической активности. Этот протокол предлагает упрощенный и масштабируемый подход, который может быть выполнен без необходимости ультрацентрифугирования и градиентов, что дает чистые и высокие титры вируса.
Введение
Вектор аденоассоциированного вируса (AAV) завоевывает свой путь в качестве одной из самых перспективных систем доставки в текущих исследованиях генной терапии. Первоначально идентифицированный в 1965году1, AAV представляет собой небольшой вирус без оболочки с икосаэдрическим белковым капсидом около 25 нм в диаметре, содержащим одноцепочечный геном ДНК. AAV принадлежат к семейству Parvoviridae и роду Dependoparvovirus из-за их уникальной зависимости от коинфекции с вирусом-помощником, таким как вирус простого герпеса или, чаще, аденовирус, для завершения своего литического цикла 2,3.
Геном AAV размером 4,7 килооснования состоит из двух открытых рамок считывания (ORF), фланкированных двумя инвертированными концевыми повторами (ITR), которые образуют характерные Т-образные концы шпилек4. ITR являются единственными цис-действующими элементами, критически важными для упаковки, репликации и интеграции AAV, поэтому являются единственными последовательностями AAV, сохраняющимися в рекомбинантных векторах AAV (rAAV). В этой системе гены, необходимые для производства векторов, поставляются отдельно, in trans, что позволяет упаковывать интересующий ген внутри вирусного капсида 5,6.
Каждый вирусный ген кодифицирует различные белки посредством альтернативного сплайсинга и стартовых кодонов. В ORF Rep кодируются четыре неструктурных белка (Rep40, Rep52, Rep68 и Rep78), играющие решающую роль в репликации, сайт-специфической интеграции и инкапсуляции вирусной ДНК 7,8. Cap ORF служит матрицей для экспрессии трех структурных белков, отличающихся друг от друга на их N-конце (VP1, VP2 и VP3), которые собираются в 60-мерный вирусный капсид в соотношении 1:1:10 4,9. Кроме того, альтернативный ORF, вложенный в ген Cap с нетрадиционным стартовым кодоном CUG, кодирует белок, активирующий сборку (AAP). Было показано, что этот ядерный белок взаимодействует с вновь синтезированными капсидными белками VP1-3 и способствует сборке капсида10,11.
Различия в аминокислотной последовательности капсида объясняют 11 встречающихся в природе серотипов AAV и более 100 вариантов, выделенных из тканей человека и приматов 7,12,13. Вариации в конформации структурно изменчивых областей определяют различные антигенные свойства и рецептор-связывающую специфичность капсидов из разных штаммов. Это приводит к различным тканевым тропизмам и эффективности трансдукции между различными органами млекопитающих14.
Ранние методы производства rAAV полагались на аденовирусную инфекцию в качестве вспомогательного средства 15,16,17,18,19. Несмотря на то, что эта инфекция эффективна и обычно проста в производстве в больших масштабах, возникает несколько проблем. Даже после очистки и этапа термоденатурации для инактивации аденовирусные частицы могут по-прежнему присутствовать в препаратах AAV, что представляет собой нежелательную проблему безопасности20. Более того, наличие денатурированных аденовирусных белков недопустимо для клинического применения. В других стратегиях производства используются рекомбинантные штаммы вируса простого герпеса, сконструированные для введения Rep/Cap и трансгена в клетки-мишени21 или в клеточную систему22 бакуловирус-насекомое. Хотя эти системы предлагают преимущества с точки зрения масштабируемости и совместимости с GMP, они все еще сталкиваются с аналогичными проблемами.
Метод тройной трансфекции для производства rAAV обычно используется для легкого преодоления этих проблем. Вкратце, сборка rAAV основана на транзиторной трансфекции клеток тремя плазмидами, кодирующими для: 1) кассеты экспрессии трансгенов, упакованной между ITR из генома AAV2 дикого типа (pITR); 2) последовательности Rep/Cap, необходимые для репликации и сборки вирионов (pAAV-RC); и 3) минимальное количество аденовирусных белков (E1A, E1B, E4 и E2A) вместе с аденовирус-ассоциированными РНК, необходимыми для хелпер-эффекта (pHelper)6,20,23. В то время как методы трансфекции плазмид обеспечивают простоту и гибкость производства rAAV в доклинических исследованиях, эти процедуры имеют ограничения с точки зрения масштабируемости и воспроизводимости при применении к крупномасштабному производству. В качестве альтернативного подхода продукция rAAV может быть достигнута за счет использования клеточных линий-продуцентов AAV (как адгезивного, так и суспензионного роста), стабильно экспрессирующих либо гены AAV Rep/Cap, либо Rep/Cap в сочетании с векторными конструкциями. В этих системах аденовирусные гены-хелперы вводятся путем трансфекции плазмид. Несмотря на то, что эта стратегия улучшает масштабируемость процесса культивирования клеток, она технически сложна и трудоемка 21,24,25.
В любом случае клетки-продуценты затем лизируют и подвергают одной или нескольким стадиям очистки. В настоящее время основные методы очистки rAAV включают использование центрифугирования со сверхскоростным градиентом плотности хлорида цезия (CsCl) или йодиксанола с последующими методами хроматографии26. Первоначальная схема очистки для вирусного осаждения использовала сульфат аммония с последующим двумя или тремя раундами ультрацентрифугирования через градиент CsCl. К основным преимуществам этого процесса можно отнести возможность очистки всех серотипов и возможность физически отделять полные частицы от пустых капсидов на основе их различной плотности. Однако этот метод сложен, занимает много времени и имеет ограниченную масштабируемость, что часто приводит к низкому выходу и низкому качеству образцов 27,28,29,30. Более того, диализ против физиологического буфера часто необходим до исследований in vivo из-за токсического воздействия, которое CsCl может оказывать на млекопитающих.
Йодиксанол также используется в качестве альтернативной изоосмотической градиентной среды для очистки векторов rAAV, имея преимущества перед CsCl как с точки зрения безопасности, так и с точки зрения векторной активности. Однако, как и CsCl, метод йодиксанола имеет некоторые недостатки, связанные с загрузочной способностью лизата клеточной культуры (и, следовательно, масштабируемостью очистки rAAV), и он остается трудоемким и дорогостоящим методом30,31.
Чтобы преодолеть эти ограничения, исследователи обратили свое внимание на методы хроматографии. В связи с этим было разработано несколько подходов к очистке, которые включают в себя либо аффинные, гидрофобные, либо ионообменные методы хроматографии. Эти методы основаны на биохимических свойствах конкретного серотипа, включая их естественные рецепторы, или на зарядовых характеристиках вирусной частицы32. Например, открытие того, что AAV2, AAV3, AAV6 и AAV13 предпочтительно связываются с гепарансульфатными протеогликанами (HSPG), открыло возможность использования близкородственного гепарина в аффинной хроматографической очистке. Однако сайты связывания с HSPG могут различаться в зависимости от серотипов, опосредуя прикрепление AAV и инфекцию клеток-мишеней различными способами 2,33,34,35,36. С другой стороны, AAV1, AAV5 и AAV6 связываются с N-связанной сиаловой кислотой (SA), в то время как AAV4 использует O-связанную SA 2,14,34. Следуя тому же обоснованию, был также разработан одноступенчатый протокол аффинной хроматографии для очистки rAAV5, основанный на использовании муцина, белка млекопитающих, высокообогащенного SA37. Как и методы на основе гепарина, это очищение также зависит от конкретного генерируемого серотипа. Помимо гепарина и муцина, для аффинной хроматографии были исследованы и другие лиганды, такие как моноклональное антитело A20 и однодоменные антитела верблюдов (AVB Sepharose и POROS CaptureSelect)22,23,38,39,40,41. Другие инновационные стратегии для улучшения ранее существовавших методов очистки включают введение небольших модификаций в капсид rAAV для представления специфических связывающих эпитопов. Например, меченные гекса-гистидином или биотинилированные rAAV могут быть очищены с помощью лигандов, нацеленных на эти эпитопы (никель-нитрилотриуксусная кислота и авидиновые смолы, соответственно)42,43,44.
В попытке расширить желаемые характеристики rAAV, исследователи пересекли вирионы, смешав их капсиды. Это достигается путем поставки гена капсида из двух различных серотипов AAV в эквимолярных или различных соотношениях во время производства, что приводит к образованию структуры капсида, состоящей из смеси субъединиц капсида из разных серотипов 34,45,46,47,48,49,50 . Предыдущие исследования предоставляют физические доказательства того, что коэкспрессия капсидных белков из AAV2 с AAV1 (соотношение 1:1) и AAV2 с AAV9 (соотношение 1:1) приводит к генерации мозаичных векторов rAAV1/2 и rAAV2/9 соответственно 45,46,48. Основным преимуществом создания мозаичных rAAV является способность интегрировать выгодные черты из различных серотипов AAV, что приводит к синергетическому улучшению экспрессии трансгенов и тропизма, сохраняя при этом другие свойства, полезные при производстве rAAV. Интересно, что некоторые мозаичные варианты даже демонстрируют новые свойства, отличные от любого родительского вируса 46,47,49. Используя гепарин-связывающую способность AAV2, мозаичные векторы rAAV потенциально могут быть сгенерированы и очищены путем смешивания AAV2 с другими естественными или новыми капсидами AAV, полученными в результате направленной эволюции и/или рационального дизайна. Тем не менее, предыдущие исследования подчеркнули важность совместимости субъединиц капсида при попытке собрать мозаичные векторы. Например, Рабинович и его коллеги продемонстрировали, что, хотя транскапсидация AAV1, AAV2 и AAV3 привела к эффективной совместной сборке мозаичных капсидов, скрещивание этих серотипов с AAV4 препятствовало генерации стабильных вирионов 34,45,47. Кроме того, AAV1, AAV2 и AAV3 показали низкую совместимость с AAV5, учитывая сниженные титры вируса, полученные при смешивании этих капсидов в разных соотношениях. Интересно, что мозаичный rAAV2/5 показал снижение гепарин-связывающих свойств, сохраняя при этом муцин-связывающую способность, как у родительского AAV5. Однако rAAV3/5 в соотношении 3:1 сохранял двойное связывание с гепарином и муцином. В целом, создание новых мозаичных rAAV с улучшенной трансдукцией, специфическим тропизмом или низкой иммуногенностью может значительно выиграть от нашего понимания сборки капсида и взаимодействия рецепторов, при этом конкретные комбинации все еще требуют тщательного исследования и оптимизации.
В настоящей работе мы описываем пошаговый протокол получения и очистки rAAV с использованием оптимизированного метода гепариновой аффинной хроматографии. rAAV производятся путем транзиторной трансфекции и очищаются с помощью системы быстрой белковой жидкостной хроматографии (FPLC). После концентрирования выбранных очищенных фракций полученные вирусные запасы характеризуются титром, чистотой, внутренними физическими свойствами и биологической активностью in vitro и in vivo. В качестве доказательства концепции мы демонстрируем улучшения и применимость этого протокола для генерации мозаичных векторов rAAV1/2 и rAAV2/9. Выбор каждого серотипа был основан на их поразительно разных тропизмах, потенциально придающих свои уникальные характеристики и мозаичным версиям. AAV серотипа 1 с общим умеренным тропизмом центральной нервной системы (ЦНС) обладает способностью трансдуцировать нейроны и глию (в меньшей степени) и подвергается аксональному транспорту в антероградном и ретроградном направлениях in vivo 2,7,8. Кроме того, серотип 9 AAV был выбран из-за его естественной способности пересекать гематоэнцефалический барьер и воздействовать на ЦНС как у новорожденных, так и у взрослых мышей51,52. Наконец, был выбран серотип 2 AAV, учитывая его способность связываться с гепарином, что позволяет проводить аффинную хроматографию33. Очищенные частицы rAAV1/2 и rAAV2/9 сочетают в себе свойства обоих родительских серотипов AAV и, следовательно, представляют собой подходящие векторы для трансдукции ЦНС 45,46,48,49.
протокол
ПРИМЕЧАНИЕ: На рисунке 1 приведена иллюстрация, обобщающая протокол. Смотрите Таблицу материалов для получения подробной информации обо всех материалах, инструментах и реагентах, используемых в этом протоколе. Все работы, связанные с клетками и вирусами, должны выполняться в специальных шкафах и инкубаторах биобезопасности, отделенных от тех, которые регулярно используются для обслуживания клеточных линий. Оборудование и реагенты, вступающие в контакт с культивируемыми клетками и вирусами, должны быть стерильными. Важно, чтобы удаление опасных реагентов и материалов, зараженных вирусами, осуществлялось в соответствии с паспортами безопасности материалов и в соответствии с национальными законами и руководящими принципами, разработанными отделом по охране окружающей среды и безопасности каждого учреждения. По состоянию на апрель 2019 года в рекомендациях NIH по исследованиям с использованием рекомбинантных или синтетических молекул нуклеиновых кислот все серотипы AAV (не связанные с заболеванием у здоровых взрослых людей) классифицируются как агенты группы риска 1 (не связанные с заболеванием у здоровых взрослых людей), а также рекомбинантные или синтетические конструкции AAV. Эта классификация применяется, когда трансген не кодирует потенциально опухолевый генный продукт или токсин, и конструкции производятся без вируса-помощника.
Все эксперименты с участием животных проводились в соответствии с директивой Сообщества Европейского союза (2010/63/EU) об уходе за лабораторными животными и их использовании, перенесенной в португальское законодательство в 2013 году (Законодательный декрет 113/2013). Кроме того, процедуры с животными были одобрены Ответственной организацией по благополучию животных медицинского факультета и Центром неврологии и клеточной биологии лицензированного ветеринарного учреждения Университета Коимбры. Исследователи прошли соответствующую подготовку (курс, сертифицированный FELASA) и сертификацию от португальских властей (Direcção Geral de Alimentação e Veterinária, Лиссабон, Португалия) для проведения экспериментов.
1. Плазмидные конструкции
- Следуйте инструкциям производителя набора без эндотоксинов maxiprep для выделения и очистки значительного количества ДНК следующих плазмид: i) pITR: вектор переноса, представляющий интерес; ii) плазмида pAAV-RC: pRV1, содержащая последовательности AAV2 Rep и Cap 36; iii) плазмида pAAV-RC: pH21, содержащая последовательности AAV1 Rep и Cap 36; iv) плазмида pAAV-RC: pAAV2/9n, содержащая последовательности AAV2 Rep и AAV9 Cap ; v) pHelper: pFdelta6, аденовирус-хелперплазмида 36.
- Скрининг целостности сгенерированных плазмид путем выполнения рекомендуемых ферментативных ограничений36. Мониторинг целостности плазмид pITR путем расщепления с помощью SmaI, эндонуклеазы рестрикции, которая разрезает вдвое нестабильную часть ITR53,54.
ПРИМЕЧАНИЕ: Поскольку ITR очень нестабильны и чувствительны к делециям, рекомендуется использовать сверхкомпетентные ячейки SURE 2 для минимизации рекомбинации в этих сайтах.
2. Клеточная культура
- Культивировали эмбриональную почку 293 человека, стабильно экспрессирующую клеточную линию большого Т-антигена (HEK293T) SV40 в модифицированной среде Dulbecco Modified Eagle Medium (DMEM) с высоким содержанием глюкозы, дополненную 10% фетальной бычьей сывороткой и 1% пенициллин-стрептомицином, при 37 °C, во влажной атмосфере, содержащей 5%CO2, в качестве отправной точки для последующих этапов.
- Субкультивируйте клетки с использованием стерильного 1x фосфатно-солевого буфера (PBS), pH 7,4, чтобы промыть клетки перед добавлением 0,05% трипсина-этилендиаминтетрауксусной кислоты (ЭДТА).
ПРИМЕЧАНИЕ: Избегайте использования клеток, которые прошли чрезмерное количество проходов (максимум 20). Регулярно проверяйте клеточные культуры на контаминацию микоплазмой.
3. Получение rAAV транзиентной трансфекцией
- День 1: Покрытие ячеек
- Для каждой вирусной продукции планшет HEK293T клетки в 10 обработанных культуральных чашек (диаметром 15 см) за день до трансфекции с плотностью 10,5 ×10 6 клеток на чашку в 22 мл питательной среды с добавкой и инкубируют в течение 24 ч до тех пор, пока клетки не слится на 70%-80% и не будут готовы к трансфекции.
- День 2: Трансфекция клеток с использованием полиэтиленимина (ПЭИ)
- Для каждого вирусного производства (эквивалентно 10,5 чашкам) поместите следующую трансфекционную смесь в микроцентрифужную пробирку: 54,6 мкг pITR; 45,675 мкг pRV1; 45,675 мкг pH21 или pAAV2/9n; 109,2 мкг pFdelta6. Перемешайте постукиванием.
- Добавьте смесь в 4,557 мл DMEM без добавок в центрифужную пробирку объемом 50 мл. Перемешайте постукиванием.
- Добавляйте 1,365 мл стерильного раствора PEI в концентрации 1 мг/мл (pH 7,4), капля за каплей. Перемешайте постукиванием. Инкубировать в течение 10 минут при комнатной температуре, чтобы обеспечить образование комплексов ДНК-ПЭИ.
- Добавьте эту смесь к 231 мл предварительно подогретого дополненного DMEM. Замените всю питательную среду каждой чашки 22 мл этой смеси для трансфекции. Инкубируйте клетки в течение 48 ч.
ПРИМЕЧАНИЕ: Этот шаг необходимо выполнять с осторожностью, чтобы избежать отслоения клеток.
- День 4: Сбор клеток
- Когда pITR кодирует флуоресцентный репортер, визуализируйте трансфицированные клетки под флуоресцентным микроскопом.
- Соберите среду из каждой чашки в центрифужные пробирки объемом 50 мл и центрифугируйте их при 800 × г в течение 10 минут. Выбросьте надосадочную жидкость.
ПРИМЕЧАНИЕ: Этот шаг является необязательным и направлен на восстановление трансфицированных клеток, которые могли отделиться из-за очень высокой конфлюенции. - Добавьте по 10 мл предварительно подогретого PBS на каждую тарелку. Аккуратно удалите клетки скребком для клеток и соберите суспензию в центрифужные пробирки объемом 50 мл на шаге 3.3.2.
- Вымойте 5 посуды за раз с добавлением дополнительных 10 мл PBS и перелейте суспензию в центрифужные пробирки объемом 50 мл с шага 3.3.3. Гранулируйте клетки по 800 × г в течение 10 мин и выбросьте надосадочную жидкость.
- Заморозьте гранулы ячейки при -80 °C.
ПРИМЕЧАНИЕ: Клеточные гранулы могут храниться в течение нескольких месяцев (точка паузы).
4. Экстракция rAAV и очистка FPLC
- День 5: Подготовка клеточного лизата
- Разморозьте гранулы клеток при комнатной температуре. Ресуспендируйте клетки, собранные из 10 чашек, в 100 мл стерильного буфера, содержащего 150 мМ хлорида натрия (NaCl) и 20 мМ Tris, pH 8,0, в сверхчистой воде (тип I). Перемешайте суспензию, пипетируя вверх и вниз, чтобы обеспечить однородную суспензию.
- Добавьте 12,5 мл свежеприготовленного стерильного раствора 10% дезоксихолата натрия в сверхчистую воду, чтобы вызвать лизис клеток. Перемешайте, пипетируя вверх и вниз.
ПРИМЕЧАНИЕ: Утилизируйте дезоксихолат натрия, а также материалы, контактирующие с ним, в соответствии с паспортом безопасности материала и инструкциями, предоставленными отделом гигиены и безопасности окружающей среды учреждения. Также рекомендуется носить маску для лица во время работы с этим порошком. После смешивания раствор становится высоковязким. - Добавьте 27 мкл бензоназной нуклеазы к предыдущей смеси. Тщательно перемешайте, пипетируя вверх и вниз, пока образец не перестанет быть вязким. Инкубировать при 37 °C в течение 1 ч, выполняя вихрь каждые 10 мин.
Эта эндонуклеаза способна эффективно разрушать все формы ДНК и РНК, не проявляя никакой протеолитической активности. - Удалите клеточный мусор, центрифугируя смесь при 3 000 × г в течение 60 мин при 25 °C. Отфильтруйте надосадочную жидкость стерильным шприцевым фильтром из поливинилидендифторида (PVDF) 0,45 мкм и переложите его в новый стерильный контейнер.
ПРИМЕЧАНИЕ: Этот важный шаг обеспечивает удаление большей части клеточного мусора, тем самым предотвращая засорение хроматографических колонок. Сохраните небольшую аликвоту этой смеси для анализа (необязательный шаг).
- День 5 (продолжение): Гепариновая колонная очистка rAAV
ПРИМЕЧАНИЕ: Нанесение образца может быть выполнено с помощью насоса для отбора проб или суперпетли объемом 50 мл или 150 мл в составе системы. Поскольку при более низких температурах растворяется больше воздуха, важно дать буферам и растворам (обычно хранящимся при 4 °C) достаточно времени для акклиматизации до комнатной температуры перед их использованием в системе FPLC.- Опция: Если система хранилась в течение длительного времени, заполните систему и все приточные отверстия свежеприготовленным раствором для хранения (20% этанол), используя инструкции по эксплуатации или заранее заданный метод безразборной мойки системы (система CIP).
- Полностью промойте канал потока жидкости стерильной сверхчистой водой, следуя инструкциям по эксплуатации или заранее определенному системному методу безразборной мойки.
- Подключите предварительно упакованную гепариновую колонку объемом 1 мл, установите сигнализацию давления и промойте пять колонок сверхчистой водой со скоростью потока 1 мл/мин.
- Переключите растворы в буферном лотке со сверхчистой воды на буфер A (стерильный раствор 100 мМ NaCl и 20 мМ Tris, pH 8, в сверхчистой воде) на входе A (системный насос A) и на буфер B (стерильный раствор 500 мМ NaCl и 20 мМ Tris, pH 8, в сверхчистой воде) на входе B (системный насос B). Если в системе есть насос для отбора проб, поместите входное отверстие буфера впускного клапана в буфер A.
- Промойте системный насос B буфером B и заполните оставшуюся часть потока жидкости буфером A.
ПРИМЕЧАНИЕ: При необходимости отсоедините колонну от проточной части, а затем снова подсоедините ее. - Вставьте трубку для впуска пробы, например, S1, в контейнер с вирусным препаратом, полученным на шаге 4.1.4. (из препарата клеточного лизата). Подготовьте раствор образца на пути потока от входного отверстия для образца S1 до клапана впрыска. В качестве альтернативы можно заполнить суперпетлю объемом 50 мл или 150 мл образцом, содержащим rAAV, с помощью шприца объемом 50 мл.
- Уравновесить колонку общим объемом пять CV, используя 12,5% буфера B со скоростью 1 мл/мин.
- Нанесите общий объем пробы в колонку с помощью насоса для отбора проб (выберите ввод всей пробы с помощью воздушного датчика) или суперпетли со скоростью 0,5 мл/мин и соберите проточный поток с помощью выпускного отверстия в новом стерильном контейнере.
ПРИМЕЧАНИЕ: Если включена функция управления потоком для предотвращения избыточного давления , поток будет автоматически уменьшаться в случае засорения колонны. Если расход значительно падает ниже 0,5 мл/мин, прекратите нанесение образца, выполните промывку с 2-5 CV буфера А, а затем возобновите нанесение образца. - Промыть колонку со скоростью 1 мл/мин 20 CV буфера А, собирая проточный поток с помощью выпускного отверстия.
- Элюирование образца со скоростью 1 мл/мин по следующей схеме: i) линейный градиент с целевым показателем 50% буфера B для пяти CV; ii) шаг с целевым показателем 90% буфера B в течение пяти CV; iii) шаг с целевым значением 100% буфера B в течение пяти CV.
- Соберите элюированный образец на фракции объемом 1 мл с помощью сборника фракций и микроцентрифужных пробирок с низким удержанием (2 мл) и храните их при температуре -20 °C.
ПРИМЕЧАНИЕ: Фракции rAAV могут храниться в течение нескольких недель (точка паузы). - Восстановите равновесие в колонке со скоростью 1 мл/мин с 12,5% буфера B для пяти CV.
- Переключите входные отверстия с буферных растворов на сверхчистую воду и промойте колонку со скоростью 1 мл/мин в течение пяти CV.
- Переключите входные отверстия со сверхчистой воды на 20% этанол и промойте колонку со скоростью 1 мл/мин в течение пяти CV. Отсоедините колонку и храните ее при температуре 4 °C.
ПРИМЕЧАНИЕ: Колонки можно использовать несколько раз без каких-либо других серьезных процедур очистки и дезинфекции, если используется один и тот же серотип rAAV и трансген. - Полностью промойте путь потока жидкости 20% этанолом, используя инструкции по эксплуатации или предварительно заданный метод безразборной мойки.
5. Концентрация очищенных rAAV
- День 6: Концентрация, шаг 1
- Концентрируйте rAAV с помощью центробежной фильтрующей установки объемом 15 мл с молекулярной массой 100 кДа. Загрузите желаемые фракции, содержащие rAAV (фракции FPLC от 7 до 16), в центробежный фильтр объемом 15 мл и центрифугируйте его при 2 000 × г в течение 2 мин при комнатной температуре. Убедитесь, что концентрированный объем в фильтрующем блоке составляет около 500 μл. Если концентрированный объем значительно превышает 500 мкл, повторяйте этапы центрифугирования с интервалом в 1 мин до достижения желаемого объема.
- День 6 (продолжение): Обмен буферами
- Добавьте 1 мл стерильного PBS в блок центробежного фильтра, содержащий rAAV. Осторожно пипеткой вверх и вниз, чтобы промыть фильтр. Центрифугируйте при 2 000 × г с интервалом в 1 мин до достижения конечного объема 500 мкл.
- День 6 (продолжение): Этап концентрации 2
- Перенесите 500 мкл концентрированных rAAV, полученных на предыдущем этапе, в центробежную фильтрующую установку объемом 0,5 мл с отсечкой молекулярной массы 100 кДа и центрифугируйте при 6000 × г в течение 1 мин. При необходимости повторяют стадию центрифугирования до тех пор, пока не будет достигнут конечный объем менее 100 мкл.
- День 6 (продолжение): Восстановление
- Чтобы извлечь концентрированный rAAV, поместите фильтрующее устройство вверх дном в новую сборную трубку микроцентрифуги. Поместите пробирку в микроцентрифугу крышкой к центру и выполните длительное вращение внутри проточной камеры, чтобы перенести концентрированные rAAV из устройства в микроцентрифужную пробирку. В качестве альтернативы центрифугируйте при 1 000 × г в течение 2 мин.
- Добавка со стерильным Pluronic F-68 0,001% (по желанию).
ПРИМЕЧАНИЕ: Плюроновый F-68 является неионогенным поверхностно-активным веществом, одобренным для использования человеком Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), которое способно смягчать потери rAAV, предотвращая их взаимодействие с поверхностями материалов (пластмасс), используемых во время приготовления разбавления, загрузки шприцев и оборудования для доставки55,56. - Аликвоты rAAV помещают в микроцентрифужные пробирки с низким удержанием и хранят при -80 °C (точка паузы).
6. Количественная оценка очищенных rAAV
- День 6 (продолжение): Определить титр препаратов rAAV, экспрессируемых в вирусных геномах/мкл (vg/μL), методом количественной полимеразной цепной реакции в реальном времени (ОТ-кПЦР) с использованием коммерческого набора и в соответствии с инструкциями производителя.
- Инкубировать раствор частиц rAAV с ДНКазой I при 37 °C в течение 20 мин.
ПРИМЕЧАНИЕ: Эта процедура способствует перевариванию свободной геномной ДНК и плазмидной ДНК, полученной из клеток-хозяев, тем самым гарантируя, что сохраняется только последовательность нуклеиновой кислоты внутри неповрежденных частиц rAAV. - Нагревать ДНКазу I при 95 °C в течение 10 мин.
- Добавьте буфер для лизиса и инкубируйте в течение 10 минут при 70 °C, чтобы стимулировать тепловую денатурацию белков частиц rAAV.
- Полученный раствор генома rAAV развести в разбавляющем буфере перед переходом к ОТ-кПЦР. Подготовить набор серийно разбавленных стандартов положительного контроля (от 2 × 107 вг/мкл до 2 × 102 вг/мкл), прилагаемых к набору.
- Проводят реакционную смесь, содержащую 12,5 мкл смеси Taq II, 0,5 мкл разбавленной смеси праймеров, 7 мкл воды и 5 мкл разбавленной ДНК rAAV (неизвестный образец AAV и стандарты, описанные на шаге 6.1.4).
- Выполните ОТ-кПЦР в системе обнаружения ПЦР в режиме реального времени по следующему протоколу: 1 цикл при 95 °C в течение 2 мин (начальная денатурация) и 40 циклов при 95 °C в течение 5 с (денатурация) и 60 °C в течение 30 с (отжиг, растяжение и чтение планшета) с последующим анализом кривой расплава.
- Рассчитайте абсолютную концентрацию образца по стандартной кривой (линии линейной регрессии) с учетом коэффициента разбавления, полученного в результате подготовки образца rAAV.
ПРИМЕЧАНИЕ: Количественная оценка количества вирусных геномов достигается путем амплификации последовательности ITR AAV2 (последовательность-мишень праймеров, поставляемых набором).
- Инкубировать раствор частиц rAAV с ДНКазой I при 37 °C в течение 20 мин.
7. SDS-PAGE, синее окрашивание Кумасси и западная блота
- Денатурируйте 40 мкл каждого образца (каждая фракция FPLC; протекающая часть; образцы предварительной колонки и в общей сложности 2,3 × 1010 vg конечного концентрированного продукта) путем добавления 6x буфера для образцов (0,5 М Tris-HCl/0,4% додецилсульфата натрия (SDS) pH 6,8, 30% глицерина, 10% SDS, 0,6 М дитиотреитола (DTT), 0,012% бромфенолового синего) и инкубации образцов в течение 5 мин при 95 °C.
- Загрузите денатурированные образцы (48 мкл) в SDS-полиакриламидный гель (4% укладки и 10% растворяющий гель) и выполните электрофоретическое разделение при 100 В в течение 70 мин рядом с белковой лестницей.
- Анализ белка
ПРИМЕЧАНИЕ: Может быть выполнено окрашивание синим цветом Кумасси или вестерн-блоттинг.- Окрашивание в синий цвет Кумасси
- Для визуализации белковых полос окрашивайте гель в течение 10 мин 0,25% раствором Coomassie blue G250, растворенным в 50% метанола и 10% уксусной кислоты ледниковой.
- Гель обезжирить, промыв его несколько раз раствором, содержащим 25% метанола и 5% уксусной кислоты ледниковой, до тех пор, пока не станут видны прозрачные полосы с низким фоном.
- Делайте снимки с помощью соответствующей системы обработки изображений.
- Вестерн-блот
- Перенесите белки на мембрану PVDF в соответствии со стандартными протоколами.
- Заблокируйте мембрану путем инкубации в 5% обезжиренном молоке, разведенном в TBS-T (0,1% Tween 20 в трис-буферном физрастворе) в течение 1 ч при комнатной температуре.
- Для ночной инкубации при 4 °C используют следующие первичные антитела (разведенные в блокирующем растворе): мышиные моноклональные антитела против AAV, VP1, VP2, VP3 (B1, 1:1000) или мышиные моноклональные антитела против AAV, VP1, VP2 (A69, 1:1000).
- Промывайте мембраны в течение 3 x 15 минут в TBS-T и инкубируйте с щелочным фосфатазой козьим вторичным антителом против мышей (1:10 000) в течение 2 часов при комнатной температуре.
- Промывайте мембраны в течение 3 x 15 минут в TBS-T. Добавьте улучшенную хемифлуоресцентную подложку (ECF) и визуализируйте белковые полосы с помощью хемифлуоресцентной визуализации.
- Окрашивание в синий цвет Кумасси
8. Просвечивающая электронная микроскопия (ПЭМ)
- Поместите сетку 200 меш с углеродным покрытием Formvar вверх дном поверх капли образца rAAV и дайте ей осесть в течение 1 минуты.
- Вымойте решетки в капле воды и высушите излишки жидкости фильтровальной бумагой.
- Отрицательно окрашивайте сетки 1% раствором уранилацетата (pH 7) в течение 1 минуты, чтобы зафиксировать и контрастировать вирусные частицы.
- Вымойте решетки в капле воды и высушите излишки жидкости фильтровальной бумагой.
- Исследуйте образцы в просвечивающем электронном микроскопе.
ПРИМЕЧАНИЕ: Высокие концентрации солей могут напрямую влиять на связывание rAAV с сеткой и приводить к визуализации кристаллоподобных структур.
9. Последовательное поглощение ультрафиолетового видимого света, статическое рассеяние света и динамический анализ рассеяния света
- На 96-луночный планшет для количественного определения загрузите 2 мкл образца rAAV и 2 мкл PBS для использования в качестве заглушки буфера (выполняйте это в двух экземплярах).
- Используйте приложение AAV Quant в программном обеспечении для анализа клиента, поместите имена образцов в правильное расположение пластины, выберите серотип AAV и нажмите кнопку Далее.
- Загрузите 96-луночную платину для количественного определения в специальное оборудование и продолжайте считывание показаний планшета для сбора данных.
10. Анализ трансдукции in vitro
- Для быстрого анализа эффективности трансдукции rAAV можно использовать различные клеточные линии.
- Равномерно засейте HEK293T клетки в 24-луночные планшеты (плотность 137 500 клеток/лунку) и клеточную линию нейробластомы мыши-2А (Neuro2a) либо в 24-луночные планшеты (50 000 клеток/лунку), либо в предметное стекло с 8-луночной камерой (27 000 клеток/лунку), используя DMEM с высоким содержанием глюкозы, дополненные 10% фетальной бычьей сывороткой и 1% пенициллин-стрептомицином, как описано выше. Дайте ячейкам прилипнуть в течение ночи при температуре 37 °C во влажной атмосфере, содержащей 5%CO2.
- Соберите кондиционированную среду из каждой лунки (250 μл из 24-луночных планшетов и 50 μл из 8-луночного предметного стекла) и храните ее при 4 °C для последующего использования.
- Добавьте следующие препараты rAAV в каждую лунку и инкубируйте клетки в течение 24 ч при 37 °C в атмосфере 5%CO2 .
- Добавьте 50 мкл фракций, собранных FPLC, F2-F16 и протекайте в HEK293T ячейки, покрытые 24-луночными планшетами.
- Добавьте в общей сложности 5,5 ×10,9 vg концентрированных rAAV, разведенных в 50 μL PBS, к клеткам Neuro2a, помещенным в 24-луночные планшеты (включите отрицательную контрольную лунку, добавив 50 μL PBS в клетки).
- Добавьте в общей сложности 2,75 × 109 vg концентрированных rAAV, разведенных в 25 мкл PBS, к клеткам Neuro2a, помещенным в предметное стекло с 8-луночной камерой (включите условие отрицательного контроля, добавив 50 мкл PBS в клетки).
- Добавьте ранее хранившуюся кондиционированную среду (шаг 10.1.2) в каждую лунку и инкубируйте в течение 24 ч.
- Выбросьте среду и промойте клетки 2 раза PBS.
- Добавьте в каждую лунку 4% раствор параформальдегида (PFA) с добавлением 4% сахарозы в PBS, предварительно подогретого до 37 °C, и инкубируйте при комнатной температуре в течение 20 минут.
- Промыть 2 раза PBS и хранить при температуре 4 °C до тех пор, пока не будет выполнена визуализация (точка паузы).
- Получение изображений с помощью инвертированного флуоресцентного микроскопа, оснащенного объективом 10x/0,30, или инвертированного конфокального микроскопа, оснащенного объективом Oil DIC 40x/1,4.
- Чтобы получить более актуальную и отражающую модель среды in vivo , используйте первичные культуры нейронов следующим образом:
- Подготовить первичные культуры корковых нейронов, как ранее было описано Santos et al.57. Вкратце, высейте 200 000 клеток/мл в 12-луночные планшеты и выдержите их в культуре до дня in vitro 16.
- Соберите кондиционированную среду из каждой лунки (100 мкл) и храните ее при температуре 4 °C для последующего использования.
- Добавьте тестируемые rAAV в каждую лунку: в общей сложности 2,75 × 10,9 vg концентрированных rAAV, разведенных в 25 μL PBS (включая отрицательный контроль: 25 μL PBS). Инкубировать в течение 24 ч при 37 °C в атмосфере 5%CO2.
- Добавьте предварительно хранившуюся кондиционированную среду и выдерживайте в течение 24 ч.
- Слейте среду в каждую лунку и промойте 2 раза PBS.
- Зафиксируйте клетки 4% ПФА/4% сахарозы в PBS, как описано в шаге 10.1.6. Постирайте 2 раза с PBS.
- Инкубируйте каждую лунку с 5 мкг/мл агглютинина зародышей пшеницы (WGA), конъюгированного с Alexa Fluor 633, в течение 10 минут при комнатной температуре (дополнительный шаг: вместо этого выполните иммуноцитохимию). Постирайте 2 раза с PBS.
- Инкубировать в 0,25% Triton X-100 в PBS в течение 5 мин при комнатной температуре. Постирайте с помощью PBS.
- Инкубировать с 4',6-диамидино-2-фенилиндолом (DAPI) в течение 5 мин при комнатной температуре. Постирайте 2 раза с PBS.
- Получение изображений на инвертированном флуоресцентном микроскопе, оснащенном объективом 40x/0,95, или инвертированном конфокальном микроскопе, оснащенном объективом Oil DIC 40x/1,4.
11. Эксперименты in vivo
ПРИМЕЧАНИЕ: Животные содержались в помещении с регулируемой температурой, поддерживаемом 12-часовым циклом свет/темнота. Еда и вода предоставлялись в свободном количестве. Были приложены все усилия, чтобы свести к минимуму страдания животных.
- Стереотаксическая инъекция в мозжечок
- Обезболить 9-недельных животных C57BL/6 путем ингаляции 2% изофлурана в присутствии кислорода (0,8 л/мин) в камере, подключенной к испарителю.
- Поместите животное, находящееся под наркозом, в стереотаксический аппарат (на подогретую при температуре 35 °C подушку) и поместите изофлурановую маску в нос животного. Снизить уровень изофлурана до 1,3-1,7%.
ПРИМЕЧАНИЕ: Убедитесь, что животное правильно обезболилось, прежде чем продолжить (потеря рефлекса сгибания в обеих задних конечностях). - Нанесите мазь-смазку для глаз, чтобы избежать пересыхания роговицы, и введите животному одобренный анальгетик.
ПРИМЕЧАНИЕ: Все последующие шаги должны выполняться в стерильных условиях. - После бритья шерсти на голове животного и дезинфекции хирургической области обнажить череп и поместить наконечник иглы для инъекций с тупым наконечником 30 г, соединенной со шприцем Гамильтона объемом 10 мкл, непосредственно над брегмой (используйте брегму как ноль для вычисления стереотаксических координат).
- Переместите иглу в нужное положение и просверлите отверстие в черепе, куда будет входить игла.
ПРИМЕЧАНИЕ: В рамках данного исследования была выполнена однократная инъекция в центр мозжечка. - Вводят 4 мкл раствора rAAV, содержащего в общей сложности 8 × 109 vg, разбавленного в PBS, со скоростью инфузии 0,5 мкл/мин с помощью автоматического инжектора. Используйте следующие координаты, рассчитанные по брегме, для выполнения однократной инъекции по центру мозжечка взрослой мыши C57BL/6: передне-задний: -6,5 мм; боковой: 0 мм; брюшной: -2,9 мм.
ПРИМЕЧАНИЕ: Эти координаты могут варьироваться в зависимости от штамма мыши, пола и возраста используемых животных. - Чтобы свести к минимуму обратный поток и обеспечить диффузию вирусного вектора, после завершения инфузии оставьте иглу шприца в этих координатах на 3 мин, затем медленно втяните ее на 0,3 мм и оставьте на месте еще 2 мин до ее полного удаления из мозга мыши.
- Закройте разрез и очистите его дезинфицирующим средством (например, 10% повидон-йодом).
- Дайте животным восстановиться после анестезии, прежде чем возвращать их в домашние клетки.
- Сбор и подготовка тканей
ПРИМЕЧАНИЕ: В этом эксперименте уровни трансдукции наблюдались через 12 недель после инъекции, но та же процедура может быть оценена уже через 4 недели после инъекции.- Смертельная анестезия животных путем внутрибрюшинного введения передозировки ксилазина/кетамина (8/160 мг/кг массы тела).
- Транскардиально перфузирируют животных ледяным PBS в течение 6 мин со скоростью 2,5 мл/мин с последующей перфузией свежеприготовленным ледяным 4% раствором PFA в течение 10 мин с той же скоростью.
- Поместите вырезанные мозги в 4% PFA на ночь при комнатной температуре, а затем перенесите их в 25% раствор сахарозы/PBS для криозащиты. Как только мозги опустятся (примерно через 48 часов), храните их при температуре -80 °C.
- Вырежьте серийные сагиттальные срезы толщиной 30 мкм с помощью криостата при -21 °C. Для каждого животного соберите 96 сагиттальных срезов полушария мозга в анатомических сериях в виде свободно плавающих срезов в PBS с добавлением 0,05% азида натрия. Хранить при температуре 4 °C до дальнейшей обработки.
- Стандартная флуоресцентная иммуногистохимия
- Выберите восемь сагиттальных срезов для каждого животного, на расстоянии 240 мкм друг от друга.
- Инкубировать свободно плавающие участки в блокирующем/пермеабилизирующем растворе (0,1% Triton X-100, содержащем 10% нормальной козьей сыворотки (NGS) в PBS) в течение 1 ч при комнатной температуре.
- Инкубируйте срезы в течение ночи при 4 °C с первичным куриным поликлональным антителом против GFP (1:1000).
- Промыть в течение 3 x 15 мин в PBS и инкубировать срезы в течение 2 ч при комнатной температуре с вторичным антителом козьего поликлонального антитела против курицы, конъюгированным с флуорофором Alexa Fluor 488 (1:200).
- Стирать 3 x 15 мин в PBS. Инкубировать с DAPI в течение 5 минут при комнатной температуре.
- Стирать 3 x 15 мин в PBS. Поместите срезы в предметные стекла с желатиновым покрытием и покройте флуоресцентным монтажным материалом.
- Получение изображений на слайдовом сканере, флуоресцентном микроскопе, оснащенном объективом 20x/0,8.
Результаты
В этой работе мы представляем подробный протокол производства, очистки и характеристики мозаичных rAAV (обобщенных на рисунке 1), которые обладают потенциалом для нацеливания и трансдукции ЦНС (например, AAV1 и AAV9), одновременно подходя для очистки гепариновой аффинной хроматографии (AAV2). Для достижения этой цели капсиды из природных серотипов AAV 1, 2 и 9 были использованы для создания мозаичных векторов rAAV1/2 и rAAV2/9.
Перед началом плазмидные препараты были проверены на структурную целостность. В дополнение к расщеплению, необходимому для проверки правильности вставки клонирующих фрагментов, важно последовательно проводить скрининг pITR-плазмид для обнаружения потенциальных делеций/вставок ITR. Например, целостность ITR в различных клонах pITR плазмиды контролировали после расщепления плазмиды с помощью фермента рестрикции SmaI (дополнительный рисунок S1).
Оба типа мозаичных векторов были получены путем котрансфекции соответствующих плазмид капсида AAV в соотношении 1:1 в соответствии со стандартными методами трансфекции6. Вкратце, HEK293T клетки трансфицировали i) плазмидой, содержащей интересующий трансген, упакованным между последовательностями ITR (pITR), ii) плазмидой, содержащей ORF Rep и Cap генома AAV дикого типа AAV2 и AAV1 или AAV9 (pAAV-RC плазмиды) и iii) плазмидой, кодирующей аденовирусные белки (E1A, E1B, E4 и E2A), а также аденовирус-ассоциированные РНК, необходимые для хелперных функций (pHelper). Через 48 часов клетки были собраны 6,36, и rAAV были очищены от клеточного гомогената с помощью аффинной хроматографии с использованием системы FPLC. Как показано на рисунке 2A, после уравновешивания колонки (стадия уравновешивания) на колонку наносили клеточный лизат, содержащий rAAV, (загрузка образца). Из-за естественного сродства rAAV2 к гепарину33 rAAV связывались со смолой колонки, в то время как другие компоненты осуществлялись в работающем буфере и детектировались УФ-монитором (протеканием), что приводило к увеличению поглощения. Затем колонку промывали (стадия промывки) и rAAV окончательно элюировали путем увеличения концентрации NaCl (стадия элюирования). Элюированные вирусы были обнаружены с помощью УФ-монитора и собраны во фракции по 1 мл.
Репрезентативный профиль пика элюирования rAAV1/2 и rAAV2/9 показан на рисунке 2B и дополнительном рисунке S2A соответственно, при этом различные вирусные партии последовательно демонстрируют один пик, начиная с фракции F7 до F16. Пиковая высота варьируется среди производств rAAV, при этом более высокие пики обычно приводят к более высокому выходу rAAV. Каждую фракцию полученных rAAV1/2 и rAAV2/9 впоследствии охарактеризовали с помощью ОТ-кПЦР для оценки титров вируса (рисунок 2C и дополнительный рисунок S2B).
Чтобы охарактеризовать чистоту элюированного материала, 40 мкл каждой фракции и соответствующего протекания исследовали с помощью 10% электрофореза в геле SDS-полиакриламида (рисунок 2D для rAAV1/2 и дополнительный рисунок S2C для rAAV2/9). Окрашивание синим цветом Кумасси выявило три основные полосы во фракциях F7-F16 с молекулярной массой, соответствующей капсидным белкам VP1 (87 кДа), VP2 (72 кДа) и VP3 (62 кДа) AAV в соответствующих соотношениях 1:1:10, как ранее было описано Ван Влитом и коллегами14. В обоих случаях, а также на основании поглощения УФ-излучения, ОТ-кПЦР и интенсивности гелевых полос, ясно, что большинство мозаичных rAAV присутствует во фракциях F7 и F8 и начинает постепенно снижаться во фракциях F9-F16. В дополнение к трем вирусным белкам капсида был обнаружен другой белок (или белки) размером около 17 кДа во фракциях F8-F16.
Для устранения этого соочищающего белка (белков) фракции F7-16 впоследствии фильтровали и концентрировали с использованием центробежных фильтровальных установок с массой 100 кДа, а окончательный титр rAAV определяли методом ОТ-кПЦР (как показано на рисунке 3A, B для rAAV1/2). Конечный выход продукции rAAV зависит от длины и сложности pITR, целостности последовательностей ITR, условий культивирования клеток (например, количества клеточных пассажей) и эффективности трансфекции 24,58,59,60,61. Тем не менее, конечный титр можно отрегулировать, выполнив многократное центрифугирование препарата rAAV с использованием центробежных фильтровальных установок объемом 0,5 мл (стадия концентрации 2). В соответствии с этим протоколом для конечного объема в диапазоне от 50 до 100 мкл концентрации обычно составляют от 2 × 109 до 5 ×10 10 вг/мкл (количественное определение проводят с использованием эталонного набора для титрования).
Затем чистоту окончательных препаратов rAAV оценивали на 10% SDS-полиакриламидном геле. Как показано на рисунке 3C, для препарата rAAV1/2 наблюдались только три полосы, представляющие капсидные белки rAAV, и не было идентифицировано никаких обнаруживаемых коочищающих белков. Эти результаты согласуются с результатами, полученными для rAAV2/9 (дополнительный рисунок S2C). Для подтверждения идентичности и дальнейшей характеристики чистоты векторов rAAV1/2 и rAAV2/9 вирусные фракции и концентрированные запасы были проанализированы методом вестерн-блоттинга со специфическими антителами B1 (дополнительный рисунок S3A и дополнительный рисунок S4A) и A69 (дополнительный рисунок S3B и дополнительный рисунок S4B). В то время как антитело B1 распознает С-концевой эпитоп, общий для всех белков VP большинства серотиповAAV 62, клон A69 распознает только эпитопы VP1 и VP263. Тем не менее, некоторые слабые полосы с молекулярной массой ниже VP3 (<62 кДа) также могут быть обнаружены при мечении B1 и A69.
Чтобы охарактеризовать структурную морфологию и в дальнейшем оценить чистоту rAAV, вирусные частицы были непосредственно визуализированы с помощью TEM. Этот метод является стандартной процедурой для оценки целостности и чистоты образцов вируса, поскольку он позволяет количественно определять пустые и полные частицы rAAV, а также оценивать загрязнение в образце 29,64,65,66,67. Как показано на рисунке 3D, большое количество частиц rAAV диаметром ~25 нм можно наблюдать на чистом фоне. Пустые частицы (черная стрелка) с электронно-плотным центром, а также полные векторы (белая стрелка) также можно наблюдать по всему полю образца.
Мы также выполнили контроль качества очищенных rAAV с помощью Stunner, платформы, которая сочетает в себе ультрафиолетовую (УФ-видимую) спектроскопию, статическое рассеяние света (SLS) и динамическое рассеяние света (DLS)68. Для каждого образца с помощью УФ-ВИД спектроскопии измеряли общее количество белка, одноцепочечной ДНК, а также поглощающие примеси и фоновую мутность (рисунок 3E и дополнительный рисунок S5A). Затем SLS и DLS были применены для оценки светорассеивающего поведения капсидов rAAV. Учитывая, что AAV имеют средний диаметр 25 нм, частицы в диапазоне диаметров 15-45 нм считаются неповрежденными. Более крупные частицы обычно представляют собой вирусные агрегаты, а все, что меньше, скорее всего, содержит мелкие частицы, включая несобранные капсидные белки68. Для rAAV1/2 один пик, соответствующий интактным частицам капсида, наблюдался на длине волны 30 нм (рис. 3F) с 0% от совокупной интенсивности и 0% от интенсивности мелких частиц. Для препарата rAAV2/9 также был обнаружен пик на длине волны 30 нм, представляющий 78% интенсивность капсида (дополнительный рисунок S5B). Несмотря на то, что интенсивность мелких частиц составила 0%, для этого образца была измерена совокупная интенсивность 22% (изображена серым цветом), причем основной вклад (19,9%) внесли крупные агрегаты со средним диаметром 620 нм (дополнительный рисунок S5B). Благодаря сочетанию УФ-ВИД спектроскопии с информацией SLS и DLS, Станнер выявил общий общий титр капсида, полный титр капсида, свободный и агрегированный белок, а также свободную и агрегированную одноцепопенную ДНК для двух вирусных препаратов, показанных на рисунке 3G и дополнительном рисунке S5C (конкретные значения указаны в подписи к каждому рисунку).
Параллельно для оценки биологической активности разработанных мозаичных AAV-векторов HEK293T клетки инфицировали 50 мкл каждой фракции, полученной FPLC (F2-F16) препарата rAAV1/2 или rAAV2/9. Поскольку вектор rAAV1/2 кодирует одноцепочечный зеленый флуоресцентный белок (GFP) под контролем промотора ЦМВ (PAAV-CMV-SSGFP), а вектор rAAV2/9 кодирует самокомплементарный GFP, под контролем промотора ЦМВ (PAAV-CMV-SCGFP53), прямая флуоресценция GFP была исследована в этих клетках через 48 часов после заражения (дополнительный рисунок S6 и дополнительный рисунок S7). В соответствии с предыдущими наблюдениями для ОТ-кПЦР, синего Кумасси и вестерн-блота наибольший уровень инфекционности был достигнут для вирусных фракций F7 и F8, постепенно снижаясь во фракциях F9 до F16.
Чтобы подтвердить, сохраняется ли биологическая активность rAAV после этапов ультрафильтрации и концентрирования, клетки Neuro2A, помещенные как в 24-луночные планшеты, так и в 8-луночное камерное стекло, были инфицированы концентрированным вектором rAAV1/2, кодирующим scGFP под контролем промотора ЦМВ (pAAV-CMV-scGFP53). Светлопольные и флуоресцентные изображения были получены через 48 ч после заражения (рис. 4A, B для изображений с более высоким разрешением).
С целью изучения инфекционной способности полученных rAAV в более релевантной и отражающей клеточной модели, полуплотные первичные нейронные культуры из коры головного мозга засеивали на 12-луночный планшет и инфицировали ранее использованным rAAV1/2 - CMV-scGFP. Через сорок восемь часов после заражения клетки фиксировали и помечали DAPI и WGA, конъюгированными с Alexa Fluor 633, широко используемый лектин для маркировки фиксированных клеток. Изображения, показанные на рисунке 4C, D, были получены с помощью Zeiss Axio Observer Z1 и конфокального объектива Zeiss LSM 710. Как показано на этих рисунках с помощью прямой флуоресценции GFP, концентрированные мозаичные вирусы сохраняют свои свойства переноса генов для нейрональных клеток.
Охарактеризовав мозаичные rAAV с точки зрения чистоты, физических свойств и функциональности in vitro, мы затем оценили возможность использования очищенных мозаичных векторов rAAV1/2 для трансдукции мозжечка мышей C57BL/6. Для этого 9-недельным мышам была выполнена стереотаксическая инъекция, а экспрессия GFP была оценена через 12 недель. Как и ожидалось, животные, которым вводили PBS, не проявляли флуоресценции при иммуномечении GFP. Эпифлуоресцентные изображения мышей, которым вводили векторы rAAV1/2, кодирующие GFP под контролем промотора синапсина 1 (rAAV1/2 - Syn-ssGFP), показали, что векторы rAAV1/2 успешно трансдуцировали несколько областей мозжечка, а именно область глубоких ядер мозжечка (DCN), а также различные дольки мозжечка (рис. 5). Эти результаты демонстрируют длительную экспрессию трансгена в мозге млекопитающих (12 недель).
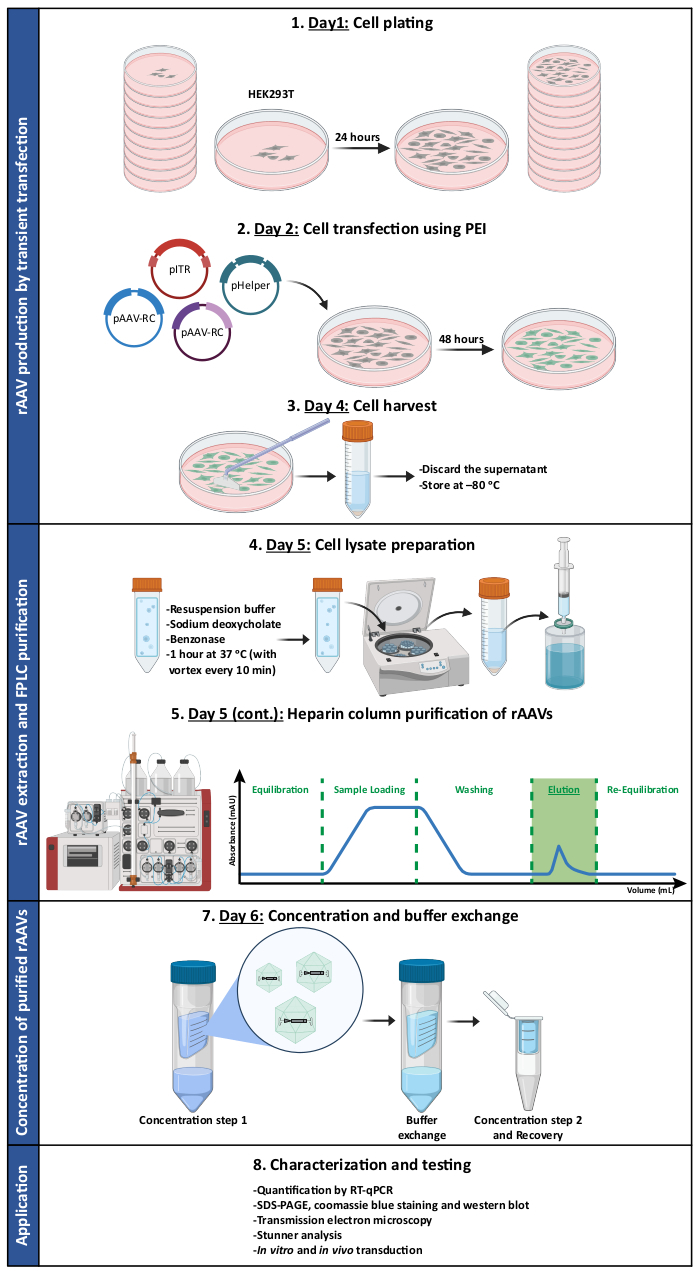
Рисунок 1: Схематическое изображение протокола производства и очистки rAAV. rAAV получают путем транзиторной трансфекции HEK293T клеток с использованием полиэтиленимина (PEI). Затем клетки собирают и лизируют, а rAAV очищают от клеточного гомогената с помощью аффинной хроматографии. Затем собранные фракции, содержащие rAAV, концентрируют, и конечные вирусные запасы характеризуют с точки зрения титра, чистоты, морфологических особенностей и биологической активности. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; PEI = полиэтиленимин; RT-qPCR = количественная полимеразная цепная реакция в реальном времени; SDS-PAGE = электрофорез в геле додецилсульфата натрия и полиакриламида. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
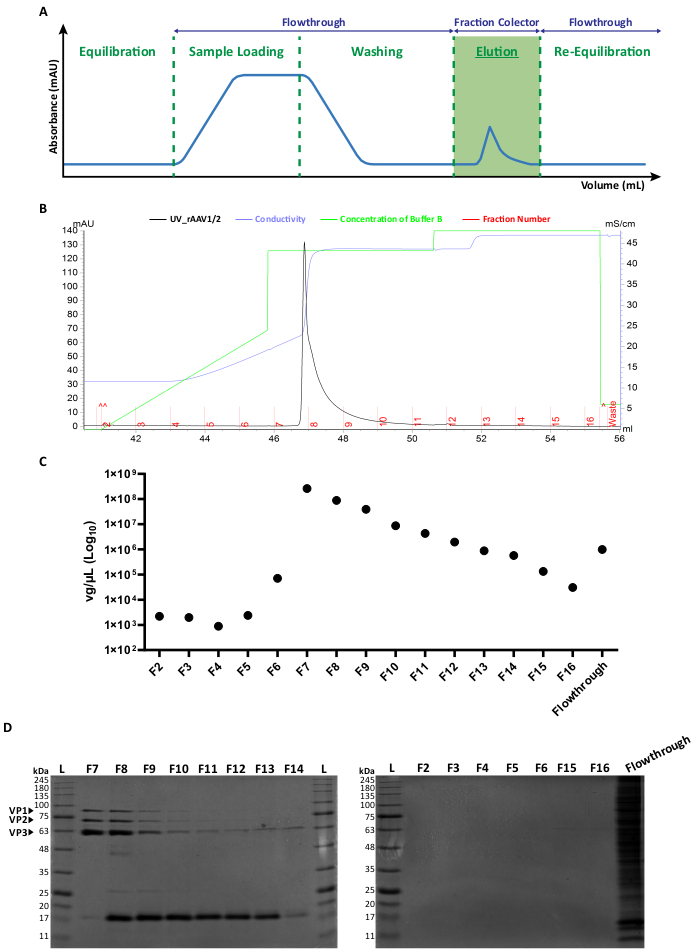
Рисунок 2: Протокол очистки FPLC и репрезентативный профиль элюирования rAAV1/2. (A) Схематическое изображение полного профиля хроматограммы, показывающее различные стадии процесса очистки rAAV. После шага уравновешивания столбца применяется выборка. Затем колонку промывают и элюируют с увеличением концентрации NaCl. Для анализа собирают несвязанный материал (проточный) и фракции 1 мл элюированных вирусов. Поглощение на длине волны 280 нм выражается в мА.е., а ось x указывает на объем в мл. (B) Увеличенная частичная хроматограмма, показывающая пик элюирования rAAV1/2 (черным цветом), с соответствующими номерами фракций (F2-F16) и отходами (обозначены красным цветом). Концентрация буфера B и проводимость (выраженная в мСм/см) также показаны зеленым и фиолетовым цветом соответственно. (C) ОТ-кПЦР каждой фракции, собранной во время аффинной очистки (F2-F16) и протекания. Титр в vg/μL представлен в логарифмической шкале. (D) Анализ собранных вирусных фракций SDS-PAGE. Равные объемы (40 мкл) каждой фракции со стадии элюирования (F2-F16) и соответствующий проток загружали и растворяли на 10% SDS-полиакриламидном геле. Белковые полосы визуализировались синим окрашиванием Кумасси. Обозначены полосы, соответствующие капсидным белкам AAV VP1, VP2 и VP3. Стандартная лестница размеров белка обозначается как (L), а также указывается соответствующая молекулярная масса. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; RT-qPCR = количественная полимеразная цепная реакция в реальном времени; SDS-PAGE = электрофорез в геле додецилсульфата натрия и полиакриламида. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
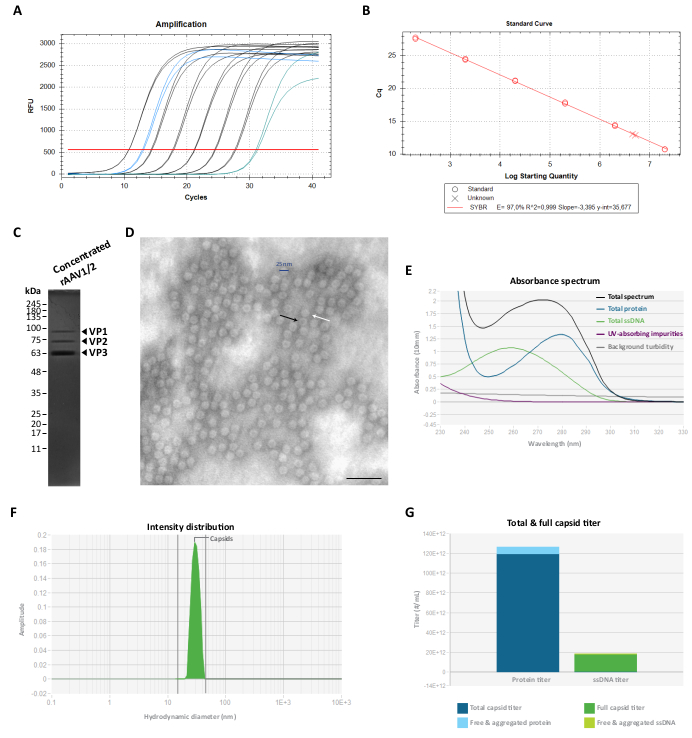
Рисунок 3: Характеристика концентрированных векторов rAAV1/2. (A) Кривые амплификации концентрированного образца rAAV1/2 (синего цвета), серийно разбавленных стандартов от 2 × 107 vg/μL до 2 × 102 vg/μL (черного цвета) и нематричного контроля (зеленого цвета), полученных в ходе RT-qPCR. (B) Стандартная кривая (линейная регрессия) для определения титра образца rAAV в vg/μL. (C) SDS-PAGE анализ концентрированных вирусных частиц. В общей сложности на геле было объединено 2,3 ×10 10 vg концентрированного запаса. (D) Просвечивающее электронное микроскопическое изображение частиц rAAV1/2 диаметром ~25-30 нм. Пустые частицы с электронно-плотным центром (о чем свидетельствуют черные стрелки) можно отличить от полных капсид (о чем свидетельствуют белые стрелки). Масштабная линейка = 100 нм. (E) Спектр поглощения препарата rAAV1/2, измеренный Stunner (черным цветом). Также показан вклад белков (синий), одноцепочечной ДНК (зеленый), других УФ-поглощающих соединений или примесей (фиолетовый) и фоновая мутность (серый). (F) Распределение интенсивности DLS rAAV1/2 с одним пиком на 30 нм, измеренное Stunner. Интенсивность рассеяния капсида 100% определяли путем измерения площади под кривой от 15 до 45 нм (заштриховано зеленым). (G) Потрясающий анализ векторного препарата rAAV1/2, демонстрирующего общий титр капсида 1,19 ×10 14 кп/мл (темно-синий) и полный титр капсида 1,73 ×10 13 вг/мл (темно-зеленый). Также измеряли свободный и агрегированный белок в эквиваленте 7,16 ×10 12 cp/мл (светло-голубой), а также свободную и агрегированную одноцепочечную ДНК в эквиваленте 1,04 × 1012 vg/мл (светло-зеленый). Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; RT-qPCR = количественная полимеразная цепная реакция в реальном времени; SDS-PAGE = электрофорез в геле додецилсульфата натрия и полиакриламида; ssDNA = одноцепочечная ДНК; DLS = динамическое рассеяние света. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
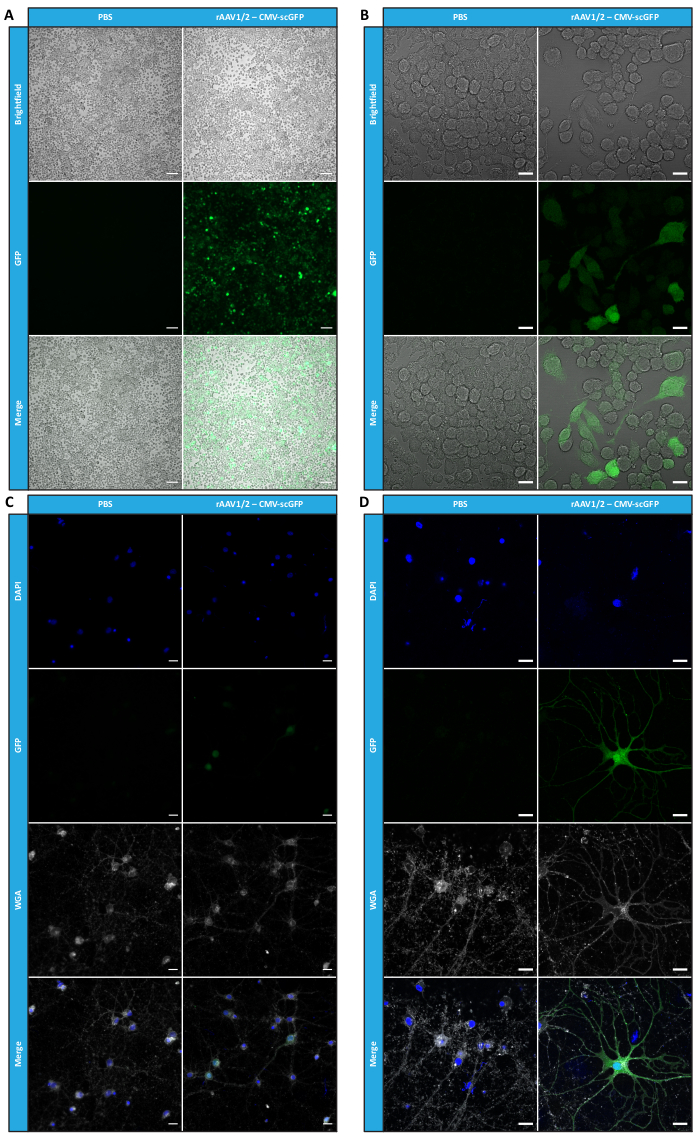
Рисунок 4: Оценка инфекционности in vitro концентрированного образца rAAV1/2. (A) Клетки Neuro2A инфицировали rAAV1/2 - CMV-scGFP или инкубировали с эквивалентным объемом PBS в качестве отрицательного контроля. Светлопольные и флуоресцентные изображения клеток, полученные через 48 ч после заражения. Изображения были получены с помощью объектива Zeiss Axio Observer Z1 (10-кратный объектив). Масштабные линейки = 100 мкм. (B) Подробные изображения клеток Neuro2A через 48 ч после заражения rAAV1/2 - CMV-scGFP. Изображения были получены с помощью объектива Zeiss LSM 710 (40-кратный объектив). Масштабные линейки = 20 мкм. (C) Полуплотные первичные культуры нейронов, инфицированные rAAV1/2 - CMV-scGFP или инкубированные с эквивалентным объемом PBS, служащие в качестве отрицательного контроля. Клетки были помечены ядерным красителем (DAPI синего цвета) и мембранным окрашиванием (WGA белым). Изображения были получены с помощью объектива Zeiss Axio Observer Z1 (40-кратный объектив). Масштабные линейки = 20 мкм. (D) Подробные изображения полуплотных первичных нейрональных культур через 48 ч после заражения rAAV1/2 - CMV-scGFP. Изображения получены с помощью объектива Zeiss LSM 710 (40-кратный объектив). Масштабные линейки = 20 μм. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; ЦМВ = цитомегаловирус; scGFP = самокомплементарный зеленый флуоресцентный белок; PBS = фосфатно-солевой буфер; DAPI = 4',6-диамидино-2-фенилиндол; WGA = агглютинин зародышей пшеницы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
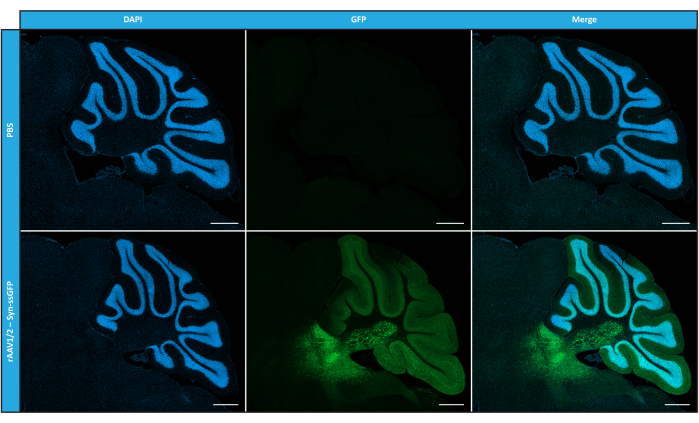
Рисунок 5: Эффективность трансдукции rAAV1/2 in vivo после внутрипаренхиматозной инъекции. Репрезентативные иммунофлуоресцентные изображения, показывающие широко распространенную экспрессию GFP (зеленым цветом) по всему мозжечку при центральной инъекции rAAV1/2 - Syn-ssGFP в мозжечок. Ядра окрашивали DAPI (синим цветом). Масштабные линейки = 500 μм. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; Syn = Синапсин 1; ssGFP = одноцепочечный зеленый флуоресцентный белок; DAPI = 4',6-диамидино-2-фенилиндол; PBS = фосфатно-солевой буфер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок S1: Анализ агарозного геля плазмиды вектора rAAV, расщепленной SmaI. Шесть клонов (C1-C6) pITR расщепляли ферментом рестрикции SmaI (дорожки 2, 4, 6, 8, 10 и 12), который разрезается дважды в каждом инвертированном концевом повторе. В этом случае ожидается, что полное расщепление этого пИТР приведет к образованию двух полос (3 796.о. и 3 013.о.). В успешных препаратах (С1, С3, С4 и С5) все еще видна полоса в 6809.о., возникающая в результате частичного переваривания (~5% от общего количества). В препаратах с рекомбинацией ИТР пропорции обратные (С2), либо переваривание не происходило (С6). Также представлены соответствующие непереваренные клоны (дорожки 3, 5, 7, 9, 11, 13). Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; ITR = инвертированный терминальный повтор. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: очистка rAAV2/9 с помощью гепариновой аффинной хроматографии. (A) Профиль элюирования rAAV2/9 с одним пиком (выделен черным цветом) после увеличения концентрации NaCl. Собранные фракции обозначены цифрами (2-16) красным цветом в нижней части графика, поглощение на 280 нм выражается в мАЕ, проводимость выражается в мСм/см, а по оси x указывается объем в мл. (B) титры rAAV, количественно определенные с помощью ОТ-кПЦР для каждой объединенной фракции (F2-F16) и сквозного потока. Значения представлены в логарифмической шкале. (C) Анализ чистоты с помощью SDS-PAGE и окрашивание в синий цвет Кумасси. Равные объемы (40 мкл) каждой фракции (F2-F16) и соответствующего протекания загружали и разрешали на 10% SDS-PAGE. Концентрированный запас количественно определяли с помощью ОТ-кПЦР, и 2,3 ×10 10 vg разбавляли в 40 мкл PBS и объединяли на геле. Белковые полосы визуализировались синим окрашиванием Кумасси. Показаны капсидные белки AAV (VP1, VP2 и VP3). Стандартная лестница размеров белка обозначается (L), а также указывается соответствующая молекулярная масса. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; RT-qPCR = количественная полимеразная цепная реакция в реальном времени; SDS-PAGE = электрофорез в геле додецилсульфата натрия и полиакриламида. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: Вестерн-блоттинг векторов rAAV1/2, очищенных FPLC. (A) Собранные фракции и концентрированные векторы rAAV1/2 растворяли на геле SDS-PAGE и зондировали мышиным моноклональным антителом против AAV (B1), которое распознает капсидные белки VP1, VP2 и VP3. (B) Собранные фракции и концентрированные векторы rAAV1/2 растворяли на геле SDS-PAGE и зондировали мышиным моноклональным антителом против AAV (A69), которое распознает капсидные белки VP1 и VP2. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; FPLC = быстрая белковая жидкостная хроматография; SDS-PAGE = электрофорез в геле додецилсульфата натрия и полиакриламида; L = стандартная лестница размера белка. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S4: Вестерн-блоттинг векторов rAAV2/9, очищенных FPLC. (A) Собранные фракции и концентрированные векторы rAAV2/9 растворяли на геле SDS-PAGE и зондировали мышиным моноклональным антителом против AAV (B1), которое распознает капсидные белки VP1, VP2 и VP3. (B) Собранные фракции и концентрированные векторы rAAV2/9 растворяли на геле SDS-PAGE и зондировали мышиным моноклональным антителом против AAV (A69), которое распознает капсидные белки VP1 и VP2. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; FPLC = быстрая белковая жидкостная хроматография; SDS-PAGE = электрофорез в геле додецилсульфата натрия и полиакриламида; L = стандартная лестница размера белка. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S5: количественное определение и характеристика вектора rAAV2/9 с помощью Stunner. (A) Спектр поглощения (черный) вектора rAAV2/9, измеренный Stunner. Также изображен вклад белков (синий), одноцепочечной ДНК (зеленый), других УФ-поглощающих соединений или примесей (фиолетовый) и фоновая мутность (серый). (B) Распределение интенсивности DLS rAAV2/9 с основным пиком на 30 нм, соответствующим интенсивности рассеяния капсида 78%, что определено путем измерения площади под кривой от 15 до 45 нм (заштриховано зеленым). Также была измерена общая совокупная интенсивность 22% (заштриховано серым цветом) с основным вкладом крупных агрегатов (19,9%) со средним диаметром 620 нм. (C) Потрясающий анализ векторного препарата rAAV2/9, демонстрирующего общий титр капсида 2,18 ×10 14 кп/мл (темно-синий) и полный титр капсида 2,35 ×10 13 вг/мл (темно-зеленый). В этом препарате также измеряли свободный и агрегированный белок в эквиваленте 2,92 ×10 13 cp/мл (светло-голубой), а также свободную и агрегированную ssDNA в эквиваленте 3,14 ×10 12 vg/мл (светло-зеленый). Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; ssDNA = одноцепочечная ДНК; DLS = динамическое рассеяние света. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S6: Эффективность трансдукции in vitro и жизнеспособность очищенных фракций rAAV1/2. HEK293T клетки, экспрессирующие GFP (прямую флуоресценцию) через 48 ч после трансдукции 50 мкл FPLC-фракций вектора rAAV1/2, кодирующего ssGFP (rAAV1/2 - CMV-ssGFP). Масштабные линейки = 100 μм. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; FPLC = быстрая белковая жидкостная хроматография; ssGFP = одноцепочечный зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S7: Эффективность трансдукции in vitro и жизнеспособность очищенных фракций rAAV2/9. HEK293T клетки были инфицированы 50 мкл каждой фракции FPLC (F2-F16) или протоком вектора rAAV2/9, кодирующего scGFP под контролем промотора ЦМВ. Клетки, экспрессирующие GFP, визуализировали через 48 ч после заражения. Масштабные линейки = 100 μм. Сокращения: rAAV = рекомбинантный аденоассоциированный вирус; FPLC = быстрая белковая жидкостная хроматография; scGFP = самокомплементарный зеленый флуоресцентный белок; ЦМВ = цитомегаловирус. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Быстро расширяющийся инструментарий вектора AAV стал одной из самых перспективных систем доставки генов для широкого спектра типов клеток с помощью различных путей введения. В этой работе мы стремились разработать улучшенный протокол для производства, очистки и характеристики мозаичных векторов rAAV, который мог бы доказать свою ценность в доклинических исследованиях. Для этой цели здесь описана генерация векторов мозаики rAAV1/2 и rAAV2/9, но процедура также может быть применена для очистки стандартных векторов rAAV2 (данные не показаны).
Мозаичные rAAV производили оптимизированным методом трансфекции с использованием PEI в качестве реагента для трансфекции. Метод транзиторной трансфекции был выбран из-за его большей гибкости и скорости, значительных преимуществ на ранних стадиях доклинических исследований. После того, как конкретный трансген и серотип были проверены, система производства может быть точно настроена для достижения лучшей масштабируемости и экономической эффективности путем создания стабильной трансфицированной клеточной линии, которая экспрессирует подмножество специфических генов Rep/Cap , с дополнительными генами, полученными в результате инфекционного процесса24. По сравнению с кальций-фосфатной трансфекцией ПЭИ имеет ряд преимуществ. Это стабильный и экономичный реагент для трансфекции, который эффективно работает в более широком диапазоне pH. Кроме того, он устраняет необходимость замены клеточной среды после трансфекции, что приводит к значительному снижению как затрат, так и рабочей нагрузки69.
В попытке обойти некоторые ограничения, налагаемые градиентами CsCl или йодиксанола, полученные rAAV собирали и очищали с помощью аффинной хроматографии. Эта стратегия предлагает упрощенный и масштабируемый подход, который может быть выполнен без необходимости ультрацентрифугирования и градиентов, что дает чистые и высокие титры вируса. Действительно, методы хроматографии с использованием системы FPLC могут быть автоматизированы и масштабированы за счет упаковки большего объема смолы в колонку с большей высотой слоя. Протокол, описанный в настоящем документе, может быть легко адаптирован для включения 5 мл столбцов HiTrap Heparin HP (данные не показаны). Кроме того, гепариновые колонки могут быть повторно использованы несколько раз, что способствует экономической эффективности этого метода.
Затем очищенные rAAV были охарактеризованы с точки зрения титра, чистоты, морфологических особенностей и биологической активности. Интересно, что при окрашивании синим цветом Кумасси полоса с примерно 17 кДа была обнаружена во фракциях F8-F16 в дополнение к трем типичным белкам вирусного капсида. Однако эта полоса больше не присутствует после стадии концентрации rAAV. Более того, некоторые слабые полосы с молекулярной массой ниже VP3 (<62 кДа) также могут быть обнаружены при мечении B1 и A69, что позволяет предположить, что они могут быть фрагментами капсидных белков VP1, VP2 и VP370. Другая возможность заключается в том, что на самом деле это другие коочищающие белки, такие как ферритин или другие клеточные белки с полипептидами, которые имеют схожие белковые отпечатки с белками капсида AAV и могут быть вовлечены в биологию AAV, как предполагалось ранее 26,71,72.
ПЭМ и анализ оглушения также выявили наличие пустых частиц на различных уровнях в различных производствах. Аналогичным образом, в других исследованиях ранее сообщалось о генерации вариабельных и высоких уровней (>65%) пустых капсидов для rAAV, приготовленных методами трансфекции или инфекции24,73. Механизм генерации rAAV начинается с быстрого образования пустых капсидов из вновь синтезированных белков VP, за которым следует медленный ограничивающий скорость этап упаковки генома в предварительно сформированные капсиды, опосредованный белками Rep74,75. Таким образом, пустые капсиды генерируются в продуктах rAAV, хотя соотношение пустых и полных капсидов может варьироваться в зависимости от размера и последовательности интересующего трансгена и условий культивирования клеток58,73. Пустые капсиды вызывают некоторые опасения, поскольку, не имея интересующего генома, они не могут обеспечить терапевтический эффект, а также потенциально могут усилить врожденный или адаптивный иммунный ответ. Однако некоторые отчеты также показали, что, регулируя их соотношение, пустые капсиды AAV могут служить высокоэффективной приманкой для специфических AAV-специфических нейтрализующих антител и, следовательно, увеличивать эффективность трансдукции 60,76,77. Если присутствие пустых капсидов является критически вредным и учитывая несколько меньший анионный характер пустых частиц по сравнению с полными векторами, потенциальное решение может включать проведение второго этапа полировочной очистки с использованием методов анионообменной хроматографии64.
Это исследование также предоставляет убедительные доказательства того, что сгенерированные мозаичные rAAV способны эффективно трансдуцировать не только культуры нейронов in vitro , но и ЦНС при внутричерепной инъекции rAAV1/2. В целом, эти результаты свидетельствуют о том, что описанный протокол производства и очистки делает высокочистые и биологически активные rAAV готовыми к использованию в течение 6 дней, представляя собой универсальный и экономически эффективный метод получения rAAV в доклинических исследованиях.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы благодарны за сотрудничество, идеи и техническую помощь, предоставленные доктором Моникой Зузарте из Института клинических и биомедицинских исследований Коимбры (iCBR) и Центра инновационной биомедицины и биотехнологии (CIBB) в отношении TEM-анализа rAAV. Мы выражаем признательность доктору Доминик Фернандес из Центра неврологии и клеточной биологии Университета Коимбры (CNC-UC) и Института междисциплинарных исследований Университета Коимбры (IIIUC) за ее неоценимую техническую помощь и идеи в отношении экспериментов с первичными культурами нейронов. Плазмиды pRV1, pH21 и pFdelta6, необходимые для этого исследования, были любезно предоставлены доктором Кристиной МакКлюр из Школы медицинских наук Колледжа наук о жизни и медицины Абердинского университета, за что мы благодарны. Эта работа финансировалась Европейским фондом регионального развития (ЕФРР) в рамках Региональной операционной программы Centro 2020; через COMPETE 2020 - Оперативную программу конкурентоспособности и интернационализации, и португальские национальные фонды через FCT - Fundação para a Ciência e a Tecnologia, в рамках проектов: UIDB/04539/2020, UIDP/04539/2020, LA/P/0058/2020, ViraVector (CENTRO-01-0145-FEDER-022095), Imagene (PTDC/BBB-NAN/0932/2014 | POCI-01-0145-FEDER-016807), ReSet - IDT-COP (CENTRO-01-0247-FEDER-070162), Борьба с Sars-CoV-2 (CENTRO-01-01D2-FEDER-000002), BDforMJD (CENTRO-01-0145-FEDER-181240), ModelPolyQ2.0 (CENTRO-01-0145-FEDER-181258), MJDEDIT (CENTRO-01-0145-FEDER-181266); Американо-португальским фондом биомедицинских исследований (APBRF) и Фондом исследований болезней Ричарда Чина и Лили Лок Мачадо-Джозефа, ARDAT в рамках соглашения о гранте IMI2 JU No 945473 при поддержке ЕС и EFPIA; GeneT - Teaming Project 101059981 поддерживается программой Европейского Союза Horizon Europe. M.M.L. был поддержан 2021.05776.BD; К.Х. был поддержан 2021.06939.BD; A.C.S. был поддержан 2020.07721.BD; и D.D.L. был поддержан 2020.09668.BD. Рисунок 1 был создан с использованием BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 10% povidone-iodine | Medline | MDS093943 | |
| 12-well plates | Thermo Scientific | 11889684 | |
| 24-well plates | VWR | 734-2325 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen | D1306 | |
| 96-well Stunner plate | Unchained Labs | 701-2025 | 96-well quantification plate for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| AAVpro Titration Kit (for Real-Time PCR) Ver.2 | Takara | 6233 | For determining the titer of AAV using RT-qPCR. This kit contains DNase I, Lysis Buffer, Dilution Buffer, positive control, Taq II mix, primer forward, primer reverse, water |
| Acetic acid glacial | Fisher Chemical | A/0360/PB17 | |
| ÄKTA pure 25 | Cytiva | 29018224 | FPLC system controlled by UNICORN software, version 6.3 |
| Alkaline phosphatase-linked goat anti-mouse | Invitrogen | 31328 | |
| Amicon ultra-0.5 centrifugal filter unit | Merck Millipore | UFC5100 | |
| Amicon ultra-15 centrifugal filter unit | Merck Millipore | UFC9100 | |
| Benzonase Nuclease | Merck Millipore | E1014 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| CFX96 Real-Time PCR detection system | Biorad | 184-5096 | |
| ChemiDoc Touch Imaging System | Bio-Rad Laboratories | 1708370 | |
| Chicken polyclonal anti-GFP primary antibody | Abcam | ab13970 | |
| Coomassie Blue G250 | Fisher Chemical | C/P541/46 | |
| Dithiothreitol (DTT) | Fisher Bioreagents | BP17225 | |
| DMEM | Sigma-Aldrich | D5796 | |
| ECF Substrate for Western Blotting | Cytiva | RPN5785 | |
| FastDigest SmaI | Thermo Scientific | FD0663 | |
| FEI-Tecnai G2 Spirit Biotwin | FEI | Biotwin | Transmission electron microscope |
| Fetal bovine serum | Biowest | S1810 | |
| Fluorescence mounting medium | Dako | S3023 | |
| Formvar-carbon coated 200 mesh grid | TAAB Laboratories Equipment | F077/025 | |
| Gas evacuation apparatus | RWD | R546W | |
| Glycerol | Fisher BioReagents | 10021083 | |
| Goat polyclonal anti-chicken antibody, Alexa Fluor 488 | Invitrogen | A-11039 | |
| Hamilton needle 30G, Small Hub RN Needle, 25 mm, PST3 | Hamilton | 7803-07 | |
| Hamilton syringe (10 µL) | Hamilton | 7653-01 | |
| HEK293T | American Type Culture Collection | CRL-11268 | |
| HiTrap Heparin HP 1 x 5 mL | Cytiva | 17040701 | Pre-packed heparin column |
| HiTrap Heparin HP 5 x 1 mL | Cytiva | 17040601 | Pre-packed heparin column |
| Immobilon-P PVDF Membrane | Merck Millipore | IPVH00010 | |
| Isoflurane | Braun | 469860 | |
| Ketamine | Dechra Pharmaceuticals | N/A | Nimatek |
| Low-retention microcentrifuge tubes (2 mL) | Fisher Scientific | 11906965 | |
| Lunatic & Stunner Client software | Unchained Labs | N/A | Client analysis software version 8.0.1.235. Software for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Methanol | Fisher Chemical | M/4000/FP21 | |
| Mouse monoclonal anti-AAV, VP1, VP2 antibody (A69) | American Research Products | 03-61057 | |
| Mouse monoclonal anti-AAV, VP1, VP2, VP3 antibody (B1) | American Research Products | 03-61058 | |
| Neuro2a | American Type Culture Collection | CCL-131 | |
| Normal goat serum | Gibco | 16210064 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 12738422 | |
| NZYColour Protein Marker II | NZYtech | MB09002 | |
| pAAV-CMV-scGFP | Addgene | 32396 | Addgene plasmid # 32396; http://n2t.net/addgene:32396; RRID:Addgene_32396 |
| pAAV-CMV-ssGFP | Addgene | 105530 | Addgene plasmid # 105530; http://n2t.net/addgene:105530; RRID:Addgene_105530 |
| pAAV2/9n | Addgene | 112865 | Addgene plasmid # 112865; http://n2t.net/addgene:112865; RRID:Addgene_112865 |
| Paraformaldehyde | Acros Organics | 10342243 | |
| PBS | Fisher BioReagents | BP2438 | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Pluronic F-68 Non-ionic Surfactant (100x) | Gibco | 24040032 | |
| Polyethylenimine MAX, MW 40,000 | Polysciences Europe | 24765 | |
| R500 Series Compact Small Animal Anesthesia Machine - Isoflurane | RWD | N/A | |
| Sample Inlet Valve V9-IS | Cytiva | 29027746 | |
| Sample pump P9-S | Cytiva | 29027745 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium chloride | Fisher Scientific | 10428420 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dodecyl sulfate (SDS) | Fisher Bioreagents | BP166 | |
| Sterile PVDF syringe filter | Fisher Scientific | 15191499 | |
| Stunner Platform | Unchained Labs | 700-2002 | Equipment for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Superloop 150 mL | Cytiva | 18-1023-85 | |
| Superloop 50 mL | Cytiva | 18-1113-82 | |
| SURE 2 supercompetent cells | Stratagene, Agilent Technologies | HPA200152 | |
| Treated culture dishes | Corning | 734-1711 | |
| Tris base | Fisher BioReagents | BP152 | |
| Tris hydrochloride | Fisher BioReagents | BP153 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin-EDTA | Gibco | 25200-072 | |
| Wheat Germ Agglutinin (WGA) conjugated with Alexa Fluor 633 | Invitrogen | W21404 | |
| Xylazine | Dechra Pharmaceuticals | N/A | Sedaxylan |
| Zeiss Axio Observer Z1 | Carl Zeiss Microscopy GmbH | N/A | Inverted fluorescence microscope equiped with an EC Plan-Neofluar 10x/0.30 objective and a Plan-Apochromat 40x/0.95 objective |
| Zeiss Axio Scan.Z1 | Carl Zeiss Microscopy GmbH | N/A | Slide scanner fluorescence microscope equipped with a Plan-Apochromat 20x/0.8 objective |
| Zeiss LSM 710 | Carl Zeiss Microscopy GmbH | N/A | Inverted confocal microscope equipped with a Plan-Apochromat 40x/1.4 Oil DIC objective |
| µ-Slide 8 well Ibidi | Ibidi | 80826 | 8-well chamber slide |
Ссылки
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Front Mol Neurosci. 7, 1-9 (2014).
- Muzyczka, N. Use of Adeno-Associated Virus as a General Transduction Vector for Mammalian Cells. Viral Expression Vectors. 158, 97-129 (1992).
- Goncalves, M. A. F. V Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43 (2005).
- Flotte, T. R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 11 (10), 805-810 (2004).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Ojala, D. S., Amara, D. P., Schaffer, D. V Adeno-Associated Virus Vectors and Neurological Gene Therapy. Neuroscientist. 21 (1), 84-98 (2014).
- Saraiva, J., Nobre, R. J., Pereira de Almeida, L. Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. Journal of Controlled Release. 241, 94-109 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods Mol Biol. 807, 47-92 (2011).
- Sonntag, F., Schmidt, K., Kleinschmidt, J. A. A viral assembly factor promotes AAV2 capsid formation in the nucleolus. Proc Natl Acad Sci U S A. 107 (22), 10220-10225 (2010).
- Sonntag, F., et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes. J Virol. 85 (23), 12686-12697 (2011).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol. 78 (12), 6381-6388 (2004).
- Gao, G., Vandenberghe, L. H., Wilson, J. M. New recombinant serotypes of AAV vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The role of the adeno-associated virus capsid in gene transfer. Methods Mol Biol. 437, 51-91 (2008).
- Clark, K. R., Voulgaropoulou, F., Fraley, D. M., Johnson, P. R. Cell lines for the production of recombinant adeno-associated virus. Hum Gene Ther. 6 (10), 1329-1341 (1995).
- Inoue, N., Russell, D. W. Packaging cells based on inducible gene amplification for the production of adeno-associated virus vectors. J Virol. 72 (9), 7024-7031 (1998).
- Liu, X., Voulgaropoulou, F., Chen, R., Johnson, P. R., Clark, K. R. Selective Rep-Cap gene amplification as a mechanism for high-titer recombinant AAV production from stable cell lines. Mol Ther. 2 (4), 394-403 (2000).
- Mathews, L. C., Gray, J. T., Gallagher, M. R., Snyder, R. O. [23] Recombinant adeno-associated viral vector production using stable packaging and producer cell lines. Methods Enzymol. 346, 393-413 (2002).
- Gao, G., et al. Purification of recombinant adeno-associated virus vectors by column chromatography and its performance in vivo. Hum Gene Ther. 11 (15), 2079-2091 (2000).
- Xiao, X., Li, J., Samulski, R. J. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus. J Virol. 72 (3), 2224-2232 (1998).
- Aponte-Ubillus, J. J., et al. Molecular design for recombinant adeno-associated virus (rAAV) vector production. Appl Microbiol Biotechnol. 102 (3), 1045-1054 (2018).
- Smith, R. H., Levy, J. R., Kotin, R. M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells. Mol Ther. 17 (11), 1888-1896 (2009).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Wright, J. F. Transient transfection methods for clinical adeno-associated viral vector production. Hum Gene Ther. 20 (7), 698-706 (2009).
- Yuan, Z., Qiao, C., Hu, P., Li, J., Xiao, X. A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes. Hum Gene Ther. 22 (5), 613-624 (2011).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Hum Gene Ther Methods. 26 (4), 147-157 (2015).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Anderson, R., Macdonald, I., Corbett, T., Whiteway, A., Prentice, H. G. A method for the preparation of highly purified adeno-associated virus using affinity column chromatography, protease digestion and solvent extraction. J Virol Methods. 85 (1-2), 23-34 (2000).
- Okada, T., et al. Scalable purification of adeno-associated virus serotype 1 (AAV1) and AAV8 vectors, using dual ion-exchange adsorptive membranes. Hum Gene Ther. 20 (9), 1013-1021 (2009).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. J Virol Methods. 183 (2), 139-146 (2012).
- Lock, M., et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale. Hum Gene Ther. 21 (10), 1259-1271 (2010).
- Wang, L., Blouin, V., Brument, N., Bello-Roufai, M., Francois, A. Production and Purification of Recombinant Adeno-Associated Vectors. Adeno-Associated Virus: Methods and Protocols. 807, 361-404 (2011).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated Virus Serotypes: Vector Toolkit for Human Gene Therapy. Molecular Therapy. 14 (3), 316-327 (2006).
- Mietzsch, M., Broecker, F., Reinhardt, A., Seeberger, P. H., Heilbronn, R. Differential adeno-associated virus serotype-specific interaction patterns with synthetic heparins and other glycans. J Virol. 88 (5), 2991-3003 (2014).
- McClure, C., Cole, K. L. H., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. JoVE. (57), e3348 (2011).
- Auricchio, A., O’Connor, E., Hildinger, M., Wilson, J. M. A single-step affinity column for purification of serotype-5 based adeno-associated viral vectors. Mol Ther. 4 (4), 372-374 (2001).
- Wang, Q., et al. Identification of an adeno-associated virus binding epitope for AVB sepharose affinity resin. Mol Ther Methods Clin Dev. 2, 15040 (2015).
- Mietzsch, M., et al. OneBac: platform for scalable and high-titer production of adeno-associated virus serotype 1–12 vectors for gene therapy. Hum Gene Ther. 25 (3), 212-222 (2014).
- Mietzsch, M., et al. Characterization of AAV-specific affinity ligands: consequences for vector purification and development strategies. Mol Ther Methods Clin Dev. 19, 362-373 (2020).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2023).
- Koerber, J. T., Jang, J. -. H., Yu, J. H., Kane, R. S., Schaffer, D. V. Engineering adeno-associated virus for one-Step purification via immobilized metal affinity chromatography. Hum Gene Ther. 18 (4), 367-378 (2007).
- Zhang, H. -. G., et al. Addition of six-His-tagged peptide to the C terminus of adeno-associated virus VP3 does not affect viral tropism or production. J Virol. 76 (23), 12023-12031 (2002).
- Arnold, G. S., Sasser, A. K., Stachler, M. D., Bartlett, J. S. Metabolic biotinylation provides a unique platform for the purification and targeting of multiple AAV vector serotypes. Mol Ther. 14 (1), 97-106 (2006).
- Rabinowitz, J. E., et al. Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol. 78 (9), 4421-4432 (2004).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Mol Ther. 7 (3), 419-425 (2003).
- Choi, V., McCarty, D., Samulski, R. AAV hybrid serotypes: improved vectors for gene delivery. Curr Gene Ther. 5 (3), 299-310 (2005).
- Nonnenmacher, M., van Bakel, H., Hajjar, R. J., Weber, T. High capsid–genome correlation facilitates creation of AAV libraries for directed evolution. Mol Ther. 23 (4), 675-682 (2015).
- Kimura, K., et al. A mosaic adeno-associated virus vector as a versatile tool that exhibits high levels of transgene expression and neuron specificity in primate brain. Nat Commun. 14 (1), 4762 (2023).
- Issa, S. S., Shaimardanova, A. A., Solovyeva, V. V., Rizvanov, A. A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 12 (5), 785 (2023).
- Foust, K. D., et al. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27 (1), 59-65 (2009).
- Lopes, M. M., et al. A new protocol for whole-brain biodistribution analysis of AAVs by tissue clearing, light-sheet microscopy and semi-automated spatial quantification. Gene Ther. 29 (12), 665-679 (2022).
- Gray, J. T., Zolotukhin, S. Design and construction of functional AAV vectors. Methods Mol Biol. 807, 25-46 (2011).
- Choi, V. W., Asokan, A., Haberman, R. A., Samulski, R. J. Production of recombinant adeno-associated viral vectors. Curr Protoc Hum Genet. , (2007).
- Bennicelli, J., et al. Reversal of blindness in animal models of leber congenital amaurosis using optimized AAV2-mediated gene transfer. Mol Ther. 16 (3), 458-465 (2008).
- Fischer, M. D., Hickey, D. G., Singh, M. S., MacLaren, R. E. Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods. 27 (4), 150-158 (2016).
- Santos, S. D., et al. Contactin-associated protein 1 (Caspr1) regulates the traffic and synaptic content of α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-type glutamate receptors. J Biol Chem. 287 (9), 6868-6877 (2012).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 7 (1), 122-128 (2003).
- Dong, B., Nakai, H., Xiao, W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther. 18 (1), 87-92 (2010).
- Wright, J. F. AAV empty capsids: For better or for worse. Mol Ther. 22 (1), 1-2 (2014).
- Asaad, W., et al. AAV genome modification for efficient AAV production. Heliyon. 9 (4), e15071 (2023).
- Wobus, C. E., et al. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J Virol. 74 (19), 9281-9293 (2000).
- Wistuba, A., Kern, A., Weger, S., Grimm, D., Kleinschmidt, J. A. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol. 71 (2), 1341-1352 (1997).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J Virol Methods. 140 (1-2), 183-192 (2007).
- Brument, N., et al. A versatile and scalable two-step ion-exchange chromatography process for the purification of recombinant adeno-associated virus serotypes-2 and -5. Mol Ther. 6 (5), 678-686 (2002).
- Potter, M., et al. A simplified purification protocol for recombinant adeno-associated virus vectors. Mol Ther Methods Clin Dev. 1, 14034 (2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570 (2019).
- Yang, Q. -. E., et al. Rapid quality control assessment of adeno-associated virus vectors via Stunner. GEN Biotechnology. 1 (3), 300-310 (2022).
- Huang, X., et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 193 (2), 270-277 (2013).
- Salganik, M., et al. Evidence for pH-dependent protease activity in the adeno-associated virus capsid. J Virol. 86 (21), 11877-11885 (2012).
- Dong, B., et al. Proteomics analysis of co-purifying cellular proteins associated with rAAV vectors. PLoS One. 9 (2), e86453 (2014).
- Grieger, J. C., Soltys, S. M., Samulski, R. J. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 24 (2), 287-297 (2016).
- Wright, J. Product-related impurities in clinical-grade recombinant AAV vectors: characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Bennett, A., Mietzsch, M., Agbandje-McKenna, M. Understanding capsid assembly and genome packaging for adeno-associated viruses. Future Virol. 12 (6), 283-297 (2017).
- Myers, M. W., Carter, B. J. Assembly of adeno-associated virus. Virology. 102 (1), 71-82 (1980).
- Mingozzi, F., et al. Overcoming preexisting humoral immunity to AAV using capsid decoys. Sci Transl Med. 5 (194), (2013).
- Hoffman, B. E., Herzog, R. W. Covert warfare against the immune system: decoy capsids, stealth genomes, and suppressors. Mol Ther. 21 (9), 1648-1650 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены