Method Article
Aislamiento de vectores virales adenoasociados mediante un protocolo de cromatografía de afinidad con heparina semiautomatizado y de un solo paso
* Estos autores han contribuido por igual
En este artículo
Resumen
Este manuscrito describe un protocolo detallado para la generación y purificación de vectores virales adenoasociados utilizando un método optimizado de cromatografía de afinidad basado en heparina. Presenta un enfoque simple, escalable y rentable, que elimina la necesidad de ultracentrifugación. Los vectores resultantes exhiben una alta pureza y actividad biológica, lo que demuestra su valor en estudios preclínicos.
Resumen
El virus adenoasociado (AAV) se ha convertido en un vector cada vez más valioso para la administración de genes in vivo y actualmente se encuentra en ensayos clínicos en humanos. Sin embargo, los métodos comúnmente utilizados para purificar los AAV utilizan la ultracentrifugación de gradiente de densidad de cloruro de cesio o yodixanol. A pesar de sus ventajas, estos métodos requieren mucho tiempo, tienen una escalabilidad limitada y, a menudo, dan lugar a vectores de baja pureza. Para superar estas limitaciones, los investigadores están centrando su atención en las técnicas de cromatografía. Aquí, presentamos un protocolo optimizado de cromatografía de afinidad basado en heparina que sirve como un paso de captura universal para la purificación de AAV.
Este método se basa en la afinidad intrínseca del serotipo 2 de AAV (AAV2) por los proteoglicanos de sulfato de hepán. En concreto, el protocolo implica la co-transfección de plásmidos que codifican las proteínas deseadas de la cápside AAV con las de AAV2, dando lugar a vectores AAV en mosaico que combinan las propiedades de ambos serotipos parentales. Brevemente, después de la lisis de las células productoras, una mezcla que contiene partículas de AAV se purifica directamente siguiendo un protocolo optimizado de cromatografía de afinidad con heparina de un solo paso utilizando un sistema estándar de cromatografía líquida rápida de proteínas (FPLC). Posteriormente, las partículas de AAV purificadas se concentran y se someten a una caracterización exhaustiva en términos de pureza y actividad biológica. Este protocolo ofrece un enfoque simplificado y escalable que se puede realizar sin necesidad de ultracentrifugación ni gradientes, lo que produce títulos virales limpios y altos.
Introducción
El vector de virus adenoasociado (AAV) se está abriendo camino como uno de los sistemas de administración más prometedores en los estudios actuales de terapia génica. Identificado inicialmente en 19651, el AAV es un virus pequeño, sin envoltura, con una cápside de proteína icosaédrica de unos 25 nm de diámetro, que alberga un genoma de ADN monocatenario. Los AAV pertenecen a la familia Parvoviridae y al género Dependoparvovirus debido a su dependencia única de la coinfección con un virus auxiliar, como el virus del herpes simple o, más frecuentemente, el adenovirus, para completar su ciclo lítico 2,3.
El genoma de 4,7 kilobases de los AAV consta de dos marcos de lectura abiertos (ORF) flanqueados por dos repeticiones terminales invertidas (ITR) que forman los característicos extremos de horquilla en forma de T4. Los ITRs son los únicos elementos de acción cis críticos para el empaquetamiento, la replicación y la integración de AAV, por lo que son las únicas secuencias de AAV retenidas en vectores AAV recombinantes (rAAV). En este sistema, los genes necesarios para la producción del vector se suministran por separado, en trans, lo que permite empaquetar el gen de interés dentro de la cápside viral 5,6.
Cada gen viral codifica diferentes proteínas a través de empalme alternativo y codones de inicio. Dentro de la Rep ORF, cuatro proteínas no estructurales (Rep40, Rep52, Rep68 y Rep78) están codificadas, desempeñando un papel crucial en la replicación, la integración específica del sitio y la encapsulación del ADN viral 7,8. El Cap ORF sirve como molde para la expresión de tres proteínas estructurales que difieren entre sí en su extremo N-terminal, (VP1, VP2 y VP3), que se ensamblan para formar una cápside viral de 60 meros en una proporción de 1:1:10 4,9. Además, un ORF alternativo anidado en el gen Cap con un codón de inicio CUG no convencional codifica una proteína activadora de ensamblaje (AAP). Se ha demostrado que esta proteína nuclear interactúa con las proteínas de la cápside VP1-3 recién sintetizadas y promueve el ensamblaje de la cápside10,11.
Las diferencias en la secuencia de aminoácidos de la cápside explican los 11 serotipos de AAV que ocurren naturalmente y más de 100 variantes aisladas de tejidos humanos y de primates no humanos 7,12,13. Las variaciones en la conformación de regiones estructuralmente variables gobiernan las distintas propiedades antigénicas y las especificidades de unión al receptor de las cápsidas de diferentes cepas. Esto da lugar a distintos tropismos tisulares y eficiencias de transducción a través de diferentes órganos de mamíferos14.
Los primeros métodos de producción de rAAV se basaron en la infección por adenovirus con fines auxiliares 15,16,17,18,19. A pesar de ser eficiente y generalmente fácil de producir a gran escala, surgen varios problemas de esta infección. Incluso después de la purificación y de una etapa de desnaturalización por calor para la inactivación, las partículas adenovirales pueden seguir estando presentes en las preparaciones de AAV, lo que constituye un problema de seguridad no deseado20. Además, la presencia de proteínas adenovirales desnaturalizadas es inaceptable para uso clínico. Otras estrategias de producción aprovechan las cepas recombinantes del virus del herpes simple modificadas para llevar el Rep/Cap y el transgén a las células diana21 o al sistema celular baculovirus-insecto22. Aunque estos sistemas ofrecen ventajas en términos de escalabilidad y compatibilidad con las buenas prácticas de fabricación, todavía se enfrentan a problemas similares.
El método de triple transfección para la producción de rAAV se ha adoptado comúnmente para superar fácilmente estos problemas. Brevemente, el ensamblaje de rAAV se basa en la transfección transitoria de células con tres plásmidos que codifican para: 1) el casete de expresión transgénica empaquetado entre los ITRs del genoma AAV2 de tipo salvaje (pITR); 2) las secuencias Rep/Cap necesarias para la replicación y el ensamblaje del virión (pAAV-RC); y 3) las proteínas adenovirales mínimas (E1A, E1B, E4 y E2A) junto con los ARN asociados al virus del adenovirus necesarios para el efecto auxiliar (pHelper)6,20,23. Si bien los métodos de transfección de plásmidos proporcionan simplicidad y flexibilidad para la producción de rAAV en estudios preclínicos, estos procedimientos tienen limitaciones en términos de escalabilidad y reproducibilidad cuando se aplican a la producción a gran escala. Como enfoque alternativo, la producción de rAAV puede lograrse mediante el uso de líneas celulares productoras de AAV (tanto de crecimiento adherente como en suspensión), que expresan de manera estable los genes Rep/Cap de AAV o Rep/Cap en combinación con construcciones vectoriales. En estos sistemas, los genes auxiliares adenovirales se introducen a través de la transfección de plásmidos. A pesar de que esta estrategia mejora la escalabilidad del proceso de cultivo celular, es técnicamente compleja y requiere mucho tiempo 21,24,25.
En cualquier caso, las células productoras se lisan y se someten a una o varias etapas de purificación. En la actualidad, los principales métodos de purificación de los rAAV incluyen el uso de cloruro de cesio (CsCl) o yodixanol en centrifugación en gradiente de densidad de ultra alta velocidad seguido, o no, por técnicas de cromatografía26. El esquema original de purificación para la precipitación viral utilizaba sulfato de amonio, seguido de dos o tres rondas de ultracentrifugación a través de un gradiente de CsCl. Las principales ventajas de este proceso incluyen la posibilidad de purificar todos los serotipos y la capacidad de separar físicamente las partículas completas de las cápsidas vacías en función de sus diferentes densidades. Este método, sin embargo, es elaborado, requiere mucho tiempo y tiene una escalabilidad limitada, lo que a menudo resulta en un rendimiento deficiente y una baja calidad de la muestra 27,28,29,30. Además, a menudo es necesaria la diálisis frente a un tampón fisiológico antes de los estudios in vivo debido a los efectos tóxicos que el CsCl puede ejercer sobre los mamíferos.
El yodixanol también se ha utilizado como medio de gradiente isoosmótico alternativo para purificar los vectores de rAAV, con ventajas sobre el CsCl desde el punto de vista de la seguridad y la potencia del vector. Sin embargo, al igual que el CsCl, el método de iodixanol presenta algunos inconvenientes relacionados con la capacidad de carga del lisado de cultivo celular (y, por lo tanto, la escalabilidad de la purificación de rAAV) y sigue siendo un método lento y costoso30,31.
Para superar estas limitaciones, los investigadores centraron su atención en las técnicas de cromatografía. En este sentido, se desarrollaron varios enfoques de purificación que incorporan métodos de cromatografía de afinidad, hidrofóbica o de intercambio iónico. Estos métodos se basan en las propiedades bioquímicas de un serotipo particular, incluidos sus receptores naturales, o las características de carga de la partícula viral32. Por ejemplo, el descubrimiento de que AAV2, AAV3, AAV6 y AAV13 se unen preferentemente a los proteoglicanos de heparán sulfato (HSPG), abrió la posibilidad de utilizar la heparina estrechamente relacionada en la purificación por cromatografía de afinidad. Sin embargo, los sitios de unión a HSPG pueden diferir entre serotipos, mediando la unión de AAV y la infección de las células diana de diferentes maneras 2,33,34,35,36. Por otro lado, AAV1, AAV5 y AAV6 se unen al ácido siálico (SA) ligado a N, mientras que AAV4 utiliza SA 2,14,34 ligado a O. Siguiendo la misma lógica, también se ha desarrollado un protocolo de cromatografía de afinidad de un solo paso para la purificación de rAAV5 basado en el uso de mucina, una proteína de mamífero altamente enriquecida en SA37. Al igual que las técnicas basadas en heparina, esta purificación también depende del serotipo específico que se genere. Además de la heparina y la mucina, se han explorado otros ligandos para la cromatografía de afinidad, como el anticuerpo monoclonal A20 y los anticuerpos de dominio único camélidos (AVB Sepharose y POROS CaptureSelect)22,23,38,39,40,41. Otras estrategias innovadoras para mejorar los métodos de purificación previamente existentes implican la introducción de pequeñas modificaciones en la cápside de rAAV para presentar epítopos de unión específicos. Por ejemplo, los rAAV marcados con hexa-histidina o biotinilados pueden purificarse utilizando ligandos que se dirigen a esos epítopos (ácido nitrilotriacético de níquel y resinas de avidina, respectivamente)42,43,44.
En un esfuerzo por ampliar las características deseadas de los rAAV, los investigadores han cruzado los viriones mezclando sus cápsides. Esto se logra mediante el suministro del gen de la cápside de dos serotipos distintos de AAV en proporciones equimolares o diferentes durante la producción, dando lugar a una estructura de la cápside compuesta por una mezcla de subunidades de la cápside de diferentes serotipos 34,45,46,47,48,49,50 . Estudios previos proporcionan evidencia física de que la coexpresión de proteínas de la cápside de AAV2 con AAV1 (relación 1:1) y AAV2 con AAV9 (relación 1:1) da lugar a la generación de vectores mosaico rAAV1/2 y rAAV2/9, respectivamente 45,46,48. Un beneficio importante de la generación de rAAV en mosaico es la capacidad de integrar rasgos ventajosos de diferentes serotipos de AAV, lo que resulta en mejoras sinérgicas en la expresión de transgenes y el tropismo, al tiempo que mantiene otras propiedades útiles durante la producción de rAAV. Curiosamente, ciertas variantes de mosaico incluso exhiben propiedades novedosas diferentes de cualquiera de los virus parentales 46,47,49. Al aprovechar la capacidad de unión a la heparina de AAV2, los vectores de rAAV en mosaico podrían generarse y purificarse mezclando AAV2 con otras cápsides de AAV naturales o nuevas generadas por evolución dirigida y/o diseño racional. No obstante, estudios anteriores han destacado la importancia de la compatibilidad de las subunidades de la cápside cuando se intenta ensamblar vectores de mosaico. Por ejemplo, Rabinowitz y sus colegas demostraron que, aunque la transencapsulsidación de AAV1, AAV2 y AAV3 condujo a un coensamblaje eficiente de cápsidos en mosaico, el cruzamiento de estos serotipos con AAV4 dificultó la generación de viriones estables 34,45,47. Además, AAV1, AAV2 y AAV3 mostraron una baja compatibilidad con AAV5, dada la reducción de los títulos virales obtenidos al mezclar estas cápsidas en diferentes proporciones. Curiosamente, el mosaico rAAV2/5 mostró una disminución de las propiedades de unión a la heparina, al tiempo que mantuvo la capacidad de unión a la mucina como la AAV5 parental. Sin embargo, rAAV3/5 en una proporción de 3:1 preservó la doble unión a la heparina y la mucina. En general, la generación de nuevos rAAV en mosaico con transducción mejorada, tropismo específico o baja inmunogenicidad podría beneficiarse en gran medida de nuestra comprensión del ensamblaje de la cápside y las interacciones de los receptores, con combinaciones específicas que aún requieren una investigación y optimización exhaustivas.
En el presente trabajo, describimos un protocolo paso a paso para la producción y purificación de rAAVs utilizando un método optimizado de cromatografía de afinidad con heparina. Los rAAV se producen por transfección transitoria y se purifican mediante un sistema de cromatografía líquida rápida de proteínas (FPLC). Después de la concentración de las fracciones purificadas seleccionadas, las existencias virales resultantes se caracterizan en términos de título, pureza, propiedades físicas intrínsecas y actividad biológica in vitro e in vivo. Como prueba de concepto, demostramos las mejoras y aplicabilidad de este protocolo para la generación de vectores mosaico rAAV1/2 y rAAV2/9. La elección de cada serotipo se basó en sus tropismos sorprendentemente diferentes, lo que podría conferir sus características únicas también a las versiones en mosaico. El serotipo 1 de AAV, con un tropismo moderado en general para el sistema nervioso central (SNC), tiene la capacidad de transducir neuronas y glía (en menor medida) y experimenta transporte axonal en direcciones anterógrada y retrógrada in vivo 2,7,8. Además, se eligió el serotipo 9 de AAV por su capacidad natural para atravesar la barrera hematoencefálica y dirigirse al SNC tanto en ratones neonatos como adultos51,52. Finalmente, se seleccionó el serotipo 2 de AAV por su capacidad de unirse a la heparina, lo que permitió la cromatografía de afinidad33. Las partículas purificadas rAAV1/2 y rAAV2/9 combinan las propiedades de ambos serotipos parentales de AAV y, por lo tanto, constituyen vectores adecuados para la transducción del SNC 45,46,48,49.
Protocolo
NOTA: Consulte la Figura 1 para obtener una ilustración que resume el protocolo. Consulte la Tabla de materiales para obtener detalles sobre todos los materiales, instrumentos y reactivos utilizados en este protocolo. Todos los trabajos relacionados con células y virus deben realizarse en cabinas e incubadoras de bioseguridad específicos, separados de los que se utilizan habitualmente para el mantenimiento de las líneas celulares. El equipo y los reactivos que entren en contacto con las células cultivadas y los virus deben ser estériles. Es esencial que la eliminación de los reactivos peligrosos y los materiales contaminados con virus se realice de acuerdo con las fichas de datos de seguridad de los materiales y de conformidad con las leyes y directrices nacionales proporcionadas por la oficina de salud y seguridad ambiental de cada institución. A partir de abril de 2019, las directrices de los NIH para la investigación que involucra moléculas de ácido nucleico recombinantes o sintéticos categorizan como agentes del Grupo de Riesgo 1 (no asociados con enfermedad en humanos adultos sanos) todos los serotipos de AAV, así como las construcciones de AAV recombinantes o sintéticas. Esta clasificación se aplica cuando el transgén no codifica un producto génico potencialmente tumorigénico o una toxina, y las construcciones se producen sin un virus auxiliar.
Todos los experimentos con animales se llevaron a cabo de conformidad con la Directiva de la Comunidad de la Unión Europea (2010/63/UE) para el cuidado y uso de animales de laboratorio, transpuesta a la ley portuguesa en 2013 (Decreto Ley 113/2013). Además, los procedimientos con animales fueron aprobados por la Organización Responsable para el Bienestar Animal de la Facultad de Medicina y el Centro de Neurociencia y Biología Celular de la Universidad de Coimbra. Los investigadores recibieron una formación adecuada (curso certificado por FELASA) y una certificación de las autoridades portuguesas (Direcção Geral de Alimentação e Veterinária, Lisboa, Portugal) para realizar los experimentos.
1. Construcciones de plásmidos
- Siga las instrucciones del fabricante de un kit libre de endotoxinas maxiprep para aislar y purificar cantidades sustanciales de ADN de los siguientes plásmidos: i) pITR: el vector de transferencia de interés; ii) plásmido pAAV-RC: pRV1, que contiene las secuencias AAV2 Rep y Cap 36; iii) plásmido pAAV-RC: pH21, que contiene las secuencias Rep y Cap 36 de AAV1; iv) plásmido pAAV-RC: pAAV2/9n, que contiene las secuencias AAV2 Rep y AAV9 Cap ; v) pHelper: pFdelta6, plásmido helper de adenovirus36.
- Cribar la integridad de los plásmidos generados realizando las restricciones enzimáticas recomendadas36. Monitorizar la integridad de los plásmidos pITR por digestión con SmaI, una endonucleasa de restricción, que corta dos veces dentro de una porción inestable de los ITRs53,54.
NOTA: Dado que los ITRs son altamente inestables y susceptibles a las deleciones, se recomienda el uso de células supercompetentes SURE 2 para minimizar la recombinación en estos sitios.
2. Cultivo celular
- Cultivo de riñón embrionario humano 293, que expresa de forma estable la línea celular SV40 de antígeno T grande (HEK293T) en el nivel de glucosa alta Modified Eagle Medium (DMEM) de Dulbecco, suplementado con un 10% de suero fetal bovino y un 1% de penicilina-estreptomicina, a 37 °C, bajo una atmósfera humidificada que contiene 5% de CO2, como punto de partida para los pasos posteriores.
- Subcultive las células utilizando solución salina tamponada con fosfato (PBS) estéril 1x, pH 7,4, para lavar las células antes de añadir ácido tripsina-etilendiaminotetraacético (EDTA) al 0,05%.
NOTA: Evite utilizar celdas que hayan pasado por un número excesivo de pasajes (máximo de 20). Analice regularmente los cultivos celulares para detectar contaminación por micoplasma.
3. Producción de rAAV por transfección transitoria
- Día 1: Recubrimiento de celdas
- Para cada producción viral, se colocan las células HEK293T en 10 placas de cultivo tratadas (15 cm de diámetro) el día antes de la transfección, a una densidad de 10,5 × 106 células por placa en 22 mL de medio de cultivo suplementado e incubar durante 24 h hasta que las células estén 70%-80% confluentes y listas para la transfección.
- Día 2: Transfección celular con polietilenimina (PEI)
- Para cada producción viral (equivalente a 10,5 placas), configure la siguiente mezcla de transfección en un tubo de microcentrífuga: 54,6 μg de pITR; 45,675 μg de pRV1; 45,675 μg de pH21 o pAAV2/9n; 109,2 μg de pFdelta6. Mezclar dando golpecitos.
- Agregue la mezcla a 4.557 mL de DMEM no suplementado en un tubo de centrífuga de 50 mL. Mezclar dando golpecitos.
- Añadir 1,365 mL de solución estéril de PEI a 1 mg/mL (pH 7,4), gota a gota. Mezclar dando golpecitos. Incubar durante 10 min a temperatura ambiente para permitir la formación de complejos ADN-PEI.
- Agregue esta mezcla a 231 mL de DMEM suplementado precalentado. Reemplace todo el medio de cultivo de cada plato con 22 mL de esta mezcla de transfección. Incubar las células durante 48 h.
NOTA: Este paso debe realizarse con cuidado para evitar el desprendimiento de la célula.
- Día 4: Recolección de células
- Cuando el pITR codifica un indicador fluorescente, visualice las células transfectadas bajo un microscopio de fluorescencia.
- Recoja el medio de cada plato en tubos de centrífuga de 50 ml y centrifugue a 800 × g durante 10 minutos. Deseche el sobrenadante.
NOTA: Este paso es opcional y tiene como objetivo recuperar las células transfectadas que pueden haberse desprendido debido a una confluencia muy alta. - Agregue 10 ml de PBS precalentado a cada plato. Retire suavemente las células con un raspador de células y recoja la suspensión en los tubos de centrífuga de 50 ml del paso 3.3.2.
- Lave 5 platos a la vez con 10 ml adicionales de PBS y transfiera la suspensión a los tubos de centrífuga de 50 ml del paso 3.3.3. Granular las células a 800 × g durante 10 min y desechar el sobrenadante.
- Congele los gránulos de celda a -80 °C.
NOTA: Los gránulos de celda pueden almacenarse durante varios meses (punto de pausa).
4. Extracción de rAAV y purificación de FPLC
- Día 5: Preparación del lisado celular
- Descongele los gránulos de celda a temperatura ambiente. Vuelva a suspender las células recogidas de las 10 placas en 100 mL de un tampón estéril que contenga 150 mM de cloruro de sodio (NaCl) y 20 mM de Tris, pH 8,0, en agua ultrapura (tipo I). Mezcle la suspensión pipeteando hacia arriba y hacia abajo, para asegurar una suspensión homogénea.
- Añadir 12,5 mL de una solución estéril recién preparada de desoxicolato de sodio al 10% en agua ultrapura para inducir la lisis celular. Mezclar pipeteando hacia arriba y hacia abajo.
NOTA: Deseche el desoxicolato de sodio, así como los materiales que estén en contacto con él, de acuerdo con la ficha de datos de seguridad del material y las directrices proporcionadas por la oficina de seguridad y salud ambiental de la institución. También se recomienda usar una mascarilla facial mientras se manipula este polvo. Después de mezclar, la solución se vuelve altamente viscosa. - Añadir 27 μL de benzonasa nucleasa a la mezcla anterior. Mezcle bien pipeteando hacia arriba y hacia abajo hasta que la muestra ya no sea viscosa. Incubar a 37 °C durante 1 h, realizando un vórtice cada 10 min.
NOTA: Esta endonucleasa es capaz de degradar eficientemente todas las formas de ADN y ARN sin exhibir ninguna actividad proteolítica. - Eliminar los restos celulares centrifugando la mezcla a 3.000 × g durante 60 min a 25 °C. Filtre el sobrenadante con un filtro de jeringa estéril de difluoruro de polivinilideno (PVDF) de 0,45 μm y transfiéralo a un nuevo recipiente estéril.
NOTA: Este importante paso asegura que se elimine la mayor parte de los desechos celulares, evitando así la obstrucción de las columnas de cromatografía. Guarde una pequeña alícuota de esta mezcla para su análisis (paso opcional).
- Día 5 (continuación): Purificación de rAAVs en columna de heparina
NOTA: La aplicación de muestras se puede realizar utilizando una bomba de muestra o un superloop de 50 mL o 150 mL como parte del sistema. Dado que se disuelve más aire a temperaturas más bajas, es importante dejar tiempo suficiente para que los tampones y las soluciones (generalmente almacenados a 4 °C) se aclimaten a la temperatura ambiente antes de su uso en el sistema FPLC.- Opcional: Si el sistema se ha almacenado durante largos períodos, llene el sistema y todas las entradas con una solución de almacenamiento recién preparada (etanol al 20%) siguiendo instrucciones manuales o un método predefinido de limpieza del sistema en el lugar (CIP del sistema).
- Lave completamente la ruta de flujo de líquido con agua ultrapura estéril siguiendo instrucciones manuales o un método CIP del sistema predefinido.
- Conecte una columna de heparina preempaquetada de 1 mL, configure la alarma de presión y lave con cinco volúmenes de columna (CV) de agua ultrapura a un caudal de 1 mL/min.
- Cambie las soluciones de la bandeja tampón de agua ultrapura a tampón A (solución estéril de 100 mM de NaCl y 20 mM de Tris, pH 8, en agua ultrapura) para la entrada A (bomba del sistema A) y al tampón B (solución estéril de 500 mM de NaCl y 20 mM de Tris, pH 8, en agua ultrapura) para la entrada B (bomba del sistema B). Si el sistema tiene una bomba de muestreo, coloque la entrada de tampón de la válvula de entrada de muestra en el tampón A.
- Lave la bomba del sistema B con el tampón B y llene el resto de la trayectoria del flujo de líquido con el tampón A.
NOTA: Si es necesario, desconecte la columna de la ruta de flujo y vuelva a conectarla después. - Inserte un tubo de entrada de muestra de la válvula de entrada de muestra, por ejemplo, S1, en el recipiente con la preparación viral obtenida en el paso 4.1.4. (de la preparación de lisado celular). Prepare la ruta de flujo desde la entrada de muestra S1 hasta la válvula de inyección con la solución de muestra. Alternativamente, llene un superloop de 50 mL o 150 mL con la muestra que contiene rAAV usando una jeringa de 50 mL.
- Equilibre la columna con un volumen total de cinco CV utilizando el 12,5% del tampón B a una velocidad de 1 mL/min.
- Aplique el volumen total de la muestra en la columna utilizando la bomba de muestreo (seleccione inyectar toda la muestra con sensor de aire) o el superloop a 0,5 mL/min y recoja el flujo utilizando el puerto de salida en un nuevo recipiente estéril.
NOTA: Cuando la función de control de flujo para evitar la sobrepresión está habilitada, el flujo disminuirá automáticamente en caso de obstrucción de la columna. Si el caudal cae significativamente por debajo de 0,5 mL/min, detenga la aplicación de la muestra, realice un lavado con 2-5 CV de tampón A y, a continuación, reanude la aplicación de la muestra. - Lavar la columna a 1 mL/min con 20 CVs de tampón A, recogiendo el caudal mediante el puerto de salida.
- Eluir la muestra a 1 mL/min con el siguiente esquema: i) gradiente lineal con un objetivo del 50% del tampón B para cinco CV; ii) paso con un objetivo del 90% de tampón B durante cinco CV; iii) paso con un objetivo del 100% del colchón B durante cinco CV.
- Recoja la muestra eluida en fracciones de 1 mL utilizando un colector de fracciones y tubos de microcentrífuga de baja retención (2 mL) y guárdelos a -20 °C.
NOTA: Las fracciones rAAV pueden almacenarse durante varias semanas (punto de pausa). - Reequilibrar la columna a 1 mL/min con 12,5% de tampón B para cinco CV.
- Cambie las entradas de las soluciones tampón a agua ultrapura y lave la columna a 1 mL/min durante cinco CV.
- Cambie las entradas de agua ultrapura a etanol al 20% y lave la columna a 1 mL/min durante cinco CV. Desconecte la columna y guárdela a 4 °C.
NOTA: Las columnas se pueden reutilizar varias veces sin ningún otro procedimiento importante de limpieza y desinfección si se utilizan el mismo serotipo y transgén de rAAV. - Lave completamente la ruta del flujo de líquido con etanol al 20% siguiendo instrucciones manuales o un método CIP del sistema predefinido.
5. Concentración de rAAVs purificados
- Día 6: Paso 1 de concentración
- Concentre los rAAV utilizando una unidad de filtro centrífugo de 15 mL con un límite de peso molecular de 100 kDa. Cargue las fracciones deseadas que contengan rAAV (fracciones FPLC 7 a 16) en la unidad de filtro centrífugo de 15 ml y centrifugue a 2.000 × g durante 2 min a temperatura ambiente. Asegúrese de que el volumen concentrado en la unidad de filtro sea de aproximadamente 500 μL. Si el volumen concentrado supera ampliamente los 500 μL, repita los pasos de centrifugación en intervalos de 1 minuto hasta que alcance el volumen deseado.
- Día 6 (continuación): Intercambio de búferes
- Añada 1 mL de PBS estéril a la unidad de filtro centrífugo que contiene los rAAV. Pipetea con cuidado hacia arriba y hacia abajo para lavar el filtro. Centrifugar a 2.000 × g en intervalos de 1 min hasta alcanzar el volumen final de 500 μL.
- Día 6 (continuación): Paso de concentración 2
- Transfiera los 500 μL de rAAV concentrados obtenidos en el paso anterior a una unidad de filtro centrífugo de 0,5 mL con un corte de peso molecular de 100 kDa y centrifugar a 6.000 × g durante 1 min. Si es necesario, repita el paso de centrifugación hasta alcanzar un volumen final inferior a 100 μL.
- Día 6 (continuación): Recuperación
- Para recuperar el rAAV concentrado, coloque el dispositivo de filtro boca abajo en un nuevo tubo de recolección de microcentrífuga. Coloque el tubo en una microcentrífuga con la tapa hacia el centro y realice un centrifugado prolongado dentro de la cámara de flujo para transferir los rAAV concentrados del dispositivo al tubo de microcentrífuga. Alternativamente, centrifugar a 1.000 × g durante 2 min.
- Suplemento con Pluronic F-68 estéril 0,001% (opcional).
NOTA: Pluronic F-68 es un tensioactivo no iónico aprobado para uso humano por la Administración de Alimentos y Medicamentos que es capaz de mitigar las pérdidas de rAAV al prevenir sus interacciones con las superficies de los materiales (plásticos) utilizados durante la preparación de la dilución, la carga de jeringas y el equipo de administración55,56. - Aliquot los rAAV en tubos de microcentrífuga de baja retención y almacenarlos a -80 °C (punto de pausa).
6. Cuantificación de rAAVs purificados
- Día 6 (continuación): Determinar el título de las preparaciones de rAAV, expresado en genomas virales/μL (vg/μL), mediante reacción en cadena de la polimerasa cuantitativa en tiempo real (RT-qPCR) utilizando un kit comercial y siguiendo las instrucciones del fabricante.
- Incubar la solución de partículas rAAV con DNasa I a 37 °C durante 20 min.
NOTA: Este procedimiento promueve la digestión del ADN genómico libre y el ADN plásmido derivado de las células huésped, asegurando así que solo se conserve la secuencia de ácido nucleico dentro de las partículas intactas de rAAV. - Inactivación térmica de la DNasa I a 95 °C durante 10 min.
- Añadir tampón de lisis e incubar durante 10 min a 70 °C para favorecer la desnaturalización por calor de las proteínas de las partículas de rAAV.
- Diluir la solución del genoma rAAV obtenida en tampón de dilución antes de proceder a la RT-qPCR. Prepare un conjunto de patrones diluidos en serie del control positivo (de 2 × 107 vg/μL a 2 × 102 vg/μL) suministrado con el kit.
- Realice una mezcla de reacción que contenga 12,5 μL de mezcla Taq II, 0,5 μL de mezcla de cebador diluida, 7 μL de agua y 5 μL de ADN rAAV diluido (muestra de AAV desconocida y estándares del paso 6.1.4.).
- Realice la RT-qPCR en un sistema de detección de PCR en tiempo real, utilizando el siguiente protocolo: 1 ciclo a 95 °C durante 2 min (desnaturalización inicial) y 40 ciclos a 95 °C durante 5 s (desnaturalización) y 60 °C durante 30 s (recocido, extensión y lectura de placas), seguido de un análisis de la curva de fusión.
- Calcular la concentración absoluta de la muestra a partir de la curva estándar (línea de regresión lineal), considerando el factor de dilución que resulta de la preparación de la muestra rAAV.
NOTA: La cuantificación del número de genomas virales se logra a través de la amplificación de la secuencia ITR de AAV2 (secuencia diana de los cebadores proporcionados por el kit).
- Incubar la solución de partículas rAAV con DNasa I a 37 °C durante 20 min.
7. SDS-PAGE, tinción azul de Coomassie y Western blot
- Desnaturalizar 40 μL de cada muestra (cada fracción de FPLC; el flujo; las muestras previas a la columna y un total de 2,3 ×10 10 vg del producto concentrado final) añadiendo 6 tampones de muestra (0,5 M de Tris-HCl/0,4% dodecil sulfato de sodio (SDS) pH 6,8, 30% glicerol, 10% SDS, 0,6 M de ditiotreitol (DTT), 0,012% azul de bromofenol) e incubando las muestras durante 5 min a 95 °C.
- Cargue las muestras desnaturalizadas (48 μL) en un gel de poliacrilamida SDS (4% de apilamiento y 10% de gel de resolución) y realice la separación electroforética a 100 V durante 70 min, adyacente a una escalera de proteínas.
- Análisis de proteínas
NOTA: Se puede realizar una tinción con azul de Coomassie o un Western blot.- Tinción azul de Coomassie
- Para visualizar las bandas de proteínas, tiña el gel durante 10 minutos con una solución de azul de Coomassie G250 al 0,25% disuelta en metanol al 50% y ácido acético glacial al 10%.
- Realice la eliminación de manchas en gel lavándola varias veces con una solución que contenga un 25% de metanol y un 5% de ácido acético glacial hasta que se vean bandas claras con fondo bajo.
- Capture imágenes utilizando un sistema de imágenes adecuado.
- Western blot
- Transfiera las proteínas a una membrana de PVDF de acuerdo con los protocolos estándar.
- Bloquear la membrana mediante incubación en leche descremada al 5% diluida en TBS-T (0,1% Tween 20 en solución salina tamponada con Tris) durante 1 h a temperatura ambiente.
- Utilice los siguientes anticuerpos primarios (diluidos en solución bloqueante) para la incubación nocturna a 4 °C: anticuerpo monoclonal anti-AAV de ratón, VP1, VP2, VP3 (B1, 1:1.000) o anticuerpo monoclonal anti-AAV monoclonal de ratón, VP1, VP2 (A69, 1:1.000).
- Lavar las membranas durante 3 x 15 min en TBS-T e incubar con un anticuerpo secundario anti-ratón de cabra unido a fosfatasa alcalina (1:10.000), durante 2 h a temperatura ambiente.
- Lave las membranas durante 3 x 15 min en TBS-T. Agregue sustrato quimiofluorescente (ECF) mejorado y visualice las bandas de proteínas mediante imágenes de quimiofluorescencia.
- Tinción azul de Coomassie
8. Microscopía electrónica de transmisión (TEM)
- Coloque una rejilla de malla 200 recubierta de carbono Formvar boca abajo sobre una gota de una muestra de rAAV y deje que se asiente durante 1 minuto.
- Lavar las rejillas con una gota de agua y secar el exceso de líquido con papel de filtro.
- Tiñe negativamente las rejillas con una solución de acetato de uranilo al 1% (pH 7) durante 1 minuto para fijar y contrastar las partículas virales.
- Lavar las rejillas con una gota de agua y secar el exceso de líquido con papel de filtro.
- Examine las muestras en un microscopio electrónico de transmisión.
NOTA: Las concentraciones altas de sal pueden afectar directamente la unión de los rAAV a la red y conducir a la visualización de estructuras cristalinas.
9. Absorción consecutiva de luz ultravioleta-visible, dispersión de luz estática y análisis de dispersión de luz dinámica
- En una placa de cuantificación de 96 pocillos, cargue 2 μL de una muestra de rAAV y 2 μL de PBS para utilizarlos como tampón en blanco (realice esto por duplicado).
- Utilice la aplicación AAV Quant en el software de análisis del cliente, coloque los nombres de las muestras en la ubicación correcta de la placa, seleccione el serotipo AAV y haga clic en Siguiente.
- Cargue la placa de cuantificación de 96 pocillos en el equipo dedicado y proceda con la lectura de la placa para la adquisición de datos.
10. Ensayos de transducción in vitro
- Se pueden utilizar diferentes líneas celulares para analizar rápidamente la eficiencia de transducción de los rAAV.
- Siembra uniformemente células de HEK293T en placas de 24 pocillos (a una densidad de 137.500 células/pocillo) y una línea celular de neuroblastoma-2A (Neuro2a) de ratón en placas de 24 pocillos (50.000 células/pocillo) o en un portaobjetos de cámara de 8 pocillos (27.000 células/pocillo), utilizando DMEM con glucosa alta, suplementada con un 10% de suero fetal bovino y un 1% de penicilina-estreptomicina, como se ha descrito anteriormente. Deje que las células se adhieran durante la noche a 37 °C en una atmósfera humidificada que contenga 5% de CO2.
- Recoja el medio acondicionado de cada pocillo (250 μL de placas de 24 pocillos y 50 μL del portaobjetos de la cámara de 8 pocillos) y guárdelo a 4 °C para su uso posterior.
- Añadir las siguientes preparaciones de rAAV a cada pocillo e incubar las células durante 24 h a 37 °C en una atmósfera con 5% de CO2 .
- Agregue 50 μL de las fracciones F2-F16 recolectadas por FPLC y fluya a través de HEK293T celdas sembradas en placas de 24 pocillos.
- Añadir un total de 5,5 × 109 vg de los rAAVs concentrados diluidos en 50 μL de PBS a las células Neuro2a sembradas en placas de 24 pocillos (incluir un pocillo de control negativo, añadiendo 50 μL de PBS a las células).
- Añadir un total de 2,75 × 109 vg de los rAAVs concentrados diluidos en 25 μL de PBS a las células Neuro2a colocadas en un portaobjetos de 8 pocillos (incluir la condición de control negativo, añadiendo 50 μL de PBS a las células).
- Añadir el medio acondicionado previamente almacenado (paso 10.1.2) a cada pocillo e incubar durante 24 h.
- Deseche el medio y lave las celdas 2 veces con PBS.
- Añadir una solución de paraformaldehído (PFA) al 4%, suplementada con sacarosa al 4% en PBS, precalentada a 37 °C, a cada pocillo e incubar a temperatura ambiente durante 20 min.
- Lavar 2 veces con PBS y almacenar a 4 °C hasta que se realice la obtención de imágenes (punto de pausa).
- Adquiera imágenes en un microscopio de fluorescencia invertida equipado con un objetivo de 10x/0,30, o en un microscopio confocal invertido equipado con un objetivo DIC de aceite de 40x/1,4.
- Para tener un modelo más relevante y reflexivo del entorno in vivo , utilice cultivos neuronales primarios de la siguiente manera:
- Preparar cultivos primarios de neuronas corticales como lo describieron previamente Santos et al.57. En resumen, siembre 200.000 células/mL en placas de 12 pocillos y manténgalas en cultivo hasta el día in vitro 16.
- Recoja el medio acondicionado de cada pocillo (100 μL) y guárdelo a 4 °C para su uso posterior.
- Añadir a cada pocillo los rAAVs a ensayar: un total de 2,75 × 109 vg de los rAAVs concentrados diluidos en 25 μL de PBS (incluir el testigo negativo: 25 μL de PBS). Incubar durante 24 h a 37 °C en una atmósfera con 5% deCO2 .
- Añadir el medio acondicionado previamente almacenado e incubar durante 24 h.
- Deseche el medio en cada pocillo y lave 2 veces con PBS.
- Fije las células con 4% de PFA/4% de sacarosa en PBS, como se describe en el paso 10.1.6. Lavar 2 veces con PBS.
- Incubar cada pocillo con 5 μg/mL de aglutinina de germen de trigo (WGA) conjugada con Alexa Fluor 633 durante 10 min a temperatura ambiente (paso opcional: realizar inmunocitoquímica en su lugar). Lavar 2 veces con PBS.
- Incubar en Triton X-100 al 0,25% en PBS durante 5 min a temperatura ambiente. Lavar con PBS.
- Incubar con 4',6-diamidino-2-fenilindol (DAPI) durante 5 min a temperatura ambiente. Lavar 2 veces con PBS.
- Adquiera imágenes en un microscopio de fluorescencia invertida equipado con un objetivo de 40x/0,95, o en un microscopio confocal invertido equipado con un objetivo DIC de aceite de 40x/1,4.
11. Experimentos in vivo
NOTA: Los animales se alojaron en una sala con temperatura controlada, mantenida en un ciclo de luz/oscuridad de 12 h. Se proporcionaba comida y agua ad libitum. Se hizo todo lo posible para minimizar el sufrimiento de los animales.
- Inyección estereotáxica en el cerebelo
- Anestesiar animales C57BL/6 de 9 semanas de edad por inhalación de isoflurano al 2% en presencia de oxígeno (0,8 L/min) en una cámara conectada a un vaporizador.
- Colocar el animal anestesiado en el aparato estereotáxico (sobre una almohadilla calentada a 35 °C) y colocar la mascarilla de isoflurano en la nariz del animal. Bajar el nivel de isoflurano a 1,3-1,7%.
NOTA: Asegúrese de que el animal esté correctamente anestesiado antes de proceder (pérdida del reflejo de flexión en ambas extremidades traseras). - Aplique ungüento lubricante para los ojos para evitar la sequedad de las córneas e inyecte al animal un analgésico aprobado.
NOTA: Todos los pasos posteriores deben realizarse en condiciones estériles. - Después de afeitar el pelaje de la cabeza del animal y desinfectar el área quirúrgica, exponer el cráneo y colocar la punta de una aguja de inyección de punta roma de 30 G, conectada a una jeringa Hamilton de 10 μL, directamente sobre bregma (use bregma como cero para el cálculo de coordenadas estereotáxicas).
- Mueva la aguja a la coordenada deseada y perfore un agujero a través del cráneo donde entrará la aguja.
NOTA: En el marco de este estudio, se realizó una sola inyección central en el cerebelo. - Inyectar 4 μL de una solución de rAAVs que contenga un total de 8 × 109 vg, diluida en PBS, a una velocidad de perfusión de 0,5 μL/min utilizando un inyector automático. Utilice las siguientes coordenadas, calculadas a partir de bregma, para realizar una sola inyección central en el cerebelo de un ratón C57BL/6 adulto: antero-posterior: -6,5 mm; lateral: 0 mm; ventral: -2,9 mm.
NOTA: Estas coordenadas pueden variar según la cepa del ratón, el sexo y la edad de los animales en uso. - Para minimizar el reflujo y permitir la difusión del vector viral, una vez que se complete la infusión, deje la aguja de la jeringa en estas coordenadas durante 3 minutos, luego retírela lentamente 0,3 mm y deje que permanezca en su lugar durante 2 minutos adicionales antes de su extracción completa del cerebro del ratón.
- Cierre la incisión y límpiela con un agente desinfectante (por ejemplo, povidona yodada al 10%).
- Permita que los animales se recuperen de la anestesia antes de devolverlos a sus jaulas domésticas.
- Recolección y preparación de tejidos
NOTA: En este experimento, los niveles de transducción se observaron 12 semanas después de la inyección, pero el mismo procedimiento pudo evaluarse tan pronto como 4 semanas después de la inyección.- Anestesiar terminalmente a los animales mediante la administración intraperitoneal de una sobredosis de xilacina/ketamina (8/160 mg/kg de peso corporal).
- Perfundir transcardialmente a los animales con PBS helado durante 6 min a una velocidad de 2,5 mL/min, seguido de la perfusión con una solución de PFA al 4% helada recién preparada durante 10 min a la misma tasa.
- Fije los cerebros extirpados en PFA al 4% durante la noche a temperatura ambiente y luego transfiéralos a una solución de sacarosa/PBS al 25% para la crioprotección. Una vez que los cerebros se hundan (aproximadamente 48 h después), guárdelos a -80 °C.
- Corte secciones sagitales seriadas con un grosor de 30 μm utilizando un criostato a -21 °C. Para cada animal, recoja 96 secciones sagitales de un hemisferio cerebral en series anatómicas como secciones flotantes en PBS suplementadas con azida de sodio al 0,05%. Almacenar a 4 °C hasta su posterior procesamiento.
- Inmunohistoquímica de fluorescencia estándar
- Seleccione ocho secciones sagitales por animal, a una distancia de 240 μm entre sí.
- Incubar las secciones de flotación libre en una solución de bloqueo/permeabilización (Triton X-100 al 0,1% que contiene un 10% de suero de cabra normal (NGS) en PBS) durante 1 h a temperatura ambiente.
- Incubar las secciones durante la noche a 4 °C con anticuerpo primario policlonal anti-GFP de pollo (1:1.000).
- Lavar durante 3 x 15 min en PBS e incubar las secciones durante 2 h a temperatura ambiente con el anticuerpo secundario anticuerpo policlonal anti-pollo de cabra conjugado con fluoróforo Alexa Fluor 488 (1:200).
- Lavar durante 3 x 15 min en PBS. Incubar con DAPI durante 5 min a temperatura ambiente.
- Lavar durante 3 x 15 min en PBS. Coloque las secciones en portaobjetos recubiertos de gelatina y cubra con medio de montaje de fluorescencia.
- Adquiera imágenes en un microscopio de fluorescencia con escáner de portaobjetos equipado con un objetivo de 20x/0,8.
Resultados
En este trabajo, presentamos un protocolo detallado para la producción, purificación y caracterización de rAAVs en mosaico (resumidos en la Figura 1), que tienen el potencial de dirigirse y transducir el SNC (por ejemplo, AAV1 y AAV9), siendo simultáneamente adecuados para la purificación por cromatografía de afinidad de heparina (AAV2). Para lograrlo, se utilizaron cápsides de los serotipos 1, 2 y 9 naturales de AAV para desarrollar vectores en mosaico rAAV1/2 y rAAV2/9.
Antes de comenzar, las preparaciones de plásmidos se examinaron para determinar la integridad estructural. Además de las digestiones necesarias para validar la correcta inserción de los fragmentos de clonación, es esencial realizar un cribado coherente de los plásmidos pITR para detectar posibles deleciones/inserciones de ITR. A modo de ejemplo, se monitorizó la integridad de los ITRs en diferentes clones de un plásmido pITR después de la digestión del plásmido con la enzima de restricción SmaI (Figura suplementaria S1).
Ambos tipos de vectores de mosaico se generaron por la co-transfección de los respectivos plásmidos de cápside AAV en una proporción de 1:1, de acuerdo con los métodos de transfección estándar6. En resumen, HEK293T células se transfectaron con i) un plásmido que contenía el transgén de interés empaquetado entre las secuencias de ITR (pITR), ii) un plásmido que contenía los ORF Rep y Cap del genoma AAV de tipo salvaje de AAV2 y AAV1 o AAV9 (plásmidos pAAV-RC) y iii) un plásmido que codifica las proteínas adenovirales (E1A, E1B, E4 y E2A), así como los ARN asociados al virus del adenovirus esenciales para las funciones auxiliares (pHelper). Cuarenta y ocho horas después, se recolectaron las células 6,36 y se purificaron los rAAV a partir del homogeneizado celular mediante cromatografía de afinidad utilizando un sistema FPLC. Como se muestra en la Figura 2A, después del equilibrio de la columna (paso de equilibrio), el lisado de la célula que contiene los rAAV se aplicó a la columna (carga de la muestra). Debido a la afinidad natural de rAAV2 por la heparina33, los rAAV se unieron a la resina de la columna, mientras que otros componentes se llevaron a cabo en el tampón de funcionamiento y fueron detectados por el monitor UV (flowthrough), lo que resultó en un aumento de la absorbancia. Posteriormente, la columna se lavó (etapa de lavado) y los rAAV finalmente se eluyeron mediante un aumento de la concentración de NaCl (etapa de elución). Los virus eluidos fueron detectados por el monitor UV y recogidos en fracciones de 1 mL.
En la Figura 2B y en la Figura Suplementaria S2A se muestra un perfil representativo de picos de elución de rAAV1/2 y rAAV2/9, respectivamente, con diferentes lotes virales que presentan sistemáticamente un único pico desde la fracción F7 hasta F16. La altura del pico varía entre las producciones de rAAV, y los picos más altos generalmente conducen a mayores rendimientos de rAAV. Cada fracción de los rAAV1/2 y rAAV2/9 producidos se caracterizó posteriormente mediante RT-qPCR para evaluar los títulos virales (Figura 2C y Figura Suplementaria S2B).
Para caracterizar la pureza del material eluido, se examinaron 40 μL de cada fracción y del respectivo flujo mediante electroforesis en gel de poliacrilamida SDS al 10% (Figura 2D para rAAV1/2 y Figura suplementaria S2C para rAAV2/9). La tinción con azul de Coomassie reveló tres bandas principales en las fracciones F7-F16, con pesos moleculares correspondientes a las proteínas de la cápside VP1 (87 kDa), VP2 (72 kDa) y VP3 (62 kDa) de los AAV en las proporciones apropiadas 1:1:10, como lo describieron previamente Van Vliet y sus colegas14. En ambos casos, y en base a la absorbancia UV, RT-qPCR y la intensidad de la banda de gel, está claro que la mayoría de los rAAV en mosaico están presentes en las fracciones F7 y F8 y comienzan a disminuir gradualmente en las fracciones F9-F16. Además de las tres proteínas virales de la cápside, se detectó otra proteína (o proteínas) de aproximadamente 17 kDa en las fracciones F8-F16.
Para eliminar esta(s) proteína(s) copurificadora(s), las fracciones F7-16 se filtraron y concentraron posteriormente utilizando unidades de filtro centrífugo de 100 KDa y el título final de rAAV se determinó mediante RT-qPCR (como se muestra en la Figura 3A, B para rAAV1/2). El rendimiento final de una producción de rAAV depende de la longitud y complejidad del pITR, la integridad de las secuencias de ITR, las condiciones de cultivo celular (por ejemplo, el número de pasajes celulares) y la eficiencia de la transfección 24,58,59,60,61. No obstante, el título final se puede ajustar realizando múltiples centrifugaciones de la preparación de rAAV utilizando unidades de filtro centrífugo de 0,5 mL (paso de concentración 2). Siguiendo este protocolo, para un volumen final en el rango de 50 a 100 μL, las concentraciones suelen estar comprendidas entre 2 × 109 y 5 × 1010 vg/μL (cuantificación realizada utilizando el kit de valoración de referencia).
A continuación, se evaluó la pureza de las preparaciones finales de rAAV en un gel de poliacrilamida SDS al 10%. Como se muestra en la Figura 3C, solo se observaron tres bandas que representan las proteínas de la cápside de rAAV para la preparación de rAAV1/2 y no se identificaron proteínas copurificadoras detectables. Estos resultados fueron consistentes con los obtenidos para rAAV2/9 (Figura Suplementaria S2C). Para confirmar la identidad y caracterizar aún más la pureza de los vectores rAAV1/2 y rAAV2/9, se analizaron fracciones virales y stocks concentrados mediante Western blot, con los anticuerpos específicos B1 (Figura Suplementaria S3A y Figura Suplementaria S4A) y A69 (Figura Suplementaria S3B y Figura Suplementaria S4B). Mientras que el anticuerpo B1 reconoce un epítopo C-terminal común a todas las proteínas VP de la mayoría de los serotipos62 de AAV, el clon A69 solo reconoce epítopos de VP1 y VP263. No obstante, también se pueden detectar algunas bandas débiles con pesos moleculares inferiores a VP3 (<62 kDa) en el marcaje B1 y A69.
Para caracterizar la morfología estructural y evaluar más a fondo la pureza de los rAAV, las partículas virales se visualizaron directamente mediante TEM. Esta técnica ha sido el procedimiento estándar para evaluar la integridad y pureza de la muestra en muestras virales, ya que permite la cuantificación de partículas de rAAV vacías y llenas, así como la evaluación de la contaminación en una muestra 29,64,65,66,67. Como se muestra en la Figura 3D, se pudieron observar grandes cantidades de partículas de rAAV, de ~25 nm de diámetro, sobre un fondo limpio. También se pudieron observar partículas vacías (flecha negra) con un centro denso en electrones, así como vectores llenos (flecha blanca) en todo el campo de la muestra.
También realizamos un control de calidad de los rAAV purificados utilizando Stunner, una plataforma que combina espectroscopía ultravioleta-visible (UV-Vis), dispersión de luz estática (SLS) y dispersión de luz dinámica (DLS)68. Para cada muestra, se midió la cantidad total de proteína, ssDNA, así como las impurezas absorbentes y la turbidez de fondo, mediante espectroscopia UV-Vis (Figura 3E y Figura Suplementaria S5A). A continuación, se aplicaron SLS y DLS para evaluar el comportamiento de dispersión de la luz de las cápsidas de rAAV. Dado que los AAV tienen un diámetro medio de 25 nm, las partículas dentro de un rango de diámetro de 15-45 nm se consideran intactas. Las partículas más grandes suelen representar agregados virales, y todo lo más pequeño comprende probablemente partículas pequeñas, incluidas lasproteínas de la cápside sin ensamblar. Para rAAV1/2, se observó un solo pico correspondiente a partículas de cápside intactas a 30 nm (Figura 3F), con 0% de intensidad agregada y 0% de intensidad de partícula pequeña. Para la preparación de rAAV2/9, también se detectó un pico a 30 nm que representa una intensidad de cápside del 78% (Figura suplementaria S5B). A pesar de que la intensidad de partículas pequeñas fue del 0%, para esta muestra, se midió una intensidad agregada del 22% (representada en gris), con la mayor contribución (19,9%) de agregados grandes con un diámetro medio de 620 nm (Figura suplementaria S5B). A través de la combinación de la espectroscopia UV-Vis con la información de SLS y DLS, Stunner reveló el título total general de la cápside, el título de la cápside completa, la proteína libre y agregada, así como el ssDNA libre y agregado para las dos preparaciones virales, que se muestran en la Figura 3G y la Figura Suplementaria S5C (valores específicos indicados en la leyenda de cada figura).
Paralelamente, para evaluar la actividad biológica de los vectores AAV en mosaico desarrollados, HEK293T células se infectaron con 50 μL de cada fracción obtenida por FPLC (F2-F16) de la preparación rAAV1/2 o rAAV2/9. Dado que el vector rAAV1/2 codifica una proteína verde fluorescente (GFP) de cadena simple, bajo el control de un promotor de CMV (pAAV-CMV-ssGFP), y el vector rAAV2/9 codifica una GFP autocomplementaria, bajo el control del promotor de CMV (pAAV-CMV-scGFP53), se examinó la fluorescencia directa de GFP en estas células 48 horas después de la infección (Figura suplementaria S6 y Figura suplementaria S7). De acuerdo con las observaciones previas de RT-qPCR, azul de Coomassie y Western blot, el nivel más alto de infectividad se alcanzó para las fracciones virales F7 y F8, disminuyendo gradualmente en las fracciones F9 a F16.
Para confirmar si la actividad biológica de los rAAV se mantenía después de las etapas de ultrafiltración y concentración, las células Neuro2A, colocadas en placas de 24 pocillos y en un portaobjetos de cámara de 8 pocillos, se infectaron con el vector rAAV1/2 concentrado, que codifica scGFP bajo el control del promotor de CMV (pAAV-CMV-scGFP53). Las imágenes de campo claro y fluorescencia se adquirieron 48 h después de la infección (Figura 4A,B para imágenes de mayor resolución).
Con el objetivo de explorar la capacidad infecciosa de los rAAVs producidos en un modelo celular más relevante y reflexivo, se sembraron cultivos neuronales primarios semidensos de la corteza en una placa de 12 pocillos y se infectaron con el rAAV1/2 - CMV-scGFP utilizado anteriormente. Cuarenta y ocho horas después de la infección, las células se fijaron y marcaron con DAPI y WGA conjugadas con Alexa Fluor 633, Una lectina ampliamente utilizada para marcar células fijas. Las imágenes que se muestran en la Figura 4C,D se adquirieron con un Zeiss Axio Observer Z1 y en un Zeiss confocal LSM 710. Como se muestra en estas figuras mediante fluorescencia directa de GFP, los virus en mosaico concentrados conservan sus propiedades de transferencia de genes para las células neuronales.
Después de haber caracterizado los rAAV en mosaico en términos de pureza, propiedades físicas y funcionalidad in vitro, a continuación evaluamos la posibilidad de utilizar los vectores de mosaico rAAV1/2 purificados para transducir el cerebelo de ratones C57BL/6. Para ello, se realizó una inyección estereotáxica en ratones de 9 semanas de edad y se evaluó la expresión de GFP 12 semanas después. Como se anticipó, los animales inyectados con PBS no mostraron fluorescencia tras el inmunomarcaje de GFP. Las imágenes de epifluorescencia de ratones inyectados con vectores rAAV1/2 que codifican GFP bajo el control del promotor de sinapsina 1 (rAAV1/2 - Syn-ssGFP) revelaron que los vectores rAAV1/2 transducieron con éxito varias regiones del cerebelo, a saber, la región de los núcleos cerebelosos profundos (DCN), así como los diferentes lóbulos del cerebelo (Figura 5). Estos resultados demuestran la expresión prolongada del transgén en el cerebro de los mamíferos (12 semanas).
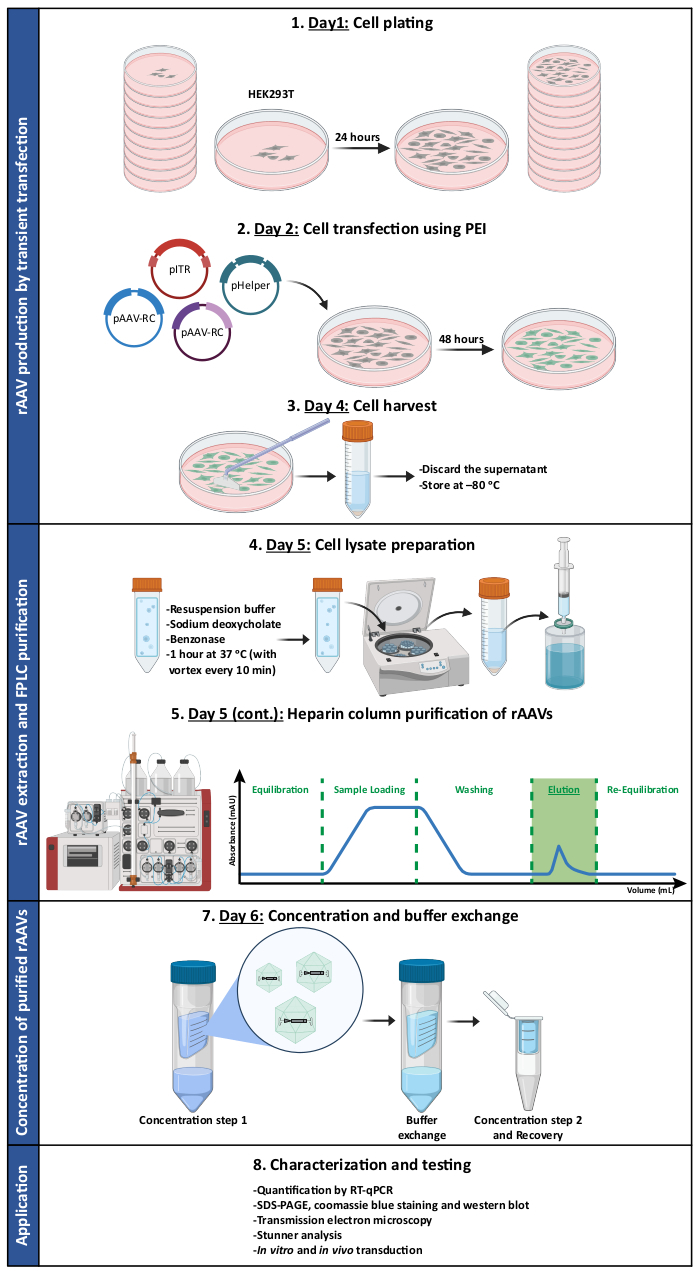
Figura 1: Representación esquemática del protocolo de producción y purificación de rAAV. Los rAAV se producen por transfección transitoria de células HEK293T utilizando polietilenina (PEI). Posteriormente, las células se recolectan y lisan, y los rAAV se purifican a partir del homogeneizado celular mediante cromatografía de afinidad. A continuación, se concentran las fracciones recolectadas que contienen rAAV y se caracterizan las existencias virales finales en términos de título, pureza, características morfológicas y actividad biológica. Abreviaturas: rAAV = virus adenoasociado recombinante; PEI = polietilenimina; RT-qPCR = reacción en cadena de la polimerasa cuantitativa en tiempo real; SDS-PAGE = electroforesis en gel de dodecil sulfato de sodio-poliacrilamida. Haga clic aquí para ver una versión más grande de esta figura.
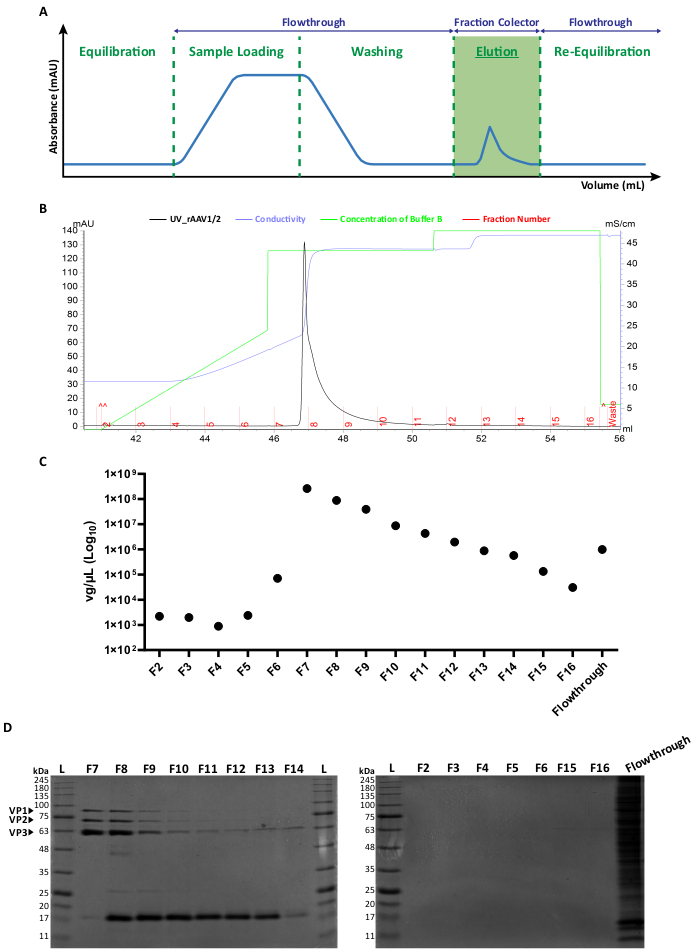
Figura 2: Protocolo de purificación de FPLC y perfil de elución representativo de rAAV1/2. (A) Representación esquemática de un perfil de cromatograma completo, que muestra las diferentes etapas del proceso de purificación de rAAV. Después de un paso de equilibrio de columnas, se aplica la muestra. A continuación, se lava la columna y se realiza la elución con concentraciones crecientes de NaCl. El material no unido (flujo) y las fracciones de 1 mL de los virus eluidos se recogen para su análisis. La absorbancia a 280 nm se expresa en mAU y el eje x indica el volumen en mL. (B) Cromatograma parcial ampliado que muestra un pico de elución de rAAV1/2 (en negro), con los números de fracción correspondientes (F2-F16) y residuos (indicados en rojo). La concentración emitida de tampón B y la conductividad (expresada en mS/cm) también se muestran en verde y morado, respectivamente. (C) RT-qPCR de cada fracción recogida durante la purificación por afinidad (F2-F16) y el flujo. El título en vg/μL se representa en una escala logarítmica. (D) Análisis SDS-PAGE de las fracciones virales recolectadas. Se cargaron volúmenes iguales (40 μL) de cada fracción de la etapa de elución (F2-F16) y el flujo respectivo y se resolvieron en un gel de poliacrilamida SDS al 10%. Las bandas de proteínas se visualizaron mediante tinción con azul de Coomassie. Se indican las bandas correspondientes a las proteínas de la cápside AAV VP1, VP2 y VP3. La escala de tamaño de proteína estándar se designa como (L) y también se indican los pesos moleculares correspondientes. Abreviaturas: rAAV = virus adenoasociado recombinante; RT-qPCR = reacción en cadena de la polimerasa cuantitativa en tiempo real; SDS-PAGE = electroforesis en gel de dodecil sulfato de sodio-poliacrilamida. Haga clic aquí para ver una versión más grande de esta figura.
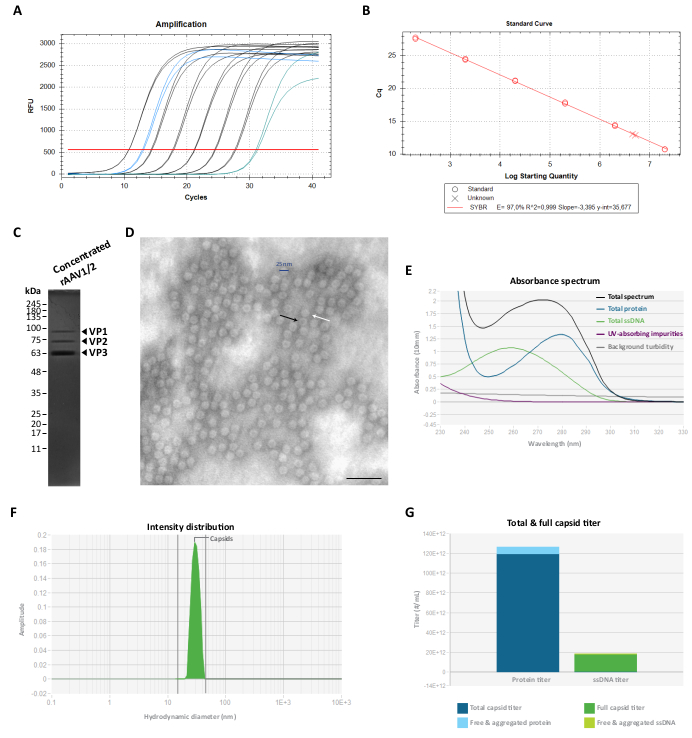
Figura 3: Caracterización de los vectores rAAV1/2 concentrados. (A) Curvas de amplificación de una muestra concentrada de rAAV1/2 (en azul), patrones diluidos en serie de 2 × 107 vg/μL a 2 × 102 vg/μL (en negro) y un control sin plantilla (en verde), obtenidos durante RT-qPCR. (B) Curva estándar (regresión lineal) para la determinación del título de una muestra de rAAV en vg/μL. (C) Análisis SDS-PAGE de las partículas virales concentradas. Un total de 2,3 ×10 10 vg del stock concentrado se agruparon en el gel. (D) Imagen de microscopía electrónica de transmisión de partículas rAAV1/2 con ~25-30 nm de diámetro. Las partículas vacías con un centro denso en electrones (evidenciado por flechas negras) se pueden distinguir de las cápsidas llenas (evidenciado por flechas blancas). Barra de escala = 100 nm. (E) Espectro de absorbancia de una preparación de rAAV1/2 medido por Stunner (en negro). También se muestra el aporte de proteínas (en azul), ssDNA (en verde), otros compuestos absorbentes de rayos UV o impurezas (en morado) y la turbidez de fondo (en gris). (F) Distribución de intensidad DLS de rAAV1/2 con un solo pico a 30 nm, medido por Stunner. Se determinó una intensidad de dispersión de la cápside del 100% midiendo el área bajo la curva de 15 a 45 nm (sombreado en verde). (G) Análisis aturdidor de una preparación vectorial rAAV1/2 que exhibe un título total de cápside de 1,19 × 1014 cp/mL (azul oscuro) y un título de cápside completo de 1,73 ×10 13 vg/mL (verde oscuro). También se midió una proteína libre y agregada de 7,16 × 1012 cp/mL equivalentes (azul claro), así como un ssDNA libre y agregado de 1,04 ×10 12 vg/mL equivalentes (verde claro). Abreviaturas: rAAV = virus adenoasociado recombinante; RT-qPCR = reacción en cadena de la polimerasa cuantitativa en tiempo real; SDS-PAGE = electroforesis en gel de dodecil sulfato de sodio-poliacrilamida; ssDNA = ADN monocatenario; DLS = dispersión dinámica de la luz. Haga clic aquí para ver una versión más grande de esta figura.
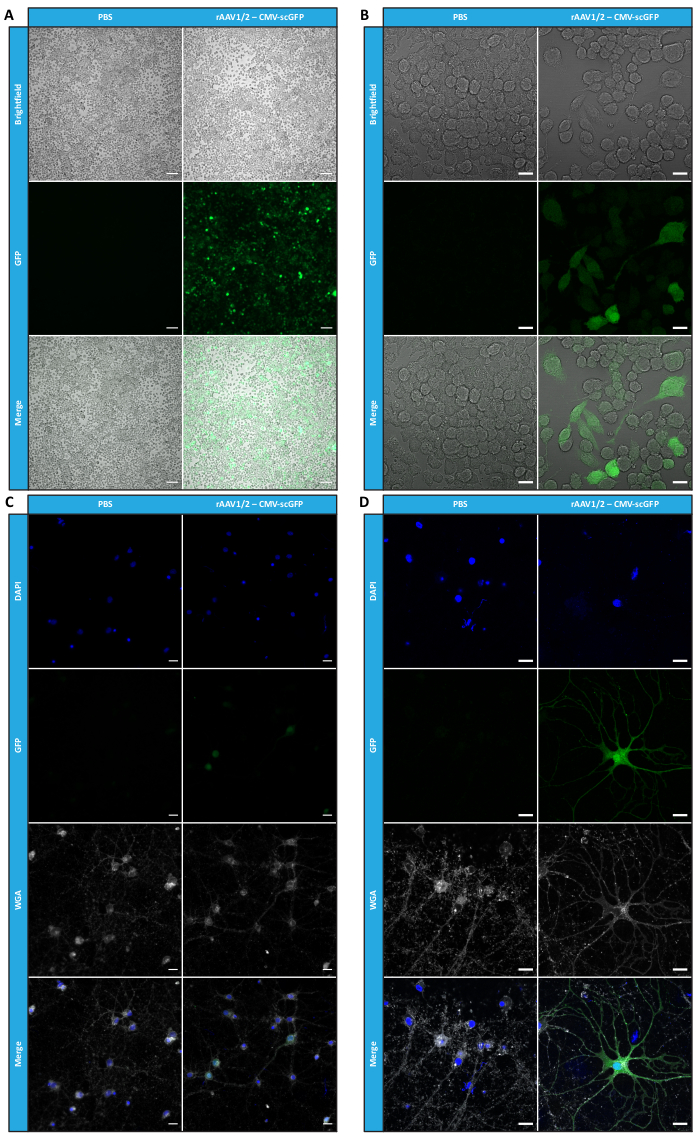
Figura 4: Evaluación de la infectividad in vitro de una muestra concentrada de rAAV1/2. (A) Las células Neuro2A se infectaron con rAAV1/2 - CMV-scGFP o se incubaron con un volumen equivalente de PBS, como control negativo. Imágenes de campo claro y fluorescencia de células obtenidas 48 h después de la infección. Las imágenes se adquirieron en un Zeiss Axio Observer Z1 (objetivo 10x). Barras de escala = 100 μm. (B) Imágenes detalladas de las células Neuro2A 48 h después de la infección con rAAV1/2 - CMV-scGFP. Las imágenes se adquirieron en un Zeiss LSM 710 (objetivo 40x). Barras de escala = 20 μm. (C) Cultivos neuronales primarios semidensos infectados con rAAV1/2 - CMV-scGFP o incubados con un volumen equivalente de PBS, que sirven como control negativo. Las células se marcaron con una tinción nuclear (DAPI en azul) y una tinción de membrana (WGA en blanco). Las imágenes se adquirieron en un Zeiss Axio Observer Z1 (objetivo 40x). Barras de escala = 20 μm. (D) Imágenes detalladas de cultivos neuronales primarios semidensos 48 h después de la infección con rAAV1/2 - CMV-scGFP. Las imágenes se adquirieron en un Zeiss LSM 710 (objetivo 40x). Barras de escala = 20 μm. Abreviaturas: rAAV = virus adenoasociado recombinante; CMV = citomegalovirus; scGFP = proteína fluorescente verde autocomplementaria; PBS = solución salina tamponada con fosfato; DAPI = 4',6-diamidino-2-fenilindol; WGA = aglutinina de germen de trigo. Haga clic aquí para ver una versión más grande de esta figura.
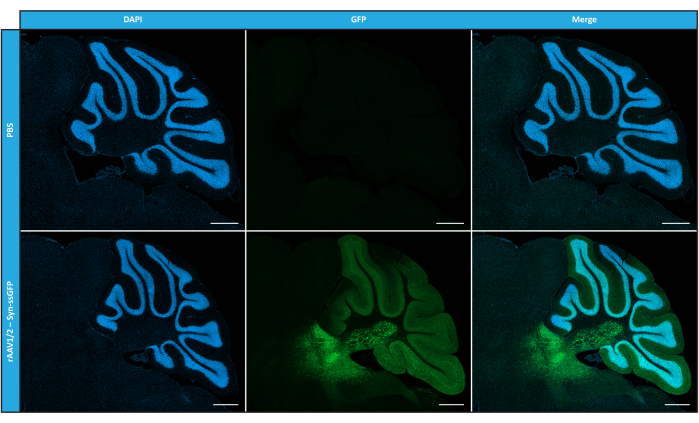
Figura 5: Eficiencia de transducción in vivo de rAAV1/2 después de una inyección intraparenquimatosa. Imágenes representativas de inmunofluorescencia que muestran la expresión generalizada de GFP (en verde) en todo el cerebelo tras una inyección central de rAAV1/2 - Syn-ssGFP en el cerebelo. Los núcleos se tiñeron con DAPI (en azul). Barras de escala = 500 μm. Abreviaturas: rAAV = virus adenoasociado recombinante; syn = sinapsina 1; ssGFP = proteína fluorescente verde monocatenaria; DAPI = 4',6-diamidino-2-fenilindol; PBS = solución salina tamponada con fosfato. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria S1: Análisis en gel de agarosa de un plásmido vector rAAV digerido con SmaI. Seis clones (C1-C6) de un pITR fueron digeridos con la enzima de restricción SmaI (carriles 2, 4, 6, 8, 10 y 12), que corta dos veces dentro de cada repetición terminal invertida. En este caso, se esperaría que una digestión completa de este pITR genere dos bandas (3.796 pb y 3.013 pb). En preparaciones exitosas (C1, C3, C4 y C5) una banda de 6809 pb, resultante de la digestión parcial, todavía es visible (~5% del total). En las preparaciones con recombinación de ITR, las proporciones se invierten (C2) o no se produce la digestión (C6). También se presentan los respectivos clones no digeridos (carriles 3, 5, 7, 9, 11, 13). Abreviaturas: rAAV = virus adenoasociado recombinante; ITR = repetición terminal invertida. Haga clic aquí para descargar este archivo.
Figura suplementaria S2: purificación de rAAV2/9 por cromatografía de afinidad basada en heparina. (A) Perfil de elución de rAAV2/9 con un solo pico (en negro), tras un aumento en la concentración de NaCl. Las fracciones recolectadas se indican con números (2-16) en rojo en la parte inferior del gráfico, la absorbancia a 280 nm se expresa en mAU, la conductividad se expresa en mS/cm y el eje x indica el volumen en mL. (B) títulos de rAAV cuantificados por RT-qPCR para cada fracción agrupada (F2-F16) y flujo. Los valores se representan en una escala logarítmica. (C) Ensayo de pureza por SDS-PAGE y tinción con azul de Coomassie. Los volúmenes iguales (40 μL) de cada fracción (F2-F16) y el flujo respectivo se cargaron y resolvieron en una página SDS del 10%. El stock concentrado se cuantificó mediante RT-qPCR y 2,3 ×10 10 vg se diluyeron en 40 μL de PBS y se agruparon en el gel. Las bandas de proteínas se visualizaron mediante tinción con azul de Coomassie. Las proteínas de la cápside AAV (VP1, VP2 y VP3) están indicadas. La escala de tamaño de proteína estándar se designa con (L) y también se indican los pesos moleculares correspondientes. Abreviaturas: rAAV = virus adenoasociado recombinante; RT-qPCR = reacción en cadena de la polimerasa cuantitativa en tiempo real; SDS-PAGE = electroforesis en gel de dodecil sulfato de sodio-poliacrilamida. Haga clic aquí para descargar este archivo.
Figura suplementaria S3: Análisis de Western blot de vectores rAAV1/2 purificados por FPLC. (A) Las fracciones recolectadas y los vectores concentrados de rAAV1/2 se resolvieron en un gel SDS-PAGE y se probaron con un anticuerpo monoclonal anti-AAV (B1) de ratón que reconoce las proteínas de la cápside VP1, VP2 y VP3. (B) Las fracciones recolectadas y los vectores concentrados rAAV1/2 se resolvieron en un gel SDS-PAGE y se sondearon con un anticuerpo monoclonal anti-AAV de ratón (A69) que reconoce las proteínas de la cápside VP1 y VP2. Abreviaturas: rAAV = virus adenoasociado recombinante; FPLC = cromatografía líquida rápida de proteínas; SDS-PAGE = electroforesis en gel de dodecil sulfato de sodio-poliacrilamida; L = escala de tamaño estándar de proteína. Haga clic aquí para descargar este archivo.
Figura suplementaria S4: Análisis de Western blot de vectores rAAV2/9 purificados por FPLC. (A) Las fracciones recolectadas y los vectores concentrados rAAV2/9 se resolvieron en un gel SDS-PAGE y se probaron con un anticuerpo monoclonal anti-AAV (B1) de ratón que reconoce las proteínas de la cápside VP1, VP2 y VP3. (B) Las fracciones recolectadas y los vectores concentrados de rAAV2/9 se resolvieron en un gel SDS-PAGE y se sondearon con un anticuerpo monoclonal anti-AAV de ratón (A69) que reconoce las proteínas de la cápside VP1 y VP2. Abreviaturas: rAAV = virus adenoasociado recombinante; FPLC = cromatografía líquida rápida de proteínas; SDS-PAGE = electroforesis en gel de dodecil sulfato de sodio-poliacrilamida; L = escala de tamaño estándar de proteína. Haga clic aquí para descargar este archivo.
Figura suplementaria S5: Cuantificación y caracterización del vector rAAV2/9 mediante Stunner. (A) Espectro de absorbancia (negro) de un vector rAAV2/9 medido por Stunner. También se representa la contribución de proteínas (azul), ssDNA (verde), otros compuestos absorbentes de rayos UV o impurezas (púrpura) y la turbidez de fondo (gris). (B) Distribución de intensidad DLS de rAAV2/9 con un pico mayor a 30 nm correspondiente a una intensidad de dispersión de la cápside del 78%, determinada midiendo el área bajo la curva de 15 a 45 nm (sombreada en verde). También se midió una intensidad total de agregados del 22% (sombreada en gris) con una contribución principal de agregados grandes (19,9%) con un diámetro promedio de 620 nm. (C) Análisis aturdidor de una preparación vectorial rAAV2/9 que exhibe un título total de la cápside de 2,18 × 1014 cp/mL (azul oscuro) y un título de cápside completo de 2,35 ×10 13 vg/mL (verde oscuro). En esta preparación también se midió una proteína libre y agregada de 2,92 ×10 13 cp/mL equivalentes (azul claro), así como un ssDNA libre y agregado de 3,14 ×10 12 vg/mL equivalentes (verde claro). Abreviaturas: rAAV = virus adenoasociado recombinante; ssDNA = ADN monocatenario; DLS = dispersión dinámica de la luz. Haga clic aquí para descargar este archivo.
Figura suplementaria S6: Eficiencia de transducción in vitro y viabilidad de las fracciones purificadas de rAAV1/2. HEK293T células que expresan GFP (fluorescencia directa) 48 h después de la transducción con 50 μL de fracciones de FPLC de un vector rAAV1/2 que codifica ssGFP (rAAV1/2 - CMV-ssGFP). Barras de escala = 100 μm. Abreviaturas: rAAV = virus adenoasociado recombinante; FPLC = cromatografía líquida rápida de proteínas; ssGFP = proteína fluorescente verde monocatenaria. Haga clic aquí para descargar este archivo.
Figura suplementaria S7: Eficiencia y viabilidad de la transducción in vitro de las fracciones purificadas de rAAV2/9. HEK293T células se infectaron con 50 μL de cada fracción de FPLC (F2-F16) o flujo a través de un vector rAAV2/9 que codifica scGFP bajo el control del promotor de CMV. Las células que expresan GFP se visualizaron 48 h después de la infección. Barras de escala = 100 μm. Abreviaturas: rAAV = virus adenoasociado recombinante; FPLC = cromatografía líquida rápida de proteínas; scGFP = proteína fluorescente verde autocomplementaria; CMV = citomegalovirus. Haga clic aquí para descargar este archivo.
Discusión
El conjunto de herramientas de vectores AAV, en rápida expansión, se ha convertido en uno de los sistemas de entrega de genes más prometedores para una amplia gama de tipos de células a través de diferentes vías de administración. En este trabajo, nuestro objetivo fue desarrollar un protocolo mejorado para la producción, purificación y caracterización de vectores rAAV en mosaico que pudiera demostrar su utilidad en estudios preclínicos. Para ello, se describe aquí la generación de vectores mosaico rAAV1/2 y rAAV2/9, pero el procedimiento también se puede aplicar para purificar vectores rAAV2 estándar (datos no mostrados).
Los rAAV en mosaico se produjeron siguiendo un método de transfección optimizado utilizando PEI como reactivo de transfección. Se seleccionó un método de transfección transitoria debido a su mayor flexibilidad y rapidez, ventajas considerables en estudios preclínicos en etapas tempranas. Una vez que se han validado un transgén y un serotipo en particular, el sistema de producción se puede ajustar para lograr una mejor escalabilidad y rentabilidad mediante el establecimiento de una línea celular transfectada estable que exprese un subconjunto de los genes Rep/Cap específicos, con genes adicionales proporcionados por un proceso de infección24. En comparación con la transfección de calcio-fosfato, la PEI presenta varias ventajas. Es un reactivo de transfección estable y rentable que funciona eficazmente dentro de un rango de pH más amplio. Además, elimina la necesidad de cambiar el medio celular después de la transfección, lo que resulta en una reducción significativa tanto en el costo como en la carga de trabajo69.
En un intento de eludir algunas de las limitaciones impuestas por los gradientes de CsCl o yodixanol, los rAAV producidos se cosecharon y purificaron mediante cromatografía de afinidad. Esta estrategia ofrece un enfoque simplificado y escalable que se puede realizar sin necesidad de ultracentrifugación ni gradientes, lo que produce títulos virales limpios y altos. De hecho, las técnicas de cromatografía que utilizan un sistema FPLC pueden automatizarse y ampliarse empaquetando más volumen de resina en una columna con una altura de lecho más alta. El protocolo descrito en este documento se puede adaptar fácilmente para incorporar columnas de 5 mL de HiTrap Heparin HP (datos no mostrados). Además, las columnas de heparina pueden reutilizarse varias veces, lo que contribuye a la rentabilidad de este método.
A continuación, se caracterizaron los rAAV purificados en términos de título, pureza, características morfológicas y actividad biológica. Curiosamente, en la tinción con azul de Coomassie, se detectó una banda con aproximadamente 17 kDa en las fracciones F8-F16 además de las tres proteínas típicas de la cápside viral. Sin embargo, esta banda ya no está presente después de la etapa de concentración de los rAAV. Además, también se pueden detectar algunas bandas débiles con pesos moleculares inferiores a VP3 (<62 kDa) en el marcaje B1 y A69, lo que sugiere que podrían ser fragmentos de las proteínas de la cápside VP1, VP2 y VP370. Otra posibilidad es que se trate de otras proteínas copurificadoras como la ferritina u otras proteínas celulares con polipéptidos que comparten huellas proteicas similares a las proteínas de la cápside AAV y podrían estar involucradas en la biología de la AAV, como se sugirió anteriormente 26,71,72.
El análisis TEM y stunner también reveló la presencia de partículas vacías a niveles variables en diferentes producciones. Del mismo modo, otros estudios reportaron previamente la generación de niveles variables y altos (>65%) de cápsidas vacías para rAAVs preparados por métodos de transfección o infección24,73. El mecanismo detrás de la generación de rAAV comienza con la rápida formación de cápsidas vacías a partir de proteínas VP recién sintetizadas, seguido de un lento paso de limitación de velocidad de empaquetamiento del genoma en las cápsides preformadas mediadas por proteínas Rep74,75. Por lo tanto, se generan cápsidas vacías en las producciones de rAAV, aunque la proporción de cápsidas vacías y llenas puede variar dependiendo del tamaño y secuencia del transgén de interés y de las condiciones de cultivo celular58,73. Las cápsidas vacías plantean algunas preocupaciones ya que, al carecer del genoma de interés, no pueden proporcionar un efecto terapéutico y también pueden aumentar potencialmente una respuesta inmunitaria innata o adaptativa. Sin embargo, algunos informes también han demostrado que, al ajustar su proporción, las cápsidas vacías de AAV pueden servir como señuelos altamente efectivos para los anticuerpos neutralizantes específicos de AAV y, por lo tanto, aumentar la eficiencia de la transducción 60,76,77. Si la presencia de cápsidas vacías es críticamente perjudicial y dado el carácter ligeramente menos aniónico de las partículas vacías en comparación con los vectores completos, una posible solución podría implicar la realización de una segunda etapa de purificación de pulido utilizando técnicas de cromatografía de intercambio aniónico64.
Este estudio también proporciona evidencia convincente de que los rAAV en mosaico generados son capaces de transducir de manera eficiente no solo cultivos neuronales in vitro , sino también el SNC tras la inyección intracraneal de rAAV1/2. En general, estos resultados sugieren que el protocolo de producción y purificación descrito hace que los rAAV de alta pureza y biológicamente activos estén listos para usar en 6 días, presentándose como un método versátil y rentable para la generación de rAAV en estudios preclínicos.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos la colaboración, los conocimientos y la asistencia técnica brindados por la Dra. Mónica Zuzarte, del Instituto de Investigación Clínica y Biomédica de Coimbra (iCBR) y del Centro de Biomedicina y Biotecnología Innovadoras (CIBB), en relación con el análisis TEM de los rAAV. Extendemos nuestro agradecimiento a la Dra. Dominique Fernandes, del Centro de Neurociencia y Biología Celular de la Universidad de Coimbra (CNC-UC) y del Instituto de Investigación Interdisciplinaria de la Universidad de Coimbra (IIIUC), por su inestimable asistencia técnica y sus conocimientos sobre los experimentos de cultivo neuronal primario. Los plásmidos pRV1, pH21 y pFdelta6, esenciales para este estudio, fueron generosamente proporcionados por la Dra. Christina McClure, de la Facultad de Ciencias Médicas de la Facultad de Ciencias de la Vida y Medicina de la Universidad de Aberdeen, por lo que estamos agradecidos. Este trabajo fue financiado por el Fondo Europeo de Desarrollo Regional (FEDER), a través del Programa Operativo Regional Centro 2020; a través del Programa Operativo de Competitividad e Internacionalización COMPETE 2020, y fondos nacionales portugueses a través de FCT - Fundação para a Ciência e a Tecnologia, en el marco de los proyectos: UIDB/04539/2020, UIDP/04539/2020, LA/P/0058/2020, ViraVector (CENTRO-01-0145-FEDER-022095), Imagene (PTDC/BBB-NAN/0932/2014 | POCI-01-0145-FEDER-016807), Reset - IDT-COP (CENTRO-01-0247-FEDER-070162), Lucha contra el Sars-CoV-2 (CENTRO-01-01D2-FEDER-000002), BDforMJD (CENTRO-01-0145-FEDER-181240), ModelPolyQ2.0 (CENTRO-01-0145-FEDER-181258), MJDEDIT (CENTRO-01-0145-FEDER-181266); por el Fondo Portugués Americano de Investigación Biomédica (APBRF) y el Fondo de Investigación de la Enfermedad Richard Chin y Lily Lock Machado-Joseph, ARDAT en virtud del acuerdo de subvención n.º 945473 de la IMI2 JU, con el apoyo de la UE y la EFPIA; El proyecto GeneT-Teaming 101059981 apoyado por el programa Horizonte Europa de la Unión Europea. M.M.L. contó con el apoyo de 2021.05776.BD; C.H. contó con el apoyo de 2021.06939.BD; A.C.S. contó con el apoyo de 2020.07721.BD; y D.D.L. fue apoyado por 2020.09668.BD. La Figura 1 se creó utilizando BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 10% povidone-iodine | Medline | MDS093943 | |
| 12-well plates | Thermo Scientific | 11889684 | |
| 24-well plates | VWR | 734-2325 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen | D1306 | |
| 96-well Stunner plate | Unchained Labs | 701-2025 | 96-well quantification plate for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| AAVpro Titration Kit (for Real-Time PCR) Ver.2 | Takara | 6233 | For determining the titer of AAV using RT-qPCR. This kit contains DNase I, Lysis Buffer, Dilution Buffer, positive control, Taq II mix, primer forward, primer reverse, water |
| Acetic acid glacial | Fisher Chemical | A/0360/PB17 | |
| ÄKTA pure 25 | Cytiva | 29018224 | FPLC system controlled by UNICORN software, version 6.3 |
| Alkaline phosphatase-linked goat anti-mouse | Invitrogen | 31328 | |
| Amicon ultra-0.5 centrifugal filter unit | Merck Millipore | UFC5100 | |
| Amicon ultra-15 centrifugal filter unit | Merck Millipore | UFC9100 | |
| Benzonase Nuclease | Merck Millipore | E1014 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| CFX96 Real-Time PCR detection system | Biorad | 184-5096 | |
| ChemiDoc Touch Imaging System | Bio-Rad Laboratories | 1708370 | |
| Chicken polyclonal anti-GFP primary antibody | Abcam | ab13970 | |
| Coomassie Blue G250 | Fisher Chemical | C/P541/46 | |
| Dithiothreitol (DTT) | Fisher Bioreagents | BP17225 | |
| DMEM | Sigma-Aldrich | D5796 | |
| ECF Substrate for Western Blotting | Cytiva | RPN5785 | |
| FastDigest SmaI | Thermo Scientific | FD0663 | |
| FEI-Tecnai G2 Spirit Biotwin | FEI | Biotwin | Transmission electron microscope |
| Fetal bovine serum | Biowest | S1810 | |
| Fluorescence mounting medium | Dako | S3023 | |
| Formvar-carbon coated 200 mesh grid | TAAB Laboratories Equipment | F077/025 | |
| Gas evacuation apparatus | RWD | R546W | |
| Glycerol | Fisher BioReagents | 10021083 | |
| Goat polyclonal anti-chicken antibody, Alexa Fluor 488 | Invitrogen | A-11039 | |
| Hamilton needle 30G, Small Hub RN Needle, 25 mm, PST3 | Hamilton | 7803-07 | |
| Hamilton syringe (10 µL) | Hamilton | 7653-01 | |
| HEK293T | American Type Culture Collection | CRL-11268 | |
| HiTrap Heparin HP 1 x 5 mL | Cytiva | 17040701 | Pre-packed heparin column |
| HiTrap Heparin HP 5 x 1 mL | Cytiva | 17040601 | Pre-packed heparin column |
| Immobilon-P PVDF Membrane | Merck Millipore | IPVH00010 | |
| Isoflurane | Braun | 469860 | |
| Ketamine | Dechra Pharmaceuticals | N/A | Nimatek |
| Low-retention microcentrifuge tubes (2 mL) | Fisher Scientific | 11906965 | |
| Lunatic & Stunner Client software | Unchained Labs | N/A | Client analysis software version 8.0.1.235. Software for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Methanol | Fisher Chemical | M/4000/FP21 | |
| Mouse monoclonal anti-AAV, VP1, VP2 antibody (A69) | American Research Products | 03-61057 | |
| Mouse monoclonal anti-AAV, VP1, VP2, VP3 antibody (B1) | American Research Products | 03-61058 | |
| Neuro2a | American Type Culture Collection | CCL-131 | |
| Normal goat serum | Gibco | 16210064 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 12738422 | |
| NZYColour Protein Marker II | NZYtech | MB09002 | |
| pAAV-CMV-scGFP | Addgene | 32396 | Addgene plasmid # 32396; http://n2t.net/addgene:32396; RRID:Addgene_32396 |
| pAAV-CMV-ssGFP | Addgene | 105530 | Addgene plasmid # 105530; http://n2t.net/addgene:105530; RRID:Addgene_105530 |
| pAAV2/9n | Addgene | 112865 | Addgene plasmid # 112865; http://n2t.net/addgene:112865; RRID:Addgene_112865 |
| Paraformaldehyde | Acros Organics | 10342243 | |
| PBS | Fisher BioReagents | BP2438 | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Pluronic F-68 Non-ionic Surfactant (100x) | Gibco | 24040032 | |
| Polyethylenimine MAX, MW 40,000 | Polysciences Europe | 24765 | |
| R500 Series Compact Small Animal Anesthesia Machine - Isoflurane | RWD | N/A | |
| Sample Inlet Valve V9-IS | Cytiva | 29027746 | |
| Sample pump P9-S | Cytiva | 29027745 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium chloride | Fisher Scientific | 10428420 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dodecyl sulfate (SDS) | Fisher Bioreagents | BP166 | |
| Sterile PVDF syringe filter | Fisher Scientific | 15191499 | |
| Stunner Platform | Unchained Labs | 700-2002 | Equipment for the consecutive ultraviolet-visible light absorption, static light scattering, and dynamic light scattering analysis of rAAV samples |
| Superloop 150 mL | Cytiva | 18-1023-85 | |
| Superloop 50 mL | Cytiva | 18-1113-82 | |
| SURE 2 supercompetent cells | Stratagene, Agilent Technologies | HPA200152 | |
| Treated culture dishes | Corning | 734-1711 | |
| Tris base | Fisher BioReagents | BP152 | |
| Tris hydrochloride | Fisher BioReagents | BP153 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin-EDTA | Gibco | 25200-072 | |
| Wheat Germ Agglutinin (WGA) conjugated with Alexa Fluor 633 | Invitrogen | W21404 | |
| Xylazine | Dechra Pharmaceuticals | N/A | Sedaxylan |
| Zeiss Axio Observer Z1 | Carl Zeiss Microscopy GmbH | N/A | Inverted fluorescence microscope equiped with an EC Plan-Neofluar 10x/0.30 objective and a Plan-Apochromat 40x/0.95 objective |
| Zeiss Axio Scan.Z1 | Carl Zeiss Microscopy GmbH | N/A | Slide scanner fluorescence microscope equipped with a Plan-Apochromat 20x/0.8 objective |
| Zeiss LSM 710 | Carl Zeiss Microscopy GmbH | N/A | Inverted confocal microscope equipped with a Plan-Apochromat 40x/1.4 Oil DIC objective |
| µ-Slide 8 well Ibidi | Ibidi | 80826 | 8-well chamber slide |
Referencias
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Front Mol Neurosci. 7, 1-9 (2014).
- Muzyczka, N. Use of Adeno-Associated Virus as a General Transduction Vector for Mammalian Cells. Viral Expression Vectors. 158, 97-129 (1992).
- Goncalves, M. A. F. V Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43(2005).
- Flotte, T. R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 11 (10), 805-810 (2004).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Ojala, D. S., Amara, D. P., Schaffer, D. V Adeno-Associated Virus Vectors and Neurological Gene Therapy. Neuroscientist. 21 (1), 84-98 (2014).
- Saraiva, J., Nobre, R. J., Pereira de Almeida, L. Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. Journal of Controlled Release. 241, 94-109 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods Mol Biol. 807, 47-92 (2011).
- Sonntag, F., Schmidt, K., Kleinschmidt, J. A. A viral assembly factor promotes AAV2 capsid formation in the nucleolus. Proc Natl Acad Sci U S A. 107 (22), 10220-10225 (2010).
- Sonntag, F., et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes. J Virol. 85 (23), 12686-12697 (2011).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol. 78 (12), 6381-6388 (2004).
- Gao, G., Vandenberghe, L. H., Wilson, J. M. New recombinant serotypes of AAV vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The role of the adeno-associated virus capsid in gene transfer. Methods Mol Biol. 437, 51-91 (2008).
- Clark, K. R., Voulgaropoulou, F., Fraley, D. M., Johnson, P. R. Cell lines for the production of recombinant adeno-associated virus. Hum Gene Ther. 6 (10), 1329-1341 (1995).
- Inoue, N., Russell, D. W. Packaging cells based on inducible gene amplification for the production of adeno-associated virus vectors. J Virol. 72 (9), 7024-7031 (1998).
- Liu, X., Voulgaropoulou, F., Chen, R., Johnson, P. R., Clark, K. R. Selective Rep-Cap gene amplification as a mechanism for high-titer recombinant AAV production from stable cell lines. Mol Ther. 2 (4), 394-403 (2000).
- Mathews, L. C., Gray, J. T., Gallagher, M. R., Snyder, R. O. [23] Recombinant adeno-associated viral vector production using stable packaging and producer cell lines. Methods Enzymol. 346, 393-413 (2002).
- Gao, G., et al. Purification of recombinant adeno-associated virus vectors by column chromatography and its performance in vivo. Hum Gene Ther. 11 (15), 2079-2091 (2000).
- Xiao, X., Li, J., Samulski, R. J. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus. J Virol. 72 (3), 2224-2232 (1998).
- Aponte-Ubillus, J. J., et al. Molecular design for recombinant adeno-associated virus (rAAV) vector production. Appl Microbiol Biotechnol. 102 (3), 1045-1054 (2018).
- Smith, R. H., Levy, J. R., Kotin, R. M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells. Mol Ther. 17 (11), 1888-1896 (2009).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Wright, J. F. Transient transfection methods for clinical adeno-associated viral vector production. Hum Gene Ther. 20 (7), 698-706 (2009).
- Yuan, Z., Qiao, C., Hu, P., Li, J., Xiao, X. A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes. Hum Gene Ther. 22 (5), 613-624 (2011).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Hum Gene Ther Methods. 26 (4), 147-157 (2015).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Anderson, R., Macdonald, I., Corbett, T., Whiteway, A., Prentice, H. G. A method for the preparation of highly purified adeno-associated virus using affinity column chromatography, protease digestion and solvent extraction. J Virol Methods. 85 (1-2), 23-34 (2000).
- Okada, T., et al. Scalable purification of adeno-associated virus serotype 1 (AAV1) and AAV8 vectors, using dual ion-exchange adsorptive membranes. Hum Gene Ther. 20 (9), 1013-1021 (2009).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. J Virol Methods. 183 (2), 139-146 (2012).
- Lock, M., et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale. Hum Gene Ther. 21 (10), 1259-1271 (2010).
- Wang, L., Blouin, V., Brument, N., Bello-Roufai, M., Francois, A. Production and Purification of Recombinant Adeno-Associated Vectors. Adeno-Associated Virus: Methods and Protocols. 807, 361-404 (2011).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated Virus Serotypes: Vector Toolkit for Human Gene Therapy. Molecular Therapy. 14 (3), 316-327 (2006).
- Mietzsch, M., Broecker, F., Reinhardt, A., Seeberger, P. H., Heilbronn, R. Differential adeno-associated virus serotype-specific interaction patterns with synthetic heparins and other glycans. J Virol. 88 (5), 2991-3003 (2014).
- McClure, C., Cole, K. L. H., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. JoVE. (57), e3348(2011).
- Auricchio, A., O’Connor, E., Hildinger, M., Wilson, J. M. A single-step affinity column for purification of serotype-5 based adeno-associated viral vectors. Mol Ther. 4 (4), 372-374 (2001).
- Wang, Q., et al. Identification of an adeno-associated virus binding epitope for AVB sepharose affinity resin. Mol Ther Methods Clin Dev. 2, 15040(2015).
- Mietzsch, M., et al. OneBac: platform for scalable and high-titer production of adeno-associated virus serotype 1–12 vectors for gene therapy. Hum Gene Ther. 25 (3), 212-222 (2014).
- Mietzsch, M., et al. Characterization of AAV-specific affinity ligands: consequences for vector purification and development strategies. Mol Ther Methods Clin Dev. 19, 362-373 (2020).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2023).
- Koerber, J. T., Jang, J. -H., Yu, J. H., Kane, R. S., Schaffer, D. V. Engineering adeno-associated virus for one-Step purification via immobilized metal affinity chromatography. Hum Gene Ther. 18 (4), 367-378 (2007).
- Zhang, H. -G., et al. Addition of six-His-tagged peptide to the C terminus of adeno-associated virus VP3 does not affect viral tropism or production. J Virol. 76 (23), 12023-12031 (2002).
- Arnold, G. S., Sasser, A. K., Stachler, M. D., Bartlett, J. S. Metabolic biotinylation provides a unique platform for the purification and targeting of multiple AAV vector serotypes. Mol Ther. 14 (1), 97-106 (2006).
- Rabinowitz, J. E., et al. Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol. 78 (9), 4421-4432 (2004).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Mol Ther. 7 (3), 419-425 (2003).
- Choi, V., McCarty, D., Samulski, R. AAV hybrid serotypes: improved vectors for gene delivery. Curr Gene Ther. 5 (3), 299-310 (2005).
- Nonnenmacher, M., van Bakel, H., Hajjar, R. J., Weber, T. High capsid–genome correlation facilitates creation of AAV libraries for directed evolution. Mol Ther. 23 (4), 675-682 (2015).
- Kimura, K., et al. A mosaic adeno-associated virus vector as a versatile tool that exhibits high levels of transgene expression and neuron specificity in primate brain. Nat Commun. 14 (1), 4762(2023).
- Issa, S. S., Shaimardanova, A. A., Solovyeva, V. V., Rizvanov, A. A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 12 (5), 785(2023).
- Foust, K. D., et al. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27 (1), 59-65 (2009).
- Lopes, M. M., et al. A new protocol for whole-brain biodistribution analysis of AAVs by tissue clearing, light-sheet microscopy and semi-automated spatial quantification. Gene Ther. 29 (12), 665-679 (2022).
- Gray, J. T., Zolotukhin, S. Design and construction of functional AAV vectors. Methods Mol Biol. 807, 25-46 (2011).
- Choi, V. W., Asokan, A., Haberman, R. A., Samulski, R. J. Production of recombinant adeno-associated viral vectors. Curr Protoc Hum Genet. , Chapter 12, Unit 12.9-12.9.21 (2007).
- Bennicelli, J., et al. Reversal of blindness in animal models of leber congenital amaurosis using optimized AAV2-mediated gene transfer. Mol Ther. 16 (3), 458-465 (2008).
- Fischer, M. D., Hickey, D. G., Singh, M. S., MacLaren, R. E. Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods. 27 (4), 150-158 (2016).
- Santos, S. D., et al. Contactin-associated protein 1 (Caspr1) regulates the traffic and synaptic content of α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-type glutamate receptors. J Biol Chem. 287 (9), 6868-6877 (2012).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 7 (1), 122-128 (2003).
- Dong, B., Nakai, H., Xiao, W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther. 18 (1), 87-92 (2010).
- Wright, J. F. AAV empty capsids: For better or for worse. Mol Ther. 22 (1), 1-2 (2014).
- Asaad, W., et al. AAV genome modification for efficient AAV production. Heliyon. 9 (4), e15071(2023).
- Wobus, C. E., et al. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J Virol. 74 (19), 9281-9293 (2000).
- Wistuba, A., Kern, A., Weger, S., Grimm, D., Kleinschmidt, J. A. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol. 71 (2), 1341-1352 (1997).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J Virol Methods. 140 (1-2), 183-192 (2007).
- Brument, N., et al. A versatile and scalable two-step ion-exchange chromatography process for the purification of recombinant adeno-associated virus serotypes-2 and -5. Mol Ther. 6 (5), 678-686 (2002).
- Potter, M., et al. A simplified purification protocol for recombinant adeno-associated virus vectors. Mol Ther Methods Clin Dev. 1, 14034(2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570(2019).
- Yang, Q. -E., et al. Rapid quality control assessment of adeno-associated virus vectors via Stunner. GEN Biotechnology. 1 (3), 300-310 (2022).
- Huang, X., et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 193 (2), 270-277 (2013).
- Salganik, M., et al. Evidence for pH-dependent protease activity in the adeno-associated virus capsid. J Virol. 86 (21), 11877-11885 (2012).
- Dong, B., et al. Proteomics analysis of co-purifying cellular proteins associated with rAAV vectors. PLoS One. 9 (2), e86453(2014).
- Grieger, J. C., Soltys, S. M., Samulski, R. J. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 24 (2), 287-297 (2016).
- Wright, J. Product-related impurities in clinical-grade recombinant AAV vectors: characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Bennett, A., Mietzsch, M., Agbandje-McKenna, M. Understanding capsid assembly and genome packaging for adeno-associated viruses. Future Virol. 12 (6), 283-297 (2017).
- Myers, M. W., Carter, B. J. Assembly of adeno-associated virus. Virology. 102 (1), 71-82 (1980).
- Mingozzi, F., et al. Overcoming preexisting humoral immunity to AAV using capsid decoys. Sci Transl Med. 5 (194), (2013).
- Hoffman, B. E., Herzog, R. W. Covert warfare against the immune system: decoy capsids, stealth genomes, and suppressors. Mol Ther. 21 (9), 1648-1650 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados