Method Article
التقييم النوعي الغليكوني السريع للبروتينات المؤتلفة باستخدام نظام مؤتمت بالكامل
In This Article
Summary
تم تطوير نظام للتحليل الآلي والسريع للجليكان على البروتينات. تقدم هذه المقالة بروتوكول "التحليل النوعي السكري" ، الأمثل لمجموعة واسعة من المستخدمين ، مثل أولئك المشاركين في تحليل هياكل الجليكان في المستحضرات الصيدلانية الحيوية وغيرها من المواد المترافقة.
Abstract
يؤثر غليكوزيل البروتين ، وهو تعديل حاسم بعد الترجمة ، على استقرار وفعالية ومناعة البروتينات المؤتلفة ، بما في ذلك المستحضرات الصيدلانية الحيوية. تظهر هياكل الجليكان عدم تجانس كبير ، يختلف باختلاف أنواع خلايا الإنتاج وظروف الاستزراع وطرق التنقية. وبالتالي ، فإن مراقبة وتقييم هياكل الجليكان للبروتينات المؤتلفة أمر حيوي ، لا سيما في إنتاج المستحضرات الصيدلانية الحيوية. تتميز مصفوفة الليكتين الدقيقة ، وهي تقنية مكملة لقياس الطيف الكتلي ، بحساسية عالية وسهولة الاستخدام. ومع ذلك ، فإنه يتطلب عادة أكثر من يوم لتحقيق النتائج. لتكييفه مع الأبحاث غير المتعلقة بعلم السكر أو تطوير عملية المنتجات الدوائية ، هناك حاجة إلى بديل آلي عالي الإنتاجية. لذلك ، تم تطوير أول نظام تنميط جليكان مؤتمت بالكامل في العالم ، باستخدام مفهوم تقنية "مجموعة الخرز في طرف واحد (BIST)". يسمح هذا النظام بإعداد وتخزين خرز الليكتين المجمد في وحدات من 1000 ، مع أوامر إدخال متوازية قابلة للتخصيص لأغراض مختلفة. تقدم هذه المقالة بروتوكولا عمليا للبحث الذي يتضمن بروتينات مؤتلفة "مؤهلة للجليكو". بعد اختبار تفاعلها ضد 12 اتحادا بولي أكريلاميد جليكان ، تم اختيار 15 محاضرا لزيادة تنوع النظام. بالإضافة إلى ذلك ، تم تحسين عملية وضع العلامات على العينات عن طريق التبديل من Cy3 إلى البيوتين ، مما يقلل من وقت المعالجة الإجمالي بمقدار 30 دقيقة. للتأهل الفوري للبيانات ، يتم عرض إشارات ربط الليكتين كرمز نقطي على الشاشة العلوية. تم تأكيد موثوقية النظام من خلال اختبارات التكرار اليومية واختبارات التكرار واختبارات التخزين طويلة الأجل ، مع معامل اختلاف بنسبة <10٪. يحتوي محلل الجليكو سهل الاستخدام والسريع هذا على تطبيقات محتملة في مراقبة جودة البروتينات السكرية الداخلية لتقييم العلامات الحيوية والتحقق من صحتها. تسهل هذه الطريقة التحليل لأولئك الجدد في علم السكر ، وبالتالي توسيع فائدته العملية.
Introduction
غليكوزيل البروتين هو تعديل حاسم بعد الترجمة يحتاج إلى تقييم في المستحضرات الصيدلانية الحيوية. يمكن أن تختلف ملامح الجليكان للبروتينات بناء على ظروف المزرعة وعمليات التنقية والخلايا المضيفة1. مطلوب أدوات بسيطة لتأهيل الجليكوزيل داخل خط أنابيب العملية الحيوية. تشير التقديرات إلى أن أكثر من 50٪ من البروتينات المفرزة والأغشية في الجسم الحي يتم تعديلها باستخدام جليكان متعدد ، والذي يتغير وفقا لنسب الخلية ومرحلة النمو وحالة المرض ، مثل ظهور الورم الخبيث2. تحمل مراقبة ملامح الجليكان إمكانات كبيرة لتحديد علامات التشخيص الفريدة وأهداف الأدوية. هناك طلب كبير على الأدوات الآلية القادرة على قياس أحجام العينات على نطاق واسع بسرعة للتحقق من هذا الجليكوزيل الشاذ والتحقق من صحته من مئات عينات المرضى في خط أنابيب الاكتشاف.
تم دمج تقنية Microarray في glycomics لتقييم تنميط الجليكان للبروتينات السكرية3. في هذه الطريقة ، يتم تجميد العديد من المحاضرات ، وهي بروتينات ملزمة للجليكان ، على سطح مثل الشريحة الزجاجية. لا تتطلب تقنية تحليل الجليكو القائمة على التفاعل إطلاق الجليكان من البروتينات الأساسية مسبقا ، مما يبسط العملية للباحثين الجدد في مجال تقنية السكر. على الرغم من استخدامه على نطاق واسع ، بالنسبة للتطبيقات الصناعية مثل الإنتاج الحيوي ، كان هناك حاجة إلى نظام آلي قادر على مراقبة الجليكان بسرعة وسهولة لعدد أكبر من أهداف التحليل. لمعالجة هذا الأمر ، تم الإبلاغ سابقا عن نظام تنميط جليكان آلي يعتمد على مفهوم فريد يسمى "مصفوفة الخرز في طرف واحد" (BIST) ، تم تطويره في البداية للتنميط الجيني. يبسط هذا النظام العملية باستخدام أداة تلقائية عالية الإنتاجية من نوع صندوق واحد4. باستخدام النصائح التي يتم فيها ترتيب العديد من حبات الليكتين الثابتة بالتوازي 4,5 ، تم إنشاء طريقة لتحليل هياكل الجليكان المعدلة في البروتينات السكرية وسميت GlycoBIST (يشار إليها فيما يلي باسم "نظام التنميط الغليكان التلقائي") (الشكل 1 أ). يمكن تثبيت الليكتين على 1000 حبة وتجفيفها للحفاظ على النشاط لمدة عام ، قبل وبعد التعبئة في طرف. بمجرد وضع الأطراف والخراطيش التي تحتوي على كواشف مثل الجسم المضاد للستربتافيدين المسمى HRP (SA-HRP) في أداة النموذج الأولي للقياس (جهاز قياس التفاعل الآلي ، انظر جدول المواد) ، يعمل الطرف كماصة تلقائية. يقوم ماسح ضوئي للكشف عن التلألؤ الكيميائي في الجزء الخلفي الداخلي للجهاز بتحديد إشارات ثمانية أطراف في وقت واحد. يتم عرض البيانات الكمية من هذه النصائح الثمانية بشكل مضغوط ومتزامن كرموز نقطية على شاشة اللمس الخاصة بالجهاز للتأكيد السريع لنتائج القياس. علاوة على ذلك ، يتم نقل القيمة الممثلة كحد أقصى للذروة المقاسة من الأداة كبيانات أولية ، وتسمح بالرسوم البيانية من قبل الباحثين الفرديين (الشكل 1 أ ، اللوحة السفلية).
في هذه المقالة ، يصف المؤلفون طريقة محسنة لبروتينات وضع العلامات على البيوتين ، مما يقلل من وقت المعالجة إلى 30 دقيقة. يتم إنتاج البروتينات المستهدفة مسبقا واكتشافها بواسطة SA-HRP (الشكل 1 ب). تم إنشاء طرف GlycoBIST قياسي (طرف متخصص لتوصيف الجليكان التلقائي) مع 15 محاضرا مختارا لتحقيق تنميط جليكان البروتين السكري متعدد الاستخدامات من أجل الشمولية التحليلية.
Protocol
يتم سرد تفاصيل الكواشف والمعدات المستخدمة لهذه الدراسة في جدول المواد.
1. إعداد طرف متخصص لتوصيف الجليكان التلقائي
- أحضر حبات الليكتين المجففة ، المخزنة في 4 درجات مئوية في كيس مغلق ، إلى المقعد واتركها تعود إلى درجة حرارة الغرفة (~ 23 درجة مئوية).
ملاحظة: هذا يمنع التكثيف على الخرز ، مما قد يقلل من جودتها. تم الإبلاغ سابقا عن هذه الطريقة في تحضير حبات تثبيت الليكتين5. - ضع قطعة قماش مضادة للكهرباء الساكنة على المكتب وضع المزيل الثابت المحمول في مواجهة مساحة العمل. هذا يسمح بإجراء العمل اللاحق على مقاعد البدلاء مع حماية الاستاتيكيه (الشكل 2 أ).
- أدخل الخرز في الطرف الفارغ باستخدام ملاقط مضادة للكهرباء الساكنة بحيث يتم وضع حبتين مباعدتين بين حبات تثبيت الليكتين (الشكل 1 أ).
- اضغط برفق على الجزء العلوي من الطرف باستخدام كماشة لإغلاق الفتحة ، مع الحرص على عدم قطع الطرف بعد ملء جميع الخرز (الشكل 2 ب).
ملاحظة: هذا لتثبيت الخرزات داخل الحافة. يوصى بصنع القراص لتجنب قطع الطرف (الشكل 2C). - قم بتصويب الطرف باليد إذا كان مثنيا.
- يخزن الطرف المحضر على حرارة 4 درجات مئوية في كيس محكم الغلق مع مادة مجففة لحين الحاجة.
ملاحظة: قبل استخدام الطرف ، يجب إحضاره إلى درجة حرارة الغرفة قبل فتح الكيس المختوم وإخراجه. تقلل الرطوبة بشكل كبير من تفاعل المحاضرات.
2. إعداد التحليلات
- قم بتعبئة كاشف البيوتينيل مسبقا للتحليل الروتيني.
ملاحظة: للتحليل الروتيني ، من المفيد التعبئة المسبقة لكاشف البيوتينيل (البيوتين- (AC5) 2 Sulfo-Osu ، انظر جدول المواد) في أجزاء صغيرة على النحو التالي للتحليل السريع. يوصى بتجفيف كاشف البيوتينيل وتخزينه ، لأن إستر السكسينيميديل الخاص به عرضة بشكل عام للتحلل المائي.- حل كاشف البيوتينيل في الماء منزوع الأيونات.
- قم بتوزيع 10 ميكروغرام من الكاشف في أنابيب باستخدام ماصة.
- جفف الأنابيب بكاشف البيوتينيل في مكثف فراغ مبرد وقم بتخزينها بمجفف عند 4 درجات مئوية في كيس مقاوم للضوء حتى الاستخدام.
- أضف محلول المادة المراد تحليلها (200 نانوغرام مكافئ بروتين) إلى الأنبوب الذي يحتوي على كاشف البيوتينيل المجفف المحضر في الخطوة 2.1.
ملاحظة: ضع في اعتبارك تركيبة المخزن المؤقت المستخدمة لإذابة وتخفيف التحليلات ، اعتمادا على خصائص كاشف البيوتينيل المستخدم. على سبيل المثال ، تجنب استخدام كواشف الأمين الأولية كمخازن لاقتران الأمين. هذا سيمنع انخفاض كفاءة البيوتينيل للتحليلات. - تخلط جيدا عن طريق الدوامة ، ثم تدور لأسفل (1000 × غرام لمدة 5 ثوان في درجة حرارة الغرفة) في جهاز طرد مركزي منضدية لإسقاط السائل على الغطاء إلى أسفل الأنبوب.
- احتضان الأنابيب لمدة 1 ساعة في درجة حرارة الغرفة ، محمية من الضوء.
- قم بتخفيف العينات البيوتينيلية 10 أضعاف في المخزن المؤقت للفحص (1٪ Triton X-100 ، 0.5 M Glycine ، 1 mM CaCl2 ، و 1 mM MnCl2 في TBS) لتعطيل أي كواشف بوتينيل غير متفاعلة.
ملاحظة: في حالة التفاعلات عن طريق اقتران الأمين ، يتم استهلاك كاشف البيوتينيل غير المتفاعل بواسطة التفاعل مع مخزن مؤقت يحتوي على كاشف أمين أولي مثل Tris في TBS ، مما يمنع البيوتينيل من المحاضرات والمواد الأخرى التي تجمد على الخرز في القياس اللاحق. - احتضان في درجة حرارة الغرفة ، محمية من الضوء ، لمدة 2 ساعة.
- تقييم كفاءة البيوتينيل للتحليلات من خلال النشاف الغربي ، باستخدام الستربتافيدين المسمى HRP كمسبار كشف إذا لزم الأمر. يرجى الرجوع إلى الأدبيات الخاصة بطرق النشاف الغربية6.
3. إعداد الكواشف لتوصيف الغليكان باستخدام جهاز قياس التفاعل الآلي
- تمييع الستربتافيدين المترافق HRP مع حل حجب في نسبة 1: 3000.
- تخلط مع أحجام متساوية من الركيزة A والركيزة B (انظر جدول المواد). استخدم 160 ميكرولتر من الركيزة المختلطة لكل عينة.
- قم بتوزيع محلول الحجب ، وغسل المخزن المؤقت (0.1٪ Triton X-100 / TBS) ، و TBS ، ومحلول الستربتافيدين المترافق HRP ، وكل ركيزة في الآبار المخصصة للخرطوشة مع 10 خزانات سائلة.
ملاحظة: يتم وصف الحجم الموصى به ووضع المحاليل لملء كل بئر من خرطوشة التفاعل أدناه. ومع ذلك ، يمكن تغيير الحلول وترتيب البئر في جهاز قياس التفاعل الآلي حسب الاقتضاء مسبقا.- أضف 0.2 مل من الستربتافيدين المسمى HRP المحضر في الخطوة 3.1. إلى حسنا # 2 باستخدام ماصة. يدعى البئر # 1 من مقدمة الخرطوشة.
- أضف 0.2 مل من محلول الحجب إلى البئر # 3 باستخدام ماصة.
- أضف 1 مل من TBS إلى الآبار # 4 و # 6 باستخدام ماصة.
- أضف 1 مل من المخزن المؤقت للغسيل إلى الآبار # 7 و # 8 باستخدام ماصة.
- أضف 0.16 مل من خليط الركيزة إلى البئر # 10 باستخدام ماصة.
- تأكد من أن الآبار # 1 و # 5 و # 9 فارغة.
- أضف المواد المراد تحليلها المحضرة في الخطوة 2 إلى أنبوب دقيق بغطاء لولبي منخفض البروتين سعة 2 مل.
- افتح الباب الأمامي لجهاز قياس التفاعل الآلي.
- اضبط الخزانات السائلة المحضرة في الخطوة 3.3 ، والنصائح المحضرة في 1 ، والتحليلات المعدة في الخطوة 3.4 في المواضع المخصصة لجهاز قياس التفاعل الآلي (الشكل 2D) على النحو التالي. يتم إجراء كل قياس في اتجاه خط عمودي واحد.
- ضع طرفا واحدا معدا في الخطوة 1 في كل حفرة عند الرمز الأصفر "a" في الشكل 2D.
ملاحظة: مرة أخرى ، إذا تم تبريدها ، أحضر الأطراف إلى درجة حرارة الغرفة قبل فتح الكيس المختوم. تفقد الليكتين إشارتها بشكل كبير بسبب الرطوبة. - أزل غطاء الأنبوب الذي يحتوي على المادة المراد تحليلها في الخطوة 3.4 وأدخله في كل فتحة في الموضع "ب" بالمثل.
- أدخل الخرطوشة التي تحتوي على السائل المحضر في الخطوة 3.3 ، مع الحرص على عدم انسكابها في الموضع "c".
- قم بإزالة "صندوق النفايات" بالكامل في الشكل 2D عندما يكون ممتلئا ، وقم بتفريغ المحتويات في سلة المهملات ، وأعد "صندوق النفايات" إلى موضعه الأصلي.
ملاحظة: يتم جمع النصائح المتفاعلة تلقائيا في "صندوق النفايات" بعد القياس.
- ضع طرفا واحدا معدا في الخطوة 1 في كل حفرة عند الرمز الأصفر "a" في الشكل 2D.
4. التنميط غليكان مع جهاز قياس رد الفعل الآلي
- قم بتشغيل مفتاح الطاقة على جانب الوحدة الرئيسية.
- المس زر "بدء التشخيص" المعروض على الشاشة (الشكل 3 أ). يبدأ برنامج التشخيص الذاتي تلقائيا. بعد فترة ، يكتمل برنامج التشخيص الذاتي ، وتظهر شاشة الصفحة الرئيسية (الشكل 3 ب).
ملاحظة: يمكن إجراء العمليات التالية عن طريق لمس الرموز المعنية. "فحص" لبدء القياس. "الصيانة" لتأكيد أي خطأ في النظام. "السجل" لعرض بيانات القياس السابقة. - المس "الفحص" المعروض على شاشة الصفحة الرئيسية لتحديد البروتوكول (الشكل 3 ب).
- حدد "BAssaySTD" لطريقة الفحص (الشكل 3C) ثم اضغط على "التالي" في أسفل اليمين.
- أدخل اسم العينة (الشكل 3D) لكل عينة حسب الضرورة ثم المس "التالي" في أسفل اليمين.
- أدخل اسم التلميح (الشكل 3E) المستخدم لكل عينة حسب الضرورة ثم المس "التالي" في أسفل اليمين.
- قم بتأكيد الملاحظات على اليمين (الشكل 3F) ، وإذا لم تكن هناك مشكلة ، فالمس "ابدأ" في أسفل اليمين للقياس.
- قم بتأكيد مفتاح الشاشة إلى وضع التشغيل (الشكل 3G) وانتظر حتى يتم تمييز سهم "الانتهاء". إذا لزم الأمر ، المس "استراحة" لإيقاف وضع التشغيل.
ملاحظة: العمليات التي يتم التحكم فيها تلقائيا بواسطة جهاز قياس التفاعل الآلي هي كما يلي: (1) فوهات الماصة الدقيقة التلقائية داخل الجهاز تعلق ثمانية أطراف كحد أقصى في وقت واحد (انظر الرمز الأصفر "a" في الشكل 2D) ؛ (2) نضح / تفريغ المحلول بشكل متكرر في الأنبوب الذي يحتوي على المادة المراد تحليلها لمدة 5 دقائق ؛ (3) نقل إلى حل حجب ونضح / تفريغ لمدة 5 دقائق ؛ (4) نقل إلى TBS ونضح / تفريغ لمدة 2 دقيقة ؛ (5) نقل إلى محلول الستربتافيدين المسمى HRP ونضح / تفريغ 5 دقائق ؛ (6) انقله إلى المخزن المؤقت للغسيل ونضح / تفريغ لمدة 7 دقائق ؛ (7) نقل إلى TBS ونضح / تفريغ لمدة 2 دقيقة ؛ (8) نقل إلى خليط الركيزة ونضح في وقت واحد ؛ (9) مسح التلألؤ الكيميائي لثمانية أطراف في وقت واحد في الجزء الخلفي من الجهاز للحصول على بيانات الذروة ؛ (10) إسقاط النصائح المستخدمة في صندوق النفايات ؛ (11) تعود الفوهة إلى الموضع الأولي. - تأكد من أن الشاشة قد تغيرت إلى وضع النتيجة (الشكل 3H) عند اكتمال القياس. يتم عرض الرموز الثماني في وقت واحد على الشاشة لسهولة التحقق منها.
ملاحظة: المس "المحفوظات" في أسفل اليسار لعرض مخطط المسح الضوئي (الشكل 3I ، J) ، والرسم البياني الشريطي (الشكل 3K ، L) ، والجدول (الشكل 3M) ، والتفاصيل (الشكل 3N) كنتيجة على الشاشة. عرض النتائج من حارات أخرى من القائمة المنسدلة "حارة". - أدخل ذاكرة USB في منفذ USB على جانب الوحدة الرئيسية والمس "تصدير" في أسفل يمين وضع النتيجة لحفظ بيانات جميع الممرات بشكل فردي في ذاكرة USB.
- قم بتصدير البيانات الأولية (الشكل 3M) كملف CSV باستخدام منفذ USB لمزيد من تحليل البيانات والرسوم البيانية الفردية في Excel. تشير "قيمة" الجدول إلى شدة إشارة كل ليكتين. تمثل قيم الشدة القيمة القصوى لبيانات الذروة (الشكل 3I ، J) في مسح النصائح المتفاعلة.
ملاحظة: يمكن تعيين عتبة الاستخراج القصوى. اعتمادا على التحليلات ، قد تكون الإشارة في جزء حبة الفاصل أعلى بشكل عام ، وفي هذه الحالة يتم طرح القيمة في جزء المباعد كخلفية.
النتائج
أولا ، يتم عرض توزيع الإشارة لكل ليكتين لفهم خصائص مجموعة حبة الليكتين. تم إعداد مكتبة من الخرز الثابت بالليكتين (1000 حبة لكل منهما). تم اختيار خمسة عشر خرزة عشوائيا من 1000 وإضافتها إلى طرف واحد. يظهر مخطط نموذجي في الجزء السفلي من الشكل 1 أ ، يمثل تقريبا نفس شدة الإشارة التي لوحظت بين 15 حبة تشل حركة نفس الليكتين. يمكن تطبيق إجراء القياس هذا لتأهيل إنتاج حبة الليكتين المصنوعة يدويا قبل استخدام تنميط الجليكان. على سبيل المثال ، يتم استخدام ستة أطراف للقياس المتزامن لحساب معامل الاختلاف (CV) من الإشارات الموجودة على 90 حبة. ويرد مثال نموذجي في الجدول 1. عندما تم توسيع مكتبة حبات الخرز الثابتة بالليكتين لاستيعاب 28 محاضرا مختلفا ، أظهر 25 من أصل 28 محاضرا قابلية عالية للتكاثر مع سيرة ذاتية أقل من 10٪.
بعد ذلك ، يتم عرض البيانات الخاصة بمجموعة حبات الليكتين التي تحتوي على 15 محاضرات مختلفة. تم اختيار المحاضرات ال 15 الموضحة في الجدول 2 لمجموعة حبات الليكتين. بالإضافة إلى ذلك ، تم قياس 12 بولي أكريلاميد (PAA) أحادي / ثنائي / ثلاثي السكاريد المدرجة في الجدول 3. بعد تقييم موثوقية القياس باستخدام شاشة الترميز النقطي على الشاشة ، تم تصدير البيانات الخام من جهاز قياس التفاعل الآلي (انظر خطوة البروتوكول 4.11) ، وتم إنشاء رسم بياني في Excel باستخدام قيم ذروة التفاعل في كل سكريات (الشكل 4 أ). ثم تم استخدام هذه القيم لتحليل المكونات الرئيسية لتصور العلاقة بين المحاضرات ال 15 المختارة والسكريات المتفاعلة (الشكل 4B ، C). نتج عن ذلك اختلاف واضح في نمط الارتباط لكل ليكتين مقابل 12 سكريات PAA الموضحة في الشكل 4 أ. هنا ، تظهر صلاحية كل إشارة للإشارة إلى القوائم السابقة المتكاملة لخصائص الليكتين والسكاريد 7,8 (راجع أيضا هذه الخصائص في الجدول 2). نظرا لأن AAL يرتبط بمحطة α-Fuc و Sia-Lex و Lex ، أكد تحليل الجليكان التلقائي اعتراف AAL بالجزيئات المحتوية على الفوكوز (الشكل 4A). اعترف SSA و MAL (انظر الجدول 2 للحصول على الأسماء الكاملة للمحاضرات والاختصارات المعطاة) ب Siaα2-6Gal / GalNAc و Siaα2-3Gal ، على التوالي. يمكن أيضا ربط MAL في مجموعة الخرزات ب 3'-O-sulfo-Galβ3GalNAc و LacNAc. وهذا يتفق مع النتائج السابقة التي تم تحليلها باستخدام التعلمالآلي 7 ، حيث يفضل MAL 3'-O-sulfo-Gal بشكل سائد ، في حين أن LacNAc ليس مهيمنا9. تفاعل RCA120 ، وهو محاضر يتعرف على Gal ، بقوة مع محطة β-Gal ، بما في ذلك Lac / LacNAc ، وسمح له بالارتباط ب Siaα2-6Lac ولكن ليس Siaα2-3Lac. كان لدى ECA تفاعل مع LacNAc أعلى بكثير من Lac. كان لدى WFA خصوصية أوسع ، والتي لم تعترف فقط ب α / β-GalNAc ولكن أيضا المحطة الطرفية β-Gal كما تم الإبلاغ عنها 7,10. لم يرتبط GSL II ، الذي يتعرف على GlcNAc و N-glycans ثلاثي / رباعي الهوائيات المجرية ، بأي سكريات باستثناء GlcNAc واحد بين التحليلات المعدة. تفاعل GRFT ، الذي يتعرف على N-glycans من نوع المانوز العالي ، مع α-Man. تم استخدام ABA و Jacalin و MAH بشكل عام للكشف عن O-glycans. نظرا لأن ABA تفضل هياكل Galβ1-3GalNAcα-Thr / Ser (T) و sialyl-T ، فإن ABA في مجموعة الخرزات تفاعلت بقوة مع 3'-O-sulfo-Galβ1-3GalNAc ومرتبطة بشكل ضعيف ب α-GalNAc. كما اعترفت ABA ب β-GlcNAc ، بما يتفق مع التقارير السابقة بشأن الارتباط ب N-glycans7 agalactosylated. يتمتع Jacalin بخصوصية أوسع نسبيا وبالتالي تفاعل مع α-mannose و β-GalNAc و βGal و α-GalNAc و 3'-O-sulfo-Galβ1-3GalNAc. اعترفت MAH على وجه التحديد ب 3'-O-sulfate-Galβ1,3GalNAc كما تم الإبلاغ عنه سابقا7. تعرفت المحاضرات الأربعة المتبقية ، NPA و LCA و PHA-L و PHA-E ، على البنية الداخلية ل N-glycan غير المدرجة في السكريات PAA المحضرة ، وبالتالي لم يكن لها أي تقارب مع جميع المواد التحليلية.
باستخدام البيانات التي تم الحصول عليها ، يمكن توضيح تشابه المحاضرات التي تساهم في الارتباط بكل سكريد عن طريق رسمها على رسم بياني لتحليل المكونات الرئيسية (الشكل 4 ب). تم تمثيل جميع السكريات التي ساهمت في التباين في الشكل 4B بواسطة المتجه الذاتي ، وهي طريقة للتحليل الإحصائي يتم فيها تمثيل نسبة المساهمة بواسطة متجه (الشكل 4C). من الجدير بالذكر هنا أن السكريات المتفاعلة تساهم في كل محاضرة دون تحيز. لا تظهر الليكتين خصوصية لنوع واحد فقط من السكريات. على سبيل المثال ، يتم تحديد وجود جليكان من النوع المعقد من خلال التعرف الجزئي على بعض الجليكان داخل الجليكان من النوع المعقد في البشر. يمكن ل Jacalin ، الذي يتعرف على O-glycans (انظر الخصائص في الجدول 2) ، التعرف على بنية 3'suTF و α-GalNAc بين السكريات المستخدمة في هذه الدراسة ، وبالتالي ، تم رسم 3'suTF و α-GalNAc (الشكل 4C) مقابل اتجاه موضع Jacalin (النقطة البنية) المرسومة في الشكل 4B. يمكن ل WFA التعرف على α / β-GalNAc بين السكريات المستخدمة في هذه الدراسة. لذلك ، تم رسم α / β-GalNAc في الشكل 4C في نفس اتجاه WFA المرسوم في الشكل 4B. في المقابل ، يتم رسم α-GalNAc بين WFA و Jacalin لأنه هيكل سكاريد يمكن ل Jacalin الارتباط به بسهولة. تتوافق جميع السكريات ال 11 المرسومة في هذه الدراسة مع خصوصية (ربط السكريات) للمحاضرات التي تم الإبلاغ عنها سابقا 7,8 ، مما يشير إلى أن الطريقة المقترحة هي طريقة قياس موثوقة. علاوة على ذلك ، يتم تشتيت المتجهات الذاتية المقابلة لكل سكاريد ، مما يدعم أنه تم اختيار 15 محاضرا بأقل قدر من التحيز لضمان تغطية شاملة في التحليل. وبالتالي ، تم تعريف الطرف الذي تم تجديده بهذه المحاضرات ال 15 على أنه طرف GlycoBIST القياسي (الجدول 2).
في المثال الأكثر عملية ، خضعت منتجات البروتين المنقى لقياس الطرف (الشكل 5). تم تحليل الثيروجلوبولين البقري ، الذي يحتوي على موقع N-glycosylation ويحتوي على N-glycans 11 معقد وهجين وعالي المانوز. أشار الطرف القياسي إلى زيادة تفاعل بعض المحاضرات مع السكريات8 (يرجى الرجوع إلى الخصائص في الجدول 2): PHA-E ، الذي يتعرف على تقسيم GlcNAc ؛ GRFT ، التعرف على نوع المانوز N-glycans ؛ SSA ، الاعتراف ب Siaα2-6Gal / GalNAc ؛ RCA120 ، التعرف على اللاكتوز و LacNAc ؛ و AAL ، مع الاعتراف بالفوكوز. توجد هياكل الجليكان هذه في N-glycans المعقدة والهجينة وعالية المانوز ، مما يشير إلى أنه يمكن تقييم بنية N-glycan ل thyroglobulin11 بشكل فعال. علاوة على ذلك ، أظهر ثيروجلوبولين المعالج بالسياليداز أ ، وهو إنزيم يهضم حمض السياليك ، انخفاضا في التفاعل مع SSA ، الذي يتعرف على حمض السياليك ، وزيادة التفاعل مع RCA120 و WFA و ECA ، والتي يتم التعرف عليها بسهولة أكبر بعد إزالة أحماض السياليك. لم يتم الإبلاغ سابقا عن وجود هياكل O-glycan في هرمون الغدة الدرقية البقري. كما هو متوقع ، لم يكن هناك اعتراف ب O-glycan في ثيروجلوبولين مع أو بدون علاج سياليداز في تحليل الجليكان التلقائي.
يظهر اختبار استنساخ داخل التشغيل باستخدام 15 محاضرات مختارة لفهم متانة القياس (الجدول 4). لهذا الاختبار ، تم إعداد سبع نصائح قياسية للتحليلات ونصيحة إضافية للتحكم السلبي ، وتم قياس جميع النصائح الثمانية في وقت واحد. تم تكرار هذا الإجراء ثلاث مرات في يوم واحد. تم إعداد "Mix Analytes" ، وهو مزيج من التحليلات التي أدت إلى الحصول على إشارات مهمة على جميع المحاضرات ، لمراقبة جودة مجموعة الخرز. تمت صياغة تحليلات المزيج عن طريق خلط الإريثروبويتين المهضوم بالسياليداز (EPO) بشكل مناسب ، و EPO المهضوم بالسياليداز والجالاكتوزيداز ، و IgA البشري ، ومصفوفة ميتالوبروتيناز 3 (MMP3) ، وثيروجلوبولين. تم تصنيف كل بروتين سكري (200 نانوغرام) ب 10 ميكروغرام من كاشف البيوتينيل في PBS يحتوي على Triton X-100. إذا لزم الأمر ، تم إجراء علاجات سياليداز وجالاكتوزيداز كما هو موضح في التعليمات. بعد الهضم ، تم تحضين المنتجات في كتلة حرارية عند 75 درجة مئوية لمدة 10 دقائق لتعطيل الإنزيم. تم خلط الكميات المناسبة من البروتينات السكرية البيوتينيلية (3 نانوغرام من EPO ، 8 نانوغرام من IgA البشري ، 5 نانوغرام من MMP3 ، و 15 نانوغرام من ثيروجلوبولين) مباشرة قبل التحليل. أشارت نتائج القياس إلى أن الحد الأقصى لقيمة السيرة الذاتية كان 13.5٪ ، وكان متوسط السيرة الذاتية للمحاضرات ال 15 8.2٪ ، مما يدل على قابلية عالية للاستنساخ.
بالإضافة إلى ذلك ، يظهر اختبار التكاثر اليومي لفهم الاختلافات بسبب تاريخ القياس (الجدول 5). تم إعداد النصائح القياسية والتحليلات المختلطة مسبقا ، وتم تكرار قياسات سبع نصائح يوميا لمدة خمسة أيام متتالية. أظهرت النتائج أن معظم المحاضرات لديها سيرة ذاتية أقل من 10٪. ومع ذلك ، أظهرت بعض المحاضرات ، مثل LCA و ECA ، سيرة ذاتية أعلى. كان متوسط السيرة الذاتية ل 15 محاضرا لكل دورة يصل إلى 7.7٪ ، وكان متوسط قيم السيرة الذاتية على مدار 5 أيام أقل من 10٪ ، مما يدل على قابلية عالية للتكرار. لوحظ أن Jacalin ، بسبب الهضم الذاتي ل MMP3 في Mix Analyte ، أظهر قابلية استنساخ زمنية منخفضة. ومن ثم، يجب تحديد مادة تحليلية أكثر ملاءمة لتحل محل MMP3.
لفهم استقرار حبات الليكتين الثابتة ، يتم عرض اختبار ثبات طويل المدى باستخدام هذه الحبيبات المجففة الثابتة بالليكتين (الجدول 6). تم إعداد النصائح القياسية وكواشف الفحص و Mix Analytes مسبقا ، وتم إجراء القياسات بعد 12 شهرا من التخزين. تم تخزين الأنواع الخمسة المذكورة أعلاه من تحليلات البيوتينيل بشكل فردي وخلطها قبل القياس. أظهرت النتائج أن متوسط السيرة الذاتية للمحاضرات ال 15 كان أقل من 10٪ ، حتى بعد 12 شهرا من التخزين الجاف. يشير هذا إلى جدوى القياسات السريعة والدقيقة عن طريق تخزين العديد من النصائح (حتى 1000) من نفس المجموعة في وقت واحد.
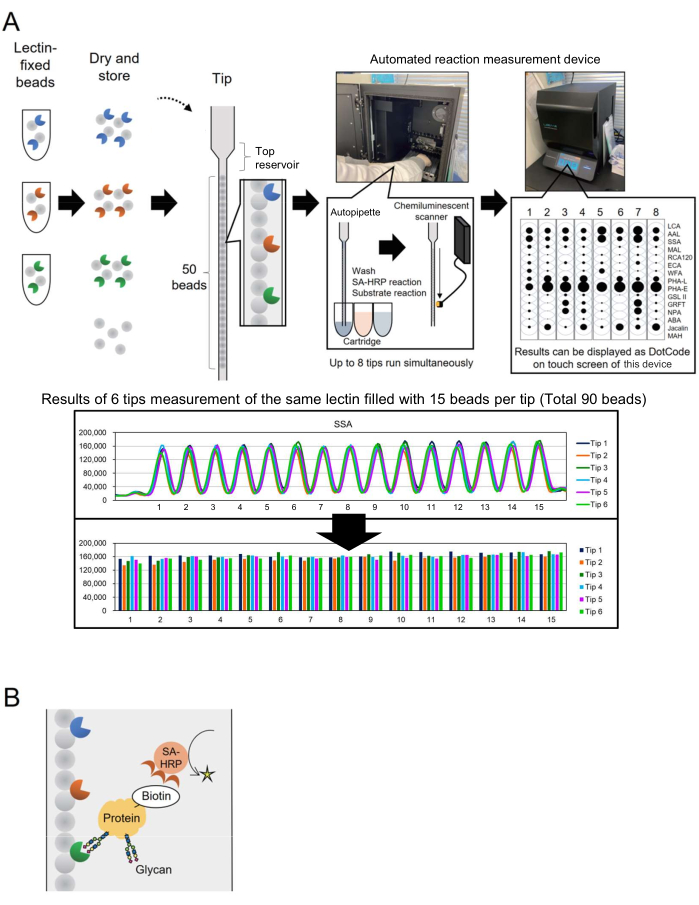
الشكل 1: مخططات أداة "مصفوفة الخرز في طرف واحد" وطريقة التحليل. (أ) مخطط نظام التنميط الغليكان التلقائي. يمكن تجفيف حبات الليكتين الثابتة وتخزينها في نصائح. عندما يتم وضع الأطراف والخراطيش التي تحتوي على كواشف مثل الأجسام المضادة للستربتافيدين (SA-HRP) التي تحمل علامة HRP في أداة القياس (جهاز قياس التفاعل الآلي) وتنشيطها ، يعمل الطرف كماصة تلقائية. يقوم ماسح الكشف عن التلألؤ الكيميائي في الجزء الخلفي من الجهاز بقياس الإشارات من ثمانية أطراف في وقت واحد. يتم عرض البيانات الكمية كرموز نقطية على شاشة اللمس الخاصة بالجهاز للتأكيد السريع لنتائج القياس. يوضح القسم السفلي نتائج قياس 90 حبة بنفس الليكتين. يتم نقل نتائج القياس من الأداة ورسمها بيانيا بواسطة الباحث الفردي. ب: مخطط طريقة الكشف المستخدمة في هذه التجربة. يتم الكشف عن البروتينات المستهدفة مسبقا باستخدام SA-HRP. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صور المواد والإعداد لتوصيف الجليكان التلقائي باستخدام جهاز قياس التفاعل الآلي. (أ) تصوير حبات تثبيت الليكتين وهي معبأة في طرف. التقاط الخرز مع ملاقط الاستاتيكيه على حصيرة الاستاتيكيه وملء الطرف مع الخرز. ب: قرص الطرف بالقراصة. يتم ضغط الجزء العلوي الطفيف من الخرزة العلوية. ج: القراص لتجعيد الأطراف. يتم قرص البلاستيك (الدائرة الصفراء) لمنعها من القص تماما. (د) ترتيب المواد المستخدمة في جهاز قياس التفاعل الآلي. ج: نصائح ، ب: أنبوب يحتوي على تحليلات ، و ج: يجب إدخال خراطيش تحتوي على سائل في مكانها ، على التوالي. في صندوق النفايات ، يتم جمع النصائح المتفاعلة بعد القياس. يمكن إزالة المربع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
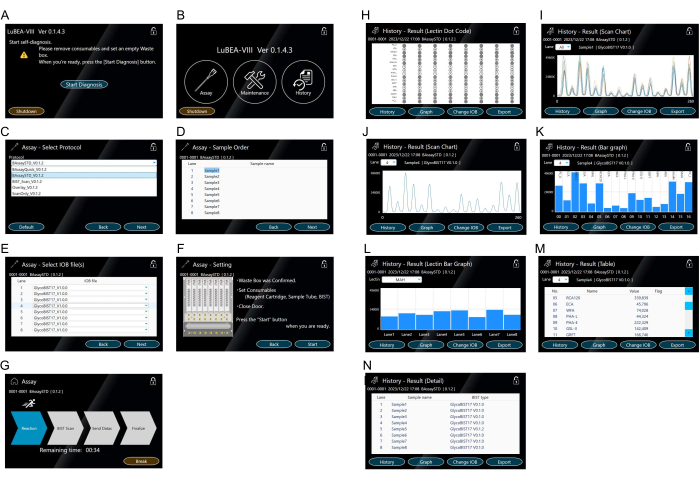
الشكل 3: شاشة تعمل باللمس لمعالجة الماكينة. ( أ) يبدأ برنامج التشخيص الذاتي تلقائيا عند تشغيل الطاقة. (ب) تعرض شاشة الصفحة الرئيسية "الفحص" و "الصيانة" و "التاريخ". (ج-ز) تشغيل وضع "الفحص". اختيار طريقة الفحص (C). يمكن تسجيل بروتوكولات متعددة مسبقا. إدخال ترتيب العينة (التحليل) (د). تحديد نوع الطرف (E). تأكيد إعدادات طريقة الفحص (F) وبدء الفحص من شاشة "بدء الفحص" (G). (ح-ن) تمثيل النتيجة في "التاريخ". يتم عرض رمز نقطة Lectin (H) بعد اكتمال الفحص أو من وضع "المحفوظات". يتم عرض مخطط مسح ضوئي ل 15 محاضرة على الشاشة لجميع العينات (I) أو لكل عينة (J). يتم عرض مخطط المسح الضوئي كرسم بياني شريطي (K). يمكن تحديد المخططات الشريطية للممرات الأخرى من قائمة "حارة" المنسدلة. رسم بياني بالأعمدة يقارن ثمانية ممرات من العينات لكل ليكتين (L). يمكن اختيار محاضرات أخرى من القائمة المنسدلة "Lectin". جدول يوضح القيم الكمية (M). سجل طريقة القياس المنفذة (N). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
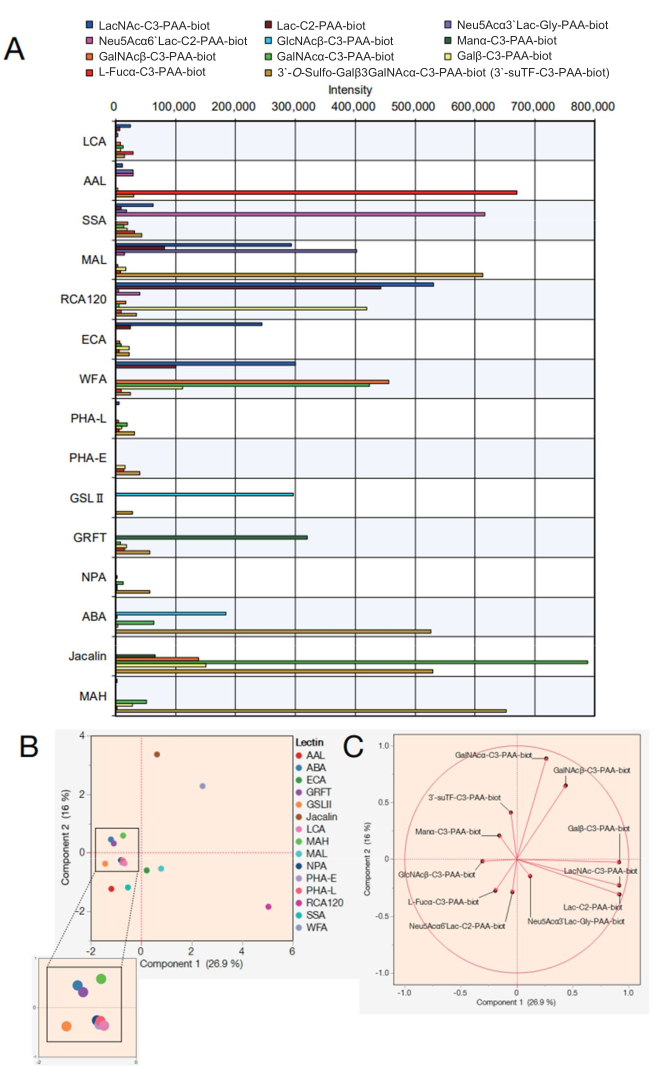
الشكل 4: تقييم التفاعل مع سكريات PAA في نظام التنميط الغليكان التلقائي. (أ) عدل تمثيل بياني يوضح تفاعلية المحاضرات مع مختلف سكريات PAA لقيم التحكم السالبة. (ب) تحليل المكون الرئيسي استنادا إلى البيانات الواردة في (أ). ج: المتجهات الذاتية من التحليل في (ب). تم استخدام برنامج تحليل متوافق للجزأين (B) و (C). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
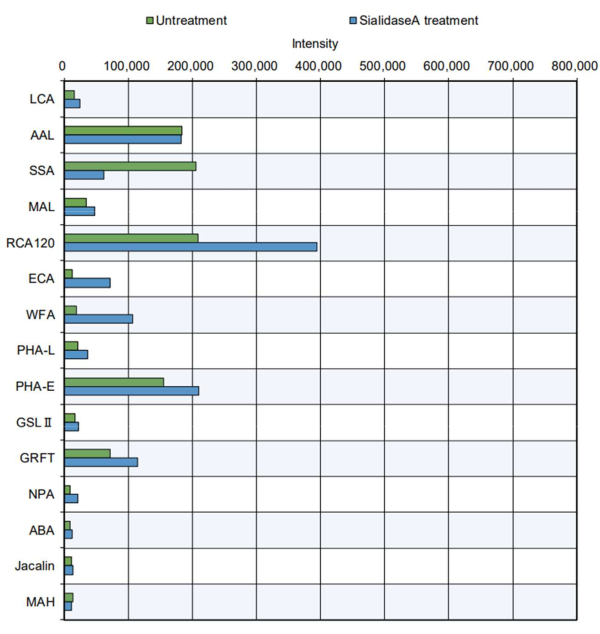
الشكل 5: التحقق من تفاعل GlycoBIST باستخدام بروتين ثيروجلوبولين البقري المنقى. تم تحضير العينة دون معالجة في نفس ظروف الهضم مثل المخزن المؤقت وحده ، باستثناء إضافة sialidase A. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: اختبار التكرار مع حبات ثابتة من الليكتين. تم تقييم تكرار التفاعل ل 28 محاضرة. تفاعلت المواد المحللة مع كل طرف. EPO: الإريثروبويتين ، PSA: مستضد البروستاتا النوعي ، Tf: ترانسفيرين ، M2BP: بروتين ربط Mac-2 ، hIgG: IgG البشري ، MMP3: مصفوفة ميتالوبروتيناز 3 ، (Sia +): تحليلات سياليداز A المهضومة ، (Sia + ، Gal +): سياليداز A والتحليلات المهضومة بالجالاكتوزيداز ، Ab: الأجسام المضادة. DSA: داتورا سترامونيوم agglutinin ، HypninA2: Hypnea japonica agglutinin ، WGA: agglutinin جنين القمح ، UDA: Urtica dioica agglutinin ، BPL: Bauhinia purpurea lectin ، Orysata: Oryza sativa lectin ، LSL-N: Laetiporus sulphureus lectin N-terminal domain ، SNA: Sambucus nigra lectin ، BanLec: محاضرات الموز ، MPA: Maclura pomifera agglutinin ، TxLC-I: Tulipa gesneriana agglutinin ، AOL: Aspergillus oryzae lectin ، ACG: أجروسيبي أسطواني جالكتين. السيرة الذاتية: معامل التباين. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: قائمة المحاضرات التي تشكل الطرف القياسي للتنميط التلقائي للجليكان. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 3: السكريات PAA المستخدمة كمعايير لنظام التنميط الغليكان التلقائي. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 4: نتائج اختبار قابلية التكاثر داخل التشغيل. السيرة الذاتية: معامل التباين. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 5: نتائج اختبار التكاثر بين اليوم. السيرة الذاتية: معامل التباين. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 6: نتائج اختبار الاستقرار على المدى الطويل. السيرة الذاتية: معامل التباين. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
في هذه الدراسة ، تم تطوير تقنية تقييم سريع للجليكوزيل باستخدام تقنية "مجموعة الخرزة في طرف واحد". قدمت الدراسة الحالية نصيحة GlycoBIST القياسية ، المصممة لكل من الباحثين في علم السكر وغير الباحثين في علم السكر ، لتسهيل تقييم الجليكوزيل الروتيني والشامل. تم استخدام مصفوفة الليكتين الدقيقة ، التي تستخدم عادة 20-100 محاضرات12,13 ، على نطاق واسع في التقييمات. ومع ذلك ، بالنظر إلى الخصائص المتداخلة لبعض المحاضرات على المصفوفات الدقيقة والتنوع المحدود نسبيا للجليكوفورم على البروتين السكري المستهدف مقارنة بالسكريات في العينات السريرية الخام ، كان من المتوقع أن يكون 15 محاضرا كافيا للتقييم المبسط لتوصيف الجليكان المركز.
تتمثل الخطوة الحاسمة في البروتوكول في السماح للخرزات أو الأطراف المملوءة بالليكتين المملوءة بتلك الخرزات بالعودة إلى درجة حرارة الغرفة بعد التخزين قبل استخدامها للقياسات. على وجه الخصوص ، لوحظ أن التكثيف يضعف الإشارات. لذلك ، ينصح بعدم فتح حقيبة التخزين أبدا حتى تعود إلى درجة حرارة الغرفة. لتخزين كواشف البيوتينيل ، من الضروري أيضا أن تجف تماما قبل التخزين. تقلل عملية التجفيف غير الكافية من كفاءة البيوتينيل إلى البروتين بسبب التحلل المائي لكاشف البيوتينيل14.
فيما يتعلق بالتعديلات واستكشاف الأخطاء وإصلاحها ، تم استكشاف طريقة لتقليل التباين ، خاصة فيما يتعلق بطريقة القياس في جهاز قياس التفاعل الآلي. على وجه الخصوص ، عندما يكون حجم المخزن المؤقت في الخزان المستخدم للتحليل 150 ميكرولتر ، تدخل الفقاعات إلى الطرف ، مما يؤدي إلى انخفاض كفاءة التفاعل ويؤدي إلى تباين كبير في القيم. لذلك ، يوصى بوضع 200 ميكرولتر على الأقل من المخزن المؤقت في الخزان.
كمية السائل التي تملأ الأطراف أثناء السحب التلقائي هي أيضا عامل مهم. لا يمكن للأطراف طرد السائل تماما أثناء انتقاله إلى خطوة التفاعل التالية. لذلك ، بكمية ليست صغيرة ، يتم ترحيل المخزن المؤقت من الخطوة السابقة إلى الخطوة التالية ، ويظل المخزن المؤقت السابق في المنطقة العلوية من المحلول المدرج عند استنشاق المخزن المؤقت الجديد. لذلك ، يجب استنشاق الركيزة والحلول الأخرى بشكل كاف لملء الخزان العلوي (انظر الشكل 1 أ). نظرا لعدم رجعية تفاعلات الأجسام المضادة على الأداة ، فمن الأهمية بمكان توخي الحذر وتجنب الأخطاء أثناء الإعداد الأولي.
أحد قيود الطريقة هو أنها تقتصر على البروتينات القابلة للذوبان المشتقة من طافات المصل والثقافة. في الطريقة الحالية ، لا يتم ربط الليكتين تساهميا بالخرزة ، مما يجعله غير قادر على تحليل العينات التي تحتوي على تركيزات عالية من المواد الخافضة للتوتر السطحي ، مثل مستخلصات الخلايا والأنسجة. وبالتالي، من الضروري إدخال تحسينات في المستقبل لمعالجة هذه القيود.
تكمن أهمية مجموعة حبات الليكتين في قابلية التبادل وقابلية التوسع لأنواع الليكتين المثبتة على الخرز. على سبيل المثال ، في التحليل التفاضلي واسع النطاق (>1000 عينة) باستخدام نظام التنميط الآلي للجليكان ، يمكن للمستخدمين تخصيص تشكيلة 15 ليكتين في الطرف بناء على التنميط الأولي القائم على الجليكان القائم على مصفوفة الليكتين الدقيقة للبروتين السكري المستهدف (<100 عينة). علاوة على ذلك ، فإن الثبات العالي للخرز المثبت بالليكتين يتيح إجراء تجارب فورية من تصميم الطرف الأولي إلى القياس باستخدام الإجراءات الروتينية. ليس فقط 25 من 28 محاضرات أظهرت موثوقية عالية (الجدول 1) ، ولكن يمكن استخدام أي محاضرات تهم المستخدم لإنشاء نظام تنميط جليكان آلي مخصص لتجاربهم المحددة ، بعد اختبار الموثوقية الروتيني المذكور أعلاه. أدى هذا النهج إلى تصميم مجموعة حبات 120 ليكتين محتملة من ثمانية أنواع مختلفة من النصائح للقياس الموسع بالتزامن مع نظام التنميط الغليكان القياسي.
ركزت دراسة سابقة على إنشاء إجراء للكشف عن البروتينات السكرية التي تحمل علامة Cy3 بما يتماشى مع ميكروأريالليكتين 15. اقتصرت هذه الطريقة على 13 محاضرا بالتوازي في الطرف بسبب تداخل التألق. تستوعب الطريقة الحالية ، باستخدام ملصقات الكشف عن HRP ، 15 حبة ثابتة من الليكتين واثنين من حبات التحكم (الإيجابية والسلبية) في طرف. بالإضافة إلى ذلك ، أدى البيوتينيل للعينات إلى تقصير عملية التحليل.
يمكن تطبيق هذه الطريقة التحليلية ليس فقط على البحث الأكاديمي ، ولكن أيضا على البحوث الطبية والصيدلانية والمواد الغذائية ومستحضرات التجميل وغيرها من المجالات الصناعية. في حين أن تقنيات ميكروأري الليكتين والجليكوبروتيوميكس راسخة ، إلا أن نهج هذه الدراسة لا يزال مهما لأتمتتها الكاملة وقدرتها على التحليل السريع بخطوات أقل. في المستقبل ، سيتم إجراء تحسينات على هذا التحليل على طريقة كمية عن طريق تطبيع الإشارة باستخدام بعض البروتينات السكرية ، باستخدام حبات ثابتة بالأجسام المضادة جنبا إلى جنب مع حبات ثابتة من الليكتين في طرف.
Disclosures
AO ، TO ، NT ، HS ، KK ، MA ، SY ، TM ، KN ، OS ، و KS هم موظفون في شركة Precision System Science Co.، Ltd.
Acknowledgements
تم دعم هذا العمل من خلال برنامج نقل التكنولوجيا القابل للتكيف والسلس من خلال البحث والتطوير القائم على الهدف (A-STEP) ، بتمويل من وكالة العلوم والتكنولوجيا اليابانية (JST) ، بموجب المنحة رقم JPMJTR204A وجزئيا من قبل الجمعية اليابانية لتعزيز العلوم (JSPS) رقم منحة KAKENHI 23H02680 إلى AK. نود أن نشكر Editage (www.editage.jp) على تحرير اللغة الإنجليزية.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
References
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103(2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved