Method Article
使用全自动系统对重组蛋白进行快速糖质定性评估
摘要
之前开发了一种用于自动快速分析蛋白质上糖基的系统。本文介绍了"糖定性分析"方案,该方案针对广泛的用户进行了优化,例如那些从事分析生物制药和其他糖缀合物材料中聚糖结构的用户。
摘要
蛋白质糖基化是一种关键的翻译后修饰,会影响重组蛋白(包括生物制药)的稳定性、有效性和免疫原性。聚糖结构表现出显著的异质性,随生产细胞类型、培养条件和纯化方法的不同而变化。因此,监测和评估重组蛋白的聚糖结构至关重要,尤其是在生物制药生产中。凝集素微阵列是一种与质谱相辅相成的技术,具有高灵敏度和易用性。但是,通常需要一天以上的时间才能产生结果。为了使其适应非糖科学研究或药品工艺开发,需要一种自动化、高通量的替代方案。因此,利用"单针头磁珠阵列 (BIST)"技术理念开发了世界上第一个全自动基于凝集素的聚糖分析系统。该系统允许以 1,000 个为单位制备和储存凝集素固定的微珠,并具有用于各种用途的可定制平行插入订单。本文提出了一种涉及"糖合格"重组蛋白的研究的实用方案。在测试了它们与 12 种聚丙烯酰胺-糖基偶联物的反应性后,选择了 15 种凝集素以提高系统的多功能性。此外,通过将 Cy3 切换到生物素来优化样品标记过程,将整体处理时间缩短了 30 分钟。为了立即进行数据鉴定,凝集素结合信号在顶部监视器上显示为点代码。通过日常重现性测试、重复性测试和长期储存测试证实了该系统的可靠性,变异系数为 <10%。这款用户友好型快速糖分析仪在内源性糖蛋白的质量监测中具有潜在的应用潜力,用于生物标志物评估和验证。这种方法有助于糖科学的新手进行分析,从而扩大其实际用途。
引言
蛋白质糖基化是一种重要的翻译后修饰,需要在生物制药中进行评估。蛋白质的聚糖谱可能因培养条件、纯化过程和宿主细胞而异1。需要简单的仪器来鉴定生物工艺管道中的糖基化。据估计, 体内 超过 50% 的分泌蛋白和膜蛋白被多种聚糖修饰,这些聚糖根据细胞谱系、发育阶段和疾病状态(如恶性肿瘤的发作)而变化2。监测聚糖谱在识别独特的诊断标志物和药物靶标方面具有重要潜力。对于从发现流程中的数百个患者样本中验证和确认这种异常糖基化,需要能够快速测量大规模样本量的自动化仪器。
微阵列技术已被纳入糖组学中,用于评估糖蛋白的聚糖分析3。在这种方法中,几种凝集素(即聚糖结合蛋白)被固定在载玻片等表面上。这种基于相互作用的糖分析技术不需要事先从核心蛋白中释放聚糖,从而简化了糖技术新手研究人员的流程。尽管其应用广泛,但对于生物生产等工业应用,需要一种能够快速、轻松地监测大量分析靶标的游离寡糖的自动化系统。为了解决这个问题,之前报道了一种基于独特概念的自动化游离寡糖分析系统,该系统称为"单针头微珠阵列"(BIST),最初是为基因分型而开发的。该系统通过一体式高通量自动仪器4 简化了流程。使用各种凝集素固定珠平行排列的尖端 4,5,建立了一种分析在糖蛋白中修饰的聚糖结构的方法,并将其命名为 GlycoBIST(以下简称"自动聚糖分析系统")(图 1A)。凝集素可以固定在 1,000 个珠子上并干燥,以保持一年的活性,无论是在吸头装填之前还是之后。一旦在测量原型仪器(一种自动反应测量设备,参见材料表)中设置含有 HRP 标记的抗链霉亲和素抗体 (SA-HRP) 等试剂的吸头和吸头盒,吸头即可用作自动移液器。仪器内部后部的化学发光检测扫描仪可同时量化 8 个尖端的信号。来自这 8 个吸头的定量数据以点代码的形式紧凑地同时显示在仪器的触摸屏上,以便快速确认测量结果。此外,表示为测量峰最大值的值作为原始数据从仪器传输,并允许各个研究人员绘制图表(图 1A,下图)。
在本文中,作者描述了一种改进的生物素标记蛋白质方法,将处理时间缩短至 30 分钟。靶蛋白预先生物素化并通过 SA-HRP 检测(图 1B)。构建具有 15 种选定凝集素的标准 GlycoBIST 吸头(用于自动糖谱分析的专用吸头),以实现多功能糖蛋白聚糖分析,从而提高分析的全面性。
研究方案
用于本研究的试剂和设备的详细信息列在 材料表中。
1. 制备用于自动游离寡糖分析的专用吸头
- 将干燥的凝集素固定珠子(储存在4°C的密封袋中)带到工作台上,让它们恢复到室温(~23°C)。
注:这可以防止珠子上出现冷凝水,而冷凝水会降低其质量。这种制备凝集素固定珠的方法之前已经报道过5。 - 将防静电布放在桌子上,并将便携式静电消除器面向工作区。这允许在具有防静电保护的工作台上进行后续工作(图 2A)。
- 使用抗静电镊子将珠子插入空尖端,以便在凝集素固定珠之间放置两个间隔珠(图 1A)。
- 用钳子轻轻挤压尖端的顶部以关闭开口,注意不要在所有珠子填充后割伤尖端(图 2B)。
注意: 这是为了将珠子固定在尖端内。建议制作钳子以避免割伤尖端(图 2C)。 - 如果尖端弯曲,请用手拉直。
- 将准备好的尖端在 4 °C 下储存在装有干燥剂的密封袋中,以备不时之需。
注意:在使用尖端之前,应将其加热至室温,然后再打开密封袋并将其取出。水分大大降低了凝集素的反应性。
2. 分析物的制备
- 预填充生物素化试剂用于常规分析。
注:对于常规分析,将生物素化试剂(生物素-(AC5)2 Sulfo-Osu,参见 材料表)分成小份进行预包装是有帮助的,以便快速分析。建议将生物素化试剂干燥并储存,因为其琥珀酰亚胺酯通常易水解。- 将生物素化试剂溶解在去离子水中。
- 使用移液管将 10 μg 试剂分配到试管中。
- 在冷冻真空浓缩器中用生物素化试剂干燥试管,并用干燥剂在 4 °C 下储存在避光袋中直至使用。
- 将分析物溶液(200 ng eq. 蛋白质)添加到含有步骤 2.1 中制备的干燥生物素化试剂的试管中。
注:请注意用于溶解和稀释分析物的缓冲液组成,具体取决于所用生物素化试剂的性质。例如,避免使用伯胺试剂作为胺偶联的缓冲液。这将防止分析物的生物素化效率降低。 - 涡旋充分混合,然后在台式离心机中旋转(在室温下 1000 x g 持续 5 秒),将盖子上的液体滴到管底。
- 将试管在室温下避光孵育 1 小时。
- 在探测缓冲液(1% Triton X-100、0.5 M 甘氨酸、1 mM CaCl2 和 1 mM MnCl2 的 TBS 溶液)中将生物素化样品稀释 10 倍,以灭活任何未反应的生物素化试剂。
注:在胺偶联反应的情况下,未反应的生物素化试剂被与含有伯胺试剂(如 TBS 中的 Tris)的缓冲液的反应消耗,这可以防止凝集素和其他固定在珠子上的物质在后续测量中发生生物素化。 - 在室温下避光孵育 2 小时。
- 通过 Western blotting 评估分析物的生物素化效率,必要时使用 HRP 标记的链霉亲和素作为检测探针。请参阅文献以了解 Western 印迹方法6.
3. 使用自动反应测量设备制备用于聚糖分析的试剂
- 用封闭溶液以 1:3000 的比例稀释 HRP 偶联的链霉亲和素。
- 与等体积的底物 A 和底物 B 混合(参见 材料表)。每个样品使用 160 μL 混合底物。
- 将封闭溶液、洗涤缓冲液 (0.1% Triton X-100/TBS)、TBS、HRP 偶联的链霉亲和素溶液和每种底物分配到具有 10 个储液器的小柱的指定孔中。
注:填充反应柱每个孔的推荐溶液体积和位置如下所述。但是,可以提前在自动反应测量设备中根据需要更改溶液和孔排列。- 加入 0.2 mL 步骤 3.1 中制备的 HRP 标记的链霉亲和素。使用移液管到 #2 孔。该孔从小柱的正面命名为 #1。
- 使用移液管向 #3 孔中加入 0.2 mL 封闭溶液。
- 使用移液管向孔 #4 和 #6 中加入 1 mL TBS。
- 使用移液管向孔 #7 和 #8 中加入 1 mL 洗涤缓冲液。
- 使用移液管将 0.16 mL 底物混合物添加到 #10 孔中。
- 确认 #1、#5 和 #9 孔为空。
- 将步骤 2 中制备的分析物添加到 2 mL 低蛋白吸附螺旋盖微管中。
- 打开自动反应测量设备的前门。
- 将步骤 3.3 中制备的储液器、1 中制备的尖端和步骤 3.4 中制备的分析物设置在自动反应测量装置的指定位置(图 2D),如下所示。每次测量都在单个垂直线方向上执行。
- 将步骤 1 中准备好的一个尖端放在 图 2D 中"a"黄色符号位置的每个孔中。
注意:同样,如果冷藏,请在打开密封袋之前将吸头加热至室温。由于水分,凝集素会急剧失去信号。 - 取下含有步骤 3.4 中制备的分析物的试管盖,并以类似方式将其插入位置"b"的每个孔中。
- 插入含有步骤 3.3 中制备的液体的墨盒,小心不要将其溅到位置"c"。
- 图 2D 中的整个"废液箱"装满后取出,将内容物倒入垃圾箱,然后将"废液箱"放回原来的位置。
注意:测量后,反应的吸头会自动收集在"废液箱"中。
- 将步骤 1 中准备好的一个尖端放在 图 2D 中"a"黄色符号位置的每个孔中。
4. 使用自动反应测量设备进行游离寡糖分析
- 打开主机侧面的电源开关。
- 触摸屏幕上显示的"开始诊断"按钮(图 3A)。自诊断程序会自动启动。片刻后,自诊断程序完成,出现 HOME 屏幕(图 3B)。
注意: 可以通过触摸相应的图标来执行以下操作。"Assay" 开始测量。"维护"以确认任何系统错误。"History" 查看过去的测量数据。 - 触摸主屏幕上显示的"检测"以选择协议(图 3B)。
- 选择测定方法的"BAssaySTD"(图 3C),然后按右下角的"下一步"。
- 根据需要为每个样品输入样品名称(图 3D),然后触摸右下角的"下一步"。
- 根据需要输入用于每个样品的吸头名称(图 3E),然后触摸右下角的"下一步"。
- 确认右侧的注释(图 3F),如果没有问题,请触摸右下角的"开始"进行测量。
- 确认屏幕切换到运行模式(图 3G)并等待"完成"箭头突出显示。如有必要,点击 "Break" 停止运行模式。
注意:由自动反应测量设备自动控制的操作如下:(1) 仪器内部的自动微量移液器喷嘴最多可同时连接八个吸头(参见 图 2D 中的黄色"a"符号);(2) 反复吸出/排出含有分析物的试管中的溶液 5 分钟;(3) 转移至封闭液中,吸出/排出 5 min;(4) 转移到 TBS 并抽吸/排出 2 分钟;(5) 转移至 HRP 标记的链霉亲和素溶液中,吸出/排出 5 分钟;(6) 转移至洗涤缓冲液中,吸出/排出 7 分钟;(7) 转移到 TBS 并抽吸/排出 2 分钟;(8) 转移到底物混合物中并立即吸出;(9) 在设备背面同时扫描 8 个 tip的化学发光,以获得 peak 数据;(10) 将用过的吸头放入垃圾箱中;(11) 喷嘴返回到初始位置。 - 确认测量完成后屏幕已更改为结果模式(图 3H)。八个点代码同时显示在屏幕上,以便于验证。
注意:触摸左下角的"历史记录",在屏幕上显示扫描图表(图 3I、J)、条形图(图 3K、L)、表格(图 3M)和详细信息(图 3N)作为结果。从下拉的 "Lane" 列表中查看其他泳道的 Results。 - 将 USB 存储器插入主机侧面的 USB 端口,点击结果模式右下角的"导出",将所有通道的数据单独保存在 USB 存储器中。
- 使用 USB 端口将原始数据(图 3M)导出为 CSV 文件,以便在 Excel 中进一步进行数据分析和单独绘图。表格的 "值" 表示每种凝集素的信号强度。强度值表示反应针尖扫描中峰数据的最大值(图 3I、J)。
注意:可以设置峰值提取阈值。根据分析物的不同,间隔珠部分的信号总体上可能更高,在这种情况下,间隔部分的值被减去作为背景。
结果
首先,显示每个凝集素的信号分布,以了解凝集素微珠阵列的特征。制备凝集素固定珠子库(每个 1,000 个珠子)。从 1,000 颗珠子中随机挑选 15 颗珠子,并添加到一个尖端中。 图 1A 底部显示了一个典型的图表,代表在固定相同凝集素的 15 个珠子中观察到的几乎相同的信号强度。该测量程序可用于在使用聚糖分析之前鉴定手工制作的凝集素微珠的生产。例如,使用 6 个吸头进行同步测量,以根据 90 个微珠上的信号计算变异系数 (CV)。 表 1 显示了一个典型的示例。当凝集素固定磁珠库扩展为容纳 28 种不同的凝集素时,28 种凝集素中有 25 种表现出高重现性,CV 小于 10%。
接下来,显示了具有 15 种不同凝集素的凝集素珠阵列的数据。表 2 中所示的 15 种凝集素被选为凝集素珠阵列。此外,还测量了表 3 中列出的 12 种聚丙烯酰胺 (PAA) 单/二/三糖。使用屏幕上的点编码显示评估测量可靠性后,从自动反应测量设备导出原始数据(参见协议步骤 4.11),并在 Excel 中使用每种糖类的反应峰值创建图表(图 4A)。然后将这些值用于主成分分析,以可视化选定的 15 种凝集素与反应糖之间的相关性(图 4B、C)。这导致每种凝集素与图 4A 所示的 12 种 PAA 糖的结合模式存在明显差异。在此,每个信号的有效性显示是指凝集素和糖类特异性的综合先前列表 7,8(也指表 2 中的这些特异性)。由于 AAL 与末端 α-Fuc、Sia-Lex 和 Lex 结合,自动聚糖分析证实了 AAL 对含岩藻糖分子的识别(图 4A)。SSA 和 MAL (凝集素的全名和给定的缩写见表 2)分别识别 Siaα2-6Gal/GalNAc 和 Siaα2-3Gal。微珠阵列中的 MAL 还可以与 3'-O-磺基-Galβ3GalNAc 和 LacNAc 结合。这与之前使用机器学习7 分析的结果一致,其中 MAL 主要偏爱 3'-O-磺基-Gal,而 LacNAc 不是显性9。RCA120 是一种识别 Gal 的凝集素,与末端 β-Gal (包括 Lac/LacNAc) 发生强烈反应,并且允许与 Siaα2-6Lac 结合,但不能与 Siaα2-3Lac 结合。ECA 与 LacNAc 的反应性远高于 Lac。WFA 具有更广泛的特异性,据报道,它不仅可以识别 α/β-GalNAc,还可以识别末端 β-GalNAc 7,10。GSL II 可识别 GlcNAc 和半乳糖基化的三/四天线 N-糖,除制备的分析物中的单个 GlcNAc 外,未与任何糖结合。GRFT 可识别高甘露糖型 N-糖,与 α-Man 反应。ABA、Jacalin 和 MAH 通常用于检测 O-糖。由于 ABA 偏好 Galβ1-3GalNAcα-Thr/Ser (T) 和唾液酸-T 结构,因此微珠阵列中的 ABA 与 3'-O-磺基-Galβ1-3GalNAc 发生强烈反应,并与 α-GalNAc 弱结合。ABA 还识别出 β-GlcNAc,这与之前关于与无乳糖基化 N-糖结合的报道一致7。Jacalin 具有相对更广泛的特异性,因此可与 α-甘露糖、β-GalNAc、βGal、α-GalNAc、3'-O-磺基-Galβ1-3GalNAc 反应。MAH 特异性识别了 3'-O-硫酸盐-Galβ1,3GalNAc,如先前报道的那样7.残留的四种凝集素(NPA、LCA、PHA-L 和 PHA-E)识别出制备的 PAA 糖类中未包含的 N-糖的内部结构,因此与所有分析物均无亲和力。
使用获得的数据,可以通过将它们绘制在主成分分析图上来阐明有助于与每种糖结合的凝集素的相似性(图 4B)。导致图 4B 中方差的所有糖类都由特征向量表示,这是一种统计分析方法,其中贡献率由向量表示(图 4C)。这里值得注意的是,反应的糖对每个凝集素都有贡献,没有偏差。凝集素不仅对一种糖类表现出特异性。例如,复合物型游离寡糖的存在是通过人类复杂型游离寡糖中某些游离寡糖的部分识别来确定的。Jacalin 可识别 O-糖(参见表 2 中的特异性),可以识别本研究中使用的糖类中的 3'suTF 结构和 α-GalNAc,因此,将 3'suTF 和 α-GalNAc 与图 4B 中绘制的 Jacalin(棕色点)的位置方向作图(图 4C)。WFA 可以识别本研究中使用的糖类中的 α/β-GalNAc;因此,图 4C 中的 α/β-GalNAc 的绘制方向与图 4B 中绘制的 WFA 的方向相同。相比之下,α-GalNAc 绘制在 WFA 和 Jacalin 之间,因为它是 Jacalin 能够轻松结合的糖结构。本研究中绘制的所有 11 种糖类与先前报道的凝集素的特异性(糖结合)一致 7,8,表明所提出的方法是一种可靠的测量方法。此外,对应于每种糖类的特征向量是分散的,这支持以最小的偏差选择 15 种凝集素,以确保分析的全面覆盖。因此,补充了这 15 种凝集素的尖端被定义为标准 GlycoBIST 尖端(表 2)。
在更实际的示例中,对纯化的蛋白质产品进行尖端测量(图 5)。分析了牛甲状腺球蛋白,该酶具有 N-糖基化位点,含有复合物、杂化和高甘露糖型 N-糖11。标准尖端表明某些凝集素对糖类的反应性增加8(请参阅表 2 中的特异性):PHA-E,识别一分为二的 GlcNAc;GRFT,识别甘露糖型 N-糖;SSA,识别 Siaα2-6Gal/GalNAc;RCA120,识别乳糖和 LacNAc;和 AAL,识别岩藻糖。这些聚糖结构存在于复合物、杂化和高甘露糖型 N-糖中,表明可以有效评估甲状腺球蛋白11 的 N-糖结构。此外,用唾液酸酶 A(一种消化唾液酸的酶)处理的甲状腺球蛋白与识别唾液酸的 SSA 的反应性降低,与 RCA120、WFA 和 ECA 的反应性增加,这些反应性在去除唾液酸后更容易识别。牛甲状腺球蛋白中存在 O-糖结构之前没有报道。正如预期的那样,在自动游离寡糖分析中,有或没有唾液酸酶处理的甲状腺球蛋白中没有鉴定出 O-聚糖。
使用 15 种选定的凝集素的运行内重现性测试显示了了解测量的稳健性(表 4)。对于该测试,制备了 7 个用于分析物的标准吸头和一个用于阴性对照的附加吸头,并同时测量了所有 8 个吸头。该程序在一天内重复 3 次。"混合分析物",一种导致在所有凝集素上获得重要信号的分析物组合,用于磁珠阵列的质量控制。通过将唾液酸酶消化的促红细胞生成素 (EPO)、唾液酸酶和半乳糖苷酶消化的 EPO、人 IgA、基质金属蛋白酶 3 (MMP3) 和甲状腺球蛋白适当混合来配制混合分析物。在含有 Triton X-100 的 PBS 中用 10 μg 生物素化试剂标记每个糖蛋白 (200 ng)。如有必要,按照说明中的说明进行唾液酸酶和半乳糖苷酶处理。消化后,将产物在 75 °C 的加热块中孵育 10 分钟以灭活酶。分析前立即混合适量的生物素化糖蛋白(3 ng EPO、8 ng 人 IgA、5 ng MMP3 和 15 ng 甲状腺球蛋白)。测量结果表明,最大 CV 值为 13.5%,15 种凝集素的平均 CV 为 8.2%,表现出较高的重现性。
此外,日常重现性测试可用于了解测量日期引起的变化(表 5)。提前制备标准吸头和混合分析物,连续 5 天每天重复测量 7 个吸头。结果表明,大多数凝集素的 CV 低于 10%。然而,一些凝集素,如 LCA 和 ECA,表现出较高的 CV。每个周期 15 个凝集素的平均 CV 高达 7.7%,5 天的平均 CV 值小于 10%,表明具有很高的可重复性。值得注意的是,由于混合分析物中 MMP3 的自消化,Jacalin 表现出较低的时间重现性。因此,应确定更合适的分析物来替代 MMP3。
为了了解凝集素固定珠的稳定性,显示了使用这些干燥的凝集素固定珠的长期稳定性测试(表 6)。提前制备标准吸头、分析试剂和混合分析物,并在储存 12 个月后进行测量。将上述五种类型的生物素化分析物单独储存并在测量前混合。结果表明,即使在干燥储存后长达 12 个月,15 种凝集素的平均 CV 也低于 10%。这表明了通过一次存储来自同一批次的大量针头(最多 1,000 个)进行快速精确测量的可行性。
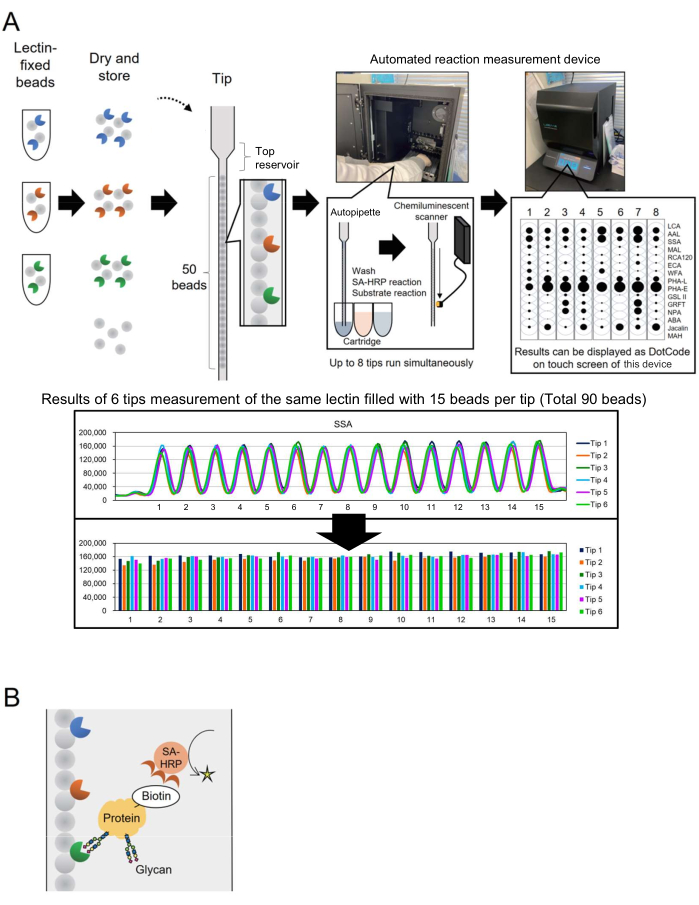
图 1:"单针头磁珠阵列"仪器和分析方法的方案。 (A) 自动糖谱分析系统方案。凝集素固定的微珠可以干燥并储存在吸头中。当在测量仪器(自动反应测量设备)中设置并激活含有 HRP 标记的抗链霉亲和素抗体 (SA-HRP) 等试剂的吸头和吸头盒时,吸头将用作自动移液器。仪器后部的化学发光检测扫描仪可同时量化来自 8 个吸头的信号。定量数据在仪器的触摸屏上显示为点代码,以便快速确认测量结果。下半部分显示了用相同凝集素测量 90 个珠子的结果。测量结果从仪器中传输出来,并由研究人员个人绘制成图表。(B) 本实验中使用的检测方法方案。对靶蛋白进行生物素前化并使用 SA-HRP 进行检测。 请单击此处查看此图的较大版本。

图 2:使用自动反应测量设备进行自动糖基分析的材料和设置图像。 (A) 将凝集素固定珠填充到吸头中的描述。在抗静电垫上用抗静电镊子拾取珠子,然后用珠子填充尖端。(B) 用钳子捏住尖端。顶部珠子的略微上部被挤压。(C) 用于压接尖端的钳子。塑料(黄色圆圈)被捏住以防止它们完全剪断。(D) 自动反应测量装置中使用的材料的排列。A:吸头,B:含有分析物的试管,以及 C:应分别将含有液体的小柱插入到位。在废液箱中,测量后收集反应的吸头。该框可以移除。 请单击此处查看此图的较大版本。
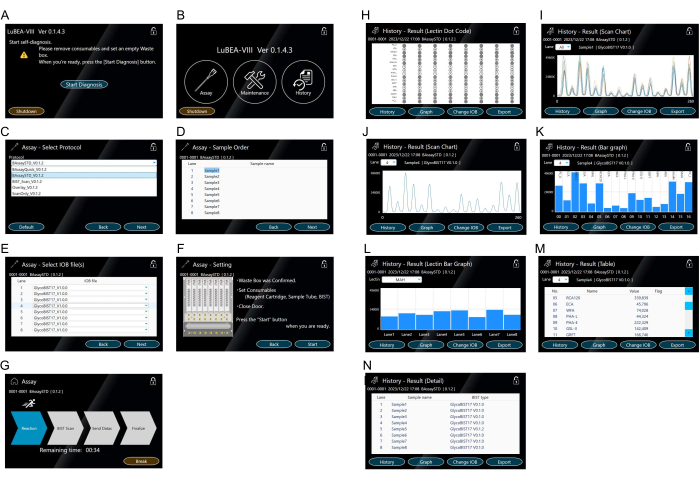
图 3:用于机器操作的触摸屏。(A) 开机时,自诊断程序会自动启动。(B) 主屏幕显示"Assay"、"Maintenance"和"History"。(C-G)"Assay" 模式的操作。检测方法选择 (C)。可以提前注册多个协议。样品(分析物)订单 (D) 的输入。选择尖端类型 (E)。确认检测方法设置 (F) 并从 "Start Assay" 屏幕 (G) 开始检测。(H-N)在 "History" 中表示结果。凝集素点代码 (H) 在检测完成后或从"历史"模式显示。屏幕上显示所有样品 (I) 或每个样品 (J) 的 15 个凝集素的扫描图。扫描图表显示为条形图 (K)。可以从 "Lane" 下拉列表中选择其他泳道的条形图。比较每个凝集素 (L) 的 8 个样品泳道的条形图。可以从下拉的 "Lectin" 列表中选择其他凝集素。显示定量值 (M) 的表格。执行的测量方法的记录 (N)。请单击此处查看此图的较大版本。
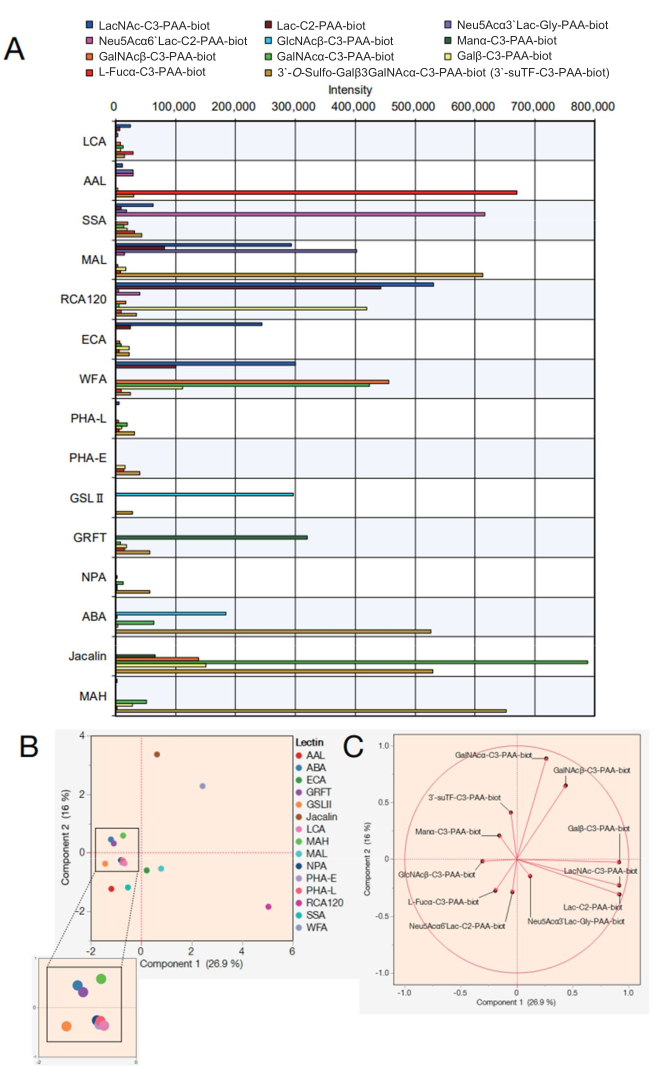
图 4:在自动聚糖分析系统中评估与 PAA 糖 的反应性。(A) 针对阴性对照值调整了描述凝集素与各种 PAA 糖反应性的图表。(B) 基于 (A) 中的数据的主成分分析。(C) 来自 (B) 中分析的特征向量。(B) 和 (C) 部分使用了兼容的分析软件。 请单击此处查看此图的较大版本。
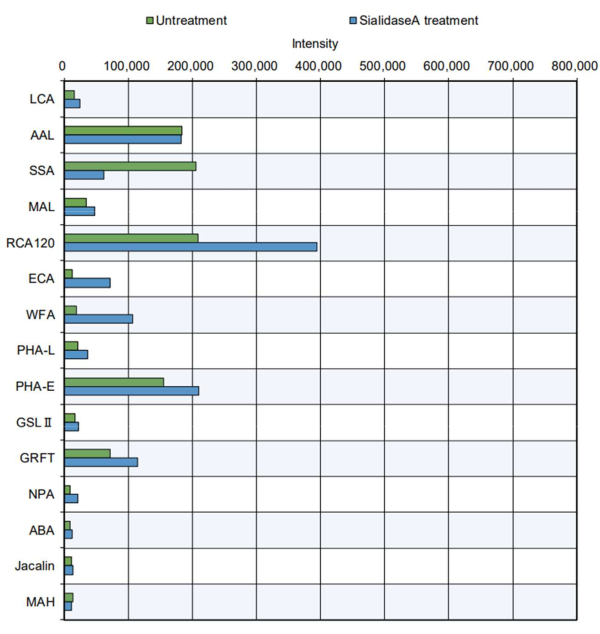
图 5:使用纯化的牛甲状腺球蛋白验证 GlycoBIST 反应性。 未经处理的样品制备在与单独缓冲液相同的消化条件下进行,不包括添加唾液酸酶 A。 请点击此处查看此图的较大版本。
表 1:凝集素固定珠的可重复性测试。 评估了 28 种凝集素的反应性可重复性。分析物与每个吸头反应。EPO:促红细胞生成素,PSA:前列腺特异性抗原,Tf:转铁蛋白,M2BP:Mac-2 结合蛋白,hIgG:人 IgG,MMP3:基质金属蛋白酶 3,(Sia+):唾液酸酶 A 消化的分析物,(Sia+,Gal+):唾液酸酶 A 和半乳糖苷酶消化的分析物,Ab:抗体。DSA: 曼陀 罗凝集素,HypninA2: 日本高通气 凝集素,WGA:小麦胚芽凝集素,UDA: 荨麻疹 凝集素,BPL: 紫 荆花凝集素,Orysata: 水稻 凝集素,LSL-N: Laetiporus sulphureus 凝集素 N 末端结构域,SNA: 接骨 木凝集素,BanLec:香蕉凝集素,MPA: Maclura pomifera 凝集素,TxLC-I: Tulipa gesneriana 凝集素,AOL: 米曲 霉凝集素,ACG: Agrocybe cylindracea 半乳糖凝集素。CV:变异系数。 请点击此处下载此表格。
表 2:构成用于自动糖基分析的标准 Tip 的凝集素列表。请点击此处下载此表格。
表 3:用作自动糖基分析系统标准品的 PAA 糖类。请点击此处下载此表格。
表 4:运行内重现性检验的结果。 CV:变异系数。 请点击此处下载此表格。
表 5:日间重现性测试的结果。 CV:变异系数。 请点击此处下载此表格。
表 6:长期稳定性测试结果。 CV:变异系数。 请点击此处下载此表格。
讨论
在本研究中,开发了一种采用"单尖端微珠阵列"技术的糖基化快速评估技术。本研究介绍了一种标准的 GlycoBIST tip,专为糖科学和非糖科学研究人员设计,以促进常规、全面的糖基化评估。凝集素微阵列通常使用 20-100 个凝集素 12,13,已广泛用于评估。然而,考虑到微阵列上一些凝集素的重叠特异性,以及与粗临床样品的糖组学相比,靶糖蛋白上的糖型种类相对有限,预计 15 个凝集素就足以简化聚焦聚糖分析的评估。
该方案中的关键步骤是让充满这些微珠的凝集素固定磁珠或尖端在储存后返回室温,然后再用于测量。特别是,观察到冷凝会减弱信号;因此,建议在储物袋恢复到室温之前不要打开它。对于生物素化试剂的储存,储存前必须完全干燥。由于生物素化试剂的水解,不充分的干燥过程会降低生物素化为蛋白质的效率14。
关于修改和故障排除,探索了一种减少可变性的方法,特别是与自动反应测量设备中的测量方法有关。特别是,当用于分析的储液槽中的缓冲液体积为 150 μL 时,气泡会进入吸头,导致反应效率降低,并导致值变化很大。因此,建议在储液槽中至少放置 200 μL 缓冲液。
自动移液过程中填充吸头的液体量也是一个重要因素。当液体进入下一个反应步骤时,吸头无法完全排出液体。因此,上一步的缓冲液被带入下一步,当吸出新缓冲液时,前一个缓冲液保持在插入溶液的顶部区域。因此,应充分吸出底物和其他溶液以填充顶部储液器(参见 图 1A)。鉴于仪器上抗体反应的不可逆性,在初始设置期间谨慎行事并避免错误至关重要。
该方法的一个局限性是它仅限于来自血清和培养上清液的可溶性蛋白质。在当前方法中,凝集素未与磁珠共价交联,因此无法分析含有高浓度表面活性剂的样品,例如细胞和组织提取物。因此,需要将来的改进来解决这些限制。
凝集素微珠阵列的意义在于固定在微珠上的凝集素种类的互换性和可扩展性。例如,在使用自动糖基分析系统的大规模差异分析(>1,000 个样品)中,用户可以根据基于凝集素微阵列的靶糖蛋白(<100 个样品)的初步糖基分析,在针头中定制 15 个凝集素系列。此外,凝集素固定微珠的高稳定性使从初始尖端设计到常规程序测量的即时实验成为可能。不仅 28 种凝集素中的 25 种已证明具有高可靠性(表 1),而且用户感兴趣的任何凝集素都可以用于根据上述常规可靠性测试为其特定实验创建定制的自动聚糖分析系统。这种方法导致设计了一个可能的 120 凝集素微珠阵列,其中包含 8 种不同类型的吸头,用于与标准聚糖分析系统结合使用进行扩展测量。
之前的一项研究侧重于建立与凝集素微阵列15 一致的 Cy3 标记糖蛋白的检测程序。由于荧光干扰,该方法仅限于尖端中平行的 13 个凝集素。当前方法使用 HRP 检测标记,一个吸头可容纳 15 个凝集素固定微珠和 2 个对照微珠(阳性和阴性)。此外,样品的生物素化缩短了分析过程。
这种分析方法不仅可以应用于学术研究,还可以应用于医学和制药研究、食品、化妆品和其他工业领域。虽然凝集素微阵列和糖蛋白质组学技术已经成熟,但本研究的方法仍然具有重要意义,因为它具有完全自动化和以更少的步骤进行快速分析的能力。将来,通过使用某些糖蛋白对信号进行归一化,在尖端中使用抗体固定的微珠和凝集素固定的微珠,对这种分析进行增强。
披露声明
AO、TO、NT、HS、KK、MA、SY、TM、KN、OS 和 KS 是 Precision System Science Co., Ltd. 的员工。
致谢
这项工作得到了通过目标驱动研发 (A-STEP) 的适应性和无缝技术转让计划的支持,该计划由日本科学技术振兴机构 (JST) 资助,资助号 JPMJTR204A部分由日本科学促进会 (JSPS) KAKENHI 资助号 23H02680 授予 AK。感谢 Editage (www.editage.jp) 对英文版本的编辑。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
参考文献
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103 (2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。