Method Article
全自動システムを用いた組換えタンパク質の迅速な糖質定性評価
要約
タンパク質上の糖鎖を自動的かつ迅速に分析するためのシステムは、以前に開発されました。本稿では、バイオ医薬品やその他の複合糖質材料の糖鎖構造解析に従事するユーザーなど、幅広いユーザー向けに最適化された「糖質定性分析」のプロトコールを紹介します。
要約
タンパク質のグリコシル化は、重要な翻訳後修飾であり、バイオ医薬品を含む組換えタンパク質の安定性、有効性、免疫原性に影響を与えます。糖鎖構造は、生産細胞の種類、培養条件、精製方法によって異なる大きな不均一性を示します。そのため、組換えタンパク質の糖鎖構造のモニタリングと評価は、特にバイオ医薬品の製造において非常に重要です。レクチンマイクロアレイは、質量分析を補完する技術であり、高い感度と使いやすさを誇っています。ただし、通常、結果を出すには1日以上かかります。非糖質科学研究や医薬品プロセス開発に適応させるためには、自動化されたハイスループットな代替手段が必要です。そこで、世界初の全自動レクチンベースの糖鎖プロファイリングシステムが、「BEST (bead array in a single tip)」技術のコンセプトを活用して開発されました。このシステムにより、レクチン固定化ビーズを1,000個単位で調製・保存することができ、様々な目的に合わせてカスタマイズ可能な並列挿入順序が可能です。この記事では、「glyco-qualified」組換えタンパク質を含む研究の実用的なプロトコルを紹介します。12種類のポリアクリルアミド-糖鎖複合体に対する反応性を検証した後、システムの汎用性を高めるために15種類のレクチンを選択しました。さらに、Cy3からビオチンに切り替えることでサンプルのラベリングプロセスが最適化され、全体の処理時間が30分短縮されました。即時のデータ適格性評価のために、レクチン結合シグナルはトップモニターにドットコードとして表示されます。このシステムの信頼性は、日々の再現性試験、再現性試験、長期保存試験を通じて確認され、変動係数は<10%でした。このユーザーフレンドリーで迅速な糖分析装置は、バイオマーカーの評価と検証のための内因性糖タンパク質の品質モニタリングに応用できる可能性があります。この方法は、糖質科学に不慣れな人でも解析を容易にし、その実用的な有用性を広げます。
概要
タンパク質のグリコシル化は、バイオ医薬品で評価する必要がある重要な翻訳後修飾です。タンパク質の糖鎖プロファイルは、培養条件、精製プロセス、宿主細胞によって異なります1。バイオプロセスパイプライン内でグリコシル化を適格性評価するには、簡単な装置が必要です。 in vivo で分泌されるタンパク質および膜タンパク質の50%以上が複数の糖鎖で修飾されていると推定されており、糖鎖は細胞系譜、発生段階、悪性腫瘍の発症などの疾患状態によって変化します2。糖鎖プロファイルのモニタリングは、独自の診断マーカーや薬物標的を同定するための大きな可能性を秘めています。大規模なサンプルサイズを迅速に測定できる自動装置は、創薬パイプラインの数百の患者サンプルからのこのような異常なグリコシル化を検証および検証するために高い需要があります。
マイクロアレイ技術は、糖タンパク質の糖鎖プロファイリングを評価するためにグライコミクスに組み込まれています3。この方法では、スライドガラスなどの表面に糖鎖結合タンパク質であるレクチンを数個固定化します。この相互作用に基づく糖鎖分析技術は、コアタンパク質から糖鎖を事前に放出する必要がないため、糖鎖技術に不慣れな研究者のプロセスを簡素化します。バイオプロダクションなどの産業用途では、広く利用されているにもかかわらず、より多くの分析ターゲットについて糖鎖を迅速かつ容易にモニタリングできる自動化システムが必要でした。これに対処するために、当初ジェノタイピング用に開発された「Bead Array in a Single Tip」(BIST)と呼ばれる独自の概念に基づく自動糖鎖プロファイリングシステムが以前に報告されました。このシステムは、ワンボックスタイプのハイスループットオートインストゥルメント4でプロセスを簡素化します。4,5、様々なレクチン固定ビーズを並列に並べたヒントを用いて、糖タンパク質に修飾された糖鎖構造を解析する手法を確立し、GlycoBYST(以下、自動糖鎖プロファイリングシステム)と名付けた(図1A)。レクチンは1,000個のビーズに固定し、チップに詰める前と後の両方で1年間活性を維持するために乾燥させることができます。HRP標識抗ストレプトアビジン抗体(SA-HRP)などの試薬をセットしたチップとカートリッジを試作測定装置(自動反応測定装置、材料表参照)にセットすると、チップはオートピペットとして機能します。装置内部背面の化学発光検出スキャナーは、8つのチップの信号を同時に定量化します。これら8つのチップからの定量データは、測定結果を迅速に確認するために、機器のタッチスクリーンにコンパクトかつ同時にドットコードとして表示されます。さらに、測定されたピークの最大値として表された値は、生データとして装置から転送され、個々の研究者によるグラフ化が可能になります(図1A、下段)。
この記事では、著者らは、ビオチン標識タンパク質の改良された方法について説明し、処理時間を30分に短縮します。標的タンパク質は事前にビオチン化され、SA-HRPによって検出されます(図1B)。15種類のレクチンを選択した標準的なGlycoBISTチップ(自動糖鎖プロファイリング専用チップ)を作製し、解析の網羅性を高める汎用性の高い糖タンパク質糖鎖プロファイリングを実現しました。
プロトコル
本試験に使用した試薬および機器の詳細は、 資料表に記載されています。
1. 自動糖鎖プロファイリング用専用チップの作製
- 乾燥レクチン固定ビーズを4°Cで密封袋に入れてベンチに運び、室温(~23°C)に戻します。
注意: これにより、ビーズの品質を低下させる可能性のあるビーズの結露を防ぎます。このレクチン固定用ビーズの調製方法は、これまでに報告されています5。 - 机の上に帯電防止布を置き、ポータブル除電器をワークスペースに向けて置きます。これにより、その後の作業を帯電防止保護付きのベンチで行うことができます(図2A)。
- 帯電防止ピンセットを使用して、レクチン固定ビーズの間に2つのスペーサービーズが配置されるように、空の先端にビーズを挿入します(図1A)。
- すべてのビーズが満たされた後、先端を切らないように注意しながら、先端の上部をニッパーでそっと絞って開口部を閉じます(図2B)。
注意: これは、チップ内のビーズを固定するためです。ニッパーは先端が切れないように細工することをお勧めします(図2C)。 - 先端が曲がっている場合は手でまっすぐにします。
- 準備したチップは、必要になるまで乾燥剤を入れた密封袋に4°Cで保管してください。
注意: チップを使用する前に、密封されたバッグを開けて取り出す前に、チップを室温に戻す必要があります。水分はレクチンの反応性を大幅に低下させます。
2. 分析物の調製
- ルーチン分析のためにビオチン化試薬をプレパックします。
注:ルーチン分析では、ビオチン化試薬(Biotin-(AC5)2 Sulfo-Osu、 材料表を参照)を次のように少量に予め詰めておくと、迅速な分析に役立ちます。ビオチン化試薬は、そのスクシンイミジルエステルが一般的に加水分解しやすいため、乾燥させて保存することをお勧めします。- ビオチン化試薬を脱イオン水に溶解します。
- ピペットを使用して10 μgの試薬をチューブに分注します。
- ビオチン化試薬を入れたチューブを冷蔵真空濃縮器で乾燥させ、使用するまで4°Cの乾燥剤で遮光バッグに保管します。
- ステップ2.1で調製した乾燥ビオチン化試薬の入ったチューブに、分析種溶液(200 ng等価タンパク質)を加えます。
注:使用するビオチン化試薬の特性に応じて、分析対象物を溶解および希釈するために使用されるバッファー組成に注意してください。例えば、第一級アミン試薬をアミンカップリングのバッファーとして使用することは避けてください。これにより、分析種のビオチン化効率の低下を防ぐことができます。 - ボルテックスでよく混合し、卓上遠心分離機でスピンダウン(室温で1000 x g 、5秒間)して、蓋の上の液体をチューブの底に落とします。
- チューブを室温で1時間インキュベートし、光から遮蔽します。
- ビオチン化サンプルをプロービングバッファー(1% Triton X-100、0.5 M Glycine、1 mM CaCl2、および1 mM MnCl2 in TBS)で10倍に希釈し、未反応のビオチン化試薬を不活性化します。
注:アミンカップリングによる反応の場合、未反応のビオチン化試薬は、TBSのTrisなどの第一級アミン試薬を含むバッファーとの反応によって消費され、その後の測定でビーズに固定化されたレクチンやその他の物質のビオチン化を防ぎます。 - 光を遮蔽した室温で2時間インキュベートします。
- ウェスタンブロッティングにより分析種のビオチン化効率を評価し、必要に応じてHRP標識ストレプトアビジンを検出プローブとして使用します。ウェスタンブロッティング法6の文献を参照してください。
3. 自動反応測定装置による糖鎖プロファイリング用試薬の調製
- HRP標識ストレプトアビジンをブロッキング溶液で1:3000の比率で希釈します。
- 同量の基材Aと基材Bを混合します( 材料の表を参照)。サンプルあたり160μLの混合基質を使用してください。
- ブロッキング溶液、洗浄バッファー(0.1% Triton X-100/TBS)、TBS、HRP標識ストレプアビジン溶液、および各基質を、10個の液体リザーバーを備えたカートリッジの指定ウェルに分注します。
注:反応カートリッジの各ウェルを充填するための溶液の推奨容量と配置を以下に説明します。ただし、溶液やウェル配置は、自動反応測定装置内で事前に適宜変更することができます。- ステップ3.1で調製したHRP標識ストレプトアビジン0.2mLを添加します。ピペットを使用して井戸#2に。ウェルには、カートリッジの前面から #1 という名前が付けられています。
- ピペットを使用して、0.2 mLのブロッキング溶液をウェル#3に加えます。
- ピペットを使用して、TBSをウェル#4およびウェル#6に1mL加えます。
- ピペットを使用して、1 mLの洗浄バッファーをウェル#7およびウェル#8に加えます。
- ピペットを使用して、0.16 mLの基質混合物をウェル#10に加えます。
- ウェル #1、#5、および #9 が空であることを確認します。
- ステップ 2 で調製した分析種を、タンパク質の少ない 2 mL の低吸着性スクリューキャップマイクロチューブに加えます。
- 自動反応測定装置の正面ドアを開けます。
- ステップ3.3で調製した液溜め、1で調製したチップ、ステップ3.4で調製した分析物を、自動反応測定装置(図2D)の所定の位置に以下のようにセットします。各測定は、1つの垂直線方向で実行されます。
- ステップ1で準備した1つのチップを、 図2Dの黄色の記号の位置にある各穴に配置します。
注意: 繰り返しになりますが、冷蔵している場合は、密封された袋を開ける前にチップを室温に戻してください。レクチンは水分によりシグナルを劇的に失います。 - ステップ3.4で調製した分析物が入ったチューブの蓋を取り外し、同様に各穴の位置「b」に挿入します。
- 手順3.3で準備した液体が入ったカートリッジを、「c」の位置にこぼさないように注意しながら挿入します。
- Figure 2Dの「waste box」がいっぱいになったら、全体を取り外し、中身をゴミ箱に捨てて、「waste box」を元の位置に戻します。
注:反応したチップは、測定後、自動的に「廃棄物ボックス」に収集されます。
- ステップ1で準備した1つのチップを、 図2Dの黄色の記号の位置にある各穴に配置します。
4. 自動反応測定装置による糖鎖プロファイリング
- 本体側面の電源スイッチを入れてください。
- 画面に表示されている「診断開始」ボタンをタッチします(図3A)。自己診断プログラムが自動的に開始されます。しばらくすると、自己診断プログラムが完了し、HOME画面が表示されます(図3B)。
注意: 次の操作は、それぞれのアイコンをタッチすることで実行できます。「Assay」で測定を開始します。システムエラーを確認するための「メンテナンス」。過去の測定データを表示するための「履歴」。 - HOME画面に表示されている「Assay」をタッチして、プロトコールを選択します(図3B)。
- アッセイ法(図3C)の「BAssaySTD」を選択し、右下の「次へ」を押します。
- 必要に応じて各サンプルのサンプル名(図3D)を入力し、右下の「次へ」をタッチします。
- 各サンプルに使用したチップ名(図3E)を必要に応じて入力し、右下の「次へ」をタッチします。
- 右側の注意事項(図3F)を確認し、問題がなければ、右下の「開始」をタッチして測定してください。
- 画面が実行モードに切り替わったことを確認し(図3G)、「ファイナライズ」矢印が強調表示されるまで待ちます。必要に応じて、「ブレーク」をタッチして実行モードを停止します。
注:自動反応測定装置によって自動的に制御される操作は次のとおりです:(1)装置内の自動マイクロピペットノズルは、最大8つのチップを同時に取り付けます( 図2Dの記号黄色「a」を参照)。(2)分析物を含むチューブ内の溶液を5分間繰り返し吸引/排出します。(3)ブロッキング溶液に移し、5分間吸引/放電します。(4) TBSに移管し、2分間吸引・放電します。(5)HRP標識ストレプトアビジン溶液に移し、5分間吸引/放電します。(6)洗浄バッファーに移し、7分間吸引/排出します。(7) TBSに移管し、2分間吸引・放電します。(8)基質混合物に移し、一度に吸引します。(9)デバイスの背面にある8つのチップの化学発光を同時にスキャンして、ピークデータを取得します。(10)使用済みのチップを廃棄物ボックスに落とします。(11)ノズルが初期位置に戻ります。 - 測定が完了したら、画面が結果モード(図3H)に変わったことを確認します。8つのドットコードが同時に画面に表示されるため、簡単に確認できます。
注意: 左下の「履歴」をタッチすると、スキャンチャート(図3I、J)、棒グラフ(図3K、L)、テーブル(図3M)、および詳細(図3N)が画面に表示されます。ドロップダウンの「レーン」リストから他のレーンの結果を表示します。 - 本体側面のUSBポートにUSBメモリを差し込み、リザルトモード右下の「Export」をタッチすると、全レーンのデータが個別にUSBメモリに保存されます。
- 生データ(図3M)をUSBポートを使用してCSVファイルとしてエクスポートし、Excelでの詳細なデータ分析と個々のグラフ作成を行います。表の「値」は、各レクチンの信号強度を示します。強度の値は、反応したチップのスキャンにおけるピークデータ(図3I、J)の最大値を表します。
注:ピーク抽出しきい値は設定できます。分析種によっては、スペーサービーズ部分のシグナルが全体的に高くなる場合があり、その場合、スペーサー部分の値はバックグラウンドとして差し引かれます。
結果
まず、レクチンビーズアレイの特性を理解するために、各レクチンのシグナル分布を示します。レクチン固定ビーズのライブラリー(各1,000ビーズ)を調製しました。1,000個の中から15個のビーズがランダムに選ばれ、1つのチップに追加されました。典型的なグラフを 図1Aの下部に示し、同じレクチンを固定化する15個のビーズで観察された信号強度とほぼ同じことを示しています。この測定手順は、糖鎖プロファイリングを使用する前に、手作りのレクチンビーズ産生を適格性評価するために適用できます。たとえば、6つのチップが同時測定に使用され、90個のビーズの信号から変動係数(CV)が計算されます。典型的な例を 表1に示します。レクチン固定ビーズライブラリーを28種類のレクチンに対応できるように拡張したところ、28種類のレクチン中25種類がCVが10%未満と高い再現性を示しました。
次に、15種類のレクチンを持つレクチンビーズアレイのデータを示します。表2に示す15種類のレクチンをレクチンビーズアレイに選択しました。さらに、表3にリストされている12のポリアクリルアミド(PAA)モノ/ジ/トリサッカライドを測定しました。画面上のドットコーディングディスプレイを使用して測定信頼性を評価した後、生データを自動反応測定装置からエクスポートし(プロトコールステップ4.11を参照)、各糖類の反応ピーク値を使用してExcelでグラフを作成しました(図4A)。次に、これらの値を主成分分析に使用して、選択した15個のレクチンと反応した糖との相関を視覚化しました(図4B、C)。その結果、図4Aに示す12種類のPAA糖に対する各レクチンの結合パターンに明確な違いが生じました。ここでは、各シグナルの有効性は、レクチンと糖の特異性7,8の統合された以前のリストを参照していることが示されています(表2のこれらの特異性も参照してください)。AALは末端のα-Fuc、Sia-Lex、Lexに結合するため、自動糖鎖分析により、AALがフコース含有分子を認識することが確認されました(図4A)。SSAとMAL(レクチンのフルネームと略称については表2を参照)は、それぞれSiaα2-6Gal/GalNAcとSiaα2-3Galを認識しました。ビーズアレイ中のMALは、3'-O-sulfo-Galβ3GalNAcおよびLacNAcにも結合できます。これは、機械学習を用いて分析された以前の結果7と一致しており、MALは3'-O-スルホ-Galを優勢に好むのに対し、LacNAcは優勢ではない9。Galを認識するレクチンであるRCA120は、Lac/LacNAcを含む末端β-Galと強く反応し、Siaα2-6Lacには結合できたが、Siaα2-3Lacには結合できなかった。ECAは、LacよりもLacNAcとの反応性がはるかに高かった。WFAはより広範な特異性を持ち、α/β-GalNAcだけでなく、報告されているように末端β-Galも認識しました7,10。GSL IIは、GlcNAcとガラクトシル化三角/四角形N型糖鎖を認識するため、調製した分析種のうち、1つのGlcNAcを除いて糖に結合しなかった。高マンノース型N型糖鎖を認識するGRFTは、α-Manと反応しました。ABA、ジャカリン、およびMAHは、一般的にO型糖鎖の検出に使用されてきました。ABAはGalβ1-3GalNAcα-Thr/Ser(T)構造とシアリル-T構造を好むため、ビーズ配列中のABAは3'-O-sulfo-Galβ1-3GalNAcと強く反応し、α-GalNAcと弱く結合した。ABAはβ-GlcNAcも認識しており、これはアガラクトシル化N型糖鎖への結合に関する以前の報告と一致しています7。ジャカリンは比較的広範な特異性を有するため、α-マンノース、β-GalNAc、βGal、α-GalNAc、3'-O-スルホ-Galβ1-3GalNAcと反応しました。MAHは、以前に報告された3'-O-sulfate-Galβ1,3GalNAcを特異的に認識しました7。残留した4つのレクチン(NPA、LCA、PHA-L、PHA-E)は、調製したPAA糖に含まれないN型糖鎖の内部構造を認識していたため、すべての分析種との親和性がありませんでした。
得られたデータを用いて、各糖類への結合に寄与するレクチンの類似性を主成分分析グラフにプロットすることで明らかにすることができます(図4B)。図 4B の分散に寄与したすべての糖類は、寄与率をベクトルで表す統計分析手法である固有ベクトルで表されました (図 4C)。ここで注目すべきは、反応した糖が偏りなく各レクチンに寄与していることです。レクチンは、1種類の糖類だけに特異性を示すわけではありません。例えば、コンプレックス型糖鎖の存在は、ヒトのコンプレックス型糖鎖内の一部の糖鎖を部分的に認識することで判断されます。O型糖鎖を認識するジャカリン(表2の特異性を参照)は、本研究で用いた糖類のうち3'suTF構造とα-GalNAcを認識できるため、図4Bにプロットしたジャカリン(茶色の点)の位置方向に対して3'suTFとα-GalNAcをプロットしました(図4C)。WFAは、この研究で使用された糖類の中でα/β-GalNAcを認識できます。したがって、図4Cのα/β-GalNAcは、図4BにプロットされたWFAと同じ方向にプロットされました。これに対し、α-GalNAcは、ジャカリンが容易に結合できる糖構造であるため、WFAとジャカリンの間にプロットされます。本研究でプロットされた11種類の糖類は、いずれも以前に報告されたレクチンの特異性(糖結合性)と一致しており7,8、提案法が信頼性の高い測定法であることを示しています。さらに、各糖類に対応する固有ベクトルは分散しており、15種類のレクチンが最小限のバイアスで選択され、解析が包括的にカバーされていることを裏付けています。したがって、これらの15種類のレクチンを補充したチップを標準的なGlycoBISTチップと定義しました(表2)。
より実用的な例では、精製されたタンパク質製品をチップ測定に供しました(図5)。N-グリコシル化部位を有し、複合体型、ハイブリッド型、および高マンノース型N型糖鎖11を含むウシサイログロブリンを解析した。標準的なチップは、特定のレクチンの糖類に対する反応性の増加を示しました8(表2の特異性を参照)PHA-Eは、GlcNAcの二分を認識します。GRFT、マンノース型N型糖鎖の認識;SSA、Siaα2-6Gal/GalNAcを認識。RCA120、乳糖とLacNAcを認識する。そしてAAL、フコースを認識します。これらの糖鎖構造は、複合体型、ハイブリッド型、および高マンノース型のN型糖鎖に存在し、サイログロブリン11のN型糖鎖構造を効果的に評価できることを示唆しています。さらに、シアル酸を消化する酵素であるシアリダーゼAで処理したサイログロブリンは、シアル酸を認識するSSAとの反応性が低下し、シアル酸の除去後に認識されやすいRCA120、WFA、ECAとの反応性が増加しました。ウシのサイログロブリンにおけるO型糖鎖構造の存在は、これまで報告されていません。予想通り、自動糖鎖解析では、シアリダーゼ処理の有無にかかわらず、サイログロブリン中のO型糖鎖の認識は認められなかった。
選択した15種類のレクチンを用いた実行内再現性試験が示され、測定のロバスト性が理解されます(表4)。この試験では、分析物用の標準チップ 7 個とネガティブコントロール用のチップを 1 個用意し、8 つのチップすべてを同時に測定しました。この手順を1日に3回繰り返しました。「Mix Analytes」は、すべてのレクチンで有意なシグナルを得ることになった分析種の組み合わせであり、ビーズアレイの品質管理のために調製されました。ミックス分析種は、シアリダーゼ消化エリスロポエチン(EPO)、シアリダーゼおよびガラクトシダーゼ消化EPO、ヒトIgA、マトリックスメタロプロテイナーゼ3(MMP3)、およびサイログロブリンを適切に混合して調製しました。各糖タンパク質(200 ng)を、Triton X-100を含むPBS中の10 μgのビオチン化試薬で標識しました。必要に応じて、シアリダーゼおよびガラクトシダーゼの治療を説明書に記載されているとおりに行った。消化後、生成物を75°Cのヒートブロックで10分間インキュベートし、酵素を不活性化しました。分析の直前に、適切な量のビオチン化糖タンパク質(3 ng の EPO、8 ng のヒト IgA、5 ng の MMP3、15 ng のサイログロブリン)を混合しました。測定結果から、15種類のレクチンの最大CV値は13.5%、平均CVは8.2%であり、高い再現性が示されました。
さらに、測定日によるばらつきを理解するために、日々の再現性テストが示されています(表5)。標準チップとミックス分析種を事前に調製し、7チップの測定を5日間連続して毎日繰り返しました。その結果、ほとんどのレクチンのCVは10%未満でした。しかし、LCAやECAなどの一部のレクチンでは、CVが高かった。1サイクルあたり15個のレクチンの平均CVは最大7.7%、5日間の平均CV値は10%未満であり、高い再現性を示しました。ジャカリンは、ミックス分析物中のMMP3の自己消化により、低い時間的再現性を示したことが注目されました。したがって、MMP3に代わるより適切な分析種を特定する必要があります。
レクチン固定ビーズの安定性を理解するために、これらの乾燥レクチン固定ビーズを用いた長期安定性試験を示します(表6)。標準チップ、アッセイ試薬、およびミックスアナライトを事前に調製し、12 か月の保存後に測定を行いました。前述の5種類のビオチン化分析種を個々に保存し、測定前に混合しました。その結果、15種類のレクチンの平均CVは、乾式保存後12ヶ月まででも10%未満であったことが示されました。これは、同じロットから多数のチップ(最大1,000個)を一度に保存することにより、迅速かつ正確な測定を実現できることを示唆しています。
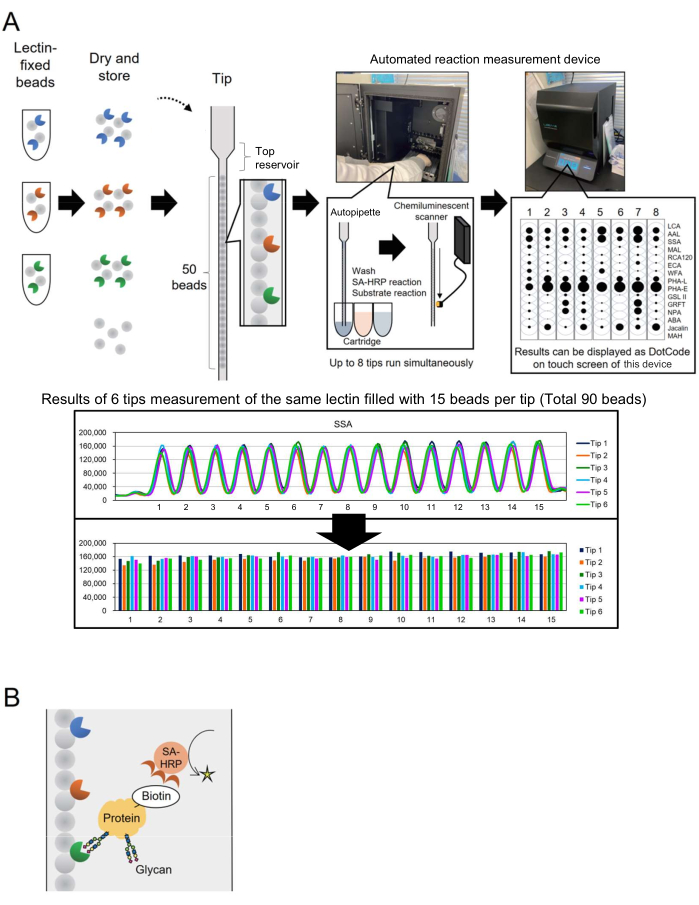
図1:「bead array in a single tip」装置のスキームと分析法 (A)自動糖鎖プロファイリングシステムのスキーム。レクチン固定ビーズは乾燥させてチップに収納できます。HRP標識抗ストレプトアビジン抗体(SA-HRP)などの試薬が入ったチップやカートリッジを測定器(自動反応測定装置)にセットして活性化すると、チップがオートピペットとして機能します。装置の背面にある化学発光検出スキャナーは、8つのチップからの信号を同時に定量化します。定量データは、測定結果を迅速に確認するために、機器のタッチスクリーンにドットコードとして表示されます。下段は、同じレクチンで90個のビーズを測定した結果です。測定結果は装置から転送され、個々の研究者によってグラフ化されます。(B)この実験で用いた検出方法のスキーム。標的タンパク質はビオチン化されており、SA-HRPを使用して検出されます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:自動反応測定装置による自動糖鎖プロファイリングの材料とセットアップのイメージ (A)チップに詰められたレクチン固定ビーズの様子。帯電防止マットの上の帯電防止ピンセットでビーズを拾い上げ、先端にビーズを充填します。(B)先端をニッパーで挟みます。トップビードのわずかな上部が絞られています。(C)先端を圧着するためのニッパー。プラスチック(黄色の円)は、完全に切り取られるのを防ぐためにつままれています。(D)自動反応測定装置に用いる材料の配置A:チップ、B:分析物が入ったチューブ、C:液体の入ったカートリッジをそれぞれ所定の位置に挿入する必要があります。廃棄物ボックスでは、反応した先端は測定後に収集されます。ボックスは取り外すことができます。 この図の拡大版を表示するには、ここをクリックしてください。
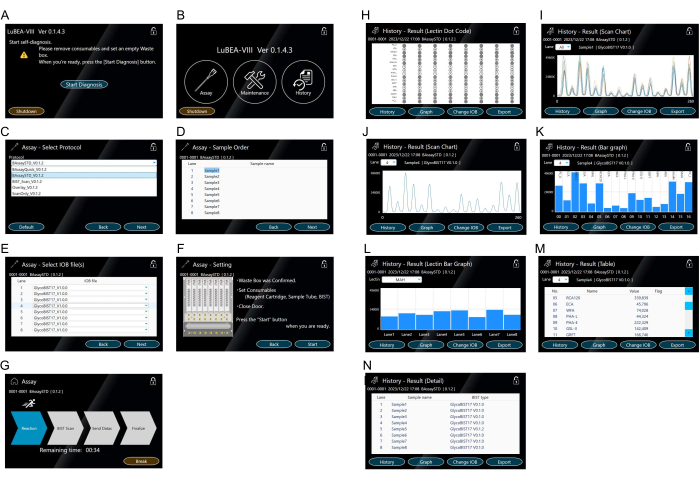
図3:機械操作用のタッチスクリーン (A)電源を入れると、自己診断プログラムが自動的に開始されます。(B)HOME画面に「アッセイ」「メンテナンス」「履歴」が表示されます。(C-G)「アッセイ」モードの操作。アッセイ法の選択(C)。事前に複数のプロトコルを登録できます。サンプル(分析物)の注文(D)の入力。先端の種類(E)を選択します。アッセイ方法の設定(F)を確認し、「アッセイ開始」画面(G)からアッセイを開始します。(H-N)「履歴」での結果の表現。レクチンドットコード(H)は、アッセイ完了後または「履歴」モードから表示されます。15個のレクチンのスキャンチャートが、すべてのサンプル(I)または各サンプル(J)の画面に表示されます。スキャンチャートは棒グラフ(K)で表示されます。他のレーンの棒グラフは、ドロップダウンの「レーン」リストから選択できます。レクチン(L)あたりのサンプルの8レーンを比較した棒グラフ。他のレクチンは「レクチン」のドロップダウンリストから選択することができます。定量値(M)を示す表。実行された測定方法の記録(N)。この図の拡大版を表示するには、ここをクリックしてください。
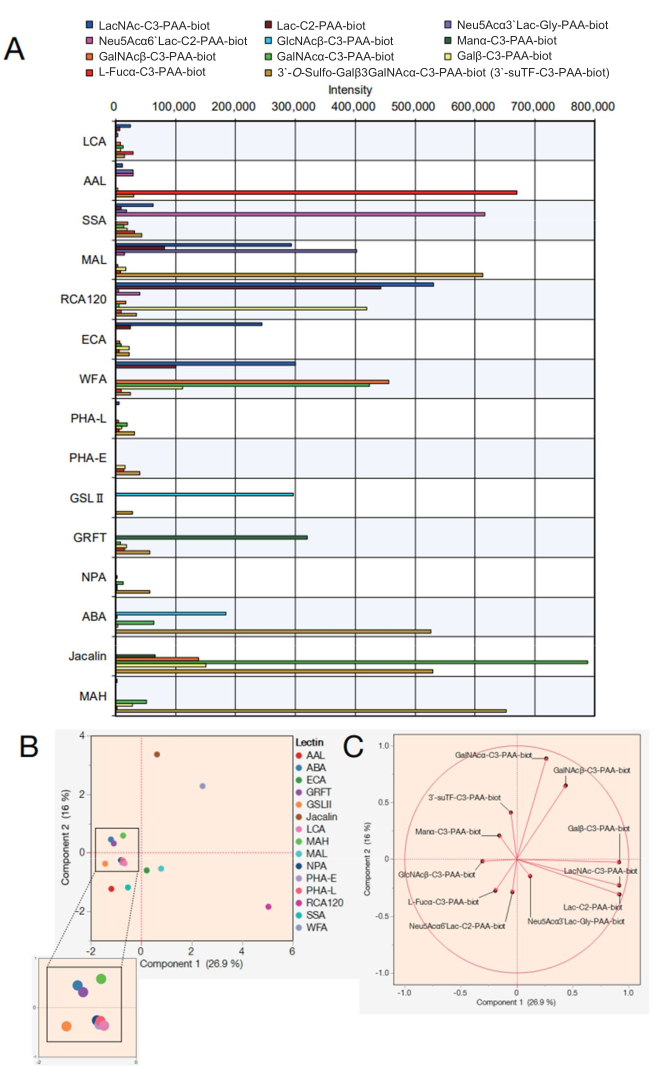
図4:自動糖鎖プロファイリングシステムにおけるPAA糖との反応性の評価 (A)レクチンと各種PAA糖との反応性を示すグラフをネガティブコントロール値で調整しました。(B) (A)のデータに基づく主成分分析。(C) (B) の解析による固有ベクトル。部品(B)と(C)は適合する解析ソフトウェアを使用しました。 この図の拡大版を表示するには、ここをクリックしてください。
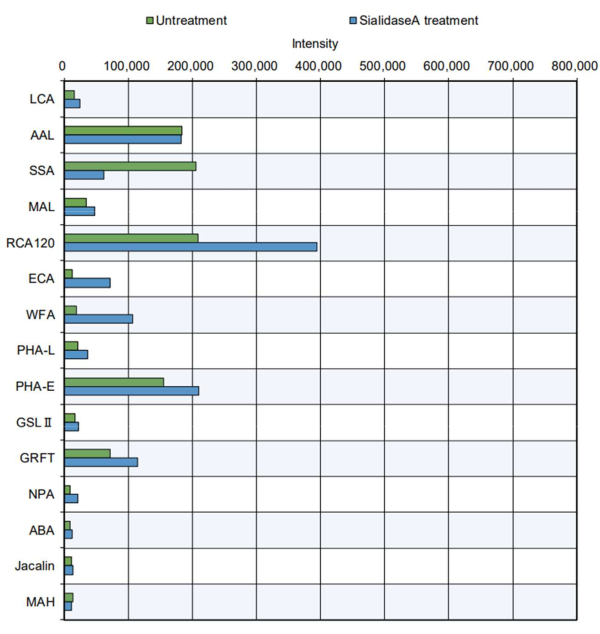
図5:精製ウシサイログロブリンタンパク質を用いたGlycoBIST反応性の検証。 無処理のサンプル調製は、シアリダーゼAの添加を除いて、バッファー単独と同じ消化条件下で 行った。
表1:レクチン固定ビーズによる再現性試験。 28種類のレクチンに対する反応性の再現性を評価しました。分析種は各チップで反応させました。EPO:エリスロポエチン、PSA:前立腺特異抗原、Tf:トランスフェリン、M2BP:Mac-2結合タンパク質、hIgG:ヒトIgG、MMP3:マトリックスメタロプロテイナーゼ3、(Sia+):シアリダーゼA消化分析物、(Sia+、Gal+):シアリダーゼAおよびガラクトシダーゼ消化分析物、Ab:抗体。DSA: チョウセンアサガオ 凝集素、HypninA2: ヒプネア・ジャポニカ 凝集素、WGA:コムギ胚芽凝集素、UDA: Urtica dioica 凝集素、BPL: バウヒニア・プルプレア ・レクチン、Orysata: Oryza sativa レクチン、LSL-N: Laetiporus sulphureus lectin N末端ドメイン、SNA: Sambucus nigra レクチン、BanLec:バナナレクチン、MPA: Maclura pomifera 凝集素、TxLC-I: Tulipa gesneriana 凝集素、AOL: Aspergillus oryzae lectin、ACG: Agrocybe cylindracea ガレクチン。CV:変動係数。 この表をダウンロードするには、ここをクリックしてください。
表2:自動糖鎖プロファイリングの標準的なヒントを構成するレクチンのリスト。この表をダウンロードするには、ここをクリックしてください。
表3:自動糖鎖プロファイリングシステムの標準物質として使用されるPAA糖。この表をダウンロードするには、ここをクリックしてください。
表4:実行内再現性テストの結果。 CV:変動係数。 この表をダウンロードするには、ここをクリックしてください。
表5:日中再現性試験の結果。 CV:変動係数。 この表をダウンロードするには、ここをクリックしてください。
表6:長期安定性試験の結果。 CV:変動係数。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
本研究では、「Bead Array in a Single Tip」技術を用いた糖鎖修飾の迅速評価技術を開発しました。本研究では、糖質科学の研究者と非糖質科学の研究者の両方を対象に、日常的で包括的な糖鎖修飾評価を容易にするために設計された標準的なGlycoBISTチップを導入しました。レクチンマイクロアレイは、典型的には20-100個のレクチン12,13を用いており、評価に広く利用されている。しかし、マイクロアレイ上の一部のレクチンの特異性が重複していることや、粗い臨床サンプルのグライコミクスと比較して、標的糖タンパク質上のグリコフォームの種類が比較的限られていることを考慮すると、焦点を絞った糖鎖プロファイリングの簡易評価には15個のレクチンで十分であると予想されました。
このプロトコールの重要なステップは、レクチンを固定化したビーズまたはそれらのビーズで満たされたチップを、保存後に室温に戻してから測定に使用することです。特に、結露は信号を弱めることが観察されました。したがって、保存袋は室温に戻るまで絶対に開けないことをお勧めします。ビオチン化試薬の保管には、保存前に完全に乾燥させることも不可欠です。乾燥プロセスが不十分な場合、ビオチン化試薬14の加水分解により、タンパク質に対するビオチン化の効率が低下する。
修正とトラブルシューティングに関しては、特に自動反応測定装置の測定方法に関するばらつきを減らすための方法が検討されました。特に、分析に用いるリザーバー内のバッファー容量が150μLの場合、チップ内に気泡が入り込むため、反応効率が低下し、値のばらつきが大きくなります。したがって、少なくとも200μLのバッファーをリザーバーに入れることをお勧めします。
オートピペッティング中にチップに充填される液体の量も重要な要素です。先端は、液体が次の反応ステップに移動するときに液体を完全に排出することはできません。したがって、少なからず、前のステップのバッファーは次のステップに持ち越され、新しいバッファーが吸引されるときに、前のバッファーは挿入された溶液の上部領域に残ります。したがって、基質およびその他の溶液は、上部リザーバーを満たすために十分に吸引する必要があります( 図1Aを参照)。装置上での抗体反応は不可逆的であることを考えると、初期設定中のエラーを避け、注意を払うことが重要です。
この方法の1つの制限は、血清および培養上清に由来する可溶性タンパク質に限定されることです。現在の方法では、レクチンはビーズに共有結合していないため、細胞抽出物や組織抽出物などの高濃度の界面活性剤を含むサンプルを分析することができません。したがって、これらの制限に対処するには、将来の改善が必要です。
レクチンビーズアレイの重要性は、ビーズに固定されたレクチン種の互換性と拡張性にあります。例えば、全自動糖鎖プロファイリングシステムを用いた大規模差解析(>1,000サンプル)では、レクチンマイクロアレイを用いた標的糖タンパク質の糖鎖プロファイリング(<100サンプル)を事前に行い、チップ内の15レクチンのラインナップを調整することができます。さらに、レクチン固定ビーズの安定性が高いため、初期のチップ設計から日常的な手順による測定まで、すぐに実験を行うことができます。高い信頼性を示した28種類のレクチンのうち25種類(表1)だけでなく、ユーザーが関心のある任意のレクチンを使用して、前述の定期的な信頼性試験に従って、特定の実験のためのカスタム自動糖鎖プロファイリングシステムを作成することができます。このアプローチにより、標準的な糖鎖プロファイリングシステムと組み合わせて、8種類の異なるチップからなる120-lectinビーズアレイの設計が可能になりました。
これまでの研究では、レクチンマイクロアレイ15に沿ったCy3標識糖タンパク質の検出手順の確立に焦点が当てられていました。この方法は、蛍光干渉のため、チップ内で並列に13個のレクチンに制限されていました。HRP検出標識を使用する現在の方法では、15個のレクチン固定ビーズと2個のコントロールビーズ(ポジティブおよびネガティブ)をチップに収納できます。さらに、サンプルのビオチン化により、分析プロセスが短縮されました。
この分析手法は、学術研究だけでなく、医学・薬学研究、食品、化粧品などの産業分野にも応用できます。レクチンマイクロアレイおよびグライコプロテオミクス技術は十分に確立されていますが、この研究のアプローチは、その完全な自動化とより少ないステップでの迅速な分析能力において依然として重要です。今後は、特定の糖タンパク質を用いてシグナルを正常化し、チップにレクチン固定ビーズと抗体固定ビーズを併用することで、この解析を定量的な方法に強化していく予定です。
開示事項
AO、TO、NT、HS、KK、MA、SY、TM、KN、OS、KSは、Precision System Science Co., Ltd.の従業員です。
謝辞
本研究は、国立研究開発法人科学技術振興機構(JST)の助成を受け、課題番号JPMJTR204A、一部は日本学術振興会科学研究費23H02680(AK)の支援を受けて行われました。英語の編集にご協力いただいたエディテージ(www.editage.jp)に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
参考文献
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103(2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved