Method Article
Быстрая гликокачественная оценка рекомбинантных белков с использованием полностью автоматизированной системы
В этой статье
Резюме
Ранее была разработана система автоматизированного и экспресс-анализа гликанов на белках. В данной статье представлен протокол «гликокачественного анализа», оптимизированный для широкого круга пользователей, например, для тех, кто занимается анализом гликановых структур в биофармацевтических препаратах и других гликоконъюгатных материалах.
Аннотация
Гликозилирование белков, важнейшая посттрансляционная модификация, влияет на стабильность, эффективность и иммуногенность рекомбинантных белков, в том числе биофармацевтических препаратов. Гликановые структуры демонстрируют значительную гетерогенность, варьирующуюся в зависимости от типов клеток-производителей, условий культивирования и методов очистки. Следовательно, мониторинг и оценка гликановых структур рекомбинантных белков имеет жизненно важное значение, особенно в биофармацевтическом производстве. Лектиновый микрочип, дополняющий масс-спектрометрию, отличается высокой чувствительностью и простотой использования. Однако, как правило, для получения результатов требуется более суток. Чтобы адаптировать его к исследованиям, не связанным с гликонаукой, или к разработке процессов производства лекарственных препаратов, необходима автоматизированная альтернатива с высокой пропускной способностью. Поэтому была разработана первая в мире полностью автоматизированная система профилирования гликана на основе лектина, использующая концепцию технологии «массив шариков в одном наконечнике (BIST)». Эта система позволяет готовить и хранить иммобилизованные лектином бусины в единицах по 1 000 штук с настраиваемыми заказами параллельной вставки для различных целей. В данной статье представлен практический протокол исследований с использованием «гликоквалифицированных» рекомбинантных белков. После проверки их реакционной способности в отношении 12 полиакриламид-гликановых конъюгатов были выбраны 15 лектинов для повышения универсальности системы. Кроме того, процесс мечения образцов был оптимизирован за счет перехода с Cy3 на биотин, что сократило общее время обработки на 30 минут. Для немедленной квалификации данных сигналы связывания лектина отображаются в виде доткода на верхнем мониторе. Надежность системы была подтверждена ежедневными испытаниями воспроизводимости, повторяемостью и долговременным хранением с коэффициентом вариации <10%. Этот удобный в использовании и быстрый гликоанализатор может быть применен в мониторинге качества эндогенных гликопротеинов для оценки и валидации биомаркеров. Этот метод облегчает анализ для новичков в гликонауке, тем самым расширяя его практическую полезность.
Введение
Гликозилирование белка является важнейшей посттрансляционной модификацией, которую необходимо оценивать в биофармацевтических препаратах. Гликановые профили белков могут варьироваться в зависимости от условий культивирования, процессов очистки и клеток хозяина1. Для квалификации гликозилирования в процессе биопроцесса требуются простые приборы. Подсчитано, что более 50% секретируемых и мембранных белков in vivo модифицированы множественными гликанами, которые изменяются в зависимости от клеточной линии, стадии развития и статуса заболевания, такого как начало злокачественного новообразования2. Мониторинг профилей гликанов обладает значительным потенциалом для выявления уникальных диагностических маркеров и мишеней для лекарств. Автоматизированные приборы, способные быстро измерять большие размеры образцов, пользуются большим спросом для проверки и валидации такого аберрантного гликозилирования из сотен образцов пациентов, находящихся в процессе разработки.
Технология микрочипов была включена в гликомику для оценки гликанового профилирования гликопротеинов3. В этом методе несколько лектинов, которые являются гликан-связывающими белками, иммобилизуются на поверхности, такой как предметное стекло. Эта технология гликоанализа, основанная на взаимодействии, не требует предварительного высвобождения гликанов из основных белков, что упрощает процесс для исследователей, не знакомых с гликотехнологией. Несмотря на широкое распространение, для промышленного применения, такого как биопроизводство, требовалась автоматизированная система, способная быстро и легко контролировать гликаны для большего числа целей анализа. Для решения этой проблемы ранее сообщалось об автоматизированной системе профилирования гликанов, основанной на уникальной концепции под названием «массив шариков в одном наконечнике» (BIST), первоначально разработанной для генотипирования. Эта система упрощает процесс с помощью однокоробочного типа высокопроизводительного автоинструмента4. С использованием наконечников, в которых различные фиксированные лектин-фиксированные шарики расположены параллельно 4,5, был создан метод анализа гликановых структур, модифицированных в гликопротеинах, получивший название GlycoBIST (далее именуемый «автоматическая система профилирования гликанов») (рисунок 1А). Лектины можно закрепить на 1000 бусинах и высушить для поддержания активности в течение года, как до, так и после упаковки в наконечник. После установки наконечников и картриджей, содержащих реагенты, такие как меченые HRP антистрептавидиновые антитела (SA-HRP), установлены в измерительный прототип (автоматизированное устройство для измерения реакций, см. Таблицу материалов), наконечник функционирует как автопипетка. Сканер для обнаружения хемилюминесценции во внутренней задней части прибора количественно оценивает сигналы восьми зондов одновременно. Количественные данные с этих восьми наконечников компактно и одновременно отображаются в виде точечных кодов на сенсорном экране прибора для быстрого подтверждения результатов измерений. Кроме того, значение, представленное в виде максимума измеренного пика, передается из прибора в виде исходных данных, что позволяет отдельным исследователям строить графики (рис. 1A, нижняя панель).
В данной статье авторы описывают усовершенствованный метод мечения биотином белков, сокращающий время обработки до 30 минут. Белки-мишени заранее биотинилируются и обнаруживаются с помощью SA-HRP (рис. 1B). Стандартный наконечник GlycoBIST (специализированный наконечник для автоматического профилирования гликанов) с 15 выбранными лектинами был сконструирован для достижения универсального профилирования гликопротеингликанов для аналитической полноты.
протокол
Подробная информация о реагентах и оборудовании, использованном для этого исследования, приведена в Таблице материалов.
1. Подготовка специализированного наконечника для автоматического профилирования гликана
- Принесите высушенные фиксированные лектином бусины, хранящиеся при температуре 4 °C в герметичном пакете, к скамейке и дайте им вернуться к комнатной температуре (~23 °C).
ПРИМЕЧАНИЕ: Это предотвращает образование конденсата на бусинах, которое может ухудшить их качество. Ранее сообщалось об этом способе приготовления лектинфиксирующих бусин5. - Положите антистатическую ткань на стол и поставьте портативный антистатический элиминатор лицом к рабочему месту. Это позволяет в дальнейшем выполнять работы на стенде с антистатической защитой (рисунок 2А).
- Вставьте бусины в пустой наконечник с помощью антистатического пинцета таким образом, чтобы между бусинами, фиксирующими лектин, были помещены две бусины-распорки (рис. 1A).
- Аккуратно сожмите верхнюю часть кончика кусачками, чтобы закрыть отверстие, стараясь не разрезать кончик после того, как все бусины будут заполнены (Рисунок 2B).
ПРИМЕЧАНИЕ: Это необходимо для закрепления бусин внутри кончика. Рекомендуется, чтобы кусачки были изготовлены таким образом, чтобы не порезать кончик (Рисунок 2C). - Расправьте кончик рукой, если он согнут.
- Храните подготовленный наконечник при температуре 4 °C в герметичном пакете с влагопоглотителем до тех пор, пока он не понадобится.
ПРИМЕЧАНИЕ: Перед использованием наконечника его следует довести до комнатной температуры, прежде чем открывать запечатанный пакет и вынимать его. Влага резко снижает реакционную способность лектинов.
2. Подготовка аналитов
- Предварительно упакуйте реагент для биотинилирования для рутинного анализа.
ПРИМЕЧАНИЕ: Для рутинного анализа полезно предварительно упаковать реагент биотинилирования (Biotin-(AC5)2 Sulfo-Osu, см. Таблицу материалов) небольшими порциями следующим образом для быстрого анализа. Рекомендуется высушить реагент для биотинилирования и хранить его, так как его сукцинимидиловый эфир, как правило, подвержен гидролизу.- Растворите реагент биотинилирования в деионизированной воде.
- Диспонируйте 10 г реагента в пробирки с помощью пипетки.
- Пробирки с реагентом биотинилирования высушите в охлаждаемом вакуумном концентраторе и храните их с влагопоглотителем при температуре 4 °C в светонепроницаемом пакете до использования.
- Добавьте раствор аналита (200 нг экв. белка) в пробирку, содержащую высушенный реагент для биотинилирования, приготовленный на шаге 2.1.
ПРИМЕЧАНИЕ: Помните о буферной композиции, используемой для растворения и разбавления аналитов, в зависимости от свойств используемого реагента для биотинилирования. Например, избегайте использования первичных аминных реагентов в качестве буферов для связи аминов. Это предотвратит снижение эффективности биотинилирования аналитов. - Хорошо перемешайте с помощью вортекса, затем уменьшите (1000 x g в течение 5 с при комнатной температуре) в настольной центрифуге, чтобы капнуть жидкость с крышки на дно пробирки.
- Инкубируйте пробирки в течение 1 ч при комнатной температуре, защищенной от света.
- Разбавьте биотинилированные образцы в 10 раз в зондирующем буфере (1% Triton X-100, 0,5 М глицина, 1 мМ CaCl2 и 1 мМ MnCl2 в TBS) для инактивации любых непрореагировавших реагентов биотинилирования.
ПРИМЕЧАНИЕ: В случае реакций с аминовым соединением, непрореагировавший реагент биотинилирования расходуется в ходе реакции с буфером, содержащим первичный аминный реагент, такой как Tris в TBS, который предотвращает биотинилирование лектинов и других веществ, иммобилизованных на шариках при последующем измерении. - Выдерживать при комнатной температуре, защищенной от света, в течение 2 ч.
- Оцените эффективность биотинилирования аналитов с помощью вестерн-блоттинга, при необходимости используя меченный HRP стрептавидин в качестве зонда для обнаружения. Пожалуйста, обратитесь к литературе по западным методам блоттинга6.
3. Приготовление реагентов для профилирования гликана с помощью автоматизированного прибора для измерения реакций
- Разведите HRP-конъюгированный стрептавидин с блокирующим раствором в соотношении 1:3000.
- Смешайте с равными объемами субстрата А и субстрата Б (см. Таблицу материалов). Используйте 160 мкл смешанного субстрата на образец.
- Дозируйте блокирующий раствор, промывочный буфер (0,1% Triton X-100/TBS), TBS, HRP-конъюгированный раствор стрептавидина и каждый субстрат в предназначенные для этого лунки картриджа с 10 резервуарами для жидкости.
ПРИМЕЧАНИЕ: Рекомендуемый объем и расположение растворов для заполнения каждой лунки реакционного картриджа описаны ниже. Тем не менее, решения и расположение лунок могут быть изменены в автоматическом устройстве измерения реакции по мере необходимости.- Добавьте 0,2 мл меченного HRP стрептавидина, приготовленного на шаге 3.1. до лунки #2 с помощью пипетки. Колодец назван #1 по передней части картриджа.
- Добавьте 0,2 мл блокирующего раствора в лунку #3 с помощью пипетки.
- Добавьте 1 мл TBS в лунки #4 и #6 с помощью пипетки.
- Добавьте 1 мл промывочного буфера в лунки #7 и #8 с помощью пипетки.
- Добавьте 0,16 мл субстратной смеси в лунку #10 с помощью пипетки.
- Убедитесь, что колодцы #1, #5 и #9 пусты.
- Добавьте подготовленные на шаге 2 аналиты в микропробирку с завинчивающейся крышкой с низким содержанием адсорбента 2 мл.
- Откройте переднюю дверцу автоматического устройства измерения реакции.
- Резервуары для жидкости, подготовленные на шаге 3.3, наконечники, приготовленные на этапе 1, и аналиты, приготовленные на шаге 3.4, установите в назначенные положения автоматизированного устройства измерения реакции (рисунок 2D) следующим образом. Каждое измерение выполняется в одном вертикальном направлении линии.
- Поместите по одному наконечнику, подготовленному на шаге 1, в каждую лунку в позиции «a» желтого символа на рисунке 2D.
ПРИМЕЧАНИЕ: Опять же, если кончики хранятся в холодильнике, доведите их до комнатной температуры, прежде чем открывать запечатанный пакет. Лектины резко теряют сигнал из-за влаги. - Снимите крышку пробирки, содержащей аналит, приготовленный на шаге 3.4, и вставьте его в каждое отверстие в положении «b» аналогичным образом.
- Вставьте картридж с жидкостью, приготовленной на шаге 3.3, стараясь не пролить ее в положение «c».
- Уберите весь «мусорный ящик» на рисунке 2D , когда он заполнится, выбросьте содержимое в мусорное ведро и верните «мусорный ящик» в исходное положение.
ПРИМЕЧАНИЕ: Прореагировавшие типсы автоматически собираются в «контейнер для отходов» после измерения.
- Поместите по одному наконечнику, подготовленному на шаге 1, в каждую лунку в позиции «a» желтого символа на рисунке 2D.
4. Профилирование гликана с помощью автоматизированного прибора для измерения реакций
- Включите выключатель питания сбоку от основного блока.
- Нажмите кнопку «Начать диагностику», отображаемую на экране (рисунок 3A). Программа самодиагностики запускается автоматически. Через некоторое время программа самодиагностики завершается, и появляется экран HOME (рисунок 3B).
ПРИМЕЧАНИЕ: Следующие операции можно выполнить, коснувшись соответствующих значков. «Пробой» начать измерение. «Техническое обслуживание» для подтверждения любой системной ошибки. «История» для просмотра данных прошлых измерений. - Нажмите «Анализ», отображаемый на главном экране, чтобы выбрать протокол (Рисунок 3B).
- Выберите «BAssaySTD» метода анализа (Рисунок 3C) и нажмите «Далее» в правом нижнем углу.
- Введите имя образца (рисунок 3D) для каждого образца по мере необходимости, а затем нажмите «Далее» в правом нижнем углу.
- При необходимости введите название наконечника (рис. 3E), используемое для каждого образца, а затем нажмите «Далее» в правом нижнем углу.
- Подтвердите примечания справа (Рисунок 3F) и, если проблем нет, нажмите «Пуск» в правом нижнем углу для измерения.
- Подтвердите переход экрана в режим работы (рисунок 3G) и дождитесь, пока стрелка «завершить» не загорится. При необходимости нажмите «Перерыв», чтобы остановить режим работы.
ПРИМЕЧАНИЕ: Автоматические реакционные измерительные приборы автоматически контролируются следующим образом: (1) К форсункам автоматической микропипетки внутри прибора одновременно прикрепляется не более восьми наконечников (см. желтый символ «a» на рисунке 2D); (2) Многократно отсасывайте/выглаживайте раствор в пробирке, содержащей аналит, в течение 5 минут; (3) Переложите в блокирующий раствор и аспирацию/разрядку в течение 5 минут; (4) Перевод в TBS и аспирация/выписка в течение 2 минут; (5) Переложите в меченный HRP раствор стрептавидина и аспирацию/выписку в течение 5 минут; (6) Переложите в буфер для промывки и аспирацию/выгрузку в течение 7 минут; (7) Перевод в TBS и аспирация/выписка в течение 2 минут; (8) Переложите на субстрат смесь и аспират одновременно; (9) Отсканируйте хемилюминесценцию восьми зондов одновременно на задней панели устройства для получения пиковых данных; (10) Выбросьте использованные наконечники в мусорный контейнер; (11) Сопло возвращается в исходное положение. - Убедитесь, что экран перешел в режим получения результатов (Рисунок 3H) после завершения измерения. Восемь доткодов одновременно отображаются на экране для удобства проверки.
ПРИМЕЧАНИЕ: Нажмите на кнопку «История» в левом нижнем углу, чтобы отобразить на экране диаграмму сканирования (Рисунок 3I,J), гистограмму (Рисунок 3K,L), таблицу (Рисунок 3M) и подробную информацию (Рисунок 3N). Просматривайте результаты с других полос движения из выпадающего списка «Полосы». - Вставьте USB-накопитель в USB-порт на боковой стороне основного устройства и нажмите «Экспорт» в правом нижнем углу режима результатов, чтобы сохранить данные всех полос по отдельности в USB-памяти.
- Экспортируйте необработанные данные (рис. 3M) в виде файла CSV с помощью USB-порта для дальнейшего анализа данных и построения индивидуальных графиков в Excel. «Значение» в таблице обозначает интенсивность сигнала каждого лектина. Значения интенсивности представляют собой максимальное значение пиковых данных (рис. 3I, J) при сканировании прореагировавших зондов.
ПРИМЕЧАНИЕ: Можно установить пиковый порог экстракции. В зависимости от аналитов, сигнал в части распорного шва может быть выше в целом, и в этом случае значение в распорном участке вычитается в качестве фона.
Результаты
Во-первых, показано распределение сигнала для каждого лектина, чтобы понять характеристики массива лектиновых шариков. Была подготовлена библиотека фиксированных лектином бусин (1000 бусин каждая). Пятнадцать бусин были случайным образом выбраны из 1000 и добавлены к одному кончику. Типичная диаграмма показана в нижней части рисунка 1А, представляющая почти одинаковую интенсивность сигнала, наблюдаемую среди 15 бусин, иммобилизующих один и тот же лектин. Эта процедура измерения может быть применена для квалификации ручного производства лектиновых шариков до использования гликанового профилирования. Например, шесть наконечников используются для одновременного измерения коэффициента вариации (CV) по сигналам на 90 бусинах. Типичный пример приведен в таблице 1. Когда библиотека фиксированных лектинов была расширена до 28 различных лектинов, 25 из 28 лектинов продемонстрировали высокую воспроизводимость с CV менее 10%.
Далее показаны данные для матрицы лектиновых шариков с 15 различными лектинами. 15 лектинов, показанных в таблице 2, были выбраны для массива лектиновых шариков. Кроме того, было измерено 12 полиакриламидов (ПАА) моно/ди/трисахаридов, перечисленных в таблице 3. После оценки надежности измерений с помощью дисплея с доткодированием на экране, исходные данные были экспортированы с автоматизированного устройства измерения реакций (см. протокол шаг 4.11), и в Excel был построен график с использованием значений пиков реакции на каждом сахариде (рис. 4A). Затем эти значения были использованы для анализа главных компонент для визуализации корреляции между выбранными 15 лектинами и прореагировавшими сахаридами (рис. 4B, C). Это привело к явной разнице в характере связывания каждого лектина с 12 сахарами ПАА, показанными на рисунке 4А. В настоящем описании показано, что достоверность каждого сигнала относится к интегрированным предыдущим спискам специфичностей лектина и сахаридов 7,8 (также см. эти особенности в таблице 2). Поскольку AAL связывается с концевыми α-Fuc, Sia-Lex и Lex, автоматический анализ гликанов подтвердил распознавание AAL молекул, содержащих фукозу (рис. 4A). SSA и MAL (полные названия лектинов и их сокращения см. в таблице 2) признали Siaα2-6Gal/GalNAc и Siaα2-3Gal соответственно. MAL в массиве шариков также может связываться с 3'-O-сульфо-Galβ3GalNAc и LacNAc. Это согласуется с предыдущими результатами, проанализированными с использованием машинного обучения7, в которых MAL предпочитает 3'-O-сульфо-Gal преимущественно не является, в то время как LacNAc не является доминирующим9. RCA120, лектин, распознающий Gal, сильно реагировал с терминальными β-Gal, включая Lac/LacNAc, и ему разрешалось связываться с Siaα2-6Lac, но не с Siaα2-3Lac. Реакционная способность ЭКА с LacNAc была намного выше, чем у Lac. WFA имела более широкую специфичность, которая признавала не только α/β-GalNAc, но и терминальный β-Gal, как сообщалось 7,10. GSL II, который распознает GlcNAc и галактозилированный три/тетраантеннарный N-гликан, не связывался ни с какими сахаридами, за исключением одного GlcNAc среди полученных аналитов. GRFT, который распознает N-гликаны маннозного типа, реагировал с α-Man. АБА, Джакалин и МАГ обычно используются для обнаружения О-гликанов. Поскольку АБК предпочитает структуры Galβ1-3GalNAcα-Thr/Ser (T) и сиалил-T, АБК в массиве гранул сильно реагирует с 3'-O-сульфо-Galβ1-3GalNAc и слабо связывается с α-GalNAc. АБК также признала β-GlcNAc, что согласуется с предыдущими сообщениями о связывании с агалактозилированными N-гликанами7. Жакалин обладает относительно более широкой специфичностью и поэтому реагирует с α-маннозой, β-GalNAc, βGal, α-GalNAc, 3'-O-сульфо-Galβ1-3GalNAc. MAH специфически распознал 3'-O-сульфат-Galβ1,3GalNAc, как сообщалось ранее7. Остаточные четыре лектина, NPA, LCA, PHA-L и PHA-E, распознавали внутреннюю структуру N-гликан, не входящего в состав приготовленных сахаридов ПАА, и, таким образом, не имели сродства со всеми аналитами.
Используя полученные данные, можно уточнить сходство лектинов, участвующих в связывании с каждым сахаридом, нанеся их на график анализа главных компонент (рис. 4В). Все сахариды, которые внесли свой вклад в дисперсию на рисунке 4B, были представлены собственным вектором, методом статистического анализа, в котором отношение вклада представлено вектором (рисунок 4C). Здесь примечательно, что прореагировавшие сахариды вносят свой вклад в каждый лектин без смещения. Лектины не проявляют специфичности только к одному типу сахаридов. Например, наличие гликанов сложного типа определяется частичным распознаванием некоторых гликанов в составе гликанов сложного типа у человека. Джакалин, который распознает O-гликаны (см. особенности в таблице 2), может распознавать структуру 3'suTF и α-GalNAc среди сахаридов, использованных в этом исследовании, и поэтому 3'suTF и α-GalNAc были построены (рисунок 4C) относительно направления положения Jacalin (коричневая точка), нанесенного на рисунок 4B. WFA может распознавать α/β-GalNAc среди сахаридов, используемых в этом исследовании; следовательно, α/β-GalNAc на рисунке 4C был нанесен в том же направлении, что и WFA, построенный на рисунке 4B. Напротив, α-GalNAc построен между WFA и Jacalin, потому что это сахаридная структура, с которой Jacalin способен легко связываться. Все 11 сахаридов, отмеченных в этом исследовании, согласуются со специфичностью (связыванием сахаридов) лектинов, о которой сообщалось ранее 7,8, что указывает на то, что предложенный метод является надежным методом измерения. Кроме того, собственные векторы, соответствующие каждому сахариду, диспергированы, что свидетельствует о том, что 15 лектинов были выбраны с минимальным смещением для обеспечения полного охвата в анализе. Следовательно, наконечник, пополняемый этими 15 лектинами, был определен как стандартный GlycoBIST-наконечник (Таблица 2).
В более практическом примере очищенные белковые продукты подвергали измерению с помощью наконечника (рис. 5). Был проанализирован тиреоглобулин крупного рогатого скота, который обладает сайтом N-гликозилирования и содержит сложные, гибридные и высокоманнозные N-гликаны 11-го типа. Стандартный наконечник указывал на повышенную реакционную способность некоторых лектинов к сахаридам8 (см. особенности в таблице 2): PHA-E, который распознает разделяющий пополам GlcNAc; GRFT, распознавание N-гликанов маннозного типа; SSA, распознавание Siaα2-6Gal/GalNAc; RCA120, распознающий лактозу и LacNAc; и AAL, распознавание фукозы. Эти гликановые структуры присутствуют в сложных, гибридных и высокоманнозных N-гликанах, что позволяет предположить, что N-гликановая структура тиреоглобулина11 может быть эффективно оценена. Кроме того, тиреоглобулин, обработанный сиалидазой А, ферментом, который переваривает сиаловую кислоту, показал снижение реакционной способности с SSA, который распознает сиаловую кислоту, и повышенную реактивность с RCA120, WFA и ECA, которые легче распознаются после удаления сиаловых кислот. О присутствии структур О-гликана в тиреоглобулине крупного рогатого скота ранее не сообщалось. Как и ожидалось, в анализе автоматического гликана не было обнаружено распознавания О-гликана в тиреоглобулине с лечением сиалидазой или без него.
Показано, что внутрипрогонный тест на воспроизводимость с использованием 15 выбранных лектинов позволяет понять надежность измерений (Таблица 4). Для этого теста было подготовлено семь стандартных зондов для аналитов и дополнительный наконечник для отрицательного контроля, причем все восемь зондов были измерены одновременно. Эту процедуру повторяли три раза в течение одного дня. Для контроля качества массива шариков были подготовлены «Смешанные аналиты», комбинация аналитов, которая привела к получению значимых сигналов по всем лектинам. Смесь аналитов была получена путем надлежащего смешивания эритропоэтина, расщепленного сиалидазой и галактозидазой, человеческого IgA, матриксной металлопротеиназы 3 (MMP3) и тиреоглобулина. Каждый гликопротеин (200 нг) был помечен 10 мкг реагента биотинилирования в PBS, содержащем Triton X-100. При необходимости проводили лечение сиалидазой и галактозидазой, как описано в инструкции. После разложения продукты инкубировали в тепловом блоке при температуре 75 °C в течение 10 минут для инактивации фермента. Соответствующие количества биотинилированных гликопротеинов (3 нг ЭПО, 8 нг человеческого IgA, 5 нг MMP3 и 15 нг тиреоглобулина) смешивали непосредственно перед анализом. Результаты измерений показали, что максимальное значение CV составило 13,5%, а среднее значение CV для 15 лектинов — 8,2%, что свидетельствует о высокой воспроизводимости.
Кроме того, ежедневный тест на воспроизводимость позволяет понять изменения, обусловленные датой измерения (Таблица 5). Стандартные наконечники и смешанные аналиты были подготовлены заранее, а измерения семи наконечников повторялись ежедневно в течение пяти дней подряд. Результаты показали, что большинство лектинов имели CV менее 10%. Тем не менее, некоторые лектины, такие как LCA и ECA, демонстрировали более высокие CV. Средняя CV 15 лектинов за цикл составила до 7,7%, а средние CV значения за 5 дней – менее 10%, что свидетельствует о высокой воспроизводимости. Было отмечено, что Jacalin, благодаря самоперевариванию MMP3 в Mix Analyte, продемонстрировал низкую временную воспроизводимость. Поэтому следует определить более подходящий аналит для замены MMP3.
Чтобы понять стабильность фиксированных лектином бусин, было показано испытание на долгосрочную стабильность с использованием этих высушенных фиксированных лектином бусин (Таблица 6). Стандартные наконечники, реагенты для анализа и смешанные аналиты были подготовлены заранее, а измерения были проведены после 12 месяцев хранения. Вышеупомянутые пять типов биотинилированных аналитов хранили по отдельности и смешивали перед измерением. Результаты показали, что средний CV для 15 лектинов составлял менее 10%, даже до 12 месяцев после сухого хранения. Это говорит о возможности быстрых и точных измерений за счет одновременного хранения нескольких наконечников (до 1000) из одной партии.
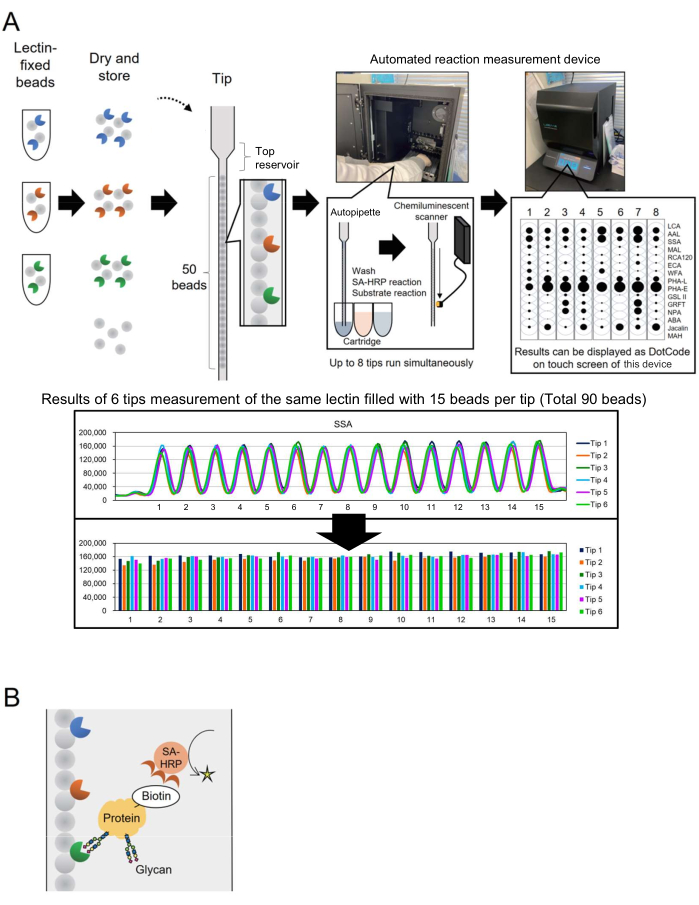
Рисунок 1: Схемы прибора «массив шариков в одном наконечнике» и метод анализа. (А) Схема автоматической системы профилирования гликанов. Фиксированные лектином бусины можно сушить и хранить в кончиках. Когда наконечники и картриджи, содержащие реагенты, такие как меченые HRP антистрептавидиновые антитела (SA-HRP), устанавливаются в измерительный прибор (устройство для измерения автоматических реакций) и активируются, наконечник функционирует как автопипетка. Сканер хемилюминесцентного детектирования на задней панели прибора количественно оценивает сигналы от восьми зондов одновременно. Количественные данные отображаются в виде точечных кодов на сенсорном экране прибора для быстрого подтверждения результатов измерений. В нижнем разделе показаны результаты измерения 90 бусин с одним и тем же лектином. Результаты измерений переносятся с прибора и отображаются на графике отдельным исследователем. (В) Схема метода обнаружения, использованного в данном эксперименте. Целевые белки предварительно биотинилируются и обнаруживаются с помощью SA-HRP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Изображения материалов и настройка для автоматического профилирования гликана с помощью автоматизированного устройства для измерения реакции. (A) Изображение фиксирующих лектин шариков, упаковывающихся в наконечник. Подбираем бусины антистатическим пинцетом на антистатическом коврике и заполняем кончик бусинами. (Б) Защипывание кончика кусачком. Небольшая верхняя часть верхнего валика сжимается. (В) Кусачки для обжима кончиков. Пластик (желтый круг) защипывают, чтобы они не обрезались полностью. (D) Расположение материалов, используемых в автоматизированном устройстве для измерения реакции. a: наконечники, b: пробирка с аналитами, и c: картриджи с жидкостью должны быть вставлены на место соответственно. В контейнере для отходов после измерения собираются прореагировавшие кончики. Коробку можно снять. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
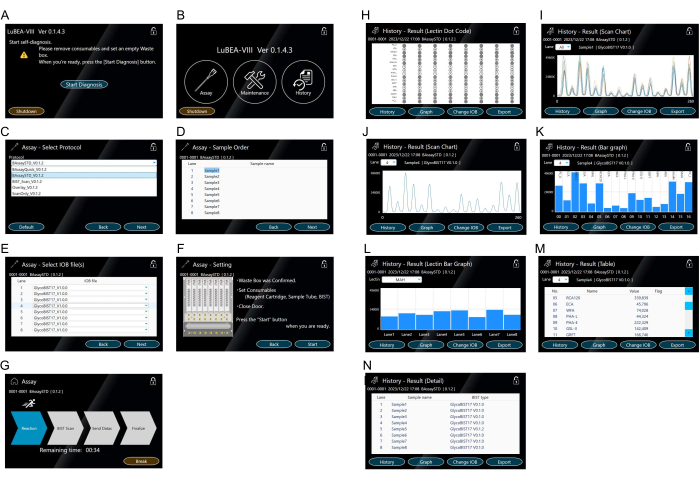
Рисунок 3: Сенсорный экран для манипуляций с машиной. (A) Программа самодиагностики запускается автоматически при включении питания. (B) На главном экране отображаются «Анализ», «Техническое обслуживание» и «История». (К-Г) Работа в режиме «Проба». Выбор метода анализа (С). Несколько протоколов могут быть зарегистрированы заранее. Ввод заказа образца (аналита) (D). Выбор типа наконечника (E). Подтверждение настроек метода анализа (F) и запуск анализа с экрана "Начать анализ" (G). (Х-Н) Представление результата в «Истории». Лектиновый доткод (H) отображается после завершения анализа или в режиме "История". На экране отображается диаграмма сканирования 15 лектинов для всех образцов (I) или для каждого образца (J). Диаграмма сканирования отображается в виде столбчатой диаграммы (K). Гистограммы для других полос движения можно выбрать из выпадающего списка «Полоса». Гистограмма, сравнивающая восемь полос образцов на лектин (л). Другие лектины можно выбрать из выпадающего списка «Лектины». Таблица с количественными значениями (М). Запись выполненного метода измерения (N). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
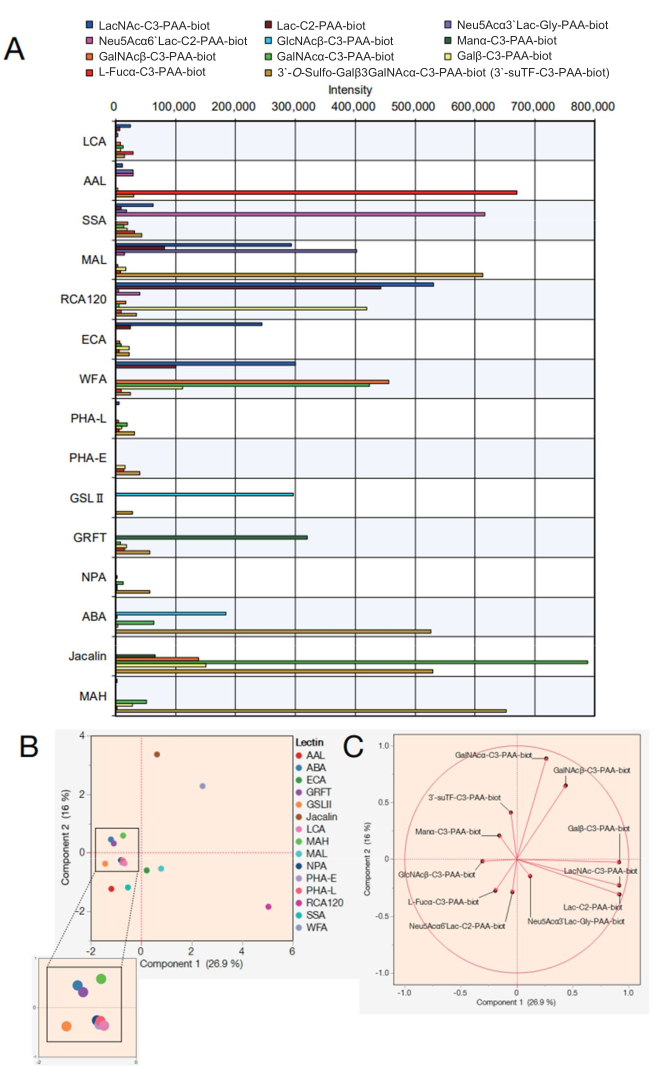
Рисунок 4: Оценка реакционной способности с сахаридами ПАК в автоматической системе профилирования гликанов. (A) График, показывающий реакционную способность лектинов с различными сахаридами ПАА, был скорректирован на отрицательные контрольные значения. (В) Анализ главных компонент на основе данных в пункте (А). (C) Собственные векторы из анализа в (B). Для деталей (B) и (C) использовалось совместимое программное обеспечение для анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
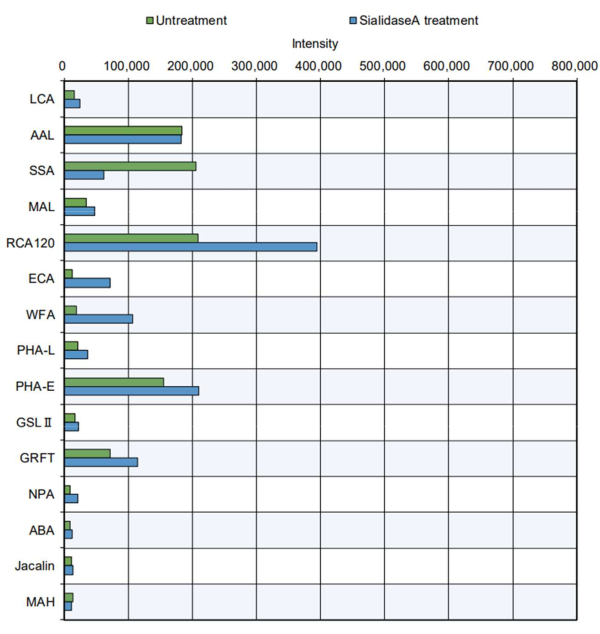
Рисунок 5: Проверка реактивности GlycoBIST с использованием очищенного белка тиреоглобулина крупного рогатого скота. Подготовка образцов без обработки проводилась в тех же условиях разложения, что и только буфер, без добавления сиалидазы А. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Тест на повторяемость с использованием фиксированных лектином шариков. Оценивали повторяемость реакционной способности для 28 лектинов. Аналиты реагировали с каждым наконечником. ЭПО: эритропоэтин, ПСА: простатспецифический антиген, Tf: трансферрин, M2BP: связывающий белок Mac-2, hIgG: человеческий IgG, MMP3: матриксная металлопротеиназа 3, (Sia+): аналиты сиалидазы А, (Sia+, Gal+): сиалидаза А и аналиты, расщепленные галактозидазой, Ab: антитела. DSA: агглютинин Datura stramonium , HypninA2: агглютинин Hypnea japonica , WGA: агглютинин зародышей пшеницы, UDA: агглютинин крапицы диоикой , BPL: лектин Bauhinia purpurea , Orysata: лектин Oryza sativa , LSL-N: N-концевой домен лектина Laetiporus sulphureus , SNA: лектин Sambucus nigra , BanLec: банановый лектин, MPA: агглютинин Maclura pomifera , TxLC-I: агглютинин Tulipa gesneriana , AOL: Aspergillus oryzae лектин, ACG: Agrocybe cylindracea galectin. CV: коэффициент вариации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Список лектинов, составляющих стандартный наконечник для автоматического профилирования гликанов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Сахариды ПАА, используемые в качестве стандартов для автоматической системы профилирования гликанов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Результаты теста на воспроизводимость в ходе прогона. CV: коэффициент вариации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 5: Результаты междневного теста на воспроизводимость. CV: коэффициент вариации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 6: Результаты испытания на долговременную устойчивость. CV: коэффициент вариации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
В этом исследовании была разработана методика быстрой оценки гликозилирования с использованием технологии «массив шариков в одном наконечнике». В настоящем исследовании был представлен стандартный наконечник GlycoBITE, предназначенный как для исследователей, так и для исследователей, не связанных с гликонаукой, чтобы облегчить рутинную, всестороннюю оценку гликозилирования. Лектиновый микрочип, обычно использующий 20-100 лектинов12,13, широко используется в оценках. Однако, учитывая перекрывающиеся специфичности некоторых лектинов на микрочипе и относительно ограниченное разнообразие гликоформ на гликопротеине-мишени по сравнению с гликомикой необработанных клинических образцов, ожидалось, что 15 лектинов будет достаточно для упрощенной оценки фокусированного профилирования гликанов.
Критическим шагом в протоколе является то, чтобы позволить иммобилизованным лектином бусинам или кончикам, наполненным этими бусинами, вернуться к комнатной температуре после хранения перед использованием их для измерений. В частности, было замечено, что конденсация ослабляет сигналы; Поэтому рекомендуется никогда не открывать пакет для хранения, пока он не нагреется до комнатной температуры. Для хранения реагентов для биотинилирования также важно полностью высушить их перед хранением. Недостаточный процесс сушки снижает эффективность биотинилирования до белка из-за гидролиза реагента биотинилирования14.
Что касается модификаций и устранения неполадок, был изучен метод снижения вариативности, особенно в отношении метода измерения в автоматизированном устройстве для измерения реакций. В частности, когда объем буфера в резервуаре, используемом для анализа, составляет 150 мкл, пузырьки попадают в зонд, что приводит к снижению эффективности реакции и большому разбросу значений. Поэтому рекомендуется помещать в резервуар не менее 200 мкл буфера.
Количество жидкости, которая заполняет наконечники во время автоматического пипетирования, также является важным фактором. Наконечники не могут полностью вытеснить жидкость при переходе к следующему этапу реакции. Таким образом, в немалом количестве буфер с предыдущего этапа переносится на следующий этап, а предыдущий буфер остается в верхней области введенного раствора при аспирации нового буфера. Поэтому субстрат и другие растворы должны быть достаточно аспирированы, чтобы заполнить верхний резервуар (см. рисунок 1А). Учитывая необратимость реакций антител на приборе, крайне важно проявлять осторожность и не допускать ошибок при первоначальной настройке.
Одним из ограничений метода является то, что он ограничен растворимыми белками, полученными из сыворотки крови и супернатантами культур. В данном методе лектин не ковалентно сшивается с шариком, что делает его неспособным анализировать образцы, содержащие высокие концентрации поверхностно-активных веществ, таких как клеточные и тканевые экстракты. Следовательно, для устранения этих ограничений необходимы дальнейшие усовершенствования.
Значение массива лектиновых бусин заключается во взаимозаменяемости и расширяемости закрепленных на бусинах форм лектина. Например, при крупномасштабном дифференциальном анализе (>1000 образцов) с использованием автоматизированной системы профилирования гликанов пользователи могут настроить линейку из 15 лектинов в наконечнике на основе предварительного профилирования гликана на основе лектиновых микрочипов целевого гликопротеина (образцы <100). Кроме того, высокая стабильность фиксированных лектином шариков позволяет проводить немедленные эксперименты от первоначального дизайна наконечника до измерения с помощью рутинных процедур. Не только 25 из 28 лектинов, продемонстрировавших высокую надежность (Таблица 1), но и любые лектины, представляющие интерес для пользователя, могут быть использованы для создания собственной автоматизированной системы профилирования гликанов для своих конкретных экспериментов после вышеупомянутого рутинного теста на надежность. Этот подход привел к разработке возможного массива 120-лектиновых шариков, состоящего из восьми различных типов наконечников, для расширенного измерения в сочетании со стандартной системой профилирования гликанов.
Предыдущее исследование было сосредоточено на установлении процедуры обнаружения гликопротеинов, меченных Cy3, в соответствии с лектиновым микрочипом15. Этот метод был ограничен 13 лектинами параллельно в кончике из-за флуоресцентной интерференции. Текущий метод, использующий метки для обнаружения HRP, вмещает 15 фиксированных лектином шариков и две контрольные бусины (положительную и отрицательную) в наконечнике. Кроме того, биотинилирование образцов сократило процесс анализа.
Этот аналитический метод может быть применен не только к академическим исследованиям, но и к медицинским и фармацевтическим исследованиям, пищевым продуктам, косметике и другим промышленным областям. Несмотря на то, что лектиновые микрочипы и технологии гликопротеомики хорошо зарекомендовали себя, подход к этому исследованию остается важным благодаря его полной автоматизации и возможности быстрого анализа с меньшим количеством шагов. В будущем этот анализ будет усовершенствован в количественном методе путем нормализации сигнала с использованием определенных гликопротеинов, с использованием фиксированных антителами гранул наряду с фиксированными лектином гранулами в наконечнике.
Раскрытие информации
AO, TO, NT, HS, KK, MA, SY, TM, KN, OS и KS являются сотрудниками компании Precision System Science Co., Ltd.
Благодарности
Эта работа была поддержана Программой адаптируемой и бесшовной передачи технологий через целевые исследования и разработки (A-STEP), финансируемой Японским агентством по науке и технике (JST), в рамках гранта No JPMJTR204A и частично грантом KAKENHI No 23H02680 Японского общества содействия науке (JSPS). Мы хотели бы поблагодарить Editage (www.editage.jp) за редактирование английского языка.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
Ссылки
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103(2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены