Method Article
Evaluación glicocualitativa rápida de proteínas recombinantes mediante un sistema totalmente automatizado
En este artículo
Resumen
Anteriormente se desarrolló un sistema para el análisis automatizado y rápido de glicanos en proteínas. Este artículo presenta el protocolo para el "análisis glicocualitativo", optimizado para un amplio espectro de usuarios, como los que se dedican al análisis de estructuras de glicanos en biofarmacéuticos y otros materiales glicoconjugados.
Resumen
La glicosilación de proteínas, una modificación postraduccional crítica, influye en la estabilidad, eficacia e inmunogenicidad de las proteínas recombinantes, incluidos los biofármacos. Las estructuras de glicanos exhiben una heterogeneidad significativa, que varía según los tipos de células de producción, las condiciones de cultivo y los métodos de purificación. En consecuencia, el seguimiento y la evaluación de las estructuras de glicanos de las proteínas recombinantes es vital, especialmente en la producción biofarmacéutica. El microarray de lectinas, una técnica complementaria a la espectrometría de masas, cuenta con una alta sensibilidad y facilidad de uso. Sin embargo, normalmente se necesita más de un día para dar resultados. Para adaptarlo a la investigación no glicocientífica o al desarrollo de procesos de productos farmacéuticos, se necesita una alternativa automatizada y de alto rendimiento. Por lo tanto, se desarrolló el primer sistema de perfilado de glicanos basado en lectina totalmente automatizado del mundo, utilizando el concepto de tecnología de "matriz de perlas en una sola punta (BIST)". Este sistema permite la preparación y el almacenamiento de perlas inmovilizadas con lectina en unidades de 1.000, con órdenes de inserción paralelas personalizables para diversos fines. Este artículo presenta un protocolo práctico para la investigación con proteínas recombinantes "glico-calificadas". Después de probar su reactividad frente a 12 conjugados de poliacrilamida-glicano, se seleccionaron 15 lectinas para aumentar la versatilidad del sistema. Además, el proceso de etiquetado de muestras se optimizó cambiando de Cy3 a biotina, lo que redujo el tiempo total de procesamiento en 30 minutos. Para una calificación inmediata de los datos, las señales de unión a lectina se muestran como un código de puntos en el monitor superior. La fiabilidad del sistema se confirmó mediante pruebas de reproducibilidad diarias, pruebas de repetibilidad y pruebas de almacenamiento a largo plazo, con un coeficiente de variación del <10%. Este glicoanalizador rápido y fácil de usar tiene aplicaciones potenciales en el control de calidad de glicoproteínas endógenas para la evaluación y validación de biomarcadores. Este método facilita el análisis para aquellos que se inician en la glicociencia, ampliando así su utilidad práctica.
Introducción
La glicosilación de proteínas es una modificación postraduccional crucial que debe evaluarse en biofármacos. Los perfiles de glicanos de las proteínas pueden variar en función de las condiciones de cultivo, los procesos de purificación y las células huésped1. Se requieren instrumentos simples para calificar la glicosilación dentro de la tubería de bioprocesos. Se estima que más del 50% de las proteínas secretadas y de membrana in vivo se modifican con múltiples glicanos, que cambian según el linaje celular, la etapa de desarrollo y el estado de la enfermedad, como el inicio de la malignidad2. El seguimiento de los perfiles de glicanos tiene un potencial significativo para identificar marcadores de diagnóstico únicos y dianas farmacológicas. Los instrumentos automatizados capaces de medir rápidamente tamaños de muestra a gran escala tienen una gran demanda para verificar y validar dicha glicosilación aberrante a partir de cientos de muestras de pacientes en proceso de descubrimiento.
La tecnología de microarrays se ha incorporado a la glucómica para evaluar el perfil de glicanos de las glicoproteínas3. En este método, varias lectinas, que son proteínas de unión a glicanos, se inmovilizan en una superficie como un portaobjetos de vidrio. Esta tecnología de glicoanálisis basada en la interacción no requiere la liberación previa de glicanos de las proteínas centrales, lo que simplifica el proceso para los investigadores nuevos en la glicotecnología. A pesar de su uso generalizado, para aplicaciones industriales como la bioproducción, se requería un sistema automatizado capaz de monitorear rápida y fácilmente los glicanos para un mayor número de objetivos de análisis. Para abordar esto, se informó anteriormente de un sistema automatizado de perfiles de glicanos basado en un concepto único denominado "matriz de cuentas en una sola punta" (BIST), desarrollado inicialmente para el genotipado. Este sistema simplifica el proceso con un autoinstrumento de alto rendimiento de tipo cajaúnica 4. Utilizando puntas en las que varias perlas fijadas por lectina están dispuestas en paralelo 4,5, se estableció un método para analizar las estructuras de glicanos modificadas en glicoproteínas, denominado GlycoBIST (en adelante, "sistema automático de perfil de glicanos") (Figura 1A). Las lectinas se pueden fijar en 1.000 perlas y secar para mantener la actividad durante un año, tanto antes como después de envasarlas en una punta. Una vez que las puntas y los cartuchos que contienen reactivos, como el anticuerpo antiestreptavidina marcado con HPP (SA-HRP), se colocan en el instrumento prototipo de medición (un dispositivo de medición de reacción automatizado, consulte la Tabla de materiales), la punta funciona como una autopipeta. Un escáner de detección de quimioluminiscencia en la parte trasera interior del instrumento cuantifica las señales de ocho puntas simultáneamente. Los datos cuantitativos de estas ocho puntas se muestran de forma compacta y simultánea como códigos de puntos en la pantalla táctil del instrumento para una confirmación rápida de los resultados de la medición. Además, el valor representado como el máximo del pico medido se transporta desde el instrumento como datos brutos, y permite la representación gráfica por parte de investigadores individuales (Figura 1A, panel inferior).
En este artículo, los autores describen un método mejorado de etiquetado de proteínas con biotina, reduciendo el tiempo de procesamiento a 30 minutos. Las proteínas diana se biotinilan con antelación y se detectan mediante SA-HRP (Figura 1B). Se construyó una punta GlycoBIST estándar (punta especializada para el perfilado automático de glicanos) con 15 lectinas seleccionadas para lograr el perfil versátil de glicanos glicoproteínas para la exhaustividad analítica.
Protocolo
Los detalles de los reactivos y el equipo utilizado para este estudio se enumeran en la Tabla de Materiales.
1. Preparación de la punta especializada para el perfilado automático de glicanos
- Lleve las perlas secas fijadas con lectina, almacenadas a 4 °C en una bolsa sellada, al banco y deje que vuelvan a temperatura ambiente (~23 °C).
NOTA: Esto evita la condensación en las cuentas, lo que puede disminuir su calidad. Este método de preparación de perlas fijadoras de lectina ha sido reportado previamente5. - Coloque un paño antiestático sobre el escritorio y coloque el eliminador de estática portátil frente al espacio de trabajo. Esto permite realizar trabajos posteriores en el banco con protección antiestática (Figura 2A).
- Inserte las cuentas en la punta vacía con pinzas antiestáticas de modo que se coloquen dos cuentas espaciadoras entre las cuentas fijadoras de lectina (Figura 1A).
- Apriete suavemente la parte superior de la punta con unas pinzas para cerrar la abertura, teniendo cuidado de no cortar la punta después de que se hayan llenado todas las cuentas (Figura 2B).
NOTA: Esto es para asegurar las cuentas dentro de la punta. Se recomienda que la pinza esté hecha a medida para evitar cortar la punta (Figura 2C). - Endereza la punta con la mano si está doblada.
- Guarde la punta preparada a 4 °C en una bolsa sellada con un desecante hasta que la necesite.
NOTA: Antes de usar la punta, debe llevarla a temperatura ambiente antes de abrir la bolsa sellada y sacarla. La humedad reduce drásticamente la reactividad de las lectinas.
2. Preparación de los analitos
- Envase previamente el reactivo de biotinilación para el análisis de rutina.
NOTA: Para el análisis de rutina, es útil empaquetar previamente el reactivo de biotinilación (Biotina-(AC5)2 Sulfo-Osu, consulte la Tabla de materiales) en porciones pequeñas de la siguiente manera para un análisis rápido. Se recomienda que el reactivo de biotinilación se seque y almacene, ya que su éster de succinimidilo es generalmente susceptible a la hidrólisis.- Disuelva el reactivo de biotinilación en agua desionizada.
- Dispense 10 μg del reactivo en tubos con una pipeta.
- Seque los tubos con reactivo de biotinilación en un concentrador de vacío refrigerado y guárdelos con un desecante a 4 °C en una bolsa resistente a la luz hasta su uso.
- Añadir la solución de analito (200 ng de proteína) al tubo que contiene el reactivo de biotinilación seco preparado en el paso 2.1.
NOTA: Tenga en cuenta la composición tampón utilizada para disolver y diluir los analitos, en función de las propiedades del reactivo de biotinilación utilizado. Por ejemplo, evite el uso de reactivos de amina primaria como tampones para el acoplamiento de aminas. Esto evitará una reducción en la eficiencia de biotinilación de los analitos. - Mezcle bien por vórtice, luego gire hacia abajo (1000 x g durante 5 s a temperatura ambiente) en una centrífuga de mesa para dejar caer el líquido en la tapa hasta el fondo del tubo.
- Incubar los tubos durante 1 h a temperatura ambiente, protegidos de la luz.
- Diluya las muestras biotiniladas 10 veces en el tampón de sondeo (1% Triton X-100, 0,5 M de glicina, 1 mM de CaCl2 y 1 mM de MnCl2 en TBS) para inactivar cualquier reactivo de biotinilación sin reaccionar.
NOTA: En el caso de reacciones por acoplamiento de aminas, el reactivo de biotinilación sin reaccionar es consumido por la reacción con un tampón que contiene un reactivo de amina primario como Tris en TBS, que evita la biotinilación de lectinas y otras sustancias inmovilizadas en las perlas en la medición posterior. - Incubar a temperatura ambiente, protegido de la luz, durante 2 h.
- Evaluar la eficiencia de la biotinilación de los analitos a través de Western blot, utilizando estreptavidina marcada con HRP como sonda de detección si es necesario. Consulte la bibliografía sobre los métodos de transferencia occidentales6.
3. Preparación de reactivos para el perfilado de glicanos con el dispositivo automatizado de medición de reacciones
- Diluir la estreptavidina conjugada con HRP con la solución de bloqueo en una proporción de 1:3000.
- Mezclar con volúmenes iguales de Sustrato A y Sustrato B (ver Tabla de Materiales). Utilice 160 μL de sustrato mezclado por muestra.
- Dispense la solución de bloqueo, el tampón de lavado (Triton X-100/TBS al 0,1 %), la TBS, la solución de estreptavidina conjugada con HRP y cada sustrato en los pocillos designados de un cartucho con 10 depósitos de líquido.
NOTA: A continuación se describen el volumen y la ubicación recomendados de las soluciones para llenar cada pocillo del cartucho de reacción. Sin embargo, las soluciones y la disposición de los pozos se pueden cambiar en el dispositivo de medición de reacción automatizado según corresponda con anticipación.- Agregue 0,2 mL de estreptavidina marcada con HRP preparada en el paso 3.1. al pozo #2 usando una pipeta. El pozo se llama # 1 desde el frente del cartucho.
- Agregue 0.2 mL de solución de obstrucción al pocillo #3 usando una pipeta.
- Agregue 1 mL de TBS a los pocillos #4 y #6 usando una pipeta.
- Agregue 1 mL de tampón de lavado a los pocillos #7 y #8 usando una pipeta.
- Agregue 0.16 mL de mezcla de sustrato al pocillo #10 usando una pipeta.
- Confirme que los pozos #1, #5 y #9 estén vacíos.
- Agregue los analitos preparados en el paso 2 a un microtubo de rosca de 2 mL de absorbente bajo en proteínas.
- Abra la puerta frontal del dispositivo automatizado de medición de reacciones.
- Coloque los depósitos de líquido preparados en el paso 3.3, las puntas preparadas en 1 y los analitos preparados en el paso 3.4 en las posiciones designadas del dispositivo de medición de reacción automatizado (Figura 2D) de la siguiente manera. Cada medición se realiza en una sola dirección de línea vertical.
- Coloque una punta preparada en el paso 1 en cada orificio en la posición "a" símbolo amarillo en la Figura 2D.
NOTA: Nuevamente, si está refrigerado, lleve las puntas a temperatura ambiente antes de abrir la bolsa sellada. Las lectinas pierden su señal drásticamente debido a la humedad. - Retire la tapa del tubo que contiene el analito preparado en el paso 3.4 e insértelo en cada orificio en la posición "b" de manera similar.
- Inserte el cartucho que contiene el líquido preparado en el paso 3.3, teniendo cuidado de no derramarlo en la posición "c".
- Retire toda la "caja de desechos" de la Figura 2D cuando esté llena, vierta el contenido en el contenedor de basura y devuelva la "caja de desechos" a su posición original.
NOTA: Las puntas reaccionadas se recogen automáticamente en la "caja de residuos" después de la medición.
- Coloque una punta preparada en el paso 1 en cada orificio en la posición "a" símbolo amarillo en la Figura 2D.
4. Perfilado de glicanos con el dispositivo automatizado de medición de reacciones
- Encienda el interruptor de encendido en el costado de la unidad principal.
- Toque el botón "Iniciar diagnóstico" que aparece en la pantalla (Figura 3A). El programa de autodiagnóstico se inicia automáticamente. Después de un tiempo, se completa el programa de autodiagnóstico y aparece la pantalla INICIO (Figura 3B).
NOTA: Las siguientes operaciones se pueden realizar tocando los iconos respectivos. "Ensayo" para iniciar la medición. "Mantenimiento" para confirmar cualquier error del sistema. "Historial" para ver los datos de medición anteriores. - Toque "Ensayo" que se muestra en la pantalla de inicio para seleccionar el protocolo (Figura 3B).
- Seleccione el "BAssaySTD" del método de ensayo (Figura 3C) y luego presione "Siguiente" en la parte inferior derecha.
- Introduzca el nombre de la muestra (Figura 3D) para cada muestra según sea necesario y, a continuación, toque "Siguiente" en la parte inferior derecha.
- Ingrese el nombre de la punta (Figura 3E) utilizado para cada muestra según sea necesario y luego toque "Siguiente" en la parte inferior derecha.
- Confirme las notas de la derecha (Figura 3F) y, si no hay ningún problema, toque "Inicio" en la parte inferior derecha para medir.
- Confirme el cambio de pantalla al modo de ejecución (Figura 3G) y espere hasta que se resalte la flecha "finalizar". Si es necesario, toque "Interrumpir" para detener el modo de ejecución.
NOTA: Las operaciones controladas automáticamente por el dispositivo de medición de reacción automatizado son las siguientes: (1) Las boquillas de micropipeta automática dentro del instrumento conectan un máximo de ocho puntas simultáneamente (consulte el símbolo amarillo "a" en la Figura 2D); (2) Aspirar/descargar repetidamente la solución en el tubo que contiene el analito durante 5 min; (3) Transfiera a la solución de bloqueo y aspire/descargue durante 5 min; (4) Transfiera a TBS y aspire/descargue durante 2 minutos; (5) Transfiera a la solución de estreptavidina marcada con HRP y aspire/descargue 5 min; (6) Transfiera al tampón de lavado y aspire/descargue durante 7 min; (7) Transfiera a TBS y aspire/descargue durante 2 minutos; (8) Transfiera a la mezcla de sustrato y aspire de inmediato; (9) Escanee la quimioluminiscencia de ocho puntas simultáneamente en la parte posterior del dispositivo para obtener datos máximos; (10) Deje caer las puntas usadas en la caja de residuos; (11) La boquilla vuelve a la posición inicial. - Confirme que la pantalla ha cambiado al modo de resultados (Figura 3H) cuando se complete la medición. Los ocho códigos de puntos se muestran simultáneamente en la pantalla para facilitar la verificación.
NOTA: Toque el "Historial" en la parte inferior izquierda para mostrar el gráfico de escaneo (Figura 3I, J), el gráfico de barras (Figura 3K, L), la tabla (Figura 3M) y el detalle (Figura 3N) como resultado en la pantalla. Vea los resultados de otros carriles en la lista desplegable "Carril". - Inserte una memoria USB en el puerto USB en el costado de la unidad principal y toque "Exportar" en la parte inferior derecha del modo de resultados para guardar los datos de todos los carriles individualmente en la memoria USB.
- Exporte los datos sin procesar (Figura 3M) como un archivo CSV utilizando un puerto USB para un análisis posterior de datos y gráficos individuales en Excel. El "valor" de la tabla denota la intensidad de la señal de cada lectina. Los valores de intensidad representan el valor máximo de los datos de pico (Figura 3I,J) en el escaneo de las puntas reaccionadas.
NOTA: Se puede establecer el umbral de extracción máxima. Dependiendo de los analitos, la señal en la parte del cordón espaciador puede ser más alta en general, en cuyo caso el valor en la parte del espaciador se resta como fondo.
Resultados
Primero, se muestra la distribución de la señal para cada lectina para comprender las características de la matriz de perlas de lectina. Se preparó una biblioteca de cuentas fijadas con lectina (1.000 cuentas cada una). Se eligieron quince cuentas al azar de las 1.000 y se añadieron a una sola punta. En la parte inferior de la Figura 1A se muestra un gráfico típico, que representa casi la misma intensidad de señal observada entre las 15 perlas que inmovilizan la misma lectina. Este procedimiento de medición se puede aplicar para calificar la producción manual de perlas de lectina antes del uso del perfil de glicanos. Por ejemplo, se utilizan seis puntas para la medición simultánea para calcular el coeficiente de variación (CV) a partir de las señales en las 90 cuentas. Un ejemplo típico se muestra en la Tabla 1. Cuando la biblioteca de perlas fijadas con lectina se amplió para dar cabida a 28 lectinas diferentes, 25 de las 28 lectinas demostraron una alta reproducibilidad con un CV de menos del 10%.
A continuación, se muestran los datos de una matriz de perlas de lectina con 15 lectinas diferentes. Las 15 lectinas que se muestran en la Tabla 2 fueron seleccionadas para la matriz de perlas de lectina. Además, se midieron 12 mono/di/trisacáridos de poliacrilamida (PAA) enumerados en la Tabla 3. Después de evaluar la fiabilidad de la medición utilizando una pantalla de codificación de puntos, los datos brutos se exportaron desde el dispositivo de medición de reacción automatizado (véase el paso del protocolo 4.11) y se creó un gráfico en Excel utilizando los valores máximos de reacción en cada sacárido (Figura 4A). Estos valores se utilizaron para el análisis de componentes principales para visualizar la correlación entre las 15 lectinas seleccionadas y los sacáridos reaccionados (Figura 4B, C). Esto dio lugar a una clara diferencia en el patrón de unión de cada lectina frente a los 12 azúcares PAA que se muestran en la Figura 4A. En este trabajo, se muestra que la validez de cada señal se refiere a las listas previas integradas de especificidades de lectina y sacárido 7,8 (también se refieren a estas especificidades en la Tabla 2). A medida que el AAL se une al α-Fuc terminal, Sia-Lex y Lex, el análisis automático de glicanos confirmó el reconocimiento del AAL de las moléculas que contienen fucosa (Figura 4A). SSA y MAL (ver Tabla 2 para los nombres completos de las lectinas y las abreviaturas proporcionadas) reconocieron Siaα2-6Gal/GalNAc y Siaα2-3Gal, respectivamente. MAL en la matriz de perlas también puede unirse a 3'-O-sulfo-Galβ3GalNAc y LacNAc. Esto es consistente con resultados previos analizados utilizando el aprendizaje automático7, en el que MAL prefiere el 3'-O-sulfo-Gal dominantemente, mientras que LacNAc no es dominante9. RCA120, una lectina que reconoce Gal, reaccionó fuertemente con la β-Gal terminal, incluida la Lac/LacNAc, y se le permitió unirse a Siaα2-6Lac pero no a Siaα2-3Lac. El ECA tuvo una reactividad con LacNAc mucho mayor que con Lac. La WFA tuvo una especificidad más amplia, que reconoció no solo α/β-GalNAc sino también β-Gal terminal, según lo reportado 7,10. GSL II, que reconoce GlcNAc y N-glicanos tri/tetra-antenarios galactosilados, no se unió a ningún sacárido, excepto a un solo GlcNAc entre los analitos preparados. El GRFT, que reconoce los N-glicanos de tipo manosa con alto contenido de manosa, reaccionó con α-Man. El ABA, la jacalina y la MAH se han utilizado generalmente para detectar O-glicanos. Como ABA prefiere las estructuras Galβ1-3GalNAcα-Thr/Ser (T) y sialyl-T, ABA en la matriz de perlas reaccionó fuertemente con 3'-O-sulfo-Galβ1-3GalNAc y se unió débilmente a α-GalNAc. ABA también reconoció β-GlcNAc, en consonancia con los informes anteriores sobre la unión a N-glicanos agalactosilados7. La jacalina tiene una especificidad relativamente más amplia y, por lo tanto, reaccionó con α-manosa, β-GalNAc, βGal, α-GalNAc, 3'-O-sulfo-Galβ1-3GalNAc. MAH reconoció específicamente 3'-O-sulfato-Galβ1,3GalNAc como se informó anteriormente7. Las cuatro lectinas residuales, NPA, LCA, PHA-L y PHA-E, reconocieron la estructura interna del N-glicano no incluida en los sacáridos de PAA preparados y, por lo tanto, no tenían afinidad con todos los analitos.
Con los datos obtenidos, se puede aclarar la similitud de las lectinas que contribuyen a la unión a cada sacárido trazándolas en un gráfico de análisis de componentes principales (Figura 4B). Todos los sacáridos que contribuyeron a la varianza de la Figura 4B fueron representados por vectores propios, un método de análisis estadístico en el que la relación de contribución está representada por un vector (Figura 4C). Cabe destacar aquí que los sacáridos reaccionados contribuyen a cada lectina sin sesgos. Las lectinas no muestran especificidad para un solo tipo de sacárido. Por ejemplo, la presencia de glicanos de tipo complejo está determinada por el reconocimiento parcial de algunos glicanos dentro de los glicanos de tipo complejo en los seres humanos. La jacalina, que reconoce los O-glicanos (ver las especificidades en la Tabla 2), puede reconocer la estructura del 3'suTF y el α-GalNAc entre los sacáridos utilizados en este estudio, y por lo tanto, el 3'suTF y el α-GalNAc se trazaron (Figura 4C) contra la dirección de posición de la jacalina (punto marrón) trazada en la Figura 4B. WFA puede reconocer α/β-GalNAc entre los sacáridos utilizados en este estudio; por lo tanto, el α/β-GalNAc en la Figura 4C se trazó en la misma dirección que el WFA trazado en la Figura 4B. Por el contrario, α-GalNAc se traza entre WFA y Jacalin porque es una estructura de sacárido a la que Jacalin es capaz de unirse fácilmente. Los 11 sacáridos trazados en este estudio son consistentes con la especificidad (unión a sacáridos) de las lectinas reportadas anteriormente 7,8, lo que indica que el método propuesto es un método de medición confiable. Además, los vectores propios correspondientes a cada sacárido están dispersos, lo que apoya que las 15 lectinas se seleccionaron con un sesgo mínimo para garantizar una cobertura completa en el análisis. En consecuencia, la punta repuesta con estas 15 lectinas se definió como la punta estándar de GlycoBST (Tabla 2).
En el ejemplo más práctico, los productos proteicos purificados se sometieron a la medición de la punta (Figura 5). Se analizó la tiroglobulina bovina, que tiene un sitio de N-glicosilación y contiene N-glicanos complejos, híbridos y de tipo manosa alto 11. La punta estándar indicó un aumento de la reactividad de ciertas lectinas a los sacáridos8 (consulte las especificidades en la Tabla 2): PHA-E, que reconoce la bisección de GlcNAc; GRFT, reconociendo los N-glicanos de tipo manosa; SSA, reconociendo Siaα2-6Gal/GalNAc; RCA120, reconociendo lactosa y LacNAc; y AAL, reconociendo la fucosa. Estas estructuras de glicanos están presentes en N-glicanos complejos, híbridos y de tipo manosa alta, lo que sugiere que la estructura de N-glicanos de la tiroglobulina11 podría evaluarse de manera efectiva. Además, la tiroglobulina tratada con sialidasa A, una enzima que digiere el ácido siálico, mostró una disminución de la reactividad con SSA, que reconoce el ácido siálico, y una mayor reactividad con RCA120, WFA y ECA, que se reconocen más fácilmente después de la eliminación de los ácidos siálicos. La presencia de estructuras O-glicanos en la tiroglobulina bovina no ha sido reportada previamente. Como se esperaba, no hubo reconocimiento de O-glicano en tiroglobulina con o sin tratamiento con sialidasa en el análisis automático de glicanos.
Se muestra una prueba de reproducibilidad dentro de la corrida utilizando las 15 lectinas seleccionadas para comprender la robustez de la medición (Tabla 4). Para esta prueba, se prepararon siete puntas estándar para analitos y una punta adicional para el control negativo, y se midieron las ocho puntas simultáneamente. Este procedimiento se repitió tres veces en un solo día. Se prepararon "analitos de mezcla", una combinación de analitos que permitió obtener señales significativas en todas las lectinas, para el control de calidad de la matriz de perlas. Los analitos Mix se formularon mezclando adecuadamente eritropoyetina (EPO) digerida con sialidasa, EPO digerida con sialidasa y galactosidasa, IgA humana, metaloproteinasa de matriz 3 (MMP3) y tiroglobulina. Cada glicoproteína (200 ng) se marcó con 10 μg de reactivo de biotinilación en PBS que contenía Triton X-100. Si fue necesario, se realizaron tratamientos con sialidasa y galactosidasa como se describe en las instrucciones. Después de la digestión, los productos se incubaron en un bloque de calor a 75 °C durante 10 min para inactivar la enzima. Las cantidades apropiadas de glicoproteínas biotiniladas (3 ng de EPO, 8 ng de IgA humana, 5 ng de MMP3 y 15 ng de tiroglobulina) se mezclaron inmediatamente antes del análisis. Los resultados de la medición indicaron que el valor máximo de CV fue de 13,5%, y el promedio de CV para las 15 lectinas fue de 8,2%, demostrando una alta reproducibilidad.
Además, se muestra una prueba de reproducibilidad diaria para comprender las variaciones debidas a la fecha de medición (Tabla 5). Las puntas estándar y los analitos de mezcla se prepararon con anticipación, y las mediciones de siete puntas se repitieron diariamente durante cinco días consecutivos. Los resultados mostraron que la mayoría de las lectinas tenían un CV inferior al 10%. Sin embargo, algunas lectinas, como LCA y ECA, exhibieron CV más altos. El CV promedio de las 15 lectinas por ciclo fue de hasta 7,7%, y los valores promedio de CV durante 5 días fueron inferiores al 10%, lo que significa una alta reproducibilidad. Se observó que Jacalin, debido a la autodigestión de MMP3 en el analito mixto, demostró una baja reproducibilidad temporal. Por lo tanto, se debe identificar un analito más adecuado para reemplazar a MMP3.
Para comprender la estabilidad de las perlas fijadas con lectina, se muestra una prueba de estabilidad a largo plazo utilizando estas perlas secas fijadas con lectina (Tabla 6). Las puntas estándar, los reactivos de ensayo y los analitos de mezcla se prepararon con anticipación, y las mediciones se realizaron después de 12 meses de almacenamiento. Los cinco tipos de analitos biotinilados antes mencionados se almacenaron individualmente y se mezclaron antes de la medición. Los resultados mostraron que el CV promedio para las 15 lectinas fue inferior al 10%, incluso hasta 12 meses después del almacenamiento en seco. Esto sugiere la viabilidad de mediciones rápidas y precisas mediante el almacenamiento de numerosas puntas (hasta 1.000) del mismo lote a la vez.
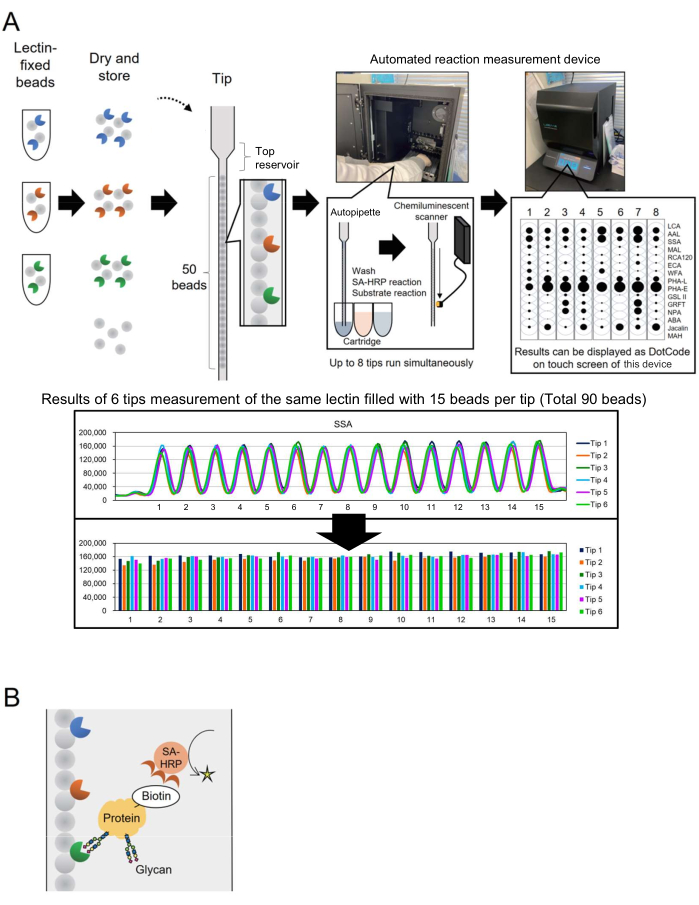
Figura 1: Esquemas del instrumento "matriz de perlas en una sola punta" y método de análisis. (A) Esquema del sistema automático de perfilado de glicanos. Las perlas fijadas con lectina se pueden secar y almacenar en puntas. Cuando las puntas y los cartuchos que contienen reactivos como el anticuerpo antiestreptavidina marcado con HPP (SA-HRP) se colocan en el instrumento de medición (dispositivo de medición de reacción automatizado) y se activan, la punta funciona como una autopipeta. El escáner de detección de quimioluminiscencia en la parte trasera del instrumento cuantifica las señales de ocho puntas simultáneamente. Los datos cuantitativos se muestran como códigos de puntos en la pantalla táctil del instrumento para una confirmación rápida de los resultados de la medición. La sección inferior muestra los resultados de la medición de 90 cuentas con la misma lectina. Los resultados de la medición se transportan desde el instrumento y son graficados por el investigador individual. (B) Esquema del método de detección utilizado en este experimento. Las proteínas diana se biotinilan previamente y se detectan mediante SA-HRP. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imágenes de los materiales y configuración para el perfilado automático de glicanos con el dispositivo automatizado de medición de reacciones. (A) Representación de perlas fijadoras de lectina empaquetadas en una punta. Recoger las cuentas con pinzas antiestáticas en la alfombrilla antiestática y llenar la punta con las cuentas. (B) Pellizcar la punta con una pinza. Se aprieta una ligera parte superior de la cuenta superior. (C) Una pinza para engarzar las puntas. El plástico (círculo amarillo) se pellizca para evitar que se corten por completo. (D) Disposición de los materiales utilizados en el dispositivo automatizado de medición de reacciones. A: puntas, B: tubo que contiene analitos y C: Los cartuchos que contienen líquido deben insertarse en su lugar, respectivamente. En la caja de residuos, las puntas reaccionadas se recogen después de la medición. La caja se puede quitar. Haga clic aquí para ver una versión más grande de esta figura.
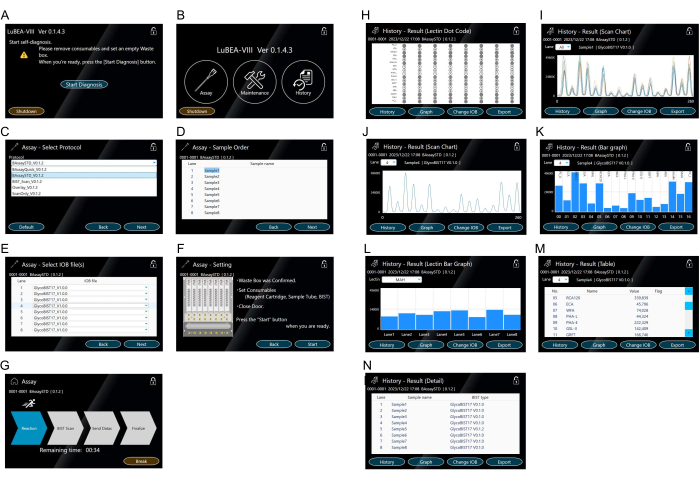
Figura 3: Pantalla táctil para la manipulación de la máquina. (A) El programa de autodiagnóstico se inicia automáticamente cuando se enciende la alimentación. (B) La pantalla de inicio muestra "Ensayo", "Mantenimiento" e "Historial". (C-G) Funcionamiento del modo "Ensayo". Selección del método de ensayo (C). Se pueden registrar varios protocolos por adelantado. Entrada de la orden de la muestra (analito) (D). Seleccionando el tipo de punta (E). Confirmación de los ajustes del método de ensayo (F) e inicio del ensayo desde la pantalla "Iniciar ensayo" (G). (H-N) Representación del resultado en la "Historia". El código de puntos de lectina (H) se muestra después de la finalización del ensayo o desde el modo "Historial". En la pantalla se muestra una tabla de escaneo de 15 lectinas para todas las muestras (I) o para cada muestra (J). El gráfico de escaneo se muestra como un gráfico de barras (K). Los gráficos de barras para otros carriles se pueden seleccionar en la lista desplegable "Carril". Gráfico de barras que compara ocho carriles de muestras por lectina (L). Se pueden seleccionar otras lectinas de la lista desplegable "Lectina". Tabla que muestra los valores cuantitativos (M). Registro del método de medición ejecutado (N). Haga clic aquí para ver una versión más grande de esta figura.
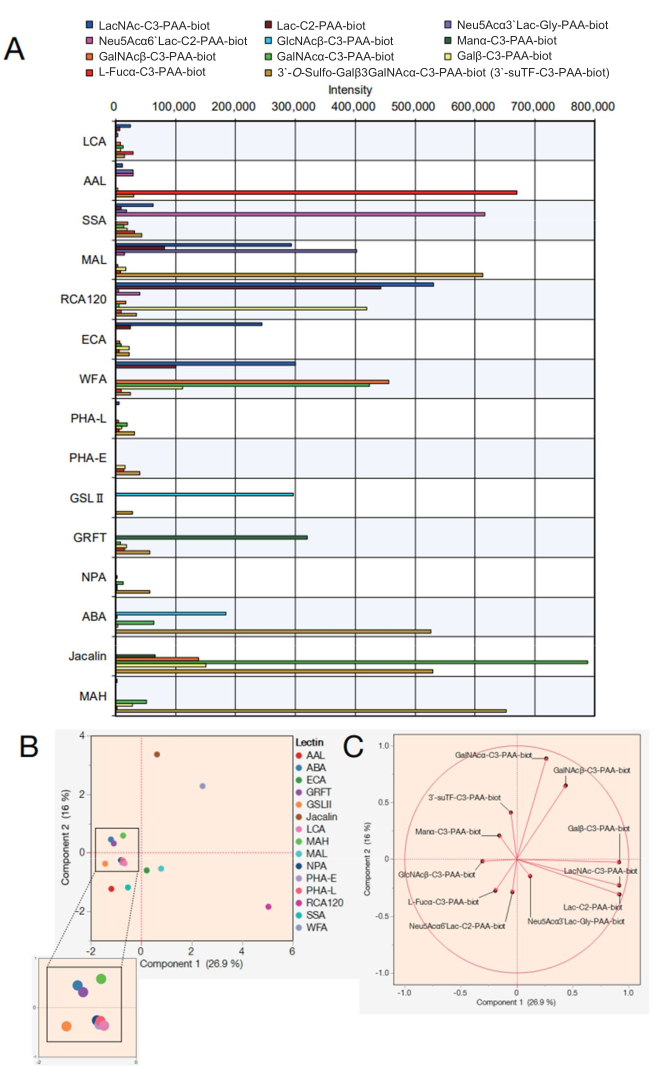
Figura 4: Evaluación de la reactividad con sacáridos de PAA en el sistema automático de perfilado de glicanos. (A) Un gráfico que representa la reactividad de las lectinas con varios sacáridos de PAA se ajustó para valores de control negativos. (B) Análisis de componentes principales basado en los datos de (A). (C) Vectores propios del análisis en (B). Se utilizó un software de análisis compatible para las partes (B) y (C). Haga clic aquí para ver una versión más grande de esta figura.
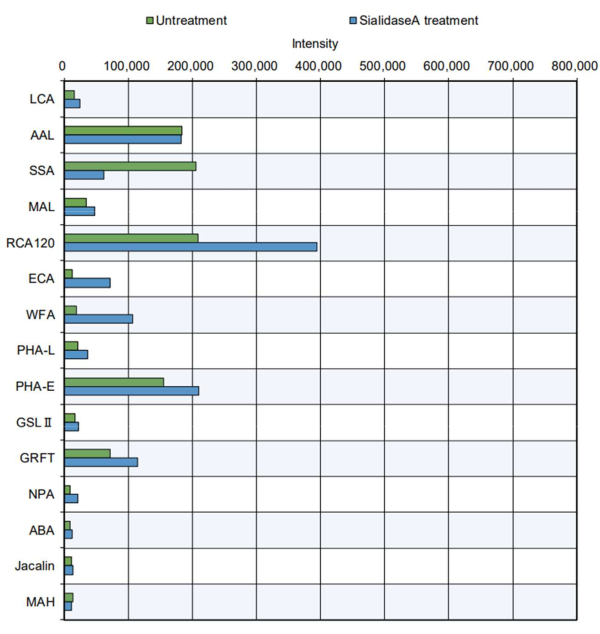
Figura 5: Verificación de la reactividad de GlycoBIST utilizando proteína tiroglobulina bovina purificada. La preparación de la muestra sin tratamiento se llevó a cabo en las mismas condiciones de digestión que el tampón solo, excluyendo la adición de sialidasa A. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Ensayo de repetibilidad con perlas fijadas con lectina. Se evaluó la repetibilidad de la reactividad de 28 lectinas. Los analitos reaccionaron con cada punta. EPO: eritropoyetina, PSA: antígeno prostático específico, Tf: transferrina, M2BP: proteína de unión a Mac-2, hIgG: IgG humana, MMP3: metaloproteinasa 3 de la matriz, (Sia+): analitos digeridos por la sialidasa A, (Sia+, Gal+): sialidasa A y analitos digeridos por galactosidasa, Ab: anticuerpo. DSA: Datura aglutinina de stramonio , HypninA2: Aglutinina de Hypnea japonica , WGA: aglutinina de germen de trigo, UDA: Aglutinina de Urtica dioica , BPL: Lectina de Bauhinia purpurea , Orysata: lectina de Oryza sativa , LSL-N: Dominio N-terminal de lectina de Laetiporus sulphureus , SNA: lectina de Sambucus nigra , BanLec: lectina de plátano, MPA: aglutinina de Maclura pomifera , TxLC-I: Aglutinina de Tulipa gesneriana , AOL: Lectina de Aspergillus oryzae , ACG: Agrocybe cylindracea galectin. CV: coeficiente de variación. Haga clic aquí para descargar esta tabla.
Tabla 2: Lista de lectinas que constituyen la punta estándar para el perfilado automático de glicanos. Haga clic aquí para descargar esta tabla.
Tabla 3: Sacáridos de PAA utilizados como patrones para el sistema automático de perfilado de glicanos. Haga clic aquí para descargar esta tabla.
Tabla 4: Resultados de la prueba de reproducibilidad dentro de la tirada. CV: coeficiente de variación. Haga clic aquí para descargar esta tabla.
Tabla 5: Resultados de la prueba de reproducibilidad entre días. CV: coeficiente de variación. Haga clic aquí para descargar esta tabla.
Tabla 6: Resultados de la prueba de estabilidad a largo plazo. CV: coeficiente de variación. Haga clic aquí para descargar esta tabla.
Discusión
En este estudio, se ha desarrollado una técnica de evaluación rápida para la glicosilación que emplea la tecnología de "matriz de perlas en una sola punta". El presente estudio introdujo una punta estándar de GlycoMIST, diseñada tanto para investigadores de glicociencia como para investigadores no glicocientíficos, para facilitar la evaluación rutinaria y completa de la glicosilación. El microarray de lectinas, que normalmente emplea entre 20 y 100 lectinas 12,13, se ha utilizado ampliamente en las evaluaciones. Sin embargo, teniendo en cuenta las especificidades superpuestas de algunas lectinas en el microarray y la variedad relativamente limitada de glicoformas en una glicoproteína objetivo en comparación con los glucómicos de muestras clínicas crudas, se anticipó que 15 lectinas serían suficientes para una evaluación simplificada del perfil de glicanos focalizados.
El paso crítico en el protocolo es permitir que las perlas inmovilizadas con lectina o las puntas llenas de esas perlas vuelvan a la temperatura ambiente después del almacenamiento antes de usarlas para mediciones. En particular, se observó que la condensación debilita las señales; Por lo tanto, se recomienda nunca abrir la bolsa de almacenamiento hasta que vuelva a la temperatura ambiente. Para el almacenamiento de reactivos de biotinilación, también es esencial secar completamente antes del almacenamiento. Un proceso de secado insuficiente disminuye la eficiencia de la biotinilación a proteína debido a la hidrólisis del reactivo de biotinilación14.
En cuanto a las modificaciones y la resolución de problemas, se exploró un método para reducir la variabilidad, especialmente en lo que respecta al método de medición en el dispositivo automatizado de medición de reacciones. En particular, cuando el volumen de tampón en el depósito utilizado para el análisis es de 150 μL, las burbujas entran en la punta, lo que reduce la eficiencia de la reacción y da lugar a una gran variación en los valores. Por lo tanto, se recomienda colocar al menos 200 μL de tampón en el depósito.
La cantidad de líquido que llena las puntas durante el pipeteo automático también es un factor importante. Las puntas no pueden expulsar completamente el líquido a medida que pasa al siguiente paso de reacción. Por lo tanto, en una cantidad no pequeña, el tampón del paso anterior se transfiere al siguiente paso, y el tampón anterior permanece en el área superior de la solución insertada cuando se aspira el nuevo tampón. Por lo tanto, el sustrato y otras soluciones deben aspirarse lo suficiente como para llenar el depósito superior (ver Figura 1A). Dada la irreversibilidad de las reacciones de anticuerpos en el instrumento, es crucial tener precaución y evitar errores durante la configuración inicial.
Una limitación del método es que se restringe a proteínas solubles derivadas de suero y sobrenadantes de cultivo. En el método actual, la lectina no está reticulada covalentemente a la perla, lo que la hace incapaz de analizar muestras que contienen altas concentraciones de tensioactivos, como extractos de células y tejidos. En consecuencia, son necesarias mejoras futuras para abordar estas limitaciones.
La importancia de la matriz de perlas de lectina radica en la intercambiabilidad y expansión de las especies de lectina fijadas en las perlas. Por ejemplo, en el análisis diferencial a gran escala (>1.000 muestras) utilizando el sistema automatizado de perfiles de glicanos, los usuarios pueden adaptar una línea de 15 lectinas en la punta basándose en el perfil preliminar de glicanos basado en micromatrices de lectinas de la glicoproteína objetivo (<100 muestras). Además, la alta estabilidad de las perlas fijadas con lectina permite la experimentación inmediata desde el diseño inicial de la punta hasta la medición con procedimientos rutinarios. No solo las 25 de las 28 lectinas que han demostrado una alta fiabilidad (Tabla 1), sino también las lectinas de interés para el usuario pueden utilizarse para crear un sistema de perfilado de glicanos automatizado personalizado para sus experimentos específicos, siguiendo la prueba de fiabilidad rutinaria antes mencionada. Este enfoque condujo al diseño de una posible matriz de perlas de 120 lectinas de ocho tipos diferentes de puntas para la medición ampliada junto con el sistema estándar de perfiles de glicanos.
Un estudio previo se centró en establecer un procedimiento de detección de glicoproteínas marcadas con Cy3 en línea con el microarray de lectinas15. Este método se limitó a 13 lectinas en paralelo en la punta debido a la interferencia de fluorescencia. El método actual, que utiliza etiquetas de detección de HRP, tiene capacidad para 15 perlas fijadas con lectina y dos perlas de control (positiva y negativa) en una punta. Además, la biotinilación de las muestras ha acortado el proceso de análisis.
Este método analítico se puede aplicar no solo a la investigación académica, sino también a la investigación médica y farmacéutica, alimentos, cosméticos y otros campos industriales. Si bien las tecnologías de microarrays de lectinas y glicoproteómica están bien establecidas, el enfoque de este estudio sigue siendo significativo por su automatización total y su capacidad para un análisis rápido con menos pasos. En el futuro, se realizarán mejoras en este análisis a un método cuantitativo mediante la normalización de la señal utilizando ciertas glicoproteínas, empleando perlas fijadas en anticuerpos junto con perlas fijadas en lectina en una punta.
Divulgaciones
AO, TO, NT, HS, KK, MA, SY, TM, KN, OS y KS son empleados de Precision System Science Co., Ltd.
Agradecimientos
Este trabajo fue apoyado por el Programa de Transferencia de Tecnología Adaptable y sin Costuras a través de la Investigación y Desarrollo Impulsados por Objetivos (A-STEP), financiado por la Agencia de Ciencia y Tecnología de Japón (JST), bajo la Subvención Número JPMJTR204A y en parte por la Sociedad Japonesa para la Promoción de la Ciencia (JSPS) KAKENHI Subvención Número 23H02680 a AK. Nos gustaría agradecer a Editage (www.editage.jp) por editar el idioma inglés.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
Referencias
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103 (2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados