Method Article
Tam Otomatik Bir Sistem Kullanılarak Rekombinant Proteinlerin Hızlı Gliko-Kalitatif Değerlendirmesi
Bu Makalede
Özet
Daha önce glikanların proteinler üzerinde otomatik ve hızlı analizi için bir sistem geliştirilmiştir. Bu makale, biyofarmasötikler ve diğer glikokonjugat malzemelerdeki glikan yapılarını analiz etmekle uğraşanlar gibi geniş bir kullanıcı yelpazesi için optimize edilmiş "gliko-kalitatif analiz" protokolünü sunmaktadır.
Özet
Kritik bir translasyon sonrası modifikasyon olan protein glikozilasyonu, biyofarmasötikler de dahil olmak üzere rekombinant proteinlerin stabilitesini, etkinliğini ve immünojenisitesini etkiler. Glikan yapıları, üretim hücresi tiplerine, kültür koşullarına ve saflaştırma yöntemlerine göre değişen önemli bir heterojenlik sergiler. Sonuç olarak, rekombinant proteinlerin glikan yapılarının izlenmesi ve değerlendirilmesi, özellikle biyofarmasötik üretimde hayati önem taşımaktadır. Kütle spektrometresini tamamlayan bir teknik olan lektin mikrodizisi, yüksek hassasiyet ve kullanım kolaylığına sahiptir. Bununla birlikte, sonuç vermek için genellikle bir günden fazla sürer. Bunu glikobilim dışı araştırmalara veya ilaç ürünü proses geliştirmeye uyarlamak için otomatik, yüksek verimli bir alternatife ihtiyaç vardır. Bu nedenle, "tek uçta boncuk dizisi (BIST)" teknoloji konseptini kullanarak dünyanın ilk tam otomatik lektin tabanlı glikan profilleme sistemi geliştirildi. Bu sistem, lektin ile hareketsiz hale getirilmiş boncukların 1.000'lik birimler halinde, çeşitli amaçlar için özelleştirilebilir paralel yerleştirme emirleri ile hazırlanmasına ve depolanmasına izin verir. Bu makale, "gliko-nitelikli" rekombinant proteinleri içeren araştırmalar için pratik bir protokol sunmaktadır. 12 poliakrilamid-glikan konjugatına karşı reaktiviteleri test edildikten sonra, sistemin çok yönlülüğünü artırmak için 15 lektin seçildi. Ek olarak, numune etiketleme işlemi, Cy3'ten biotin'e geçilerek optimize edildi ve toplam işlem süresi 30 dakika azaltıldı. Anında veri kalifikasyonu için, lektin bağlama sinyalleri üst monitörde bir nokta kodu olarak görüntülenir. Sistemin güvenilirliği, %<10'luk bir varyasyon katsayısı ile günlük tekrarlanabilirlik testleri, tekrarlanabilirlik testleri ve uzun süreli depolama testleri ile doğrulanmıştır. Bu kullanıcı dostu ve hızlı gliko-analizör, biyobelirteç değerlendirmesi ve validasyonu için endojen glikoproteinlerin kalite izlemesinde potansiyel uygulamalara sahiptir. Bu yöntem, glikobilime yeni başlayanlar için analizi kolaylaştırır ve böylece pratik faydasını genişletir.
Giriş
Protein glikozilasyonu, biyofarmasötiklerde değerlendirilmesi gereken çok önemli bir translasyon sonrası modifikasyondur. Proteinlerin glikan profilleri, kültür koşullarına, saflaştırma işlemlerine ve konakçı hücrelere bağlı olarak değişebilir1. Biyoproses boru hattı içinde glikozilasyonu nitelendirmek için basit aletler gereklidir. İn vivo salgılanan ve zar proteinlerinin %50'sinden fazlasının, hücre soyuna, gelişim aşamasına ve malignitenin başlangıcı gibi hastalık durumuna göre değişen çoklu glikanlarla modifiye edildiği tahmin edilmektedir2. Glikan profillerinin izlenmesi, benzersiz tanı belirteçlerini ve ilaç hedeflerini belirlemek için önemli bir potansiyele sahiptir. Büyük ölçekli numune boyutlarını hızlı bir şekilde ölçebilen otomatik cihazlar, keşif hattındaki yüzlerce hasta numunesinden bu tür anormal glikozilasyonu doğrulamak ve doğrulamak için yüksek talep görmektedir.
Mikroarray teknolojisi, glikoproteinlerin3 glikan profilini değerlendirmek için glikomiklere dahil edilmiştir. Bu yöntemde, glikan bağlayıcı proteinler olan birkaç lektin, cam slayt gibi bir yüzey üzerinde hareketsiz hale getirilir. Bu etkileşime dayalı gliko-analiz teknolojisi, glikoteknolojiye yeni başlayan araştırmacılar için süreci basitleştirerek, çekirdek proteinlerden glikanların önceden salınmasını gerektirmez. Yaygın kullanımına rağmen, biyoüretim gibi endüstriyel uygulamalar için, daha fazla sayıda analiz hedefi için glikanları hızlı ve kolay bir şekilde izleyebilen otomatik bir sistem gerekliydi. Bunu ele almak için, başlangıçta genotipleme için geliştirilen, "tek bir uçta boncuk dizisi" (BIST) olarak adlandırılan benzersiz bir konsepte dayanan otomatik bir glikan profilleme sistemi daha önce rapor edilmiştir. Bu sistem, tek kutu tipi yüksek verimli otomatik cihaz4 ile süreci basitleştirir. Çeşitli lektinle sabitlenmiş boncukların paralel 4,5'te düzenlendiği uçlar kullanılarak, glikoproteinlerde modifiye edilmiş glikan yapılarını analiz etmek için bir yöntem oluşturulmuş ve GlycoBIST (bundan böyle "otomatik glikan profilleme sistemi" olarak anılacaktır) olarak adlandırılmıştır (Şekil 1A). Lektinler 1.000 boncuk üzerine sabitlenebilir ve bir yıl boyunca aktiviteyi sürdürmek için kurutulabilir, hem önce hem de bir uçta paketlendikten sonra. HRP etiketli anti-streptavidin antikoru (SA-HRP) gibi reaktifler içeren uçlar ve kartuşlar ölçüm prototip cihazına (otomatik bir reaksiyon ölçüm cihazı, bkz. Malzeme Tablosu) yerleştirildikten sonra, uç bir otomatik pipet görevi görür. Cihazın iç arka kısmında bulunan bir kemilüminesans algılama tarayıcısı, sekiz ucun sinyallerini aynı anda ölçer. Bu sekiz uçtan elde edilen nicel veriler, ölçüm sonuçlarının hızlı bir şekilde onaylanması için cihazın dokunmatik ekranında kompakt ve eş zamanlı olarak nokta kodları olarak görüntülenir. Ayrıca, ölçülen tepe noktasının maksimumu olarak temsil edilen değer, cihazdan ham veri olarak taşınır ve bireysel araştırmacılar tarafından grafik oluşturulmasına olanak tanır (Şekil 1A, alt panel).
Bu makalede yazarlar, işlem süresini 30 dakikaya indiren gelişmiş bir biyotin etiketleme proteinleri yöntemini tanımlamaktadır. Hedef proteinler önceden biyotinile edilir ve SA-HRP ile tespit edilir (Şekil 1B). Analitik kapsamlılık için çok yönlü glikoprotein glikan profillemesini elde etmek için 15 seçilmiş lektin içeren standart bir GlycoBIST ucu (otomatik glikan profili oluşturma için özel uç) oluşturulmuştur.
Protokol
Bu çalışma için kullanılan reaktiflerin ve ekipmanın detayları Malzeme Tablosunda listelenmiştir.
1. Otomatik glikan profili oluşturma için özel ucun hazırlanması
- Kapalı bir torbada 4 °C'de saklanan kurutulmuş lektinle sabitlenmiş boncukları tezgaha getirin ve oda sıcaklığına (~23 °C) dönmelerine izin verin.
NOT: Bu, boncukların kalitesini düşürebilecek yoğuşmayı önler. Lektin sabitleme boncuklarının hazırlanması için bu yöntem daha önce bildirilmiştir5. - Masanın üzerine antistatik bir bez yerleştirin ve portatif statik elimatörü çalışma alanına bakacak şekilde yerleştirin. Bu, daha sonraki çalışmaların antistatik korumalı tezgah üzerinde yapılmasına izin verir (Şekil 2A).
- Antistatik cımbız kullanarak, lektin sabitleme boncukları arasına iki ara boncuk yerleştirilecek şekilde boncukları boş uca yerleştirin (Şekil 1A).
- Açıklığı kapatmak için ucun üst kısmını pense ile hafifçe sıkın, tüm boncuklar doldurulduktan sonra ucu kesmemeye dikkat edin (Şekil 2B).
NOT: Bu, boncukları ucun içine sabitlemek içindir. Ucun kesilmesini önlemek için pensenin yapılması önerilir (Şekil 2C). - Bükülmüşse ucu elinizle düzeltin.
- Hazırlanan ucu 4 °C'de, ihtiyaç duyulana kadar kurutucu madde ile kapalı bir torbada saklayın.
NOT: Ucu kullanmadan önce, kapalı torbayı açmadan ve çıkarmadan önce oda sıcaklığına getirilmelidir. Nem, lektinlerin reaktivitesini büyük ölçüde azaltır.
2. Analitlerin hazırlanması
- Rutin analiz için biyotinilasyon reaktifini önceden paketleyin.
NOT: Rutin analiz için, hızlı analiz için biyotinilasyon reaktifinin (Biotin-(AC5)2 Sulfo-Osu, bkz . Malzeme Tablosu) aşağıdaki gibi küçük porsiyonlar halinde önceden paketlenmesi yararlı olacaktır. Süksinimidil esteri genellikle hidrolize duyarlı olduğundan, biyotinilasyon reaktifinin kurutulması ve saklanması önerilir.- Biyotinilasyon reaktifini deiyonize suda çözün.
- 10 μg reaktifi bir pipet kullanarak tüplere dağıtın.
- Tüpleri biyotinilasyon reaktifi ile soğutmalı bir vakum yoğunlaştırıcıda kurutun ve kullanana kadar ışık geçirmez bir torbada 4 ° C'de bir kurutucu madde ile saklayın.
- Analit çözeltisini (200 ng eşdeğeri protein), adım 2.1'de hazırlanan kurutulmuş biyotinilasyon reaktifini içeren tüpe ekleyin.
NOT: Kullanılan biyotinilasyon reaktifinin özelliklerine bağlı olarak, analitleri çözmek ve seyreltmek için kullanılan tampon bileşimine dikkat edin. Örneğin, birincil amin reaktiflerini amin eşleşmesi için tampon olarak kullanmaktan kaçının. Bu, analitlerin biyotinilasyon verimliliğinde bir azalmayı önleyecektir. - Girdap yaparak iyice karıştırın, ardından kapaktaki sıvıyı tüpün dibine bırakmak için bir masa üstü santrifüjde aşağı döndürün (oda sıcaklığında 5 saniye boyunca 1000 x g ).
- Tüpleri ışıktan korunarak oda sıcaklığında 1 saat inkübe edin.
- Reaksiyona girmemiş biyotinilasyon reaktiflerini inaktive etmek için biyotinile edilmiş numuneleri Problama tamponunda (TBS'de %1 Triton X-100, 0.5 M Glisin, 1 mM CaCl2 ve 1 mM MnCl2 ) 10 kat seyreltin.
NOT: Amin eşleşmesi ile reaksiyonlar söz konusu olduğunda, reaksiyona girmemiş biyotinilasyon reaktifi, TBS'deki Tris gibi bir birincil amin reaktifi içeren bir tampon ile reaksiyon tarafından tüketilir, bu da sonraki ölçümde boncuklar üzerinde hareketsiz hale getirilen lektinlerin ve diğer maddelerin biyotinilasyonunu önler. - Oda sıcaklığında, ışıktan korunarak 2 saat inkübe edin.
- Gerekirse HRP etiketli streptavidin kullanarak analitlerin biyotinilasyon verimliliğini Western blotlama yoluyla değerlendirin. Batı lekeleme yöntemleri için lütfen literatüre bakın6.
3. Otomatik reaksiyon ölçüm cihazı ile glikan profillemesi için reaktiflerin hazırlanması
- HRP ile konjuge streptavidini bloke edici çözelti ile 1:3000 oranında seyreltin.
- Eşit hacimlerde Substrat A ve Substrat B ile karıştırın ( Malzeme Tablosuna bakın). Numune başına 160 μL karışık substrat kullanın.
- Bloke etme solüsyonunu, yıkama tamponunu (% 0.1 Triton X-100 / TBS), TBS'YI, HRP konjuge streptavidin solüsyonunu ve her bir substratı 10 sıvı rezervuarlı bir kartuşun belirlenen kuyucuklarına dağıtın.
NOT: Reaksiyon kartuşunun her bir kuyusunu doldurmak için önerilen çözelti hacmi ve yerleşimi aşağıda açıklanmıştır. Bununla birlikte, çözeltiler ve kuyu düzenlemesi, otomatik reaksiyon ölçüm cihazında önceden uygun şekilde değiştirilebilir.- Adım 3.1'de hazırlanan 0.2 mL HRP etiketli streptavidin ekleyin. bir pipet kullanarak kuyu #2'ye. Kuyu, kartuşun ön tarafından #1 olarak adlandırılmıştır.
- Bir pipet kullanarak kuyu #3'e 0.2 mL engelleme solüsyonu ekleyin.
- Bir pipet kullanarak #4 ve # 6 numaralı kuyulara 1 mL TBS ekleyin.
- Bir pipet kullanarak #7 ve #8 numaralı kuyulara 1 mL yıkama tamponu ekleyin.
- Bir pipet kullanarak #10 numaralı kuyuya 0.16 mL substrat karışımı ekleyin.
- #1, #5 ve #9 numaralı kuyuların boş olduğunu onaylayın.
- 2. adımda hazırlanan analitleri 2 mL proteinli düşük adsorban vidalı kapaklı bir mikrotüpe ekleyin.
- Otomatik reaksiyon ölçüm cihazının ön kapağını açın.
- Adım 3.3'te hazırlanan sıvı rezervuarlarını, 1'de hazırlanan uçları ve adım 3.4'te hazırlanan analitleri otomatik reaksiyon ölçüm cihazının (Şekil 2D) belirlenen konumlarına aşağıdaki gibi ayarlayın. Her ölçüm tek bir dikey çizgi yönünde gerçekleştirilir.
- Adım 1'de hazırlanan bir ucu, Şekil 2D'deki "a" sarı sembolü konumundaki her deliğe yerleştirin.
NOT: Yine buzdolabındaysa, kapalı torbayı açmadan önce uçları oda sıcaklığına getirin. Lektinler nem nedeniyle sinyallerini önemli ölçüde kaybederler. - Adım 3.4'te hazırlanan analiti içeren tüpün kapağını çıkarın ve benzer şekilde "b" pozisyonundaki her deliğe yerleştirin.
- Adım 3.3'te hazırlanan sıvıyı içeren kartuşu, "c" konumunda dökmemeye dikkat ederek yerleştirin.
- Dolduğunda Şekil 2D'deki tüm "atık kutusunu" çıkarın, içindekileri çöp kutusuna atın ve "atık kutusunu" orijinal konumuna geri koyun.
NOT: Reaksiyona giren uçlar, ölçümden sonra otomatik olarak "atık kutusunda" toplanır.
- Adım 1'de hazırlanan bir ucu, Şekil 2D'deki "a" sarı sembolü konumundaki her deliğe yerleştirin.
4. Otomatik reaksiyon ölçüm cihazı ile glikan profili oluşturma
- Ana ünitenin yan tarafındaki güç anahtarını açın.
- Ekranda görüntülenen "Teşhisi Başlat" düğmesine dokunun (Şekil 3A). Kendi kendine teşhis programı otomatik olarak başlar. Bir süre sonra, kendi kendine teşhis programı tamamlanır ve GİRİŞ ekranı belirir (Şekil 3B).
NOT: İlgili simgelere dokunarak aşağıdaki işlemler gerçekleştirilebilir. Ölçüme başlamak için "Tahlil". Herhangi bir sistem hatasını onaylamak için "Bakım". Geçmiş ölçüm verilerini görüntülemek için "Geçmiş". - Protokolü seçmek için GİRİŞ ekranında görüntülenen "Tahlil"e dokunun (Şekil 3B).
- Tahlil yönteminin "BAssaySTD"sini seçin (Şekil 3C) ve ardından sağ alttaki "İleri"ye basın.
- Her numune için numune adını (Şekil 3D) gerektiği gibi girin ve ardından sağ alttaki "İleri"ye dokunun.
- Her numune için kullanılan uç adını (Şekil 3E) gerektiği gibi girin ve ardından sağ alttaki "İleri"ye dokunun.
- Sağdaki notları onaylayın (Şekil 3F) ve herhangi bir sorun yoksa ölçüm için sağ alttaki "Başlat"a dokunun.
- Ekranın çalışma moduna geçtiğini onaylayın (Şekil 3G) ve "sonlandır" oku vurgulanana kadar bekleyin. Gerekirse, çalışma modunu durdurmak için "Kır"a dokunun.
NOT: Otomatik reaksiyon ölçüm cihazı tarafından otomatik olarak kontrol edilen işlemler aşağıdaki gibidir: (1) Cihazın içindeki otomatik mikropipet nozulları aynı anda maksimum sekiz uç takar ( Şekil 2D'deki sarı "a" sembolüne bakın); (2) Analit içeren tüpteki çözeltiyi 5 dakika boyunca tekrar tekrar aspire edin / boşaltın; (3) Bloke edici çözeltiye aktarın ve 5 dakika boyunca aspire edin / boşaltın; (4) TBS'ye aktarın ve 2 dakika boyunca aspire / deşarj; (5) HRP etiketli streptavidin çözeltisine aktarın ve 5 dakika aspirat / boşaltın; (6) Yıkama tamponuna aktarın ve 7 dakika boyunca aspire edin / boşaltın; (7) TBS'ye aktarın ve 2 dakika boyunca aspire edin / boşaltın; (8) Substrat karışımına aktarın ve bir kerede aspire edin; (9) En yüksek verileri elde etmek için cihazın arkasındaki sekiz ucun kemilüminesansını aynı anda tarayın; (10) Kullanılmış uçları atık kutusuna atın; (11) Nozul başlangıç konumuna geri döner. - Ölçüm tamamlandığında ekranın sonuç moduna geçtiğini onaylayın (Şekil 3H). Sekiz nokta kodu, kolay doğrulama için ekranda aynı anda görüntülenir.
NOT: Tarama grafiğini (Şekil 3I,J), çubuk grafiği (Şekil 3K,L), tabloyu (Şekil 3M) ve ayrıntıyı (Şekil 3N) ekranda sonuç olarak görüntülemek için sol alttaki "Geçmiş"e dokunun. Açılır "Şerit" listesinden Diğer şeritlerden gelen sonuçları görüntüleyin. - Ana ünitenin yan tarafındaki USB bağlantı noktasına bir USB bellek takın ve tüm şeritlerin verilerini ayrı ayrı USB belleğe kaydetmek için sonuç modunun sağ alt kısmındaki "Dışa Aktar"a dokunun.
- Excel'de daha fazla veri analizi ve bireysel grafik oluşturma için ham verileri (Şekil 3M) bir USB bağlantı noktası kullanarak bir CSV dosyası olarak dışa aktarın. Tablonun "değeri", her bir lektinin sinyal yoğunluğunu gösterir. Yoğunluk değerleri, reaksiyona giren uçların taranmasında tepe verilerinin (Şekil 3I,J) maksimum değerini temsil eder.
NOT: En yüksek ekstraksiyon eşiği ayarlanabilir. Analitlere bağlı olarak, ara boncuk kısmındaki sinyal genel olarak daha yüksek olabilir, bu durumda ara parça kısmındaki değer arka plan olarak çıkarılır.
Sonuçlar
İlk olarak, lektin boncuk dizisinin özelliklerini anlamak için her bir lektin için sinyal dağılımı gösterilir. Lektinle sabitlenmiş boncuklardan (her biri 1.000 boncuk) oluşan bir kütüphane hazırlandı. 1.000 boncuktan rastgele on beş boncuk seçildi ve tek bir uca eklendi. Şekil 1A'nın alt kısmında, aynı lektini hareketsiz hale getiren 15 boncuk arasında gözlemlenen hemen hemen aynı sinyal yoğunluğunu temsil eden tipik bir tablo gösterilmektedir. Bu ölçüm prosedürü, glikan profillemesinin kullanılmasından önce el yapımı lektin boncuk üretimini nitelendirmek için uygulanabilir. Örneğin, 90 boncuk üzerindeki sinyallerden varyasyon katsayısını (CV) hesaplamak için eşzamanlı ölçüm için altı uç kullanılır. Tipik bir örnek Tablo 1'de gösterilmiştir. Lektinle sabitlenmiş boncuk kütüphanesi 28 farklı lektini barındıracak şekilde genişletildiğinde, 28 lektinden 25'i, %10'dan daha az bir CV ile yüksek tekrarlanabilirlik gösterdi.
Daha sonra, 15 farklı lektin içeren bir lektin boncuk dizisi için veriler gösterilir. Tablo 2'de gösterilen 15 lektin, lektin boncuk dizisi için seçilmiştir. Ek olarak, Tablo 3'te listelenen 12 poliakrilamid (PAA) mono/di/trisakkarit ölçülmüştür. Ekranda bir nokta kodlama ekranı kullanılarak ölçüm güvenilirliği değerlendirildikten sonra, ham veriler otomatik reaksiyon ölçüm cihazından dışa aktarıldı (bkz. protokol adımı 4.11) ve her bir sakkaritteki reaksiyon tepe değerleri kullanılarak Excel'de bir grafik oluşturuldu (Şekil 4A). Bu değerler daha sonra seçilen 15 lektin ile reaksiyona giren sakkaritler arasındaki korelasyonu görselleştirmek için temel bileşen analizi için kullanıldı (Şekil 4B,C). Bu, Şekil 4A'da gösterilen 12 PAA şekerine karşı her bir lektinin bağlanma modelinde belirgin bir farkla sonuçlandı. Burada, her bir sinyalin geçerliliğinin, önceki lektin ve sakkarit özgüllükleri 7,8 listelerine atıfta bulunduğu gösterilmiştir (ayrıca Tablo 2'deki bu özgüllüklere de bakın). AAL, terminal α-Fuc, Sia-Lex ve Lex'e bağlandığında, otomatik glikan analizi, AAL'nin fukoz içeren molekülleri tanıdığını doğruladı (Şekil 4A). SSA ve MAL (lektinlerin tam isimleri ve verilen kısaltmalar için Tablo 2'ye bakınız) sırasıyla Siaα2-6Gal / GalNAc ve Siaα2-3Gal'i tanıdı. Boncuk dizisindeki MAL ayrıca 3'-O-sülfo-Galβ3GalNAc ve LacNAc'ye bağlanabilir. Bu, MAL'ın baskın olarak 3'-O-sülfo-Gal'i tercih ettiği, LacNAc'nin baskın olmadığımakine öğrenimi 7 kullanılarak analiz edilen önceki sonuçlarla tutarlıdır 9. Gal'i tanıyan bir lektin olan RCA120, Lac / LacNAc dahil olmak üzere terminal β-Gal ile güçlü bir şekilde reaksiyona girdi ve Siaα2-6Lac'a bağlanmasına izin verildi, ancak Siaα2-3Lac'a bağlanmasına izin verilmedi. ECA, LacNAc ile Lac'tan çok daha yüksek reaktiviteye sahipti. WFA, yalnızca α/β-GalNAc'yi değil, aynı zamanda 7,10 olarak bildirildiği gibi terminal β-Gal'yi de tanıyan daha geniş bir özgüllüğe sahipti. GlcNAc ve bir galaktosillenmiş tri/tetra antenli N-glikanları tanıyan GSL II, hazırlanan analitler arasında tek bir GlcNAc dışında herhangi bir sakkarite bağlanmadı. Yüksek mannoz tipi N-glikanları tanıyan GRFT, α-Man ile reaksiyona girdi. ABA, Jacalin ve MAH genellikle O-glikanları tespit etmek için kullanılmıştır. ABA, Galβ1-3GalNAcα-Thr/Ser (T) ve sialil-T yapılarını tercih ettiğinden, boncuk dizisindeki ABA, 3'-O-sülfo-Galβ1-3GalNAc ile güçlü bir şekilde reaksiyona girdi ve α-GalNAc'ye zayıf bir şekilde bağlandı. ABA ayrıca, agalaktosile N-glikanlara bağlanma ile ilgili önceki raporlarla tutarlı olarakβ-GlcNAc'yi de tanıdı 7. Jacalin nispeten daha geniş bir özgüllüğe sahiptir ve bu nedenle α-mannoz, β-GalNAc, βGal, α-GalNAc, 3'-O-sülfo-Galβ1-3GalNAc ile reaksiyona girer. MAH, daha önce bildirildiği gibi 3'-O-sülfat-Galβ1,3GalNAc'yi özel olarak tanıdı7. Kalıntı dört lektin, NPA, LCA, PHA-L ve PHA-E, hazırlanan PAA sakkaritlerine dahil edilmeyen N-glikanın iç yapısını tanıdı ve bu nedenle tüm analitlerle hiçbir afinitesi yoktu.
Elde edilen veriler kullanılarak, her bir sakkarite bağlanmaya katkıda bulunan lektinlerin benzerliği, bunların bir temel bileşen analiz grafiği üzerinde çizilmesiyle açıklığa kavuşturulabilir (Şekil 4B). Şekil 4B'deki varyansa katkıda bulunan tüm sakkaritler, katkı oranının bir vektör ile temsil edildiği bir istatistiksel analiz yöntemi olan özvektör ile temsil edildi (Şekil 4C). Burada, reaksiyona giren sakkaritlerin her bir lektine önyargısız olarak katkıda bulunması dikkat çekicidir. Lektinler sadece bir tür sakkarit için özgüllük göstermez. Örneğin, kompleks tip glikanların varlığı, insanlarda kompleks tip glikanlar içindeki bazı glikanların kısmi olarak tanınmasıyla belirlenir. O-glikanları tanıyan Jacalin (Tablo 2'deki özgüllüklere bakınız), bu çalışmada kullanılan sakkaritler arasında 3'suTF yapısını ve α-GalNAc'yi tanıyabilir ve bu nedenle, 3'suTF ve α-GalNAc, Şekil 4B'de çizilen Jacalin'in (kahverengi nokta) konum yönüne karşı çizilmiştir (Şekil 4C). WFA, bu çalışmada kullanılan sakkaritler arasında α/β-GalNAc'yi tanıyabilir; bu nedenle, Şekil 4C'deki α/β-GalNAc, Şekil 4B'de çizilen WFA ile aynı yönde çizildi. Buna karşılık, α-GalNAc, WFA ve Jacalin arasında çizilir, çünkü Jacalin'in kolayca bağlanabildiği bir sakkarit yapıdır. Bu çalışmada çizilen 11 sakkaritin tümü, daha öncebildirilen lektinlerin özgüllüğü (sakkarit bağlanması) ile tutarlıdır 7,8, bu da önerilen yöntemin güvenilir bir ölçüm yöntemi olduğunu göstermektedir. Ayrıca, her bir sakkarite karşılık gelen özvektörler dağılmıştır, bu da analizde kapsamlı bir kapsama alanı sağlamak için 15 lektinin minimum yanlılık ile seçildiğini desteklemektedir. Sonuç olarak, bu 15 lektin ile doldurulan uç, standart GlikoBIST ucu olarak tanımlandı (Tablo 2).
Daha pratik örnekte, saflaştırılmış protein ürünleri uç ölçümüne tabi tutulmuştur (Şekil 5). N-glikosilasyon bölgesine sahip olan ve kompleks, hibrit ve yüksek mannoz tipi N-glikanlar 11 içeren sığır tiroglobulini analiz edildi. Standart uç, belirli lektinlerin sakkaritlere8 karşı artan reaktivitesini gösterdi (lütfen Tablo 2'deki özelliklere bakın): ikiye bölünen GlcNAc'yi tanıyan PHA-E; GRFT, mannoz tipi N-glikanları tanıyan; SSA, Siaα2-6Gal / GalNAc'yi tanıyan; RCA120, laktoz ve LacNAc'yi tanır; ve fukozu tanıyan AAL. Bu glikan yapıları karmaşık, hibrit ve yüksek mannoz tipi N-glikanlarda bulunur, bu da tiroglobulin11'in N-glikan yapısının etkili bir şekilde değerlendirilebileceğini düşündürür. Ayrıca, sialik asidi sindiren bir enzim olan sialidaz A ile muamele edilen tiroglobulin, sialik asidi tanıyan SSA ile azalmış reaktivite ve sialik asitlerin çıkarılmasından sonra daha kolay tanınan RCA120, WFA ve ECA ile artan reaktivite gösterdi. Sığır tiroglobulininde O-glikan yapılarının varlığı daha önce bildirilmemiştir. Beklendiği gibi, otomatik glikan analizinde sialidaz tedavisi olsun veya olmasın tiroglobulinde O-glikan tanınmamıştır.
Ölçümün sağlamlığını anlamak için seçilen 15 lektin kullanılarak yapılan bir çalışma içi tekrarlanabilirlik testi gösterilmiştir (Tablo 4). Bu test için, analitler için yedi standart uç ve negatif kontrol için ek bir uç hazırlandı ve sekiz ucun tümü aynı anda ölçüldü. Bu prosedür bir günde üç kez tekrarlandı. Tüm lektinler üzerinde önemli sinyaller elde edilmesini sağlayan analitlerin bir kombinasyonu olan "Karışım Analitleri", boncuk dizisinin kalite kontrolü için hazırlandı. Karışım Analitleri, sialidaz ile sindirilmiş eritropoietin (EPO), sialidaz ve galaktosidaz ile sindirilmiş EPO, insan IgA, matris metalloproteinaz 3 (MMP3) ve tiroglobulinin uygun şekilde karıştırılmasıyla formüle edildi. Her glikoprotein (200 ng), Triton X-100 içeren PBS'de 10 μg biyotinilasyon reaktifi ile etiketlendi. Gerekirse, sialidaz ve galaktosidaz tedavileri talimatlarda anlatıldığı gibi yapıldı. Sindirimden sonra, ürünler enzimi inaktive etmek için 10 dakika boyunca 75 ° C'de bir ısı bloğunda inkübe edildi. Uygun miktarlarda biyotinile glikoproteinler (3 ng EPO, 8 ng insan IgA, 5 ng MMP3 ve 15 ng tiroglobulin) analizden hemen önce karıştırıldı. Ölçüm sonuçları, maksimum CV değerinin %13.5 olduğunu ve 15 lektin için ortalama CV'nin %8.2 olduğunu ve yüksek tekrarlanabilirlik gösterdiğini gösterdi.
Ek olarak, ölçüm tarihinden kaynaklanan değişiklikleri anlamak için günlük bir tekrarlanabilirlik testi gösterilmiştir (Tablo 5). Standart uçlar ve Karışım Analitleri önceden hazırlandı ve yedi ucun ölçümleri art arda beş gün boyunca günlük olarak tekrarlandı. Sonuçlar, çoğu lektinin %10'dan daha az bir CV'ye sahip olduğunu gösterdi. Bununla birlikte, LCA ve ECA gibi bazı lektinler daha yüksek CV'ler sergiledi. Döngü başına 15 lektinin ortalama CV'si %7.7'ye kadardı ve 5 günlük ortalama CV değerleri %10'dan azdı, bu da yüksek tekrarlanabilirlik anlamına geliyordu. Jacalin'in, Karışım Analitindeki MMP3'ün kendi kendine sindirilmesi nedeniyle, düşük zamansal tekrarlanabilirlik gösterdiği kaydedildi. Bu nedenle, MMP3'ün yerini almak için daha uygun bir analit tanımlanmalıdır.
Lektinle sabitlenmiş boncukların stabilitesini anlamak için, bu kurutulmuş lektinle sabitlenmiş boncuklar kullanılarak uzun vadeli bir stabilite testi gösterilmiştir (Tablo 6). Standart uçlar, tahlil reaktifleri ve Karışım Analitleri önceden hazırlandı ve ölçümler 12 aylık depolamadan sonra yapıldı. Yukarıda bahsedilen beş tip biyotinile analit, ölçümden önce ayrı ayrı saklandı ve karıştırıldı. Sonuçlar, 15 lektin için ortalama CV'nin, kuru depolamadan 12 ay sonra bile% 10'dan az olduğunu gösterdi. Bu, aynı partiden aynı anda çok sayıda ucu (1.000'e kadar) depolayarak hızlı ve hassas ölçümlerin fizibilitesini gösterir.
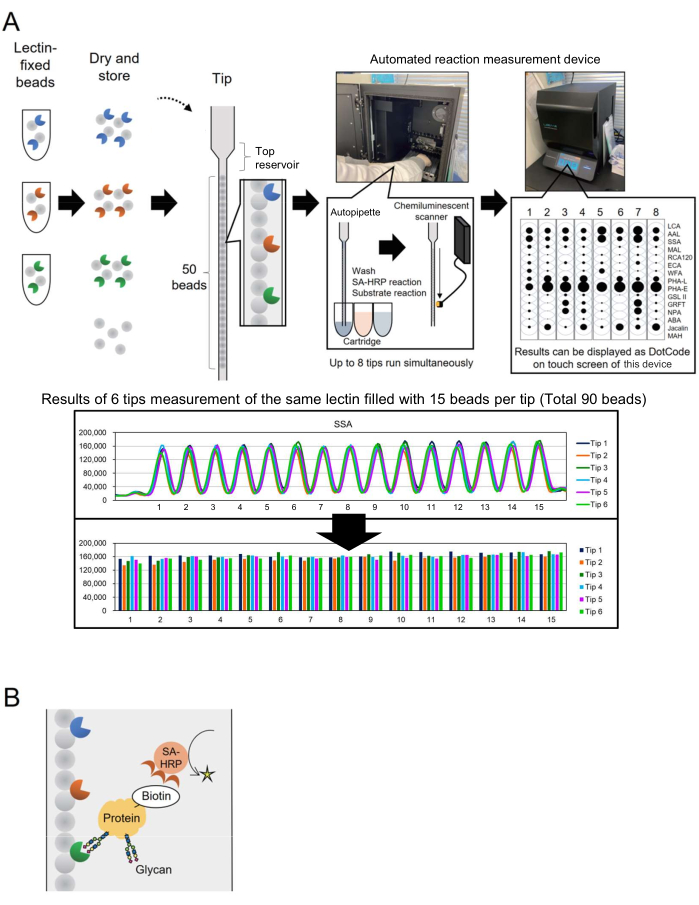
Şekil 1: "Tek bir uçta boncuk dizisi" enstrümanı ve analiz yönteminin şemaları. (A) Otomatik glikan profilleme sisteminin şeması. Lektin ile sabitlenmiş boncuklar kurutulabilir ve uçlarda saklanabilir. HRP etiketli anti-streptavidin antikoru (SA-HRP) gibi reaktifler içeren uçlar ve kartuşlar ölçüm cihazına (otomatik reaksiyon ölçüm cihazı) yerleştirildiğinde ve etkinleştirildiğinde, uç bir otomatik pipet görevi görür. Cihazın arkasındaki kemilüminesans algılama tarayıcısı, aynı anda sekiz uçtan gelen sinyalleri ölçer. Kantitatif veriler, ölçüm sonuçlarının hızlı bir şekilde onaylanması için cihazın dokunmatik ekranında nokta kodları olarak görüntülenir. Alt kısım, aynı lektin ile 90 boncuğun ölçülmesinin sonuçlarını göstermektedir. Ölçüm sonuçları cihazdan taşınır ve bireysel araştırmacı tarafından grafiklendirilir. (B) Bu deneyde kullanılan tespit yönteminin şeması. Hedef proteinler önceden biyotinile edilir ve SA-HRP kullanılarak tespit edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Otomatik reaksiyon ölçüm cihazı ile otomatik glikan profillemesi için malzeme görüntüleri ve kurulum. (A) Lektin sabitleme boncuklarının bir uca paketlenmesinin tasviri. Antistatik mat üzerinde antistatik cımbız ile boncukların alınması ve ucunun boncuklarla doldurulması. (B) Ucu bir pense ile sıkıştırmak. Üst boncuğun hafif bir üst kısmı sıkılır. (C) Uçları kıvırmak için bir pense. Plastik (sarı daire), tamamen kesilmelerini önlemek için sıkıştırılır. (D) Otomatik reaksiyon ölçüm cihazında kullanılan malzemelerin düzenlenmesi. A: uçlar, B: analit içeren tüp ve C: sıvı içeren kartuşlar sırasıyla yerine yerleştirilmelidir. Atık kutusunda, reaksiyona giren uçlar ölçümden sonra toplanır. Kutu çıkarılabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
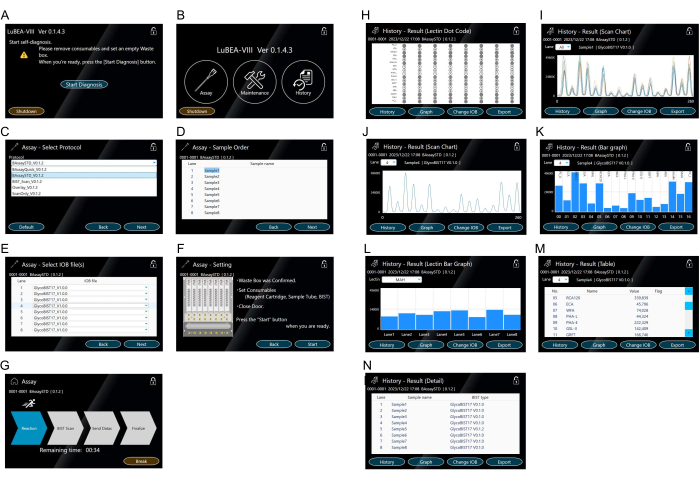
Şekil 3: Makine manipülasyonu için dokunmatik ekran. (A) Güç açıldığında kendi kendine teşhis programı otomatik olarak başlar. (B) GİRİŞ ekranında "Tahlil", "Bakım" ve "Geçmiş" görüntülenir. (C-G) "Tahlil" modunun çalışması. Tahlil yöntemi seçimi (C). Birden fazla protokol önceden kaydedilebilir. Numune (analit) sırasının (D) girişi. Uç tipinin seçilmesi (E). Tahlil yöntemi ayarlarının (F) onaylanması ve tahlilin "Testi Başlat" ekranından (G) başlatılması. (H-N) Sonucun "Tarih" te temsili. Tahlil tamamlandıktan sonra veya "Geçmiş" modundan görüntülenen lektin nokta kodu (H). Tüm numuneler (I) veya her numune (J) için ekranda 15 lektinlik bir tarama tablosu görüntülenir. Tarama grafiği bir çubuk grafik (K) olarak görüntülenir. Diğer şeritler için çubuk grafikler açılır "Şerit" listesinden seçilebilir. Lektin (L) başına sekiz numune şeridini karşılaştıran çubuk grafik. Diğer lektinler açılır "Lektin" listesinden seçilebilir. Kantitatif değerleri (M) gösteren tablo. Yürütülen ölçüm yönteminin kaydı (N). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
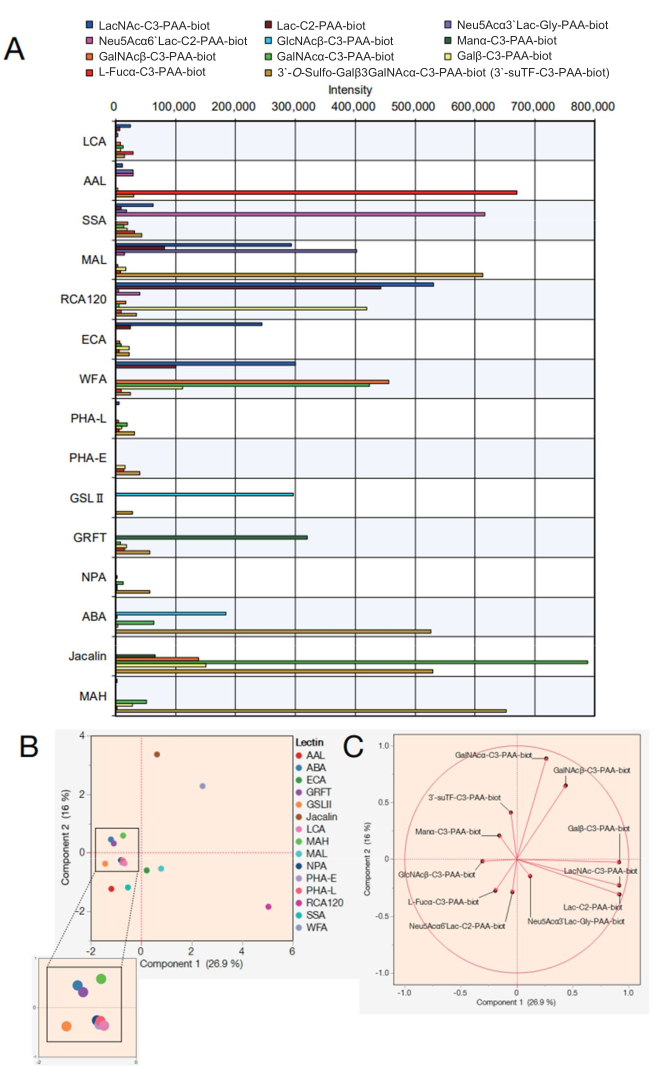
Şekil 4: Otomatik glikan profilleme sisteminde PAA sakkaritleri ile reaktivitenin değerlendirilmesi. (A) Lektinlerin çeşitli PAA sakkaritleri ile reaktivitesini gösteren bir grafik, negatif kontrol değerleri için ayarlandı. (B) (A)'daki verilere dayalı temel bileşen analizi. (C) (B)'deki analizden elde edilen özvektörler. (B) ve (C) parçaları için uyumlu analiz yazılımı kullanılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
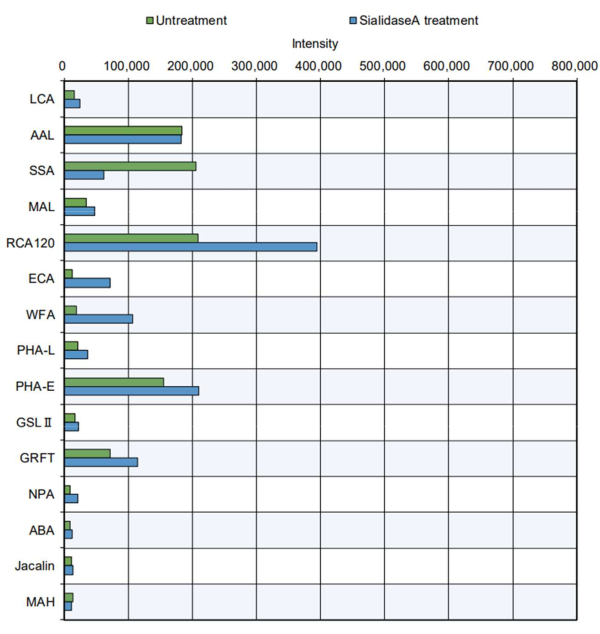
Şekil 5: Saflaştırılmış sığır tiroglobulin proteini kullanılarak GlikoBIST reaktivitesinin doğrulanması. İşlem yapılmadan numune hazırlama, sialidaz A ilavesi hariç olmak üzere, tek başına tampon ile aynı sindirim koşulları altında gerçekleştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Lektin ile sabitlenmiş boncuklarla tekrarlanabilirlik testi. 28 lektin için reaktivitenin tekrarlanabilirliği değerlendirildi. Analitler her uçta reaksiyona sokuldu. EPO: eritropoietin, PSA: prostat spesifik antijen, Tf: transferrin, M2BP: Mac-2 bağlayıcı protein, hIgG: insan IgG, MMP3: matris metalloproteinaz 3, (Sia+): sialidaz A-sindirilmiş analitler, (Sia+, Gal+): sialidaz A ve galaktosidaz sindirilmiş analitler, Ab: antikor. DSA: Datura stramonium aglütinin, HypninA2: Hypnea japonica aglütinin, WGA: buğday tohumu aglütinini, UDA: Urtica dioica aglütinini, BPL: Bauhinia purpurea lektin, Orysata: Oryza sativa lektin, LSL-N: Laetiporus sulphureus lektin N-terminal alanı, SNA: Sambucus nigra lektin, BanLec: muz lektini, MPA: Maclura pomifera aglütininin, TxLC-I: Tulipa gesneriana aglütininin, AOL: Aspergillus oryzae lektin, ACG: Agrocybe cylindracea galectin. CV: varyasyon katsayısı. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Otomatik glikan profillemesi için standart ucu oluşturan lektinlerin listesi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Otomatik glikan profilleme sistemi için standart olarak kullanılan PAA sakkaritler. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4: Çalışma içi tekrarlanabilirlik testinin sonuçları. CV: varyasyon katsayısı. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 5: Günler arası tekrarlanabilirlik testinin sonuçları. CV: varyasyon katsayısı. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 6: Uzun süreli stabilite testinin sonuçları. CV: varyasyon katsayısı. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmada, "tek uçta boncuk dizisi" teknolojisini kullanan glikozilasyon için hızlı bir değerlendirme tekniği geliştirilmiştir. Bu çalışma, rutin, kapsamlı glikosilasyon değerlendirmesini kolaylaştırmak için hem glikobilim hem de glikobilim olmayan araştırmacılar için tasarlanmış standart bir GlycoBIST ucu tanıttı. Tipik olarak 20-100 lektin12,13 kullanan lektin mikrodizisi, değerlendirmelerde yaygın olarak kullanılmıştır. Bununla birlikte, bazı lektinlerin mikrodizi üzerindeki örtüşen özgüllükleri ve ham klinik örneklerin gliomiklerine kıyasla bir hedef glikoprotein üzerindeki nispeten sınırlı glikoform çeşitliliği göz önüne alındığında, odaklanmış glikan profillemesinin basitleştirilmiş değerlendirmesi için 15 lektinin yeterli olacağı tahmin edilmiştir.
Protokoldeki kritik adım, lektin ile hareketsiz hale getirilmiş boncukların veya bu boncuklarla doldurulmuş uçların, ölçümler için kullanılmadan önce saklandıktan sonra oda sıcaklığına geri dönmesine izin vermektir. Özellikle, yoğuşmanın sinyalleri zayıflattığı gözlemlendi; Bu nedenle, saklama torbasını oda sıcaklığına dönene kadar asla açmamanız tavsiye edilir. Biyotinilasyon reaktiflerinin depolanması için, depolamadan önce tamamen kurutulması da önemlidir. Yetersiz bir kurutma işlemi, biyotinilasyon reaktifinin14 hidrolizi nedeniyle biyotinilasyonun proteine olan etkinliğini azaltır.
Modifikasyonlar ve sorun giderme ile ilgili olarak, özellikle otomatik reaksiyon ölçüm cihazındaki ölçüm yöntemiyle ilgili olarak, değişkenliği azaltmak için bir yöntem araştırılmıştır. Özellikle, analiz için kullanılan rezervuardaki tampon hacmi 150 μL olduğunda, kabarcıklar uca girerek reaksiyon verimliliğinin azalmasına ve değerlerde büyük bir değişikliğe neden olur. Bu nedenle, rezervuara en az 200 μL tampon yerleştirilmesi önerilir.
Otomatik pipetleme sırasında uçları dolduran sıvı miktarı da önemli bir faktördür. Uçlar, bir sonraki reaksiyon adımına geçerken sıvıyı tamamen dışarı atamaz. Bu nedenle, küçük bir miktarda, önceki adımdaki tampon bir sonraki adıma taşınır ve yeni tampon aspire edildiğinde önceki tampon, eklenen çözeltinin üst bölgesinde kalır. Bu nedenle, substrat ve diğer çözeltiler, üst rezervuarı doldurmak için yeterince aspire edilmelidir (bkz. Şekil 1A). Cihaz üzerindeki antikor reaksiyonlarının geri döndürülemezliği göz önüne alındığında, ilk kurulum sırasında dikkatli olmak ve hatalardan kaçınmak çok önemlidir.
Yöntemin bir sınırlaması, serum ve kültür süpernatanlarından türetilen çözünür proteinlerle sınırlı olmasıdır. Mevcut yöntemde, lektin, boncuk ile kovalent olarak çapraz bağlı değildir, bu da onu hücre ve doku ekstraktları gibi yüksek konsantrasyonlarda yüzey aktif maddeler içeren numuneleri analiz edemez hale getirir. Sonuç olarak, bu sınırlamaları ele almak için gelecekteki iyileştirmeler gereklidir.
Lektin boncuk dizisinin önemi, boncuklara sabitlenmiş lektin türlerinin değiştirilebilirliği ve genişletilebilirliğinde yatmaktadır. Örneğin, otomatik glikan profilleme sistemini kullanan büyük ölçekli diferansiyel analizde (>1.000 numune), kullanıcılar, hedef glikoproteinin (<100 numune) ön lektin mikrodizi bazlı glikan profillemesine dayalı olarak uçta 15 lektinlik bir dizilimi uyarlayabilir. Ayrıca, lektinle sabitlenmiş boncukların yüksek stabilitesi, ilk uç tasarımından rutin prosedürlerle ölçüme kadar anında deney yapılmasını sağlar. Sadece yüksek güvenilirlik gösteren 28 lektinin 25'i değil (Tablo 1), aynı zamanda kullanıcının ilgisini çeken herhangi bir lektin, yukarıda belirtilen rutin güvenilirlik testini takiben, özel deneyleri için özel bir otomatik glikan profilleme sistemi oluşturmak için kullanılabilir. Bu yaklaşım, standart glikan profilleme sistemi ile bağlantılı olarak genişletilmiş ölçüm için sekiz farklı tipte uçtan oluşan olası bir 120 lektin boncuk dizisinin tasarımına yol açtı.
Önceki bir çalışma, lektin mikrodizisi15 ile uyumlu olarak Cy3 etiketli glikoproteinler için bir tespit prosedürü oluşturmaya odaklandı. Bu yöntem, floresan girişimi nedeniyle uçta paralel olarak 13 lektin ile sınırlıydı. HRP algılama etiketlerini kullanan mevcut yöntem, bir uçta 15 lektinle sabitlenmiş boncuk ve iki kontrol boncuğu (pozitif ve negatif) barındırır. Ek olarak, numunelerin biyotinilasyonu analiz sürecini kısaltmıştır.
Bu analitik yöntem sadece akademik araştırmalara değil, aynı zamanda tıbbi ve farmasötik araştırmalara, gıda, kozmetik ve diğer endüstriyel alanlara da uygulanabilir. Lektin mikroarray ve glikoproteomik teknolojileri iyi kurulmuş olsa da, bu çalışmanın yaklaşımı, tam otomasyonu ve daha az adımla hızlı analiz kabiliyeti açısından önemini korumaktadır. Gelecekte, bu analizdeki iyileştirmeler, belirli glikoproteinler kullanılarak sinyali normalleştirerek, bir uçta lektinle sabitlenmiş boncukların yanı sıra antikorla sabitlenmiş boncuklar kullanarak kantitatif bir yöntemde yapılacaktır.
Açıklamalar
AO, TO, NT, HS, KK, MA, SY, TM, KN, OS ve KS, Precision System Science Co., Ltd.'nin çalışanlarıdır.
Teşekkürler
Bu çalışma, Japonya Bilim ve Teknoloji Ajansı (JST) tarafından finanse edilen, JPMJTR204A Numaralı Hibe kapsamında ve kısmen Japonya Bilimi Teşvik Derneği (JSPS) KAKENHI Hibe Numarası 23H02680 ile AK'ye finanse edilen Hedef Odaklı Ar-Ge (A-STEP) yoluyla Uyarlanabilir ve Kesintisiz Teknoloji Transferi Programı tarafından desteklenmiştir. İngilizce dilini düzenlediği için Editage'a (www.editage.jp) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
Referanslar
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103(2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır