Method Article
완전 자동화된 시스템을 사용한 재조합 단백질의 신속한 Glyco-Qualitative Assessment of recombinant proteins with a fully automated system (완전 자동화된 시스템을 사용한 재조합 단백질의 신속한 Glyco-Qualitative Assessment of recombinant proteins using a fully automated system)
요약
단백질에 있는 글라이칸의 자동적이고 신속한 분석을 위한 시스템이 이전에 개발되었습니다. 이 기사에서는 바이오 의약품 및 기타 당접합체 물질의 글라이칸 구조를 분석하는 사용자와 같은 광범위한 사용자에게 최적화된 "글리코 정성 분석"을 위한 프로토콜을 제시합니다.
초록
중요한 번역 후 변형(post-translational modification)인 단백질 당화(glycosylation)는 바이오 의약품을 포함한 재조합 단백질의 안정성, 효능 및 면역원성에 영향을 미칩니다. 글라이칸 구조는 생산 세포 유형, 배양 조건 및 정제 방법에 따라 달라지는 상당한 이질성을 나타냅니다. 결과적으로, 재조합 단백질의 글라이칸 구조를 모니터링하고 평가하는 것은 특히 바이오 의약품 생산에서 매우 중요합니다. 질량 분석법을 보완하는 기술인 렉틴 마이크로어레이는 높은 감도와 사용 편의성을 자랑합니다. 그러나 일반적으로 결과를 산출하는 데 하루 이상이 걸립니다. 비(非)글리코사이언스 연구 또는 의약품 공정 개발에 적용하려면 자동화된 고처리량 대안이 필요합니다. 따라서 세계 최초의 완전 자동화된 렉틴 기반 글라이칸 프로파일링 시스템이 개발되었으며, 이는 "BIST(bead array in a single tip)" 기술 개념을 활용했습니다. 이 시스템을 사용하면 1,000개 단위로 렉틴 고정 비드를 준비하고 보관할 수 있으며, 다양한 목적에 맞게 사용자 정의 가능한 병렬 삽입 주문을 할 수 있습니다. 이 기사는 "glyco-qualified" 재조합 단백질과 관련된 연구를 위한 실용적인 프로토콜을 제시합니다. 12개의 폴리아크릴아마이드-글라이칸 접합체에 대한 반응성을 테스트한 후, 시스템의 다양성을 높이기 위해 15개의 렉틴을 선택했습니다. 또한 Cy3에서 비오틴으로 전환하여 시료 라벨링 공정을 최적화하여 전체 처리 시간을 30분 단축했습니다. 즉각적인 데이터 검증을 위해 렉틴 결합 신호는 상단 모니터에 도트 코드로 표시됩니다. 시스템의 신뢰성은 일일 재현성 테스트, 반복성 테스트 및 장기 보관 테스트를 통해 확인되었으며 변동 계수는 <10%였습니다. 이 사용자 친화적이고 신속한 당(glyco-analyzer)은 바이오마커 평가 및 검증을 위한 내인성 당단백질의 품질 모니터링에 잠재적으로 응용될 수 있습니다. 이 방법은 당과학을 처음 접하는 사람들의 분석을 용이하게 하여 실용적인 유용성을 확대합니다.
서문
단백질 당화(glycosylation)는 바이오 의약품에서 평가해야 하는 중요한 번역 후 변형(post-translational modification)입니다. 단백질의 글라이칸 프로필은 배양 조건, 정제 과정 및 숙주 세포에 따라 달라질 수 있습니다1. 바이오프로세스 파이프라인 내에서 당화(glycosylation)를 검증하기 위해 간단한 기기가 필요합니다. in vivo 에서 분비되는 단백질과 막 단백질의 50% 이상이 여러 글라이칸으로 변형되는 것으로 추정되며, 이는 세포 계통, 발달 단계, 악성 종양 발병과 같은 질병 상태에 따라 변화한다2. 글라이칸 프로파일 모니터링은 고유한 진단 마커와 약물 표적을 식별할 수 있는 상당한 잠재력을 가지고 있습니다. 대규모 시료 크기를 신속하게 측정할 수 있는 자동화된 기기는 발견 파이프라인에 있는 수백 개의 환자 시료에서 이러한 비정상적인 당화(glycosylation)를 확인하고 검증하기 위해 수요가 많습니다.
마이크로어레이 기술은 당단백질의 글라이칸 프로파일링을 평가하기 위해 글리코믹스에 통합되었다3. 이 방법에서는 글리칸 결합 단백질인 여러 렉틴이 유리 슬라이드와 같은 표면에 고정됩니다. 이 상호 작용 기반 당(glyco-analysis) 기술은 핵심 단백질에서 글라이칸을 미리 방출할 필요가 없어 당기술을 처음 접하는 연구자의 프로세스를 단순화합니다. 널리 사용됨에도 불구하고 바이오 생산과 같은 산업 응용 분야의 경우 더 많은 분석 대상에 대해 글라이칸을 빠르고 쉽게 모니터링할 수 있는 자동화 시스템이 필요했습니다. 이 문제를 해결하기 위해 초기에 유전형 분석을 위해 개발된 "단일 팁의 비드 어레이"(BIST)라는 고유한 개념을 기반으로 하는 자동화된 글라이칸 프로파일링 시스템이 이전에 보고되었습니다. 이 시스템은 일체형 고처리량 자동 기기4로 공정을 단순화합니다. 다양한 렉틴 고정 비드가 평행하게 배열된 팁 4,5를 사용하여 당단백질에서 변형된 글라이칸 구조를 분석하는 방법을 확립하고 GlycoBIST(이하 "자동 글라이칸 프로파일링 시스템"이라고 함)로 명명했습니다(그림 1A). 렉틴은 1,000개의 비드에 고정하고 건조시켜 팁에 패킹 전과 후에 1년 동안 활성을 유지할 수 있습니다. HRP 표지 항-스트렙타비딘 항체(SA-HRP)와 같은 시약이 포함된 팁 및 카트리지가 측정 프로토타입 기기(자동 반응 측정 장치, 재료 표 참조)에 설정되면 팁이 자동 피펫 역할을 합니다. 기기 내부 후면에 있는 화학발광 감지 스캐너는 8개 팁의 신호를 동시에 정량화합니다. 이 8가지 팁의 정량 데이터는 측정 결과를 빠르게 확인할 수 있도록 기기의 터치스크린에 동시에 도트 코드로 간결하게 표시됩니다. 또한 측정된 피크의 최대값으로 표시된 값은 기기에서 원시 데이터로 전송되며 개별 연구원이 그래프로 작성할 수 있습니다(그림 1A, 하단 패널).
이 기사에서 저자는 단백질의 비오틴 표지를 개선하는 개선된 방법을 설명하여 처리 시간을 30분으로 단축했습니다. 표적 단백질은 사전에 비오틴화되어 SA-HRP에 의해 검출됩니다(그림 1B). 15개의 선택된 렉틴이 포함된 표준 GlycoBIST 팁(자동 글라이칸 프로파일링을 위한 특수 팁)은 분석 포괄성을 위한 다목적 당단백질 글라이칸 프로파일링을 달성하기 위해 구성되었습니다.
프로토콜
이 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 자동 글라이칸 프로파일링을 위한 전문 팁 준비
- 밀봉된 백에 담아 4°C에서 보관된 건조된 렉틴 고정 비드를 벤치로 가져와 실온(~23°C)으로 되돌립니다.
알림: 이렇게 하면 비드의 품질이 저하될 수 있는 비드의 결로를 방지할 수 있습니다. 이러한 렉틴 고정 비드를 제조하는 방법은 이전에 보고된 바 있다5. - 책상 위에 정전기 방지 천을 놓고 휴대용 정전기 제거기를 작업 공간을 향하게 놓습니다. 이를 통해 정전기 방지 보호 장치가 있는 벤치에서 후속 작업을 수행할 수 있습니다(그림 2A).
- 정전기 방지 핀셋을 사용하여 빈 팁에 비드를 삽입하여 렉틴 고정 비드 사이에 두 개의 스페이서 비드가 배치되도록 합니다(그림 1A).
- 니퍼로 팁 상단을 부드럽게 짜서 개구부를 닫고 모든 비즈를 채운 후 팁이 잘리지 않도록 주의합니다(그림 2B).
알림: 이것은 팁 내부에 비드를 고정하기 위한 것입니다. 니퍼는 팁이 잘리지 않도록 제작하는 것이 좋습니다(그림 2C). - 팁이 구부러진 경우 손으로 곧게 펴십시오.
- 준비된 팁을 4°C에서 필요할 때까지 건조제와 함께 밀봉된 백에 보관하십시오.
알림: 팁을 사용하기 전에 밀봉된 백을 개봉하여 꺼내기 전에 실온에 두어야 합니다. 수분은 렉틴의 반응성을 크게 줄입니다.
2. 분석물의 준비
- 일상적인 분석을 위해 비오틴화 시약을 미리 포장합니다.
참고: 일상적인 분석의 경우 빠른 분석을 위해 비오틴화 시약(Biotin-(AC5)2 Sulfo-Osu, 재료 표 참조)을 다음과 같이 소량으로 미리 포장하는 것이 도움이 됩니다. 비오틴화 시약은 숙시니미딜 에스테르가 일반적으로 가수분해에 취약하므로 건조하여 보관하는 것이 좋습니다.- 비오틴화 시약을 탈이온수에 용해시킵니다.
- 피펫을 사용하여 10μg의 시약을 튜브에 분주합니다.
- 냉장 진공 농축기에서 비오틴화 시약으로 튜브를 건조시키고 사용할 때까지 4°C의 건조제와 함께 차광 백에 보관합니다.
- 2.1단계에서 준비한 건조된 비오틴화 시약이 들어 있는 튜브에 분석물 용액(200ng eq. 단백질)을 추가합니다.
참고: 사용된 비오틴화 시약의 특성에 따라 분석물을 용해 및 희석하는 데 사용되는 완충액 조성에 유의하십시오. 예를 들어, 1차 아민 시약을 아민 커플링의 완충액으로 사용하지 마십시오. 이는 분석물질의 비오틴화 효율이 감소하는 것을 방지할 수 있습니다. - 소용돌이로 잘 섞은 다음 탁상용 원심 분리기에서 스핀 다운(실온에서 1000 x g 동안 5초) 뚜껑의 액체를 튜브 바닥으로 떨어뜨립니다.
- 빛으로부터 차폐된 실온에서 1시간 동안 튜브를 배양합니다.
- 비오틴화된 샘플을 프로빙 완충액(TBS에서 1% Triton X-100, 0.5M 글리신, 1mM CaCl2 및 1mM MnCl2 )에 10배 희석하여 미반응 비오틴화 시약을 비활성화합니다.
참고: 아민 커플링에 의한 반응의 경우, 미반응 비오틴화 시약은 TBS의 Tris와 같은 1차 아민 시약을 함유한 완충액과 함께 반응에 의해 소모되며, 이는 후속 측정에서 비드에 고정된 렉틴 및 기타 물질의 비오틴화를 방지합니다. - 빛을 차단하고 실온에서 2시간 동안 배양합니다.
- 필요한 경우 HRP 표지 스트렙타비딘을 검출 프로브로 사용하여 웨스턴 블로팅을 통해 분석물질의 비오틴화 효율을 평가합니다. 웨스턴 블로팅 방법에 대해서는 문헌을 참조하십시오6.
3. 자동 반응 측정 장치를 사용한 글라이칸 프로파일링을 위한 시약 준비
- HRP 접합 스트렙타비딘을 차단 용액과 1:3000 비율로 희석합니다.
- 동일한 부피의 기판 A와 기판 B와 혼합합니다( 재료 표 참조). 시료당 160μL의 혼합 기질을 사용합니다.
- 차단 용액, 세척 완충액(0.1% Triton X-100/TBS), TBS, HRP-복합 스트렙타비딘 용액 및 각 기질을 10개의 액체 저장소가 있는 카트리지의 지정된 웰에 세척합니다.
참고: 반응 카트리지의 각 웰을 채우기 위한 용액의 권장 부피 및 배치는 아래에 설명되어 있습니다. 그러나, 용액 및 웰 배열은 사전에 적절하게 자동 반응 측정 장치에서 변경할 수 있습니다.- 3.1단계에서 준비한 HRP 표지 스트렙타비딘 0.2mL를 추가합니다. 피펫을 사용하여 #2를 잘 만듭니다. 웰은 카트리지 전면에서 #1로 명명됩니다.
- 피펫을 사용하여 0.2mL의 차단 용액을 웰 #3에 추가합니다.
- 피펫을 사용하여 웰 #4 및 #6에 TBS 1mL를 추가합니다.
- 피펫을 사용하여 웰 #7 및 #8에 세척 완충액 1mL를 추가합니다.
- 피펫을 사용하여 0.16mL의 기질 혼합물을 웰 #10에 추가합니다.
- 웰 #1, #5, #9가 비어 있는지 확인합니다.
- 2단계에서 준비한 분석물을 2mL 단백질이 적은 흡착제 스크류캡 마이크로튜브에 추가합니다.
- 자동 반응 측정 장치의 전면 도어를 엽니다.
- 3.3단계에서 준비한 액체 저장조, 1단계에서 준비한 팁, 3.4단계에서 준비한 분석물을 자동 반응 측정 장치(그림 2D)의 지정된 위치에 다음과 같이 설정합니다. 각 측정은 단일 수직선 방향으로 수행됩니다.
- 그림 1D의 노란색 기호 "a" 위치에 있는 각 구멍에 1단계에서 준비한 하나의 팁을 놓습니다.
알림: 다시 말하지만, 냉장 보관하는 경우 밀봉된 백을 열기 전에 팁을 실온으로 가져오십시오. 렉틴은 습기로 인해 신호를 급격히 잃습니다. - 3.4단계에서 준비한 분석물이 들어 있는 튜브의 뚜껑을 제거하고 유사하게 위치 "b"의 각 구멍에 삽입합니다.
- 3.3단계에서 준비한 액체가 들어 있는 카트리지를 "c" 위치에 흘리지 않도록 주의하면서 삽입합니다.
- 그림 2D의 "쓰레기 상자"가 가득 차면 전체 항목을 제거하고 내용물을 쓰레기통에 버리고 "폐기물 상자"를 원래 위치로 되돌립니다.
알림: 반응된 팁은 측정 후 "폐기물 상자"에 자동으로 수거됩니다.
- 그림 1D의 노란색 기호 "a" 위치에 있는 각 구멍에 1단계에서 준비한 하나의 팁을 놓습니다.
4. 자동 반응 측정 장치를 사용한 글라이칸 프로파일링
- 본체 측면에 있는 전원 스위치를 켭니다.
- 화면에 표시된 "진단 시작" 버튼을 터치합니다(그림 3A). 자가 진단 프로그램이 자동으로 시작됩니다. 잠시 후 자가 진단 프로그램이 완료되고 HOME 화면이 나타납니다(그림 3B).
알림: 각 아이콘을 터치하여 다음 작업을 수행할 수 있습니다. "분석"을 눌러 측정을 시작합니다. 시스템 오류를 확인하기 위한 "유지 관리". "기록"은 과거 측정 데이터를 표시합니다. - HOME 화면에 표시된 "Assay"를 터치하여 프로토콜을 선택합니다(그림 3B).
- 분석 방법의 "BAssaySTD"(그림 3C)를 선택한 후 오른쪽 하단의 "다음"을 누릅니다.
- 필요에 따라 각 샘플에 대한 샘플 이름(그림 3D)을 입력하고 오른쪽 하단의 "다음"을 터치합니다.
- 필요에 따라 각 샘플에 사용된 팁 이름(그림 3E)을 입력하고 오른쪽 하단의 "다음"을 터치합니다.
- 오른쪽의 참고 사항(그림 3F)을 확인하고 문제가 없으면 오른쪽 하단의 "시작"을 터치하여 측정합니다.
- 화면이 실행 모드로 전환되는지 확인하고(그림 3G) "finalize" 화살표가 강조 표시될 때까지 기다립니다. 필요한 경우 "Break"를 터치하여 실행 모드를 중지합니다.
참고: 자동 반응 측정 장치에 의해 자동으로 제어되는 작업은 다음과 같습니다: (1) 기기 내부의 자동 마이크로피펫 노즐은 최대 8개의 팁을 동시에 부착합니다( 그림 2D의 노란색 기호 "a" 참조). (2) 분석물을 포함하는 튜브에서 용액을 5분 동안 반복적으로 흡입/배출합니다. (3) 차단 용액으로 옮기고 5분 동안 흡인/방전합니다. (4) TBS로 옮겨 2분 동안 흡인/방전합니다. (5) HRP 표지 스트렙타비딘 용액으로 옮기고 5분 동안 흡인/배출합니다. (6) 세척 버퍼로 옮기고 7분 동안 흡인/배출합니다. (7) TBS로 이송하여 2분 동안 흡인/방전합니다. (8) 기판 혼합물로 옮기고 한 번에 흡인합니다. (9) 장치 뒷면에서 8개 팁의 화학발광을 동시에 스캔하여 피크 데이터를 얻습니다. (10) 사용한 팁을 쓰레기통에 버리십시오. (11) 노즐이 초기 위치로 돌아갑니다. - 측정이 완료되면 화면이 결과 모드(그림 3H)로 변경되었는지 확인합니다. 8개의 도트 코드가 동시에 화면에 표시되어 쉽게 확인할 수 있습니다.
알림: 왼쪽 하단의 "기록"을 터치하여 스캔 차트(그림 3I,J), 막대 그래프(그림 3K,L), 표(그림 3M) 및 세부 정보(그림 3N)를 화면에 결과로 표시합니다. 드롭다운 "차선" 목록에서 다른 차선의 결과를 봅니다. - 본체 측면의 USB 포트에 USB 메모리를 삽입하고 결과 모드의 오른쪽 하단에 있는 "내보내기"를 터치하면 모든 레인의 데이터가 USB 메모리에 개별적으로 저장됩니다.
- 원시 데이터(그림 3M)를 USB 포트를 사용하여 CSV 파일로 내보내면 Excel에서 추가 데이터 분석 및 개별 그래프를 작성할 수 있습니다. 표의 "값"은 각 렉틴의 신호 강도를 나타냅니다. intensity 값은 반응된 팁의 스캔에서 피크 데이터(그림 3I,J)의 최대값을 나타냅니다.
참고: 피크 추출 임계값을 설정할 수 있습니다. 분석물질에 따라 스페이서 비드 부분의 신호가 전체적으로 더 높을 수 있으며, 이 경우 스페이서 부분의 값이 배경으로 차감됩니다.
결과
먼저, 렉틴 비드 어레이의 특성을 이해하기 위해 각 렉틴에 대한 신호 분포를 보여줍니다. 렉틴 고정 비드(각 1,000개의 비드) 라이브러리가 준비되었습니다. 1,000개의 구슬 중에서 무작위로 15개의 구슬을 선택하여 하나의 팁에 추가했습니다. 일반적인 차트는 그림 1A의 하단에 표시되어 있으며, 이는 동일한 렉틴을 고정시키는 15개의 비드에서 관찰된 것과 거의 동일한 신호 강도를 나타냅니다. 이 측정 절차는 글라이칸 프로파일링을 사용하기 전에 수작업 렉틴 비드 생산을 검증하는 데 적용할 수 있습니다. 예를 들어, 90개의 비드에 있는 신호로부터 변동 계수(CV)를 계산하기 위해 동시 측정에 6개의 팁이 사용됩니다. 일반적인 예가 표 1에 나와 있습니다. 렉틴 고정 비드 라이브러리가 28개의 서로 다른 렉틴을 수용할 수 있도록 확장되었을 때, 28개의 렉틴 중 25개가 CV가 10% 미만으로 높은 재현성을 보여주었습니다.
다음으로, 15개의 서로 다른 렉틴이 있는 렉틴 비드 어레이에 대한 데이터가 표시됩니다. 표 2에 나타낸 15개의 렉틴은 렉틴 비드 어레이를 위해 선택되었다. 또한, 표 3에 나열된 12개의 폴리아크릴아미드(PAA) 모노/디/트리사카라이드를 측정하였다. 화면의 도트코딩 디스플레이를 사용하여 측정 신뢰성을 평가한 후 원시 데이터를 자동 반응 측정 장치에서 내보내고(프로토콜 단계 4.11 참조) 각 당류의 반응 피크 값을 사용하여 Excel에서 그래프를 생성했습니다(그림 4A). 그런 다음 이 값을 주성분 분석에 사용하여 선택한 15개의 렉틴과 반응된 당류 간의 상관관계를 시각화했습니다(그림 4B,C). 그 결과 그림 4A에 나타난 12개의 PAA-당에 대한 각 렉틴의 결합 패턴에서 뚜렷한 차이가 나타났다. 여기에서, 각 신호의 타당성은 렉틴 및 당류 특이성(lectin and saccharide specificities)7,8의 통합된 이전 리스트를 참조하는 것으로 나타난다(또한 표 2에서 이들 특이성 참조). AAL이 말단 α-Fuc, Sia-Lex 및 Lex에 결합함에 따라 자동 글라이칸 분석을 통해 AAL의 푸코스 함유 분자 인식을 확인했습니다(그림 4A). SSA 및 MAL(렉틴의 전체 이름 및 주어진 약어는 표 2 참조)은 각각 Siaα2-6Gal/GalNAc 및 Siaα2-3Gal을 인식했습니다. 비드 어레이의 MAL은 3'-O-sulfo-Galβ3GalNAc 및 LacNAc에도 결합할 수 있습니다. 이는머신러닝7을 사용하여 분석한 이전 결과와 일치하며, MAL은 3'-O-sulfo-Gal을 우세하게 선호하는 반면, LacNAc는 우성적이지 않다9. Gal 인식 렉틴인 RCA120은 Lac/LacNAc를 포함한 말단 β-Gal과 강하게 반응하여 Siaα2-6Lac에는 결합할 수 있었지만 Siaα2-3Lac에는 결합할 수 없었습니다. ECA는 LacNAc에 대한 반응성이 Lac보다 훨씬 높았습니다. WFA는 보고된 바와 같이 α/β-GalNAc뿐만 아니라 말단 β-Gal도 인식하는 보다 광범위한 특이성을 가졌습니다. GlcNAc와 갈락토실화된 삼중/테트라 안테나 N-글라이칸을 인식하는 GSL II는 제조된 분석물 중 단일 GlcNAc를 제외하고는 어떤 당류에도 결합하지 않았습니다. 높은 만노스형 N-글리칸을 인식하는 GRFT는 α-Man과 반응했습니다. ABA, Jacalin 및 MAH는 일반적으로 O-글리칸을 검출하는 데 사용되었습니다. ABA는 Galβ1-3GalNAcα-Thr/Ser (T) 및 sialyl-T 구조를 선호하므로 비드 어레이의 ABA는 3'-O-sulfo-Galβ1-3GalNAc와 강하게 반응하고 α-GalNAc에 약하게 결합했습니다. ABA는 또한 아β락토실화된 N-글리칸에 대한 결합에 대한 이전 보고와 일치하는 -GlcNAc를 인정했습니다7. 자칼린은 상대적으로 더 넓은 특이성을 가지므로 α-만노스, β-GalNAc, βGal, α-GalNAc, 3'-O-설포-Galβ1-3GalNAc와 반응하였다. MAH는 이전에 보고된 바와 같이 3'-O-sulfate-Galβ1,3GalNAc를 구체적으로 인식했습니다7. 잔류 4개의 렉틴(NPA, LCA, PHA-L 및 PHA-E)은 제조된 PAA 당류에 포함되지 않은 N-글리칸의 내부 구조를 인식하여 모든 분석물과 친화성이 없었습니다.
얻어진 데이터를 사용하여 각 당류에 대한 결합에 기여하는 렉틴의 유사성은 주성분 분석 그래프에 표시하여 명확히 할 수 있습니다(그림 4B). 그림 4B의 분산에 기여한 모든 당류는 기여 비율이 벡터로 표시되는 통계 분석 방법인 고유벡터로 표현되었습니다(그림 4C). 여기서 주목할 만한 것은 반응된 당류가 바이어스 없이 각 렉틴에 기여한다는 점이다. 렉틴은 한 가지 유형의 당류에 대해서만 특이성을 나타내지 않습니다. 예를 들어, 복합형 글라이칸의 존재는 인간의 복합형 글라이칸 내에서 일부 글라이칸의 부분적 인식에 의해 결정됩니다. O-glycan을 인식하는 Jacalin(표 2의 특이성 참조)은 본 연구에서 사용된 당류 중 3'suTF 구조와 α-GalNAc를 인식할 수 있으므로, 그림 4B에 표시된 Jacalin(갈색 점)의 위치 방향에 대해 3'suTF와 α-GalNAc를 플롯하였다(그림 4C). WFA는 이 연구에 사용된 당류 중 α/β-GalNAc를 인식할 수 있습니다. 따라서 그림 4C의 α/β-GalNAc는 그림 4B의 WFA와 동일한 방향으로 플롯되었습니다. 대조적으로, α-GalNAc는 자칼린이 쉽게 결합할 수 있는 당류 구조이기 때문에 WFA와 자칼린 사이에 표시됩니다. 이 연구에서 표시된 11개의 당류는 모두 이전에 보고된 렉틴의 특이성(당류 결합)과 일치하며, 7,8, 이는 제안된 방법이 신뢰할 수 있는 측정 방법임을 나타냅니다. 또한, 각 당류에 해당하는 고유 벡터가 분산되어 있어 분석에서 포괄적인 적용 범위를 보장하기 위해 15개의 렉틴이 최소한의 바이어스로 선택되었음을 뒷받침합니다. 결과적으로, 이들 15개의 렉틴으로 보충된 팁은 표준 GlycoBIST-tip으로 정의되었습니다(표 2).
보다 실용적인 예에서, 정제된 단백질 제품은 팁 측정을 거쳤습니다(그림 5). N-글리코실화 부위를 가지고 있으며 복합체, 하이브리드, 고만노스형 N-글리칸11을 포함하는 소 갑상선 글로불린을 분석하였다. 표준 팁은 당류8에 대한 특정 렉틴의 반응성 증가를 나타냈습니다 (표 2의 특이성 참조) : PHA-E는 GlcNAc를 이등분합니다. GRFT, 만노스형 N-글리칸 인식; SSA, Siaα2-6Gal/GalNAc 인식; RCA120, 유당 및 LacNAc를 인식; 그리고 AAL, fucose를 인식합니다. 이러한 글라이칸 구조는 복합체, 하이브리드, 하이브리드형 N-글리칸에 존재하며, 이는 갑상선 글로불린11의 N-글리칸 구조를 효과적으로 평가할 수 있음을 시사합니다. 또한, 시알산을 소화하는 효소인 시알리다아제 A를 처리한 티로글로불린은 시알산을 인식하는 SSA와의 반응성이 감소하고, 시알산을 제거한 후 더 쉽게 인식되는 RCA120, WFA, ECA와의 반응성이 증가한 것으로 나타났습니다. 소의 갑상선 글로불린에서 O-글리칸 구조의 존재는 이전에 보고된 적이 없습니다. 예상했던 대로, 자동 글라이칸 분석에서 시알리다아제 처리 유무에 관계없이 갑상선 글로불린에서 O-글리칸이 인식되지 않았습니다.
선택된 15개의 렉틴을 사용한 실행 내 재현성 테스트는 측정의 견고성을 이해하는 것으로 나타났습니다(표 4). 이 테스트를 위해 분석물질에 대한 7개의 표준 팁과 음성 대조군을 위한 추가 팁을 준비했으며 8개의 팁을 모두 동시에 측정했습니다. 이 과정을 하루에 세 번 반복했습니다. 모든 렉틴에서 유의미한 신호를 얻는 분석물질의 조합인 "혼합 분석물"은 비드 어레이의 품질 관리를 위해 준비되었습니다. 혼합물 분석물질은 시알리다아제 소화 에리트로포이에틴(EPO), 시알리다아제 및 갈락토시다아제 소화 EPO, 인간 IgA, 매트릭스 금속단백분해효소 3(MMP3) 및 티로글로불린을 적절하게 혼합하여 제조되었습니다. 각 당단백질(200ng)은 Triton X-100을 함유하는 PBS에서 10μg의 비오틴화 시약으로 표지되었습니다. 필요한 경우, 시알리다아제 및 갈락토시다아제 처리를 지시사항에 기재된 대로 수행하였다. 분해 후, 산물을 75°C의 열 블록에서 10분 동안 배양하여 효소를 비활성화시켰다. 적절한 양의 비오틴화 당단백질(EPO 3ng, 인간 IgA 8ng, MMP3 5ng, 티로글로불린 15ng)을 분석 직전에 혼합했습니다. 측정 결과, 15개의 렉틴에 대한 최대 CV값은 13.5%, 평균 CV는 8.2%로 높은 재현성을 보여주었습니다.
또한 측정 날짜로 인한 변동을 이해하기 위해 일상적인 재현성 테스트를 수행하는 것으로 나타났습니다(표 5). 표준 팁과 혼합 분석물을 미리 준비하고, 7개의 팁을 5일 연속 매일 측정했습니다. 그 결과 대부분의 렉틴은 CV가 10% 미만인 것으로 나타났습니다. 그러나 LCA 및 ECA와 같은 일부 렉틴은 더 높은 CV를 나타냈습니다. 사이클당 15개 렉틴의 평균 CV는 최대 7.7%였으며 5일 동안의 평균 CV 값은 10% 미만으로 높은 재현성을 의미했습니다. 자칼린(Jacalin)은 믹스 분석물에서 MMP3의 자가 소화(self-digestion)로 인해 낮은 시간적 재현성을 보였다. 따라서 MMP3를 대체하기 위해 더 적합한 분석물을 식별해야 합니다.
렉틴 고정 비드의 안정성을 이해하기 위해 이러한 건조된 렉틴 고정 비드를 사용하여 장기 안정성 테스트를 보여줍니다(표 6). 표준 팁, 분석 시약 및 Mix Analytes를 미리 준비하고 12개월 보관 후 측정을 수행했습니다. 앞서 언급한 5가지 유형의 비오틴화 분석물을 개별적으로 저장하고 측정 전에 혼합했습니다. 그 결과, 15개의 렉틴에 대한 평균 CV는 10% 미만이었으며, 심지어 건조 보관 후 최대 12개월까지도 마찬가지였습니다. 이는 동일한 로트에서 한 번에 수많은 팁(최대 1,000개)을 저장하여 빠르고 정밀한 측정의 실현 가능성을 시사합니다.
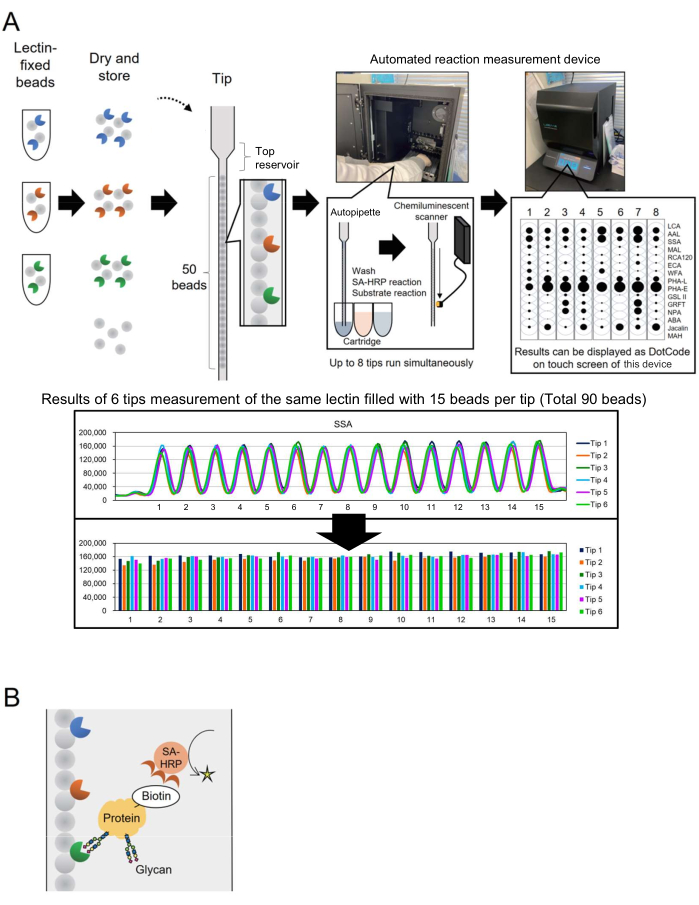
그림 1: "단일 팁의 비드 어레이" 기기 및 분석 방법의 구성표. (A) 자동 글라이칸 프로파일링 시스템의 구성표. 렉틴 고정 비드는 건조하여 팁에 보관할 수 있습니다. HRP 표지 항-스트렙타비딘 항체(SA-HRP)와 같은 시약이 포함된 팁 및 카트리지를 측정기(자동 반응 측정 장치)에 설정하고 활성화하면 팁이 자동 피펫 역할을 합니다. 기기 후면에 있는 화학발광 검출 스캐너는 8개 팁의 신호를 동시에 정량화합니다. 정량적 데이터는 측정 결과를 빠르게 확인할 수 있도록 기기의 터치스크린에 도트 코드로 표시됩니다. 아래 섹션은 동일한 렉틴으로 90개의 비드를 측정한 결과를 보여줍니다. 측정 결과는 기기에서 전송되고 개별 연구원에 의해 그래프로 표시됩니다. (B) 이 실험에 사용된 검출 방법의 구성표. 표적 단백질은 사전 비오틴화되고 SA-HRP를 사용하여 검출됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 자동 반응 측정 장치를 사용한 자동 글라이칸 프로파일링을 위한 재료 이미지 및 설정. (A) 렉틴 고정 구슬이 팁에 포장되는 모습. 정전기 방지 매트에서 정전기 방지 핀셋으로 구슬을 집어 올리고 끝 부분에 구슬을 채웁니다. (B) 니퍼로 팁을 끼웁니다. 상단 비드의 약간 윗부분이 짜여져 있습니다. (C) 팁을 압착하기 위한 니퍼. 플라스틱(노란색 원)은 완전히 잘리는 것을 방지하기 위해 꼬집습니다. (D) 자동 반응 측정 장치에 사용되는 재료의 배치. A: 팁, B: 분석물이 포함된 튜브 및 C: 액체가 포함된 카트리지를 각각 제자리에 삽입해야 합니다. 폐기물 상자에는 측정 후 반응 된 팁이 수집됩니다. 상자는 제거할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
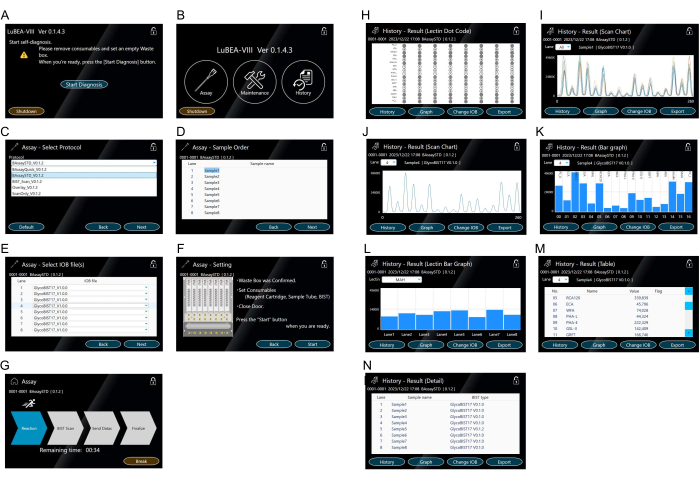
그림 3: 기계 조작을 위한 터치 스크린. (A) 전원을 켜면 자가 진단 프로그램이 자동으로 시작됩니다. (B) HOME 화면에 "Assay", "Maintenance" 및 "History"가 표시됩니다. (C-G) "분석" 모드의 작동. 분석 방법 선택(C). 여러 프로토콜을 미리 등록할 수 있습니다. 시료(분석물) 순서 입력(D). 팁(E)의 유형을 선택합니다. 분석 방법 설정 확인(F) 및 "분석 시작" 화면(G)에서 분석 시작. (HN) "기록"에 결과를 표시합니다. Lectin 도트 코드(H)는 분석 완료 후 또는 "기록" 모드에서 표시됩니다. 모든 샘플(I) 또는 각 샘플(J)에 대해 15개의 렉틴으로 구성된 스캔 차트가 화면에 표시됩니다. 스캔 차트는 막대 그래프(K)로 표시됩니다. 다른 차선에 대한 막대 차트는 드롭다운 "차선" 목록에서 선택할 수 있습니다. 렉틴(L)당 8개의 샘플 레인을 비교하는 막대 그래프. 다른 렉틴은 드롭다운 "렉틴" 목록에서 선택할 수 있습니다. 정량적 값(M)을 보여주는 표. 실행된 측정 방법의 기록(N). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
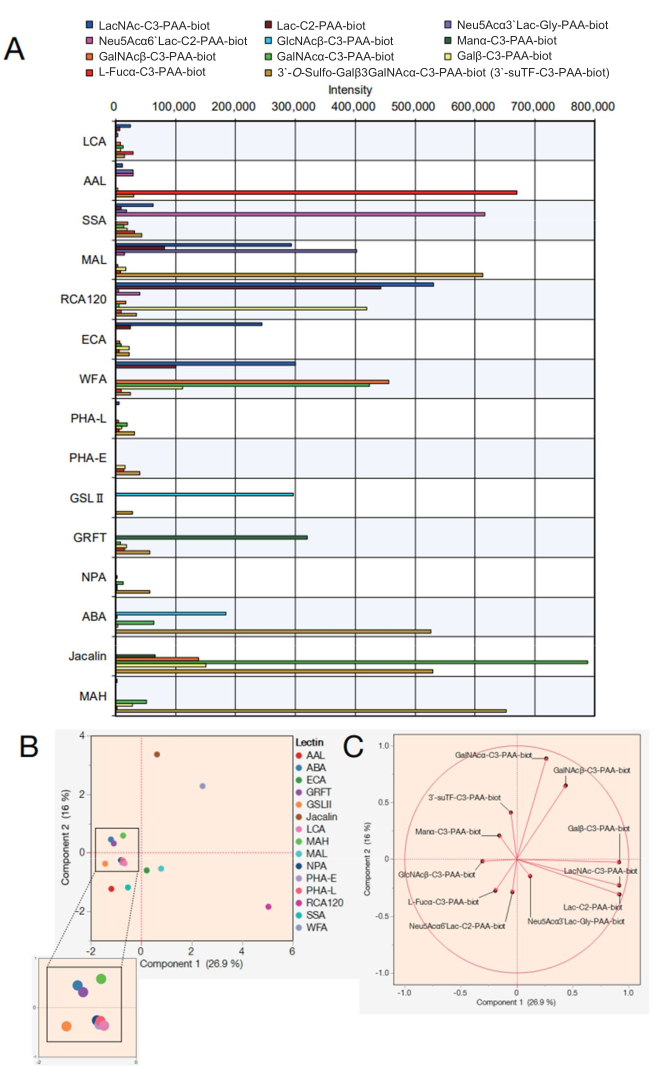
그림 4: 자동 글라이칸 프로파일링 시스템에서 PAA 당류를 사용한 반응성 평가. (A) 다양한 PAA 당류와 렉틴의 반응성을 나타내는 그래프를 음의 대조군 값에 대해 조정했습니다. (B) (A)의 데이터를 기반으로 한 주성분 분석. (C) (B)의 분석에서 얻은 고유 벡터. 부품 (B) 및 (C)에는 호환 가능한 분석 소프트웨어가 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
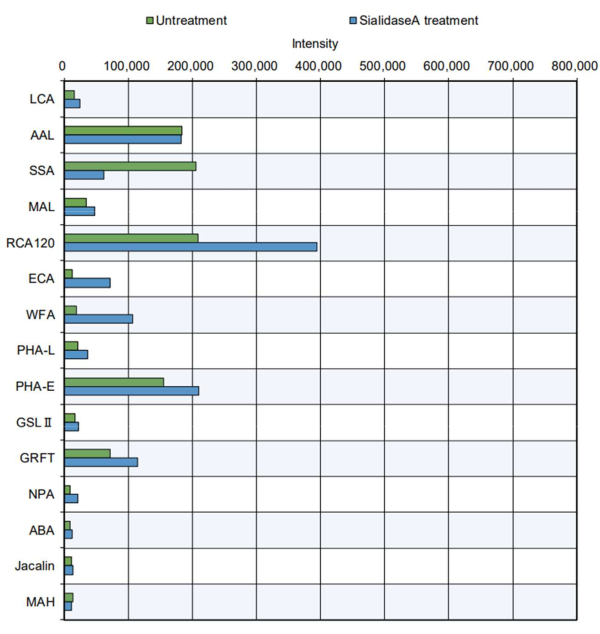
그림 5: 정제된 소 갑상선 글로불린 단백질을 사용한 GlycoBIST 반응성 검증. 처리 없이 시료 전처리는 시알리다아제 A의 첨가를 제외하고 완충액 단독과 동일한 분해 조건에서 수행되었습니다 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 렉틴 고정 비드를 사용한 반복성 테스트. 28개의 렉틴에 대한 반응성의 반복성을 평가했습니다. 분석물은 각 팁으로 반응했습니다. EPO: 에리스로포이에틴, PSA: 전립선 특이 항원, Tf: 트랜스페린, M2BP: Mac-2 결합 단백질, hIgG: 인간 IgG, MMP3: 매트릭스 금속단백질분해효소 3, (Sia+): 시알리다아제 A-소화 분석물, (Sia+, Gal+): 시알리다아제 A 및 갈락토시다아제 소화 분석물, Ab: 항체. DSA: Datura stramonium agglutinin, HypninA2: Hypnea japonica agglutinin, WGA: 밀 배아 응집소, UDA: Urtica dioica agglutinin, BPL: Bauhinia purpurea lectin, Orysata: Oryza sativa lectin, LSL-N: Laetiporus sulphureus lectin N-terminal domain, SNA: Sambucus nigra lectin, BanLec: 바나나 렉틴, MPA: Maclura pomifera agglutinin, TxLC-I: Tulipa gesneriana agglutinin, AOL: Aspergillus oryzae lectin, ACG: Agrocybe cylindracea galectin. CV: 변동 계수. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 자동 글라이칸 프로파일링을 위한 표준 팁을 구성하는 렉틴 목록. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: 자동 글라이칸 프로파일링 시스템의 표준물질로 사용되는 PAA 당류. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: 실행 내 재현성 테스트 결과. CV: 변동 계수. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 5: 일간 재현성 테스트 결과. CV: 변동 계수. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 6: 장기 안정성 테스트 결과. CV: 변동 계수. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
본 연구에서는 "bead array in a single tip" 기술을 이용한 당화(glycosylation)를 위한 신속한 평가 기법을 개발하였다. 본 연구에서는 일상적이고 포괄적인 당화(glycosylation) 평가를 용이하게 하기 위해 해당과학(glycoscience) 연구자와 비당과학(non-glycoscience) 연구자 모두를 위해 설계된 표준 GlycoBIST 팁을 도입했습니다. 일반적으로 20-100 렉틴12,13을 사용하는 렉틴 마이크로 어레이는 평가에 광범위하게 활용되었습니다. 그러나, 마이크로어레이에서 일부 렉틴의 중복 특이성과 조잡한 임상 샘플의 글리코믹스와 비교하여 표적 글리코단백질에 대한 글리코폼의 다양성이 상대적으로 제한적이라는 점을 고려할 때, 15개의 렉틴은 집중 글리칸 프로파일링의 단순화된 평가에 충분할 것으로 예상되었습니다.
프로토콜의 중요한 단계는 렉틴 고정 비드 또는 이러한 비드로 채워진 팁이 측정에 사용하기 전에 보관 후 실온으로 돌아갈 수 있도록 하는 것입니다. 특히, 응축이 신호를 약화시키는 것으로 관찰되었습니다. 따라서 실온으로 돌아올 때까지 보관 백을 절대 열지 않는 것이 좋습니다. 비오틴화 시약을 보관하려면 보관하기 전에 완전히 건조하는 것도 중요합니다. 불충분한 건조 공정은 비오틴화 시약(14)의 가수분해로 인해 단백질에 대한 비오틴화의 효율성을 감소시킨다.
수정 및 문제 해결과 관련하여, 특히 자동 반응 측정 장치의 측정 방법과 관련된 변동성을 줄이기 위한 방법을 모색했습니다. 특히, 분석에 사용되는 reservoir의 buffer 부피가 150 μL인 경우 기포가 팁으로 들어가 반응 효율이 떨어지고 값의 변동이 커집니다. 따라서 최소 200μL의 버퍼를 저장소에 배치하는 것이 좋습니다.
자동 피펫팅 중 팁을 채우는 액체의 양도 중요한 요소입니다. 팁은 다음 반응 단계로 이동할 때 액체를 완전히 배출할 수 없습니다. 따라서 적지 않게 이전 단계의 완충액은 다음 단계로 이월되고 이전 완충액은 새 완충액이 흡인될 때 삽입된 용액의 상단 영역에 남아 있습니다. 따라서 기판 및 기타 용액은 상단 저장소를 채울 수 있도록 충분히 흡인되어야 합니다( 그림 1A 참조). 기기에 대한 항체 반응의 비가역성을 감안할 때 초기 설정 중에 주의를 기울이고 오류를 피하는 것이 중요합니다.
이 방법의 한 가지 한계는 혈청 및 배양 상층액으로부터 유래된 용해성 단백질로 제한된다는 것이다. 현재 방법에서는 렉틴이 비드에 공유 결합되지 않아 세포 및 조직 추출물과 같은 고농도의 계면활성제가 포함된 샘플을 분석할 수 없습니다. 따라서 이러한 제한 사항을 해결하기 위해 향후 개선이 필요합니다.
lectin bead array의 중요성은 beads에 고정된 lectin 종의 호환성과 확장성에 있습니다. 예를 들어, 자동 글라이칸 프로파일링 시스템을 사용하는 대규모 차등 분석(>1,000개 샘플)에서 사용자는 표적 당단백질(< 100개 샘플)의 예비 렉틴 마이크로어레이 기반 글라이칸 프로파일링을 기반으로 팁에 15-렉틴 라인업을 맞춤화할 수 있습니다. 또한, 렉틴 고정 비드의 높은 안정성으로 인해 초기 팁 설계부터 일상적인 절차를 통한 측정에 이르기까지 즉각적인 실험이 가능합니다. 높은 신뢰성을 입증한 28개의 렉틴 중 25개(표 1)뿐만 아니라 사용자가 관심을 가질 수 있는 모든 렉틴을 사용하여 앞서 언급한 일상적인 신뢰성 테스트에 따라 특정 실험을 위한 맞춤형 자동 글라이칸 프로파일링 시스템을 만들 수 있습니다. 이 접근법은 표준 글라이칸 프로파일링 시스템과 함께 확장된 측정을 위한 8가지 유형의 팁으로 구성된 가능한 120-lectin 비드 어레이의 설계로 이어졌습니다.
이전 연구는 렉틴 마이크로어레이15에 따라 Cy3 표지된 당단백질에 대한 검출 절차를 확립하는 데 중점을 두었습니다. 이 방법은 형광 간섭 때문에 팁에서 병렬로 13개의 렉틴으로 제한되었습니다. HRP 검출 라벨을 사용하는 현재 방법은 팁에 15개의 렉틴 고정 비드와 2개의 대조 비드(포지티브 및 네거티브)를 수용합니다. 또한 샘플의 비오틴화(biotinylation)로 분석 과정이 단축되었습니다.
이 분석 방법은 학술 연구뿐만 아니라 의료 및 제약 연구, 식품, 화장품 및 기타 산업 분야에도 적용될 수 있습니다. 렉틴 마이크로어레이 및 글리코프로테오믹스 기술은 잘 확립되어 있지만, 이 연구의 접근 방식은 완전 자동화 및 더 적은 단계로 신속하게 분석할 수 있는 기능으로 인해 여전히 중요합니다. 미래에는 특정 당단백질을 사용하여 신호를 정규화하고 팁에 렉틴 고정 비드와 함께 항체 고정 비드를 사용하여 이 분석을 정량화하는 방법을 개선할 것입니다.
공개
AO, TO, NT, HS, KK, MA, SY, TM, KN, OS 및 KS는 Precision System Science Co., Ltd.의 직원입니다.
감사의 말
이 연구는 일본과학기술진흥기구(JST)가 자금을 지원하는 목표 기반 R&D(A-STEP)를 통한 적응 가능하고 원활한 기술 이전 프로그램의 지원을 받았으며, 보조금 번호 JPMJTR204A로, 일본 과학 진흥회(JSPS) KAKENHI 보조금 번호 23H02680에 의해 부분적으로 AK에 지원되었습니다. 영어 편집에 참여해 주신 에디티지(www.editage.jp)에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 mL 8 PCR tubes + flat cap | FastGene | FG-0028FC/SE | For dispensing and storage of biotin labeling reagents |
| 2.0 mL SC Micro Tube protein LB | SARSTEDT AG&Co. KG | 72.694.600 | For loading samples in LuBEA-VIII |
| Analysis software | SAS Institute Inc. | JMP 17 | |
| Anti-Static Ionizer. 110 volts | Plas-Labs | 800-AS/SPI | Use while inserting beads into BIST Tip. |
| Antistatic tweezers NK2A | RUBIS | 9-5681-01 | Use while inserting beads into BIST Tip. |
| Automated reaction measurement device | Precision System Science Co., Ltd. | LuBEA | All data in this study were obtained using LuBEA-VIII. While LuBEA is commercialized, LuBEA-VIII is currently in the development phase. The website for product details of LuBEA and LuBEA-VIII can be found at the following URL (https://www.pss.co.jp/english/technology/apit/bist02.html). |
| Biotin-(AC5)2 Sulfo-Osu | Dojindo | 341-06801 | As biotinilation reagent |
| BIST spacer bead- V-11 | Precision System Science Co., Ltd. | F4938000 | Diameter: 1 mm |
| BIST tip and sheath | Precision System Science Co., Ltd. | F4930-000 | Fill this empty tip with beads. |
| Calcium chloride | Wako | 039-00475 | For preparing buffer solutions |
| Can Get Signal Solution 2 | TOYOBO | NKB-301 | This blocking reagent is good for this method |
| CentriVap Benchtop Vacuum Concentrators | Labconco | 7810010 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | For measuring the samples by LuVEA VIII |
| Cold trap CentriVap series | Labconco | 7460040 | For dry of biotinilation reagent. The substitution provided by other companies is possible. |
| Glycine | Wako | 077-00735 | For preparing buffer solutions |
| Manganese(II) Chloride Tetrahydrate | Wako | 139-00722 | For preparing buffer solutions |
| Milli-Q reference | MERCK | ZIQ7000T0C | As deionazed water for dilution of reagents and buffers |
| PBS | Wako | 162-19321 | For preparing buffer solutions |
| Peroxidase Streptavidin | Jackson | 016-030-084 | This antibody is good for GlycoBIST analysis. It is useful for the detection of the western blotting, although substitutions can be provided by other companies. |
| Probe bead | Precision System Science Co., Ltd. | FP4936000 | For preparing lectin-fixed beads. See Shimazaki, H. et al., Current Protocols in Protein Science, 2020 in reference section for detail. |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 0030108442 | Use while preparing the samples such as biotinylation. |
| Silica gel (for desiccan) | Kanto chemical | 37039-02 | Use while storing the GlycoBIST tip and dried biotinylation reagent. |
| Static electricity removal sheet M | TRUSCO NAKAYAMA | SD5050 | Use while inserting beads into BIST Tip. |
| SV Cartridge II | Daido Chemical Industry | ED041 | For measuring the samples by LuVEA VIII |
| Table Microcentrifuge-CAPSULEFUGE | TOMY | PMC-060 | For spin-down of the mixture in each process |
| Triton X-100 | Nacalai tesque | 35501-15 | For preparing buffer solutions |
참고문헌
- Butler, M., Reichl, U. Animal cell expression systems. Adv Biochem Eng Biotechnol. 175, 1-36 (2021).
- Silva, M. L. S. Chapter One - Lectin biosensors in cancer glycan biomarker detection. Adv Clin Chem. 93, 1-61 (2019).
- Hiono, T., Nagai-Okatani, C., Kuno, A. 4.07 - Application of glycan-related microarrays. Comprehensive Glycoscience (Second Edition). , 134-148 (2021).
- Shimazaki, H., et al. Lectin bead array in a single tip facilitates fully automatic glycoprotein profiling). Anal Chem. 91 (17), 11162-11169 (2019).
- Shimazaki, H., et al. GlycoBIST: A System for automatic glycan profiling of a target protein using milli-bead array in a tip. Curr Protoc Protein Sci. 99 (1), e103(2020).
- Mahmood, T., Yang, P. C. Western blot: Technique, theory, and trouble shooting. N Am J Med Sci. 4 (9), 429-434 (2012).
- Bojar, D., et al. A useful guide to lectin binding: machine-learning directed annotation of 57 unique lectin specificities. ACS Chem Biol. 17 (11), 2993-3012 (2022).
- Nagai-Okatani, C., et al. 2.0: An integrated visualization for lectin microarray-based mouse tissue glycome mapping data with lectin histochemistry. J Proteome Res. 20 (4), 2069-2075 (2021).
- Geisler, C., Jarvis, D. L. Effective glycoanalysis with Maackia amurensis lectins requires a clear understanding of their binding specificities. Glycobiology. 21 (8), 988-993 (2011).
- Noro, E., et al. N -glycan structures of Wisteria floribunda agglutinin-positive Mac2 binding protein in the serum of patients with liver fibrosis. Glycobiology. 31 (10), 1268-1278 (2021).
- Rawitch, A. B., Pollock, H. G., Yang, S. X. Thyroglobulin glycosylation: Location and nature of the N-Linked oligosaccharide units in bovine thyroglobulin. Arch Biochem Biophys. 300 (1), 271-279 (1993).
- Dang, K., Zhang, W., Jiang, S., Lin, X., Qian, A. Application of lectin microarrays for biomarker discovery. Chemistry Open. 9 (3), 285-300 (2020).
- Chen, S., Qin, R., Mahal, L. K. Sweet systems: Technologies for glycomic analysis and their integration into systems biology. Crit Rev Biochem Mol Biol. 56 (3), 301-320 (2021).
- Dwivedi-Agnihotri, H., Srivastava, A., Shukla, A. K. Reversible biotinylation of purified proteins for measuring protein-protein interactions. Methods Enzymol. 633, 281-294 (2020).
- Shimazaki, H., et al. Auto-lectin dotcoding by two octopuses: Rapid analysis of fluorescence-labeled glycoproteins by an 8-channel fully-automatic bead array scanner with a rolling-circle detector. Anal Chem. 95 (32), 11868-11873 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유