Method Article
عزل وتوسع ونواة الخلايا الجذعية العصبية من منطقة تحت البطين الفئران البالغة
In This Article
Summary
هنا ، نصف نظام nucleofection المصمم لتعزيز كفاءة توصيل الجينات في الخلايا الجذعية العصبية الموسعة (NSCs) المعزولة من منطقة تحت البطين للفئران البالغة. تظهر النتائج أن هذه الطريقة تحسن بشكل كبير اضطراب الجينات في NSCs ، متجاوزة فعالية بروتوكولات النقل التقليدية وتعزز معدل بقاء الخلية.
Abstract
يمكن تحقيق عزل وتوسيع الخلايا الجذعية العصبية (NSCs) من المنطقة تحت البطينية (SVZ) لدماغ الفأر البالغ في وسط مكمل بعامل نمو الخلايا الليفية الأساسي (bFGF) وعامل نمو البشرة (EGF) كميتوجين ، مما ينتج عنه مجاميع نسيلية تعرف باسم المجالات العصبية. هذا النظام في المختبر هو أداة قيمة لدراسة إمكانات NSC. يمكن استخدام نقل siRNAs أو الجينات المحمولة في البلازميدات للحث على اضطرابات التعبير الجيني ودراسة بيولوجيا NSC. ومع ذلك ، فإن توصيل الحمض النووي الخارجي إلى مزارع NSC يمثل تحديا بسبب انخفاض كفاءة نقل خلايا الجهاز العصبي المركزي (CNS). هنا ، نقدم نظاما محسنا للنواة يحقق كفاءة عالية في توصيل الجينات في NSCs الموسعة من الفئران البالغة SVZ. لقد أثبتنا أن هذه الطريقة البسيطة نسبيا تعزز اضطراب الجينات في NSCs البالغة ، متجاوزة بروتوكولات النقل التقليدية مع معدلات بقاء تتجاوز 80٪. علاوة على ذلك ، يمكن أيضا تطبيق هذه الطريقة في NSCs الأولية المعزولة ، مما يوفر تقدما حاسما في دراسات وظائف الجينات من خلال التلاعب بالتعبير الجيني عن طريق الضربة القاضية أو الإفراط في التعبير في مزارع الغلاف العصبي.
Introduction
الخلايا الجذعية العصبية (NSCs) هي خلايا جذعية متعددة القدرات مقيمة في الدماغ. تمتلك هذه الخلايا القدرة على التجديد الذاتي والتمايز إلى السلالات العصبية الثلاثة: الخلايا النجمية ، oligodendrocytes ، والخلايا العصبية1. وبالتالي ، تلعب NSCs دورا حاسما في تكوين الخلايا العصبية للبالغين في الثدييات ، وهي عملية يتم فيها إنشاء خلايا عصبية جديدة في الدماغ2. تتواجد NSCs في الغالب في منطقتين داخل الدماغ البالغ تسمى المنافذ العصبية: المنطقة تحت البطينية (SVZ) على طول جدران البطينين الجانبيين والمنطقة تحت الحبيبية (SGZ) داخل التلفيف المسنن للحصين 3,4. NSCs (المعروفة أيضا باسم الخلايا البائية) في SVZ ، وهي أكثر الأماكن العصبية نشاطا في الفأر البالغ ، تجدد ذاتيا وتنتج أسلاف تضخيم العبور (TAPs أو خلايا C) التي تتمايز لاحقا إلى خلايا عصبية (خلايا A). تهاجر هذه الخلايا العصبية عبر تيار الهجرة المنقاري (RMS) إلى المصابيح الشمية (OB) ، حيث تخضع للتمايز الكامل إلى الخلايا العصبية البينية ، وتندمج في الدوائر الموجودة مسبقا3،4،5،6.
إن فهم التفاعل المعقد للإشارات والإشارات الجزيئية التي تنظم NSCs داخل هذه المنافذ أمر مهم لتسخير إمكاناتها للتطبيقات العلاجية. لهذا الغرض ، تم تطوير طرق مختلفة لدراسة هذه الخلايا ، بدءا من الثقافة الأولية الانتقائية ل NSCs إلى اختيار الخلايا باستخدام علامات السطح7،8،9،10. تفصل هذه المخطوطة عزل وزراعة SVZ NSCs في المختبر باستخدام وسط انتقائي خال من المصل يحتوي على كل من الميتوجينات: عامل نمو الخلايا الليفية الأساسي (bFGF) وعامل نمو البشرة (EGF). يسهل هذا الوسط تكاثر الخلايا ويحافظ على جذع NSCs التي تم الحصول عليها من SVZ لأدمغة الفئران البالغة التي تشكل في المختبر مجاميع نسيلية ثلاثية الأبعاد وغير ملتصقة تعرف باسم الكرات العصبية9. تعمل ثقافات الغلاف العصبي كمنصة خاضعة للرقابة لمعالجة ودراسة الآليات والعوامل الجزيئية التي تؤثر على انتشار NSC والتجديد الذاتي والتمايز والبقاء على قيد الحياة11. والجدير بالذكر أن عدد الكرات العصبية الأولية التي تشكلت في الثقافة يسمح بتقدير عدد NSCs الموجودة في SVZ في الجسم الحي ، مما يجعلها أداة قوية لدراسة آثار الظروف المختلفة على تجمع NSC للبالغين12,13. وعلاوة على ذلك، بمجرد إنشاء الثقافة الأولية، يمكن لمراكز الأمن القومي أن تولد مجاميع جديدة (كرات عصبية ثانوية) عند المرور عبر الانقسامات المتماثلة في ظل ظروف الانتشار14. وبالتالي ، يمكن استخدام البذر منخفض الكثافة لخلايا الغلاف العصبي الثانوية (الفحص النسيلي) لتقييم معدل التجديد الذاتي لهذه الثقافات4،15،16،17.
على الرغم من إمكانات المجالات العصبية في الكشف عن الآليات التي تحكم تنظيم NSC ، يشكك بعض الباحثين في صحة النتائج في المختبر ، بحجة أن الظروف الاصطناعية التي تنمو فيها الخلايا قد لا تكرر بأمانة البيئة المكروية المعقدة في الجسم الحي للمنافذ العصبية18،19،20،21،22. نقطة أخرى مثيرة للجدل تدور حول عدم التجانس الملحوظ في المجالات العصبية. ومع ذلك ، يعتقد أن هذا التباين يعكس التقسيمات المتماثلة وغير المتماثلة ل NSCs التي تحدث بشكل طبيعي في الجسم الحي23,24. علاوة على ذلك ، دعم التحقق الأخير استخدام ثقافات NSC للتنبؤ بالآليات التي تعمل داخل مكانة SVZ العصبية في الجسم الحي ، وقد أظهرت العديد من الدراسات أن NSCs المستزرعة في المختبر تحافظ بدقة على ملف النسخ الذي لوحظ في الجسم الحي11،25.
لذلك ، لا تعمل ثقافات الغلاف العصبي كطريقة لاستكشاف قدرات انتشار وتمايز NSC فحسب ، بل تقدم أيضا نظاما لدراسة تأثير الجينات التي تحكم بيولوجيا NSC. تقنية محورية للتحقيق في وظيفة الجينات في NSCs هي اضطراب التعبير الجيني. يمكن نقل siRNAs أو الجينات التي يتم توصيلها من خلال البلازميدات إلى مزارع الخلايا ، مما يؤدي إلى ضربة قاضية أو تنظيم الجين المستهدف. يقلل هذا النهج متعدد الاستخدامات بشكل كبير من الوقت والتكلفة مقارنة بإنشاء مزارع باستخدام الفئران بالضربة القاضية المشروطة ، مما يوفر وسيلة واعدة لكشف الأسس الجينية لتكوين الخلايا العصبية واستكشاف الآفاق العلاجية. إن تغيير التعبير عن جينات معينة في NSCs يمكن من تعديل سلوكها ، مما يؤثر على العمليات البيولوجية الحاسمة مثل الانتشار والتمايز والهجرة. ومع ذلك ، فإن احتمال نقل NSCs ، لا سيما داخل المجالات العصبية للفئران ، يمثل تحديات ملحوظة. إن البنية ثلاثية الأبعاد للكرات العصبية تضر بكفاءة النقل ، مما يؤدي في كثير من الأحيان إلى انخفاض معدلات توصيل الحمض النووي الخارجي الناجح ، مما يحد من مدى التلاعب الجيني26,27. بالإضافة إلى ذلك ، يمكن أن تؤثر إجراءات النقل بشكل ضار على صلاحية الخلية ووظائفها27. في هذا السياق ، نقدم نظام nucleofection كطريقة للتخفيف من تلف الخلايا ، وتحقيق معدل بقاء مرتفع وضمان فعالية أعلى في فحوصات توصيل الجينات المستخدمة لإزعاج ثقافات NSC.
تهدف هذه المخطوطة إلى توضيح الإجراء الخاص بعزل NSCs وتوسيعها ومعالجتها من مكانة SVZ العصبية البالغة لاضطراب الجينات باستخدام نظام زراعة الغلاف العصبي. تتجاوز هذه الطريقة فعالية بروتوكولات النقل التقليدية ، حيث تقدم معدلات بقاء أعلى بكثير وكفاءة توصيل الجينات المحسنة بين الخلايا المستهدفة.
Protocol
تمت الموافقة مسبقا على جميع التجارب التي أجريت على من قبل اللجنة الأخلاقية بجامعة فالنسيا وأذنت بها Conselleria de Agricultura و Ganadería y Pesca و Generalitat Valenciana (إسبانيا).
1. الثقافة الأولية للمجالات العصبية
- تحضير الكواشف
- قم بإعداد محلول عازل من محلول الفوسفات الملحي (DPBS) من Dulbecco في الماء منزوع الأيونات وتعقيمه عن طريق التعقيم. بدلا من ذلك ، قم بإعداد 0.1 M PBS pH 7.4 بإضافة 137 mM NaCl و 2.7 mM KCl و 10 mM Na2HPO4 و 1.8 mM KH2PO4 محلول في الماء منزوع الأيونات.
- املأ لوحين من 12 بئرا ب DPBS المبردة مسبقا واحتفظ بها على الجليد: سيتم استخدام أحدهما للحفاظ على الدماغ بالكامل قبل التشريح ، والآخر سيحافظ على SVZs المشرحة حتى معالجة الأنسجة.
- تحضير مزيج الأنزيمية التي تحتوي على غراء كما هو موضح أدناه.
- قم بإعداد محلول تفكك EDTA / L-cysteine في محلول ملح إيرلز المتوازن (EBSS) إلى تركيز نهائي قدره 0.2 مجم / مل لكل منهما. لتحقيق الذوبان الكامل ، احتضان الأنبوب في حمام مائي عند 37 درجة مئوية.
- قم بإذابة 12 وحدة / مل من غراء في محلول EDTA / L-cysteine. ضع في اعتبارك أنه سيتم استخدام 500 ميكرولتر من المحلول الأنزيمي لكل دماغ.
- أدخل محلول غراء في حمام مائي 37 درجة مئوية لمدة 20 دقيقة تقريبا حتى يذوب الإنزيم تماما.
- قم بتصفية المزيج الأنزيمي وتعقيمه باستخدام حقنة ومرشح مسام 0.22 ميكرومتر واحتفظ به عند 4 درجات مئوية حتى الاستخدام.
ملاحظة: يتم تنشيط غراء بعد 30 دقيقة عند 37 درجة مئوية ، ويمكن تخزينه لمدة 12 ساعة عند 4 درجات مئوية.
- تحضير وسط ثقافة التحكم عن طريق إضافة محلول مزيج الهرمونات وفقا للجدول 1 وتعقيمه بالترشيح باستخدام مرشحات النيتروسليلوز 0.22 ميكرومتر. احتفظ بالوسط عند 4 درجات مئوية وقم بتسخينه في حمام مائي على حرارة 37 درجة مئوية قبل الاستخدام.
- قم بإعداد الوسط الكامل عن طريق استكمال وسيط التحكم ب EGF و bFGF قبل الاستخدام مباشرة كما هو موضح في الجدول 1. لا تقم بتصفية الوسط الكامل ، حيث يمكن فقد الميتوجين مع التصفية.
- استخراج الدماغ وتشريح SVZ
ملاحظة: يسمح للفئران بحرية الوصول إلى الطعام والماء قبل القتل الرحيم. يتم استخدام الفئران C57BL / 6 التي يتراوح عمرها من 8 إلى 16 أسبوعا. يتم استخدام كلا الجنسين دون اختلافات ملحوظة في التحضير.- تعقيم أدوات التشريح عن طريق التعقيم قبل الجراحة. بعد ذلك ، اغمر المشارط والملاقط والمقص والملاعق في دورق مملوء بنسبة 70٪ من الإيثانول. نظف كل سطح عمل جيدا باستخدام 70٪ إيثانول.
- التضحية بالماوس عن طريق جرعة زائدة من CO2 وتأكيد عن طريق خلع عنق الرحم. رش الرأس بنسبة 70٪ من الإيثانول لتقليل احتمالية تلوث أنسجة المخ.
- افصل رأس الماوس عن بقية الجسم باستخدام المقص. قطع الجلد فوق الجمجمة بمقص صغير على طول المحور الوردي الذيلي حتى يتم الكشف عن الجمجمة بالكامل.
- فضح الدماغ عن طريق قطع الجمجمة في البداية على طول الخيط السهمي بمقص صغير ثم إزالة العظام باستخدام ملاقط دقيقة. احرص على عدم التسبب في أي ضرر لأنسجة المخ تحت الجمجمة خلال هذه الخطوة.
- استخرج الدماغ بعناية من الجمجمة باستخدام ملعقة وضعها في طبق من 12 بئرا يحتوي على DPBS بارد. احتفظ بالطبق على الجليد حتى اكتمال التشريح.
- انقل الدماغ بالكامل إلى وسادة السيليكون حيث سيحدث التشريح وضع بضع قطرات من DPBS البارد على الدماغ (الشكل 1 أ).
- استخدم مشرطا لإزالة OB الموجود في الطرف المنقاري للدماغ والمخيخ الموجود في الجزء الذيلي مع الاحتفاظ بالجزء المركزي من الدماغ الذي يحتوي على البطينين الجانبيين (الشكل 1 ب).
- قسم الدماغ على طول الشق الطولي إلى نصفي الكرة الأرضية ثم تابع تشريح نصفي الكرة الأرضية بشكل منفصل (الشكل 1C).
- العمل مع نصف الكرة الأرضية ، وإعادة توجيهه بحيث تواجه المنطقة الإنسية لأعلى. افتح الدماغ على طول خط الجسم الثفني ، وافصل القشرة والمخطط عن الحصين والحاجز والدماغ البيني ، وبالتالي كشف البطينين الجانبيين (الشكل 1 د).
ملاحظة: يقع SVZ بين تجويف البطين والمخطط ، لذلك تهدف الخطوات اللاحقة إلى عزل SVZ بأكبر قدر ممكن من الدقة عن الأنسجة المحيطة. - قم بإزالة الحصين والحاجز والدماغ البيني باتباع الحد البطني للبطينين (الشكل 1E ، F) ، والأنسجة خارج النهايات المنقارية والذيلية ل SVZ (الشكل 1G) ، والقشرة التي تتبع الجسم الثفني (الشكل 1H ، I).
- قم بإمالة الأنسجة بحيث تواجه SVZ جانبيا (الشكل 1J) ، مما يسمح بإزالة الأنسجة المخططة أسفل SVZ (الشكل 1K) للحصول على قطعة رقيقة من الأنسجة تحتوي على NSCs (الشكل 1L).
- قم بتخزين كل من SVZs المشرحة من نفس الماوس في لوحة من 12 بئرا تحتوي على DPBS بارد ومعقم حتى تبدأ معالجة الأنسجة.
ملاحظة: يجب أن يستغرق تشريح كل من SVZs من دماغ واحد 10 دقائق. قد يؤثر الوقت الأطول على صلاحية الخلية. إذا كانت هناك حاجة إلى زيادة غلة الثقافات ، فيمكن تجميع SVZs من فئران متعددة من نفس العمر والجنس والخلفية الجينية والنمط الجيني.
- عزل وبذر NSCs
- قطع كل SVZ إلى 4-5 قطع صغيرة لتسهيل تصنيف الأنسجة.
ملاحظة: من هذه الخطوة فصاعدا ، يجب تنفيذ الإجراء بأكمله في ظروف معقمة في غطاء التدفق الصفحي. - انقل SVZs المفرومة إلى أنبوب طرد مركزي سعة 15 مل باستخدام ماصة باستور بلاستيكية معقمة. تأكد من عدم وجود شظايا متبقية في اللوحة.
- دع رواسب الأنسجة في قاع الأنبوب وقم بإزالة DPBS المتبقية.
- أضف 500 ميكرولتر من المزيج الأنزيمي المصفى المحتوي على غراء لكل دماغ (2 SVZs) واحتضن الأنابيب في حمام مائي عند 37 درجة مئوية لمدة 30 دقيقة.
- بعد الحضانة ، أضف 5 مل من وسط التحكم المسخن مسبقا عند 37 درجة مئوية لكل عينة.
- أجهزة الطرد المركزي العينات في 300 × غرام لمدة 5 دقائق. ثم ، قم بإزالة المادة الطافية بعناية باستخدام ماصة صغيرة أو مضخة تفريغ.
- أضف 1 مل من وسط التحكم وقم بتقسيم الحبيبات ميكانيكيا بعناية ، مع سحب الحبيبات لأعلى ولأسفل من 10 مرات إلى 20 ضعفا ، باستخدام ماصة زجاجية باستور مصقولة بالنار حتى يتم الحصول على تعليق خلية متجانس.
تنبيه: هذه واحدة من أهم الخطوات في البروتوكول ، حيث أن التصنيف المفرط أو غير الكافي سيؤثر سلبا على إنتاجية الثقافات. - أضف 4 مل من وسط التحكم واخلطه عن طريق الانقلاب لغسل الخلايا. أجهزة الطرد المركزي في 300 × ز لمدة 5 دقائق. ثم قم بإزالة المادة الطافية.
- أضف 1 مل من الوسط الكامل وأعد تعليق الحبيبات عن طريق السحب لأعلى ولأسفل 10x لتجانس تعليق الخلية.
- عد تعليق الخلية باستخدام غرفة نيوباور تحت المجهر بعد تخفيف 1/2 حصة من تعليق الخلية مع تريبان الأزرق أو استخدم عداد خلية أوتوماتيكي. تأكد من أن الثقافات مصنفة على مستوى الخلية الواحدة.
- بمجرد تحضير تعليق الخلية ، قم بزرع الخلايا التي تم الحصول عليها بالتساوي في 8 آبار من صفيحة 48 بئرا في حجم نهائي يبلغ 500 ميكرولتر من الوسط الكامل.
ملاحظة: نحصل عادة على 20000 خلية من اثنين من SVZs ، مما ينتج عنه كثافة بذر نهائية تبلغ حوالي 2500 خلية / مل لتحقيق أقصى عائد في المزارع.
- قطع كل SVZ إلى 4-5 قطع صغيرة لتسهيل تصنيف الأنسجة.
- تشكيل الكرات العصبية
- احتضان الخلايا لمدة 5 إلى 7 أيام في المختبر (DIV) في حاضنة مرطبة عند 37 درجة مئوية و 5٪ CO2. في ظل هذه الظروف ، تموت الخلايا المتمايزة بينما تتكاثر NSCs والأسلاف استجابة للتحفيز الانقسامي ، وتشكل مجاميع نسيلية معترف بها على أنها كرات عصبية أولية.
ملاحظة: يمكن استخدام EGF أو bFGF للحث على تكوين الغلاف العصبي. ومع ذلك ، فإن عاملي النمو هذين غير قابلين للاستبدال بالكامل. - تحقق من حجم الكرات العصبية باستخدام كاميرا مقترنة بالمجهر المقلوب ، وبمجرد أن تصل الكرات العصبية إلى نطاق حجم يتراوح من 50 إلى 100 ميكرومتر ، عد جميع الكرات العصبية الأولية التي تشكلت في البئر عند تكبير 10x. يعمل العدد الإجمالي للمجالات العصبية الأولية التي تم تشكيلها كتقدير لعدد NSCs الموجودة في مكانة SVZ.
- بعد فترة 10 أيام ، اجمع وسط الاستزراع من كل بئر لبدء المرور. إجراء المرور اللاحق بعد 5 إلى 7 DIV ، على الرغم من أنه من الجدير بالذكر أن المجالات الأولية قد تتطلب مدة أطول قليلا للوصول إلى الحجم المثالي للاستزراع الفرعي (حوالي 100 ميكرومتر).
- احتضان الخلايا لمدة 5 إلى 7 أيام في المختبر (DIV) في حاضنة مرطبة عند 37 درجة مئوية و 5٪ CO2. في ظل هذه الظروف ، تموت الخلايا المتمايزة بينما تتكاثر NSCs والأسلاف استجابة للتحفيز الانقسامي ، وتشكل مجاميع نسيلية معترف بها على أنها كرات عصبية أولية.
الجدول 1: حلول وسائل الإعلام الثقافية. يتم وصف وصفة وسيط التحكم. يتم إجراء محلول مزيج هرمون مختلط مسبقا. يمكن تحضير محاليل هرمون المخزون مسبقا كما هو موضح وتخزينها عند -20 درجة مئوية. قبل زراعة الخلايا ، استكمل وسط التحكم ب EGF و bFGF لإعداد وسط كامل. يتم توفير مواصفات التخزين والمخزونات وتركيزات العمل لكل مكون. الرجاء الضغط هنا لتنزيل هذا الجدول.
2. توسيع ثقافات الغلاف العصبي
- مرور المجالات العصبية
- اجمع الوسط الذي يحتوي على الكرات العصبية من الألواح متعددة الآبار وانقلها إلى أنبوب طرد مركزي سعة 15 مل. ضمان استعادة أكبر عدد ممكن من الخلايا عن طريق شطف الآبار ببضعة ملليلتر من DPBS.
- الكرات العصبية للطرد المركزي لمدة 5 دقائق عند 300 × جم. ثم قم بإزالة المادة الطافية.
- أضف 200 ميكرولتر من المحلول الأنزيمي (انظر جدول المواد) إلى الحبيبات واضغط برفق على قاع الأنبوب لإزاحته. احتضان لمدة 10 دقائق في درجة حرارة الغرفة لتسهيل تفكك الكرات العصبية.
- أضف 1 مل من وسط التحكم لإيقاف التفاعل الأنزيمي وفصل الكرات العصبية ميكانيكيا باستخدام ماصة P1000 الدقيقة عن طريق السحب لأعلى ولأسفل من 10x إلى 20x.
- أضف حجما إضافيا قدره 4 مل من وسط التحكم واخلطه عن طريق الانعكاس لغسل الخلايا.
- أجهزة الطرد المركزي الخلايا لمدة 5 دقائق في 300 × غرام. ثم قم بإزالة المادة الطافية.
- أضف 1 مل من الوسط الكامل وأعد تعليق الحبيبات لتجانس التعليق الخلوي عن طريق السحب لأعلى ولأسفل 10x.
ملاحظة: إذا كان العدد الأصلي وحجم الكرات العصبية مرتفعا جدا ، أضف وسيطا أكثر اكتمالا لتخفيف تعليق الخلية لضمان عدد خلايا موثوق. - عد تعليق الخلية باستخدام غرفة Neubauer بعد تخفيف 1/2 حصة من تعليق الخلية باللون الأزرق المثقب أو استخدم عداد خلية أوتوماتيكي.
- لتوسيع زراعة الخلايا ، خلايا البذور بكثافة 10000 خلية / سم2 باستخدام وسط كامل في صفيحة أو قارورة استزراع مناسبة (انظر الجدول 2).
- احتضان الخلايا لمدة 5 إلى 7 DIV في حاضنة رطبة عند 37 درجة مئوية و 5٪ CO2 لكل ممر.
ملاحظة: يمكن توسيع مزارع الغلاف العصبي ونشرها باستمرار من خلال الاستزراع الفرعي المتكرر ، بما لا يتجاوز 10 مقاطع ، دون تغيير قدراتها على الانتشار. يمكن استخدام EGF أو bFGF للزراعة. ومع ذلك ، لا يمكن تحقيق التوسع طويل الأجل للثقافات إلا في وجود EGF.
- مقايسة التجديد الذاتي
- بعد اجتياز مزارع الغلاف العصبي ، قم بلوحة 1000 خلية فردية في صفيحة 96 بئرا ، واستكمال ما يصل إلى حجم نهائي يبلغ 200 ميكرولتر بوسط كامل ، مما ينتج عنه كثافة خلية نهائية لمزارع 5 خلايا / ميكرولتر.
ملاحظة: يجب أن يكون عدد الخلايا المصنفة دقيقا قدر الإمكان. إذا لزم الأمر ، قم بإعداد التخفيفات الوسيطة لضمان حجم تعليق خلية موثوق به قبل الطلاء. علاوة على ذلك ، يوصى بلوحة 4 إلى 5 مكررات لكل حالة لتقليل التباين الفني. - احتضان الخلايا عند 37 درجة مئوية و 5٪ CO2 في حاضنة مرطبة لمدة 5 أيام أو حتى تصل الكرات العصبية إلى الحجم المناسب (60 إلى 100 ميكرومتر). تجنب تحريك أو هز الصفيحة متعددة الآبار لمنع تراكم الغلاف العصبي.
- بعد تكوين الغلاف العصبي ، احسب عدد الكرات العصبية المتكونة في كل بئر باستخدام مجهر مقلوب على تباين الطور مزود بكاميرا مرفقة. يمكن إجراء اختبار التجديد الذاتي باستخدام EGF أو bFGF بشكل منفصل.
- بعد اجتياز مزارع الغلاف العصبي ، قم بلوحة 1000 خلية فردية في صفيحة 96 بئرا ، واستكمال ما يصل إلى حجم نهائي يبلغ 200 ميكرولتر بوسط كامل ، مما ينتج عنه كثافة خلية نهائية لمزارع 5 خلايا / ميكرولتر.
- الحفظ بالتبريد لثقافات NSC
ملاحظة: يمكن حفظ مزارع الغلاف العصبي بالتبريد للاستخدام في المستقبل ، مما يقلل من عدد الفئران المطلوبة. نوصي بالحفاظ على الخلايا حتى الممر 10.- لحفظ الخلايا بالتبريد ، انقل 1 مل من معلق الخلية في وسط كامل إلى أنبوب تبريد مسمى بشكل صحيح.
- أضف ثنائي ميثيل سلفوكسيد (DMSO) إلى تركيز نهائي بنسبة 10٪ إلى تعليق الخلية واخلطه برفق عن طريق قلب الأنابيب.
ملاحظة: يعمل DMSO كواقي للتبريد ولكن يمكن أن يكون ساما للخلايا ، لذلك يجب تنفيذ هذه الخطوة بسرعة. - ضع الأنابيب في الفريزر -80 درجة مئوية باستخدام حاوية تجميد تتيح انخفاضا تدريجيا في درجة الحرارة عند 1 درجة مئوية / دقيقة. تمنع عملية التجميد التدريجي هذه تلف الخلايا الناجم عن تكوين بلورات الثلج أثناء الحفظ بالتبريد. للتخزين طويل الأجل ، حافظ على الأنابيب في خزان النيتروجين السائل عند -196 درجة مئوية.
- ذوبان ثقافات مجلس الأمن القومي
ملاحظة: عند الحاجة ، يمكن إذابة الخلايا وإعادة توسيع الثقافات لإجراء التجارب.- قم بإزالة أنابيب التبريد التي تحتوي على NSCs المجمدة من خزان تخزين النيتروجين السائل وضعها على الفور في حمام مائي 37 درجة مئوية حتى تذوب تماما ، حوالي 5 دقائق.
تنبيه: من الضروري تقليل وقت الاستحمام لأن DMSO سام ويمكن أن يؤثر على صلاحية الخلية. - انقل الخلايا المذابة بسرعة إلى أنبوب طرد مركزي سعة 15 مل يحتوي على 5 مل من وسط التحكم الذي تم تسخينه مسبقا.
- خلايا الطرد المركزي في 300 × غرام لمدة 5 دقائق وإزالة الطاف. أضف 1 مل من الوسط الكامل وأعد تعليق الحبيبات عن طريق سحب الحبيبات برفق لأعلى ولأسفل 10x لتجانس التعليق الخلوي قبل البذر.
ملاحظة: ذوبان الجليد يمكن أن يؤثر على صلاحية الخلية. لذلك ، يوصى بتمرير الخلايا مرة واحدة على الأقل قبل البذر لإجراء تجارب جديدة.
- قم بإزالة أنابيب التبريد التي تحتوي على NSCs المجمدة من خزان تخزين النيتروجين السائل وضعها على الفور في حمام مائي 37 درجة مئوية حتى تذوب تماما ، حوالي 5 دقائق.
- اختبار الميكوبلازما
ملاحظة: يمكن أن يؤثر تلوث الميكوبلازما على صحة الخلايا ، مما يؤثر على معدلات النمو. لذلك ، يعد اختبار الميكوبلازما أمرا بالغ الأهمية لضمان سلامة وموثوقية التجارب.- استخراج الحمض النووي
- جمع ما لا يقل عن 100 ميكرولتر من ثقافة الخلية لاستخراج الحمض النووي. يمكن استخدام كل من الخلايا الطافية وحبيبات الخلايا لاستخراج الحمض النووي. قم بتخزين هذه القسمة في درجة حرارة -20 درجة مئوية حتى الاستخراج.
- اثقب غطاء الأنبوب واغلي القسمة على حرارة 99 درجة مئوية لمدة 15 دقيقة باستخدام كتلة حرارية.
ملاحظة: ثقب أغطية الأنابيب يتجنب فتح الأنابيب أثناء الغليان في درجات حرارة عالية. - جهاز طرد مركزي لمدة 5 دقائق عند 16900 × جم. نقل المادة الطافية التي تحتوي على الحمض النووي إلى أنبوب جديد. قم بتخزين الأنبوب مع الحمض النووي عند -20 درجة مئوية حتى اختبار تفاعل البوليميراز المتسلسل.
- PCR للكشف عن الميكوبلازما
- تحضير مزيج تفاعل البوليميراز المتسلسل باستخدام المكونات التالية: 8.9 ميكرولتر من الماء الخالي من النيوكلياز ، 3 ميكرولتر من محلول تفاعل 5x ، 1.2 ميكرولتر من 25 مللي مول MgCl2 ، 0.25 ميكرولتر من 2.5 mM dNTPs ، 0.15 ميكرولتر من Taq polymerase و 0.25 ميكرولتر من كل برايمر خاص بالميكوبلازما بتركيز 10 ميكرومتر (أمامي ، Fw: 5'GATGTTTAGCCGGGTCGAGAG3' وعكسي ، Rv: 5'GATGTCAAGAGTGGGTAAGGTT3').
- أضف 1 ميكرولتر من الحمض النووي المستخرج جينوميا. قم بإعداد مزيج PCR في غطاء التدفق الصفحي لمنع تلوث الحمض النووي.
- احتضان التفاعل في دورة حرارية على النحو التالي: تمسخ أولي عند 95 درجة مئوية لمدة 5 دقائق متبوعا ب 35 دورة من التمسخ عند 95 درجة مئوية لمدة 30 ثانية ، والتلدين عند 53 درجة مئوية لمدة 1 دقيقة ، والتمديد عند 72 درجة مئوية لمدة 30 ثانية ، والتمديد النهائي عند 72 درجة مئوية لمدة 5 دقائق.
- لتحديد حجم النطاق الناتج (حوالي 500 نقطة أساس) ، قم بتحميل 15 ميكرولتر من منتج DNA PCR الممزوج ب 3 ميكرولتر من محلول صبغة التحميل 6x على هلام أغاروز 2٪ وقم بتشغيل الكهربائي لمدة 40 إلى 50 دقيقة عند 100 فولت.
- استخراج الحمض النووي
الجدول 2: الصفائح والقوارير المستخدمة للزراعة. يتم توفير أبعاد وأحجام ألواح البذر والقوارير الأكثر استخداما. يتضمن الجدول القطر ومنطقة النمو والحجم المتوسط المستخدم لكل وعاء ، إلى جانب مثال على عدد NSCs التي سيتم بذرها في ظل ظروف التمدد (10000 خلية / سم2). الرجاء الضغط هنا لتنزيل هذا الجدول.
3. نواة ثقافات الغلاف العصبي
- تحضير الكواشف
- إعداد الحمض النووي
- تحضير 25 ميكرولتر من خلايا الإشريكية القولونية DH5α المختصة في أنبوب 1.5 مل للتحول.
- أضف 1 ميكرولتر من البلازميد محل الاهتمام (عند 100 إلى 200 نانوغرام / ميكرولتر) إلى الخلايا وعرضها لصدمة حرارية عند 42 درجة مئوية لمدة 45 ثانية. هنا ، يتم استخدام بلازميد يحتوي على دبوس شعر قصير (sh) RNA لإسكات تعبير Snrpn و shSCRAMBLE بلازميد التحكم.
ملاحظة: احتفظ بالخلايا المختصة على الجليد طوال الإجراء للحفاظ على فعالية التحول. - قم بطلاء الخلايا المحولة على ألواح أجار LB بالمضاد الحيوي المناسب واحتضانها عند 37 درجة مئوية لمدة 18 ساعة. حافظ على أطباق بتري مقلوبة لمنع تكوين القطرات بسبب التكثيف ، مما قد يزعج المستعمرات البكتيرية.
ملاحظة: أضف المضادات الحيوية المناسبة إلى وسط زراعة LB للسماح حصريا بنمو البكتيريا المحولة. - باستخدام طرف ماصة معقم ، اختر مستعمرات بكتيرية فردية وانقلها إلى دورق Erlenmeyer مملوء مسبقا ب 250 مل من LB لبدء ثقافة سائلة. تجنب اختيار مستعمرات الأقمار الصناعية الصغيرة الموضوعة حول المستعمرات المستهدفة الأكبر ، لأنها قد لا تحتوي على البلازميد المطلوب.
- احتضان القارورة أثناء الاهتزاز بقوة على شاكر مداري عند 37 درجة مئوية طوال الليل.
- استخدم مجموعة maxiprep الخالية من السموم الداخلية واستخرج الحمض النووي البلازميد النقي من الثقافات البكتيرية باتباع تعليمات الشركة المصنعة. إعادة تكوين الحمض النووي في الحجم المناسب من الماء الخالي من السموم الداخلية للحصول على تركيز بلازميد من 1 إلى 2 ميكروغرام / ميكرولتر.
ملاحظة: يعتمد عائد maxiprep على نمو الثقافة. عادة ، سيؤدي تعليق حبيبات الحمض النووي البلازميد بحجم 200 ميكرولتر إلى تركيز الحمض النووي المطلوب. - قم بتخزين الأنبوب مع الحمض النووي البلازميد عند -20 درجة مئوية حتى الاستخدام. تحضير أنبوب سعة 1.5 مل بحجم نهائي قدره 5 ميكرولتر يحتوي على 2 إلى 6 ميكروغرام من الحمض النووي البلازميدي المخصص للنواة.
- إعداد المواد
- تحضير محلول النواة. في حالة استخدام المجموعة الموصى بها (انظر جدول المواد) ، قم بإعداد 95 ميكرولتر من محلول النواة في أنبوب 1.5 مل لكل نواة مرغوبة. عادة ما يتم تضمين الماصات و cuvettes في المجموعة. قم بإعداد واحد من كل حالة لكل حالة من حالات النواة.
- قم بإعداد قارورة T25 مملوءة ب 4 مل من الوسط الكامل المسخن مسبقا لكل حالة واحتفظ بها في الحاضنة حتى الاستخدام.
- إعداد الحمض النووي
- نواة NSCs
- استخدم 1 إلى 2 × 106 خلايا فردية لكل حالة للتقييم. أجهزة الطرد المركزي الخلايا لمدة 5 دقائق عند 300 × جم ، ثم قم بإزالة المادة الطافية.
- أضف 1 مل من DPBS وأعد تعليق الحبيبات عن طريق السحب لأعلى ولأسفل 10x لضمان تعليق خلوي متجانس.
- كرر الطرد المركزي (الخطوة 2.1.6) للغسل الثاني وأخيرا أعد تعليق الحبيبات في 95 ميكرولتر من محلول النواة.
ملاحظة: خطوات الغسيل ضرورية لإزالة المضادات الحيوية من وسط التحكم وضمان فعالية النواة. - اجمع بين 95 ميكرولتر من الخلايا مع محلول مسبق الخلط يحتوي على 5 ميكرولتر من كل بلازميد (إجمالي 2 ميكروغرام) تم اختياره للنواة.
- باستخدام ماصة صغيرة P200 ، انقل هذا المحلول إلى كوفيت وضعه في جهاز nucleofector.
- Nucleofect الخلايا مع البلازميدات المطلوبة باستخدام برنامج NSC الأمثل لنظام nucleofector.
- بعد الانتهاء من التثقيب الكهربائي ، أدخل بعناية وسيطا كاملا دافئا إلى كوفيت باستخدام ماصات باستور المتوفرة في المجموعة. بعد ذلك ، انقل محتويات الكوفيت إلى قارورة T25 معدة مسبقا تحتوي على وسط كامل تم تسخينه مسبقا. بعد التثقيب الكهربائي ، قد يكون هناك موت للخلايا ، وترسيب الحمض النووي ، وتشكيل الركام اللزج. تجنب نقل هذا إلى دورق T25 ، لأنه قد يقلل من بقاء الخلية.
ملاحظة: هذه الخطوة حاسمة ويجب تنفيذها في أسرع وقت ممكن لضمان غلة عالية من النواة وبقاء الثقافة اللاحقة. - احتضان الخلايا ذات النواة عند 37 درجة مئوية و 5٪ CO2 في حاضنة مرطبة لمدة 3 إلى 5 أيام.
- اختيار الخلايا ذات النواة
- الاستراتيجية أ: اختيار قياس التدفق الخلوي عن طريق فرز الخلايا المنشطة بالفلورة (FACS)
- بعد 3 إلى 5 أيام من النواة ، قم بتمرير الثقافات النووية باتباع الخطوة 2.1 وجمع جميع الخلايا الفردية التي تم الحصول عليها.
- قم بتصفية العينات من خلال مصفاة خلية 40 ميكرومتر لإزالة مجاميع الخلايا وتحليلها باستخدام مقياس تدفق الخلايا الفارز.
ملاحظة: من الضروري فرز نفس عدد الخلايا في كل حالة للحصول على نتائج مقارنة. - باستخدام برنامج مقياس الخلايا ، تقوم بوابة الخلايا الحية بناء على مقياسين: الضوء المبعثر الأمامي (FSC-A) الذي يتوافق مع حجم الخلية والضوء المبعثر الجانبي (SSC-A) الذي يتوافق مع التعقيد داخل الخلايا. حدد مجموعة الخلايا الحية التي تتميز بارتفاع FSC-A وارتفاع SSC-A.
ملاحظة: اختياريا ، أضف 0.1 ميكروغرام / مل من 4 ′ ، 6-دياميدينو -2-فينيليندول (DAPI) إلى تعليق الخلية قبل الفرز. سيسمح ذلك بالتخلص من الخلايا الميتة والأجسام المبرمج من البوابة. - تجاهل مضاعفة الخلايا وثلاثة توائم عن طريق رسم معلمات FSC-A مقابل FSC-H. اختر الأحداث المدرجة في قطري المؤامرة ، والتي تمثل الفردي.
ملاحظة: عندما تمر الخلايا عبر الليزر ، يكتشف مقياس الخلايا تغيرات الجهد بمرور الوقت. يمثل FSC-A منطقة الإشارة ، ويشير FSC-H إلى ارتفاع الذروة. تظهر المفرد علاقة تناسبية بين FSC-A و FSC-H (الموجودة على قطر المخطط) ، بينما تعرض مجاميع الخلايا FSC-A أكبر بالنسبة إلى FSC-H بسبب إشارة أطول. - حدد الخلايا ذات النواة بناء على شدة مضان الجين المراسل المشفر بواسطة البلازميد المستخدم. على سبيل المثال ، عند استخدام خلايا GFP + يمكن تحديدها بناء على مستويات مضان FITC-A مقابل مخطط SSC-A.
- اعزل العدد المطلوب من الخلايا المستهدفة لكل حالة واجمعها مباشرة في أنبوب تجميع مملوء بوسط كامل.
- البذور النووية NSCs بكثافة 10000 خلية / سم2. احتضان مزارع الخلايا المصنفة عند 37 درجة مئوية و 5٪ CO2 في حاضنة مرطبة.
- الاستراتيجية ب: الانتقاء باستخدام مقاومة المضادات الحيوية المشفرة في البلازميد
- بعد 48 ساعة من النواة ، أضف تركيز المضادات الحيوية المناسب لاختيار الخلايا المقاومة.
ملاحظة: قبل البدء ، يوصى باختبار تركيزات متعددة من المضادات الحيوية على الخلايا غير النواة. التركيز الأمثل للمضادات الحيوية هو أقل كمية يتم فيها التخلص من جميع الخلايا غير المقاومة. على سبيل المثال ، حددنا التركيز الأمثل ل 4 ميكروغرام / مل من المضادات الحيوية blasticidin لمزارع NSC. - احتضان الخلايا عند 37 درجة مئوية و 5٪ CO2 في حاضنة مرطبة لمدة 48 ساعة.
- بعد 48 ساعة من العلاج بالمضادات الحيوية ، قم بزراعة الخلايا النواة وفقا للخطوة 2.1. إذا ظلت الكرات العصبية صغيرة ، فقم بإزالة المضاد الحيوي من وسط المزرعة عن طريق الطرد المركزي عند 300 × جم لمدة 5 دقائق. أعد تعليق الخلايا واستزراعها في قارورة باستخدام وسط كامل فقط. احتضان الخلايا عند 37 درجة مئوية و 5٪ CO2 في حاضنة مرطبة حتى يمكن توسيعها بعد الخطوة 2.1.
- بعد 48 ساعة من النواة ، أضف تركيز المضادات الحيوية المناسب لاختيار الخلايا المقاومة.
- الاستراتيجية أ: اختيار قياس التدفق الخلوي عن طريق فرز الخلايا المنشطة بالفلورة (FACS)
النتائج
تتيح ظروف الاستزراع المثلى عزل وتوسيع NSCs المشتقة من SVZ للبالغين في المختبر
كانت ثقافات NSCs المشتقة من SVZ البالغة بمثابة طريقة قيمة في المختبر للتحقيق في الآليات الجزيئية والإشارات المتخصصة التي تنظم NSCs داخل بيئاتها الدقيقة المحددة. تم استخدام فحص الغلاف العصبي الموضح في هذه المخطوطة لفحص عدد NSC داخل SVZ للبالغين. تم عزل أنسجة SVZ من أدمغة الفئران البالغة من العمر 3 أشهر ، وفصلها ، وزراعتها في وسط NSC كامل مع كل من EGF و bFGF أو كل على حدة. بعد 10 أيام في المختبر (DIV) ، تم تحديد العدد الإجمالي للمجالات الأولية التي تشكلت في ظل ظروف الاستزراع الثلاثة المتميزة هذه باستخدام مجهر تباين الطور (الشكل 2A ، B). ومن اللافت للنظر أن النتائج التي توصلنا إليها توضح أن وجود EGF أدى إلى الحد الأقصى لتشكيل المجال الأولي ، وهو ما يتضح من انخفاض عدد المجالات الأولية التي لوحظت في الثقافات مع bFGF فقط (الشكل 2A ، B). لتقييم قدرة التجديد الذاتي ل NSCs في ظل ظروف متوسطة متنوعة ، تم استزراع الخلايا وطلائها بكثافة منخفضة (5 خلايا / ميكرولتر) في وسط مكمل بمجموعات الميتوجين المذكورة أعلاه. كشف القياس الكمي للمجالات الثانوية أن SVZ NSCs تحتاج على الأقل إلى EGF للتجديد الذاتي بكفاءة وأن الجمع بين كل من EGF و bFGF يحسن قدرة الخلايا على التجديد الذاتي (الشكل 2B). علاوة على ذلك ، للحصول على تحليل مفصل لديناميكيات النمو عبر ظروف الوسائط المتنوعة ، تم تسجيل عدد الخلايا التي تم زرعها والحصول عليها من خلال 7 مقاطع. أكدت منحنيات النمو التي تم الحصول عليها من ظروف الوسائط المختلفة أن الثقافات المكملة ب EGF وحدها أو بالاشتراك مع bFGF أظهرت ديناميكيات نمو محسنة مقارنة بالثقافات المكملة فقط ب bFGF (الشكل 2C). بشكل جماعي ، تثبت هذه النتائج أن الاستخدام المتزامن لكل من EGF و bFGF يعزز محصول زراعة NSC في المختبر.
من أجل التحقيق في عدد NSC داخل SVZ عبر أعمار مختلفة بعد الولادة وتقييم تأثير شيخوخة الفئران على كفاءة ثقافة الغلاف العصبي ، تم تشريح أنسجة SVZ من الفئران التي تتراوح أعمارها بين شهر واحد حتى 12 شهرا. والجدير بالذكر أن النتائج التي توصلنا إليها كشفت عن انخفاض كبير في عدد المجالات الأولية مع زيادة العمر ، مما يدل على أقصى قدر من الكفاءة في عدد المجالات في حوالي 2 إلى 4 أشهر من العمر (الشكل 2 د). بالإضافة إلى ذلك ، لتقييم قدرة التجديد الذاتي ل NSCs أثناء الاستزراع الفرعي ، تم استزراع NSCs من الفئران التي تتراوح أعمارها بين 2 إلى 4 أشهر وبذرها بكثافة نسيلية (5 خلايا / ميكرولتر) في وسط كامل. أشار التحديد الكمي لعدد المجالات الثانوية عبر الممرات اللاحقة إلى انخفاض كبير في كفاءة الثقافة على الممرات (الشكل 2ه). بناء على كل هذه الملاحظات ، يوصى بإجراء فحوصات التجديد الذاتي خلال الممرات المبكرة لزيادة تحسين ظروف ثقافة NSC.
Nucleofection هي تقنية عالية الكفاءة لمعالجة التعبير الجيني في NSCs البالغين
بالنظر إلى أن NSCs ليست قابلة للنقل بسهولة ، للتلاعب بالتعبير الجيني ، نقدم هنا بروتوكولا للنواة مع معدل أعلى من توصيل الجينات الناجح دون الحاجة إلى استخدام النقل الفيروسي. بعد تشريح وزراعة SVZs الفردية من الفئران البالغة من العمر 2 إلى 4 أشهر ، تم استخدام NSCs ببلازميد يحمل GFP كما هو موضح (الشكل 3 أ). كشف الكشف عن الخلايا الإيجابية ل GFP بعد يومين من النواة عن كفاءة تتراوح من 30٪ إلى 50٪ ، بما يتفق مع الأدبيات السابقة28. لعزل NSCs بنجاح على وجه التحديد ، تم فرز الخلايا بواسطة FACS بناء على شدة مضان GFP بعد 3 إلى 5 أيام من النواة (الشكل 3A-C). أظهر ما يقرب من 40٪ من الخلايا التي تم تحليلها قبل FACS مستويات عالية من مضان GFP وتم اختيارها لاحقا عن طريق الفرز (الشكل 3C). أظهرت إعادة بذر GFP + NSCs المصنفة أن جميع الخلايا كانت إيجابية GFP ، مما يؤكد صحة طريقة عزل الخلايا القائمة على النواة (الشكل 3D). والجدير بالذكر أن NSCs ذات النواة حافظت على صلاحيتها من خلال الممرات اللاحقة ، مما يؤكد جدوى النواة ل NSCs البالغة. تؤكد هذه النتائج على فعالية الجمع بين النواة و FACS لإنشاء ثقافة نقية من NSCs المعدلة.
كمثال على تعديل الجينات في NSCs البالغة ، تم استخدام توهين الجينات عن طريق نواة الحمض النووي الريبي القصير (sh). على وجه التحديد ، تم استخدام الحمض النووي الريبي shRNA الذي يستهدف جين بولي ببتيد البروتين النووي الريبي النووي الصغير N (Snrpn) ، والذي يحمل مراسل CAG-GFP (SHSNRPN) في ثقافات NSC المشتقة من الفئران البالغة من العمر 2 شهر. تم تأكيد انخفاض تنظيم Snrpn بواسطة qPCR والكيمياء المناعية في الخلايا التي تم نواتها باستخدام بلازميد shSNRPN ولكن ليس للتحكم في بلازميد shSCRAMBLE (الشكل 3E ، F) 29. لتوضيح آثار خفض تنظيم Snrpn على قدرة التجديد الذاتي ل NSC ، تم إجراء اختبار منخفض الكثافة في الخلايا النووية (الشكل 3F ، G). كشف القياس الكمي للكرات العصبية الثانوية في الثقافات النووية عن زيادة قدرة تكوين الغلاف العصبي عند خفض تنظيم Snrpn (الشكل 3G). يؤكد هذا الفحص على قدرة النواة على معالجة التعبير الجيني في NSCs البالغة ، وبشكل أكثر تحديدا ، يحدد دور Snrpn في الحفاظ على الجذعية في NSCs البالغة.
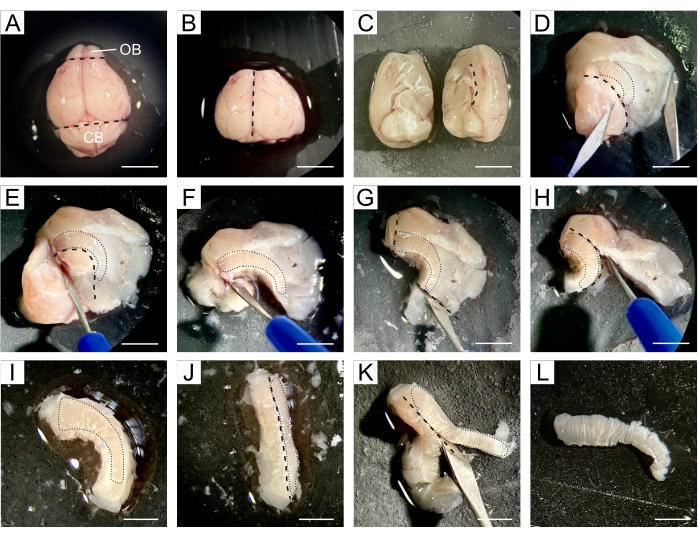
الشكل 1: وصف مفصل لتشريح SVZ. (أ) بعد إزالة دماغ الفأر ، يتم نقل الدماغ بأكمله باستخدام DPBS إلى وسادة سيليكون للتشريح. (ب) إزالة المخيخ والمخيخ من الدماغ باستخدام مشرط. ج: ينقسم الدماغ إلى نصفي الكرة الأرضية لمتابعة عملية التشريح كل على حدة. د: يفتح الدماغ على طول خط الجسم الثفني، ويفصل القشرة والمخطط عن الحصين والحاجز والدماغ البيني، وبذلك يعرض البطينين الجانبيين. (إ-و) تتم إزالة الحصين والحاجز والدماغ البيني بعد الحد البطني للبطينين. (ز-ط) تتم إزالة الأنسجة خارج الأطراف المنضدية والذيلية ل SVZ والقشرة بعد الجسم الثفني. (ي-ك) يتم إمالة الأنسجة بحيث يواجه SVZ جانبيا ، مما يسمح بإزالة الأنسجة المخططة أسفل SVZ. (L) يتم الحصول على قطعة رقيقة من الأنسجة تحتوي على SVZ. تشير الخطوط المتقطعة السوداء إلى موقع القطع. تشير الخطوط المنقطة السوداء إلى موقع SVZ في كل خطوة. الاختصارات: OB = لمبة شمية. CB = المخيخ. شريط المقياس في A-H: 5 مم ؛ في I-L: 3 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
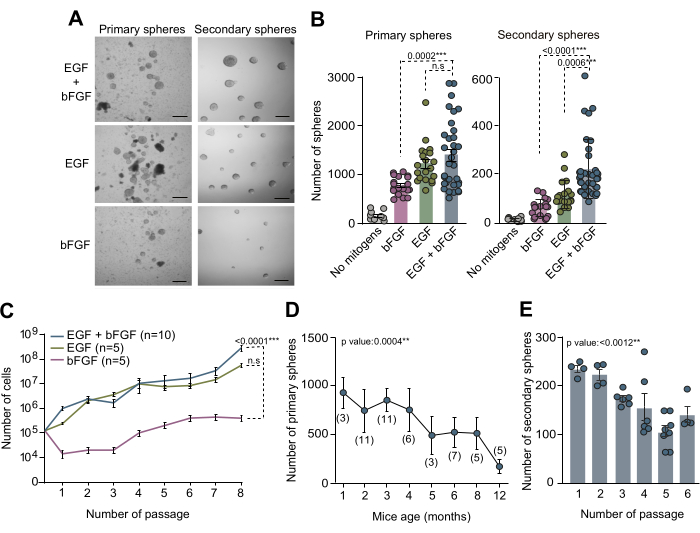
الشكل 2: كل من الميتوجين EGF و bFGF ضروريان للثقافة المثلى وتوسيع NSCs في المختبر. (أ) صور مجهرية متباينة الطور لثقافات الغلاف العصبي الأولية والثانوية في وسط NSC مكملة بكل من EGF و bFGF أو كل ميتوجين على حدة. (ب) عدد المجالات الأولية التي تم الحصول عليها لكل فأر ولكل بئر بناء على تكوين الميتوجين لوسط الاستزراع: لا توجد ميتوجينات (رمادي ، ن = 9) ، EGF + bFGF (أزرق ، ن = 33) ، فقط EGF (أخضر ، ن = 20) ، أو فقط bFGF (وردي ، ن = 19 ؛ اللوحة اليسرى). عدد الكرات العصبية الثانوية التي تشكلت بكثافة منخفضة (5 خلايا / ميكرولتر) لكل بئر بناء على تكوين الميتوجين لوسط الاستزراع): لا توجد ميتوجينات (رمادي ، ن = 11) ، bFGF (وردي ، ن = 18) ، EGF (أخضر ، ن = 18) أو EGF + bFGF (أزرق ، ن = 37 ؛ اللوحة اليمنى). تم استخدام اختبار Kruskal-Wallis مع تحليل Dunn اللاحق. (ج) منحنيات النمو التي توضح العدد الإجمالي للخلايا التي تشكلت بعد 8 ممرات في ثقافات الغلاف العصبي المتميزة وفقا للميتوجينات الموجودة في وسط الاستزراع: bFGF (وردي ، ن = 5) ، EGF (أخضر ، ن = 5) أو EGF + bFGF (أزرق ، ن = 10). تم استخدام تحليل الانحدار الخطي. د: عدد الكرات العصبية الأولية المشتقة من فئران فردية تم تشريحها وتفكيكها من في مراحل نمو مختلفة بعد الولادة. تم استخدام تحليل الانحدار الخطي. (ن) بين قوسين. ه: عدد الكرات العصبية الثانوية التي تشكلت بكثافة منخفضة (5 خلايا/ميكرولتر) من خلال الممرات اللاحقة في المختبر لتقييم قدرتها على التجديد الذاتي. تم استخدام اختبار Kruskal-Wallis ، وتم تضمين قيم p: *: p<0.05 ؛ **: ص<0.01; ص<0.001; ص<0.0001.: ملحوظة: غير مهمة. تمثل أشرطة الخطأ SEM. شريط المقياس في A هو 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
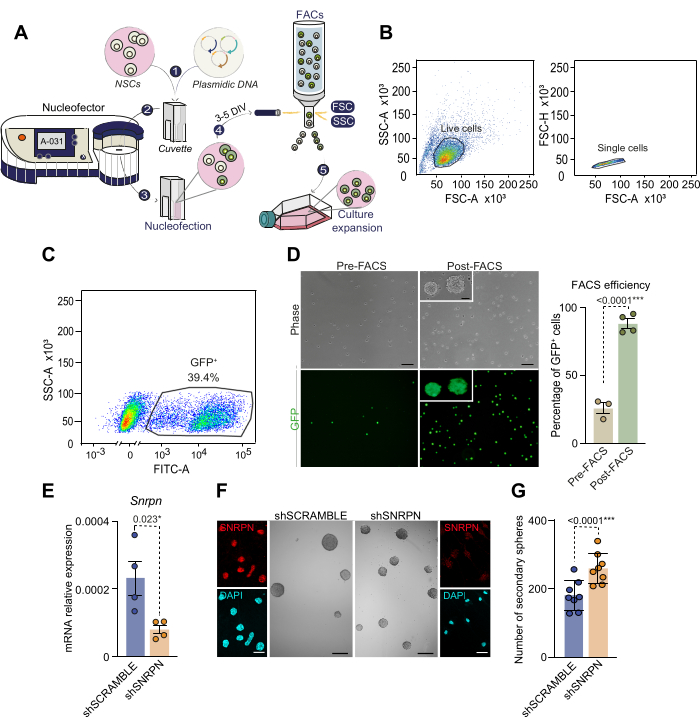
الشكل 3: رسم تخطيطي لعملية النوة النووية واختيار الخلايا القائمة على FACS للخلايا ذات النواة. (أ) نظرة عامة على عملية النوة النووية واختيار الخلايا القائمة على FACS للخلايا ذات النواة. 1) يتم دمج محلول الحمض النووي البلازميد مع محلول النواة ويضاف إلى الخلايا. ثم ينقل هذا الخليط إلى كفيت لتكوين النواة. 2) يتم إدخال الكوفيت الذي يحتوي على الحمض النووي والخلايا في nucleofector ، حيث يتم تطبيق صدمة كهربائية. بالنسبة لثقافات الغلاف العصبي المعزولة عن SVZ للبالغين ، نوصي باستخدام برنامج A-031 NSC. 3) بعد النواة ، يتم نقل الخلايا إلى قارورة تحتوي على وسط كامل مكمل ب EGF و bFGF. 4) يتم فرز الخلايا بواسطة FACS بناء على تعبير المراسل الموجود في الحمض النووي البلازميدي. 5) تخضع الخلايا المصنفة لمزيد من الثقافة للتجارب اللاحقة. (ب) استراتيجية الاختيار القائمة على FACS وبوابات ل NSCs ذات النواة. أولا ، يتم اختيار الخلايا الحية بناء على FSC-A العالي و SSC-A العالي (الرسم البياني الأيسر) ، ثم يتم التخلص من ثنائيات الخلايا وثلاثة توائم من خلال تحليل معلمات FSC-A مقابل FSC-H (الرسم البياني الأيمن). (ج) بوابات FACS للخلايا ذات النواة بناء على تعبير GFP الخاص بها (مضان SSC-A مقابل FITC-A). (د) الفحص المجهري لتباين الطور وصور مضان GFP ل NSCs ذات النواة قبل (ن = 3) وبعد (ن = 4) اختيار FACS (اللوحة اليسرى). يتم تصوير النسبة المئوية لخلايا GFP + ذات التأثير النووي قبل وبعد اختيار FACS (اللوحة اليمنى). تم استخدام اختبار T. (ه) التحليل الكمي لتفاعل البوليميراز المتسلسل (qPCR) لتعبير Snrpn في تكاثر NSCs باستخدام shRNA الخاص ب Snrpn (n = 4). كان Nucleofection باستخدام تدافع shRNA بمثابة عنصر تحكم (n = 4). تم استخدام اختبار T. (F) صور الكيمياء الخلوية المناعية التي تعرض SNRPN (باللون الأحمر) في NSCs بعد 7 أيام من نواة shRNA (الألواح الخارجية). تم استخدام DAPI لمقاومة الحمض النووي. صور تمثيلية تصور الكرات العصبية المشتقة من NSCs تحت ظروف shSNRPN و shSCRAMBLE (الألواح الوسطى). (ز) التحديد الكمي لعدد الكرات العصبية التي تشكلت في مزارع NSC بعد النواة باستخدام shSNRPN (ن = 8) أو shSCRAMBLE (ن = 8). تم استخدام اختبار T. يتم تضمين قيم p: *: p<0.05 ؛ **: ص<0.01; ص<0.001; ص<0.0001.: ملحوظة: غير مهمة. تمثل أشرطة الخطأ SEM. شريط المقياس في D ، 10 ميكرومتر ؛ في F ، 100 ميكرومتر (صور عالية التكبير في F ، 7 ميكرومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نظرا لعدم وجود علامات نهائية لتحديد مجموعة NSC في الجسم الحي ، فقد استند تحليل NSCs في المقام الأول إلى مراقبة سلوك الخلايا المعزولة من المنافذ العصبية في ظروف خارج الجسم الحي . وضع العمل الرائد الذي قام به رينولدز وفايس الأساس من خلال إنشاء ظروف زراعة دقيقة ، مما يتيح عزل وتوسيع الخلايا الفردية من أنسجة SVZ للفأر البالغ من العمر 2 شهرا في ظل ظروف غير لاصقة. عادة ما يتم نشر هذه الخلايا في وسط خال من المصل يحتوي على EGF و bFGF ، وهي ظروف تمنع تماما التمايز إلى الخلايا العصبية والدبقية مع تعزيز الانتشار. في الواقع ، في ظل ظروف الثقافةهذه 9 ، تموت معظم الخلايا خلال الأيام الأولى في الثقافة ، لكن مجموعة فرعية صغيرة تبدأ في الانقسام وتشكل في المقام الأول كرات عصبية عائمة9. يسهل التفكك الأنزيمي والمزارع الفرعية لهذه المجاميع الخلوية انتشار الثقافة ، مما يدل على قدرة التجديد الذاتي لهذه الثقافات.
والجدير بالذكر أن مزارع الغلاف العصبي تظهر إمكانات التوسع مع إضافة EGF فقط ، في حين أن NSCs المزروعة في وسط يحتوي على bFGF فقط لا تظهر تكاثر الخلايا على المدى الطويل30. يشير كلا الدليلين إلى EGF باعتباره الميتوجين الأساسي للتجديد الذاتي ل NSC. ومع ذلك ، فإن وجود كل من EGF و bFGF في وسط الاستزراع يحسن قدرة التجديد الذاتي ل NSCs31 ، وكذلك يساهم في موازنة إمكانات التمايز في الخلايا النجمية والخلايا العصبية والخلايا قليلة التغصن32،33،34،35. علاوة على ذلك ، فإن استخدام مزيج محدد من الهرمونات والعوامل بدلا من البدائل التجارية لتكملة الوسط يضمن الجودة العالية وقابلية التكاثر لثقافات NSC. في ظل هذه الظروف ، يمكن أن تستمر مزارع NSC للفأر كخطوط خلايا مستقرة دون الخضوع للتخليد. ومع ذلك ، فإن مصدر القلق في ثقافات الغلاف العصبي هو إمكانية خضوع مجموعات الخلايا التكاثرية للتحولات الجينية ، وتجاوز الآليات التنظيمية لدورة الخلية وتؤدي إلى نمط ظاهري خالد. لذلك ، على الرغم من أن مزارع الغلاف العصبي قابلة للتوسيع بدرجة كبيرة ، إلا أن الثقافات التي تتجاوز 10 ممرات في المختبر عادة ما يتم تجاهلها للدراسات ، لأنها قد تخضع لشيخوخة متكررة ، وقد تظهر خلايا ذات محتوى كروموسومي غير طبيعي أو ديناميكيات نمو غير منتظمة. علاوة على ذلك ، يجب مراقبة استخدام ثقافات الغلاف العصبي الراسخة على المدى الطويل بشكل مستمر. توفر ثقافات الغلاف العصبي أيضا الفرصة لفحص خصائصها وإمكاناتها في بيئة خاضعة للرقابة ، مما يوفر إعدادا أكثر دقة وقابلية للتعديل يمكن تعديله ومراقبته بدقة أكبر من الجسم الحي. من خلال التحليلات المستنسخة أو السكانية في المختبر ، من الممكن تحديد قدرات التجديد الذاتي والانتشار لهذه الخلايا ، مما يسهل تحديد الآليات الأساسية التي تحكم هذه الخصائص.
ومع ذلك، وعلى الرغم من القائمة الكبيرة من مزايا العمل مع NSCs في المختبر، فإن طبيعة بروتوكول الاستزراع هذا وحساسية NSCs يشكلان تحديا في هذا المجال. على سبيل المثال ، يمكن أن يختلف عدد الكرات العصبية الأولية المتولدة أثناء التشريح النموذجي بشكل كبير بناء على مهارة ودقة المجرب. توضح نتائج الغلاف العصبي الأولي هذا التباين في عدد الكرات العصبية الأولية التي تم الحصول عليها من SVZ للفئران البالغة من العمر شهرين ، والتي تتراوح بين 500 و 3000 كرة عصبية. قد تساهم عوامل مختلفة في هذا التباين. أولا ، تقلل دقة التشريح من الأنسجة المتنية غير المرغوب فيها ، والتي تمنع تكوين المجال الأساسي. ثانيا ، يسمح توليد قطع صغيرة من أنسجة SVZ بالهضم الأنزيمي الفعال والتثليج ، وبالتالي تقليل فقد الخلايا. هذا يسلط الضوء على الحاجة إلى ممارسة مسبقة كافية لبروتوكول التشريح وتطوير دقيق لمعالجة الأنسجة أثناء إنشاء مزارع الغلاف العصبي.
يكمن قيد آخر لهذه الثقافات في حقيقة أن المجالات العصبية يمكن أن تضم كلا من NSCs والخلايا السلفية ، مما يجعل من الصعب التمييز بين هاتين المجموعتين داخل الثقافات الأولية. في حين تم الإبلاغ عن علامات مختلفة مثل GFAP و Nestin و Musashi و SOX2 بواسطةNSCs 8 ، لم يتم ربط أي منها حصريا ب NSCs. مكنت تقنيات FACS الناشئة القائمة على التعبير عن مستضد سطح الخلية من عزل NSCs وذريتها. أظهرت هذه الدراسات أن أسلاف تضخيم العبور غير قادرين على تكوين كرات عصبية عند المرور25،36. وهكذا ، في حين أن العلاقة بين خلايا SVZ والخلايا البادئة للغلاف العصبي تتطلب مزيدا من الصقل18،19،20،21،22،23 ، فإن قدرة الكرات العصبية على المرور بشكل متسلسل على مدى فترة طويلة قد تعكس وجود NSCs في الثقافات.
كان نظام زراعة الغلاف العصبي هذا بمثابة نموذج قوي للتحقيق في تأثير مسارات الإشارات والتعبير الجيني في الحفاظ على قدرة التجديد الذاتي NSC في المختبر15,29. تتضمن إحدى الطرق لاستكشاف هذه الجوانب نقل NSCs إما للإفراط في التعبير عن جينات معينة أو إسقاطها. يمكن تحقيق ذلك من خلال تقنيات مختلفة ، بما في ذلك الطرق الفيروسية وغير الفيروسية. في حين أن النواقل الفيروسية غالبا ما تحقق كفاءة عالية في نقل الجينات ، إلا أن لها قيودا مهمة ، مثل متطلبات السلامة العالية وإنتاج النواقل الذي يستغرق وقتاطويلا 26. على العكس من ذلك ، فإن طرق النقل الكلاسيكية مثل lipofection والتثقيب الكهربائي تحقق معدلات نقل منخفضة للغاية ، مما يجعلها غير مجدية للخلايا التي يصعب نقلها. تقدم تقنية nucleofection نهجا سهل الاستخدام من خلال الجمع بين حلول nucleofection الخاصة بنوع الخلية مع المعلمات الكهربائية الفريدة لكل نوع خلية37,38. هذا يضمن نقل الحمض النووي مباشرة إلى نواة الخلية39 ، مما يسمح بدمج الحمض النووي بطريقة مستقلة عن دورة الخلية. وبالتالي ، يظهر nucleofection كتقنية قابلة للتطبيق لنقل الخلايا التي يصعب نقلها مثل NSCs28,40 للفأر.
أحد قيود هذه الطريقة هو أنه يوصى بما لا يقل عن 2 × 106 خلايا وضروري لكل نواة ، على الرغم من أنه في الظروف المثلى ، يمكن استخدام عدد أقل من الخلايا لكل نواة واحدة (أي 5 × 105 خلايا). عيب آخر لهذه الطريقة هو أن جودة وتركيز الحمض النووي المستخدم في النواة يؤثر بشكل كبير على كفاءة نقل الجينات. يوصى بشدة باستخدام الحمض النووي المحضر الخالي من السموم الداخلية لمنع ارتفاع معدل وفيات الخلايا بسبب وجود السموم الداخلية. بالإضافة إلى ذلك ، فإن استخدام أكثر من 6 ميكروغرام من إجمالي الحمض النووي للنواة يمكن أن يقلل بشكل كبير من كفاءة نقل الجينات وصلاحية الخلية. أخيرا ، يعد إعطاء النبض الكهربائي أمرا بالغ الأهمية أيضا لبقاء الخلايا النووية.
في هذا العمل ، قمنا بتمثيل التلاعب بالتعبير الجيني Snrpn من خلال استخدام استراتيجية تنطوي على تقليل تنظيم تعبيره باستخدام البلازميدات العرضية. لا يتم دمج هذه البلازميدات في جينوم الخلايا ، ومع استمرار NSCs في التكاثر في المختبر ، سيتم تخفيف الحمض النووي الذي تم إدخاله لاحقا على طول انقسام الخلايا ، وبالتالي يفقد تأثير التلاعب الجيني. لذلك ، هذه الاستراتيجية قيمة لدراسة تأثير التغيير الحاد في فترة قصيرة أو لخلايا تاريخ الميلاد في المختبر. تتوفر بعض البدائل لتقييم التأثير المطول للاضطراب الجيني. على سبيل المثال ، يمكن استخدام نظام تكاملي مثل الخنزير القائم على الترانسبوزونBAC. يتكون هذا النظام من إدخال تسلسل الترميز المطلوب الموجود في البلازميد المحاط بتسلسلات قابلة للنقل ومشاركة الخلايا في النواة ببلازميد يحتوي على تسلسل إنزيم transposase41. وبدلا من ذلك، يمكن استخدام الترانسبوزونات أو أنظمة كريسبر/كاس.
سيكون التطوير الإضافي لتقنيات النقل خطوة مهمة نحو فحوصات عالية الإنتاجية لتقييم دور الجينات المختلفة في فسيولوجيا الخلايا الجذعية العصبية للبالغين. بالاقتران مع طرق التنقية والتوسع المتطورة بشكل متزايد ، ستمكن هذه الدراسات من فهم البيولوجيا في المختبر ل NSCs البالغة ومقارنة الاختلافات البيولوجية بين المجالات العصبية العائمة و NSCs في الجسم الحي.
Disclosures
يعلن أصحاب البلاغ عدم وجود مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل بمنح من وزارة العلوم والابتكار والوكالة الحكومية للبحوث (MCIN/AEI) (PID2019-110045GB-I00; PID2022-142734OB-I00 و EUR2023-143479) إلى SRF. يتم تمويل EJV (FPU20 / 00795) و DSL (FPU22 / 03797) من قبل برنامج زمالة Formación de Profesorado Universitario الإسباني (FPU). يتم تمويل LLC (PRE2020-094137) و JDM (PREP2022-000680) من قبل برنامج زمالة Formación de Personal Investigador الإسباني (FPI). يتم تمويل CMM (CIACIF / 2022/366) من قبل Generalitat Valenciana. يتم تمويل MIL (CPI-22-481) من قبل زمالة Programa INVESTIGO (الجيل القادم من الاتحاد الأوروبي). تمويل الوصول المفتوح المقدم من وزارة العلوم والابتكار.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm pore-filter bottles (250 mL) | VWR | 514-0330P | |
| 0.22 μm pore-filter bottles (500 mL) | VWR | 514-0332P | |
| 12-well plate | LabClinics | PLC30012 | |
| 15 mL tube | Fisher | 10738771 | |
| 24-well plate | LabClinics | PLC30024 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | BioWest | L0180-100 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| 48-well plate | ThermoFisher | 150687 | |
| 6-well plate | LabClinics | PLC30006 | |
| 96-well plate | Labclinics | PLC30096 | |
| Accutase solution | Sigma | A6964-100ML | Referred as enzymatic solution |
| Amaxa Mouse Neural Stem Cell Nucleofector Kit | Lonza | VPG-1004 | |
| Amaxa Nucleofector Iib | Lonza | 10700807 | |
| Antibiotic/Antimitotic (A/A) | Sigma | A5955 | |
| Apo-t-Transferrine | Sigma | T2252-1G | |
| Basic Fibroblast Growth Factor (bFGF) | Sigma | F0291 | |
| Blasticidin | Sigma | 203350 | |
| Bovine Serum Albumin (BSA) | Sigma | B4287-25MG | |
| Cell strainer 40 μm | LabClinics | PLC93040 | |
| Deoxynucleotide triphosphate (dNTPs) | NZYTech | MB08701 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dulbecco’s Phosphate Saline Buffer (DPBS) | Gibco | 14080-055 | |
| Dulbecco's Modified Eagle's Medium (DMEM) F12 1:1 | Gibco | 11320-074 | |
| E. coli DH5α Competent Cells | ThermoFisher | EC0112 | |
| Earles's Balanced Salt Solution (EBSS) | Gibco | 24010-043 | |
| Epidermal Growth Factor - Human recombinant (EGF) | Gibco | 53003-018 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | E-6511 | |
| Fine Forceps | Fine Science Tools | 11274-20 | |
| Fine Scissors Sharp | Fine Science Tools | 14060-09 | |
| Glucose | Sigma | G-7021 | |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Kit includes reagents for PCR |
| Heparin | Sigma | H-3149 | |
| Insuline | Sigma | I6634 | |
| LB agar (Lennox) | LabKem | AGLB-00P-500 | |
| LB broth (Lennox) | LabKem | LBBR-00P-500 | |
| L-Cysteine | Sigma | C-8277 | |
| L-Glutamine | Gibco | 25030-024 | |
| Neubauer chamber | Blaubrand | BR718620 | |
| Nuclease free water | Labbox | WATR-00A-10K | |
| NZYMaxiprep Endotoxin Free Kit | NZYTech | MB39901 | |
| Papain Lyophilized | Worthington | LS003119 | |
| Progesterone | Sigma | P-6149 | |
| Putrescine | Sigma | P-7505 | |
| Scalpel | Fine Science Tools | 10316-14 | |
| shSCRAMBLE | Mission (Sigma) | SHC003 | |
| shSNRPN | Mission (Sigma) | TRCN0000109285 | |
| Sodium Selenite | Sigma | S-9133 | |
| Spatula | Fine Science Tools | 10090-17 | |
| Sterile PES Syringe Filters (0.22 μm pore-filter) | Epica | SFPE-22E-050 | |
| T12.5 cm2 Flask | Biofil | TCF012025 | |
| T25 cm2 Flask | LabClinics | PLC70025 | |
| T75 cm2 Flask | LabClinics | PLC70075 | |
| Tweezers | Fine Science Tools | 91150-20 |
References
- Gage, F. H. Mammalian neural stem cells. Science. 287 (5457), 1433-1438 (2000).
- Ming, G., Song, H. Adult neurogenesis in the mammalian central nervous system. Ann Rev Neurosci. 28 (1), 223-250 (2005).
- Doetsch, F., Caillé, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97 (6), 703-716 (1999).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Regeneration of a germinal layer in the adult mammalian brain. Proc Natl Acad Sci. 96 (20), 11619-11624 (1999).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. J Neurosci. 17 (13), 5046-5061 (1997).
- Mamber, C., Kozareva, D. A., Kamphuis, W., Hol, E. M. Shades of gray: The delineation of marker expression within the adult rodent subventricular zone. Prog Neurobiol. 111, 1-16 (2013).
- Cebrian-Silla, A., et al. Single-cell analysis of the ventricular-subventricular zone reveals signatures of dorsal and ventral adult neurogenesis. eLife. 10, e67436(2021).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), New York, N.Y. 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. (45), e2393(2010).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ferrón, S. R., et al. Postnatal loss of Dlk1 imprinting in stem cells and niche astrocytes regulates neurogenesis. Nature. 475 (7356), 381-385 (2011).
- Gil-Perotín, S., et al. Adult neural stem cells from the subventricular zone: A review of the neurosphere assay. Anat Record. 296 (9), 1435-1452 (2013).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), 156059(2019).
- Ferrón, S. R., et al. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Prot. 2 (4), 849-859 (2007).
- Ferron, S., et al. Telomere shortening and chromosomal instability abrogates proliferation of adult but not embryonic neural stem cells. Development. 131 (16), 4059-4070 (2004).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Meth. 3 (10), 801-806 (2006).
- Santa-Olalla, J., Baizabal, J., Fregoso, M., Cárdenas, M. D. C., Covarrubias, L. The in vivo positional identity gene expression code is not preserved in neural stem cells grown in culture. Eur J Neurosci. 18 (5), 1073-1084 (2003).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: A critical review of sphere-formation as an assay for stem cells. Cell Stem Cell. 8 (5), 486-498 (2011).
- Wan, F., et al. The utility and limitations of neurosphere assay, CD133 immunophenotyping and side population assay in Glioma stem cell research. Brain Pathol. 20 (5), 877-889 (2010).
- Deleyrolle, L. P., Rietze, R. L., Reynolds, B. A. The neurosphere assay, a method under scrutiny. Acta Neuropsych. 20 (1), 2-8 (2008).
- Campos, L. S. Neurospheres: Insights into neural stem cell biology. Neurosci Res. 78 (6), 761-769 (2004).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres—re-evaluating the relationship. Nat Meth. 2 (5), 333-336 (2005).
- Parker, M. A. Expression profile of an operationally-defined neural stem cell clone. Exp Neurol. 194 (2), 320-332 (2005).
- Belenguer, G., et al. Adult neural stem cells are alerted by systemic inflammation through TNF-α receptor signaling. Cell Stem Cell. 28 (2), 285-299 (2021).
- Cruz, M. T. G., Simões, S., Lima, M. C. P. de Improving lipoplex-mediated gene transfer into C6 glioma cells and primary neurons. Exp Neurol. 187 (1), 65-75 (2004).
- Hagemann, C., et al. High efficiency transfection of glioma cell lines and primary cells for overexpression and RNAi experiments. J Neurosci Meth. 156 (12), 194-202 (2006).
- Moritz, S., Lehmann, S., Faissner, A., Holst, A. von An induction gene trap screen in neural stem cells reveals an instructive function of the niche and identifies the splicing regulator Sam68 as a Tenascin-C-regulated target gene. Stem Cells. 26 (9), 2321-2331 (2008).
- Montalbán-Loro, R., et al. TET3 prevents terminal differentiation of adult NSCs by a non-catalytic action at Snrpn. Nat Comm. 10 (1), 1726(2019).
- Gritti, A., et al. Epidermal and fibroblast growth factors behave as mitogenic regulators for a single multipotent stem cell-like population from the subventricular region of the adult mouse forebrain. J Neurosci. 19 (9), 3287-3297 (1999).
- Nieto-Estévez, V., Pignatelli, J., Araúzo-Bravo, M. J., Hurtado-Chong, A., Vicario-Abejón, C. A global transcriptome analysis reveals molecular hallmarks of neural stem cell death, survival, and differentiation in response to partial FGF-2 and EGF deprivation. PLoS One. 8 (1), 53594(2013).
- Vergaño-Vera, E., Méndez-Gómez, H. R., Hurtado-Chong, A., Cigudosa, J. C., Vicario-Abejón, C. Fibroblast growth factor-2 increases the expression of neurogenic genes and promotes the migration and differentiation of neurons derived from transplanted neural stem/progenitor cells. Neuroscience. 162 (1), 39-54 (2009).
- Gabay, L., Lowell, S., Rubin, L. L., Anderson, D. J. Deregulation of dorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron. 40 (3), 485-499 (2003).
- Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M., Götz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6. Mol Cell Neurosci. 25 (4), 664-678 (2004).
- Bithell, A., Finch, S. E., Hornby, M. F., Williams, B. P. Fibroblast growth factor 2 maintains the neurogenic capacity of embryonic neural progenitor cells in vitro but changes their neuronal subtype specification. Stem Cells. 26 (6), 1565-1574 (2008).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci. 106 (15), 6387-6392 (2009).
- Kobayashi, N., et al. Gene delivery to embryonic stem cells. Birth Def Res C. 75 (1), 10-18 (2005).
- Gresch, O., Altrogge, L. Transfection of difficult-to-transfect primary mammalian cells. Meth Mol Biol. 801, 65-74 (2011).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J Immunol Meth. 284 (1-2), 133-140 (2004).
- von Holst, A., Egbers, U., Prochiantz, A., Faissner, A. Neural stem/progenitor cells express 20 tenascin C isoforms that are differentially regulated by Pax6. J Biol Chem. 282 (12), 9172-9181 (2007).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trend Biotechnol. 33 (9), 525-533 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved