Method Article
来自成体小鼠脑室下区的神经干细胞的分离、扩增和成核转染
摘要
在这里,我们描述了一种核转染系统,旨在提高从成体小鼠脑室下区分离的扩增神经干细胞 (NSC) 的基因递送效率。研究结果表明,该方法显著改善了 NSCs 中的基因扰动,超越了传统转染方案的有效性,提高了细胞存活率。
摘要
在补充有碱性成纤维细胞生长因子 (bFGF) 和表皮生长因子 (EGF) 作为有丝分裂原的培养基中,可以从成年小鼠大脑的脑室下区 (SVZ) 中分离和扩增神经干细胞 (NSC),从而产生称为神经球的克隆聚集体。这种 体外 系统是研究 NSC 潜力的宝贵工具。转染质粒中携带的 siRNA 或基因可用于诱导对基因表达的扰动并研究 NSC 生物学。然而,由于中枢神经系统 (CNS) 细胞转染效率低,外源核酸递送到 NSC 培养物具有挑战性。在这里,我们提出了一种改进的核转染系统,该系统在来自成年小鼠 SVZ 的扩增 NSC 中实现了基因递送的高效率。我们证明,这种相对简单的方法增强了成年 NSC 中的基因扰动,超过了传统的转染方案,存活率超过 80%。此外,该方法还可以应用于原代分离的 NSC,通过在神经球培养物中敲低或过表达进行基因表达操作,为基因功能研究提供重要进展。
引言
神经干细胞 (NSC) 是驻留在大脑中的多能干细胞。这些细胞具有自我更新和分化为三个神经谱系的能力:星形胶质细胞、少突胶质细胞和神经元1。因此,NSC 在哺乳动物的成体神经发生中起着至关重要的作用,这是在大脑中产生新神经元的过程2。NSC 主要存在于成人大脑内的两个区域,称为神经源性生态位:沿侧脑室壁的脑室下区 (SVZ) 和海马齿状回内的颗粒下区 (SGZ) 3,4。SVZ 中的 NSC(也称为 B 细胞)是成年小鼠中最活跃的神经源性生态位,可自我更新并产生过境扩增祖细胞(TAP 或 C 细胞),随后分化为神经母细胞(A 细胞)。这些神经母细胞通过喙部迁移流 (RMS) 迁移到嗅球 (OB),在那里它们完全分化为中间神经元,整合到预先存在的回路中 3,4,5,6。
了解在这些生态位中调节 NSC 的分子线索和信号的复杂相互作用对于利用它们在治疗应用中的潜力非常重要。为此,已经开发了各种方法来研究该细胞群,从 NSC 的选择性原代培养到使用表面标志物的细胞选择 7,8,9,10。本手稿详细介绍了使用含有碱性成丝细胞生长因子 (bFGF) 和表皮生长因子 (EGF) 的无血清选择性培养基在体外分离和培养 SVZ NSC。这种培养基可促进细胞增殖并维持从成年小鼠大脑 SVZ 获得的 NSC 的干性,形成体外克隆、三维、非粘附聚集体,称为神经球9。神经球培养物作为操纵和研究影响 NSC 增殖、自我更新、分化和存活的分子机制和因素的受控平台11。值得注意的是,培养物中形成的原代神经球的数量允许估计体内 SVZ 中存在的 NSC 数量,使其成为研究不同条件对成人 NSC 库影响的有力工具12,13。此外,一旦原代培养物建立,NSC 可以在增殖条件下通过对称分裂传代时产生新的聚集体(次级神经球)14。因此,次生神经球细胞的低密度接种(克隆测定)可用于评估这些培养物的自我更新率 4,15,16,17。
尽管神经球在揭示控制 NSC 调节的机制方面具有潜力,但一些研究人员质疑体外研究结果的有效性,认为细胞生长的人工条件可能无法忠实地复制神经源性生态位错综复杂的体内微环境 18,19,20,21,22.另一个有争议的点围绕着观察到的神经球异质性。尽管如此,这种可变性被认为反映了体内自然发生的 NSC 的对称和不对称分裂 23,24。此外,最近的验证支持利用 NSC 培养物来预测体内 SVZ 神经源性生态位内起作用的机制,并且几项研究表明,体外培养的 NSC 准确维持了在体内观察到的转录组谱 11,25。
因此,神经球培养物不仅作为探索 NSC 增殖和分化能力的方法,而且还提供了一个研究控制 NSC 生物学的基因影响的系统。研究 NSC 中基因功能的关键技术是基因表达扰动。通过质粒递送的 siRNA 或基因可以转染到细胞培养物中,从而导致靶基因的敲低或上调。与使用条件性敲除小鼠建立培养物相比,这种多功能方法显着减少了时间和成本,为解开神经发生的遗传基础和探索治疗前景提供了一条有希望的途径。改变 NSC 中特定基因的表达能够调节其行为,影响关键的生物过程,例如增殖、分化和迁移。然而,转染 NSCs,特别是在小鼠神经球内的 NSC 的前景带来了显著的挑战。神经球的三维结构会影响转染效率,通常会导致外源核酸成功递送率低,这限制了基因操作的范围26,27。此外,转染程序会对细胞活力和功能产生不利影响27。在这种情况下,我们将核转染系统作为一种减轻细胞损伤的方法,实现高存活率并确保用于扰乱 NSC 培养物的基因递送测定的更高功效。
本手稿旨在说明使用神经球培养系统从成人 SVZ 神经源性生态位分离、扩增和成核影响 NSC 以扰乱基因的程序。该方法超越了传统转染方案的有效性,在靶细胞中表现出显著提高的存活率和更高的基因递送效率。
研究方案
所有用动物进行的实验都事先得到了瓦伦西亚大学伦理委员会的批准,并得到了 Conselleria de Agricultura, Ganadería y Pesca, Generalitat Valenciana(西班牙)的授权。
1. 神经球的原代培养
- 试剂的制备
- 在去离子水中制备 Dulbecco 磷酸盐水缓冲液 (DPBS) 的缓冲溶液,并通过高压灭菌进行灭菌。或者,通过在去离子水中加入 137 mM NaCl、2.7 mM KCl、10 mM Na2HPO4 和 1.8 mM KH2PO4 溶液来制备 0.1 M PBS pH 7.4。
- 用预先冷却的 DPBS 填充两个 12 孔板并将它们保存在冰上:一个将用于在解剖前保存整个大脑,另一个将保存解剖的 SVZ 直到组织处理。
- 如下所述准备含木瓜蛋白酶的酶混合物。
- 在 Earl 平衡盐溶液 (EBSS) 中制备 EDTA/L-半胱氨酸解离溶液,每种溶液的最终浓度为 0.2 mg/mL。为了实现完全溶解,请将试管置于 37 °C 的水浴中孵育。
- 将 12 U/mL 木瓜蛋白酶溶解在 EDTA/L-半胱氨酸溶液中。假设每个大脑将使用 500 μL 酶溶液。
- 将木瓜蛋白酶溶液在 37 °C 的水浴中加入约 20 分钟,直到酶完全溶解。
- 用注射器和 0.22 μm 孔径过滤器对酶混合物进行过滤灭菌,并将其保持在 4 °C 直至使用。
注意:木瓜蛋白酶在 37 °C 下 30 分钟后被激活,并且可以在 4 °C 下储存 12 小时。
- 根据 表 1 添加激素混合物溶液来制备对照培养基,并使用硝酸纤维素 0.22 μm 孔径过滤器对其进行过滤灭菌。将培养基保持在 4 °C,并在使用前在 37 °C 的水浴中加热。
- 按照 表 1 使用前,通过在对照培养基中补充 EGF 和 bFGF 来制备完全培养基。不要过滤完全培养基,因为过滤时有丝分裂原会丢失。
- 脑提取和 SVZ 解剖
注意:在安乐死之前,允许老鼠自由获取食物和水。使用8至16周龄的C57BL / 6小鼠。两性均使用,制备方法无明显差异。- 手术前通过高压灭菌对解剖工具进行消毒。然后,将手术刀、镊子、剪刀和抹刀浸入装有 70% 乙醇的烧杯中。用 70% 乙醇彻底清洁每个工作表面。
- 通过 CO2 过量处死小鼠并通过颈椎脱位确认。用 70% 乙醇喷洒头部,以尽量减少脑组织污染的可能性。
- 用剪刀将鼠标的头部与身体的其他部分分开。用小剪刀沿头尾轴切开颅骨上方的皮肤,直到颅骨完全露出。
- 首先用小剪刀沿着矢状缝线切开颅骨,然后用细镊子去除骨头,从而暴露大脑。在此步骤中,请注意不要对颅骨下方的脑组织造成任何损害。
- 使用刮刀小心地从颅骨中取出大脑,并将其放入含有冷 DPBS 的 12 孔板中。将板放在冰上,直到解剖完成。
- 将整个大脑转移到将进行解剖的硅垫上,并在大脑上滴几滴冷 DPBS(图 1A)。
- 使用手术刀去除位于大脑喙端的 OB 和位于尾部的小脑,同时保留包含两个侧脑室的大脑中央部分(图 1B)。
- 沿纵裂将大脑分成两个半球,然后分别解剖两个半球(图 1C)。
- 使用一个半球,重新调整方向,使内侧区域朝上。沿着胼胝体线打开大脑,将皮层和纹状体与海马体、隔膜和间脑分开,从而暴露出侧脑室(图 1D)。
注意:SVZ 位于心室腔和纹状体之间,因此后续步骤旨在尽可能准确地将 SVZ 与周围组织隔离。 - 沿着脑室的腹侧界限去除海马体、隔膜和间脑(图 1E,F),去除 SVZ 喙端和尾端以外的组织(图 1G),以及遵循胼胝体的皮层(图 1H,I)。
- 倾斜组织,使 SVZ 面向侧面(图 1J),允许去除 SVZ 下方的纹状体组织(图 1K)以获得一块含有 NSC 的薄组织(图 1L)。
- 将来自同一只小鼠的两种解剖 SVZ 储存在含有冷、无菌 DPBS 的 12 孔板中,直到组织处理开始。
注意:从一个大脑解剖两个 SVZ 需要 10 分钟。较长的时间可能会影响细胞活力。如果需要提高培养物的产量,可以合并来自相同年龄、性别、遗传背景和基因型的多只小鼠的 SVZ。
- NSC 的分离和接种
- 将每个 SVZ 切成 4-5 小块,以促进组织的解聚。
注意:从此步骤开始,整个过程必须在无菌条件下在层流罩中进行。 - 使用无菌塑料巴斯德移液管将切碎的 SVZ 转移到 15 mL 离心管中。确保板中没有残留物。
- 让组织沉淀物在管底部,并去除剩余的 DPBS。
- 每个大脑 (2 SVZ) 加入 500 μL 过滤的含木瓜蛋白酶的酶混合物,并将试管在 37 °C 的水浴中孵育 30 分钟。
- 孵育后,向每个样品中加入 5 mL 在 37 °C 下预热的对照培养基。
- 将样品以 300 x g 离心 5 分钟。然后,使用微量移液管或真空泵小心去除上清液。
- 加入 1 mL 对照培养基,小心地机械解聚沉淀,使用火焰抛光的巴斯德玻璃移液器上下移液 10 倍至 20 倍,直到获得均匀的细胞悬液。
注意:这是方案中最关键的步骤之一,因为过度或不充分的解聚都会对培养物的产量产生负面影响。 - 加入 4 mL 对照培养基,倒置混合以洗涤细胞。以 300 x g 离心 5 分钟。然后,去除上清液。
- 加入 1 mL 完全培养基,上下吹打 10 次以使细胞悬液匀浆,重悬沉淀。
- 用台盼蓝稀释 1/2 等分试样的细胞悬液后,在显微镜下使用 Neubauer 室对细胞悬液进行计数,或使用自动细胞计数器。确保在单细胞水平上分解培养物。
- 制备细胞悬液后,将获得的细胞均匀接种在 48 孔板的 8 个孔中,最终体积为 500 μL 完全培养基。
注:我们通常从两个 SVZ 获得 20,000 个细胞,最终接种密度约为 2,500 个细胞/mL,以实现培养物的最大产量。
- 将每个 SVZ 切成 4-5 小块,以促进组织的解聚。
- 神经球形成
- 将细胞 在 37 °C 和 5% CO2 的加湿培养箱中体外 (DIV) 孵育 5 至 7 天。在这些条件下,分化的细胞死亡,而 NSC 和祖细胞响应于有丝分裂刺激而增殖,形成公认的原代神经球克隆聚集体。
注意:EGF 或 bFGF 都可用于诱导神经球形成。然而,这两个生长因子并不完全是可替代的。 - 使用倒置显微镜耦合相机检查神经球的大小,一旦神经球达到 50 至 100 μm 的大小范围,以 10 倍放大倍率计数孔中形成的所有原代神经球。形成的原代神经球总数用作 SVZ 生态位中存在的 NSC 数量的估计值。
- 10 天后,从每个孔中收集培养基以开始传代。在 5 到 7 DIV 后进行后续传代,尽管值得注意的是,初级球体可能需要稍长的持续时间才能达到传代培养的理想大小(约 100 μm)。
- 将细胞 在 37 °C 和 5% CO2 的加湿培养箱中体外 (DIV) 孵育 5 至 7 天。在这些条件下,分化的细胞死亡,而 NSC 和祖细胞响应于有丝分裂刺激而增殖,形成公认的原代神经球克隆聚集体。
表 1:培养基解决方案。 描述了对照培养基的配方。制备预混合的激素混合物溶液。可以按照说明提前制备激素储备溶液并储存在 -20 °C。 细胞培养前,用 EGF 和 bFGF 补充对照培养基以制备完全培养基。提供了每种组分的储存规格、储备液和工作浓度。 请点击此处下载此表格。
2. 神经球培养物的扩展
- 神经球的通过
- 从多孔板中收集含有神经球的培养基,并将其转移到 15 mL 离心管中。通过用几毫升 DPBS 冲洗孔,确保回收尽可能多的细胞。
- 以 300 x g 离心神经球 5 分钟。然后,去除上清液。
- 向沉淀中加入 200 μL 酶溶液(参见 材料表),然后轻轻敲击试管底部以使其脱落。在室温下孵育 10 分钟以促进神经球解离。
- 加入 1 mL 对照培养基以终止酶促反应,并使用 P1000 微量移液器上下移液 10 倍至 20 倍来机械解离神经球。
- 加入额外体积的 4 mL 对照培养基,倒置混合以洗涤细胞。
- 将细胞以 300 x g 离心 5 分钟。然后,去除上清液。
- 加入 1 mL 完全培养基并重悬沉淀,通过上下吹打 10 次使细胞悬液匀浆。
注意:如果神经球的原始数量和大小太高,请添加更多完全培养基以稀释细胞悬液,确保可靠的细胞计数。 - 用台盼蓝稀释 1/2 等分试样的细胞悬液后,使用 Neubauer 腔室对细胞悬液进行计数,或使用自动细胞计数器。
- 为了扩增细胞培养物,使用完全培养基在适当的培养板或培养瓶中以 10,000 个细胞/cm2 的密度接种细胞(见 表 2)。
- 在加湿培养箱中,在 37 °C 和 5% CO2 下孵育细胞 5 至 7 DIV,每次传代。
注:神经球培养物可以通过重复传代培养(不超过 10 次传代)持续扩增和繁殖,而不会改变其增殖能力。EGF 或 bFGF 都可用于培养;然而,只有在 EGF 存在的情况下才能实现培养物的长期扩增。
- 自我更新试验
- 传代神经球培养物后,在 96 孔板中接种 1,000 个单个细胞,用完全培养基完成高达 200 μL 的最终体积,得到培养物的最终细胞密度为 5 个细胞/μL。
注:接种的细胞数必须尽可能准确。如有必要,准备中间稀释液,以确保在铺板前获得可靠的细胞悬液体积。此外,建议每种条件进行 4 至 5 次重复接种,以减少技术差异。 - 将细胞在 37 °C 和 5% CO2 下在加湿培养箱中孵育 5 天或直到神经球达到足够的大小(60 至 100 μm)。避免移动或摇晃多孔板以防止神经球聚集。
- 神经球形成后,使用配备有附加摄像头的倒置相差显微镜计算每个孔中形成的神经球的数量。可分别使用 EGF 或 bFGF 进行自我更新测定。
- 传代神经球培养物后,在 96 孔板中接种 1,000 个单个细胞,用完全培养基完成高达 200 μL 的最终体积,得到培养物的最终细胞密度为 5 个细胞/μL。
- NSC 培养物的冻存
注意:神经球培养物可以冷冻保存以备将来使用,从而最大限度地减少所需的小鼠数量。我们建议将细胞保存至第 10 代。- 为了冻存细胞,将 1 mL 完全培养基中的细胞悬液转移至正确标记的冻存管中。
- 向细胞悬液中加入终浓度为 10% 的二甲基亚砜 (DMSO),然后倒置试管轻轻混合。
注:DMSO 用作冷冻保护剂,但可能对细胞有毒,因此应迅速执行此步骤。 - 使用冷冻容器将试管放入 -80 °C 冰箱中,使温度以 1 °C/min 的速度逐渐降低。这种逐渐冷冻的过程可防止在冷冻保存过程中因形成冰晶而引起的细胞损伤。如需长期储存,请将试管保持在 -196 °C 的液氮罐中。
- NSC 培养物的解冻
注:需要时,可以解冻细胞,并重新扩增培养物以进行实验。- 从液氮储罐中取出含有冷冻 NSC 的冻存管,并立即将它们置于 37 °C 水浴中直至完全解冻,大约需要 5 分钟。
注意:尽量减少浴疗时间至关重要,因为 DMSO 有毒且会影响细胞活力。 - 将解冻的细胞快速转移到含有 5 mL 预热对照培养基的 15 mL 离心管中。
- 将细胞以 300 x g 离心 5 分钟,然后去除上清液。加入 1 mL 完全培养基,轻轻上下吹打 10 次以使细胞悬液匀浆,以在接种前重悬沉淀。
注意:解冻会影响细胞活力;因此,建议在接种前至少传代细胞一次以进行新的实验。
- 从液氮储罐中取出含有冷冻 NSC 的冻存管,并立即将它们置于 37 °C 水浴中直至完全解冻,大约需要 5 分钟。
- 支原体检测
注:支原体污染会损害细胞健康,影响生长速率。因此,支原体检测对于确保实验的完整性和可靠性至关重要。- DNA 提取
- 收集至少 100 μL 的细胞培养物用于 DNA 提取。上清液和细胞沉淀均可用于 DNA 提取。将此等分试样储存在 -20 °C 直至提取。
- 刺穿管盖,使用加热块将等分试样在 99 °C 下煮沸 15 分钟。
注意:刺穿管盖可避免在高温下沸腾时管子打开。 - 以 16,900 x g 离心 5 分钟。将含有 DNA 的上清液转移到新试管中。将装有 DNA 的试管储存在 -20 °C 直至 PCR 检测。
- 用于支原体检测的 PCR
- 使用以下组分制备 PCR 混合物:8.9 μL 无核酸酶水、3 μL 5x 反应缓冲液、1.2 μL 25 mM MgCl2、0.25 μL 2.5 mM dNTP、0.15 μL Taq 聚合酶和 0.25 μL 浓度为 10 μM 的每种支原体特异性引物(正向,Fw:5'GATGTTTAGCCGGGTCGAGAG3' 和反向,Rv: 5'GATGTCAAGAGTGGGTAAGGTT3')。
- 加入 1 μL 基因组提取的 DNA。在层流罩中制备 PCR 混合物,以防止 DNA 污染。
- 在热循环仪中孵育反应如下:在 95 °C 下初始变性 5 分钟,然后在 95 °C 下变性 30 秒,在 53 °C 下退火 1 分钟,在 72 °C 下延伸 30 秒,最后在 72 °C 下延伸 5 分钟。
- 为了鉴定所得条带的大小(约 500 bp),将 15 μL DNA PCR 产物与 3 μL 6x 上样染料溶液混合,加载到 2% 琼脂糖凝胶上,并在 100 V 下运行电泳 40 至 50 分钟。
- DNA 提取
表 2:用于培养的板和培养瓶。 提供了最常用的接种板和培养瓶的尺寸和体积。该表包括每个容器使用的直径、生长面积和培养基体积,以及在扩增条件下(10,000 个细胞/cm2)接种的 NSC 数量示例。 请点击此处下载此表格。
3. 神经球培养物的核转染
- 试剂的制备
- DNA 制备
- 在 1.5 mL 试管中制备 25 μL 感受态 大肠杆菌 DH5α 细胞进行转化。
- 向细胞中加入 1 μL 目标质粒(100 至 200 ng/μL),并在 42 °C 下对其进行热休克 45 秒。在这里,使用含有用于沉默 Snrpn 表达的短发夹 (sh) RNA 的质粒和对照质粒 shSCRAMBLE。
注:在整个过程中将感受态细胞置于冰上,以保持转化效果。 - 用适当的抗生素将转化的细胞接种在 LB 琼脂平板上,并在 37 °C 下孵育 18 小时。将培养皿倒置以防止由于冷凝而形成液滴,这可能会干扰细菌菌落。
注:向 LB 培养基中添加适当的抗生素,以专门允许转化细菌的生长。 - 使用无菌移液器吸头,挑选单个细菌菌落并将其转移到先前装满 250 mL LB 的锥形瓶中,以开始液体培养。避免挑选位于较大靶标菌落周围的小卫星菌落,因为它们可能没有掺入所需的质粒。
- 将培养瓶在 37 °C 的轨道振荡器上剧烈摇动孵育过夜。
- 使用无内毒素的大提试剂盒,并按照制造商的说明从细菌培养物中提取纯质粒 DNA。在适当体积的无内毒素水中重构 DNA,以获得 1 至 2 μg/μL 的质粒浓度。
注:大量制备的产量取决于培养物的生长。通常,将质粒 DNA 沉淀重悬于 200 μL 的体积中将得到所需的 DNA 浓度。 - 将带有质粒 DNA 的试管储存在 -20 °C 直至使用。制备一根 1.5 mL 试管,最终体积为 5 μL,其中含有 2 至 6 μg 用于核转染的质粒 DNA。
- 材料准备
- 制备 nucleofection 溶液。如果使用推荐的试剂盒(参见 材料表),请在 1.5 mL 试管中为每个所需的核转染制备 95 μL 的核转染溶液。移液器和比色皿通常包含在试剂盒中。为每种成核条件准备一个。
- 根据每种条件准备一个装满 4 mL 预热完全培养基的 T25 培养瓶,并将其保存在培养箱中直至使用。
- DNA 制备
- NSC 的核转染
- 每个条件使用 1 到 2 x 106 个单独的细胞进行评估。将细胞以 300 x g 离心 5 分钟,然后去除上清液。
- 加入 1 mL DPBS 并通过上下吹打 10 次重悬沉淀,以确保细胞悬浮均匀。
- 重复离心(步骤 2.1.6)进行第二次洗涤,最后将沉淀重悬于 95 μL 核转染溶液中。
注:洗涤步骤对于从对照培养基中去除抗生素并确保有效的核转染至关重要。 - 将 95 μL 细胞与含有 5 μL 选择用于核转染的每种质粒(总共 2 μg)的预混溶液混合。
- 使用 P200 微量移液器,将此溶液转移到比色皿中,并将其放入 nucleofector 装置中。
- 使用 nucleofector 系统的优化 NSC 程序,用所需的质粒对细胞进行成核。
- 完成电穿孔后,使用试剂盒中提供的巴斯德移液器小心地将温热的完全培养基引入比色皿中。随后,将比色皿的内容物转移到先前制备的含有预热完全培养基的 T25 培养瓶中。电穿孔后,可能会出现细胞死亡、DNA 沉淀和粘性聚集体的形成。避免将其转移到 T25 培养瓶中,因为它可能会降低细胞存活率。
注:此步骤至关重要,应尽快执行,以确保高产量的核转染和随后的培养存活。 - 将有核转染细胞在 37 °C 和 5% CO2 下在加湿培养箱中孵育 3 至 5 天。
- 核感染细胞的选择
- 策略 A:通过荧光激活细胞分选 (FACS) 进行流式细胞术选择
- 核转染 3 至 5 天后,按照步骤 2.1 传代核转染培养物,并收集获得的所有个体化细胞。
- 通过 40 μm 细胞过滤器过滤样品以去除细胞聚集体,并使用细胞分选仪流式细胞仪对其进行分析。
注意:在每种条件下对相同数量的细胞进行排序以获得比较结果至关重要。 - 使用细胞仪的软件,根据两种措施对活细胞进行门控:对应于细胞大小的前向散射光 (FSC-A) 和对应于细胞内复杂性的侧向散射光 (SSC-A)。选择具有高 FSC-A 和高 SSC-A 特征的活细胞群。
注:或者,在分选前向细胞悬液中添加 0.1 μg/mL 的 4′,6-二脒基-2-苯基吲哚 (DAPI)。这将允许从门控中丢弃死细胞和凋亡小体。 - 通过绘制 FSC-A 与 FSC-H 参数来丢弃细胞双联体和三联体。选择图对角线中包含的事件,表示单峰。
注:当细胞通过激光时,细胞仪会检测电压随时间的变化。FSC-A 表示信号区域,FSC-H 表示峰高。单重体显示 FSC-A 和 FSC-H 之间的比例关系(位于图的对角线上),而由于信号较长,细胞聚集体相对于 FSC-H 显示更大的 FSC-A。 - 根据所用质粒编码的报告基因的荧光强度选择核转染细胞。例如,当使用 GFP + 时,可以根据 FITC-A 荧光水平与 SSC-A 图来选择细胞。
- 为每种条件分离所需数量的靶细胞,并将它们直接收集在装满完全培养基的收集管中。
- 以 10,000 个细胞/cm2 的密度接种有核转染的 NSC。将分选的细胞培养物在 37 °C 和 5% CO2 下在加湿培养箱中孵育。
- 策略 B:使用质粒中编码的抗生素抗性进行选择
- 核转染 48 小时后,添加适当浓度的抗生素以选择耐药细胞。
注:在开始之前,建议在非核染细胞上测试多种浓度的抗生素。最佳抗生素浓度是消除所有非耐药细胞的最低量。例如,我们确定了 NSC 培养物的最佳浓度为 4 μg/mL 抗生素杀稻瘟菌素。 - 将细胞在 37 °C 和 5% CO2 下在加湿培养箱中孵育 48 小时。
- 抗生素处理 48 小时后,根据步骤 2.1 传代培养有核感染的细胞。如果神经球仍然很小,则通过以 300 x g 离心 5 分钟从培养基中去除抗生素。重悬细胞,并在培养瓶中仅使用完全培养基培养它们。将细胞在 37 °C 和 5% CO2 下在加湿培养箱中孵育,直到它们可以按照步骤 2.1 扩增。
- 核转染 48 小时后,添加适当浓度的抗生素以选择耐药细胞。
- 策略 A:通过荧光激活细胞分选 (FACS) 进行流式细胞术选择
结果
最佳的培养条件能够在体外分离和扩增成体 SVZ 衍生的 NSC
源自成体 SVZ 的 NSCs 培养物已成为研究其特定微环境中调节 NSC 的分子机制和生态位信号的有价值的 体外 方法。本手稿中概述的神经球测定用于检查成人 SVZ 内的 NSC 计数。从 3 个月大小鼠的大脑中分离 SVZ 组织,解离,并在补充有 EGF 和 bFGF 的完全 NSC 培养基中培养,或分别培养。 体外 10 天 (DIV) 后,使用相差显微镜量化在这三种不同培养条件下形成的初级球体总数(图 2A、B)。值得注意的是,我们的研究结果表明,EGF 的存在导致了最大的初级球体形成,这从在仅具有 bFGF 的培养物中观察到的初级球体数量减少中可以明显看出(图 2A、B)。为了评估 NSCs 在不同培养基条件下的自我更新能力,将细胞传代培养并以低密度 (5 个细胞/μL) 接种在补充有上述有丝分裂原组合的培养基中。次级球体定量显示,SVZ NSC 至少需要 EGF 才能有效地自我更新,并且 EGF 和 bFGF 的组合可改善细胞的自我更新能力(图 2B)。此外,为了详细分析不同培养基条件下的生长动力学,记录了在 7 次传代中接种和获得的细胞数量。从不同培养基条件获得的生长曲线证实,与仅补充 bFGF 的培养物相比,单独补充 EGF 或与 bFGF 联合补充的培养物表现出更好的生长动力学(图 2C)。总的来说,这些发现证实了同时使用 EGF 和 bFGF 可以提高体外 NSC 培养产量 。
为了研究不同出生后年龄 SVZ 内的 NSC 计数并评估小鼠衰老对神经球培养效率的影响,解剖了 1 个月至 12 个月小鼠的 SVZ 组织。值得注意的是,我们的研究结果显示,随着年龄的增长,初级球体的数量显着下降,在 2 至 4 个月左右显示出球体数量的最大效率(图 2D)。此外,为了评估传代培养过程中 NSCs 的自我更新能力,将 2 至 4 月龄小鼠的 NSCs 进行传代培养,并以克隆密度 (5 个细胞/μL) 接种在完全培养基中。对后续传代中次级球体数量的量化表明,传代过程中培养效率显着降低(图 2E)。基于所有这些观察结果,建议在早期传代期间进行自我更新测定,以进一步优化 NSC 培养条件。
核转染是一种在成人 NSC 中操纵基因表达的高效技术
鉴于 NSCs 不易转染,为了操纵基因表达,我们在这里提出了一种具有更高基因成功递送率的成核转染方案,而无需使用病毒转导。在解剖和培养 2 至 4 个月龄小鼠的单个 SVZ 后,如上所述,用携带 GFP 的质粒对 NSC 进行核感染(图 3A)。核转染后 2 天检测 GFP 阳性细胞显示效率范围为 30% 至 50%,与以前的文献一致28。为了特异性分离成功核转染的 NSC,在核转染后 3 至 5 天通过 FACS 根据 GFP 荧光强度对细胞进行分选(图 3A-C)。大约 40% 的 FACS 前分析细胞表现出高 GFP 荧光水平,随后通过排序选择(图 3C)。分选的 GFP+ NSC 的重新接种显示所有细胞均为 GFP 阳性,验证了基于核转染的细胞分离方法(图 3D)。值得注意的是,核转染的 NSC 在随后的传代中保持了活力,证实了成体 NSC 的核转染可行性。这些结果强调了结合核转染和 FACS 建立修饰 NSC 纯培养物的有效性。
作为成人 NSC 中基因调控的一个例子,采用了通过短发夹 (sh) RNA 核转染的基因衰减。具体来说,在来自 2 个月大小鼠的 NSC 培养物中,靶向小核核糖核核蛋白多肽 N (Snrpn) 基因的 shRNA,携带 CAG-GFP 报告基因 (shSNRPN)。在用 shSNRPN 质粒核染的细胞中通过 qPCR 和免疫细胞化学证实 Snrpn 下调,但对照 shSCRAMBLE 质粒未证实 Snrpn 下调(图 3E,F)29。为了阐明 Snrpn 下调对 NSC 自我更新能力的影响,在核感染细胞中进行了低密度测定(图 3F,G)。核感染培养物中次级神经球的定量显示,Snrpn 下调后神经球形成能力增加(图 3G)。该测定强调了操纵成体 NSC 基因表达的核转染能力,更具体地说,确定了 Snrpn 在维持成体 NSC 干性中的作用。
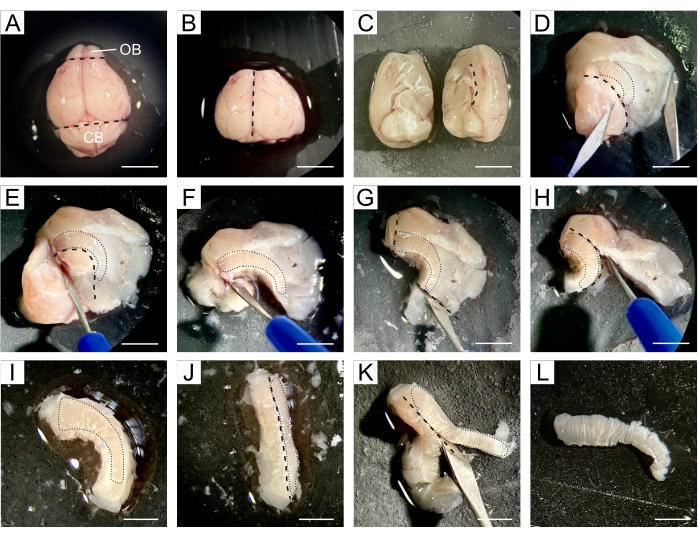
图 1:SVZ 解剖的详细说明。 (A) 取出小鼠大脑后,用 DPBS 将整个大脑转移到硅垫上进行解剖。(B) 使用手术刀从大脑中取出 OB 和小脑。(C) 将大脑分成两个半球,分别进行解剖。(D) 大脑沿着胼胝体的线打开,将皮层和纹状体与海马体、隔膜和间脑分开,从而暴露出侧脑室。(E-F)海马体、隔膜和间脑在脑室的腹侧限制后被切除。(G-I)SVZ 的喙端和尾端以及皮层以外的组织在胼胝体之后被去除。(J-K)组织倾斜,使 SVZ 面向侧面,从而去除 SVZ 下方的纹状体组织。(L) 获得一块含有 SVZ 的薄组织。黑色虚线表示切割地点。黑色虚线表示每个步骤中 SVZ 的位置。缩写: OB = 嗅球;CB = 小脑。A-H 比例尺:5 毫米;内长:3 毫米。 请点击此处查看此图的较大版本。
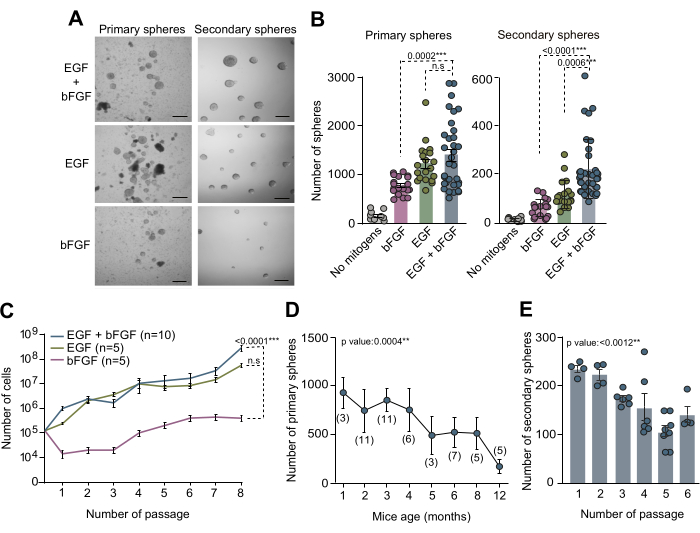
图 2:有丝分裂原 EGF 和 bFGF 都是 体外 NSC 最佳培养和扩增所必需的。 (A) 在分别补充有 EGF 和 bFGF 或每种有丝分裂原的 NSC 培养基中原代和继发性神经球培养物的相差显微镜图像。(B) 根据培养基的有丝分裂原组成,每只小鼠和每孔获得的初级球体数量:无丝裂原(灰色,n=9)、EGF+bFGF(蓝色,n=33)、仅 EGF(绿色,n=20)或仅 bFGF(粉红色,n=19;左图)。根据培养基的有丝分裂原组成,以低密度(5 个细胞/μL)每孔形成的次级神经球数量):无丝裂原(灰色,n=11)、bFGF(粉红色,n=18)、EGF(绿色,n=18)或 EGF+bFGF(蓝色,n=37;右图)。使用 Kruskal-Wallis 检验和 Dunn 事后分析。(C) 生长曲线,显示根据培养基中存在的有丝分裂原,在不同的神经球培养物中传代 8 次后形成的细胞总数:bFGF(粉红色,n=5)、EGF(绿色,n=5)或 EGF+bFGF(蓝色,n=10)。采用线性回归分析。 (D) 从处于不同出生后发育阶段的动物中解剖和分解的个体小鼠衍生的原代神经球的数量。采用线性回归分析。n 在括号中表示。(E) 通过随后的 体外 传代以低密度 (5 个细胞/μL) 形成的次级神经球的数量,以评估它们的自我更新能力。使用 Kruskal-Wallis 检验,包括 p 值: *: p<0.05;**: 第 0<.01 页;: 第 0.001 页<;:第 <0.0001 页。N.S: 不显著。误差线代表 SEM。A 中的比例尺为 100 μm。 请单击此处查看此图的较大版本。
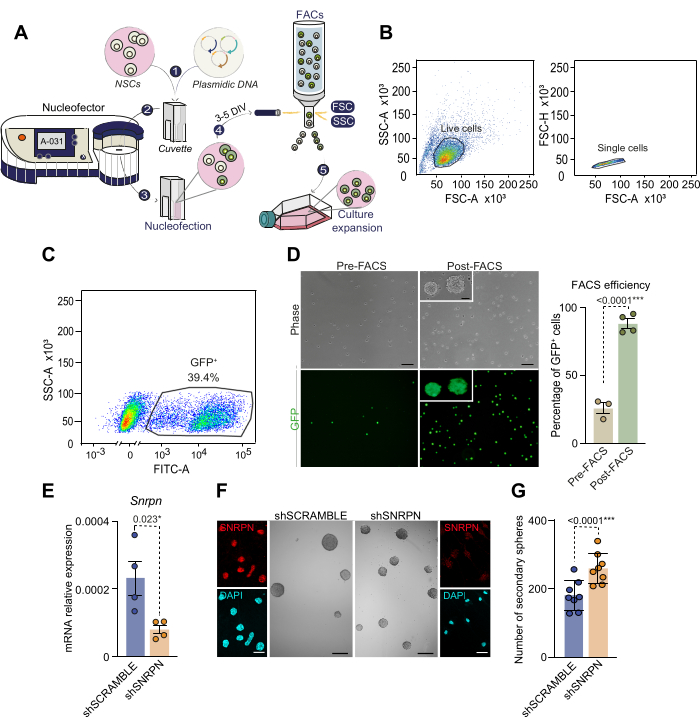
图 3:核转染过程和基于 FACS 的核转染细胞细胞选择示意图。 (A) 核转染过程和基于 FACS 的核转染细胞选择概述。1) 质粒 DNA 溶液与核转染溶液混合并加入细胞中。然后将该混合物转移到比色皿中进行核转染。2) 将含有 DNA 和细胞的比色皿插入 nucleofector 中,在那里进行电击。对于从成人 SVZ 中分离的神经球培养物,我们建议使用 A-031 NSC 程序。3) 核转染后,将细胞转移至含有补充有 EGF 和 bFGF 的完全培养基的培养瓶中。4) 根据质粒 DNA 中包含的报告基因的表达,通过 FACS 对细胞进行分类。5) 分选的细胞经过进一步培养以进行后续实验。(B) 基于 FACS 的选择策略和核感染 NSC 的门控。首先,根据高 FSC-A 和高 SSC-A 选择活细胞(左图),然后通过分析 FSC-A 与 FSC-H 参数(右图)来消除细胞双联体和三联体。(C) 基于其 GFP 表达(SSC-A 与 FITC-A 荧光)对有核细胞进行 FACS 设门。(D) FACS 选择 (n=3) 和 (n=4) 之前 (n=4) 有核 NSC 的相差显微镜和 GFP 荧光图像(左图)。描述了 FACS 选择前后的核转染 GFP + 细胞的百分比(右图)。使用 t 检验。(五) 对 Snrpn 特异性 shRNA 核染的增殖 NSC 中 Snrpn 表达进行定量 PCR (qPCR) 分析 (n=4)。使用 shRNA SCRAMBLE 的核转染作为对照 (n=4)。使用 t 检验。(F) 免疫细胞化学图像显示 shRNA 核转染后 7 天在 NSC 中 SNRPN(红色)(外图)。使用 DAPI 对 DNA 进行复染。描绘了在 shSNRPN 和 shSCRAMBLE 条件下源自 NSC 的神经球的代表性图像(中间面板)。(G) 用 shSNRPN (n=8) 或 shSCRAMBLE (n=8) 核转染后 NSC 培养物中形成的神经球数的定量。使用 t 检验。包括 p 值: *: p<0.05;**: 第 0<.01 页;: 第 0.001 页<;:第 <0.0001 页。N.S: 不显著。误差线代表 SEM。D 中的比例尺,10 μm;F 值为 100 μm(F 中的高放大倍率图像为 7 μm)。请单击此处查看此图的较大版本。
讨论
由于缺乏用于在 体内识别 NSC 群体的明确标志物,NSC 的分析主要基于观察在 离体 条件下从神经源性生态位分离的细胞的行为。Reynolds 和 Weiss 的开创性工作通过建立精确的培养条件奠定了基础,能够在非粘附条件下从年轻成年(2 个月大)小鼠 SVZ 组织中分离和扩增单个细胞。这些细胞通常在含有 EGF 和 bFGF 的无血清培养基中繁殖,这些条件完全阻止分化为神经元和神经胶质细胞,同时促进增殖。事实上,在这些培养条件下9,大多数细胞在培养的最初几天死亡,但一小部分细胞开始分裂并主要形成漂浮的神经球9。这些细胞聚集体的酶解离和传代培养促进了培养物的繁殖,证明了这些培养物的自我更新能力。
值得注意的是,神经球培养物仅通过添加 EGF 显示出扩增潜力,而在仅含有 bFGF 的培养基中生长的 NSC 不显示长期细胞增殖30。两项证据都指出 EGF 是主要的 NSC 自我更新有丝分裂原。然而,培养基中 EGF 和 bFGF 的存在提高了 NSC 的自我更新能力31,并有助于平衡分化为星形胶质细胞、神经元和少突胶质细胞的潜力 32,33,34,35。此外,使用确定的激素和因子混合物代替商业替代品来补充培养基,确保了 NSC 培养物的高质量和可重复性。在这些条件下,小鼠 NSC 培养物可以作为稳定的细胞系持续存在,而无需进行永生化。然而,神经球培养中的一个问题是增殖细胞群可能经历遗传转化,绕过细胞周期调节机制并导致永生化表型。因此,尽管神经球培养物具有高度可扩增性,但超过 10 次体外传代的培养物通常被丢弃用于研究,因为它们可能会经历复制性衰老,并且可能会出现染色体含量异常或不规则生长动力学的细胞。此外,必须持续监测长期建立的神经球培养物的使用。神经球培养物还提供了在受控环境中检查其特性和潜力的机会,提供了比体内更精确和可调节的设置,可以比体内更准确地进行调节和监测。通过体外克隆形成或群体分析,可以量化这些细胞的自我更新和增殖能力,从而有助于确定控制这些特性的潜在机制。
然而,尽管在 体外使用 NSC 有很多优势,但这种培养方案的性质和 NSC 的精致构成了该领域的挑战。例如,在典型解剖过程中产生的初级神经球的数量可能会因实验者的技能和精度而有很大差异。原代神经球结果说明了从 2 个月大小鼠的 SVZ 获得的原代神经球数量的这种可变性,范围在 500 到 3000 个神经球之间。各种因素都可能导致这种可变性。首先,解剖的精确性最大限度地减少了不需要的实质组织,从而抑制了初级球体的形成。其次,生成小块 SVZ 组织可实现高效的酶消化和研磨,从而减少细胞损失。这突出了在建立神经球培养物期间需要对解剖方案进行充分的事先实践和组织处理的微调开发。
这些培养物的另一个局限性在于神经球可以同时包含 NSC 和祖细胞,这使得在原代培养物中区分这两个群体具有挑战性。虽然据报道 GFAP、Nestin、Musashi 和 SOX2 等各种标志物由 NSCs 表达8,但这些标志物都与 NSC 无关。基于细胞表面抗原表达的新兴 FACS 技术能够分离 NSC 及其后代。这些研究表明,传递扩增的祖细胞在传代25,36 时无法形成神经球。因此,虽然 SVZ 细胞和神经球起始细胞之间的关系需要进一步细化 18,19,20,21,22,23,但神经球在较长时间内连续传代的能力可能反映了培养物中 NSC 的存在。
这种神经球培养系统已成为研究信号通路和基因表达对维持体外 NSC 自我更新能力的影响的稳健模型 15,29。探索这些方面的一种方法涉及转染 NSC 以过表达或敲低特定基因。这可以通过各种技术来实现,包括病毒和非病毒方法。虽然病毒载体通常可实现高基因转移效率,但它们也有重要的局限性,例如高安全要求和耗时的载体生产26。相反,脂质转染和电穿孔等经典转染方法的转染速率非常低,因此无法用于难以转染的细胞。核转染技术通过将细胞类型特异性的核转染溶液与每种细胞类型的独特电参数相结合,提供了一种用户友好的方法37,38。这确保了 DNA 直接转移到细胞核39 中,从而允许 DNA 以不依赖细胞周期的方式掺入。因此,核转染成为转染难以转染的细胞(如小鼠 NSC)的可行技术28,40。
该方法的一个限制是,建议每次核转染至少需要 2 x 106 个细胞,但在最佳条件下,每个核转染可以使用较少数量的细胞(即 5 × 105 个细胞)。该方法的另一个缺点是用于核转染的 DNA 的质量和浓度会显著影响基因转移效率。强烈建议使用不含内毒素的制备 DNA,以防止因内毒素的存在而导致细胞死亡率升高。此外,使用超过 6 μg 的总 DNA 进行成核转染会显著降低基因转移效率和细胞活力。最后,电脉冲给药对于核感染细胞的存活也至关重要。
在这项工作中,我们通过采用一种涉及使用游离型质粒下调其表达的策略来举例说明对 Snrpn 基因表达的操纵。这些质粒没有整合到细胞的基因组中,随着 NSC 在体外不断增殖,引入的 DNA 随后会随着细胞分裂而被稀释,从而失去基因操作的效果。因此,该策略对于研究短期内急性改变或体外出生 日期细胞的影响很有价值。有一些替代方法可以评估基因扰动的更持久影响。例如,可以使用基于转座子的 piggyBAC 等整合系统。该系统包括引入质粒中包含的所需编码序列,两侧是转座序列,并用含有转座酶41 序列的质粒对细胞进行共核染。或者,可以使用转座子或 CRISPR/Cas 系统。
转染技术的进一步发展将是迈向高通量检测的重要一步,以评估不同基因对成体神经干细胞生理学的作用。结合日益复杂的纯化和扩增方法,这些研究将能够理解成体 NSC 的 体外 生物学以及比较漂浮神经球和 NSC 在 体内的生物学差异。
披露声明
作者声明没有竞争性的经济利益。
致谢
这项工作得到了 Ministerio de Ciencia e Innovación 和 Agencia Estatal de Investigación (MCIN/AEI) (PID2019-110045GB-I00;PID2022-142734OB-I00 和 EUR2023-143479) 发送到 SRF。EJV (FPU20/00795) 和 DSL (FPU22/03797) 由西班牙 Formación de Profesorado Universitario 奖学金计划 (FPU) 资助。LLC (PRE2020-094137) 和 JDM (PREP2022-000680) 由西班牙个人调查协会 (FPI) 奖学金计划资助。CMM (CIACIF/2022/366) 由 Generalitat Valenciana 资助。MIL (CPI-22-481) 由 Programa INVESTIGO 奖学金(下一代欧盟)资助。开放获取资金由 Ministerio de Ciencia e Innovación 提供。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 μm pore-filter bottles (250 mL) | VWR | 514-0330P | |
| 0.22 μm pore-filter bottles (500 mL) | VWR | 514-0332P | |
| 12-well plate | LabClinics | PLC30012 | |
| 15 mL tube | Fisher | 10738771 | |
| 24-well plate | LabClinics | PLC30024 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | BioWest | L0180-100 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| 48-well plate | ThermoFisher | 150687 | |
| 6-well plate | LabClinics | PLC30006 | |
| 96-well plate | Labclinics | PLC30096 | |
| Accutase solution | Sigma | A6964-100ML | Referred as enzymatic solution |
| Amaxa Mouse Neural Stem Cell Nucleofector Kit | Lonza | VPG-1004 | |
| Amaxa Nucleofector Iib | Lonza | 10700807 | |
| Antibiotic/Antimitotic (A/A) | Sigma | A5955 | |
| Apo-t-Transferrine | Sigma | T2252-1G | |
| Basic Fibroblast Growth Factor (bFGF) | Sigma | F0291 | |
| Blasticidin | Sigma | 203350 | |
| Bovine Serum Albumin (BSA) | Sigma | B4287-25MG | |
| Cell strainer 40 μm | LabClinics | PLC93040 | |
| Deoxynucleotide triphosphate (dNTPs) | NZYTech | MB08701 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dulbecco’s Phosphate Saline Buffer (DPBS) | Gibco | 14080-055 | |
| Dulbecco's Modified Eagle's Medium (DMEM) F12 1:1 | Gibco | 11320-074 | |
| E. coli DH5α Competent Cells | ThermoFisher | EC0112 | |
| Earles's Balanced Salt Solution (EBSS) | Gibco | 24010-043 | |
| Epidermal Growth Factor - Human recombinant (EGF) | Gibco | 53003-018 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | E-6511 | |
| Fine Forceps | Fine Science Tools | 11274-20 | |
| Fine Scissors Sharp | Fine Science Tools | 14060-09 | |
| Glucose | Sigma | G-7021 | |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Kit includes reagents for PCR |
| Heparin | Sigma | H-3149 | |
| Insuline | Sigma | I6634 | |
| LB agar (Lennox) | LabKem | AGLB-00P-500 | |
| LB broth (Lennox) | LabKem | LBBR-00P-500 | |
| L-Cysteine | Sigma | C-8277 | |
| L-Glutamine | Gibco | 25030-024 | |
| Neubauer chamber | Blaubrand | BR718620 | |
| Nuclease free water | Labbox | WATR-00A-10K | |
| NZYMaxiprep Endotoxin Free Kit | NZYTech | MB39901 | |
| Papain Lyophilized | Worthington | LS003119 | |
| Progesterone | Sigma | P-6149 | |
| Putrescine | Sigma | P-7505 | |
| Scalpel | Fine Science Tools | 10316-14 | |
| shSCRAMBLE | Mission (Sigma) | SHC003 | |
| shSNRPN | Mission (Sigma) | TRCN0000109285 | |
| Sodium Selenite | Sigma | S-9133 | |
| Spatula | Fine Science Tools | 10090-17 | |
| Sterile PES Syringe Filters (0.22 μm pore-filter) | Epica | SFPE-22E-050 | |
| T12.5 cm2 Flask | Biofil | TCF012025 | |
| T25 cm2 Flask | LabClinics | PLC70025 | |
| T75 cm2 Flask | LabClinics | PLC70075 | |
| Tweezers | Fine Science Tools | 91150-20 |
参考文献
- Gage, F. H. Mammalian neural stem cells. Science. 287 (5457), 1433-1438 (2000).
- Ming, G., Song, H. Adult neurogenesis in the mammalian central nervous system. Ann Rev Neurosci. 28 (1), 223-250 (2005).
- Doetsch, F., Caillé, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97 (6), 703-716 (1999).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Regeneration of a germinal layer in the adult mammalian brain. Proc Natl Acad Sci. 96 (20), 11619-11624 (1999).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. J Neurosci. 17 (13), 5046-5061 (1997).
- Mamber, C., Kozareva, D. A., Kamphuis, W., Hol, E. M. Shades of gray: The delineation of marker expression within the adult rodent subventricular zone. Prog Neurobiol. 111, 1-16 (2013).
- Cebrian-Silla, A., et al. Single-cell analysis of the ventricular-subventricular zone reveals signatures of dorsal and ventral adult neurogenesis. eLife. 10, e67436(2021).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), New York, N.Y. 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. (45), e2393(2010).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ferrón, S. R., et al. Postnatal loss of Dlk1 imprinting in stem cells and niche astrocytes regulates neurogenesis. Nature. 475 (7356), 381-385 (2011).
- Gil-Perotín, S., et al. Adult neural stem cells from the subventricular zone: A review of the neurosphere assay. Anat Record. 296 (9), 1435-1452 (2013).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), 156059(2019).
- Ferrón, S. R., et al. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Prot. 2 (4), 849-859 (2007).
- Ferron, S., et al. Telomere shortening and chromosomal instability abrogates proliferation of adult but not embryonic neural stem cells. Development. 131 (16), 4059-4070 (2004).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Meth. 3 (10), 801-806 (2006).
- Santa-Olalla, J., Baizabal, J., Fregoso, M., Cárdenas, M. D. C., Covarrubias, L. The in vivo positional identity gene expression code is not preserved in neural stem cells grown in culture. Eur J Neurosci. 18 (5), 1073-1084 (2003).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: A critical review of sphere-formation as an assay for stem cells. Cell Stem Cell. 8 (5), 486-498 (2011).
- Wan, F., et al. The utility and limitations of neurosphere assay, CD133 immunophenotyping and side population assay in Glioma stem cell research. Brain Pathol. 20 (5), 877-889 (2010).
- Deleyrolle, L. P., Rietze, R. L., Reynolds, B. A. The neurosphere assay, a method under scrutiny. Acta Neuropsych. 20 (1), 2-8 (2008).
- Campos, L. S. Neurospheres: Insights into neural stem cell biology. Neurosci Res. 78 (6), 761-769 (2004).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres—re-evaluating the relationship. Nat Meth. 2 (5), 333-336 (2005).
- Parker, M. A. Expression profile of an operationally-defined neural stem cell clone. Exp Neurol. 194 (2), 320-332 (2005).
- Belenguer, G., et al. Adult neural stem cells are alerted by systemic inflammation through TNF-α receptor signaling. Cell Stem Cell. 28 (2), 285-299 (2021).
- Cruz, M. T. G., Simões, S., Lima, M. C. P. de Improving lipoplex-mediated gene transfer into C6 glioma cells and primary neurons. Exp Neurol. 187 (1), 65-75 (2004).
- Hagemann, C., et al. High efficiency transfection of glioma cell lines and primary cells for overexpression and RNAi experiments. J Neurosci Meth. 156 (12), 194-202 (2006).
- Moritz, S., Lehmann, S., Faissner, A., Holst, A. von An induction gene trap screen in neural stem cells reveals an instructive function of the niche and identifies the splicing regulator Sam68 as a Tenascin-C-regulated target gene. Stem Cells. 26 (9), 2321-2331 (2008).
- Montalbán-Loro, R., et al. TET3 prevents terminal differentiation of adult NSCs by a non-catalytic action at Snrpn. Nat Comm. 10 (1), 1726(2019).
- Gritti, A., et al. Epidermal and fibroblast growth factors behave as mitogenic regulators for a single multipotent stem cell-like population from the subventricular region of the adult mouse forebrain. J Neurosci. 19 (9), 3287-3297 (1999).
- Nieto-Estévez, V., Pignatelli, J., Araúzo-Bravo, M. J., Hurtado-Chong, A., Vicario-Abejón, C. A global transcriptome analysis reveals molecular hallmarks of neural stem cell death, survival, and differentiation in response to partial FGF-2 and EGF deprivation. PLoS One. 8 (1), 53594(2013).
- Vergaño-Vera, E., Méndez-Gómez, H. R., Hurtado-Chong, A., Cigudosa, J. C., Vicario-Abejón, C. Fibroblast growth factor-2 increases the expression of neurogenic genes and promotes the migration and differentiation of neurons derived from transplanted neural stem/progenitor cells. Neuroscience. 162 (1), 39-54 (2009).
- Gabay, L., Lowell, S., Rubin, L. L., Anderson, D. J. Deregulation of dorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron. 40 (3), 485-499 (2003).
- Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M., Götz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6. Mol Cell Neurosci. 25 (4), 664-678 (2004).
- Bithell, A., Finch, S. E., Hornby, M. F., Williams, B. P. Fibroblast growth factor 2 maintains the neurogenic capacity of embryonic neural progenitor cells in vitro but changes their neuronal subtype specification. Stem Cells. 26 (6), 1565-1574 (2008).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci. 106 (15), 6387-6392 (2009).
- Kobayashi, N., et al. Gene delivery to embryonic stem cells. Birth Def Res C. 75 (1), 10-18 (2005).
- Gresch, O., Altrogge, L. Transfection of difficult-to-transfect primary mammalian cells. Meth Mol Biol. 801, 65-74 (2011).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J Immunol Meth. 284 (1-2), 133-140 (2004).
- von Holst, A., Egbers, U., Prochiantz, A., Faissner, A. Neural stem/progenitor cells express 20 tenascin C isoforms that are differentially regulated by Pax6. J Biol Chem. 282 (12), 9172-9181 (2007).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trend Biotechnol. 33 (9), 525-533 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。