Method Article
Isolement, expansion et nucléofection de cellules souches neurales de la zone sous-ventriculaire murine adulte
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous décrivons un système de nucléofection conçu pour améliorer l’efficacité de l’administration de gènes dans les cellules souches neurales (NSC) élargies isolées de la zone sous-ventriculaire murine adulte. Les résultats démontrent que cette méthode améliore considérablement la perturbation des gènes dans les CSN, surpassant l’efficacité des protocoles de transfection traditionnels et augmentant le taux de survie cellulaire.
Résumé
L’isolement et l’expansion des cellules souches neurales (NSC) de la zone sous-ventriculaire (SVZ) du cerveau de la souris adulte peuvent être réalisés dans un milieu complété par le facteur de croissance des fibroblastes basiques (bFGF) et le facteur de croissance épidermique (EGF) en tant que mitogènes, produisant des agrégats clonaux connus sous le nom de neurosphères. Ce système in vitro est un outil précieux pour étudier le potentiel des NSC. La transfection de siRNA ou de gènes portés dans les plasmides peut être utilisée pour induire des perturbations de l’expression des gènes et étudier la biologie des NSC. Cependant, l’administration d’acides nucléiques exogènes aux cultures de NSC est difficile en raison de la faible efficacité de la transfection des cellules du système nerveux central (SNC). Ici, nous présentons un système de nucléofection amélioré qui atteint une grande efficacité de l’administration de gènes dans les NSC élargies à partir de SVZ murins adultes. Nous démontrons que cette méthode relativement simple améliore la perturbation génique dans les CSN adultes, surpassant les protocoles de transfection traditionnels avec des taux de survie supérieurs à 80%. De plus, cette méthode peut également être appliquée dans les CSN primaires isolées, fournissant une avancée cruciale dans les études de la fonction génique par manipulation de l’expression génique par knockdown ou surexpression dans les cultures de la neurosphère.
Introduction
Les cellules souches neurales (NSC) sont des cellules souches multipotentes résidant dans le cerveau. Ces cellules possèdent la capacité de s’auto-renouveler et de se différencier en trois lignées neuronales : les astrocytes, les oligodendrocytes et les neurones1. Par conséquent, les NSC jouent un rôle crucial dans la neurogenèse adulte chez les mammifères, un processus où de nouveaux neurones sont générés dans le cerveau2. Les NSC résident principalement dans deux régions du cerveau adulte appelées niches neurogènes : la zone sous-ventriculaire (SVZ) le long des parois des ventricules latéraux et la zone subgranulaire (SGZ) dans le gyrus denté de l’hippocampe 3,4. Les NSC (également appelées cellules B) dans la SVZ, la niche neurogène la plus active chez la souris adulte, s’auto-renouvellent et produisent des progéniteurs amplificateurs de transit (TAPs ou cellules C) qui se différencient ensuite en neuroblastes (cellules A). Ces neuroblastes migrent par le flux migratoire rostral (RMS) vers les bulbes olfactifs (OB), où ils subissent une différenciation complète en interneurones, s’intégrant dans les circuits préexistants 3,4,5,6.
Il est important de comprendre l’interaction complexe des signaux et des signaux moléculaires qui régulent les CSN au sein de ces niches afin d’exploiter leur potentiel pour des applications thérapeutiques. À cette fin, diverses méthodes ont été développées pour étudier cette population cellulaire, allant de la culture primaire sélective de CSN à la sélection cellulaire à l’aide de marqueurs de surface 7,8,9,10. Le présent manuscrit détaille l’isolement et la culture de CSN SVZ in vitro à l’aide d’un milieu sélectif sans sérum contenant les deux mitogènes : le facteur de croissance des fibroblastes basiques (bFGF) et le facteur de croissance épidermique (EGF). Ce milieu facilite la prolifération cellulaire et maintient la souche des CSN obtenues à partir de la SVZ de cerveaux de souris adultes formant in vitro des agrégats clonaux, tridimensionnels et non adhérents appelés neurosphères9. Les cultures de la neurosphère servent de plate-forme contrôlée pour manipuler et étudier les mécanismes moléculaires et les facteurs affectant la prolifération, l’auto-renouvellement, la différenciation et la survie des NSC11. Notamment, le nombre de neurosphères primaires formées dans la culture permet d’estimer le nombre de NSC présentes dans la SVZ in vivo, ce qui en fait un outil puissant pour étudier les effets de différentes conditions sur le pool de NSC adultes12,13. De plus, une fois la culture primaire établie, les NSC peuvent générer de nouveaux agrégats (neurosphères secondaires) en passant par des divisions symétriques dans des conditions de prolifération14. Ainsi, l’ensemencement à faible densité de cellules neurosphériques secondaires (test clonal) peut être utilisé pour évaluer le taux d’auto-renouvellement de ces cultures 4,15,16,17.
Malgré le potentiel des neurosphères à découvrir les mécanismes régissant la régulation des CSN, certains chercheurs remettent en question la validité des résultats in vitro, affirmant que les conditions artificielles dans lesquelles les cellules se développent pourraient ne pas reproduire fidèlement le microenvironnement in vivo complexe des niches neurogènes 18,19,20,21,22. Un autre point controversé tourne autour de l’hétérogénéité observée dans les neurosphères. Néanmoins, on pense que cette variabilité reflète les divisions symétriques et asymétriques des CSN qui se produisent naturellement in vivo23,24. De plus, une validation récente a soutenu l’utilisation de cultures de NSC pour prédire les mécanismes opérant dans la niche neurogène de la SVZ in vivo, et plusieurs études ont démontré que les NSC cultivées in vitro maintiennent avec précision le profil transcriptomique observé in vivo11,25.
Par conséquent, les cultures de la neurosphère servent non seulement de méthode pour explorer les capacités de prolifération et de différenciation des NSC, mais offrent également un système pour étudier l’influence des gènes régissant la biologie des NSC. Une technique essentielle pour étudier la fonction des gènes dans les CSN est la perturbation de l’expression des gènes. Les siARN ou les gènes délivrés par les plasmides peuvent être transfectés dans des cultures cellulaires, ce qui entraîne l’inactivation ou la régulation positive du gène cible. Cette approche polyvalente réduit considérablement le temps et les coûts par rapport à l’établissement de cultures à l’aide de souris knock-out conditionnelles, ce qui présente une voie prometteuse pour démêler les bases génétiques de la neurogenèse et explorer des perspectives thérapeutiques. La modification de l’expression de gènes spécifiques dans les CSN permet de moduler leur comportement, influençant des processus biologiques cruciaux tels que la prolifération, la différenciation et la migration. Cependant, la perspective de transfecter des CSN, en particulier dans les neurosphères de souris, présente des défis notables. La structure tridimensionnelle des neurosphères compromet l’efficacité de la transfection, ce qui entraîne souvent de faibles taux d’administration réussie d’acides nucléiques exogènes, ce qui limite l’étendue de la manipulation génétique26,27. De plus, les procédures de transfection peuvent nuire à la viabilité et à la fonctionnalité des cellules27. Dans ce contexte, nous présentons le système de nucléofection comme une méthode pour atténuer les dommages cellulaires, atteignant un taux de survie élevé et assurant une plus grande efficacité dans les tests d’administration de gènes utilisés pour perturber les cultures de NSC.
Ce manuscrit vise à illustrer la procédure d’isolement, d’expansion et de nucléofectation des CSN de la niche neurogène SVZ adulte pour perturber les gènes à l’aide du système de culture de la neurosphère. Cette méthode surpasse l’efficacité des protocoles de transfection traditionnels, présentant des taux de survie nettement plus élevés et une efficacité améliorée de l’administration des gènes parmi les cellules ciblées.
Protocole
Toutes les expériences réalisées sur des animaux ont été préalablement approuvées par le Comité d’éthique de l’Université de Valence et autorisées par la Conselleria de Agricultura, Ganadería y Pesca, Generalitat Valenciana (Espagne).
1. Culture primaire des neurosphères
- Préparation des réactifs
- Préparez une solution tampon de tampon salin phosphate de Dulbecco (DPBS) dans de l’eau désionisée et stérilisez par autoclavage. Vous pouvez également préparer une solution de PBS de pH 7,4 de 0,1 M en ajoutant une solution de 137 mM de NaCl, 2,7 mM de KCl, 10 mM de Na2HPO4 et 1,8 mM de KH2PO4 dans de l’eau désionisée.
- Remplissez deux plaques à 12 puits avec des DPBS préalablement refroidis et conservez-les sur de la glace : l’une sera utilisée pour préserver l’ensemble du cerveau avant la dissection, et l’autre préservera les SVZ disséquées jusqu’au traitement des tissus.
- Préparez un mélange enzymatique contenant de la papaïne comme décrit ci-dessous.
- Préparer une solution de dissociation EDTA/L-cystéine dans une solution saline équilibrée Earl’s (EBSS) jusqu’à une concentration finale de 0,2 mg/mL chacune. Pour obtenir une dissolution complète, incubez le tube dans un bain-marie à 37 °C.
- Dissoudre 12 U/mL de papaïne dans une solution d’EDTA/L-cystéine. Considérez que 500 μL de solution enzymatique seront utilisés par cerveau.
- Introduire la solution de papaïne dans un bain-marie à 37 °C pendant environ 20 minutes jusqu’à ce que l’enzyme se dissolve complètement.
- Stérilisez le mélange enzymatique à l’aide d’une seringue et d’un filtre à pores de 0,22 μm et maintenez-le à 4 °C jusqu’à utilisation.
REMARQUE : Papain s’active après 30 min à 37 °C et peut être stocké pendant 12 h à 4 °C.
- Préparez le milieu de culture témoin en ajoutant la solution de mélange d’hormones conformément au tableau 1 et stérilisez-le par filtre à l’aide de filtres à pores de nitrocellulose de 0,22 μm. Maintenez le fluide à 4 °C et réchauffez-le au bain-marie à 37 °C avant utilisation.
- Préparez le milieu complet en complétant le milieu témoin avec de l’EGF et du bFGF juste avant de l’utiliser, conformément au tableau 1. Ne filtrez pas tout le milieu, car les mitogènes peuvent être perdus lors du filtrage.
- Extraction cérébrale et dissection de la SVZ
REMARQUE : Les souris ont libre accès à la nourriture et à l’eau avant l’euthanasie. On utilise des souris C57BL/6 âgées de 8 à 16 semaines. Les deux sexes sont utilisés sans différences notables dans la préparation.- Stérilisez les outils de dissection par autoclave avant la chirurgie. Ensuite, immergez des scalpels, des pinces à épiler, des ciseaux et des spatules dans un bécher rempli à 70 % d’éthanol. Nettoyez soigneusement chaque surface de travail avec de l’éthanol à 70 %.
- Sacrifiez la souris par surdosage de CO2 et confirmez par luxation cervicale. Vaporisez la tête avec de l’éthanol à 70 % pour minimiser le risque de contamination des tissus cérébraux.
- Séparez la tête de la souris du reste du corps à l’aide de ciseaux. Coupez la peau au-dessus du crâne avec de petits ciseaux le long de l’axe rostro-caudal, jusqu’à ce que le crâne soit complètement découvert.
- Exposez le cerveau en coupant d’abord le crâne le long de la suture sagittale avec de petits ciseaux, puis retirez les os à l’aide d’une pince à épiler fine. Veillez à ne pas causer de dommages au tissu cérébral sous le crâne lors de cette étape.
- Extrayez soigneusement le cerveau du crâne à l’aide d’une spatule et placez-le dans une plaque à 12 puits contenant du DPBS froid. Gardez la plaque sur de la glace jusqu’à ce que la dissection soit terminée.
- Transférez tout le cerveau sur le tampon de silicium où la dissection aura lieu et appliquez quelques gouttes de DPBS froid sur le cerveau (Figure 1A).
- À l’aide d’un scalpel, on enlève l’OB situé à l’extrémité rostrale du cerveau et le cervelet situé dans la partie caudale tout en conservant la partie centrale du cerveau contenant les deux ventricules latéraux (Figure 1B).
- Divisez le cerveau le long de la fissure longitudinale en deux hémisphères, puis procédez à la dissection des deux hémisphères séparément (Figure 1C).
- En travaillant avec un hémisphère, réorientez-le de manière à ce que la zone médiane soit tournée vers le haut. Ouvrez le cerveau le long de la ligne du corps calleux, séparant le cortex et le striatum de l’hippocampe, du septum et du diencéphale, exposant ainsi les ventricules latéraux (Figure 1D).
REMARQUE : La SVZ est située entre la cavité du ventricule et le striatum, de sorte que les étapes suivantes visent à isoler la SVZ aussi précisément que possible des tissus environnants. - Retirez l’hippocampe, le septum et le diencéphale en suivant la limite ventrale des ventricules (Figure 1E, F), le tissu au-delà des extrémités rostrale et caudale de la SVZ (Figure 1G) et le cortex suivant le corps calleux (Figure 1H, I).
- Inclinez le tissu de manière à ce que la ZVS soit tournée vers le côté (Figure 1J), ce qui permet d’enlever le tissu striatal sous la ZVS (Figure 1K) pour obtenir un mince morceau de tissu contenant les CSN (Figure 1L).
- Stockez les deux SVZ disséquées de la même souris dans une plaque à 12 puits contenant des DPBS froids et stériles jusqu’à ce que le traitement des tissus commence.
REMARQUE : La dissection des deux SVZ d’un cerveau devrait prendre 10 min. Un temps plus long peut affecter la viabilité cellulaire. Si un rendement accru des cultures est nécessaire, les SVZ de plusieurs souris du même âge, du même sexe, du même patrimoine génétique et du même génotype peuvent être regroupées.
- Isolement et ensemencement des CSN
- Coupez chaque SVZ en 4-5 petits morceaux pour faciliter la désagrégation du tissu.
REMARQUE : À partir de cette étape, l’ensemble de la procédure doit être effectué dans des conditions stériles dans une hotte à flux laminaire. - Transférez les SVZ hachés dans un tube à centrifuger de 15 mL à l’aide d’une pipette Pasteur en plastique stérile. Assurez-vous qu’il ne reste aucun fragment dans l’assiette.
- Laissez le tissu sédimenter au fond du tube et retirez le DPBS restant.
- Ajouter 500 μL de mélange enzymatique filtré contenant de la papaïne par cerveau (2 SVZ) et incuber les tubes dans un bain-marie à 37 °C pendant 30 min.
- Après l’incubation, ajouter 5 mL de milieu témoin préchauffé à 37 °C à chaque échantillon.
- Centrifuger les échantillons à 300 x g pendant 5 min. Ensuite, retirez délicatement le surnageant à l’aide d’une micropipette ou d’une pompe à vide.
- Ajouter 1 mL de milieu témoin et désagréger soigneusement mécaniquement la pastille, en pipetant de haut en bas de 10x à 20x, à l’aide d’une pipette en verre Pasteur polie au feu jusqu’à l’obtention d’une suspension cellulaire homogène.
ATTENTION : Il s’agit de l’une des étapes les plus critiques du protocole, car une désagrégation excessive ou insuffisante affectera négativement le rendement des cultures. - Ajouter 4 mL de milieu témoin et mélanger par inversion pour laver les cellules. Centrifugeuse à 300 x g pendant 5 min. Ensuite, retirez le surnageant.
- Ajouter 1 mL de milieu complet et remettre la pastille en suspension en pipetant de haut en bas 10 fois pour homogénéiser la suspension cellulaire.
- Comptez la suspension cellulaire à l’aide d’une chambre Neubauer sous le microscope après avoir dilué 1/2 une aliquote de la suspension cellulaire avec du bleu de trypan ou utilisez un compteur automatique de cellules. Assurez-vous que les cultures sont désagrégées au niveau de la cellule unique.
- Une fois la suspension cellulaire préparée, ensemencez les cellules obtenues également dans 8 puits d’une plaque de 48 puits dans un volume final de 500 μL de milieu complet.
REMARQUE : Nous obtenons habituellement 20 000 cellules de deux ZV, ce qui donne une densité de semis finale d’environ 2 500 cellules/mL pour obtenir le rendement maximal en cultures.
- Coupez chaque SVZ en 4-5 petits morceaux pour faciliter la désagrégation du tissu.
- Formation des neurosphères
- Incuber des cellules pendant 5 à 7 jours in vitro (DIV) dans un incubateur humidifié à 37 °C et 5% de CO2. Dans ces conditions, les cellules différenciées meurent tandis que les NSC et les progéniteurs prolifèrent en réponse à la stimulation mitogénique, formant des agrégats clonaux reconnus comme des neurosphères primaires.
REMARQUE : EGF ou bFGF peuvent être utilisés pour induire la formation de neurosphères. Cependant, ces deux facteurs de croissance ne sont pas entièrement substituables. - Vérifiez la taille des neurosphères à l’aide d’une caméra couplée à un microscope inversé, et une fois que les neurosphères atteignent une plage de taille de 50 à 100 μm, comptez toutes les neurosphères primaires formées dans le puits à un grossissement de 10x. Le nombre total de neurosphères primaires formées sert d’estimation du nombre de NSC présentes dans la niche SVZ.
- Après une période de 10 jours, prélever le milieu de culture de chaque puits pour commencer le passage. Effectuez un passage ultérieur après 5 à 7 DIV, bien qu’il soit intéressant de noter que les sphères primaires peuvent nécessiter une durée légèrement plus longue pour atteindre la taille idéale pour la sous-culture (environ 100 μm).
- Incuber des cellules pendant 5 à 7 jours in vitro (DIV) dans un incubateur humidifié à 37 °C et 5% de CO2. Dans ces conditions, les cellules différenciées meurent tandis que les NSC et les progéniteurs prolifèrent en réponse à la stimulation mitogénique, formant des agrégats clonaux reconnus comme des neurosphères primaires.
Tableau 1 : Solutions de milieux de culture. La recette du milieu de contrôle est décrite. Une solution de mélange d’hormones pré-mélangée est fabriquée. Les solutions hormonales mères peuvent être préparées à l’avance comme indiqué et conservées à -20 °C. Avant la culture cellulaire, complétez le milieu témoin avec de l’EGF et du bFGF pour préparer un milieu complet. Les spécifications de stockage, les stocks et les concentrations de travail sont fournis pour chaque composant. Veuillez cliquer ici pour télécharger ce tableau.
2. L’expansion des cultures de la neurosphère
- Passage des neurosphères
- Prélever le milieu contenant les neurosphères des plaques multipuits et les transférer dans un tube à centrifuger de 15 ml. Assurez la récupération d’un maximum de cellules en rinçant les puits avec quelques millilitres de DPBS.
- Centrifuger les neurosphères pendant 5 min à 300 x g. Ensuite, retirez le surnageant.
- Ajoutez 200 μL de solution enzymatique (voir Tableau des matériaux) à la pastille et tapotez doucement le fond du tube pour la déloger. Incuber 10 min à température ambiante pour faciliter la dissociation des neurosphères.
- Ajouter 1 mL de milieu témoin pour arrêter la réaction enzymatique et dissocier mécaniquement les neurosphères avec une micropipette P1000 en pipetant de haut en bas de 10x à 20x.
- Ajouter un volume supplémentaire de 4 mL du milieu témoin et mélanger par inversion pour laver les cellules.
- Centrifuger les cellules pendant 5 min à 300 x g. Ensuite, retirez le surnageant.
- Ajouter 1 mL de milieu complet et remettre la pastille en suspension pour homogénéiser la suspension cellulaire en pipetant de haut en bas 10x.
REMARQUE : Si le nombre et la taille d’origine des neurosphères sont trop élevés, ajoutez plus de milieu complet pour diluer la suspension cellulaire assurant un nombre fiable de cellules. - Comptez la suspension cellulaire à l’aide d’une chambre Neubauer après avoir dilué 1/2 une aliquote de la suspension cellulaire avec du bleu trypan ou utilisez un compteur automatique de cellules.
- Pour élargir la culture cellulaire, semez des cellules à une densité de 10 000 cellules/cm2 en utilisant un milieu complet dans une plaque ou un flacon de culture approprié (voir tableau 2).
- Incuber des cellules pour 5 à 7 DIV dans un incubateur humidifié à 37 °C et 5% de CO2 pour chaque passage.
REMARQUE : Les cultures de la neurosphère peuvent être constamment étendues et propagées par des sous-cultures répétées, ne dépassant pas 10 passages, sans altérer leurs capacités de prolifération. L’EGF ou le bFGF peuvent être utilisés pour la culture ; cependant, l’expansion à long terme des cultures ne peut être réalisée qu’en présence du FEM.
- Test d’auto-renouvellement
- Après avoir passé des cultures de neurosphère, mettez en plaque 1 000 cellules individuelles dans une plaque de 96 puits, complétant jusqu’à un volume final de 200 μL avec un milieu complet, ce qui donne une densité cellulaire finale des cultures de 5 cellules/μL.
REMARQUE : Le nombre de cellules ensemencées doit être aussi précis que possible. Si nécessaire, préparez des dilutions intermédiaires pour assurer un volume de suspension cellulaire fiable avant le placage. De plus, il est recommandé de plaquer 4 à 5 répétitions par condition pour réduire la variabilité technique. - Incuber des cellules à 37 °C et 5 % de CO2 dans un incubateur humidifié pendant 5 jours ou jusqu’à ce que les neurosphères atteignent une taille adéquate (60 à 100 μm). Évitez de déplacer ou de secouer la plaque multipuits pour éviter l’agrégation de la neurosphère.
- Après la formation des neurosphères, comptez le nombre de neurosphères formées dans chaque puits à l’aide d’un microscope à contraste de phase inversé équipé d’une caméra attachée. Le test d’auto-renouvellement peut être effectué séparément à l’aide de l’EGF ou du bFGF.
- Après avoir passé des cultures de neurosphère, mettez en plaque 1 000 cellules individuelles dans une plaque de 96 puits, complétant jusqu’à un volume final de 200 μL avec un milieu complet, ce qui donne une densité cellulaire finale des cultures de 5 cellules/μL.
- Cryoconservation des cultures de NSC
REMARQUE : Les cultures de la neurosphère peuvent être cryoconservées pour une utilisation future, minimisant ainsi le nombre de souris nécessaires. Nous recommandons de conserver les cellules jusqu’au passage 10.- Pour cryoconserver les cellules, transférez 1 mL de la suspension cellulaire dans un milieu complet dans un cryotube correctement étiqueté.
- Ajoutez du diméthylsulfoxyde (DMSO) à une concentration finale de 10 % à la suspension cellulaire et mélangez doucement en inversant les tubes.
REMARQUE : Le DMSO sert de cryoprotecteur mais peut être toxique pour les cellules, donc cette étape doit être effectuée rapidement. - Placez les tubes dans un congélateur à -80 °C à l’aide d’un récipient de congélation qui permet une diminution progressive de la température à 1 °C/min. Ce processus de congélation progressive permet d’éviter les dommages cellulaires causés par la formation de cristaux de glace lors de la cryoconservation. Pour un stockage à long terme, maintenez les tubes dans un réservoir d’azote liquide à -196 °C.
- Décongélation des cultures NSC
REMARQUE : Au besoin, les cellules peuvent être décongelées et les cultures peuvent être agrandies à nouveau pour les expériences.- Retirez les cryotubes contenant des NSC congelés du réservoir de stockage d’azote liquide et placez-les immédiatement dans un bain-marie à 37 °C jusqu’à ce qu’ils soient complètement décongelés, environ 5 min.
ATTENTION : Il est crucial de minimiser le temps de bain car le DMSO est toxique et peut affecter la viabilité cellulaire. - Transférez rapidement les cellules décongelées dans un tube à centrifuger de 15 mL contenant 5 mL de milieu témoin préchauffé.
- Centrifugez les cellules à 300 x g pendant 5 min et retirez le surnageant. Ajouter 1 mL de milieu complet et remettre la pastille en suspension en pipetant doucement de haut en bas 10 fois pour homogénéiser la suspension cellulaire avant l’ensemencement.
REMARQUE : La décongélation peut affecter la viabilité cellulaire ; Par conséquent, il est recommandé de passer les cellules au moins une fois avant de les ensemencer pour de nouvelles expériences.
- Retirez les cryotubes contenant des NSC congelés du réservoir de stockage d’azote liquide et placez-les immédiatement dans un bain-marie à 37 °C jusqu’à ce qu’ils soient complètement décongelés, environ 5 min.
- Test des mycoplasmes
REMARQUE : La contamination par les mycoplasmes peut compromettre la santé des cellules, affectant les taux de croissance. Par conséquent, l’analyse des mycoplasmes est cruciale pour garantir l’intégrité et la fiabilité des expériences.- Extraction de l’ADN
- Prélever un minimum de 100 μL de la culture cellulaire pour l’extraction de l’ADN. Le surnageant et la pastille cellulaire peuvent être utilisés pour l’extraction de l’ADN. Conservez cette aliquote à -20 °C jusqu’à l’extraction.
- Percez le couvercle du tube et faites bouillir l’aliquote à 99 °C pendant 15 min à l’aide d’un thermobloc.
REMARQUE : Le perçage des couvercles des tubes empêche l’ouverture des tubes lors de l’ébullition à haute température. - Centrifugeuse pendant 5 min à 16 900 x g. Transférez le surnageant contenant l’ADN dans un nouveau tube. Conservez le tube contenant l’ADN à -20 °C jusqu’au test PCR.
- PCR pour la détection des mycoplasmes
- Préparez le mélange PCR à l’aide des composants suivants : 8,9 μL d’eau exempte de nucléases, 3 μL de tampon réactionnel 5x, 1,2 μL de 25 mM de MgCl2, 0,25 μL de 2,5 mM de dNTPs, 0,15 μL de Taq polymérase et 0,25 μL de chaque amorce spécifique du mycoplasme à une concentration de 10 μM (Forward, Fw : 5'GATGTTTAGCCGGGTCGAGAG3' et Inverse, Rv : 5'GATGTCAAGAGTGGGTAAGGTT3').
- Ajouter 1 μL d’ADN génomique extrait. Préparez le mélange PCR dans une hotte à flux laminaire pour éviter la contamination de l’ADN.
- Incuber la réaction dans un thermocycleur comme suit : dénaturation initiale à 95 °C pendant 5 min suivie de 35 cycles de dénaturation à 95 °C pendant 30 s, de recuit à 53 °C pendant 1 min, d’extension à 72 °C pendant 30 s et d’extension finale à 72 °C pendant 5 min.
- Pour identifier la taille de la bande résultante (environ 500 pb), chargez 15 μL du produit PCR d’ADN mélangé à 3 μL de solution de colorant de chargement 6x sur un gel d’agarose à 2 % et exécutez l’électrophorèse pendant 40 à 50 min à 100 V.
- Extraction de l’ADN
Tableau 2 : Plaques et flacons utilisés pour la culture. Les dimensions et les volumes des plaques et des flacons de semis les plus couramment utilisés sont fournis. Le tableau comprend le diamètre, l’aire de croissance et le volume moyen utilisés pour chaque récipient, ainsi qu’un exemple du nombre de CSN à ensemencer dans des conditions d’expansion (10 000 cellules/cm2). Veuillez cliquer ici pour télécharger ce tableau.
3. Nucléofection des cultures de la neurosphère
- Préparation des réactifs
- Préparation de l’ADN
- Préparez 25 μL de cellules DH5α d’E. coli compétentes dans un tube de 1,5 mL pour la transformation.
- Ajouter 1 μL du plasmide d’intérêt (à 100 à 200 ng/μL) aux cellules et les soumettre à un choc thermique à 42 °C pendant 45 s. Ici, un plasmide contenant un (sh)RNA en épingle à cheveux courte pour réduire au silence l’expression de Snrpn et un plasmide témoin shSCRAMBLE sont utilisés.
REMARQUE : Gardez les cellules compétentes sur la glace tout au long de la procédure pour maintenir l’efficacité de la transformation. - Plaquez les cellules transformées sur des plaques de gélose LB avec l’antibiotique approprié et incuberez-les à 37 °C pendant 18 h. Gardez les boîtes de Pétri inversées pour éviter la formation de gouttelettes dues à la condensation, qui pourraient perturber les colonies bactériennes.
REMARQUE : Ajouter des antibiotiques appropriés au milieu de culture LB pour permettre exclusivement la croissance des bactéries transformées. - À l’aide d’une pointe de pipette stérile, prélever des colonies bactériennes individuelles et les transférer dans un erlenmeyer préalablement rempli de 250 mL de LB pour initier une culture liquide. Évitez de choisir de petites colonies satellites positionnées autour des grandes colonies cibles, car elles n’auraient peut-être pas incorporé le plasmide souhaité.
- Incuber le ballon en l’agitant vigoureusement sur un agitateur orbital à 37 °C pendant la nuit.
- Utilisez un kit maxiprep sans endotoxines et extrayez l’ADN plasmidique pur des cultures bactériennes en suivant les instructions du fabricant. Reconstituer l’ADN dans le volume approprié d’eau exempte d’endotoxines pour obtenir une concentration plasmidique de 1 à 2 μg/μL.
REMARQUE : Le rendement maxiprep dépend de la croissance de la culture. Habituellement, la remise en suspension de la pastille d’ADN plasmidique dans un volume de 200 μL permet d’obtenir la concentration d’ADN souhaitée. - Conservez le tube contenant l’ADN plasmidique à -20 °C jusqu’à utilisation. Préparez un tube de 1,5 mL d’un volume final de 5 μL contenant 2 à 6 μg d’ADN plasmidique destiné à la nucléofection.
- Préparation du matériel
- Préparez la solution de nucléofection. Si vous utilisez le kit recommandé (voir le tableau des matériaux), préparez 95 μL de la solution de nucléofection dans un tube de 1,5 mL pour chaque nucléofection désirée. Les pipettes et les cuvettes sont généralement incluses dans le kit. Préparez un exemplaire de chaque pour chaque condition de nucléofection.
- Préparez une fiole T25 remplie de 4 ml de milieu complet préchauffé par condition et conservez-la dans l’incubateur jusqu’à ce qu’elle soit utilisée.
- Préparation de l’ADN
- Nucléofection des CSN
- Utilisez 1 à 2 x 106 cellules individuelles par condition pour l’évaluation. Centrifugez les cellules pendant 5 min à 300 x g, puis retirez le surnageant.
- Ajouter 1 mL de DPBS et remettre la pastille en suspension en pipetant 10 fois de haut en bas pour assurer une suspension cellulaire homogène.
- Répéter la centrifugation (étape 2.1.6) pour un deuxième lavage et enfin remettre la pastille en suspension dans 95 μL de solution de nucléofection.
REMARQUE : Les étapes de lavage sont cruciales pour éliminer les antibiotiques du milieu de contrôle et assurer une nucléofection efficace. - Combinez les 95 μL de cellules avec une solution prémélangée contenant 5 μL de chaque plasmide (2 μg au total) sélectionné pour la nucléofection.
- À l’aide d’une micropipette P200, transférez cette solution dans une cuvette et placez-la dans le dispositif nucléofecteur.
- Nucléofect les cellules avec les plasmides souhaités à l’aide du programme NSC optimisé du système nucléofecteur.
- Une fois l’électroporation terminée, introduisez soigneusement le milieu complet chaud dans la cuvette à l’aide des pipettes Pasteur fournies dans le kit. Ensuite, transférez le contenu de la cuvette dans une fiole T25 préalablement préparée contenant un milieu complet préchauffé. Après l’électroporation, il peut y avoir mort cellulaire, précipitation de l’ADN et formation d’un agrégat visqueux. Évitez de le transférer dans la fiole T25, car cela pourrait réduire la survie cellulaire.
REMARQUE : Cette étape est cruciale et doit être effectuée le plus rapidement possible pour assurer un rendement élevé de nucléofection et la survie ultérieure de la culture. - Incuber des cellules nucléofectées à 37 °C et 5 % de CO2 dans un incubateur humidifié pendant 3 à 5 jours.
- Sélection de cellules nucléofectées
- Stratégie A : Sélection par cytométrie en flux par tri cellulaire activé par fluorescence (FACS)
- Après 3 à 5 jours de nucléofection, passer les cultures nucléofectées en suivant l’étape 2.1 et prélever toutes les cellules individualisées obtenues.
- Filtrez les échantillons à travers une crépine cellulaire de 40 μm pour éliminer les agrégats cellulaires et analysez-les avec le cytomètre en flux du trieur de cellules.
REMARQUE : Il est crucial de trier le même nombre de cellules dans chaque condition pour obtenir des résultats comparatifs. - À l’aide du logiciel du cytomètre, les cellules vivantes se basent sur deux mesures : la lumière diffusée vers l’avant (FSC-A) qui correspond à la taille de la cellule et la lumière diffusée latérale (SSC-A) qui correspond à la complexité intracellulaire. Sélectionner la population de cellules vivantes caractérisée par un FSC-A élevé et un SSC-A élevé.
REMARQUE : Si vous le souhaitez, ajoutez 0,1 μg/mL de 4′,6-diamidino-2-phénylindole (DAPI) à la suspension cellulaire avant le tri. Cela permettra d’éliminer les cellules mortes et les corps apoptotiques du porte. - Éliminez les doublets et triplets de cellules en traçant les paramètres FSC-A et FSC-H. Choisissez les événements inclus dans la diagonale du graphique, représentant les maillots.
REMARQUE : Lorsque les cellules passent à travers le laser, le cytomètre détecte les changements de tension au fil du temps. FSC-A représente la zone du signal et FSC-H signifie la hauteur de crête. Les singlets présentent une relation proportionnelle entre FSC-A et FSC-H (situés sur la diagonale du graphique), tandis que les agrégats de cellules présentent une FSC-A plus élevée par rapport au FSC-H en raison d’un signal plus long. - Sélectionner les cellules nucléofectées en fonction de l’intensité de fluorescence du gène rapporteur codé par le plasmide utilisé. Par exemple, lors de l’utilisation de la GFP+, les cellules peuvent être sélectionnées en fonction des niveaux de fluorescence FITC-A par rapport au tracé SSC-A.
- Isolez le nombre souhaité de cellules cibles pour chaque condition et collectez-les directement dans un tube de collecte rempli d’un milieu complet.
- CSN nucléofectées à une densité de 10 000 cellules/cm2. Incuber les cultures cellulaires triées à 37 °C et 5 % de CO2 dans un incubateur humidifié.
- Stratégie B : Sélection à l’aide de la résistance aux antibiotiques codée dans le plasmide
- Après 48 h de nucléofection, ajoutez la concentration d’antibiotiques appropriée pour sélectionner les cellules résistantes.
REMARQUE : Avant de commencer, il est recommandé de tester plusieurs concentrations de l’antibiotique sur des cellules non nucléofectées. La concentration optimale d’antibiotiques est la quantité la plus faible à laquelle toutes les cellules non résistantes sont éliminées. Par exemple, nous avons déterminé une concentration optimale de 4 μg/mL d’antibiotique blasticidine pour les cultures de NSC. - Incuber les cellules à 37 °C et 5 % de CO2 dans un incubateur humidifié pendant 48 h.
- Après 48 h de traitement antibiotique, sous-culture des cellules nucléofectées selon l’étape 2.1. Si les neurosphères restent petites, retirer l’antibiotique du milieu de culture par centrifugation à 300 x g pendant 5 min. Remettre les cellules en suspension et les cultiver dans une fiole en utilisant uniquement un milieu complet. Incuber les cellules à 37 °C et 5 % de CO2 dans un incubateur humidifié jusqu’à ce qu’elles puissent être dilatées après l’étape 2.1.
- Après 48 h de nucléofection, ajoutez la concentration d’antibiotiques appropriée pour sélectionner les cellules résistantes.
- Stratégie A : Sélection par cytométrie en flux par tri cellulaire activé par fluorescence (FACS)
Résultats
Des conditions de culture optimales permettent l’isolement et l’expansion in vitro de CSN adultes dérivés de la SVZ
Les cultures de CSN dérivées de la SVZ adulte ont servi de méthode in vitro précieuse pour étudier les mécanismes moléculaires et les signaux de niche régulant les CSN dans leurs microenvironnements spécifiques. Le test de la neurosphère décrit dans ce manuscrit a été utilisé pour examiner le nombre de NSC dans la SVZ adulte. Le tissu SVZ a été isolé à partir du cerveau de souris âgées de 3 mois, dissocié et cultivé dans un milieu NSC complet complété par EGF et bFGF ou chacun séparément. Après 10 jours in vitro (DIV), le nombre total de sphères primaires formées dans ces trois conditions de culture distinctes a été quantifié à l’aide de la microscopie à contraste de phase (Figure 2A,B). Remarquablement, nos résultats démontrent que la présence d’EGF a conduit à la formation maximale de sphères primaires, ce qui est évident à partir du nombre réduit de sphères primaires observé dans les cultures avec uniquement bFGF (Figure 2A,B). Pour évaluer la capacité d’auto-renouvellement des CSN dans des conditions de milieu variées, des cellules ont été sous-cultivées et plaquées à faible densité (5 cellules/μL) dans des milieux complétés par les combinaisons de mitogènes susmentionnées. La quantification des sphères secondaires a révélé que les CSN SVZ ont besoin d’au moins EGF pour s’auto-renouveler efficacement et que la combinaison de l’EGF et du bFGF améliore la capacité d’auto-renouvellement des cellules (Figure 2B). De plus, pour une analyse détaillée de la dynamique de croissance dans diverses conditions de milieux, le nombre de cellules ensemencées et obtenues à travers 7 passages a été enregistré. Les courbes de croissance obtenues à partir de différentes conditions de milieu ont confirmé que les cultures supplémentées en EGF seul ou en combinaison avec le bFGF présentaient une meilleure dynamique de croissance par rapport aux cultures supplémentées uniquement en bFGF (Figure 2C). Collectivement, ces résultats confirment que l’utilisation concomitante de l’EGF et du bFGF améliore le rendement de la culture des NSC in vitro.
Afin d’étudier le nombre de NSC au sein de la SVZ à différents âges postnatals et d’évaluer l’impact du vieillissement des souris sur l’efficacité de la culture de la neurosphère, des tissus SVZ de souris âgées de 1 mois à 12 mois ont été disséqués. Notamment, nos résultats ont révélé une baisse significative du nombre de sphères primaires avec l’âge, mettant en évidence une efficacité maximale du nombre de sphères vers l’âge de 2 à 4 mois (Figure 2D). De plus, afin d’évaluer la capacité d’auto-renouvellement des CSN pendant la sous-culture, des CSN de souris âgées de 2 à 4 mois ont été sous-cultivées et ensemencées à une densité clonale (5 cellules/μL) dans un milieu complet. La quantification du nombre de sphères secondaires tout au long des passages subséquents a indiqué une diminution considérable de l’efficacité de la culture au fil des passages (figure 2E). Sur la base de toutes ces observations, il est recommandé d’effectuer des tests d’auto-renouvellement lors des premiers passages afin d’optimiser davantage les conditions de culture des NSC.
La nucléofection est une technique très efficace pour manipuler l’expression des gènes dans les CSN adultes
Étant donné que les CSN ne sont pas facilement transfectables, pour manipuler l’expression des gènes, nous présentons ici un protocole de nucléofection avec un taux plus élevé de délivrance réussie de gènes sans qu’il soit nécessaire d’utiliser la transduction virale. Après la dissection et la culture de SVZ individuelles de souris âgées de 2 à 4 mois, les NSC ont été nucléofectées avec un plasmide porteur de GFP comme décrit (Figure 3A). La détection de cellules positives à la GFP 2 jours après la nucléofection a révélé une efficacité allant de 30 % à 50 %, ce qui correspond à la littérature antérieure28. Afin d’isoler spécifiquement les CSN nucléofectées avec succès, les cellules ont été triées par FACS en fonction de l’intensité de fluorescence de la GFP 3 à 5 jours après la nucléofection (Figure 3A-C). Environ 40 % des cellules analysées avant l’étude FACS présentaient des niveaux élevés de fluorescence GFP et ont ensuite été sélectionnées par tri (figure 3C). Le réensemencement des CSN GFP+ triées a montré que toutes les cellules étaient positives à la GFP, validant la méthode d’isolement cellulaire basée sur la nucléofection (Figure 3D). Notamment, les CSN nucléofectées ont maintenu leur viabilité lors des passages ultérieurs, confirmant la faisabilité de la nucléofection pour les CSN adultes. Ces résultats soulignent l’efficacité de la combinaison de la nucléofection et de la FACS pour établir une culture pure de NSC modifiées.
À titre d’exemple de modulation génique dans les CSN adultes, l’atténuation génique par nucléofection de l’ARN en épingle à cheveux courte (sh) a été utilisée. Plus précisément, un shRNA ciblant le gène du polypeptide N de la petite ribonucléoprotéine nucléaire (Snrpn), porteur d’un rapporteur CAG-GFP (SHSNRPN), A ÉTÉ NUCLÉOFECTÉ DANS DES CULTURES DE NSC DÉRIVÉES DE SOURIS ÂGÉES DE 2 MOIS. La régulation négative de Snrpn a été confirmée par qPCR et immunocytochimie dans les cellules nucléofectées avec le plasmide shSNRPN, mais pas pour le plasmide témoin shSCRAMBLE (Figure 3E,F)29. Pour élucider les effets de la régulation négative de Snrpn sur la capacité d’auto-renouvellement des NSC, un test à faible densité a été réalisé dans des cellules nucléofectées (Figure 3F,G). La quantification des neurosphères secondaires dans les cultures nucléofectées a révélé une augmentation de la capacité de formation des neurosphères lors de la régulation négative de Snrpn (Figure 3G). Ce test souligne la capacité de nucléofection à manipuler l’expression des gènes dans les CSN adultes et, plus précisément, identifie le rôle de Snrpn dans le maintien de la souche dans les CSN adultes.
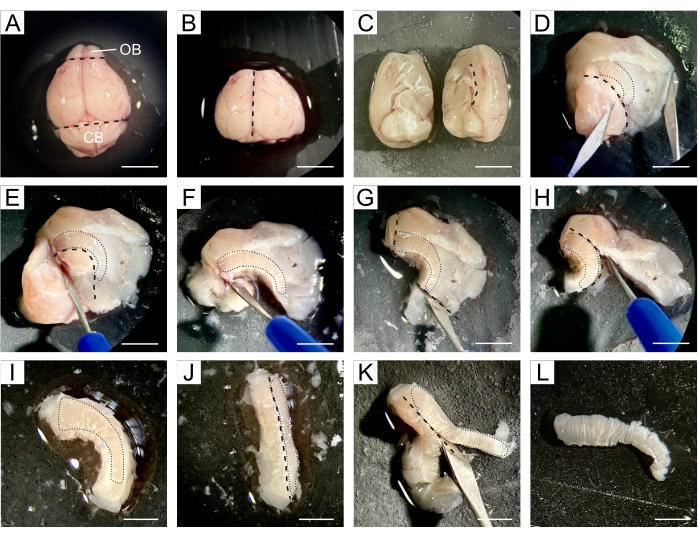
Figure 1 : Description détaillée de la dissection SVZ. (A) Après avoir retiré le cerveau de la souris, le cerveau entier est transféré avec DPBS sur un tampon en silicium pour la dissection. (B) L’OB et le cervelet sont retirés du cerveau à l’aide d’un scalpel. (C) Le cerveau est divisé en deux hémisphères pour procéder à la dissection séparément. (D) Le cerveau est ouvert le long de la ligne du corps calleux, séparant le cortex et le striatum de l’hippocampe, du septum et du diencéphale, exposant ainsi les ventricules latéraux. (E-F) L’hippocampe, le septum et le diencéphale sont retirés le long de la limite ventrale des ventricules. (G-I) Le tissu au-delà des extrémités rostrale et caudale de la SVZ et du cortex est retiré à la suite du corps calleux. (J-K) Le tissu est incliné de manière à ce que la ZVS soit tournée vers le côté, ce qui permet d’enlever le tissu striatal sous la ZVS. (L) On obtient un mince morceau de tissu contenant la SVZ. Des lignes pointillées noires indiquent le site de coupe. Des pointillés noirs indiquent l’emplacement de la SVZ à chaque étape. Abréviations : OB = bulbe olfactif ; CB = cervelet. Barre d’échelle en A-H : 5 mm ; en I-L : 3 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
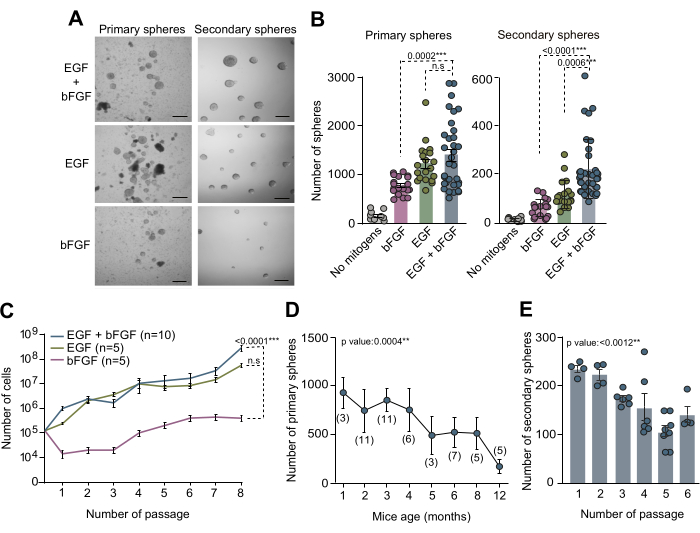
Figure 2 : Les mitogènes EGF et bFGF sont nécessaires pour une culture et une expansion optimales des NSC in vitro. (A) Images de microscopie à contraste de phase de cultures de neurosphères primaires et secondaires dans un milieu NSC complétées à la fois par EGF et bFGF ou chaque mitogène séparément. (B) Nombre de sphères primaires obtenues par souris et par puits en fonction de la composition en mitogènes du milieu de culture : pas de mitogènes (gris, n=9), EGF+bFGF (bleu, n=33), uniquement EGF (vert, n=20), ou seulement bFGF (rose, n=19 ; panneau de gauche). Nombre de neurosphères secondaires formées à faible densité (5 cellules/μL) par puits en fonction de la composition en mitogènes du milieu de culture) : pas de mitogènes (gris, n=11), bFGF (rose, n=18), EGF (vert, n=18) ou EGF+bFGF (bleu, n=37 ; panneau de droite). Le test de Kruskal-Wallis avec l’analyse post hoc de Dunn a été utilisé. (C) Courbes de croissance montrant le nombre total de cellules formées après 8 passages dans des cultures de neurosphères distinctes en fonction des mitogènes présents dans le milieu de culture : bFGF (rose, n=5), EGF (vert, n=5) ou EGF+bFGF (bleu, n=10). Une analyse de régression linéaire a été utilisée. (D) Le nombre de neurosphères primaires dérivées de souris individuelles disséquées et désagrégées d’animaux à divers stades de développement postnatal. Une analyse de régression linéaire a été utilisée. n indiqué entre parenthèses. (E) Le nombre de neurosphères secondaires formées à faible densité (5 cellules/μL) par des passages subséquents in vitro pour évaluer leur capacité d’auto-renouvellement. Le test de Kruskal-Wallis a été utilisé, et les valeurs p sont incluses : * : p<0,05 ; ** : p<0,01 ; : p<0.001 ; Réf. <0.0001. N.S : non significatif. Les barres d’erreur représentent le MEB. La barre d’échelle en A est de 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
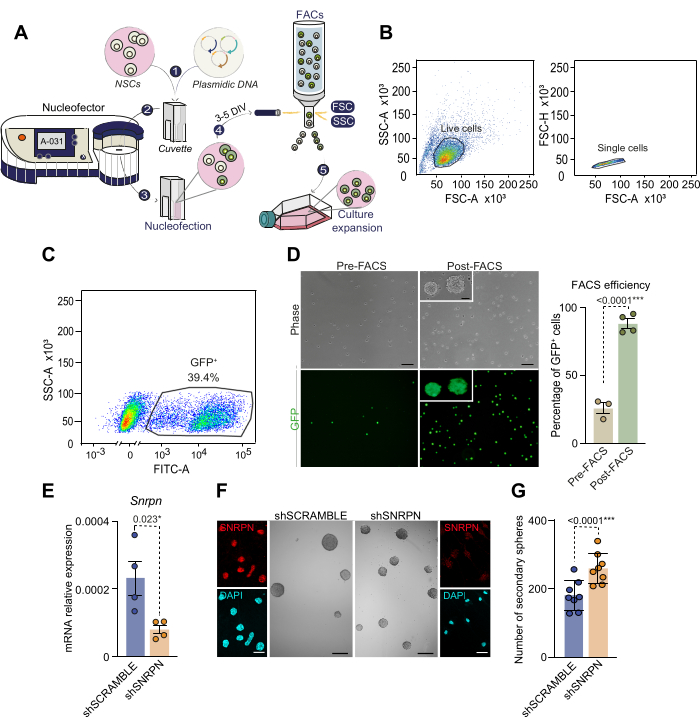
Figure 3 : Schéma du processus de nucléofection et sélection de cellules nucléofectées basée sur FACS. (A) Vue d’ensemble du processus de nucléofection et de la sélection cellulaire des cellules nucléofectées basée sur FACS. 1) La solution d’ADN plasmidique est combinée avec la solution de nucléofection et ajoutée aux cellules. Ce mélange est ensuite transféré dans une cuvette pour la nucléofection. 2) La cuvette contenant l’ADN et les cellules est insérée dans le nucléofecteur, où un choc électrique est appliqué. Pour les cultures de la neurosphère isolées de la SVZ adulte, nous recommandons d’utiliser le programme A-031 NSC. 3) Après la nucléofection, les cellules sont transférées dans un flacon contenant un milieu complet complété par de l’EGF et du bFGF. 4) Les cellules sont triées par FACS en fonction de l’expression du rapporteur contenu dans l’ADN plasmidique. 5) Les cellules triées subissent une culture supplémentaire pour des expériences ultérieures. (B) Stratégie de sélection basée sur FACS et contrôle pour les NSC nucléofectés. Tout d’abord, les cellules vivantes sont sélectionnées en fonction d’une FSC-A élevée et d’une SSC-A élevée (graphique de gauche), puis les doublets et triplets de cellules sont éliminés en analysant les paramètres FSC-A par rapport aux paramètres FSC-H (graphique de droite). (C) Déclenchement FACS pour les cellules nucléofectées en fonction de leur expression GFP (fluorescence SSC-A versus FITC-A). (D) Microscopie à contraste de phase et images de fluorescence GFP des NSC nucléofectés avant (n = 3) et après (n = 4) sélection FACS (panneau de gauche). Le pourcentage de cellules GFP+ nucléofectées est représenté avant et après la sélection FACS (panneau de droite). Le test T a été utilisé. (E) Analyse quantitative par PCR (qPCR) de l’expression de Snrpn dans les NSC proliférantes nucléofectées avec des shRNA spécifiques de Snrpn (n = 4). La nucléofection à l’aide d’un shRNA SCRAMBLE a servi de contrôle (n = 4). Le test T a été utilisé. (F) Images d’immunocytochimie montrant SNRPN (en rouge) dans les CSN 7 jours après la nucléofection du shRNA (panels externes). Le DAPI a été utilisé pour contre-colorer l’ADN. Images représentatives représentant des neurosphères dérivées de NSCs dans des conditions shSNRPN et shSCRAMBLE (panneaux du milieu). (G) Quantification du nombre de neurosphères formées dans les cultures de NSC après nucléofection avec shSNRPN (n=8) ou shSCRAMBLE (n=8). Le test T a été utilisé. Les valeurs p sont incluses : * : p<0,05 ; ** : p<0,01 ; : p<0.001 ; Réf. <0.0001. N.S : non significatif. Les barres d’erreur représentent le MEB. Barre d’échelle en D, 10 μm ; en F, 100 μm (images à fort grossissement en F, 7 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
En raison de l’absence de marqueurs définitifs pour l’identification de la population de NSC in vivo, l’analyse des NSC a été principalement basée sur l’observation du comportement de cellules isolées de niches neurogènes dans des conditions ex vivo . Les travaux pionniers de Reynolds et Weiss ont jeté les bases en établissant des conditions de culture précises, permettant l’isolement et l’expansion de cellules individuelles à partir de tissus SVZ de souris jeunes adultes (âgés de 2 mois) dans des conditions non adhésives. Ces cellules sont généralement propagées dans un milieu sans sérum contenant de l’EGF et du bFGF, des conditions qui empêchent entièrement la différenciation en neurones et en glie tout en favorisant la prolifération. En effet, dans ces conditions de culture9, la plupart des cellules meurent au cours des premiers jours de culture, mais un petit sous-ensemble commence à se diviser et forme principalement des neurosphères flottantes9. La dissociation enzymatique et la sous-culture de ces agrégats cellulaires facilitent la propagation des cultures, démontrant la capacité d’auto-renouvellement de ces cultures.
Notamment, les cultures de la neurosphère montrent un potentiel d’expansion avec l’ajout d’EGF uniquement, tandis que les NSC cultivées dans un milieu contenant uniquement du bFGF ne montrent pas de prolifération cellulaire à long terme30. Les deux éléments de preuve indiquent que l’EGF est le principal mitogène d’auto-renouvellement du NSC. Néanmoins, la présence à la fois d’EGF et de bFGF dans le milieu de culture améliore la capacité d’auto-renouvellement des NSCs31, et contribue à équilibrer le potentiel de différenciation en astrocytes, neurones et oligodendrocytes 32,33,34,35. De plus, l’utilisation d’un mélange défini d’hormones et de facteurs au lieu d’alternatives commerciales pour compléter le milieu garantit la haute qualité et la reproductibilité des cultures de NSC. Dans ces conditions, les cultures de NSC de souris peuvent persister sous forme de lignées cellulaires stables sans subir d’immortalisation. Néanmoins, une préoccupation dans les cultures de la neurosphère est le potentiel des populations cellulaires prolifératives à subir des transformations génétiques, contournant les mécanismes de régulation du cycle cellulaire et conduisant à un phénotype immortalisé. Par conséquent, bien que les cultures de la neurosphère soient très expansibles, les cultures au-delà de 10 passages in vitro sont généralement écartées pour les études, car elles peuvent subir un vieillissement réplicatif et des cellules avec un contenu chromosomique anormal ou une dynamique de croissance irrégulière peuvent émerger. De plus, l’utilisation de cultures de la neurosphère établies à long terme doit être surveillée en permanence. Les cultures de la neurosphère offrent également la possibilité d’examiner leurs caractéristiques et leur potentiel dans un environnement contrôlé, fournissant un réglage plus précis et ajustable qui peut être modulé et surveillé avec plus de précision qu’in vivo. Grâce à des analyses clonogéniques ou de population in vitro, il est possible de quantifier les capacités d’auto-renouvellement et de prolifération de ces cellules, facilitant ainsi l’identification des mécanismes sous-jacents régissant ces propriétés.
Néanmoins, malgré la longue liste d’avantages de travailler avec des CSN in vitro, la nature de ce protocole de culture et la délicatesse des CSN constituent un défi sur le terrain. Par exemple, le nombre de neurosphères primaires générées lors d’une dissection typique peut varier considérablement en fonction de l’habileté et de la précision de l’expérimentateur. Les résultats de la neurosphère primaire illustrent cette variabilité du nombre de neurosphères primaires obtenues à partir de la SVZ de souris âgées de 2 mois, allant de 500 à 3000 neurosphères. Divers facteurs peuvent contribuer à cette variabilité. Tout d’abord, la précision de la dissection minimise le tissu parenchymateux indésirable, ce qui inhibe la formation de sphères primaires. Deuxièmement, la génération de petits morceaux de tissu SVZ permet une digestion enzymatique et une trituration efficaces, réduisant ainsi la perte de cellules. Cela souligne la nécessité d’une pratique préalable suffisante du protocole de dissection et d’un développement précis du traitement tissulaire lors de l’établissement des cultures de la neurosphère.
Une autre limitation de ces cultures réside dans le fait que les neurosphères peuvent comprendre à la fois des NSC et des cellules progénitrices, ce qui rend difficile la distinction entre ces deux populations au sein des cultures primaires. Bien que divers marqueurs tels que GFAP, Nestin, Musashi et SOX2 aient été signalés comme étant exprimés par les NSCs8, aucun d’entre eux n’a été exclusivement associé aux NSC. Les techniques FACS émergentes basées sur l’expression de l’antigène de surface cellulaire ont permis d’isoler les NSC et leur descendance. Ces études ont démontré que les progéniteurs amplificateurs de transit sont incapables de former des neurosphères lors du passage25,36. Ainsi, bien que la relation entre les cellules SVZ et les cellules initiatrices de la neurosphère nécessite un raffinement supplémentaire 18,19,20,21,22,23, la capacité des neurosphères à être transmises en série sur une période prolongée peut refléter la présence de NSC dans les cultures.
Ce système de culture de la neurosphère a servi de modèle robuste pour étudier l’impact des voies de signalisation et de l’expression des gènes dans le maintien de la capacité d’auto-renouvellement des NSC in vitro15,29. Une approche pour explorer ces aspects consiste à transfecter des NSC pour surexprimer ou renverser des gènes spécifiques. Cela peut être accompli à l’aide de diverses techniques, y compris des méthodes virales et non virales. Bien que les vecteurs viraux atteignent souvent une efficacité élevée en matière de transfert de gènes, ils présentent des limites importantes, telles que des exigences de sécurité élevées et une production de vecteurs chronophage26. À l’inverse, les méthodes de transfection classiques comme la lipofection et l’électroporation atteignent des taux de transfection très faibles, ce qui les rend irréalisables pour les cellules difficiles à transfecter. La technologie de nucléofection offre une approche conviviale en combinant des solutions de nucléofection spécifiques à un type de cellule avec des paramètres électriques uniques pour chaque type de cellule37,38. Cela garantit le transfert de l’ADN directement dans le noyaucellulaire 39, permettant l’incorporation de l’ADN d’une manière indépendante du cycle cellulaire. Par conséquent, la nucléofection apparaît comme une technique viable pour transfecter des cellules difficiles à transfecter telles que les NSC de souris28,40.
L’une des limites de cette méthode est qu’un minimum de 2 x 106 cellules est recommandé et nécessaire pour chaque nucléofection, bien que dans des conditions optimales, un nombre inférieur de cellules puisse être utilisé par nucléofection unique (c’est-à-dire 5 × 105 cellules). Un autre inconvénient de la méthode est que la qualité et la concentration de l’ADN utilisé pour la nucléofection influencent considérablement l’efficacité du transfert de gènes. L’utilisation d’ADN préparé sans endotoxines est fortement recommandée pour prévenir une mortalité cellulaire élevée due à la présence d’endotoxines. De plus, l’utilisation de plus de 6 μg d’ADN total pour la nucléofection peut réduire considérablement l’efficacité du transfert de gènes et la viabilité cellulaire. Enfin, l’administration d’impulsions électriques est également essentielle à la survie des cellules nucléofectées.
Dans ce travail, nous avons illustré la manipulation de l’expression du gène Snrpn en employant une stratégie impliquant la régulation négative de son expression à l’aide de plasmides épisomaux. Ces plasmides ne sont pas intégrés dans le génome des cellules, et comme les NSC continuent de proliférer in vitro, l’ADN introduit sera ensuite dilué le long de la division cellulaire et, ainsi, perdra l’effet de la manipulation génétique. Par conséquent, cette stratégie est précieuse pour étudier l’effet d’une altération aiguë sur une courte période ou pour dater la naissance des cellules in vitro. Il existe des alternatives pour évaluer un effet plus prolongé de la perturbation génétique. Par exemple, un système intégratif tel que le piggyBAC basé sur un transposon pourrait être utilisé. Ce système consiste à introduire la séquence codante souhaitée contenue dans le plasmide flanquée de séquences transposables et à co-nucléifier les cellules avec un plasmide contenant la séquence de l’enzyme transposase41. Alternativement, des transposons ou les systèmes CRISPR/Cas pourraient être utilisés.
La poursuite du développement des technologies de transfection constituera une étape importante vers des tests à haut débit permettant d’évaluer le rôle de différents gènes sur la physiologie des cellules souches neurales adultes. Combinées à des méthodes de purification et d’expansion de plus en plus sophistiquées, ces études permettront de comprendre la biologie in vitro des CSN adultes et de comparer les différences biologiques entre les neurosphères flottantes et les CSN in vivo.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Ce travail a été soutenu par des subventions du Ministerio de Ciencia e Innovación et de l’Agencia Estatal de Investigación (MCIN/AEI) (PID2019-110045GB-I00 ; PID2022-142734OB-I00 et EUR2023-143479) à SRF. EJV (FPU20/00795) et DSL (FPU22/03797) sont financés par le programme de bourses Spanish Formación de Profesorado Universitario (FPU). LLC (PRE2020-094137) et JDM (PREP2022-000680) sont financés par le programme de bourses Spanish Formación de Personal Investigador (FPI). CMM (CIACIF/2022/366) est financé par la Generalitat Valenciana. MIL (CPI-22-481) est financé par la bourse Programa INVESTIGO (Next Generation EU). Financement Open Access fourni par le Ministerio de Ciencia e Innovación.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 μm pore-filter bottles (250 mL) | VWR | 514-0330P | |
| 0.22 μm pore-filter bottles (500 mL) | VWR | 514-0332P | |
| 12-well plate | LabClinics | PLC30012 | |
| 15 mL tube | Fisher | 10738771 | |
| 24-well plate | LabClinics | PLC30024 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | BioWest | L0180-100 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| 48-well plate | ThermoFisher | 150687 | |
| 6-well plate | LabClinics | PLC30006 | |
| 96-well plate | Labclinics | PLC30096 | |
| Accutase solution | Sigma | A6964-100ML | Referred as enzymatic solution |
| Amaxa Mouse Neural Stem Cell Nucleofector Kit | Lonza | VPG-1004 | |
| Amaxa Nucleofector Iib | Lonza | 10700807 | |
| Antibiotic/Antimitotic (A/A) | Sigma | A5955 | |
| Apo-t-Transferrine | Sigma | T2252-1G | |
| Basic Fibroblast Growth Factor (bFGF) | Sigma | F0291 | |
| Blasticidin | Sigma | 203350 | |
| Bovine Serum Albumin (BSA) | Sigma | B4287-25MG | |
| Cell strainer 40 μm | LabClinics | PLC93040 | |
| Deoxynucleotide triphosphate (dNTPs) | NZYTech | MB08701 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dulbecco’s Phosphate Saline Buffer (DPBS) | Gibco | 14080-055 | |
| Dulbecco's Modified Eagle's Medium (DMEM) F12 1:1 | Gibco | 11320-074 | |
| E. coli DH5α Competent Cells | ThermoFisher | EC0112 | |
| Earles's Balanced Salt Solution (EBSS) | Gibco | 24010-043 | |
| Epidermal Growth Factor - Human recombinant (EGF) | Gibco | 53003-018 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | E-6511 | |
| Fine Forceps | Fine Science Tools | 11274-20 | |
| Fine Scissors Sharp | Fine Science Tools | 14060-09 | |
| Glucose | Sigma | G-7021 | |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Kit includes reagents for PCR |
| Heparin | Sigma | H-3149 | |
| Insuline | Sigma | I6634 | |
| LB agar (Lennox) | LabKem | AGLB-00P-500 | |
| LB broth (Lennox) | LabKem | LBBR-00P-500 | |
| L-Cysteine | Sigma | C-8277 | |
| L-Glutamine | Gibco | 25030-024 | |
| Neubauer chamber | Blaubrand | BR718620 | |
| Nuclease free water | Labbox | WATR-00A-10K | |
| NZYMaxiprep Endotoxin Free Kit | NZYTech | MB39901 | |
| Papain Lyophilized | Worthington | LS003119 | |
| Progesterone | Sigma | P-6149 | |
| Putrescine | Sigma | P-7505 | |
| Scalpel | Fine Science Tools | 10316-14 | |
| shSCRAMBLE | Mission (Sigma) | SHC003 | |
| shSNRPN | Mission (Sigma) | TRCN0000109285 | |
| Sodium Selenite | Sigma | S-9133 | |
| Spatula | Fine Science Tools | 10090-17 | |
| Sterile PES Syringe Filters (0.22 μm pore-filter) | Epica | SFPE-22E-050 | |
| T12.5 cm2 Flask | Biofil | TCF012025 | |
| T25 cm2 Flask | LabClinics | PLC70025 | |
| T75 cm2 Flask | LabClinics | PLC70075 | |
| Tweezers | Fine Science Tools | 91150-20 |
Références
- Gage, F. H. Mammalian neural stem cells. Science. 287 (5457), 1433-1438 (2000).
- Ming, G., Song, H. Adult neurogenesis in the mammalian central nervous system. Ann Rev Neurosci. 28 (1), 223-250 (2005).
- Doetsch, F., Caillé, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97 (6), 703-716 (1999).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Regeneration of a germinal layer in the adult mammalian brain. Proc Natl Acad Sci. 96 (20), 11619-11624 (1999).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. J Neurosci. 17 (13), 5046-5061 (1997).
- Mamber, C., Kozareva, D. A., Kamphuis, W., Hol, E. M. Shades of gray: The delineation of marker expression within the adult rodent subventricular zone. Prog Neurobiol. 111, 1-16 (2013).
- Cebrian-Silla, A., et al. Single-cell analysis of the ventricular-subventricular zone reveals signatures of dorsal and ventral adult neurogenesis. eLife. 10, e67436(2021).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), New York, N.Y. 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. (45), e2393(2010).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ferrón, S. R., et al. Postnatal loss of Dlk1 imprinting in stem cells and niche astrocytes regulates neurogenesis. Nature. 475 (7356), 381-385 (2011).
- Gil-Perotín, S., et al. Adult neural stem cells from the subventricular zone: A review of the neurosphere assay. Anat Record. 296 (9), 1435-1452 (2013).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), 156059(2019).
- Ferrón, S. R., et al. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Prot. 2 (4), 849-859 (2007).
- Ferron, S., et al. Telomere shortening and chromosomal instability abrogates proliferation of adult but not embryonic neural stem cells. Development. 131 (16), 4059-4070 (2004).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Meth. 3 (10), 801-806 (2006).
- Santa-Olalla, J., Baizabal, J., Fregoso, M., Cárdenas, M. D. C., Covarrubias, L. The in vivo positional identity gene expression code is not preserved in neural stem cells grown in culture. Eur J Neurosci. 18 (5), 1073-1084 (2003).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: A critical review of sphere-formation as an assay for stem cells. Cell Stem Cell. 8 (5), 486-498 (2011).
- Wan, F., et al. The utility and limitations of neurosphere assay, CD133 immunophenotyping and side population assay in Glioma stem cell research. Brain Pathol. 20 (5), 877-889 (2010).
- Deleyrolle, L. P., Rietze, R. L., Reynolds, B. A. The neurosphere assay, a method under scrutiny. Acta Neuropsych. 20 (1), 2-8 (2008).
- Campos, L. S. Neurospheres: Insights into neural stem cell biology. Neurosci Res. 78 (6), 761-769 (2004).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres—re-evaluating the relationship. Nat Meth. 2 (5), 333-336 (2005).
- Parker, M. A. Expression profile of an operationally-defined neural stem cell clone. Exp Neurol. 194 (2), 320-332 (2005).
- Belenguer, G., et al. Adult neural stem cells are alerted by systemic inflammation through TNF-α receptor signaling. Cell Stem Cell. 28 (2), 285-299 (2021).
- Cruz, M. T. G., Simões, S., Lima, M. C. P. de Improving lipoplex-mediated gene transfer into C6 glioma cells and primary neurons. Exp Neurol. 187 (1), 65-75 (2004).
- Hagemann, C., et al. High efficiency transfection of glioma cell lines and primary cells for overexpression and RNAi experiments. J Neurosci Meth. 156 (12), 194-202 (2006).
- Moritz, S., Lehmann, S., Faissner, A., Holst, A. von An induction gene trap screen in neural stem cells reveals an instructive function of the niche and identifies the splicing regulator Sam68 as a Tenascin-C-regulated target gene. Stem Cells. 26 (9), 2321-2331 (2008).
- Montalbán-Loro, R., et al. TET3 prevents terminal differentiation of adult NSCs by a non-catalytic action at Snrpn. Nat Comm. 10 (1), 1726(2019).
- Gritti, A., et al. Epidermal and fibroblast growth factors behave as mitogenic regulators for a single multipotent stem cell-like population from the subventricular region of the adult mouse forebrain. J Neurosci. 19 (9), 3287-3297 (1999).
- Nieto-Estévez, V., Pignatelli, J., Araúzo-Bravo, M. J., Hurtado-Chong, A., Vicario-Abejón, C. A global transcriptome analysis reveals molecular hallmarks of neural stem cell death, survival, and differentiation in response to partial FGF-2 and EGF deprivation. PLoS One. 8 (1), 53594(2013).
- Vergaño-Vera, E., Méndez-Gómez, H. R., Hurtado-Chong, A., Cigudosa, J. C., Vicario-Abejón, C. Fibroblast growth factor-2 increases the expression of neurogenic genes and promotes the migration and differentiation of neurons derived from transplanted neural stem/progenitor cells. Neuroscience. 162 (1), 39-54 (2009).
- Gabay, L., Lowell, S., Rubin, L. L., Anderson, D. J. Deregulation of dorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron. 40 (3), 485-499 (2003).
- Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M., Götz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6. Mol Cell Neurosci. 25 (4), 664-678 (2004).
- Bithell, A., Finch, S. E., Hornby, M. F., Williams, B. P. Fibroblast growth factor 2 maintains the neurogenic capacity of embryonic neural progenitor cells in vitro but changes their neuronal subtype specification. Stem Cells. 26 (6), 1565-1574 (2008).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci. 106 (15), 6387-6392 (2009).
- Kobayashi, N., et al. Gene delivery to embryonic stem cells. Birth Def Res C. 75 (1), 10-18 (2005).
- Gresch, O., Altrogge, L. Transfection of difficult-to-transfect primary mammalian cells. Meth Mol Biol. 801, 65-74 (2011).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J Immunol Meth. 284 (1-2), 133-140 (2004).
- von Holst, A., Egbers, U., Prochiantz, A., Faissner, A. Neural stem/progenitor cells express 20 tenascin C isoforms that are differentially regulated by Pax6. J Biol Chem. 282 (12), 9172-9181 (2007).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trend Biotechnol. 33 (9), 525-533 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon