Method Article
Выделение, экспансия и нуклеофекция нейральных стволовых клеток из субвентрикулярной зоны взрослой мыши
В этой статье
Резюме
В данной работе мы описываем нуклеофекционную систему, предназначенную для повышения эффективности доставки генов в расширенных нейральных стволовых клетках (НСК), выделенных из субвентрикулярной зоны взрослой мыши. Полученные данные показывают, что этот метод значительно улучшает возмущение генов в НСК, превосходя по эффективности традиционные протоколы трансфекции и повышая выживаемость клеток.
Аннотация
Выделение и экспансия нейральных стволовых клеток (НСК) из субвентрикулярной зоны (SVZ) мозга взрослой мыши может быть достигнута в среде, дополненной основным фактором роста фибробластов (bFGF) и эпидермальным фактором роста (EGF) в виде митогенов, образующих клональные агрегаты, известные как нейросферы. Эта система in vitro является ценным инструментом для изучения потенциала НСК. Трансфекция миРНК или генов, переносимых в плазмидах, может быть использована для индуцирования нарушений экспрессии генов и изучения биологии НСК. Однако доставка экзогенных нуклеиновых кислот в культуры НСК затруднена из-за низкой эффективности трансфекции клеток центральной нервной системы (ЦНС). В данной работе мы представляем усовершенствованную систему нуклеофекции, которая обеспечивает высокую эффективность доставки генов в расширенные НСК от взрослых мышей SVZ. Мы демонстрируем, что этот относительно простой метод усиливает возмущение генов у взрослых НСК, превосходя традиционные протоколы трансфекции с выживаемостью более 80%. Более того, этот метод также может быть применен в первичных изолированных НСК, обеспечивая решающий прогресс в исследованиях функций генов за счет манипулирования экспрессией генов посредством нокдауна или сверхэкспрессии в культурах нейросферы.
Введение
Нейральные стволовые клетки (НСК) являются мультипотентными стволовыми клетками, проживающими в головном мозге. Эти клетки обладают способностью к самообновлению и дифференцировке в три нейронные линии: астроциты, олигодендроциты инейроны. Следовательно, НСК играют решающую роль в нейрогенезе взрослых млекопитающих, процессе, при которомв мозге генерируются новые нейроны. НСК преимущественно находятся в двух областях мозга взрослого человека, называемых нейрогенными нишами: субвентрикулярной зоне (SVZ) вдоль стенок боковых желудочков и субгранулярной зоне (SGZ) в зубчатой извилине гиппокампа 3,4. НСК (также известные как В-клетки) в СВЗ, наиболее активной нейрогенной нише у взрослой мыши, самообновляются и производят транзит-амплифицирующие предшественники (TAPs или C-клетки), которые впоследствии дифференцируются в нейробласты (А-клетки). Эти нейробласты мигрируют через ростральный миграционный поток (RMS) к обонятельным луковицам (OB), где они подвергаются полной дифференцировке в интернейроны, интегрируясь в ранее существовавшие схемы 3,4,5,6.
Понимание сложного взаимодействия молекулярных сигналов и сигналов, которые регулируют НСК в этих нишах, важно для использования их потенциала в терапевтических целях. С этой целью были разработаны различные методы изучения этой клеточной популяции, начиная от селективной первичной культуры НСК и заканчивая отбором клеток с использованием поверхностных маркеров 7,8,9,10. В настоящей рукописи подробно описывается выделение и культивирование НСК SVZ in vitro с использованием бессывороточной селективной среды, содержащей оба митогена: основной фактор роста фибробластов (bFGF) и эпидермальный фактор роста (EGF). Эта среда способствует пролиферации клеток и поддерживает стволовость НСК, полученных из СВЗ мозга взрослых мышей, образуя in vitro клональные, трехмерные, неадгезивные агрегаты, известные как нейросферы9. Культуры нейросферы служат управляемой платформой для манипулирования и изучения молекулярных механизмов и факторов, влияющих на пролиферацию, самообновление, дифференцировкуи выживание НСК. Примечательно, что количество первичных нейросфер, образованных в культуре, позволяет оценить количество НСК, присутствующих в СВЗ in vivo, что делает его мощным инструментом для изучения влияния различных состояний на пул взрослых НСК12,13. Более того, после того, как первичная культура создана, НСК могут генерировать новые агрегаты (вторичные нейросферы) при прохождении через симметричные деленияв условиях пролиферации. Таким образом, для оценки скорости самообновления этих культур можно использовать посев вторичных нейросферных клеток с низкой плотностью (клональный анализ) 4,15,16,17.
Несмотря на потенциал нейросфер в раскрытии механизмов, управляющих регуляцией НСК, некоторые исследователи ставят под сомнение достоверность выводов in vitro, утверждая, что искусственные условия, в которых растут клетки, могут не точно воспроизводить сложное микроокружение in vivo нейрогенных ниш 18,19,20,21,22. Еще один спорный момент связан с наблюдаемой гетерогенностью в нейросферах. Тем не менее, считается, что эта изменчивость отражает симметричное и асимметричное деление НСК, которые естественным образом происходят in vivo23,24. Кроме того, недавняя валидация подтвердила использование культур НСК для прогнозирования механизмов, действующих в нейрогенной нише SVZ in vivo, и несколько исследований показали, что НСК, культивируемые in vitro, точно поддерживают транскриптомный профиль, наблюдаемый in vivo11,25.
Таким образом, культуры нейросферы служат не только методом изучения пролиферации и дифференцировки НСК, но и предлагают систему для изучения влияния генов, управляющих биологией НСК. Ключевым методом исследования функции генов в НСК является пертурбация экспрессии генов. МиРНК или гены, доставляемые через плазмиды, могут быть трансфицированы в клеточные культуры, что приводит к нокдауну или апрегуляции гена-мишени. Такой универсальный подход значительно сокращает время и затраты по сравнению с созданием культур с использованием мышей с условным нокаутом, представляя собой многообещающее направление для разгадки генетических основ нейрогенеза и изучения терапевтических перспектив. Изменение экспрессии определенных генов в НСК позволяет модулировать их поведение, влияя на важнейшие биологические процессы, такие как пролиферация, дифференцировка и миграция. Тем не менее, перспектива трансфекции НСК, особенно в нейросферах мышей, представляет собой заметную проблему. Трехмерная структура нейросфер ставит под угрозу эффективность трансфекции, что часто приводит к низким показателям успешной доставки экзогенных нуклеиновых кислот, что ограничивает масштабы генетических манипуляций26,27. Кроме того, процедуры трансфекции могут пагубно повлиять на жизнеспособность и функциональность клеток27. В этом контексте мы представляем систему нуклеофекции как метод смягчения повреждения клеток, достигая высокой выживаемости и обеспечивая более высокую эффективность в анализах доставки генов, используемых для возмущения культур НСК.
Данная рукопись призвана проиллюстрировать процедуру выделения, расширения и нуклеофекции НСК из нейрогенной ниши взрослого СВЗ для возмущения генов с использованием системы нейросферных культур. Этот метод превосходит по эффективности традиционные протоколы трансфекции, обеспечивая значительно более высокие показатели выживаемости и улучшенную эффективность доставки генов среди целевых клеток.
протокол
Все эксперименты, проводимые на животных, были предварительно одобрены Этическим комитетом Университета Валенсии и одобрены Conselleria de Agricultura, Ganadería y Pesca, Generalitat Valenciana (Испания).
1. Первичная культура нейросфер
- Приготовление реагентов
- Приготовьте буферный раствор фосфатно-солевого буфера Дульбекко (DPBS) в деионизированной воде и стерилизуйте автоклавированием. В качестве альтернативы можно приготовить 0,1 М PBS pH 7,4, добавив в деионизированную воду 137 мМ раствор NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4 и 1,8 мМ раствор KH2PO4.
- Заполните две 12-луночные пластины предварительно охлажденными DPBS и держите их на льду: одна будет использоваться для сохранения всего мозга до вскрытия, а другая — для сохранения рассеченных СВЗ до обработки тканей.
- Приготовьте ферментативную смесь, содержащую папаин, как описано ниже.
- Приготовьте раствор диссоциации ЭДТА/L-цистеина в сбалансированном солевом растворе Эрла (EBSS) до конечной концентрации 0,2 мг/мл каждый. Чтобы добиться полного растворения, инкубируйте трубку на водяной бане при температуре 37 °C.
- Растворите 12 Ед/мл папаина в растворе ЭДТА/L-цистеина. Учтите, что на один мозг будет уходить 500 μл ферментативного раствора.
- Введите раствор папаина в водяную баню при температуре 37 °C примерно на 20 минут до полного растворения фермента.
- Процедите и стерилизуйте ферментативную смесь с помощью шприца и фильтра с порами 0,22 мкм и поддерживайте ее при температуре 4 °C до использования.
ПРИМЕЧАНИЕ: Папаин активируется через 30 минут при 37 °C, и его можно хранить в течение 12 часов при 4 °C.
- Приготовьте контрольную питательную среду путем добавления раствора гормональной смеси согласно таблице 1 и отфильтруйте и простерилизуйте ее с помощью фильтров с нитроцеллюлозой 0,22 мкм пор. Перед использованием поддерживайте среду при температуре 4 °C и нагревайте ее на водяной бане при температуре 37 °C.
- Приготовьте всю среду, дополнив контрольную среду EGF и bFGF непосредственно перед использованием, как показано в таблице 1. Не фильтруйте всю среду, так как митогены могут быть потеряны при фильтрации.
- Экстракция мозга и вскрытие СВЗ
ПРИМЕЧАНИЕ: Мышам разрешен свободный доступ к пище и воде до эвтаназии. Используются мыши C57BL/6 в возрасте от 8 до 16 недель. Используются оба пола без заметных различий в приготовлении.- Стерилизуйте инструменты для вскрытия путем автоклавирования перед операцией. Затем погрузите скальпели, пинцет, ножницы и шпатели в стакан, наполненный 70% этанолом. Тщательно очистите каждую рабочую поверхность 70% этанолом.
- Принесите мышь в жертву при передозировкеСО2 и подтвердите вывихом шейки матки. Опрыскайте голову 70% этанолом, чтобы свести к минимуму возможность загрязнения тканей мозга.
- Отделите голову мыши от остального тела с помощью ножниц. Разрежьте кожу над черепом маленькими ножницами по ростро-каудальной оси до полного обнажения черепа.
- Обнажите мозг, сначала разрезав череп вдоль сагиттального шва маленькими ножницами, а затем удалите кости с помощью тонкого пинцета. Будьте осторожны, чтобы не повредить мозговую ткань под черепом во время этого шага.
- Осторожно извлеките мозг из черепа с помощью шпателя и поместите его в 12-луночную пластину, содержащую холодный DPBS. Держите пластину на льду до завершения вскрытия.
- Перенесите весь мозг на силиконовую прокладку, где будет происходить рассечение, и нанесите на мозг несколько капель холодного DPBS (рисунок 1A).
- Используйте скальпель для удаления OB, расположенного на ростральном конце мозга, и мозжечка, расположенного в каудальной части, сохраняя при этом центральную часть мозга, содержащую оба боковых желудочка (рисунок 1B).
- Разделите мозг вдоль продольной щели на два полушария, а затем приступайте к рассечению обоих полушарий по отдельности (рисунок 1В).
- Работая с одним полушарием, переориентируйте его так, чтобы медиальная область была обращена вверх. Откройте мозг по линии мозолистого тела, отделив кору и стриатум от гиппокампа, перегородки и промежуточного мозга, тем самым обнажив боковые желудочки (рисунок 1D).
ПРИМЕЧАНИЕ: СВЗ расположен между полостью желудочка и стриатумом, поэтому последующие шаги направлены на максимально точную изоляцию СВЗ от окружающих тканей. - Удалите гиппокамп, перегородку и промежуточный мозг по вентральной границе желудочков (рис. 1E,F), ткань за ростральным и каудальным концами СВЗ (рис. 1G) и кору головного мозга после мозолистого тела (рис. 1H,I).
- Наклоните ткань так, чтобы СВЗ был обращен в сторону (Рисунок 1J), что позволило удалить ткань полосатого тела под СВЗ (Рисунок 1K) для получения тонкого кусочка ткани, содержащего НСК (Рисунок 1L).
- Храните оба препарированных SVZ от одной и той же мыши в 12-луночной пластине, содержащей холодные, стерильные DPBS, пока не начнется обработка тканей.
ПРИМЕЧАНИЕ: Вскрытие обоих СВЗ из одного мозга должно занять 10 минут. Более длительное время может повлиять на жизнеспособность клеток. Если требуется увеличение выхода культур, можно объединить СВЗ от нескольких мышей одного возраста, пола, генетического фона и генотипа.
- Изоляция и затравка НСК
- Разрежьте каждый СВЗ на 4-5 небольших кусочков, чтобы облегчить разукрупнение ткани.
ПРИМЕЧАНИЕ: Начиная с этого этапа, вся процедура должна выполняться в стерильных условиях в ламинарном вытяжном шкафу. - Переложите измельченные СВЗ в центрифужную пробирку объемом 15 мл с помощью стерильной пластиковой пипетки Пастера. Убедитесь, что в тарелке не осталось осколков.
- Дайте тканевым тканям отложиться на дне трубки и удалите остатки DPBS.
- Добавьте 500 μл фильтрованной ферментативной смеси, содержащей папаин, на мозг (2 SVZs) и инкубируйте пробирки на водяной бане при 37 °C в течение 30 минут.
- После инкубации добавьте в каждый образец 5 мл контрольной среды, предварительно подогретой до 37 °С.
- Центрифугируйте образцы при давлении 300 x g в течение 5 минут. Затем осторожно удалите надосадочную жидкость с помощью микропипетки или вакуумного насоса.
- Добавьте 1 мл контрольной среды и тщательно механически дезагрегируйте гранулу, пипетируя вверх и вниз от 10 до 20 раз, с помощью отполированной огнем стеклянной пипетки Пастера до получения однородной клеточной суспензии.
ВНИМАНИЕ: Это один из самых важных шагов в протоколе, так как либо чрезмерное, либо недостаточное разукрупнение негативно скажется на урожайности культур. - Добавьте 4 мл контрольной среды и перемешайте методом инверсии, чтобы промыть ячейки. Центрифугируйте при 300 х г в течение 5 мин. Затем удалите надосадочную жидкость.
- Добавьте 1 мл готовой среды и повторно суспендируйте гранулу пипетированием вверх и вниз 10 раз для гомогенизации клеточной суспензии.
- Подсчитайте клеточную суспензию с помощью камеры Нейбауэра под микроскопом после разбавления 1/2 аликвоты клеточной суспензии трипановым синим или используйте автоматический счетчик клеток. Убедитесь, что культуры дезагрегированы на уровне отдельных клеток.
- После приготовления клеточной суспензии полученные клетки равномерно засевают в 8 лунок 48-луночного планшета в конечном объеме 500 мкл полной среды.
ПРИМЕЧАНИЕ: Обычно мы получаем 20 000 клеток из двух СВЗ, в результате чего конечная плотность посева составляет около 2 500 клеток/мл для достижения максимального урожая в культурах.
- Разрежьте каждый СВЗ на 4-5 небольших кусочков, чтобы облегчить разукрупнение ткани.
- Формирование нейросфер
- Инкубируйте клетки в течение 5–7 дней in vitro (DIV) в увлажненном инкубаторе при 37 °C и 5%CO2. В этих условиях дифференцированные клетки погибают, в то время как НСК и предшественники пролиферируют в ответ на митогенную стимуляцию, образуя клональные агрегаты, признанные первичными нейросферами.
Примечание: Либо EGF, либо bFGF могут быть использованы для индуцирования формирования нейросферы. Однако эти два фактора роста не являются полностью взаимозаменяемыми. - Проверьте размер нейросфер с помощью камеры с инвертированным микроскопом, и как только нейросферы достигнут диапазона размеров от 50 до 100 мкм, подсчитайте все первичные нейросферы, образовавшиеся в лунке при 10-кратном увеличении. Общее количество образовавшихся первичных нейросфер служит оценкой количества НСК, присутствующих в нише СВЗ.
- По истечении 10-дневного периода соберите питательную среду из каждой лунки, чтобы начать пассирование. Проводите последующий пассаж через 5-7 DIV, хотя стоит отметить, что первичным сферам может потребоваться немного больше времени, чтобы достичь идеального размера для субкультивирования (около 100 мкм).
- Инкубируйте клетки в течение 5–7 дней in vitro (DIV) в увлажненном инкубаторе при 37 °C и 5%CO2. В этих условиях дифференцированные клетки погибают, в то время как НСК и предшественники пролиферируют в ответ на митогенную стимуляцию, образуя клональные агрегаты, признанные первичными нейросферами.
Таблица 1: Решения для питательных сред. Описана рецептура контрольной среды. Делается предварительно смешанный раствор гормональной смеси. Исходные гормональные растворы могут быть приготовлены заранее в соответствии с указаниями и храниться при температуре -20 °C. Перед культивированием клеток добавьте в контрольную среду EGF и bFGF для получения полной среды. Для каждого компонента предоставляются спецификации хранения, запасы и рабочие концентрации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
2. Экспансия культур нейросферы
- Прохождение нейросфер
- Соберите среду, содержащую нейросферы, из многолуночных планшетов и перенесите их в центрифужную пробирку объемом 15 мл. Обеспечьте восстановление как можно большего количества клеток, промыв лунки несколькими миллилитрами DPBS.
- Центрифугируйте нейросферы в течение 5 мин при 300 x g. Затем удалите надосадочную жидкость.
- Добавьте 200 μL ферментативного раствора (см. Таблицу материалов) в гранулу и осторожно постучите по дну пробирки, чтобы выбить ее. Инкубировать в течение 10 минут при комнатной температуре, чтобы облегчить диссоциацию нейросфер.
- Добавьте 1 мл контрольной среды, чтобы остановить ферментативную реакцию и механически диссоциировать нейросферы с помощью микропипетки P1000 путем пипетирования вверх и вниз от 10 до 20 раз.
- Добавьте дополнительный объем в 4 мл контрольной среды и перемешайте методом инверсии для промывания клеток.
- Центрифугируйте клетки в течение 5 минут при 300 x g. Затем удалите надосадочную жидкость.
- Добавьте 1 мл готовой среды и повторно суспендируйте гранулу для гомогенизации клеточной суспензии путем пипетирования вверх и вниз в 10 раз.
Примечание: Если исходное количество и размер нейросфер слишком высоки, добавьте более полную среду для разбавления клеточной суспензии, обеспечивая надежное количество клеток. - Подсчитайте клеточную суспензию с помощью камеры Нейбауэра после разбавления 1/2 аликвоты клеточной суспензии трипановым синим или используйте автоматический счетчик клеток.
- Для расширения клеточной культуры засеивают клетки плотностью 10000 клеток/см2 с использованием полной среды в соответствующей культуральной тарелке или колбе (см. таблицу 2).
- Инкубируйте клетки от 5 до 7 DIV в увлажненном инкубаторе при температуре 37 °C и 5%CO2 для каждого прохода.
Примечание: Культуры нейросферы могут быть последовательно расширены и распространены путем многократного субкультурирования, не превышающего 10 пассажей, без изменения их способности к пролиферации. Для культивирования можно использовать либо EGF, либо bFGF; однако долгосрочное распространение культур может быть достигнуто только в присутствии EGF.
- Самообновляющийся анализ
- После прохождения культур нейросферы поместите 1000 отдельных клеток в 96-луночный планшет, заполнив конечный объем 200 мкл полной средой, в результате чего конечная клеточная плотность культур составит 5 клеток/мкл.
ПРИМЕЧАНИЕ: Количество засеиваемых ячеек должно быть максимально точным. При необходимости готовят промежуточные разведения, чтобы обеспечить надежный объем клеточной суспензии перед нанесением покрытия. Кроме того, рекомендуется использовать пластину от 4 до 5 повторений для каждого условия, чтобы уменьшить техническую вариативность. - Инкубируйте клетки при 37 °C и 5%CO2 в увлажненном инкубаторе в течение 5 дней или до тех пор, пока нейросферы не достигнут адекватного размера (от 60 до 100 мкм). Избегайте перемещения или встряхивания многолуночного планшета, чтобы предотвратить агрегацию нейросферы.
- После формирования нейросферы подсчитайте количество нейросфер, образовавшихся в каждой лунке, с помощью инвертированного фазово-контрастного микроскопа, оснащенного прилагаемой камерой. Анализ самообновления может быть проведен с использованием EGF или bFGF по отдельности.
- После прохождения культур нейросферы поместите 1000 отдельных клеток в 96-луночный планшет, заполнив конечный объем 200 мкл полной средой, в результате чего конечная клеточная плотность культур составит 5 клеток/мкл.
- Криоконсервация культур НСК
ПРИМЕЧАНИЕ: Культуры нейросферы могут быть крионированы, чтобы использовать их в будущем, что сводит к минимуму необходимое количество мышей. Рекомендуем сохранять ячейки до 10 прохода.- Чтобы криоконсервировать клетки, перенесите 1 мл клеточной суспензии в готовой среде в правильно маркированную криопробирку.
- Добавьте диметилсульфоксид (ДМСО) до конечной концентрации 10% в клеточную суспензию и аккуратно перемешайте, перевернув пробирки.
ПРИМЕЧАНИЕ: ДМСО служит криопротектором, но может быть токсичным для клеток, поэтому этот шаг должен быть выполнен быстро. - Поместите пробирки в морозильную камеру при температуре -80 °C с помощью контейнера для заморозки, который обеспечивает постепенное снижение температуры на 1 °C/мин. Этот постепенный процесс замораживания предотвращает повреждение клеток, вызванное образованием кристаллов льда во время криоконсервации. Для длительного хранения пробирки следует хранить в баке с жидким азотом при температуре -196 °C.
- Размораживание культур НБК
Примечание: При необходимости клетки могут быть разморожены, а культуры повторно расширены для экспериментов.- Извлеките криопробирки, содержащие замороженные НСК, из резервуара для хранения жидкого азота и немедленно поместите их на водяную баню при температуре 37 °C до полного оттаивания, примерно на 5 минут.
ВНИМАНИЕ: Крайне важно свести к минимуму время принятия ванны, так как ДМСО токсичен и может повлиять на жизнеспособность клеток. - Быстро перенесите размороженные клетки в центрифужную пробирку объемом 15 мл, содержащую 5 мл предварительно подогретой контрольной среды.
- Центрифугируйте ячейки при 300 х г в течение 5 мин и удалите надосадочную жидкость. Добавьте 1 мл готовой среды и повторно суспендируйте гранулу, осторожно пипетируя вверх и вниз 10 раз, чтобы гомогенизировать клеточную суспензию перед посевом.
ПРИМЕЧАНИЕ: Размораживание может повлиять на жизнеспособность клеток; Поэтому рекомендуется провести пассаж клеток хотя бы один раз перед посевом для новых экспериментов.
- Извлеките криопробирки, содержащие замороженные НСК, из резервуара для хранения жидкого азота и немедленно поместите их на водяную баню при температуре 37 °C до полного оттаивания, примерно на 5 минут.
- Тестирование на микоплазму
ПРИМЕЧАНИЕ: Заражение микоплазмой может поставить под угрозу здоровье клеток, влияя на скорость роста. Поэтому тестирование на микоплазму имеет решающее значение для обеспечения честности и надежности экспериментов.- Экстракция ДНК
- Соберите не менее 100 мкл клеточной культуры для экстракции ДНК. Для экстракции ДНК можно использовать как надосадочную жидкость, так и клеточную гранулу. Храните эту аликвоту при температуре -20 °C до экстракции.
- Проткните крышку тюбика и прокипятите аликвоту при температуре 99 °C в течение 15 минут с помощью термоблока.
ПРИМЕЧАНИЕ: Прокалывание крышек туб позволяет избежать открытия трубок во время кипячения при высоких температурах. - Центрифуга в течение 5 мин при 16 900 x g. Перенесите надосадочную жидкость, содержащую ДНК, в новую пробирку. Храните пробирку с ДНК при температуре -20 °C до проведения ПЦР-теста.
- ПЦР для выявления микоплазм
- Готовят смесь для ПЦР с использованием следующих компонентов: 8,9 мкл воды, не содержащей нуклеаз, 3 мкл 5-кратного реакционного буфера, 1,2 мкл 25 мМ MgCl2, 0,25 мкл 2,5 мМ дНТФ, 0,15 мкл Taq-полимеразы и 0,25 мкл каждого микоплазмен-специфичного праймера в концентрации 10 мкМ (Forward, Fw: 5'GATGTTTAGCCGGGTCGAGAG3' и Reverse, Rv: 5'GATGTCAAGAGTGGGTAAGGTT3').
- Добавьте 1 мкл геномной выделенной ДНК. Приготовьте смесь для ПЦР в ламинарном проточном колпаке для предотвращения загрязнения ДНК.
- Инкубируют реакцию в термоамплификаторе следующим образом: начальная денатурация при 95 °C в течение 5 мин с последующим 35 циклами денатурации при 95 °C в течение 30 с, отжиг при 53 °C в течение 1 мин, удлинение при 72 °C в течение 30 с и окончательное удлинение при 72 °C в течение 5 мин.
- Чтобы определить размер полученной полосы (около 500.н.), загрузите 15 мкл продукта ДНК ПЦР, смешанного с 3 мкл 6-кратного раствора красителя, на 2% агарозный гель и запустите электрофорез в течение 40-50 мин при 100 В.
- Экстракция ДНК
Таблица 2: Тарелки и колбы, используемые для культивирования. Приведены размеры и объемы наиболее часто используемых высевающих пластин и колб. Таблица включает в себя диаметр, площадь роста и объем среды, используемые для каждого сосуда, а также пример количества NSC, которые должны быть засеяны в условиях расширения (10 000 ячеек/см2). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
3. Нуклеофекция культур нейросферы
- Приготовление реагентов
- Подготовка ДНК
- Приготовьте 25 мкл компетентных клеток E. coli DH5α в пробирке объемом 1,5 мл для трансформации.
- Добавьте 1 мкл интересующей плазмиды (в концентрации от 100 до 200 нг/л) в клетки и подвергните их тепловому удару при 42 °C в течение 45 с. Здесь используется плазмида, содержащая короткую шпильку (sh)РНК для подавления экспрессии Snrpn , и контрольная плазмида shSCRAMBLE.
ПРИМЕЧАНИЕ: Держите компетентные клетки на льду на протяжении всей процедуры, чтобы поддерживать эффективность трансформации. - Поместите трансформированные клетки на агаровые планшеты LB с соответствующим антибиотиком и инкубируйте их при 37 °C в течение 18 часов. Держите чашки Петри перевернутыми, чтобы предотвратить образование капель из-за конденсации, которая может нарушить колонии бактерий.
ПРИМЕЧАНИЕ: Добавляйте соответствующие антибиотики в питательную среду LB, чтобы обеспечить исключительно рост трансформированных бактерий. - С помощью стерильного наконечника для пипетки выберите отдельные колонии бактерий и перенесите их в колбу Эрленмейера, предварительно заполненную 250 мл LB, чтобы инициировать создание жидкой культуры. Избегайте выбора небольших колоний-сателлитов, расположенных вокруг более крупных целевых колоний, так как они могут не содержать желаемую плазмиду.
- Инкубируйте колбу, энергично встряхивая на орбитальном шейкере при температуре 37 °C в течение ночи.
- Используйте набор maxiprep, не содержащий эндотоксинов, и извлеките чистую плазмидную ДНК из бактериальных культур, следуя инструкциям производителя. Восстановите ДНК в соответствующем объеме воды, свободной от эндотоксинов, для получения концентрации плазмиды от 1 до 2 мкг/мкл.
ПРИМЕЧАНИЕ: Урожайность максипрепа зависит от роста культуры. Как правило, ресуспендирование гранулы плазмидной ДНК в объеме 200 мкл приводит к желаемой концентрации ДНК. - Храните пробирку с плазмидной ДНК при температуре -20 °C до использования. Подготовьте пробирку объемом 1,5 мл с конечным объемом 5 мкл, содержащую от 2 до 6 мкг плазмидной ДНК, предназначенной для нуклеофекции.
- Подготовка материала
- Приготовьте нуклеофекционный раствор. При использовании рекомендованного набора (см. Таблицу материалов) приготовьте 95 мкл раствора нуклеофекции в пробирке объемом 1,5 мл для каждой желаемой нуклеофекции. Пипетки и кюветы обычно входят в комплект. Приготовьте по одному из них для каждого условия нуклеофекции.
- Подготовьте колбу T25, наполненную 4 мл предварительно подогретой готовой среды в зависимости от кондиции, и держите ее в инкубаторе до использования.
- Подготовка ДНК
- Нуклеофекция НСК
- Используйте от 1 до 2 x 10по 6 отдельных клеток для каждого условия для оценки. Центрифугируйте клетки в течение 5 минут при 300 x g, затем удалите надосадочную жидкость.
- Добавьте 1 мл DPBS и повторно суспендируйте гранулу пипетированием вверх и вниз 10 раз, чтобы обеспечить однородную клеточную суспензию.
- Повторите центрифугирование (шаг 2.1.6) для второй промывки и, наконец, повторно суспендируйте гранулу в 95 мкл раствора нуклеофекции.
ПРИМЕЧАНИЕ: Этапы промывки имеют решающее значение для удаления антибиотиков из контрольной среды и обеспечения эффективной нуклеофекции. - Соедините 95 мкл клеток с предварительно смешанным раствором, содержащим по 5 мкл каждой плазмиды (всего 2 мкг), выбранной для нуклеофекции.
- С помощью микропипетки P200 перенесите этот раствор в кювету и поместите его в нуклеофекторное устройство.
- Нуклеофект клеток с нужными плазмидами с помощью оптимизированной программы НСК нуклеофекторной системы.
- После завершения электропорации осторожно введите теплую полную среду в кювету с помощью пипеток Пастера, входящих в комплект. Впоследствии переложите содержимое кюветы в заранее подготовленную колбу Т25, содержащую предварительно подогретую готовую среду. После электропорации может произойти гибель клеток, осаждение ДНК и образование вязкого агрегата. Не переносите его в колбу T25, так как это может снизить выживаемость клеток.
ПРИМЕЧАНИЕ: Этот шаг имеет решающее значение и должен быть выполнен как можно быстрее, чтобы обеспечить высокий выход нуклеофекции и последующую выживаемость культуры. - Инкубируйте нуклеофецированные клетки при 37 °C и 5%CO2 в увлажненном инкубаторе в течение 3–5 дней.
- Отбор нуклеофекцированных клеток
- Стратегия А: Отбор проточной цитометрии методом сортировки клеток, активируемых флуоресценцией (FACS)
- Через 3-5 дней после нуклеофекции проведите нуклеофектированные культуры, следуя шагу 2.1, и соберите все полученные индивидуализированные клетки.
- Отфильтруйте образцы через клеточный фильтр 40 мкм, чтобы удалить клеточные агрегаты, и проанализируйте их с помощью проточного цитометра клеточного сортировщика.
ПРИМЕЧАНИЕ: Для получения сравнительных результатов крайне важно отсортировать одинаковое количество клеток в каждом состоянии. - Используя программное обеспечение цитометра, можно определить живые клетки на основе двух показателей: прямого рассеяния света (FSC-A), который соответствует размеру клетки, и бокового рассеянного света (SSC-A), который соответствует внутриклеточной сложности. Выберите популяцию живых клеток, характеризующихся высоким FSC-A и высоким SSC-A.
ПРИМЕЧАНИЕ: По желанию добавьте 0,1 мкг/мл 4',6-диамидино-2-фенилиндола (DAPI) в клеточную суспензию перед сортировкой. Это позволит отбросить мертвые клетки и апоптотические тела из ворот. - Отбросьте дублеты и триплеты ячеек, построив графики параметров FSC-A и FSC-H. Выберите события, входящие в диагональ сюжета, представляющие собой синглеты.
ПРИМЕЧАНИЕ: Когда клетки проходят через лазер, цитометр обнаруживает изменения напряжения с течением времени. FSC-A обозначает зону сигнала, а FSC-H обозначает высоту пика. Синглеты показывают пропорциональное соотношение между FSC-A и FSC-H (расположены по диагонали графика), в то время как агрегаты ячеек демонстрируют больший FSC-A относительно FSC-H из-за более длинного сигнала. - Отбирайте нуклеофектированные клетки на основе интенсивности флуоресценции репортерного гена, кодируемого используемой плазмидой. Например, при использовании GFP+ ячейки могут быть выбраны на основе уровней флуоресценции FITC-A в сравнении с графиком SSC-A.
- Выделите желаемое количество клеток-мишеней для каждого условия и соберите их непосредственно в пробирке для сбора, заполненной готовой средой.
- Затравка нуклеофекционных НСК с плотностью 10 000 клеток/см2. Отсортированные клеточные культуры инкубируют при 37 °C и 5%CO2 в увлажненном инкубаторе.
- Стратегия Б: Отбор с использованием устойчивости к антибиотикам, закодированной в плазмиде
- Через 48 ч после нуклеофекции добавьте соответствующую концентрацию антибиотика для отбора устойчивых клеток.
ПРИМЕЧАНИЕ: Перед началом рекомендуется проверить многократные концентрации антибиотика на ненуклеофectированных клетках. Оптимальной концентрацией антибиотика является наименьшее количество, при котором все нерезистентные клетки элиминируются. Например, мы определили оптимальную концентрацию антибиотика бластицидина 4 мкг/мл для культур НСК. - Инкубируйте клетки при 37 °C и 5%CO2 в увлажненном инкубаторе в течение 48 часов.
- Через 48 ч после лечения антибиотиками субкультивируют нуклеофекцированные клетки в соответствии с этапом 2.1. Если нейросферы остаются маленькими, удалите антибиотик из питательной среды центрифугированием при 300 х г в течение 5 мин. Ресуспендируйте клетки и культивируйте их в колбе, используя только готовую среду. Инкубируйте клетки при 37 °C и 5%CO2 в увлажненном инкубаторе до тех пор, пока они не смогут быть расширены после шага 2.1.
- Через 48 ч после нуклеофекции добавьте соответствующую концентрацию антибиотика для отбора устойчивых клеток.
- Стратегия А: Отбор проточной цитометрии методом сортировки клеток, активируемых флуоресценцией (FACS)
Результаты
Оптимальные условия культивирования позволяют выделять и расширять НСК взрослого человека, полученных из СВЗ, in vitro
Культуры НСК, полученные из взрослого СВЗ, послужили ценным методом in vitro для исследования молекулярных механизмов и нишевых сигналов, регулирующих НСК в их специфическом микроокружении. Анализ нейросферы, описанный в этой рукописи, был использован для изучения количества NSC у взрослого SVZ. Ткань SVZ была выделена из мозга 3-месячных мышей, диссоциирована и культивирована в полной среде NSC с добавлением EGF и bFGF или каждого из них по отдельности. После 10 дней in vitro (DIV) общее количество первичных сфер, образовавшихся в этих трех различных условиях культивирования, было количественно определено с помощью фазово-контрастной микроскопии (рис. 2A, B). Примечательно, что наши результаты показывают, что присутствие EGF приводило к максимальному образованию первичных сфер, что очевидно из уменьшенного количества первичных сфер, наблюдаемого в культурах только с bFGF (рис. 2A, B). Для оценки способности НСК к самообновлению в различных условиях среды клетки подвергали субкультивированию и осаждению с низкой плотностью (5 клеток/мкл) в средах с добавлением вышеупомянутых комбинаций митогенов. Количественное определение вторичных сфер показало, что НСК СВЗ нуждаются по крайней мере в EGF для эффективного самообновления, и что комбинация EGF и bFGF улучшает способность клеток к самообновлению (рис. 2B). Кроме того, для детального анализа динамики роста в различных средах было зарегистрировано количество засеянных и полученных клеток на протяжении 7 пассажей. Кривые роста, полученные при различных средах, подтвердили, что культуры, дополненные только EGF или в комбинации с bFGF, продемонстрировали улучшенную динамику роста по сравнению с культурами, только дополненными bFGF (рис. 2C). В совокупности эти результаты подтверждают, что одновременное использование как EGF, так и bFGF повышает урожайность культивирования NSC in vitro.
Для того чтобы исследовать количество НСК в СВЗ в разных постнатальных возрастах и оценить влияние старения мышей на эффективность культуры нейросферы, была проанализирована ткань СВЗ у мышей в возрасте от 1 до 12 месяцев. Примечательно, что наши результаты показали значительное снижение количества первичных сфер с увеличением возраста, демонстрируя максимальную эффективность в количестве сфер в возрасте от 2 до 4 месяцев (Рисунок 2D). Кроме того, для оценки способности НСК к к самообновлению во время субкультивирования НСК от мышей в возрасте от 2 до 4 месяцев подкультивировали и высевали с клональной плотностью (5 клеток/мкл) в полной среде. Количественная оценка количества вторичных сфер в последующих проходах показала значительное снижение эффективности культивирования по сравнению с проходами (рисунок 2E). На основании всех этих наблюдений рекомендуется проведение анализов самообновления во время ранних пассажей для дальнейшей оптимизации условий культивирования НСК.
Нуклеофекция является высокоэффективным методом манипулирования экспрессией генов у взрослых НСК
Учитывая, что НСК не поддаются простой трансфекции для манипулирования экспрессией генов, здесь мы представляем протокол нуклеофекции с более высокой скоростью успешной доставки генов без необходимости использования вирусной трансдукции. После вскрытия и культивирования отдельных СВЗ у мышей в возрасте от 2 до 4 месяцев НСК подвергали нуклеофекции плазмидой, несущей GFP, как описано (рис. 3A). Обнаружение GFP-положительных клеток через 2 дня после нуклеофекции показало эффективность в диапазоне от 30% до 50%, что согласуется с предыдущей литературой28. Для выделения успешно функционирующих НСК клетки сортировали с помощью FACS на основе интенсивности флуоресценции GFP через 3–5 дней после нуклеофекции (рис. 3A-C). Примерно 40% клеток, проанализированных до FACS, продемонстрировали высокий уровень флуоресценции GFP и впоследствии были отобраны путем сортировки (рис. 3C). Повторный посев отсортированных GFP+ NSC показал, что все клетки были GFP-положительными, что подтверждает валидацию метода выделения клеток на основе нуклеофекции (рисунок 3D). Примечательно, что нуклеофектированные НСК сохраняли жизнеспособность в течение последующих пассажей, подтверждая возможность нуклеофекции для взрослых НСК. Эти результаты подчеркивают эффективность комбинации нуклеофекции и FACS для создания чистой культуры модифицированных НСК.
В качестве примера модуляции генов у взрослых НСК использовалось ослабление генов с помощью нуклеофекции короткой шпильки (sh) РНК. В частности, shRNA, нацеленная на ген малого ядерного рибонуклеопротеина полипептида N (Snrpn), несущего репортер CAG-GFP (shSNRPN), была nucleofected в культурах NSC, полученных от 2-месячных мышей. Подавление Snrpn было подтверждено с помощью количественной ПЦР и иммуноцитохимии в клетках, нуклеофектированных плазмидой shSNRPN, но не в контрольной плазмиде shSCRAMBLE (рис. 3E, F)29. Чтобы выяснить влияние подавления Snrpn на способность НСК к самообновлению, был проведен анализ низкой плотности в нуклеофectированных клетках (рис. 3F, G). Количественное определение вторичных нейросфер в нуклеофектированных культурах показало повышенную способность нейросферы к образованию при подавлении Snrpn (рис. 3G). Этот анализ подчеркивает способность нуклеофекции манипулировать экспрессией генов во взрослых НСК и, в частности, определяет роль Snrpn в поддержании стволовости у взрослых НСК.
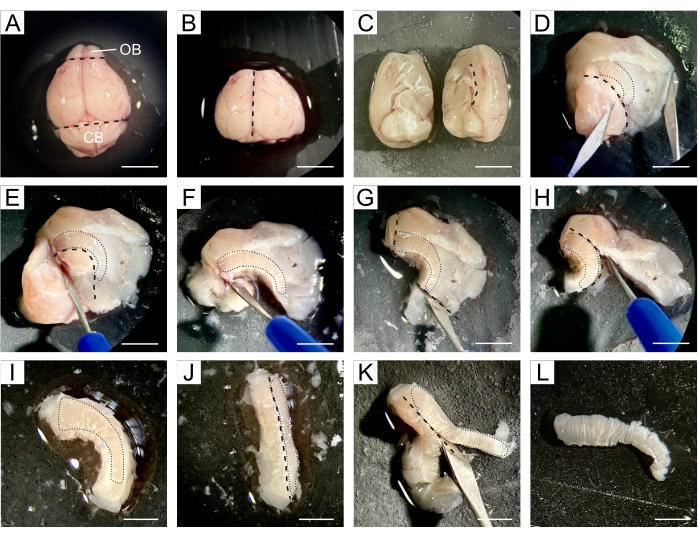
Рисунок 1: Подробное описание вскрытия СВЗ. (А) После удаления мозга мыши, весь мозг переносится с помощью DPBS на силиконовую прокладку для вскрытия. (Б) OB и мозжечок удаляются из мозга с помощью скальпеля. (В) Мозг разделяется на два полушария для проведения раздельного вскрытия. (D) Мозг открывается по линии мозолистого тела, отделяя кору и полосатое тело от гиппокампа, перегородки и промежуточного мозга, тем самым обнажая боковые желудочки. (Э-Ж) Гиппокамп, перегородка и промежуточный мозг удаляются вслед за вентральной границей желудочков. (Г-И) Ткань за ростральным и каудальным концами СВЗ и корой удаляется вслед за мозолистым телом. (Дж-К) Ткань наклоняется таким образом, что СВЗ обращена вбок, что позволяет удалить ткань полосатого тела под СВЗ. (L) Получается тонкий кусочек ткани, содержащий СВЗ. Черными пунктирными линиями обозначено место среза. Черными пунктирными линиями обозначено расположение СВЗ на каждом шаге. Сокращения: OB = обонятельная луковица; CB = мозжечок. Масштабная линейка в A-H: 5 мм; в I-L: 3 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
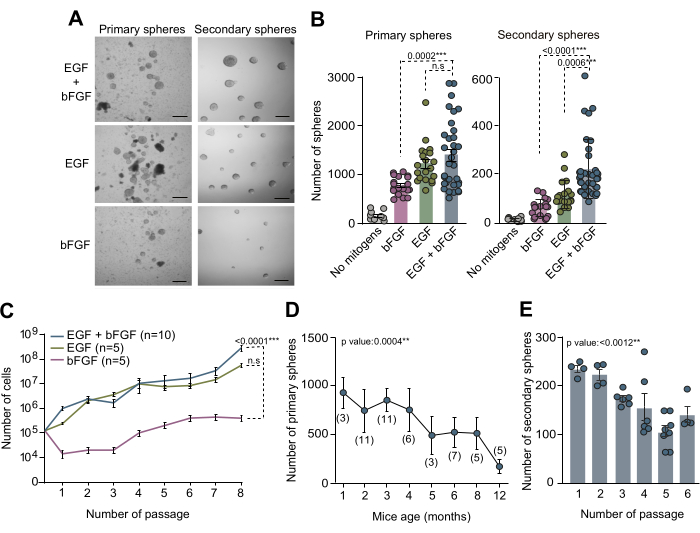
Рисунок 2: Оба митогена EGF и bFGF необходимы для оптимального культивирования и расширения НСК in vitro. (A) Фазово-контрастные микроскопические изображения первичных и вторичных культур нейросферы в среде НСК с добавлением EGF и bFGF или каждого митогена в отдельности. (B) Количество первичных сфер, полученных на мышь и на лунку в зависимости от митогенного состава питательной среды: без митогенов (серый, n=9), EGF+bFGF (синий, n=33), только EGF (зеленый, n=20) или только bFGF (розовый, n=19; левая панель). Количество вторичных нейросфер, образующихся при низкой плотности (5 клеток/мкл) на лунку в зависимости от митогенного состава питательной среды): нет митогенов (серый, n=11), bFGF (розовый, n=18), EGF (зеленый, n=18) или EGF+bFGF (синий, n=37; правая панель). Использовался критерий Краскела-Уоллиса с апостериорным анализом Данна. (C) Кривые роста, показывающие общее количество клеток, образовавшихся после 8 пассажей в различных культурах нейросферы в соответствии с митогенами, присутствующими в культуральной среде: bFGF (розовый, n=5), EGF (зеленый, n=5) или EGF+bFGF (синий, n=10). Использовался линейный регрессионный анализ. (D) Количество первичных нейросфер, полученных от отдельных мышей, препарированных и дезагрегированных от животных на различных постнатальных стадиях развития. Использовался линейный регрессионный анализ. n указан в скобках. (E) Количество вторичных нейросфер, образующихся при низкой плотности (5 клеток/мкл) в результате последующих пассажей in vitro для оценки их способности к самообновлению. Был использован критерий Краскела-Уоллиса, в который включены значения p: *: p<0,05; **: p<0.01; : р<0,001; : p<0.0001. Н.Ш.: Незначительный. Полосы погрешностей представляют собой SEM. Масштабная линейка в A составляет 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
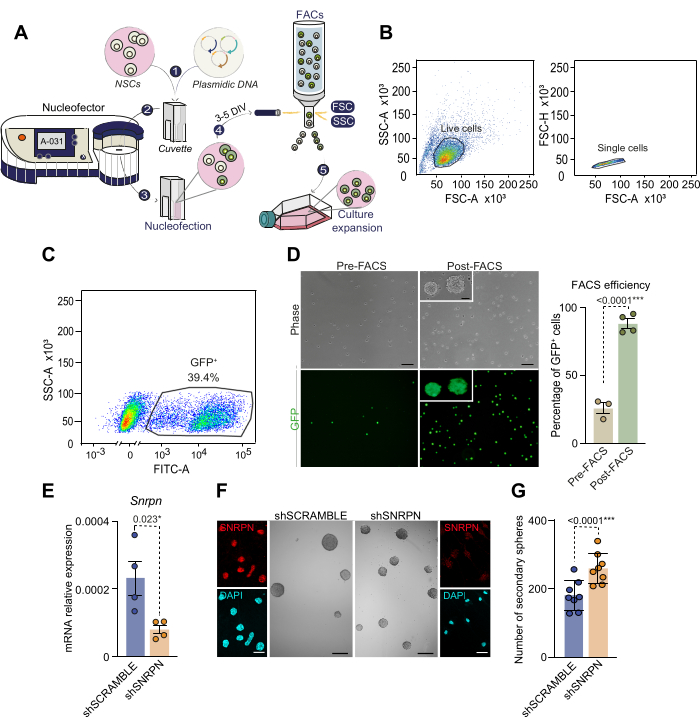
Рисунок 3: Схема процесса нуклеофекции и отбор клеток нуклеофекции на основе FACS. (A) Обзор процесса нуклеофекции и отбора клеток нуклеофected клеток на основе FACS. 1) Раствор плазмидной ДНК соединяют с раствором нуклеофекции и добавляют в клетки. Затем эту смесь переносят в кювету для нуклеофекции. 2) Кювета, содержащая ДНК и клетки, вставляется в нуклеофектор, где применяется электрошок. Для культур нейросферы, выделенных из взрослого СВЗ, рекомендуется использовать программу А-031 НСК. 3) После нуклеофекции клетки переносятся в колбу, содержащую полноценную среду с добавлением EGF и bFGF. 4) Клетки сортируются с помощью FACS на основе экспрессии репортера, содержащегося в плазмидной ДНК. 5) Отсортированные клетки подвергают дальнейшей культивации для последующих экспериментов. (B) Стратегия отбора на основе FACS и гейтирование для нуклеофектированных НСК. Сначала отбираются живые клетки на основе высокого FSC-A и высокого SSC-A (левый график), а затем удаляются клеточные дублеты и триплеты путем анализа параметров FSC-A в сравнении FSC-H (правый график). (C) FACS-гейтинг для нуклеофectированных клеток на основе их экспрессии GFP (SSC-A в сравнении с флуоресценцией FITC-A). (D) Фазово-контрастная микроскопия и флуоресцентные изображения GFP нуклеофectированных НСК до (n=3) и после (n=4) отбора FACS (левая панель). Процент нуклеофекцированных клеток GFP+ отображается до и после выбора FACS (правая панель). Был использован t-критерий. (Д) Количественная ПЦР (кПЦР) анализ экспрессии Snrpn в пролиферирующих НСК, нуклеофектированных Snrpn-специфичной шРНК (n=4). В качестве контроля проводилась нуклеофекция с помощью СКРЕМБЛ шРНК (n=4). Был использован t-критерий. (F) Иммуноцитохимические изображения, показывающие SNRPN (красным) в НСК через 7 дней после нуклеофекции шРНК (внешние панели). DAPI использовался для противодействия окрашиванию ДНК. Репрезентативные изображения, изображающие нейросферы, полученные из НСК в условиях shSNRPN и shSCRAMBLE (средние панели). (G) Количественная оценка количества нейросфер, образующихся в культурах НСК после нуклеофекции с помощью shSNRPN (n=8) или shSCRAMBLE (n=8). Был использован t-критерий. Включены значения p: *: p<0,05; **: p<0.01; : р<0,001; : p<0.0001. Н.Ш.: Незначительный. Шкала в D, 10 мкм; в F, 100 μm (изображения с большим увеличением в F, 7 μm). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Из-за отсутствия окончательных маркеров для идентификации популяции НСК in vivo, анализ НСК был основан в первую очередь на наблюдении за поведением клеток, выделенных из нейрогенных ниш, в условиях ex vivo . Новаторская работа Рейнольдса и Вайса заложила основу для создания точных условий культивирования, позволяющих выделять и расширять отдельные клетки из молодой взрослой (2-месячной) мышиной ткани SVZ в неадгезивных условиях. Эти клетки обычно размножаются в бессывороточной среде, содержащей EGF и bFGF, условиях, которые полностью препятствуют дифференцировке в нейроны и глию, способствуя пролиферации. Действительно, вэтих условиях культивирования большинство клеток умирает в течение первых дней в культуре, но небольшая часть начинает делиться и в первую очередь образует плавающиенейросферы. Ферментативная диссоциация и субкультура этих клеточных агрегатов способствуют размножению культур, демонстрируя способность этих культур к самообновлению.
Примечательно, что культуры нейросферы демонстрируют потенциал экспансии при добавлении только EGF, в то время как НСК, выращенные в среде, содержащей только bFGF, не демонстрируют длительной пролиферацииклеток30. Оба доказательства указывают на то, что EGF является основным самообновляющимся митогеном НСК. Тем не менее, присутствие как EGF, так и bFGF в культуральной среде улучшает способность к самообновлению НСК31, а также способствует балансировке потенциала дифференцировки в астроциты, нейроны и олигодендроциты 32,33,34,35. Кроме того, использование определенной смеси гормонов и факторов вместо коммерческих альтернатив для дополнения среды обеспечивает высокое качество и воспроизводимость культур НСК. В этих условиях культуры NSC мышей могут сохраняться в качестве стабильных клеточных линий, не подвергаясь иммортизации. Тем не менее, в нейросферных культурах вызывает озабоченность способность пролиферативных клеточных популяций претерпевать генетические трансформации, минуя механизмы регуляции клеточного цикла и приводя к иммортализованному фенотипу. Таким образом, несмотря на то, что культуры нейросферы обладают высокой способностью к расширению, культуры за пределами 10 пассажей in vitro обычно отбраковываются для исследований, поскольку они могут подвергаться репликативному старению, и могут появиться клетки с аномальным содержанием хромосом или нерегулярной динамикой роста. Кроме того, необходимо постоянно контролировать использование долговременных культур нейросферы. Культуры нейросферы также дают возможность исследовать их характеристики и потенциал в контролируемой среде, обеспечивая более точную и настраиваемую настройку, которую можно модулировать и контролировать более точно, чем in vivo. С помощью клоногенного или популяционного анализа in vitro можно количественно оценить способности этих клеток к самообновлению и пролиферации, что облегчает идентификацию основных механизмов, управляющих этими свойствами.
Тем не менее, несмотря на большой список преимуществ работы с НСК in vitro, характер этого протокола культивирования и деликатность НСК представляют собой проблему в этой области. Например, количество первичных нейросфер, образующихся во время типичного вскрытия, может значительно варьироваться в зависимости от мастерства и точности экспериментатора. Результаты исследования первичной нейросферы иллюстрируют эту изменчивость в количестве первичных нейросфер, полученных из СВЗ двухмесячных мышей, в диапазоне от 500 до 3000 нейросфер. Различные факторы могут способствовать этой изменчивости. Во-первых, точность диссекции сводит к минимуму нежелательную паренхиматозную ткань, которая препятствует образованию первичной сферы. Во-вторых, получение небольших кусочков ткани SVZ обеспечивает эффективное ферментативное сбраживание и растирание, тем самым уменьшая потерю клеток. Это подчеркивает необходимость достаточной предварительной практики протокола вскрытия и тонко настроенной разработки процессинга тканей во время создания культур нейросферы.
Еще одно ограничение этих культур заключается в том, что нейросферы могут содержать как НСК, так и клетки-предшественники, что затрудняет дифференциацию этих двух популяций в первичных культурах. В то время как различные маркеры, такие как GFAP, Nestin, Musashi и SOX2, экспрессируются NSCs8, ни один из них не был связан исключительно с NSCs. Новые методы FACS, основанные на экспрессии антигена клеточной поверхности, позволили выделить NSC и их потомство. Эти исследования показали, что предшественники, усиливающие транзит, не способны образовывать нейросферы при прохождении 25,36. Таким образом, в то время как отношения между клетками SVZ и клетками, инициирующими нейросферу, требуют дальнейшего уточнения 18,19,20,21,22,23, способность нейросфер к последовательному прохождению в течение длительного периода времени может отражать присутствие НСК в культурах.
Эта система культивирования нейросферы послужила надежной моделью для исследования влияния сигнальных путей и экспрессии генов на поддержание способности НСК к самообновлению in vitro 15,29. Один из подходов к изучению этих аспектов включает в себя трансфекцию НСК для либо сверхэкспрессии, либо подавления определенных генов. Это может быть достигнуто с помощью различных методов, в том числе вирусных и невирусных. В то время как вирусные векторы часто достигают высокой эффективности переноса генов, они имеют важные ограничения, такие как высокие требования к безопасности и трудоемкое производство векторов. И наоборот, классические методы трансфекции, такие как липофекция и электропорация, достигают очень низких показателей трансфекции, что делает их неосуществимыми для трудно трансфицируемых клеток. Технология нуклеофекции предлагает удобный для пользователя подход, сочетая решения для нуклеофекции, специфичные для типа клетки, с уникальными электрическими параметрами для каждого типа клеток37,38. Это обеспечивает перенос ДНК непосредственно в ядро клетки39, что позволяет встраивать ДНК независимым от клеточного цикла образом. Следовательно, нуклеофекция становится жизнеспособным методом для трансфекции труднотрансфицируемых клеток, таких как НСК мышей28,40.
Одним из ограничений этого метода является то, что для каждой нуклеофекции рекомендуется и необходимо минимум 2 x 106 клеток, хотя в оптимальных условиях можно использовать меньшее количество клеток на одну нуклеофекцию (т.е. 5 × 105 клеток). Еще одним недостатком метода является то, что качество и концентрация ДНК, используемой для нуклеофекции, существенно влияют на эффективность переноса генов. Использование подготовленной ДНК, не содержащей эндотоксинов, настоятельно рекомендуется для предотвращения повышенной смертности клеток из-за присутствия эндотоксинов. Кроме того, использование более 6 мкг общей ДНК для нуклеофекции может существенно снизить как эффективность переноса генов, так и жизнеспособность клеток. Наконец, введение электрического импульса также имеет решающее значение для выживания нуклеофectированных клеток.
В этой работе мы продемонстрировали манипулирование экспрессией гена Snrpn с помощью стратегии, включающей подавление его экспрессии с помощью эписомальных плазмид. Эти плазмиды не интегрированы в геном клеток, и поскольку НСК продолжают размножаться in vitro, введенная ДНК впоследствии разбавляется по мере деления клеток и, таким образом, теряет эффект генетической манипуляции. Таким образом, эта стратегия ценна для изучения эффекта острого изменения в течение короткого периода времени или для рождения клеток in vitro. Существуют некоторые альтернативы для оценки более длительного эффекта возмущения генов. Например, можно использовать интегративную систему, такую как piggyBAC на основе транспозонов. Эта система состоит из введения желаемой кодирующей последовательности, содержащейся в плазмиде, фланкированной транспонируемыми последовательностями, и совместного нуклеофекта клеток с плазмидой, содержащей последовательность фермента транспозазы41. В качестве альтернативы можно использовать транспозоны или системы CRISPR/Cas.
Дальнейшее развитие технологий трансфекции станет важным шагом на пути к высокопроизводительным анализам для оценки роли различных генов в физиологии взрослого нервного стволового клетки. В сочетании со все более сложными методами очистки и экспансии, эти исследования позволят понять биологию взрослых НСК in vitro и сравнить биологические различия между плавающими нейросферами и НСК in vivo.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана грантами от Ministerio de Ciencia e Innovación и Agencia Estatal de Investigación (MCIN/AEI) (PID2019-110045GB-I00; PID2022-142734OB-I00 и EUR2023-143479) в SRF. EJV (FPU20/00795) и DSL (FPU22/03797) финансируются испанской стипендиальной программой Formación de Profesorado Universitario (FPU). LLC (PRE2020-094137) и JDM (PREP2022-000680) финансируются в рамках испанской программы стипендий Formación de Personal Investigador (FPI). CMM (CIACIF/2022/366) финансируется Женералитатом Валенсии. MIL (CPI-22-481) финансируется стипендией Programa INVESTIGO (Next Generation EU). Финансирование в открытом доступе предоставлено Ministerio de Ciencia e Innovación.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 μm pore-filter bottles (250 mL) | VWR | 514-0330P | |
| 0.22 μm pore-filter bottles (500 mL) | VWR | 514-0332P | |
| 12-well plate | LabClinics | PLC30012 | |
| 15 mL tube | Fisher | 10738771 | |
| 24-well plate | LabClinics | PLC30024 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | BioWest | L0180-100 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| 48-well plate | ThermoFisher | 150687 | |
| 6-well plate | LabClinics | PLC30006 | |
| 96-well plate | Labclinics | PLC30096 | |
| Accutase solution | Sigma | A6964-100ML | Referred as enzymatic solution |
| Amaxa Mouse Neural Stem Cell Nucleofector Kit | Lonza | VPG-1004 | |
| Amaxa Nucleofector Iib | Lonza | 10700807 | |
| Antibiotic/Antimitotic (A/A) | Sigma | A5955 | |
| Apo-t-Transferrine | Sigma | T2252-1G | |
| Basic Fibroblast Growth Factor (bFGF) | Sigma | F0291 | |
| Blasticidin | Sigma | 203350 | |
| Bovine Serum Albumin (BSA) | Sigma | B4287-25MG | |
| Cell strainer 40 μm | LabClinics | PLC93040 | |
| Deoxynucleotide triphosphate (dNTPs) | NZYTech | MB08701 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dulbecco’s Phosphate Saline Buffer (DPBS) | Gibco | 14080-055 | |
| Dulbecco's Modified Eagle's Medium (DMEM) F12 1:1 | Gibco | 11320-074 | |
| E. coli DH5α Competent Cells | ThermoFisher | EC0112 | |
| Earles's Balanced Salt Solution (EBSS) | Gibco | 24010-043 | |
| Epidermal Growth Factor - Human recombinant (EGF) | Gibco | 53003-018 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | E-6511 | |
| Fine Forceps | Fine Science Tools | 11274-20 | |
| Fine Scissors Sharp | Fine Science Tools | 14060-09 | |
| Glucose | Sigma | G-7021 | |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Kit includes reagents for PCR |
| Heparin | Sigma | H-3149 | |
| Insuline | Sigma | I6634 | |
| LB agar (Lennox) | LabKem | AGLB-00P-500 | |
| LB broth (Lennox) | LabKem | LBBR-00P-500 | |
| L-Cysteine | Sigma | C-8277 | |
| L-Glutamine | Gibco | 25030-024 | |
| Neubauer chamber | Blaubrand | BR718620 | |
| Nuclease free water | Labbox | WATR-00A-10K | |
| NZYMaxiprep Endotoxin Free Kit | NZYTech | MB39901 | |
| Papain Lyophilized | Worthington | LS003119 | |
| Progesterone | Sigma | P-6149 | |
| Putrescine | Sigma | P-7505 | |
| Scalpel | Fine Science Tools | 10316-14 | |
| shSCRAMBLE | Mission (Sigma) | SHC003 | |
| shSNRPN | Mission (Sigma) | TRCN0000109285 | |
| Sodium Selenite | Sigma | S-9133 | |
| Spatula | Fine Science Tools | 10090-17 | |
| Sterile PES Syringe Filters (0.22 μm pore-filter) | Epica | SFPE-22E-050 | |
| T12.5 cm2 Flask | Biofil | TCF012025 | |
| T25 cm2 Flask | LabClinics | PLC70025 | |
| T75 cm2 Flask | LabClinics | PLC70075 | |
| Tweezers | Fine Science Tools | 91150-20 |
Ссылки
- Gage, F. H. Mammalian neural stem cells. Science. 287 (5457), 1433-1438 (2000).
- Ming, G., Song, H. Adult neurogenesis in the mammalian central nervous system. Ann Rev Neurosci. 28 (1), 223-250 (2005).
- Doetsch, F., Caillé, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97 (6), 703-716 (1999).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Regeneration of a germinal layer in the adult mammalian brain. Proc Natl Acad Sci. 96 (20), 11619-11624 (1999).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. J Neurosci. 17 (13), 5046-5061 (1997).
- Mamber, C., Kozareva, D. A., Kamphuis, W., Hol, E. M. Shades of gray: The delineation of marker expression within the adult rodent subventricular zone. Prog Neurobiol. 111, 1-16 (2013).
- Cebrian-Silla, A., et al. Single-cell analysis of the ventricular-subventricular zone reveals signatures of dorsal and ventral adult neurogenesis. eLife. 10, e67436(2021).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), New York, N.Y. 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. (45), e2393(2010).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ferrón, S. R., et al. Postnatal loss of Dlk1 imprinting in stem cells and niche astrocytes regulates neurogenesis. Nature. 475 (7356), 381-385 (2011).
- Gil-Perotín, S., et al. Adult neural stem cells from the subventricular zone: A review of the neurosphere assay. Anat Record. 296 (9), 1435-1452 (2013).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), 156059(2019).
- Ferrón, S. R., et al. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Prot. 2 (4), 849-859 (2007).
- Ferron, S., et al. Telomere shortening and chromosomal instability abrogates proliferation of adult but not embryonic neural stem cells. Development. 131 (16), 4059-4070 (2004).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Meth. 3 (10), 801-806 (2006).
- Santa-Olalla, J., Baizabal, J., Fregoso, M., Cárdenas, M. D. C., Covarrubias, L. The in vivo positional identity gene expression code is not preserved in neural stem cells grown in culture. Eur J Neurosci. 18 (5), 1073-1084 (2003).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: A critical review of sphere-formation as an assay for stem cells. Cell Stem Cell. 8 (5), 486-498 (2011).
- Wan, F., et al. The utility and limitations of neurosphere assay, CD133 immunophenotyping and side population assay in Glioma stem cell research. Brain Pathol. 20 (5), 877-889 (2010).
- Deleyrolle, L. P., Rietze, R. L., Reynolds, B. A. The neurosphere assay, a method under scrutiny. Acta Neuropsych. 20 (1), 2-8 (2008).
- Campos, L. S. Neurospheres: Insights into neural stem cell biology. Neurosci Res. 78 (6), 761-769 (2004).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres—re-evaluating the relationship. Nat Meth. 2 (5), 333-336 (2005).
- Parker, M. A. Expression profile of an operationally-defined neural stem cell clone. Exp Neurol. 194 (2), 320-332 (2005).
- Belenguer, G., et al. Adult neural stem cells are alerted by systemic inflammation through TNF-α receptor signaling. Cell Stem Cell. 28 (2), 285-299 (2021).
- Cruz, M. T. G., Simões, S., Lima, M. C. P. de Improving lipoplex-mediated gene transfer into C6 glioma cells and primary neurons. Exp Neurol. 187 (1), 65-75 (2004).
- Hagemann, C., et al. High efficiency transfection of glioma cell lines and primary cells for overexpression and RNAi experiments. J Neurosci Meth. 156 (12), 194-202 (2006).
- Moritz, S., Lehmann, S., Faissner, A., Holst, A. von An induction gene trap screen in neural stem cells reveals an instructive function of the niche and identifies the splicing regulator Sam68 as a Tenascin-C-regulated target gene. Stem Cells. 26 (9), 2321-2331 (2008).
- Montalbán-Loro, R., et al. TET3 prevents terminal differentiation of adult NSCs by a non-catalytic action at Snrpn. Nat Comm. 10 (1), 1726(2019).
- Gritti, A., et al. Epidermal and fibroblast growth factors behave as mitogenic regulators for a single multipotent stem cell-like population from the subventricular region of the adult mouse forebrain. J Neurosci. 19 (9), 3287-3297 (1999).
- Nieto-Estévez, V., Pignatelli, J., Araúzo-Bravo, M. J., Hurtado-Chong, A., Vicario-Abejón, C. A global transcriptome analysis reveals molecular hallmarks of neural stem cell death, survival, and differentiation in response to partial FGF-2 and EGF deprivation. PLoS One. 8 (1), 53594(2013).
- Vergaño-Vera, E., Méndez-Gómez, H. R., Hurtado-Chong, A., Cigudosa, J. C., Vicario-Abejón, C. Fibroblast growth factor-2 increases the expression of neurogenic genes and promotes the migration and differentiation of neurons derived from transplanted neural stem/progenitor cells. Neuroscience. 162 (1), 39-54 (2009).
- Gabay, L., Lowell, S., Rubin, L. L., Anderson, D. J. Deregulation of dorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron. 40 (3), 485-499 (2003).
- Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M., Götz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6. Mol Cell Neurosci. 25 (4), 664-678 (2004).
- Bithell, A., Finch, S. E., Hornby, M. F., Williams, B. P. Fibroblast growth factor 2 maintains the neurogenic capacity of embryonic neural progenitor cells in vitro but changes their neuronal subtype specification. Stem Cells. 26 (6), 1565-1574 (2008).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci. 106 (15), 6387-6392 (2009).
- Kobayashi, N., et al. Gene delivery to embryonic stem cells. Birth Def Res C. 75 (1), 10-18 (2005).
- Gresch, O., Altrogge, L. Transfection of difficult-to-transfect primary mammalian cells. Meth Mol Biol. 801, 65-74 (2011).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J Immunol Meth. 284 (1-2), 133-140 (2004).
- von Holst, A., Egbers, U., Prochiantz, A., Faissner, A. Neural stem/progenitor cells express 20 tenascin C isoforms that are differentially regulated by Pax6. J Biol Chem. 282 (12), 9172-9181 (2007).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trend Biotechnol. 33 (9), 525-533 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены