A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المكثفات الاصطناعية والبنى الشبيهة بالخلايا من الهياكل النانوية للحمض النووي البرمائي
In This Article
Summary
نقدم بروتوكولا لإعداد المكثفات الجزيئية الحيوية الاصطناعية التي تتكون من نجوم نانوية من الحمض النووي البرمائي بدءا من قليل النيوكليوتيدات المكونة لها من الحمض النووي. يتم إنتاج المكثفات إما من مكون نانوستار واحد أو مكونين ويتم تعديلها للحفاظ على النسخ في المختبر للحمض النووي الريبي من قالب الحمض النووي المضمن.
Abstract
أصبحت القطرات والمكثفات الاصطناعية مكونات شائعة بشكل متزايد لأنظمة المحاكاة الحيوية المتقدمة والخلايا الاصطناعية ، حيث يمكن استخدامها لإنشاء تجزئة والحفاظ على استجابات شبيهة بالحياة. أظهرت الهياكل النانوية للحمض النووي الاصطناعي إمكانات كبيرة ككتل بناء لتشكيل المكثفات بسبب شكلها القابل للبرمجة ، ووظائفها الكيميائية ، وسلوك التجميع الذاتي. لقد أثبتنا مؤخرا أن "النجوم النانوية" للحمض النووي البرمائي ، التي تم الحصول عليها عن طريق تسمية تقاطعات الحمض النووي بشقوق كارهة للماء ، تشكل حلا قويا ومتعدد الاستخدامات بشكل خاص. يمكن برمجة مكثفات الحمض النووي البرمائية الناتجة لعرض البنى الداخلية المعقدة والمتعددة الأجزاء ، والاستجابة هيكليا لمختلف المحفزات الخارجية ، وتوليف الجزيئات الكبيرة ، والتقاط الحمولات وإطلاقها، والخضوع للتحولات المورفولوجية ، والتفاعل مع الخلايا الحية. نوضح هنا بروتوكولات تحضير مكثفات الحمض النووي البرمائية بدءا من قليل النيوكليوتيدات المكونة للحمض النووي. سنتناول (i) الأنظمة أحادية المكون التي تشكل مكثفات موحدة ، (ii) الأنظمة المكونة من عنصرين والتي تشكل مكثفات الغلاف الأساسي ، و (iii) الأنظمة التي يتم فيها تعديل المكثفات لدعم النسخ في المختبر للهياكل النانوية للحمض النووي الريبي.
Introduction
الخلايا الاصطناعية عبارة عن أجهزة بمقياس ميكرومتر (10-50 ميكرومتر) تم إنشاؤها من الأسفل إلى الأعلى لتكرار وظائف وهياكل الخلايا البيولوجية الموجودة 1,2. غالبا ما ترتبط الخلايا الاصطناعية بأغشية مبنية من حويصلات ثنائية الطبقة الدهنية3،4،5،6،7 ، أو بوليميرسومات8،9 ، أو بروتينوسومات10،11 ، والتي يمكن استخدامها أيضا لإنشاء تجزئة داخلية12،13. مستوحاة من العضيات الخالية من الأغشية المعروفة بالحفاظ على وظائف مختلفة في الخلايا الحية14 ، تكتسب الهياكل مثل coacervates البوليمرية والمكثفات الجزيئية الحيوية والهلاميات المائية قوة دفع كبدائل متعددة الاستخدامات وقوية لإنشاء كل من التقسيم الخارجي والداخلي في الخلايا الاصطناعية15،16،17،18.
بالاستفادة من مجموعة الأدوات المتنوعة لتقنية النانو DNA19 ، تم تطوير حلول متعددة لهندسة القطرات والمكثفات الاصطناعية من التجميع الذاتي للهياكل النانوية للحمض النووي الاصطناعي ، والتي يمكن برمجة حجمها وشكلها ووظائفها وتكافؤها وتفاعلاتها المتبادلة بدقة20. قطرات أو مكثفات الحمض النووي متوافقة حيويا ويمكن أن تعمل كسقالات لكل من الخلايا الاصطناعية والعضيات ، وتستضيف التفاعلات الكيميائية والجزيئية الحيوية21 ، ومعلومات الحوسبة22,23 ، والتقاط الشحنات وإطلاقها24,25 ، والحفاظ على الاستجابات الهيكلية26.
من بين التصاميم المتنوعة للهياكل النانوية للحمض النووي المكونة للمكثفات ، أثبتت النجوم النانوية للحمض النووي البرمائي - التي يطلق عليها اسم C-stars - أنها قوية ومتعددة الاستخدامات27. النجوم C هي زخارف متفرعة بسيطة تتكون من تقاطع DNA ثابت (عادة رباعي الاتجاهات) ، تظهر منه أذرع الحمض النووي المزدوجة (ds)28. ثم يتم إمالة الأذرع بأجزاء كارهة للماء ، عادة الكوليسترول ، مما يجعل الهياكل النانوية برمائية ويقود تكثيفها بعد تلدين مباشر في وعاء واحد. توفر مكثفات C-star قابلية برمجة هيكلية ووظيفية دقيقة ، بما في ذلك إمكانية إنشاء بنى متعددة الأجزاء29,30 ، والاستجابة الهيكلية لمشغلات الحمض النووي والكاتيون31 ، وتوليف الجزيئات الكبيرة29 ، والتقاط الحمولات وإطلاقها32 ، والتفاعل مع الخلايا الحية33. أدناه ، سنصف ونناقش بروتوكولات إنتاج مكثفات C-star بدءا من oligonucleotides المكونة لها.
يلخص البروتوكول تحضير المكثفات الأحادية (المكونة من مكون واحد) والثنائي (المكون من عنصرين) ، باستخدام ثلاثة تصميمات مختلفة لنجوم C (الشكل 1) - "غير مستجيبة" و "مستجيبة ل TMSD" و "قوالب RNA". تتكون النجمة C "غير المستجيبة" (اللوحة A) من أربعة "خيوط أساسية" مع تسلسلات مميزة تشكل التقاطع رباعي الاتجاهات. ترتبط أربعة قليل نيوكليوتيدات متطابقة معدلة بالكوليسترول بالوصلة ، مما يضمن وجود جزيء الكوليسترول في نهاية كل ذراع. تشكل نجوم C غير المستجيبة سقالات بسيطة وخاملة للمكثفات الأحادية والثنائية. في C-star "المستجيب ل TMSD" (اللوحة B) ، يتم ضمان الاتصال بين الخيوط المعزولة والوصلة من خلال حبلا "جسر Toeholding " ، والذي يتميز بمجال "موطئ قدم" DNA أحادي الشريط (ss). في وجود شريط DNA غازي مع مجال موطئ قدم تكميلي ، يمكن تشغيل تفاعل إزاحة الشريط بوساطة إصبع القدم34 ، حيث يقوم الغازي بإزاحة جسر Toeholding ، مما يؤدي إلى قطع الاتصال بين الوصلة والأجزاء الكارهة للماء ويؤدي إلى تفكيك شبكة الحمض النووي32. أخيرا ، يتضمن "قالب الحمض النووي الريبي" C-star (اللوحة C) تعديلا "أساسيا" مكملا لشريط "الجسر" ، والذي يربط الأخير قالب ssDNA القابل للنسخ ل Broccoli aptamer29. يمكن العثور على تفاصيل تسلسل oligonucleotides المكونة للأنواع الثلاثة من تصميمات C-star المذكورة هنا في الجدول التكميلي 1 وعبر الأعمال السابقة29،30،32.
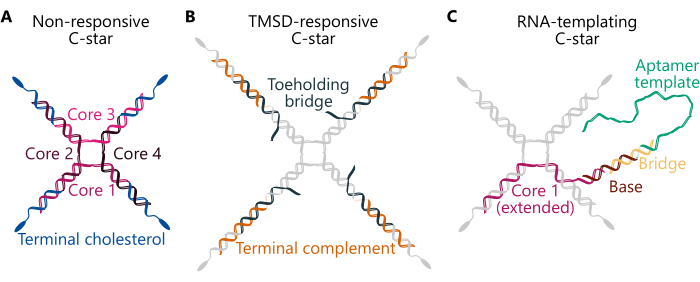
الشكل 1. مخططات لثلاثة تصميمات مختلفة لنجوم الحمض النووي البرمائية النانوية (C-stars). يمكن العثور على تسلسلات قليل النوكليوتيد لأمثلة مختلفة من النجوم C الموصوفة هنا في الجدول التكميلي 1. (أ) رسم تخطيطي لنجمة C مصممة لتشكيل مكثفات غير مستجيبة ، مع خيوط قليل النوكليوتيد المكونة "Core 1" و "Core 2" و "Core 3" و "Core 4" (ملونة بظلال من اللون الوردي) و "الكوليسترول النهائي" (ملون باللون الأزرق). يمثل كل لون فريد حبلا قليل النوكليوتيد بتسلسل فريد. "Core 1" و "Core 3" مكملان جزئيا ل "Core 2" و "Core 4" ، لكنهما غير مكملين لبعضهما البعض. (ب) رسم تخطيطي لنجمة C مصممة للتفكيك عند إضافة حبلا غازيا عبر إزاحة حبلا بوساطة إصبع القدم ، كما هو موضح في العمل السابق32. يتكون هذا النجم C من خيوط "الأساسية" و "الكوليسترول النهائي" (ملونة باللون الرمادي) بالإضافة إلى "مكمل طرفي" (كما هو موضح باللون البرتقالي) وخصلة "جسر تثبيت القدم" (كما هو موضح باللون الأزرق الداكن). يحتوي الأخير على نتوء من ستة نيوكليوتيدات يمكن أن يرتبط به حبلا غازي مصمم بشكل مناسب ثم يحل محل حبلا "جسر إصبع القدم" تماما ، مما يتسبب في تفكك تقاطع النجم النانوي المركزي (المكون من "Core 1 و 2 و 3 و 4") من الدوبلكس المكون من خيوط "المكمل الطرفي" و "الكوليسترول الطرفي". (ج) رسم تخطيطي لنجم C يعمل بقالب DNA ل RNA aptamer. يتكون هذا أيضا من حبلا "الكوليسترول النهائي" و "Core 2 و 3 و 4" (تظهر جميعها باللون الرمادي) ، بالإضافة إلى نسخة موسعة من حبلا "Core 1" (كما هو موضح باللون الوردي) ، وخيط "Base" (بني) ، وخيط "Bridge" (أصفر) ، و "قالب Aptامر" (أخضر). يشكل ازدواج الحمض النووي المكون من الشريطين الأخيرين منطقة محفز البوليميراز T7 ، والتي تحدد موقع بدء النسخ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تتشكل مكثفات C-star عند التلدين الحراري لقليل النيوكليوتيدات المكونة ، والتي يتم إجراؤها في البروتوكول المقدم هنا داخل الشعيرات الدموية الزجاجية المختومة ذات المقطع العرضي المستطيل بنسبة عرض إلى ارتفاع عالية. توفر هذه الحاويات مزايا رئيسية متعددة: ط) يضمن الختم منع التبخر تماما خلال خطوات التلدين (البطيئة أحيانا) ؛ ب) يتيح القاع المسطح ذو الجودة البصرية للشعيرات الدموية تصوير التجميع الذاتي (أو التفكيك) العابر ؛ ج) تضمن نسبة العرض إلى الارتفاع العالية للشعيرات الدموية استقرار المكثفات الثقيلة على مساحة واسعة ومسطحة ، مما يقلل من فرص الالتحام والتجميع في المراحل اللاحقة من عابر التجميع الذاتي الذي قد يحدث في حاويات على شكل إسفين (على سبيل المثال ، أنابيب الطرد المركزي الدقيقة) ، وإنتاج مجموعات مكثفات أحادية التشتت نسبيا ؛ د) يؤدي إجراء التلدين في شعيرات زجاجية ممدودة إلى تقليل تعرض العينة للواجهات الكارهة للماء (الهواء أو البلاستيك أو الزيت) ، والتي لوحظ أنها تزعج التجميع الذاتي عن طريق تجنيد قليل النيوكليوتيدات الكوليسترول البرمائي. بمجرد اكتمال بروتوكول التجميع ، يمكن استخراج المكثفات من الشعيرات الدموية الزجاجية لإجراء مزيد من التجارب التي تتضمن كواشف إضافية.
Protocol
ملاحظة: ينقسم البروتوكول إلى ثلاثة أقسام. يصف القسم 1 الخطوات الأساسية ، بما في ذلك تحضير قليل النوكليوتيدات الحمض النووي والشعيرات الدموية الزجاجية. يصف القسم 2 تحضير مكثفات C-star ذات التصميمات المختلفة ، بما في ذلك التصميمات المكونة من مكون واحد ومكونين ، واستخراجها من الشعيرات الدموية الزجاجية. يصف القسم 3 استخدام مكثفات C-star المكونة من عنصر واحد لقوالب الحمض النووي الريبي لتخليق أبتامير الحمض النووي الريبي. يجب على المستخدم اتباع الممارسات المعملية الجيدة طوال الوقت ، والتأكد من وجود جميع تقييمات المخاطر اللازمة والتخفيف من حدتها ، وارتداء معدات الحماية الشخصية المناسبة (PPE) ، بما في ذلك القفازات ونظارات السلامة ومعطف المختبر. يتطلب تنظيف الأنابيب الشعرية الزجاجية صوتنة ، أولا في محلول الفاعل بالسطح والثاني في الأيزوبروبانول أو الإيثانول. يتطلب استخراج مكثفات C-star من الأنابيب الشعرية استخدام قلم خربشة ماسي لتسجيل الزجاج وقطعه ، مع ما يرتبط بذلك من خطر الإصابة من شظايا الزجاج. يتم سرد المواد والمعدات والكواشف الرئيسية المستخدمة في جدول المواد. يتم تنقية معظم قليل النيوكليوتيدات غير الوظيفية من قبل المورد باستخدام التحلية القياسية ، باستثناء خيوط "Core 1 الموسعة" و "قالب Aptamer" ، والتي يتم طلبها باستخدام تنقية كهربائي بولي أكريلاميد جل (PAGE). يتم تنقية قليل النوكليوتيدات المعدلة بالكوليسترول من قبل المورد باستخدام كروماتوغرافيا سائلة عالية الأداء ذات الطور العكسي (HPLC).
1. المتطلبات الأساسية
ملاحظة: يجب تحضير المحاليل التالية في ماء عالي النقاء (النوع الأول) وتصفيتها باستخدام مرشحات حقنة 0.22 ميكرومتر: مخزن مؤقت Tris-EDTA (TE) ، يتألف من 10 mM Tris ، 1 mM EDTA ، عند درجة الحموضة ~ 8.0 ؛ مخزن مؤقت TE مكمل ب 2 M كلوريد الصوديوم ؛ ومخزن مؤقت TE مكمل ب 0.3 M كلوريد الصوديوم. يجب استخدام المحاليل العازلة في غضون 2 أسابيع من التحضير وتخزينها في درجة حرارة 4 درجة مئوية عندما لا تكون قيد الاستخدام. بالإضافة إلى ذلك ، سيتم استخدام محلول 1 ٪ من المنظفات البصرية القلوية في الماء عالي النقاء لتنظيف الشعيرات الدموية الزجاجية.
- تحضير قليل النوكليوتيدات الحمض النووي من الحالة المجففة بالتجميد
- أجهزة الطرد المركزي لفترة وجيزة (2000 × ز لمدة 10-30 ثانية) أنابيب oligonucleotides الحمض النووي المجففة بالتجميد لضمان تجمع كريات الحمض النووي المجفف بالتجميد في القاع.
ملاحظة: يتم الطرد المركزي في درجة حرارة الغرفة (RT) لمدة 10-30 ثانية. جهاز الطرد المركزي الصغير المستخدم هنا افتراضيا إلى 2000 × جم (6000 دورة في الدقيقة). - أضف الكمية المناسبة من المخزن المؤقت TE لإعادة تكوين كل قليل النوكليوتيد عند 100 ميكرومتر. دوامة جيدا لضمان الذوبان الكامل ، ثم قم بتدوير الأنابيب لتجميع كل السوائل وفقا للخطوة 1.1.1.
- لكل محلول مخزون ، قم بقياس الامتصاص عند 260 نانومتر واحسب التركيز النهائي باستخدام معامل الانقراض لتسلسل قليل النوكليوتيد قيد الاختبار.
ملاحظة: عادة ما يوجد معامل الانقراض لتسلسل قليل النوكليوتيد المعين في ورقة بيانات المورد ولكن يمكن أيضا حسابه باستخدام أدوات عبر الإنترنت باستخدام أقرب نموذج جار35 أو قيم مجدولة لمعامل الانقراض للنيوكليوتيدات الفردية36. - قم بتخزين قليل النيوكليوتيدات المعاد ترطيبها في 4 درجات مئوية لفترات قصيرة من الزمن (تصل إلى 1 أسبوع) أو في -20 درجة مئوية للتخزين طويل الأجل (حتى 6 أشهر).
- أجهزة الطرد المركزي لفترة وجيزة (2000 × ز لمدة 10-30 ثانية) أنابيب oligonucleotides الحمض النووي المجففة بالتجميد لضمان تجمع كريات الحمض النووي المجفف بالتجميد في القاع.
- تنظيف الأنابيب الشعرية الزجاجية
- Sonicate في 1 ٪ المنظفات البصرية القلوية للمكونات البصرية في الماء منزوع الأيونات.
- خذ العدد المطلوب من الأنابيب الشعرية الزجاجية المراد تنظيفها وضعها في حاوية طويلة وضيقة (على سبيل المثال ، دورق أو أنبوب طرد مركزي 15/50 مل) بحيث لا تستلقي الشعيرات الدموية بشكل مسطح على قاعدة الحاوية.
- أضف المنظف إلى الحاوية ، واملأه فوق مستوى الأنابيب الشعرية مباشرة. تأكد من عدم وجود فقاعات هواء محاصرة داخل الأنابيب الشعرية - انقر لإزالتها ، إذا لزم الأمر. قم بتغطية الحاوية بشكل غير محكم (على سبيل المثال ، في ورق القصدير أو باستخدام غطاء أنبوب الطرد المركزي ، مع التأكد من أنها ليست مغلقة بإحكام).
- اضبط حمام مائي صوتنة على 40 درجة مئوية ، ضع الحاوية المغطاة في وضع مستقيم في الحمام ، وقم بصوتنة لمدة 30 دقيقة. تأكد من أن الرقاقة ، إذا تم استخدامها ، لا تتلامس مع الماء في حمام الصوتنة.
ملاحظة: حمام صوتنة المستخدمة في هذه الدراسة الافتراضي إلى تردد صوتنة من 60 هرتز وقوة صوتنة من 150 W.
تنبيه: لا تقم أبدا بإضافة أو إزالة العناصر من حمام صوتنة أثناء الجري ؛ قم دائما بإيقاف البروتوكول أولا. - بمجرد اكتمال صوتنة ، قم بإيقاف تشغيل عنصر التسخين في حمام مائي صوتنة ، ثم شطف الشعيرات الدموية جيدا في الحاوية بماء منزوع الأيونات أو فائق النقاء - ما لا يقل عن خمس مرات ، وتجاهل ماء الشطف في كل مرة.
- Sonicate في 1 ٪ المنظفات البصرية القلوية للمكونات البصرية في الماء منزوع الأيونات.
- سونيكات في الأيزوبروبانول أو الإيثانول.
- إلى الأنابيب الشعرية الزجاجية في حاوية التنظيف ، أضف الأيزوبروبانول أو الإيثانول (70٪ على الأقل) ، وملء أعلى بقليل من مستوى الأنابيب الشعرية. كما في الخطوة 1.2.1.2 ، تأكد من عدم وجود فقاعات هواء محبوسة في الأنابيب الشعرية وقم بتغطية الحاوية بشكل غير محكم.
- ضع الحاوية في وضع مستقيم في حمام صوتنة وصوتنة لمدة 15-30 دقيقة.
تنبيه: الأيزوبروبانول والإيثانول قابلان للاشتعال ، مع وجود نقاط وميض أسفل RT. قلل من أحجام المذيبات المستخدمة أثناء التنظيف عن طريق اختيار حاوية ذات حجم مناسب ، وتأكد من تغطية الحاويات بشكل فضفاض ، ولا تترك حمام الصوتنة دون مراقبة خلال هذه المرحلة. - بمجرد اكتمال صوتنة ، تخلص بشكل مناسب من الأيزوبروبانول أو الإيثانول وجفف الشعيرات الدموية تحت النيتروجين ، وتعامل معها بأنسجة خالية من النسالة.
2. تحضير واستخراج مكثفات C-star (الشكل 2)

الشكل 2: تحميل مخاليط C-star واستخلاص المكثفات من الأنابيب الشعرية الزجاجية. في جميع الألواح ، تم استبدال خليط C-star بمحلول مائي من 25 mM calcein للمساعدة في الرؤية. (أ-ه) الخطوات الرئيسية ، من أجل ، يجب اتخاذها قبل التلدين ، المقابلة لأقسام البروتوكول 2.1 و 2.2. (ف-ج) الخطوات الرئيسية ، من أجل ، يجب اتخاذها بعد التلدين ، المقابلة لقسم البروتوكول 2.3. أثناء الاستخراج (الألواح (I-J)) ، سوف تترسب مكثفات الحمض النووي من الشعيرات الدموية إلى الخزان العازل طالما يتم تخزين أنبوب الطرد المركزي الدقيق عموديا. لن تكون المكثفات مرئية للعين المجردة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحضير مخاليط C-star للمكثفات أحادية المكون
ملاحظة: يمكن العثور على تفاصيل التسلسل لمختلف التصاميم للمكونات الفردية في الجدول التكميلي 1 وعبر الأعمال السابقة29،30،32. تم تطوير بروتوكولات التلدين البطيء المحددة في الخطوتين 2.1.9 و 2.2.2 لضمان استرخاء شبكات النجوم النانوية إلى أشكال مدمجة ، بالنظر إلى الخصائص الريولوجية التي تعتمد بشدة على درجة الحرارة لشبكات النجومالنانوية 37.- ستختلف مكونات قليل النوكليوتيد والعازلة اعتمادا على تصميم C-star المطلوب. قم بإعداد خليط 60 ميكرولتر من مكثفات C-star أحادية المكون بتركيز 5 ميكرومتر إما لنجم C رباعي الأذرع غير المستجيب ، أو C-star المستجيب ل TMSD ، أو C-star الذي يجرب الحمض النووي الريبي.
- لكل تصميم ، ماصة المكونات المناسبة المدرجة في الجدول التكميلي 2 في أنبوب طرد مركزي دقيق منفصل وتخلط جيدا عن طريق الماصة.
ملاحظة: يفترض أن تكون جميع محاليل مخزون قليل النوكليوتيد بتركيز 100 ميكرومتر في TE. - اسحب 60 ميكرولتر بالكامل من محلول C-star والماصة بعناية لحقن الخليط في الأنبوب الشعري الزجاجي الجاف النظيف كما هو موضح في الشكل 2A ، مع الحرص على تجنب إدخال فقاعات الهواء.
- باستخدام ماصة ، قم بحقن ما يقرب من 9-12 ميكرولتر من الزيت المعدني في كل طرف من طرفي الأنبوب الشعري ، مع تغطية العينة بحيث لا توجد واجهة حرة بين محلول C-star والهواء (انظر الشكل 2B). بعد ذلك ، جفف الأنبوب الشعري بعناية بمناديل ورقية لضمان عدم وجود زيت على السطح الخارجي منه (الشكل 2C) ، مع الحرص على عدم فتل الزيت المعدني أو محلول C-star خارج الأنبوب الشعري. النتيجة النهائية موضحة في الشكل 2D.
- قم بإعداد مجموعة صغيرة من غراء الإيبوكسي المكون من جزأين للالتصاق بكل طرف من طرفي الأنبوب الشعري ، الجانب المسطح لأسفل ، بزلة غطاء زجاجي. تأكد من تغطية فتحات الأنبوب بالكامل بالغراء ، مما يشكل ختما مستمرا ، كما هو موضح في الشكل 2E.
- توضع جانبا للعلاج لمدة لا تقل عن 3 ساعات ، ولكن يفضل بين عشية وضحاها.
- بعد ~ 30 دقيقة من المعالجة ، افحص طبقة الغراء بحثا عن وجود فجوات في الختم ناتجة عن فقاعات الهواء. إذا كانت هذه موجودة ، فقم بإغلاقها باستخدام كمية صغيرة من الغراء.
- لف الأنبوب الشعري الملصق على غطاء الغطاء بورق القصدير ، مع ضمان إبقاء الرقاقة مسطحة في الجانب السفلي من انزلاق الغطاء الزجاجي. يضمن الرقاقة اتصالا حراريا جيدا بينه وبين عنصر التسخين في جهاز التدوير الحراري (انظر الخطوة التالية).
- ضع العينة المغلفة في جهاز تدوير حراري وصلب باستخدام البروتوكول التالي: امسك عند 95 درجة مئوية لمدة 30 دقيقة ، ثم تبرد من 85 درجة مئوية إلى 50 درجة مئوية عند -0.04 درجة مئوية · دقيقة -1 ، ثم تبرد من 50 درجة مئوية إلى RT عند -0.5 درجة مئوية · دقيقة -1.
- قم بتخزين مكثفات C-star الملدنة عند 4 درجات مئوية أو RT لفترات طويلة (أشهر) طالما ظلت الشعيرات الدموية مغلقة ، حيث يقوم التلدين الحراري بتعقيم العينة بشكل فعال وتشويه النيوكليازات. حافظ على الشعيرات الدموية مسطحة أثناء التخزين والمناولة لمنع المكثفات من الترسب نحو أحد طرفيها وتجميعها.
- تحضير مخاليط C-star للمكثفات الثنائية
ملاحظة: للإبلاغ عن اختيار مجموعات النجوم C للأنظمة الثنائية ، راجع عمل Malouf et al. ، الذي يصف قواعد التصميم وسلوك الطور المتوقع لمكثفات C-starالثنائية 30.- لتحضير المكثفات الثنائية ، ادمج 30 ميكرولتر من مخاليط C-star الموصوفة في الخطوة 2.1 أعلاه في حجم إجمالي قدره 60 ميكرولتر ، واخلطها جيدا ، وقم بتحميلها في الشعيرات الدموية ، واتبع الخطوات 2.1.4-2.1.8.
- ضع العينة المغلفة في جهاز تدوير حراري وصلب باستخدام البروتوكول التالي: امسك عند 95 درجة مئوية لمدة 30 دقيقة ، ثم تبرد من 85 درجة مئوية إلى 40 درجة مئوية عند -0.01 درجة مئوية · دقيقة -1 ، ثم تبرد من 40 درجة مئوية إلى RT عند -0.1 درجة مئوية · دقيقة -1.
- استخراج مكثفات C-star من الأنابيب الشعرية.
- قم بإعداد أنبوب طرد مركزي كبير (1.5 مل أو 2.0 مل) يحتوي على 60 ميكرولتر من 0.3 متر كلوريد الصوديوم في مخزن TE.
- قم بفك غلاف العينة الشعرية واستخدم قلم خربشة ماسي لتسجيل الجانب السفلي من غطاء الغطاء في كل طرف داخلي للمنطقة الملصقة (الشكل 2F). اقطع غطاء الغطاء في هذه المنطقة وتخلص منه بشكل مناسب.
- قم بتنظيف الأنابيب الشعرية جيدا بالإيثانول وجافة.
- سجل كل طرف من طرفي الأنابيب الشعرية باستخدام قلم الكتابة الماسي ، أولا بالجانب السفلي (الشكل 2G) ، ثم اقلب الأنابيب وسجلها "الجانب الأيمن لأعلى".
- تأكد من أن خطوط النتيجة لا تتداخل مع واجهة الزيت والماء. يجب أن تكون داخل المنطقة المائية لمنع الزيت من البقاء في العينة المستخرجة.
- التقط نهايات الأنابيب الشعرية (الشكل 2H) ، مع الاحتفاظ بالجزء المركزي من الأنبوب والتخلص من الباقي. ضع الأنبوب الشعري المقطوع في أنبوب الطرد المركزي الدقيق المحضر في الخطوة 2.3.1 ، مع التأكد من أن الجزء السفلي من الأنبوب الشعري يتلامس مع المحلول العازل (الشكل 2I).
- سوف تترسب المكثفات من الأنبوب إلى الخزان العازل من خلال الجاذبية. اسمح بحدوث ذلك لمدة لا تقل عن 10 دقائق (الشكل 2J). قم بإزالة الأنبوب الشعري المقطوع وتخلص منه بشكل مناسب. يحد نهج الاستخراج اللطيف هذا من مخاطر تجميع المكثفات.
3. نسخ أبتامير الحمض النووي الريبي من مكثفات C-star التي تعمل على قوالب الحمض النووي الريبي
ملاحظة: لإنتاج أبتامير البروكلي RNA ، يلزم وجود محلول ثنائي فلورو -4-هيدروكسي بنزيليدين إيميدازوليدينون (DFHBI) - يتم تحضير مسحوق DFHBI أولا كمحلول مخزون عند 10 mM في ثنائي ميثيل سلفوكسيد (DMSO) ، والذي يتم تخفيفه بعد ذلك إلى 600 ميكرومتر في الماء الخالي من RNase و DNase.
- غسل مكثفات C-star التي تعمل بقوالب الحمض النووي الريبي
ملاحظة: يتم غسل مكثفات C-star التي تعمل بقوالب الحمض النووي الريبي ثلاث مرات لضمان إزالة قليل النيوكليوتيدات غير المنضمة.- اترك محلول المكثفات المستخرجة يستقر لمدة 5 دقائق على الأقل ، ثم قم بإزالة ما يقرب من نصف حجم المادة الطافية.
- للحصول على حجم 60 ميكرولتر من المكثفات المستخرجة ، قم بإزالة ما بين 25-30 ميكرولتر من المادة الطافية.
- ماصة من أعلى مستوى السائل لتقليل عدد المكثفات التي تمت إزالتها خلال هذه الخطوة.
- أضف نفس الحجم البالغ 0.3 M NaCl في TE لاستبدال المادة الطافية التي تمت إزالتها واخلطها عن طريق الماصة.
- كرر الخطوتين السابقتين لما مجموعه ثلاث دورات.
- اترك محلول المكثفات المستخرجة يستقر لمدة 5 دقائق على الأقل ، ثم قم بإزالة ما يقرب من نصف حجم المادة الطافية.
- تحضير خليط النسخ T7
ملاحظة: يتم تحضير خليط النسخ T7 باستخدام مجموعة النسخ CellScript T7-FlashScribe. الخطوة 3.2.2 هي تعديل لبروتوكول الشركة المصنعة ، والذي يمكن العثور عليه هنا38. هنا نصف نسخ البروكلي RNA aptamer ، الذي يحفز مضان في DFHBI عند الربط. بالنسبة للأبتامير المضيئة الأخرى ، استبدل حجم DFHBI الموصوف في الخطوة 3.2.2 بالفلوروجين المناسب. بالنسبة للنصوص الأخرى ، قم بإزالة هذا المكون بالكامل.- قم بإعداد محلول مخزون قدره 10 mM DFHBI في DMSO ، ثم قم بتخفيف القسمة إلى تركيز نهائي قدره 600 ميكرومتر باستخدام ماء خال من RNase و DNase.
- قم بإذابة مكونات مجموعة النسخ على الثلج ثم ماصة ما يلي في أنبوب طرد مركزي دقيق معقم في درجة حرارة الغرفة باستخدام أطراف ماصة معقمة: 2 ميكرولتر من 10x T7-Transcription Buffer (متوفرة في مجموعة النسخ) ، 1.8 ميكرولتر من 100 mM ATP ، 1.8 ميكرولتر من 100 mM CTP ، 1.8 ميكرولتر من 100 mM UTP ، 1.8 ميكرولتر من 100 mM GTP ، 2 ميكرولتر من 100 mM DTT ، 2 ميكرولتر من 600 ميكرومتر DFHBI ، 0.5 ميكرولتر من مثبط RNase ، 2 ميكرولتر من محلول إنزيم T7 (متوفر في مجموعة النسخ).
- امزج المحلول برفق عن طريق الماصة.
- استخدم خليط النسخ للخطوة 3.3 (تخليق نسخة الحمض النووي الريبي) مباشرة بعد التحضير.
- تخليق نسخة الحمض النووي الريبي
- في غرفة مناسبة للتصوير المجهري ، ماصة 3.3 ميكرولتر من المكثفات المغسولة المحضرة من نجوم C التي تعمل بقوالب الحمض النووي الريبي وأضف الحجم الكلي لخليط النسخ المحضر مسبقا.
- الحصول على صور مجهرية لمدة 18 ساعة ، تبدأ مباشرة بعد إضافة خليط النسخ إلى المكثفات.
ملاحظة: تعتمد إعدادات الفحص المجهري على النظام المجهز. تأكد من استخدام إعدادات الإثارة والانبعاث المناسبة لأي فلوروفورات في العينة ، إلى جانب أوقات التعرض التي لن تؤدي إلى التشبع مع تقدم النسخ. كما هو الحال بالنسبة لأي فاصل زمني ، يجب إيجاد حل وسط بين ليزر عالي بما يكفي أو طاقة LED للحصول على إشارة جيدة مع تقليل مخاطر التبييض الضوئي أيضا. سيتم تقليل التبييض الضوئي على مدى فترات زمنية طويلة على الأنظمة القائمة على LED مقارنة بالأنظمة القائمة على الليزر. فترات التصوير المقترحة: 20 دقيقة لأول ساعتين ، و 30 دقيقة بعد ذلك.
النتائج
بعد التلدين ، يمكن تصوير مكثفات C-star مباشرة في الأنبوب الشعري ، أو بعد الاستخراج ، لتأكيد تكوينها. بالنسبة لجميع الاختلافات في تصميم C-star ، يجب على المرء أن يلاحظ المكثفات الكروية أو متعددة السطوح المميزة التي يبلغ قطرها حوالي 10-50 ميكرومتر ، وتتشكل الأخيرة عند حدوث التبلور28,32
Discussion
يوفر البروتوكول الموصوف هنا نهجا لتحضير مكثفات مكونة من مكون واحد أو مكونين من نجوم الحمض النووي البرمائية النانوية ، مع اختلافات في التصميم لإدخال استجابات مختلفة في المكثفات. ينتج البروتوكول المعطى مكثفات في محلول عازل يبلغ 0.3 M NaCl في TE ، ولكن يمكن تعديل شروط المخزن المؤقت عن طريق تعديل ?...
Disclosures
لم يتم الإعلان عن أي تضارب في المصالح.
Acknowledgements
تقر LM و LDM و DT بالدعم المقدم من مجلس البحوث الأوروبي (ERC) في إطار برنامج البحث والابتكار Horizon 2020 (ERC-STG No 851667 - NANOCELL). تعترف LDM بالدعم المقدم من منحة أبحاث الجمعية الملكية للزملاء الباحثين (RGF / R1 / 180043) والدعم من زمالة أبحاث جامعة الجمعية الملكية (UF160152 ، URF / R / 221009).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm syringe filters | Sigma-Aldrich | SLGVR33RB | |
| 24 x 60 mm #1.5 Rectangular cover glasses, Menzel Gläser | VWR | 631-0853 | |
| 2-Propanol | Sigma-Aldrich | 34683 | |
| 6 L Ultrasonic Cleaner with Digital Timer and Heat, 230 VAC | Cole-Parmer | WZ-08895-11 | |
| Araldite Rapid Adhesive 2 Part Epoxy Glue | RS | ARA-400005 | |
| Bio-Rad C1000 thermal cycler | Bio-Rad | 1851197 | |
| Brand Microcentrifuge Tube 2 mL with Locking Lid | Fisher Scientific | 15338665 | 2 mL microcentrifuge tubes for the extraction of C-star condensates |
| Diamond Scribing Pen | RS | 394-217 | |
| Difluoro-4-hydroxybenzylidene imidazolidinone (DFHBI) | Sigma-Aldrich | SML1627 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Eppendorf PCR Clean Colorless Safe-Lock Centrifuge Tubes | Fisher Scientific | 0030123301 | 0.5 mL microcentrifuge tubes for the preparation of C-star mixtures |
| Ethanol Absolute 99.8+% | Fisher Scientific | 10437341 | 70% ethanol is sufficient for cleaning purposes |
| Fisherbrand ZX4 IR Vortex Mixer | Fisherbrand | 13284769 | |
| Hellmanex III | Hellma | 9-307-011-4-507 | |
| Hollow Rectangle Capillaries ID 0.40 x 4.00 mm, 50 mm in length | CM Scientific | 2540-50 | |
| Mineral oil | Sigma-Aldrich | 69794 | |
| Mini Centrifuge, 230 V | PRISM(TM) | Z763128 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NanoDrop One Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | Used to measure absorbance of oligonucleotides for concentration calculations |
| Oligonucleotides | Integrated DNA Technologies | Custom | Oligonucleotide sequences are unique to the C-star design required. |
| ScriptGuard RNase inhibitor | CELLSCRIPT | C-SRI6310K | RNase inhibitor |
| T7-FlashScribe Transcription Kit | Cambio | C-ASF3507 | |
| Tris-EDTA buffer, 100x stock solution | Sigma-Aldrich | 574793 | |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen | 10977035 | |
| VWR Spec-Wipe 3 Wipers | VWR | 21914-758 |
References
- Buddingh', B. C., Hest, J. C. M. v. Artificial cells: Synthetic compartments with life-like functionality and adaptivity. Acc Chem Res. 50 (4), 769-777 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Dora Tang, T. -. Y., et al. Fatty acid membrane assembly on coacervate microdroplets as a step towards a hybrid protocell model. Nat Chem. 6 (6), 527-533 (2014).
- Deshpande, S., et al. Spatiotemporal control of coacervate formation within liposomes. Nat Commun. 10 (1), 1800 (2019).
- Rubio-Sánchez, R., et al. Thermally driven membrane phase transitions enable content reshuffling in primitive cells. J Am Chem Soc. 143 (40), 16589-16598 (2021).
- Jahnke, K., Huth, V., Mersdorf, U., Liu, N., Göpfrich, K. Bottom-up assembly of synthetic cells with a DNA cytoskeleton. ACS Nano. 16 (5), 7233-7241 (2022).
- Tran, M. P., et al. A DNA segregation module for synthetic cells. Small. 19 (13), 2202711 (2023).
- Mason, A. F., Buddingh', B. C., Williams, D. S., Hest, J. C. M. v. Hierarchical self-assembly of a copolymer-stabilized coacervate protocell. J Am Chem Soc. 139 (48), 17309-17312 (2017).
- Gumz, H., et al. Toward functional synthetic cells: In-depth study of nanoparticle and enzyme diffusion through a cross-linked polymersome membrane. Adv Sci. 6 (7), 1801299 (2019).
- Huang, X., Patil, A. J., Li, M., Mann, S. Design and construction of higher-order structure and function in proteinosome-based protocells. J Am Chem Soc. 136 (25), 9225-9234 (2014).
- Booth, R., Qiao, Y., Li, M., Mann, S. Spatial positioning and chemical coupling in coacervate-in-proteinosome protocells. Angew Chem Int Ed Engl. 58 (27), 9120-9124 (2019).
- Hindley, J. W., et al. Light-triggered enzymatic reactions in nested vesicle reactors. Nat Commun. 9 (1), 1093 (2018).
- Zubaite, G., Hindley, J. W., Ces, O., Elani, Y. Dynamic reconfiguration of subcompartment architectures in artificial cells. ACS Nano. 16 (6), 9389-9400 (2022).
- Hirose, T., et al. A guide to membraneless organelles and their various roles in gene regulation. Nat Rev Mol Cell Biol. 24 (4), 288-304 (2023).
- Guindani, C., Silva, L. C. d., Cao, S., Ivanov, T., Landfester, K. Synthetic cells: From Simple Bio-Inspired Modules to Sophisticated Integrated Systems. Angew Chem Int Ed Engl. 61 (16), e202110855 (2022).
- Adamala, K. P., et al. Present and future of synthetic cell development. Nat Rev Mol Cell Biol. 25 (3), 162-167 (2023).
- Allen, M. E., et al. Biomimetic behaviors in hydrogel artificial cells through embedded organelles. Proc Natl Acad Sci U S A. 120 (35), e2307772120 (2023).
- Cook, A. B., Novosedlik, S., Hest, J. C. M. v. Complex coacervate materials as artificial cells. Acc Mater Res. 4 (3), 287-298 (2023).
- Seeman, N. C., Sleiman, H. F. DNA nanotechnology. Nat Rev Mater. 3, 17068 (2018).
- Takinoue, M. DNA droplets for intelligent and dynamical artificial cells: from the viewpoint of computation and non-equilibrium systems. Interface Focus. 13 (5), 20230021 (2023).
- Liu, W., Lupfer, C., Samanta, A., Sarkar, A., Walther, A. Switchable hydrophobic pockets in DNA protocells enhance chemical conversion. J Am Chem Soc. 145 (13), 7090-7094 (2023).
- Wilner, O. I., Willner, I. Functionalized DNA nanostructures. Chem Rev. 112 (4), 2528-2556 (2012).
- Gong, J., Tsumura, N., Sato, Y., Takinoue, M. Computational DNA droplets recognizing miRNA sequence inputs based on liquid-liquid phase separation. Adv Funct Mater. 32, 2202322 (2022).
- Jeon, B. -. J., Nguyen, D. T., Saleh, O. A. Sequence-controlled adhesion and microemulsification in a two-phase system of DNA liquid droplets. J Phys Chem. 124 (40), 8888-8895 (2020).
- Sato, Y., Sakamoto, T., Takinoue, M. Sequence-based engineering of dynamic functions of micrometer-sized DNA droplets. Sci Adv. 6 (23), 3471 (2020).
- Saleh, O. A., et al. Vacuole dynamics and popping-based motility in liquid droplets of DNA. Nat Commun. 14 (1), 3574 (2023).
- Rubio-Sánchez, R., Fabrini, G., Cicuta, P., Michele, L. D. Amphiphilic DNA nanostructures for bottom-up synthetic biology. Chem Commun. 57 (95), 12725-12740 (2021).
- Brady, R. A., Brooks, N. J., Cicuta, P., Di Michele, L. Crystallization of amphiphilic DNA C-Stars. Nano Lett. 17 (5), 3276-3281 (2017).
- Leathers, A., et al. Reaction-diffusion patterning of DNA-based artificial cells. J Am Chem Soc. 144 (38), 17468-17476 (2022).
- Malouf, L., et al. Sculpting DNA-based synthetic cells through phase separation and phase-targeted activity. Chem. 9 (11), 3347-3364 (2023).
- Fabrini, G., Minard, A., Brady, R. A., Antonio, M. D., Michele, L. D. Cation-responsive and photocleavable hydrogels from noncanonical amphiphilic DNA nanostructures. Nano Lett. 22 (2), 602-611 (2022).
- Brady, R. A., Brooks, N. J., Foderà, V., Cicuta, P., Di Michele, L. Amphiphilic-DNA platform for the design of crystalline frameworks with programmable structure and functionality. J Am Chem Soc. 140 (45), 15384-15392 (2018).
- Walczak, M., et al. Responsive core-shell DNA particles trigger lipid-membrane disruption and bacteria entrapment. Nat Commun. 12 (1), 4743 (2021).
- Zhang, D. Y., Winfree, E. Control of DNA strand displacement kinetics using Toehold exchange. J Am Chem Soc. 131 (47), 17303-17314 (2009).
- . Integrated DNA Technologies OligoAnalyzer Tool Available from: https://www.idtdna.com/pages/products/custom-dna-rna/dna-oligos/custom-dna-oligos (2024)
- Cavaluzzi, M. J., Borer, P. N. Revised UV extinction coefficients for nucleoside-5'-monophosphates and unpaired DNA and RNA. Nucleic Acids Res. 32 (1), e13 (2004).
- Lattuada, E., Caprara, D., Piazza, R., Sciortino, F. Spatially uniform dynamics in equilibrium colloidal gels. Sci Adv. 7 (49), (2021).
- . T7-FlashScribeTM Transcription Kit Available from: https://www.cellscript.com/products/018pl0617CS.pdf (2017)
- Zadeh, J. N., et al. NUPACK: Analysis and design of nucleic acid systems. J Comput Chem. 32 (1), 170-173 (2011).
- Walczak, M., Brady, R. A., Leathers, A., Kotar, J., Di Michele, L. Influence of hydrophobic moieties on the crystallization of amphiphilic DNA nanostructures. The Journal of Chemical Physics. 158 (8), 084501 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved