Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Синтетические конденсаты и клеточные архитектуры из наноструктур амфифильной ДНК
В этой статье
Резюме
Представлен протокол получения синтетических биомолекулярных конденсатов, состоящих из нанозвезд амфифильной ДНК, начиная с входящих в их состав ДНК-олигонуклеотидов. Конденсаты производятся либо из одного нанозвездного компонента, либо из двух компонентов и модифицируются для поддержания транскрипции РНК in vitro из встроенной матрицы ДНК.
Аннотация
Синтетические капли и конденсаты становятся все более распространенными компонентами передовых биомиметических систем и синтетических клеток, где они могут быть использованы для создания компартментализации и поддержания жизненных реакций. Синтетические наноструктуры ДНК продемонстрировали значительный потенциал в качестве строительных блоков, образующих конденсат, благодаря своей программируемой форме, химической функционализации и способности к самосборке. Недавно мы продемонстрировали, что амфифильные ДНК-нанозвезды, полученные путем мечения ДНК-соединений гидрофобными фрагментами, представляют собой особенно надежное и универсальное решение. Полученные конденсаты амфифильной ДНК могут быть запрограммированы на отображение сложных, многокомпонентных внутренних архитектур, структурно реагировать на различные внешние стимулы, синтезировать макромолекулы, захватывать и высвобождать полезную нагрузку, подвергаться морфологическим трансформациям и взаимодействовать с живыми клетками. В данной работе мы демонстрируем протоколы получения конденсатов амфифильных ДНК, начиная с входящих в состав ДНК олигонуклеотидов. Мы рассмотрим (i) однокомпонентные системы, образующие однородные конденсаты, (ii) двухкомпонентные системы, образующие конденсаты ядро-оболочка, и (iii) системы, в которых конденсаты модифицируются для поддержки транскрипции наноструктур РНК in vitro .
Введение
Синтетические клетки представляют собой устройства микрометрового масштаба (10-50 мкм), сконструированные снизу вверх для воспроизведения функций и структур существующих биологических клеток 1,2. Синтетические клетки часто связаны мембранами, состоящими из липидных двухслойных везикул 3,4,5,6,7, полимерсом 8,9 или протеиносом10,11, которые также могут быть использованы для установления внутренней компартментализации12,13. Вдохновленные безмембранными органеллами, которые, как известно, поддерживают различные функции в живых клетках14, такие структуры, как полимерные коацерваты, биомолекулярные конденсаты и гидрогели, набирают обороты в качестве универсальной и надежной альтернативы для установления как внешней, так и внутренней компартментализации в синтетических клетках 15,16,17,18.
Используя универсальный инструментарий нанотехнологии ДНК19, было разработано множество решений для создания синтетических капель и конденсатов из самосборки искусственных наноструктур ДНК, размер, форма, функциональность, валентность и взаимное взаимодействие которых могут быть точно запрограммированы. Капли или конденсаты ДНК биосовместимы и могут действовать как каркасы как для синтетических клеток, так и для органелл, обеспечивая химические и биомолекулярные реакции21, вычисляя информацию22,23, захватывая и высвобождая грузы24,25 и поддерживая структурные реакции26.
Среди разнообразных конструкций наноструктур ДНК, образующих конденсат, амфифильные нанозвезды ДНК, получившие название С-звезды, оказались надежными и универсальными. С-звезды представляют собой простые разветвленные мотивы, состоящие из неподвижного соединения ДНК (обычно четырехстороннего), из которого выходят двухцепочечные плечи (ds)ДНК28. Затем рукава покрываются гидрофобными фрагментами, обычно холестериновыми, что делает наноструктуры амфифильными и приводит к их конденсации после прямого отжига в одном котле. Конденсаты C-звезды обеспечивают точную структурную и функциональную программируемость, включая возможность создания многокомпонентных архитектур29,30, структурно реагирующих на триггеры ДНК и катионов31, синтезирующих макромолекулы29, захватывающих и высвобождающих полезных нагрузок32 и взаимодействующих с живыми клетками33. Ниже мы опишем и обсудим протоколы получения конденсатов C-звезды, начиная с входящих в их состав олигонуклеотидов.
Протокол обобщает приготовление унарных (однокомпонентных) и бинарных (двухкомпонентных) конденсатов с использованием трех различных конструкций C-звезд (рис. 1) — «Нечувствительный», «TMSD-чувствительный» и «РНК-шаблонный». «Нереагирующая» звезда С (панель А) состоит из четырех «основных нитей» с четкими последовательностями, образующими четырехстороннее соединение. Четыре идентичных модифицированных холестерином олигонуклеотида соединены с соединением, гарантируя, что молекула холестерина присутствует на конце каждого плеча. Нечувствительные С-звезды представляют собой простые, инертные каркасы для унарных и бинарных конденсатов. В «ВМСД-чувствительной» С-звезде (панель В) связь между холестеринированными нитями и соединением обеспечивается цепью «Мостик для пальцев ног», которая имеет свисающий одноцепочечный домен (ss)ДНК «опоры» для пальца ноги. В присутствии цепи ДНК захватчика с комплементарным доменом удержания пальца ноги может быть инициирована реакция34 смещения цепи, опосредованная опозданием пальца ноги, в результате которой захватчик смещает мост пальца ноги, разрывая связь между соединением и гидрофобными фрагментами и инициируя разборку сети32 ДНК. Наконец, «шаблонизирующая РНК» С-звезда (панель С) включает в себя «базовую» модификацию, комплементарную цепи «моста», последняя из которых связывает транскрибируемую матрицу одноцепочной ДНК для аптамера брокколи29. Детали последовательностей составляющих олигонуклеотидов для трех типов конструкций C-звезд, упомянутых здесь, можно найти в дополнительной таблице 1 и в предыдущих работах 29,30,32.
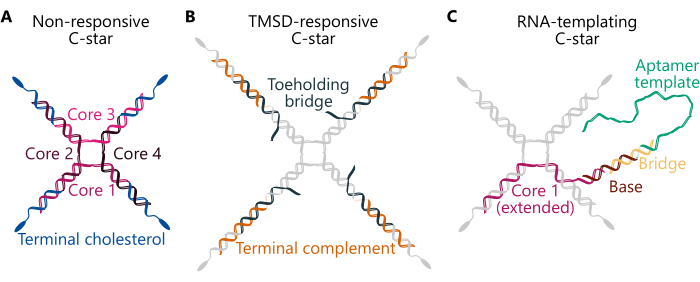
Рисунок 1. Схемы трех различных конструкций нанозвезд амфифильной ДНК (С-звезд). Олигонуклеотидные последовательности для различных примеров описанных здесь С-звезд можно найти в дополнительной таблице 1. (А) Схема С-звезды, предназначенной для образования нечувствительных конденсатов, с компонентами олигонуклеотидных нитей "Ядро 1", "Ядро 2", "Ядро 3", "Ядро 4" (окрашено в оттенки розового) и "Терминальный холестерин" (окрашено в синий цвет). Каждый уникальный цвет представляет собой олигонуклеотидную цепь уникальной последовательности. "Core 1" и "Core 3" частично дополняют "Core 2" и "Core 4", но не комплементарны друг другу. (B) Схема С-образной звезды, предназначенной для разборки при добавлении вторгающейся нити путем смещения нити, опосредованного опорой на носке, как описано в предыдущей работе32. Эта звезда типа «С» состоит из нитей «Core» и «Terminal cholesterol» (окрашены в серый цвет), а также из нити «Terminal complement» (показана оранжевым цветом) и «Toeholding bridge» (показана темно-бирюзовым цветом). Последний содержит шестинуклеотидный выступ, с которым соответствующим образом сконструированная цепь захватчика может связываться и впоследствии полностью вытеснять цепь "Toeholding bridge", что вызывает диссоциацию центрального нанозвездного соединения (состоящего из "Core 1, 2, 3, and 4") от дуплексов, состоящих из цепей "Terminal complement" и "Terminal cholesterol". (C) Схема С-звезды, функционализированной с помощью матрицы ДНК для РНК-аптамера. Она также состоит из нити «Терминальный холестерин» и «Ядра 2, 3 и 4» (все показаны серым цветом), а также расширенной версии нити «Ядра 1» (показана розовым), нити «База» (коричневая), нити «Мостик» (желтая) и «Шаблон Аптамера» (зеленая). Дуплекс ДНК, состоящий из двух последних цепей, образует промоторную область Т7-полимеразы, которая отмечает место начала транскрипции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Конденсаты С-звезды образуются при термическом отжиге составляющих олигонуклеотидов, который в представленном здесь протоколе проводится в герметичных стеклянных капиллярах с большим соотношением сторон и прямоугольным сечением. Эти контейнеры имеют несколько ключевых преимуществ: i) Герметизация обеспечивает полное предотвращение испарения на этапах (иногда медленного) отжига; ii) Плоское дно капилляров оптического качества позволяет визуализировать самосборку (или разборку) переходного процесса; iii) высокое соотношение сторон капилляров гарантирует, что тяжелые конденсаты оседают на широкой плоской площади, снижая вероятность коалесценции и агрегации на более поздних стадиях процесса самосборки, которые имели бы место в клиновидных контейнерах (например, микроцентрифужных пробирках), и образуя относительно монодисперсные популяции конденсата; iv) выполнение отжига в удлиненном стеклянном капилляре сводит к минимуму воздействие на образец гидрофобных границ раздела (воздух, пластик или масло), которые, как было замечено, нарушают самосборку путем рекрутирования амфифильных холестеринизированных олигонуклеотидов. После завершения протокола сборки конденсаты могут быть извлечены из стеклянных капилляров для дальнейших экспериментов с использованием дополнительных реагентов.
протокол
ПРИМЕЧАНИЕ: Протокол разделен на три раздела. В разделе 1 описаны предварительные этапы, включая получение олигонуклеотидов ДНК и стеклянных капилляров. В разделе 2 описывается приготовление конденсатов типа С-звезда различных конструкций, в том числе одно- и двухкомпонентных, и их извлечение из стеклянных капилляров. В разделе 3 описывается использование однокомпонентных РНК-шаблонов конденсатов C-звезды для синтеза аптамера РНК. Пользователь должен следовать надлежащей лабораторной практике на протяжении всего процесса, убедиться в наличии всех необходимых оценок и мер по снижению рисков, а также носить соответствующие средства индивидуальной защиты (СИЗ), включая перчатки, защитные очки и лабораторный халат. Очистка стеклянных капиллярных трубок требует их ультразвуковой обработки, сначала в растворе поверхностно-активного вещества, а затем в изопропаноле или этаноле. Извлечение конденсатов C-звезды из капиллярных трубок требует использования алмазной ручки для надрезания и защелкивания стекла, что сопряжено с риском травмирования осколками стекла. Основные используемые материалы, оборудование и реагенты перечислены в Таблице материалов. Большинство нефункционализированных олигонуклеотидов очищаются поставщиком с использованием стандартного обессоливания, за исключением нитей «extended Core 1» и «Aptamer template», которые заказываются с помощью электрофореза в полиакриламидном геле (PAGE). Модифицированные холестерином олигонуклеотиды очищаются поставщиком с помощью обратной фазы высокоэффективной жидкостной хроматографии (ВЭЖХ).
1. Предварительные требования
ПРИМЕЧАНИЕ: Следующие растворы должны быть приготовлены в сверхчистой воде (тип I) и отфильтрованы с использованием шприцевых фильтров 0,22 мкм: Трис-ЭДТА (TE) буфер, содержащий 10 мМ Трис, 1 мМ ЭДТА, при pH ~8,0; TE буфер с добавлением 2 М NaCl; и TE буфер с добавлением 0,3 М NaCl. Буферные растворы следует использовать в течение 2 недель после приготовления и хранить при температуре 4 °C, когда они не используются. Кроме того, для очистки стеклянных капилляров будет использоваться раствор щелочного оптического моющего средства в 1 об.% в сверхчистой воде.
- Получение ДНК-олигонуклеотидов из лиофилизированного состояния
- Кратковременно центрифугируйте (2000 х г в течение 10-30 с) пробирки с лиофилизированными олигонуклеотидами ДНК, чтобы гранулы лиофилизированной ДНК собирались на дне.
ПРИМЕЧАНИЕ: Центрифугирование проводится при комнатной температуре (RT) в течение 10-30 с. Используемая здесь миницентрифуга по умолчанию имеет скорость 2000 x g (6000 об/мин). - Добавьте соответствующее количество TE-буфера для восстановления каждого олигонуклеотида в концентрации 100 мкМ. Тщательно перебейте Vortex, чтобы обеспечить полное растворение, затем прокрутите трубки вниз, чтобы собрать всю жидкость в соответствии с шагом 1.1.1.
- Для каждого исходного раствора измерить поглощение при длине волны 260 нм и рассчитать конечную концентрацию с использованием коэффициента экстинкции испытуемой олигонуклеотидной последовательности.
ПРИМЕЧАНИЕ: Коэффициент экстинкции для данной олигонуклеотидной последовательности обычно находится в техническом описании поставщика, но также может быть рассчитан с помощью онлайн-инструментов с использованием модели ближайшего соседа35 или табличных значений коэффициента экстинкции отдельных нуклеотидов36. - Регидратированные олигонуклеотиды хранят при температуре 4 °C в течение коротких периодов времени (до 1 недели) или при -20 °C при более длительном хранении (до 6 месяцев).
- Кратковременно центрифугируйте (2000 х г в течение 10-30 с) пробирки с лиофилизированными олигонуклеотидами ДНК, чтобы гранулы лиофилизированной ДНК собирались на дне.
- Чистка стеклянных капиллярных трубок
- Ультразвук в 1% щелочном оптическом моющем средстве для оптических компонентов в деионизированной воде.
- Возьмите необходимое количество стеклянных капиллярных пробирок, которые необходимо очистить, и поместите их в высокий узкий контейнер (например, стакан или центрифужную пробирку объемом 15/50 мл) таким образом, чтобы капилляры не лежали ровно на дне контейнера.
- Добавьте моющее средство в емкость, заполнив ее чуть выше уровня капиллярных трубок. Убедитесь, что внутри капиллярных трубок нет застрявших пузырьков воздуха - при необходимости удалите их стуком. Неплотно накройте контейнер (например, оловянной фольгой или крышкой центрифужной трубки, убедившись, что она не плотно закрыта).
- Установите водяную баню для ультразвуковой обработки на 40 °C, поставьте закрытую емкость вертикально в ванну и обрабатывайте ультразвуком в течение 30 минут. Следите за тем, чтобы фольга, если она используется, не соприкасалась с водой в ванне для ультразвуковой обработки.
ПРИМЕЧАНИЕ: Ультразвуковая ванна, используемая в этом исследовании, по умолчанию имеет частоту ультразвука 60 Гц и мощность ультразвука 150 Вт.
ВНИМАНИЕ: Никогда не добавляйте и не вынимайте предметы из ванны для ультразвуковой обработки во время бега; Всегда сначала ставьте протокол на паузу. - Как только ультразвуковая обработка будет завершена, выключите нагревательный элемент ультразвуковой водяной бани, затем тщательно промойте капилляры в емкости деионизированной или сверхчистой водой - минимум пять раз, каждый раз сбрасывая воду для промывки.
- Ультразвук в 1% щелочном оптическом моющем средстве для оптических компонентов в деионизированной воде.
- Ультразвук в изопропаноле или этаноле.
- К стеклянным капиллярным трубкам в емкости для очистки добавьте изопропанол или этанол (минимум 70%), наполнив чуть выше уровня капиллярных трубок. Как и в шаге 1.2.1.2, убедитесь, что в капиллярных трубках нет пузырьков воздуха, и неплотно накройте контейнер.
- Поместите емкость вертикально в ванночку для обработки ультразвуком и обрабатывайте ультразвуком в течение 15-30 минут.
ВНИМАНИЕ: Изопропанол и этанол легковоспламеняющиеся, с температурой вспышки ниже матической температуры. Сведите к минимуму объемы растворителей, используемых во время очистки, выбрав контейнер подходящего размера, убедитесь, что контейнеры плотно закрыты, и не оставляйте ванну для ультразвуковой обработки без присмотра во время этого этапа. - После завершения ультразвуковой обработки утилизируйте изопропанол или этанол и высушите капилляры азотом, обрабатывая их безворсовой тканью.
2. Приготовление и экстракция конденсатов C-звезды (Рисунок 2)

Рисунок 2: Загрузка смесей C-star и извлечение конденсата из стеклянных капиллярных трубок. На всех панелях смесь C-звезд была заменена водным раствором 25 мМ кальцеина для улучшения видимости. (А-Е) Основные этапы, которые необходимо предпринять перед отжигом, в соответствии с разделами 2.1 и 2.2 протокола. (Ф-Дж) Основные этапы, которые необходимо предпринять после отжига, соответствующие разделу 2.3 протокола. Во время экстракции (панели (I-J)) конденсаты ДНК будут осаждаться из капилляра в буферный резервуар до тех пор, пока микроцентрифужная трубка хранится вертикально. Конденсаты не будут видны невооруженным глазом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Приготовление смесей типа С-звезда для однокомпонентных конденсатов
ПРИМЕЧАНИЕ: Подробную информацию о последовательностях для различных конструкций отдельных компонентов можно найти в дополнительной таблице 1 и в предыдущих работах 29,30,32. Протоколы медленного отжига, определенные на этапах 2.1.9 и 2.2.2, были разработаны для обеспечения релаксации нанозвездных сетей в компактные морфологии, учитывая сильно зависящие от температуры реологические свойства нанозвездных сетей37.- Олигонуклеотидные и буферные компоненты будут варьироваться в зависимости от желаемой конструкции C-звезды. Приготовьте смесь 60 мкл однокомпонентных конденсатов C-звезды в концентрации 5 мкМ для нечувствительной четырехплечевой звезды C, чувствительной к TMSD C-звезды или шаблонной РНК звезды C.
- Для каждой конструкции дозатор соответствующих компонентов, перечисленных в дополнительной таблице 2 , должен быть помещен в отдельную микроцентрифужную пробирку и тщательно перемешан с помощью пипетирования.
Примечание: Предполагается, что все исходные растворы олигонуклеотидов находятся в концентрации 100 мкМ в TE. - Извлеките все 60 мкл раствора C-star и осторожно с помощью пипетки введите смесь в очищенную сухую стеклянную капиллярную трубку, как показано на рисунке 2A, стараясь не допустить попадания пузырьков воздуха.
- С помощью пипетки введите примерно 9-12 мкл минерального масла в каждый конец капиллярной трубки, закрывая образец таким образом, чтобы между раствором C-звезды и воздухом не было свободной границы раздела (см. рис. 2B). Затем тщательно высушите капиллярную трубку папиросной бумагой, чтобы убедиться, что на ней нет масла (Рисунок 2C), стараясь не вытолкнуть минеральное масло или раствор C-star из капиллярной трубки. Конечный результат показан на рисунке 2D.
- Приготовьте небольшую партию двухкомпонентного эпоксидного клея, чтобы приклеить каждый конец капиллярной трубки плоской стороной вниз к стеклянной крышке. Убедитесь, что отверстия трубки полностью покрыты клеем, образуя непрерывное уплотнение, как показано на рисунке 2E.
- Отставить для отверждения минимум на 3 часа, но желательно на ночь.
- После ~30 минут отверждения осмотрите слой клея на наличие зазоров в уплотнении, вызванных пузырьками воздуха. Если они присутствуют, запечатайте их с помощью небольшого количества клея.
- Оберните капиллярную трубку, приклеенную к покровному листу, в оловянную фольгу, следя за тем, чтобы фольга оставалась плоской на нижней стороне стеклянного покровного стекла. Фольга обеспечивает хороший тепловой контакт между ним и нагревательным элементом термоамплификатора (см. следующий шаг).
- Поместите упакованный образец в термоамплификатор и отжгите по следующему протоколу: подержите при температуре 95 °C в течение 30 минут, затем охладите с 85 °C до 50 °C при -0,04 °C·мин-1, а затем охладите с 50 °C до RT при -0,5 °C·мин-1.
- Отожженные конденсаты C-звезды хранят при температуре 4 °C или RT в течение длительных периодов времени (месяцев) до тех пор, пока капилляр остается герметичным, так как термический отжиг эффективно стерилизует образец и денатурирует нуклеазы. Держите капилляр плоским во время хранения и обработки, чтобы предотвратить осаждение конденсата к одному концу и его скопление.
- Приготовление смесей C-звезд для бинарных конденсатов
Примечание: Для обоснования выбора популяций C-звезд для двойных систем обратитесь к работе Malouf et al., в которой описаны правила проектирования и ожидаемое фазовое поведение двойных конденсатов C-звезды30.- Для получения бинарных конденсатов соедините 30 мкл объемов смесей C-звезд, описанных на шаге 2.1 выше, с общим объемом 60 мкл, тщательно перемешайте, загрузите в капилляры и выполните шаги 2.1.4-2.1.8.
- Поместите упакованный образец в термоамплификатор и отжгите по следующему протоколу: подержите при температуре 95 °C в течение 30 минут, затем охладите с 85 °C до 40 °C при -0,01 °C·мин-1, а затем охладите с 40 °C до RT при -0,1 °C·мин-1.
- Экстракция конденсатов C-звезды из капиллярных трубок.
- Приготовьте большую (1,5 мл или 2,0 мл) микроцентрифужную пробирку, содержащую 60 мкл 0,3 М NaCl в TE-буфере.
- Разверните образец капилляра и с помощью алмазного карандаша надрежьте нижнюю сторону покровного стекла на каждом внутреннем конце склеиваемого участка (Рисунок 2F). Отломите покровную крышку в этой области и выбросьте соответствующим образом.
- Тщательно очистите капиллярные трубки с помощью этанола и высушите.
- Надрежьте каждый конец капиллярных трубок алмазной ручкой, сначала нижней стороной (Рисунок 2G), затем переверните и надрежьте трубки «правой стороной вверх».
- Убедитесь, что линии надрезов не перекрывают границу раздела вода-масло. Они должны находиться в пределах водной области, чтобы предотвратить попадание масла в извлеченный образец.
- Отломите концы капиллярных трубок (рисунок 2H), сохранив центральную часть трубки и выбросив остальные. Поместите отрезанную капиллярную трубку в микроцентрифужную пробирку, подготовленную на шаге 2.3.1, следя за тем, чтобы дно капиллярной трубки соприкасалось с буферным раствором (рисунок 2I).
- Конденсаты будут осаждаться из трубки в буферный резервуар под действием силы тяжести; Оставьте это на 10 минут (Рисунок 2J). Удалите отрезанную капиллярную трубку и выбросьте ее соответствующим образом. Такой щадящий подход к экстракции ограничивает риск скопления конденсата.
3. Транскрипция аптамера РНК из конденсатов С-звезды, шаблонизирующих РНК
ПРИМЕЧАНИЕ: Для производства аптамера РНК брокколи требуется раствор дифтор-4-гидроксибензилиден имидазолидинона (DFHBI) - порошок DFHBI сначала получают в виде исходного раствора при 10 мМ в диметилсульфоксиде (ДМСО), который затем разводят до 600 мкМ в воде, свободной от РНКазы и ДНКазы.
- Промывка шаблонов РНК конденсатов C-звезды
ПРИМЕЧАНИЕ: Конденсаты РНК-шаблонов C-звезды промывают три раза, чтобы обеспечить удаление несвязанных матричных олигонуклеотидов.- Дайте раствору извлеченных конденсатов отстояться не менее 5 мин, а затем удалите примерно половину объема надосадочной жидкости.
- Для объема экстрагированных конденсатов объемом 60 мкл удалите от 25 до 30 мкл надосадочной жидкости.
- Пипетка начинается с верхней части уровня жидкости, чтобы свести к минимуму количество конденсатов, удаляемых на этом этапе.
- Добавьте тот же объем 0,3 М NaCl в TE для замены удаленной надосадочной жидкости и перемешайте с помощью пипетирования.
- Повторите предыдущие два шага в общей сложности три цикла.
- Дайте раствору извлеченных конденсатов отстояться не менее 5 мин, а затем удалите примерно половину объема надосадочной жидкости.
- Приготовление транскрипционной смеси Т7
ПРИМЕЧАНИЕ: Смесь для транскрипции T7 готовится с использованием комплекта для транскрипции CellScript T7-FlashScribe. Шаг 3.2.2 представляет собой модификацию протокола производителя, с которым можно ознакомиться здесь38. Здесь мы опишем транскрипцию аптамера РНК брокколи, который индуцирует флуоресценцию в DFHBI при связывании. Для других аптамеров с подсветкой замените объем DFHBI, описанный в шаге 3.2.2, соответствующим фторогеном. Для других расшифровок полностью удалите этот компонент.- Приготовьте стоковый раствор 10 мМ DFHBI в ДМСО, затем разбавьте аликвоту до конечной концентрации 600 мкМ, используя воду, свободную от РНКазы и ДНКазы.
- Разморозьте компоненты набора для транскрипции на льду, а затем пипетируйте в автоклавную микроцентрифужную пробирку при комнатной температуре с использованием стерильных наконечников для пипетки: 2 мкл 10x T7-буфера для транскрипции (входит в комплект для транскрипции), 1,8 мкл 100 мМ АТФ, 1,8 мкл 100 мМ CTP, 1,8 мкл 100 мМ UTP, 1,8 мкл 100 мМ GTP, 2 мкл 100 мМ DTT, 2 мкл 600 мкМ DFHBI, 0,5 мкл ингибитора РНКазы, 2 мкл раствора фермента Т7 (входит в комплект для транскрипции).
- Аккуратно перемешайте раствор с помощью пипетки.
- Используйте транскрипционную смесь для этапа 3.3 (синтез транскрипта РНК) сразу после приготовления.
- Синтез РНК-транскрипта
- В камеру, подходящую для микроскопической визуализации, пипетку нанесите 3,3 мкл промытых конденсатов, приготовленных из шаблонов РНК C-звезд, и добавьте общий объем предварительно приготовленной транскрипционной смеси.
- Получайте микроскопические изображения в течение 18 часов, начиная сразу после добавления транскрипционной смеси к конденсатам.
ПРИМЕЧАНИЕ: Настройки микроскопии будут зависеть от подготовленной системы. Убедитесь, что для любых флуорофоров в образце используются соответствующие настройки возбуждения и излучения, а также время воздействия, которое не приведет к насыщению по мере прогрессирования транскрипции. Как и в случае с любой интервальной съемкой, следует найти компромисс между достаточно высокой мощностью лазера или светодиода для получения хорошего сигнала и минимизацией риска фотообесцвечивания. Фотообесцвечивание в течение длительных периодов времени будет сведено к минимуму в системах на основе светодиодов по сравнению с системами на основе лазеров. Рекомендуемые интервалы визуализации: 20 минут в течение первых 2 часов и 30 минут в дальнейшем.
Результаты
После отжига конденсаты C-звезды могут быть визуализированы непосредственно в капиллярной трубке или после экстракции, чтобы подтвердить их образование. Для всех вариантов конструкции C-звезды следует наблюдать отчетливые сферические или многогранные конденсаты диаметром примерно 10...
Обсуждение
Описанный здесь протокол обеспечивает подход к получению одно- или двухкомпонентных конденсатов из нанозвезд амфифильной ДНК с вариациями конструкции для введения различных ответов в конденсаты. В соответствии с данным протоколом образуются конденсаты в буферном растворе 0,3 М NaCl в TE,...
Раскрытие информации
Конфликт интересов не декларируется.
Благодарности
LM, LDM и DT выражают признательность Европейскому исследовательскому совету (ERC) за поддержку в рамках Программы исследований и инноваций Horizon 2020 (ERC-STG No 851667 - NANOCELL). LDM выражает признательность за поддержку со стороны исследовательского гранта Королевского общества для научных сотрудников (RGF/R1/180043) и поддержки от исследовательской стипендии Университета Королевского общества (UF160152, URF/R/221009).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 μm syringe filters | Sigma-Aldrich | SLGVR33RB | |
| 24 x 60 mm #1.5 Rectangular cover glasses, Menzel Gläser | VWR | 631-0853 | |
| 2-Propanol | Sigma-Aldrich | 34683 | |
| 6 L Ultrasonic Cleaner with Digital Timer and Heat, 230 VAC | Cole-Parmer | WZ-08895-11 | |
| Araldite Rapid Adhesive 2 Part Epoxy Glue | RS | ARA-400005 | |
| Bio-Rad C1000 thermal cycler | Bio-Rad | 1851197 | |
| Brand Microcentrifuge Tube 2 mL with Locking Lid | Fisher Scientific | 15338665 | 2 mL microcentrifuge tubes for the extraction of C-star condensates |
| Diamond Scribing Pen | RS | 394-217 | |
| Difluoro-4-hydroxybenzylidene imidazolidinone (DFHBI) | Sigma-Aldrich | SML1627 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Eppendorf PCR Clean Colorless Safe-Lock Centrifuge Tubes | Fisher Scientific | 0030123301 | 0.5 mL microcentrifuge tubes for the preparation of C-star mixtures |
| Ethanol Absolute 99.8+% | Fisher Scientific | 10437341 | 70% ethanol is sufficient for cleaning purposes |
| Fisherbrand ZX4 IR Vortex Mixer | Fisherbrand | 13284769 | |
| Hellmanex III | Hellma | 9-307-011-4-507 | |
| Hollow Rectangle Capillaries ID 0.40 x 4.00 mm, 50 mm in length | CM Scientific | 2540-50 | |
| Mineral oil | Sigma-Aldrich | 69794 | |
| Mini Centrifuge, 230 V | PRISM(TM) | Z763128 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NanoDrop One Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | Used to measure absorbance of oligonucleotides for concentration calculations |
| Oligonucleotides | Integrated DNA Technologies | Custom | Oligonucleotide sequences are unique to the C-star design required. |
| ScriptGuard RNase inhibitor | CELLSCRIPT | C-SRI6310K | RNase inhibitor |
| T7-FlashScribe Transcription Kit | Cambio | C-ASF3507 | |
| Tris-EDTA buffer, 100x stock solution | Sigma-Aldrich | 574793 | |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen | 10977035 | |
| VWR Spec-Wipe 3 Wipers | VWR | 21914-758 |
Ссылки
- Buddingh', B. C., Hest, J. C. M. v. Artificial cells: Synthetic compartments with life-like functionality and adaptivity. Acc Chem Res. 50 (4), 769-777 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Dora Tang, T. -. Y., et al. Fatty acid membrane assembly on coacervate microdroplets as a step towards a hybrid protocell model. Nat Chem. 6 (6), 527-533 (2014).
- Deshpande, S., et al. Spatiotemporal control of coacervate formation within liposomes. Nat Commun. 10 (1), 1800 (2019).
- Rubio-Sánchez, R., et al. Thermally driven membrane phase transitions enable content reshuffling in primitive cells. J Am Chem Soc. 143 (40), 16589-16598 (2021).
- Jahnke, K., Huth, V., Mersdorf, U., Liu, N., Göpfrich, K. Bottom-up assembly of synthetic cells with a DNA cytoskeleton. ACS Nano. 16 (5), 7233-7241 (2022).
- Tran, M. P., et al. A DNA segregation module for synthetic cells. Small. 19 (13), 2202711 (2023).
- Mason, A. F., Buddingh', B. C., Williams, D. S., Hest, J. C. M. v. Hierarchical self-assembly of a copolymer-stabilized coacervate protocell. J Am Chem Soc. 139 (48), 17309-17312 (2017).
- Gumz, H., et al. Toward functional synthetic cells: In-depth study of nanoparticle and enzyme diffusion through a cross-linked polymersome membrane. Adv Sci. 6 (7), 1801299 (2019).
- Huang, X., Patil, A. J., Li, M., Mann, S. Design and construction of higher-order structure and function in proteinosome-based protocells. J Am Chem Soc. 136 (25), 9225-9234 (2014).
- Booth, R., Qiao, Y., Li, M., Mann, S. Spatial positioning and chemical coupling in coacervate-in-proteinosome protocells. Angew Chem Int Ed Engl. 58 (27), 9120-9124 (2019).
- Hindley, J. W., et al. Light-triggered enzymatic reactions in nested vesicle reactors. Nat Commun. 9 (1), 1093 (2018).
- Zubaite, G., Hindley, J. W., Ces, O., Elani, Y. Dynamic reconfiguration of subcompartment architectures in artificial cells. ACS Nano. 16 (6), 9389-9400 (2022).
- Hirose, T., et al. A guide to membraneless organelles and their various roles in gene regulation. Nat Rev Mol Cell Biol. 24 (4), 288-304 (2023).
- Guindani, C., Silva, L. C. d., Cao, S., Ivanov, T., Landfester, K. Synthetic cells: From Simple Bio-Inspired Modules to Sophisticated Integrated Systems. Angew Chem Int Ed Engl. 61 (16), e202110855 (2022).
- Adamala, K. P., et al. Present and future of synthetic cell development. Nat Rev Mol Cell Biol. 25 (3), 162-167 (2023).
- Allen, M. E., et al. Biomimetic behaviors in hydrogel artificial cells through embedded organelles. Proc Natl Acad Sci U S A. 120 (35), e2307772120 (2023).
- Cook, A. B., Novosedlik, S., Hest, J. C. M. v. Complex coacervate materials as artificial cells. Acc Mater Res. 4 (3), 287-298 (2023).
- Seeman, N. C., Sleiman, H. F. DNA nanotechnology. Nat Rev Mater. 3, 17068 (2018).
- Takinoue, M. DNA droplets for intelligent and dynamical artificial cells: from the viewpoint of computation and non-equilibrium systems. Interface Focus. 13 (5), 20230021 (2023).
- Liu, W., Lupfer, C., Samanta, A., Sarkar, A., Walther, A. Switchable hydrophobic pockets in DNA protocells enhance chemical conversion. J Am Chem Soc. 145 (13), 7090-7094 (2023).
- Wilner, O. I., Willner, I. Functionalized DNA nanostructures. Chem Rev. 112 (4), 2528-2556 (2012).
- Gong, J., Tsumura, N., Sato, Y., Takinoue, M. Computational DNA droplets recognizing miRNA sequence inputs based on liquid-liquid phase separation. Adv Funct Mater. 32, 2202322 (2022).
- Jeon, B. -. J., Nguyen, D. T., Saleh, O. A. Sequence-controlled adhesion and microemulsification in a two-phase system of DNA liquid droplets. J Phys Chem. 124 (40), 8888-8895 (2020).
- Sato, Y., Sakamoto, T., Takinoue, M. Sequence-based engineering of dynamic functions of micrometer-sized DNA droplets. Sci Adv. 6 (23), 3471 (2020).
- Saleh, O. A., et al. Vacuole dynamics and popping-based motility in liquid droplets of DNA. Nat Commun. 14 (1), 3574 (2023).
- Rubio-Sánchez, R., Fabrini, G., Cicuta, P., Michele, L. D. Amphiphilic DNA nanostructures for bottom-up synthetic biology. Chem Commun. 57 (95), 12725-12740 (2021).
- Brady, R. A., Brooks, N. J., Cicuta, P., Di Michele, L. Crystallization of amphiphilic DNA C-Stars. Nano Lett. 17 (5), 3276-3281 (2017).
- Leathers, A., et al. Reaction-diffusion patterning of DNA-based artificial cells. J Am Chem Soc. 144 (38), 17468-17476 (2022).
- Malouf, L., et al. Sculpting DNA-based synthetic cells through phase separation and phase-targeted activity. Chem. 9 (11), 3347-3364 (2023).
- Fabrini, G., Minard, A., Brady, R. A., Antonio, M. D., Michele, L. D. Cation-responsive and photocleavable hydrogels from noncanonical amphiphilic DNA nanostructures. Nano Lett. 22 (2), 602-611 (2022).
- Brady, R. A., Brooks, N. J., Foderà, V., Cicuta, P., Di Michele, L. Amphiphilic-DNA platform for the design of crystalline frameworks with programmable structure and functionality. J Am Chem Soc. 140 (45), 15384-15392 (2018).
- Walczak, M., et al. Responsive core-shell DNA particles trigger lipid-membrane disruption and bacteria entrapment. Nat Commun. 12 (1), 4743 (2021).
- Zhang, D. Y., Winfree, E. Control of DNA strand displacement kinetics using Toehold exchange. J Am Chem Soc. 131 (47), 17303-17314 (2009).
- . Integrated DNA Technologies OligoAnalyzer Tool Available from: https://www.idtdna.com/pages/products/custom-dna-rna/dna-oligos/custom-dna-oligos (2024)
- Cavaluzzi, M. J., Borer, P. N. Revised UV extinction coefficients for nucleoside-5'-monophosphates and unpaired DNA and RNA. Nucleic Acids Res. 32 (1), e13 (2004).
- Lattuada, E., Caprara, D., Piazza, R., Sciortino, F. Spatially uniform dynamics in equilibrium colloidal gels. Sci Adv. 7 (49), (2021).
- . T7-FlashScribeTM Transcription Kit Available from: https://www.cellscript.com/products/018pl0617CS.pdf (2017)
- Zadeh, J. N., et al. NUPACK: Analysis and design of nucleic acid systems. J Comput Chem. 32 (1), 170-173 (2011).
- Walczak, M., Brady, R. A., Leathers, A., Kotar, J., Di Michele, L. Influence of hydrophobic moieties on the crystallization of amphiphilic DNA nanostructures. The Journal of Chemical Physics. 158 (8), 084501 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены