A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نهج بصري لإحداث توسع الشعيرات في الفئران لنمذجة الخلل الوظيفي الدماغي الوعائي بوساطة الأوعية الدموية الكبيرة
In This Article
Summary
لقد أثبتنا توسع الأوعية الدموية الكبيرة الذي يحفز كيميائيا في الفئران كنموذج للتحقيق في الخلل الوظيفي الوعائي الدماغي ، والذي يمكن استخدامه في الخرف الوعائي ونمذجة مرض الزهايمر. نوضح أيضا تصور الأوعية الدموية عن طريق حقن مركب مطاط السيليكون وتوفير إرشادات بصرية واضحة لقياس التغيرات في حجم الأوعية الدموية.
Abstract
الدم في الدماغ (BBB) هو نظام حاسم ينظم الدورة الدموية الانتقائية للدماغ مع المحيط ، على سبيل المثال ، مما يسمح للمغذيات الضرورية بدخول وطرد الأحماض الأمينية الزائدة أو السموم من الدماغ. لنمذجة كيف يمكن اختراق BBB في أمراض مثل الخرف الوعائي (VaD) أو مرض الزهايمر (AD) ، طور الباحثون طرقا جديدة لنمذجة توسع الأوعية. يمكن أن يكون BBB المخترق في هذه الحالات المرضية ضارا ويؤدي إلى عدم تنظيم BBB مما يؤدي إلى عواقب غير مرغوب فيها ومرضية تؤثر على وظائف المخ. تمكنا من تعديل تقنية موجودة مكنتنا من الحقن مباشرة في Cisterna magna (CM) للحث على توسع الأوعية الدموية باستخدام الإيلاستاز ، وتعطيل الوصلات الضيقة (TJ) ل BBB. باستخدام هذه الطريقة ، تمكنا من رؤية مقاييس مختلفة للنجاح مقارنة بالتقنيات السابقة ، بما في ذلك التوسع المتسق للأوعية الدموية ، وانخفاض معدل الوفيات أو تحسين التعافي ، وتحسين عامل التعبئة / التعتيم ، وهو مركب مطاط السيليكون ، والتسليم لوضع العلامات على الأوعية الدموية لتحليل التوسع. حققت هذه الطريقة المعدلة طفيفة التوغل نتائج واعدة ، مع زيادة بنسبة 19٪ -32٪ في التوسع المستمر للأوعية الدموية الكبيرة في الفئران من أسبوعين إلى 3 أشهر بعد الحقن. يتناقض هذا التحسن مع الدراسات السابقة ، والتي أظهرت زيادة التوسع فقط عند علامة أسبوع 2. تشير البيانات الإضافية إلى التوسع المستدام حتى بعد 9.5 أشهر. تم تأكيد هذه الزيادة من خلال مقارنة قطر الأوعية الدموية للإلاستاز والمجموعة المحقونة بالمركبة. بشكل عام ، هذه التقنية ذات قيمة لدراسة الاضطرابات المرضية التي تؤثر على الجهاز العصبي المركزي (CNS) باستخدام النماذج الحيوانية.
Introduction
الخلايا البطانية الوعائية الدقيقة التي تبطن الشعيرات الدموية الدماغية هي المكونات الرئيسية لتشكيل الحاجز الدموي الدماغي (BBB)1 الذي يلعب دورا حاسما في تنظيم ما يدخل أو يخرج من الدورة الدموية للدماغ مع المحيط. يسمح للعناصر الغذائية الأساسية اللازمة للأنسجة العصبية بدخول BBB ، بينما يتم طرد بعض الأحماض الأمينية الأساسية مثل الغلوتامات من الدماغ ، حيث يمكن أن تسبب التركيزات العالية ضررا عصبيا دائما لأنسجة المخ2. في ظل الظروف الفسيولوجية العادية ، يحد BBB من كمية بروتينات البلازما مثل الألبومين 3,4 والبروثرومبين من دخول الدماغ لأن هذه يمكن أن يكون لها آثار ضارة 5,6,7. أخيرا ، يحمي BBB الدماغ من السموم العصبية المنتشرة في المحيط ، مثل xenobiotics من الطعام أو البيئة1. بشكل عام ، لا رجعة في تلف أنسجة المخ ، والشيخوخة التي ترتبط بمستويات منخفضة من تكوين الخلايا العصبية8 تسلط الضوء على أهمية BBB في حماية ومنع أي عوامل من تسريع عملية التنكس العصبي.
في توسع الأوعية الدموية (أو توسع الأوعية الدموية الكبيرة) ، لوحظ انخفاض في مرونة الأوعية الدموية ، مما يؤدي إلى خضوع الأوعية لتغيرات مورفولوجية ، مما يجعلها مختلةوظيفيا 9 ويؤدي إلى انخفاض تدفق الدم في الدماغ. يؤدي هذا الانخفاض في تدفق الدم لاحقا إلى تقليل إمدادات الأكسجين والجلوكوز ، مما يؤدي في النهاية إلى تلف BBB من خلال تنشيط الخلايا النجمية التفاعلية10. عندما تتلف الصفيحة الإيلاستين الداخلية للأوعية من توسع القلة11 ، يكون التحفيز المتكرر لعامل نمو بطانة الأوعية الدموية (VEGF) ضروريا لتكوين الأوعية. هذا يمكن أن يؤدي إلى تشكيل الأوعية المتسربة ويؤدي في نهاية المطاف إلى تكوين الأوعية المرضية ، التي تتميز بتطور الأوعية المعيبة12. أثناء تكوين الأوعية المرضية ، عندما تصبح الأوعية الدموية معيبة ، تظهر آلية تعويضية لاستعادة سلامة الأوعية الدموية عن طريق تنظيم بروتينات الوصلة الضيقة. ومع ذلك ، يمكن لهذه العملية أن تعطل BBB عن غير قصد عندما تفقد السلامة الهيكلية للأوعية الدموية13. قد يحدث هذا من خلال زيادة تعطيل BBB وتعزيز إنتاج لوحة الأميلويد14. بالإضافة إلى ذلك ، يمكن أن يسبب التسرب من المحيط التهابا عصبيا15 ، مما يؤدي إلى تنكس الخلايا العصبية وفقدان الذاكرة لاحقا.
من الناحية الهيكلية ، فإن الحماية التي يوفرها BBB هي من خلال التقاطعات الضيقة التي تمنع العوامل الغريبة من دخول الدم إلى الدماغ. عند السماح لمواد معينة بدخول الدماغ ، يقوم BBB بذلك بشكل أساسي من خلال عمليتين رئيسيتين ، الانتشار السلبي ، أو قنوات محددة (مثل القنوات الأيونية والناقلات) 1. في مرض الزهايمر ، أظهرت الأبحاث أن نظام الأوعية الدموية المختل وظيفيا يلعب دورا مهما في تطور الحالة12,13. يمكن أن ينتج تكوين لويحات أميلويد بيتا (Aβ) والتنكس العصبي عن انهيار BBB12,13 واضطرابات في تدفق الدم الدماغي16. يمكن ملاحظة انخفاض في تدفق الدم الدماغي لدى الأفراد المسنين الذين تم تشخيصهم بالخرف الوعائي و17,18 بعد الميلاد. يمكن أن يساهم تلف الحاجز الدموي الدماغي (BBB) إلى جانب تدفق الدم الدماغي المختل وظيفيا (CBF) في زيادة إنتاج تركيز Aβ في الدماغ ، مصحوبا بتسلل مواد غريبة من الدورة الدموية الطرفية19.
للتحقيق في التسبب في الأمراض العصبية مثل مرض الزهايمر والخرف الوعائي (VaD) ، تم تطوير نماذج لتكرار المرض. تستخدم النماذج في المختبر على نطاق واسع ولكنها تفتقر إلى البيئة البيولوجية لنمذجة الأمراض على نطاق واسع مثل عدد الخلايا المختلطة ، مما يستلزم أهمية النماذج في الجسم الحي. يشيع استخدام الفئران بسبب سهولة التلاعب الجيني في توليد خصائص شبيهة بالإنسان (مثل علم الأمراض) في المرض. مع التقدم الذي تم إحرازه حتى الآن ، لا تزال هناك حاجة مستمرة لنماذج محسنة لمحاكاة الأنماط الظاهرية للمرض مثل توسع الأوعية الكبيرة ودورها في مرض الزهايمر. تحقيقا لهذه الغاية ، رأينا فرصة وقمنا بتعديل تقنية تضمنت حقن الإيلاستاز في Cisterna magna للفئران20,21. الإيلاستاز هو إنزيم ثبت أنه يكسر الإيلاستين في النسيج الضام22 وفي الوصلات الضيقة المحيطة23. تم اختيار Cisterna magna كنقطة للحقن نظرا لكونها تقع مباشرة فوق دائرة Willis ، أكبر وعاء دموي في الدماغ. عن طريق حقن الإيلاستاز في Cisterna magna ، يمكننا اختراق BBB والأوعية الدموية عن طريق تحطيم التقاطعات الضيقة وإحداث توسع في الأوعية الدموية (دائرة ويليس)24,25. يمكن أن يوفر الجمع بين هذه التقنية واستخدام نموذج فأر AD لعلم الأمراض ، لتحسين فهم التسبب في مكون الأوعية الدموية في مرض الزهايمر ، رؤى قيمة حول التفاعلات والتأثيرات المعقدة بين هذين المرضين المتميزين.
أظهرت الدراسات السابقة حالات يظهر فيها المرضى كلا من السمات المرضية لمرض الزهايمر و VaD ، وهي حالة يشار إليها عادة باسم الخرف المختلط 26,27. وبالتالي ، فإن فهم الآليات المترابطة بين كلتا الحالتين يمكن أن يقدم منظورا أكثر شمولا حول تطور ومظاهر هذه الاضطرابات التنكسية العصبية ، ويعزز فهمنا للآليات الأساسية والاستراتيجيات العلاجية المحتملة. تحقيقا لهذه الغاية ، نوضح تطبيق الإيلاستاز في نموذج فأر علم الأمراض AD (AppNL-F) لتحديد التغيرات الوعائية.
Protocol
تم استخدام فئرانالتطبيق NL-F(3 أشهر) التي تعبر عن لوحة الأميلويد البشرية على المستوى الفسيولوجي لهذه الدراسة على الرغم من أنه يمكن استخدام هذا النظام مع أي نموذج للقوارض. تمت الموافقة على جميع إجراءات من قبل لجنة رعاية في CAMH (البروتوكول # 843) وكانت متوافقة مع المعايير الأخلاقية لإرشادات المجلس الكندي لرعاية. تم تربية الفئران في المنزل والاحتفاظ بها في دورة 12 ساعة من الضوء والظلام مع وصول ad libitum إلى الطعام والماء.
1. إجراء حقن سيستيرنا ماجنا (CM)
- الإجراء الجراحي
- ضع الماوس (APPNL-F ، كلا الجنسين ، 3 أشهر) في غرفة تحريض التخدير لمدة 1 دقيقة.
ملاحظة: اغسل الحجرة ب 5٪ إيزوفلوران ممزوج بأكسجين 1٪ لمدة دقيقة واحدة على الأقل. - بعد تخدير الفأر ، أخرج من الغرفة وضعه على ستارة جراحية جديدة وحافظ على التخدير (إيزوفلوران ، 2.5٪ -3٪) عن طريق وضع مخروط أنف على الأنف.
ملاحظة: تحقق من عمق التخدير عن طريق الضغط على إصبع القدم لضمان عدم وجود ردود فعل. - تطبيق مرهم العيون لمنع الجفاف. بعد ذلك، يتم حقن 0.1 مل من البوبيفاكايين تحت الجلد (مخدر موضعي؛ 1-2 ملغ/كغ 0.125٪، مع نسبة تخفيف 1:2) في موقع الشق وميتاكام (مسكن؛ 5 ملغ/كغ، مع نسبة تخفيف 1:10). حافظ على رطوبة عن طريق حقن 0.5 مل من المحلول الملحي تحت الجلد قبل القيام بالإجراء للتعويض عن أي فقدان محتمل للدم أثناء الجراحة.
- للحصول على موقع شق واضح ، احلق الرقبة عند قاعدة العظم القذالي ، وامسح السطح باستخدام برنامج تلفزيوني معقم وانقل الموضوع إلى الإطار التجسيمي في وضعية الانبطاح.
ملاحظة: تأكد من الحفاظ على التخدير من خلال مخروط الأنف المجسم. - ضع قضيب الأنف من الإطار التجسيمي أعلى الماوس لتوفير الاستقرار والتأكد من تثبيت الأسنان العلوية.
- ضع رأس بزاوية 120 درجة من الجسم لرفع وإمالة القفا لكشف منطقة الاهتمام الجراحية.
- نظف موقع الجراحة باستخدام مقشر Betadine 3x ، 70٪ إيثانول 3x ، ومحلول betadine 1x بشاش معقم 2 بوصة × 2 بوصة.
- قم بطي الجلد برفق بمساعدة الملقط وقم بعمل شق صغير (1 سم) باستخدام مقص جراحي.
ملاحظة: يجب أن يكشف هذا عن خط الوسط في مؤخرة العنق. - قم بتشغيل المشرط بعناية على طول خط الوسط لقطع العضلات. ثم ، باستخدام ملاقط فصل العضلات بلطف عن طريق سحبها بعيدا إلى اليسار واليمين.
ملاحظة: يجب أن يكشف هذا عن Cisterna magna (مثلث مقلوب) الموجود أسفل قاعدة الجمجمة (الشكل 1).
- ضع الماوس (APPNL-F ، كلا الجنسين ، 3 أشهر) في غرفة تحريض التخدير لمدة 1 دقيقة.
- تحضير الإيلاستاز
ملاحظة: تحتوي عبوة الإيلاستاز (شكل مسحوق) التي تم طلبها على 250 وحدة (U). كمية الإيلاستاز المراد حقنها في كل هي 2.5 ميكرولتر. يجب أن تكون كمية الإيلاستاز التي من المفترض أن تكون في 2.5 ميكرولتر 15 مللي وحدة mU.- احسب أولا تركيز المحلول المراد حقنه.
التركيز = الكتلة / الحجم
= 15 mU / 2.5 μL
= 6 وحدة وحدة / ميكرولتر
لذلك ، فإن التركيز المطلوب هو 6 mU / μL. - كمية الإيلاستاز هي 250 U وتعمل الدراسة مع وحدات ملي ، لذلك قم بتحويل الوحدات إلى وحدات مللية مما يعطي 250000 mU.
- بعد وجود كتلة 250000 mU وتركيز 6 mU / uL ، اكتشف الحجم (PBS) الذي يتطلب تخفيف الإيلاستاز والحفاظ على تركيز 6 mU / uL.
- باستخدام نفس الصيغة أعلاه ، أعد الترتيب لإيجاد الحجم:
الحجم = الكتلة / Conc.
= 250000 mU / 6 mU / μL
= 41666.67 ميكرولتر - نظرا لأنه من الصعب ماصة 41666.67 ميكرولتر ، ما عليك سوى تحويلها إلى ملليلتر بتقسيمها على 1000 للحصول على 41.66667 مل للحصول على محلول 1x.
- لجعل الحل أكثر تركيزا ، قم بزيادته بمقدار 10x أو 100x.
- قم بإنشاء حل 10x لأنه من الأسهل العمل معه (انظر أدناه).
محلول 10x ---------- 4.166667 مل (conc.)
- ضع 250 U في أنبوب قسمة سعة 5 مل وأضف 4.167 مل من PBS المعقم في أنبوب القسمة لصنع محلول مخزون 10x.
- ماصة 10 ميكرولتر من محلول المخزون ووضعها في 100 أنبوب قسمة مما يعطي 1000 ميكرولتر من محلول المخزون 4.167 مل. قم بتخزين الأنابيب في درجة حرارة -20 درجة مئوية.
- قم بتخزين ما تبقى من محلول المخزون في أنابيب القسمة عند 100 ميكرولتر لكل أنبوب وتخزينها في الفريزر عند -20 درجة مئوية.
ملاحظة: المحاليل مستقرة عند -20 درجة مئوية لمدة تصل إلى 6 أشهر مع عدم وجود خسارة كبيرة في النشاط. بالإضافة إلى ذلك ، من المهم ملاحظة أن التجميد المفرط وذوبان الإيلاستاز يمكن أن يقلل من الاستقرار. لذلك ، لمنع حدوث ذلك ، يمكن تقسيم محلول المخزون قبل التجميد بحيث يلزم إذابة عينة واحدة فقط في كل مرة للحقن. - بعد إذابة أحد أنابيب القسمة التي تحتوي على 10 ميكرولتر من محلول 10x ، أضف 90 ميكرولتر من PBS المعقم للحصول على محلول 100 ميكرولتر 1x.
- إذا تم إذابة أنبوب القسمة الذي يحتوي على 100 ميكرولتر من محلول 10x بدلا من ذلك ، فما عليك سوى إضافة 900 ميكرولتر من PBS للحصول على 1000 ميكرولتر ، وهو محلول 1x. يخزن أي من المحلولين في درجة حرارة 4 درجة مئوية لمدة 1 أسبوع.
- احسب أولا تركيز المحلول المراد حقنه.
- الحقن في سيستيرنا ماجنا
ملاحظة: نظف حقنة هاملتون قبل التحميل بالإيلاستاز عن طريق التحميل والشفط بالماء المقطر 5x ، ثم الإيثانول 5x ، وأخيرا الماء المقطر 5x.- قم بتحميل حقنة هاملتون ب 2.5 ميكرولتر من الإيلاستاز (تركيز 15 mU) وتأكد من عدم وجود فقاعات هواء.
- أدخل المحقنة ببطء بحيث يكون الشطبة متجهة لأعلى في وسط Cisterna magna.
ملاحظة: تجنب ثقب أي أوعية دموية تمر عبر Cisterna magna. - بعد ثقب ، وإزالة شطبة. هذا سوف يسهل إطلاق كمية صغيرة من السائل النخاعي (CSF). استخدم قطعة قطن معقمة لامتصاص السائل الدماغي النخاعي الزائد.
- أعد إدخال الشطبة في موقع البزل ، وقم بحقن الإيلاستاز أو السيارة ببطء لأكثر من 1 دقيقة في Cisterna magna واترك الإبرة في مكانها لمدة 1 دقيقة لمنع أي تسرب للإلاستاز.
- بعد إزالة شطبة ، أغلق موقع الشق بخياطة جراحية غير قابلة للامتصاص (# 4-0 بإبرة 3/8 بوصة) ، وأوقف تشغيل المخدر.
- أخرج من الإطار التجسيمي وضعه على وسادة حرارة دافئة عند 37 درجة مئوية حتى يتعافى الموضوع.
ملاحظة: يوصى بجرعة أخرى من Metacam بعد الجراحة للمساعدة في تخفيف الألم أثناء التعافي بعد الجراحة.
2. حقن مركب مطاط السيليكون وحصاد الأنسجة
- تخدير بجرعة زائدة من الأفيرتين (1 مل ، 125-250 مجم / كجم).
ملاحظة: اضغط على إصبع القدم لضمان توقف ردود الفعل. - ضع على حفاضات وقم بتأمين جميع الأطراف بشريط جراحي مع توجيه تجويف الصدر لأعلى
- افتح تجويف الصدر باستخدام ملاقط ومقص لكشف القلب.
- أدخل إبرة حادة 23 جم في البطين الأيسر للقلب وقم بتعطيرها ب PBS مملوءة بالهيبارين (100 وحدة / مل) لمدة 4 دقائق لتنظيف الأوعية الدموية باستخدام مضخة التروية الدقيقة.
- استبدل الزجاجة العازلة بزجاجة تحتوي على 4٪ بارافورمالدهايد (PFA) (مكونة في برنامج تلفزيوني) وتخفف لمدة 4 دقائق أخرى.
- قم بإعداد محلول مركب مطاط السيليكون (الأصفر) عن طريق الجمع بين 5 مل من المركب مع 5 مل من المادة المخففة في أنبوب سعة 50 مل. تخلط جيدا قبل الاستخدام.
- املأ حقنة سعة 10 مل ب 10 مل من مركب مطاط السيليكون أوند. قم بتوصيل المحقنة بالخرطوم المتصل بإبرة حادة 23 جيجا ، وقم بحقن المحلول يدويا بعناية في القلب.
ملاحظة: نظرا للزوجة العالية لمركب مطاط السيليكون ، من المهم استخدام حقنة برميلية أكبر وإلا سيكون الضغط كبيرا جدا لدفع المكبس. - قم بإزالة رأس الفأر بعد الحقن وتخزينه على حرارة 4 درجات مئوية طوال الليل للسماح لمركب مطاط السيليكون بالمعالجة في الأوعية.
- في اليوم التالي ، قم بإزالة جمجمة الماوس برفق (يفضل استخدام ملاقط دقيقة) ، واستخراج الدماغ ، واحتضان 4٪ PFA طوال الليل في درجة حرارة الغرفة (RT).
- بعد حضانة لمدة 24 ساعة في PFA ، اغسل الدماغ في PBS 3x ، وضعه في 30٪ سكروز ، واحفظه في 4 درجات مئوية.
3. التحليل الكمي
- لالتقاط صور عالية الجودة لدائرة ويليس في الدماغ بأكمله (الشكل 3):
- إزالة الدماغ من محلول السكروز. جفف الدماغ تماما باستخدام منشفة ورقية لفتل رطوبة السطح.
- ضع الدماغ في قطاعة الدماغ. ضع قطاعة الدماغ تحت مجهر ضوئي مزود بكاميرا.
- ركز المجهر على دقة واضحة وعالية الدقة لدائرة ويليس.
- استخدم برنامج تحليل الصور مع مرجع مسطرة 10 سم لقياس 1 سم تقريبا ولاحظ عدد البكسل. اضبط مقياس 1 سم بناء على هذا القياس ، ثم قم بقياس سمك الشريان القاعدي أفقيا لإيجاد قطره.
- استخدم برنامج قياس كثافة البكسل القياسي لتحليل الصورة. قم بقياس (بالسنتيمتر) خمس قراءات منفصلة للشريان القاعدي باستخدام برنامج تحليل الصور وحساب المتوسط للحصول على تمثيل دقيق لقطر الشريان القاعدي.
- استخدم تحليل التباين 2-way (ANOVA) لمقارنة متوسط التغير في القطر بين الإيلاستاز والمجموعة الضابطة.
- احسب النسبة المئوية للتغير في القطر باستخدام الصيغة أدناه 21:
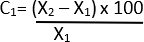
C = التغير النسبي
X1 = القيمة الأولية (السيارة)
X2 = القيمة النهائية (الإيلاستاز)
ضع في اعتبارك قيم P أقل من 0.05 ذات دلالة إحصائية. إجراء جميع التحليلات الإحصائية باستخدام برنامج التحليل الإحصائي.
- احسب النسبة المئوية للتغير في القطر باستخدام الصيغة أدناه 21:
4. إزالة مركب مطاط السيليكون باستخدام جفاف الكحول
ملاحظة: من المهم تجفيف الدماغ للمساعدة في إزالة مركب مطاط السيليكون الزائد من الأوعية الدموية والذي يمكن أن يحسن جودة التلوين المناعي.
- اغسل العقول 3x باستخدام برنامج تلفزيوني لإزالة السكروز.
- ضع الدماغ في 25٪ ، 50٪ ، 75٪ ، 95٪ ، والإيثانول المطلق لمدة 24 ساعة عند كل تركيز ، لمدة إجمالية قدرها 5 أيام.
- بعد جفاف الأنسجة ، ضع الأنسجة في ساليسيلات الميثيل (conc. ≤100 ٪) لمدة 12-24 ساعة. سيسمح الإيثانول وساليسيلات الميثيل بإزالة السيليكون الزائد في الأنسجة.
- اغسل الدماغ في PBS 3x لإزالة المواد الكيميائية المتبقية واتركه طوال الليل على كرسي هزاز عند 4 درجات مئوية في برنامج تلفزيوني جديد.
- ضع الدماغ في السكروز واحفظه عند 4 درجات مئوية قبل التقسيم والمناعة الملطخة.
5. تلطيخ كيميائي مناعي
- تقسيم العقول
- قبل التقسيم المناعي ، اسمح للدماغ بالاستقرار في قاع الأنبوب المملوء بالسكروز.
- قم بتجميد الدماغ على منصة microtome باستخدام مركب درجة حرارة القطع المثلى (OCT) المحاط بالثلج الجاف. قم بتقطيع الدماغ إلى أقسام 40 ميكرومتر باستخدام شفرة ميكروتوم.
- انقل كل قسم إلى لوحة ذات 96 بئرا تحتوي على مادة واقية من البرودة لمنع التجمد باستخدام فرشاة طلاء ذات طرف رفيع.
- أغلق اللوحة المكونة من 96 بئرا بإحكام بغلاف بلاستيكي. قم بتخزين اللوحة محكمة الغلق في فريزر -20 درجة مئوية.
- تلطيخ التألق المناعي (باستخدام NeuN كمثال)
- ضع الأقسام في طبق من 24 بئرا. قم بإجراء ثلاث غسلات باستخدام برنامج تلفزيوني للتخلص من مادة الحماية من التبريد.
- لمنع الارتباط غير المحدد ، احتضان لمدة 1 ساعة في RT باستخدام محلول مانع يحتوي على 2٪ مصل الماعز ، 0.1٪ Triton-X 100 ، و 1٪ BSA.
- قم بإعداد جميع المكونات في برنامج تلفزيوني.
ملاحظة: تضمن الجسم المضاد الأساسي المستخدم فأرا وحيد النسيلة مضادا ل NeuN مع تخفيف 1: 500. وشمل الجسم المضاد الثانوي المستخدم الماعز متعدد النسيلة المضاد للفأر 568 مع تخفيف 1: 200. - تمييع الماوس أحادي النسيلة المضادة ل NeuN في حل الحظر المذكور أعلاه.
- أضف الجسم المضاد المخفف إلى كل بئر. احتضان بين عشية وضحاها في 4 درجة مئوية ، محمية من الضوء بواسطة احباط.
- بعد الحضانة الأولية ، اغسل الأقسام 3x باستخدام PBS. تمييع الماعز متعدد النسيلة المضادة للماوس 568 في نفس حل الحظر.
- أضف الجسم المضاد المخفف إلى كل بئر. احتضان لمدة 2 ساعة في درجة حرارة الغرفة ، محمية من الضوء بواسطة احباط.
- اغسل الأقسام 3x باستخدام PBS بعد الحضانة الثانوية.
- استعد للتركيب عن طريق نقل الأقسام ببطء إلى الشرائح باستخدام فرش الطلاء الدقيقة. اترك جميع الأقسام حتى تجف.
- ضع 125-150 ميكرولتر من وسائط التركيب المضادة للتلاشي بمجرد تجفيف الأقسام. ضع أغطية الأغطية برفق.
- اترك الشرائح تجف لمدة 24 ساعة في RT في الظلام ، وختم الحواف بطلاء الأظافر. التقط صور الفلورسنت باستخدام برنامج التصوير.
النتائج
لقد نجحنا في تحديد موقع Cisterna magna تحت المنطقة القذالية من الجمجمة بعد وضع الماوس بعناية على الإطار التجسيمي وتشريح العضلات. يقع هذا الهيكل التشريحي ، الذي يشبه المثلث المقلوب والمظلل باللون الأصفر ، أسفل قاعدة الجمجمة (الشكل 1). لضمان الدقة ومنع أي ضرر لأنسجة المخ ، تم إدخال 1...
Discussion
توضح هذه المقالة بروتوكولا محسنا للتوسع الوعائي الدماغي ، مما يوفر نهجا دقيقا ومباشرا لحقن الإيلاستاز في Cisterna magna للفئران. تعمل هذه النقطة التشريحية كبوابة مباشرة للسائل النخاعي ، مما يوفر وسيلة قيمة للتحقيق في الأمراض العصبية المختلفة. واحدة من المزايا الرئيسية لهذه التقنية المعدلة هي ?...
Disclosures
لا يوجد تضارب في المصالح.
Acknowledgements
أصبحت هذه الدراسة ممكنة بفضل المساهمات القيمة لستيفاني تام التي قدمت الدعم في المساعدة في العمليات الجراحية. نعرب عن خالص امتناننا لمساعدتها. المعاهد الوطنية للصحة (AG066162) لدعم هذا البحث.
Materials
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
References
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved