Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуальный подход к индуцированию долихоэктазий у мышей для моделирования цереброваскулярной дисфункции, опосредованной крупными сосудами
В этой статье
Резюме
Мы демонстрируем химическую индуцирование расширения крупных кровеносных сосудов у мышей в качестве модели для исследования цереброваскулярной дисфункции, которая может быть использована для моделирования сосудистой деменции и болезни Альцгеймера. Мы также демонстрируем визуализацию сосудистой сети путем введения силиконовой резиновой смеси и предоставляем четкие визуальные рекомендации для измерения изменений размера кровеносных сосудов.
Аннотация
Гематоэнцефалический мозг (ГЭБ) является важнейшей системой, которая регулирует избирательное кровообращение мозга с периферией, например, позволяя необходимым питательным веществам поступать и выводить избыток аминокислот или токсинов из мозга. Чтобы смоделировать, как ГЭБ может быть нарушен при таких заболеваниях, как сосудистая деменция (ВАД) или болезнь Альцгеймера (БА), исследователи разработали новые методы моделирования расширения сосудов. Скомпрометированный ГЭБ при этих болезненных состояниях может быть вредным и привести к нарушению регуляции ГЭБ, что приводит к нежелательным и патологическим последствиям, влияющим на функцию мозга. Мы смогли модифицировать существующую технику, которая позволила нам вводить непосредственно в Cisterna magna (CM), чтобы вызвать расширение кровеносных сосудов с помощью эластазы и нарушить плотные соединения (TJ) ГЭБ. С помощью этого метода мы смогли увидеть различные показатели успеха по сравнению с предыдущими методами, включая последовательное расширение кровеносных сосудов, снижение смертности или улучшение восстановления, а также улучшение заполняющего/затемняющего агента, силиконовой резиновой смеси, доставки для маркировки кровеносных сосудов для анализа дилатации. Этот модифицированный минимально инвазивный метод показал многообещающие результаты, с увеличением на 19-32% устойчивой дилатации крупных кровеносных сосудов у мышей от 2 недель до 3 месяцев после инъекции. Это улучшение контрастирует с предыдущими исследованиями, которые показали увеличение дилатации только на отметке 2 недели. Дополнительные данные свидетельствуют об устойчивом росте даже спустя 9,5 месяцев. Это увеличение было подтверждено путем сравнения диаметра кровеносных сосудов эластазы и группы, в которой вводили носитель. В целом, эта методика ценна для изучения патологических расстройств, влияющих на центральную нервную систему (ЦНС) на животных моделях.
Введение
Микрососудистые эндотелиальные клетки, выстилающие капилляры головного мозга, являются основными компонентами для формирования гематоэнцефалического барьера (ГЭБ)1, который играет решающую роль в регулировании того, что входит в мозговой кровоток или выходит из него с периферией. Основные питательные вещества, необходимые для нервной ткани, могут поступать в ГЭБ, в то время как некоторые незаменимые аминокислоты, такие как глутамат, выводятся из мозга, так как высокие концентрации могут вызвать необратимое нейровозбуждающее повреждение мозговой ткани. В нормальных физиологических условиях ГЭБ ограничивает количество белков плазмы, таких как альбумин 3,4 и протромбин, от поступления в мозг, поскольку они могут оказывать вредное воздействие 5,6,7. Наконец, ГЭБ защищает мозг от нейротоксинов, циркулирующих на периферии, таких как ксенобиотики из пищиили окружающей среды. В целом, повреждение тканей мозга необратимо, и старение, которое коррелирует с низким уровнем нейрогенеза8, подчеркивает важность ГЭБ в защите и предотвращении любых факторов, ускоряющих нейродегенеративный процесс.
При долихоэктазии (или расширении крупных кровеносных сосудов) наблюдается снижение эластичности сосудов, что приводит к морфологическим изменениям сосудов, что делает их дисфункциональными9 и приводит к снижению кровотока в мозге. Это снижение кровотока впоследствии уменьшает поступление кислорода и глюкозы, что в конечном итоге приводит к повреждению ГЭБ через активацию реактивных астроцитов10. При повреждении внутренней эластиновой пластинки сосудов в результате долихоэктазии11 необходима повторная стимуляция фактора роста эндотелия сосудов (VEGF) для ангиогенеза. Это может привести к образованию негерметичных сосудов и в конечном итоге привести к патологическому ангиогенезу, характеризующемуся развитием дефектных сосудов12. Во время патологического ангиогенеза, когда кровеносные сосуды становятся дефектными, появляется компенсаторный механизм для восстановления целостности сосудов путем повышения регуляции белков плотных соединений. Тем не менее, этот процесс может непреднамеренно нарушить ГЭБ, когда структурная целостность кровеносного сосудатеряется. Это может произойти за счет дальнейшего нарушения ГЭБ и стимулирования производства амилоидной бляшки14. Кроме того, утечка с периферии может вызвать нейровоспаление15, которое приводит к дегенерации нейронов и последующей потере памяти.
Структурно защита, которую обеспечивает ГЭБ, заключается в герметичных соединениях, которые предотвращают попадание ксенобиотиков в кровь в мозг. Когда определенные вещества попадают в мозг, ГЭБ в основном делает это с помощью двух основных процессов: пассивной диффузии или специфических каналов (таких как ионные каналы и транспортеры). Исследования показали, что при болезни Альцгеймера дисфункциональная сосудистая система играет значительную роль в прогрессировании состояния12,13. Образование бляшек бета-амилоида (Aβ) и нейродегенерация могут быть результатом распада ГЭБ12,13 и нарушений мозгового кровотока16. Снижение мозгового кровотока может наблюдаться у пожилых людей с диагнозом сосудистая деменция и БА17,18. Повреждение гематоэнцефалического барьера (ГЭБ) наряду с нарушением мозгового кровотока (КБК) может способствовать увеличению выработки концентрации Aβ в мозге, что сопровождается инфильтрацией чужеродных материалов из периферического кровообращения19.
Для изучения патогенеза неврологических заболеваний, таких как болезнь Альцгеймера и сосудистая деменция (ВАД), разрабатываются модели для репликации заболевания. Модели in vitro широко используются, но им не хватает биологической среды для обширного моделирования заболеваний, таких как популяция смешанных клеток, что обуславливает важность моделей in vivo. Мыши широко используются из-за их простоты генетических манипуляций для создания человекоподобных свойств (например, патологии) при заболеваниях. С учетом прогресса, который был достигнут до сих пор, все еще существует потребность в улучшенных моделях для имитации фенотипов заболеваний, таких как расширение крупных сосудов и их роль в развитии болезни Альцгеймера. С этой целью мы увидели возможность и модифицировали методику, которая включала инъекцию эластазы в Cisterna magna мышей 20,21. Эластаза представляет собой фермент, который, как было показано, расщепляет эластин в соединительной ткани22 и в окружающих плотных соединениях23. В качестве точки инъекции была выбрана Цистерна Магна из-за того, что она расположена прямо над кругом Виллиса, самым большим кровеносным сосудом в мозге. Вводя эластазу в Cisterna magna, мы можем поставить под угрозу ГЭБ и кровеносные сосуды, разрушая плотные соединения и вызывая расширение кровеносных сосудов (круг Виллиса)24,25. Сочетание этого метода с использованием мышиной модели патологии БА для лучшего понимания патогенеза сосудистого компонента БА может дать ценную информацию о сложных взаимодействиях и влияниях между этими двумя различными патологиями.
Предыдущие исследования продемонстрировали случаи, когда у пациентов проявляются как патологические признаки болезни Альцгеймера, так и ВАД, состояние, обычно называемое смешанной деменцией26,27. Таким образом, понимание взаимосвязанных механизмов между обоими состояниями может предложить более полное представление о прогрессировании и проявлении этих нейродегенеративных расстройств, улучшает наше понимание основных механизмов и потенциальных терапевтических стратегий. С этой целью мы демонстрируем применение эластазы в мышиной модели с патологией болезни Альцгеймера (AppNL-F) для выявления сосудистых изменений.
протокол
Для исследования были использованы мышиApp NL-F(3 месяца), которые экспрессируют человеческие амилоидные бляшки на физиологическом уровне, хотя эта система может быть использована с любой моделью грызунов. Все процедуры для животных были одобрены Комитетом по уходу за животными CAMH (Протокол #843) и соответствовали этическим стандартам руководящих принципов Канадского совета по уходу за животными. Мышей разводили в домашних условиях и содержали в течение 12-часового цикла «свет-темнота» с неограниченным доступом к корму и воде.
1. Процедура инъекции Цистерны Магна (КМ)
- Хирургическое вмешательство
- Поместите мышь (APPNL-F, оба пола, 3 месяца) в индукционную камеру для анестезии на 1 минуту.
ПРИМЕЧАНИЕ: Промойте камеру 5% изофлураном, смешанным с 1% кислородом, в течение не менее 1 минуты. - После того, как мышь будет обезболена, извлеките животное из камеры и поместите его на свежую хирургическую простыню и поддерживайте анестезию (изофлуран, 2,5%-3%), поместив носовую конус на нос.
ПРИМЕЧАНИЕ: Проверьте глубину анестезии, зажав палец ноги, чтобы убедиться в отсутствии рефлексов. - Применяйте офтальмологическую мазь для предотвращения сухости. Затем подкожно ввести 0,1 мл бупивакаина (местный анестетик; 1-2 мг/кг 0,125%, с соотношением разведения 1:2) в место разреза и Метакам (обезболивающее; 5 мг/кг, с соотношением разведения 1:10). Поддерживайте водный баланс животного, вводя 0,5 мл физиологического раствора подкожно перед процедурой, чтобы компенсировать любую потенциальную потерю крови во время операции.
- Для четкого места разреза выбрейте шейку у основания затылочной кости, протрите поверхность стерильным PBS и перенесите субъект в стереотаксическую рамку в положении лежа.
ПРИМЕЧАНИЕ: Убедитесь, что анестезия поддерживается через стереотаксический носовой конус. - Поместите носовую планку от стереотаксической рамки в верхнюю часть мыши, чтобы обеспечить устойчивость и убедиться, что верхние зубы закреплены.
- Расположите голову животного под углом 120° к телу, чтобы поднять и расширить затылок, чтобы обнажить интересующую операционную область.
- Очистите место операции скрабом бетадином 3x, 70% этанолом 3x и раствором бетадина 1x стерильной марлей размером 2 x 2 дюйма.
- Аккуратно сложите кожу с помощью пинцета и сделайте небольшой надрез (1 см) с помощью хирургических ножниц.
ПРИМЕЧАНИЕ: Это должно показать среднюю линию затылка. - Осторожно проведите скальпелем по средней линии, чтобы разрезать мышцы. Затем с помощью пинцета аккуратно раздвиньте мышцы, раздвинув их влево и вправо.
ПРИМЕЧАНИЕ: Это должно показать Cisterna magna (перевернутый треугольник), который расположен под основанием черепа (Рисунок 1).
- Поместите мышь (APPNL-F, оба пола, 3 месяца) в индукционную камеру для анестезии на 1 минуту.
- Приготовление эластазы
ПРИМЕЧАНИЕ: Заказанная упаковка эластазы (порошкообразная форма) содержала 250 единиц (Е). Количество эластазы, вводимой каждому животному, составляет 2,5 мкл. Количество эластазы, которое предполагается в 2,5 μЛ, должно составлять 15 мЕд.- Сначала рассчитайте концентрацию раствора, который будет вводиться.
Концентрация = масса/объем
= 15 мЕд/2,5 мкл
= 6 мЕд/мкл
Таким образом, требуемая концентрация составляет 6 мЕд/мкл. - Количество эластазы составляет 250 единиц, и исследование работает с миллиединицами, поэтому преобразуйте единицы в миллиединицы, что дает 250000 мЕд.
- Имея массу 250000 мЕд и концентрацию 6 мЕд/мкл, определите объем (PBS), который потребует разбавления эластазы и поддержания концентрации 6 мЕд/мкл.
- Используя ту же формулу, приведенную выше, переставьте порядок для расчета объема:
Объем = масса/конц.
= 250000 мЕд/ 6 мЕд/мкл
= 41666.67 мкл - Поскольку пипетку 41666,67 мкл трудно издать, просто преобразуйте ее в миллилитры, разделив на 1000, чтобы получить 41,66667 мл и получить 1x раствор.
- Чтобы сделать раствор более концентрированным, увеличьте его в 10 или 100 раз.
- Создайте решение 10x, так как с ним проще работать (см. ниже).
10x раствор ---------- 4,166667 мл (конц.)
- Поместите 250 ЕД в аликвотную пробирку объемом 5 мл и добавьте 4,167 мл стерильного PBS в аликвотную пробирку, чтобы получить 10-кратный исходный раствор.
- Пипеткой нанесите 10 μL стокового раствора и поместите в 100 аликвотных пробирок, дав 1000 μL из 4,167 мл стокового раствора. Храните пробирки при температуре -20 °C.
- Оставшийся исходный раствор хранить в аликвотных тубах по 100 мкл на тубу и хранить в морозильной камере при температуре -20 °С.
ПРИМЕЧАНИЕ: Растворы стабильны при температуре -20 °C в течение 6 месяцев без существенной потери активности. Кроме того, важно отметить, что чрезмерное замораживание и размораживание эластазы может снизить стабильность. Поэтому, чтобы этого не произошло, исходный раствор можно разделить перед замораживанием таким образом, чтобы за один раз нужно было разморозить только один образец для инъекции. - После размораживания одной из аликвотных пробирок, содержащей 10 мкл 10-кратного раствора, добавьте 90 мкл стерильного PBS, чтобы получить 100 мкл 1х раствора.
- Если аликвотная пробирка, содержащая 100 мкл 10-кратного раствора, была разморожена, просто добавьте 900 мкл PBS, чтобы получить 1000 μл, что является 1-кратным раствором. Хранить любой раствор при температуре 4 °C в течение 1 недели.
- Сначала рассчитайте концентрацию раствора, который будет вводиться.
- Инъекция в Cisterna magna
ПРИМЕЧАНИЕ: Очистите шприц Hamilton перед загрузкой эластазой, загрузив и аспирировав дистиллированной водой 5x, затем этанолом 5x и, наконец, дистиллированной водой 5x.- Загрузите в шприц Hamilton 2,5 мкл эластазы (концентрация 15 мЕд) и убедитесь, что в нем нет пузырьков воздуха.
- Медленно введите шприц фаской вверх в центр Cisterna magna.
ПРИМЕЧАНИЕ: Избегайте прокола кровеносных сосудов, проходящих через Cisterna magna. - После прокола снимите фаску. Это будет способствовать выделению небольшого количества спинномозговой жидкости (ликвора). Используйте стерильный ватный тампон, чтобы впитать излишки спинномозговой жидкости.
- Снова вставьте скос в место прокола, медленно введите эластазу или средство в течение 1 минуты в Cisterna magna и оставьте иглу на месте на 1 минуту, чтобы предотвратить утечку эластазы.
- После снятия скоса закройте место разреза нерассасывающимся хирургическим швом (#4-0 с иглой 3/8 дюйма) и выключите анестетик.
- Извлеките животное из стереотаксической рамки и положите на теплую грелку, установленную при температуре 37 °C, пока объект не придет в себя.
ПРИМЕЧАНИЕ: После операции рекомендуется принять еще одну дозу Метакама, чтобы облегчить боль во время послеоперационного восстановления.
2. Инъекция силиконовой резиновой смеси и забор тканей
- Обезболить животное при передозировке авертина (1 мл, 125-250 мг/кг).
ПРИМЕЧАНИЕ: Сожмите палец ноги, чтобы предотвратить прекращение рефлексов. - Поместите животное на пеленку и закрепите все конечности хирургической лентой так, чтобы грудная полость была обращена вверх
- Откройте грудную полость с помощью пинцета и ножниц, чтобы обнажить сердце.
- Введите тупую иглу 23 г в левый желудочек сердца и перфузируйте PBS с добавлением гепарина (100 Ед/мл) в течение 4 минут, чтобы очистить кровеносные сосуды с помощью микроперфузионного насоса.
- Замените буферный флакон на тот, который содержит 4% параформальдегида (PFA) (содержит PBS) и перфузируйте еще 4 минуты.
- Приготовьте раствор силиконкаучукового компаунда (желтого), соединив 5 мл компаунда с 5 мл разбавителя в пробирке объемом 50 мл. Перед применением тщательно перемешайте.
- Наполните шприц объемом 10 мл 10 мл силиконового каучукового состава. Подсоедините шприц к шлангу, подсоединенному к тупой игле 23 G, и осторожно введите раствор вручную в сердце.
ПРИМЕЧАНИЕ: Из-за высокой вязкости силиконовой резиновой смеси важно использовать цилиндрический шприц большего размера, иначе давление будет слишком большим для нажатия на поршень. - После инъекции снимите голову мыши и храните при температуре 4 °C в течение ночи, чтобы силиконовый каучуковый состав затвердел в сосудах.
- На следующий день аккуратно удалите череп мыши (желательно с помощью тонкого пинцета), извлеките мозг и инкубируйте в 4% PFA в течение ночи при комнатной температуре (RT).
- После 24-часовой инкубации в PFA промойте мозг в PBS 3x, добавьте 30% сахарозы и храните при температуре 4 °C.
3. Количественный анализ
- Чтобы получить высококачественные изображения Виллисового круга во всем мозге (Рисунок 3):
- Извлеките мозг из раствора сахарозы. Тщательно просушите мозг, используя бумажное полотенце, чтобы отвести поверхностную влагу.
- Поместите мозг в слайсер для мозгов. Поместите мозговой слайсер под световой микроскоп, оснащенный камерой.
- Сфокусируйте микроскоп на четкое разрешение Виллисового круга с высоким разрешением.
- Используйте программное обеспечение для анализа изображений с эталонной линейкой 10 см, чтобы измерить примерно 1 см, и запишите количество пикселей. На основе этого измерения установите шкалу в 1 см, затем измерьте толщину базилярной артерии горизонтально, чтобы найти ее диаметр.
- Для анализа изображения используйте стандартное программное обеспечение для пиксельной денситометрии. Измерьте (в сантиметрах) пять отдельных показаний базилярной артерии с помощью программного обеспечения для анализа изображений и рассчитайте среднее значение, чтобы получить точное представление о диаметре базилярной артерии.
- Используйте двухфакторный дисперсионный анализ (ANOVA) для сравнения среднего изменения диаметра между эластазой и контрольной группой.
- Рассчитайте процентное изменение диаметра по формуле ниже 21:
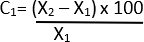
C = относительное изменение
X1 = Начальное значение (Транспортное средство)
X2 = Конечное значение (эластаза)
Считайте, что значения P менее 0,05 являются статистически значимыми. Выполняйте все статистические анализы с помощью программного обеспечения для статистического анализа.
- Рассчитайте процентное изменение диаметра по формуле ниже 21:
4. Удаление силиконовой резиновой смеси с помощью алкогольной дегидратации
ПРИМЕЧАНИЕ: Важно обезвоживать мозг, чтобы помочь удалить избыток силиконового каучука из кровеносного сосуда, который потенциально может улучшить качество иммуноокрашивания.
- Промойте мозги 3 раза с PBS, чтобы удалить сахарозу.
- Поместите мозг в 25%, 50%, 75%, 95% и абсолютный этанол на 24 часа при каждой концентрации, в общей сложности на 5 дней.
- После обезвоживания тканей поместите ткань в метилсалицилат (конк. ≤100%) на 12-24 ч. Этанол и метилсалицилат позволят удалить избыток силикона в тканях.
- Промойте мозг в PBS 3x для удаления остатков химических веществ и оставьте на ночь на качалке при температуре 4 °C в свежем PBS.
- Поместите мозг в сахарозу и храните при температуре 4 °C перед срезом и иммуноокрашиванием.
5. Иммуногистохимическое окрашивание
- Секционирование мозга
- Перед проведением иммуносекции дайте мозгу осесть на дне пробирки, наполненной сахарозой.
- Заморозьте мозг на платформе микротома с использованием компаунда с оптимальной температурой резки (ОКТ) в окружении сухого льда. Разрежьте мозг на участки размером 40 мкм с помощью лезвия микротома.
- Переложите каждую секцию в 96-луночную пластину, содержащую криопротектор, чтобы предотвратить замерзание, с помощью кисти с тонким кончиком.
- Надежно закройте 96-луночный планшет полиэтиленовой пленкой. Храните запечатанную тарелку в морозильной камере при температуре -20 °C.
- Иммунофлуоресцентное окрашивание (на примере NeuN)
- Поместите срезы в 24-луночную пластину. Выполните три промывки PBS для устранения криопротектора.
- Для предотвращения неспецифического связывания инкубируйте в течение 1 ч при ЛТ с использованием блокирующего раствора, содержащего 2% козьей сыворотки, 0,1% Тритон-Х 100 и 1% БСА.
- Подготовьте все компоненты в PBS.
Примечание: В качестве основного используемого антитела были включены моноклональные мышиные анти-NeuN с разведением 1:500. Используемое вторичное антитело включало поликлональное козье антимышиное антитело 568 в соотношении 1:200. - Разведите моноклональный мышиный анти-NeuN в упомянутом выше блокирующем растворе.
- Добавьте разведенное антитело в каждую лунку. Выдерживать в течение ночи при температуре 4 °C, защищенной от света пленкой.
- После первичной инкубации промойте секции 3 раза с PBS. Разведите поликлональный козий анти-мышь 568 в том же блокирующем растворе.
- Добавьте разведенное антитело в каждую лунку. Выдерживать в течение 2 ч при комнатной температуре, защищенной от света пленкой.
- Промойте секции 3 раза PBS после вторичной инкубации.
- Подготовьтесь к монтажу, медленно перенося секции на слайды с помощью тонких кистей. Дайте всем секциям высохнуть.
- После высыхания секций нанесите 125-150 мкл монтажного материала, препятствующего выцветанию. Аккуратно установите покровные листы.
- Дайте предметным стеклам высохнуть в течение 24 часов при RT в темноте, заклеив края лаком для ногтей. Захватывайте флуоресцентные изображения с помощью программного обеспечения для обработки изображений.
Результаты
Нам удалось обнаружить Cisterna magna под затылочной областью черепа после тщательного размещения мыши на стереотаксической раме и препарирования мышц. Эта анатомическая структура, напоминающая перевернутый треугольник и выделенная желтым цветом, расположена под основанием черепа (
Обсуждение
В этой статье демонстрируется усовершенствованный протокол цереброваскулярной дилатации, обеспечивающий точный и простой подход к введению эластазы в Cisterna magna мышей. Эта анатомическая точка служит прямыми воротами к спинномозговой жидкости, предлагая ценный путь для исследования ра...
Раскрытие информации
Конфликта интересов нет.
Благодарности
Это исследование стало возможным благодаря неоценимому вкладу Стефани Там, которая оказала поддержку в оказании помощи при проведении операций. Мы выражаем ей искреннюю благодарность за помощь. Национальным институтам здравоохранения (AG066162) за поддержку этого исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
Ссылки
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены