É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uma abordagem visual para induzir dolicoectasia em camundongos para modelar disfunção cerebrovascular mediada por grandes vasos
Neste Artigo
Resumo
Demonstramos a indução química da dilatação de grandes vasos sanguíneos em camundongos como um modelo para investigar a disfunção cerebrovascular, que pode ser usada para modelagem de demência vascular e doença de Alzheimer. Também demonstramos a visualização da vasculatura injetando composto de borracha de silicone e fornecendo orientação visual clara para medir as mudanças no tamanho dos vasos sanguíneos.
Resumo
O sangue-cérebro (BBB) é um sistema crucial que regula a circulação cerebral seletiva com a periferia, por exemplo, permitindo que os nutrientes necessários entrem e expulsem aminoácidos ou toxinas em excesso do cérebro. Para modelar como a BHE pode ser comprometida em doenças como demência vascular (DV) ou doença de Alzheimer (DA), os pesquisadores desenvolveram novos métodos para modelar a dilatação dos vasos. Uma BHE comprometida nesses estados de doença pode ser prejudicial e resultar na desregulação da BHE, levando a consequências adversas e patológicas que afetam a função cerebral. Conseguimos modificar uma técnica existente que nos permitiu injetar diretamente na Cisterna magna (CM) para induzir a dilatação dos vasos sanguíneos usando elastase e interromper as junções apertadas (TJ) da BHE. Com esse método, pudemos ver várias métricas de sucesso em relação às técnicas anteriores, incluindo dilatação consistente dos vasos sanguíneos, redução da mortalidade ou recuperação aprimorada e melhoria do agente de enchimento/opacificação, um composto de borracha de silicone, entrega para rotulagem de vasos sanguíneos para análise de dilatação. Este método minimamente invasivo modificado teve resultados promissores, com um aumento de 19% a 32% na dilatação sustentada de grandes vasos sanguíneos em camundongos de 2 semanas a 3 meses após a injeção. Essa melhora contrasta com estudos anteriores, que mostraram aumento da dilatação apenas na marca de 2 semanas. Dados adicionais sugerem expansão sustentada mesmo após 9,5 meses. Esse aumento foi confirmado comparando o diâmetro dos vasos sanguíneos da elastase e do grupo injetado no veículo. No geral, essa técnica é valiosa para estudar distúrbios patológicos que afetam o sistema nervoso central (SNC) usando modelos animais.
Introdução
As células endoteliais microvasculares que revestem os capilares cerebrais são os principais componentes para a formação da barreira hematoencefálica (BHE)1, que desempenha um papel crucial na regulação do que entra ou sai da circulação cerebral com a periferia. Os nutrientes essenciais necessários para o tecido nervoso podem entrar na BHE, enquanto alguns aminoácidos essenciais, como o glutamato, são expelidos do cérebro, pois altas concentrações podem causar danos neuroexcitatórios permanentesao tecido cerebral. Em condições fisiológicas normais, a BHE limita a entrada no cérebro de proteínas plasmáticas como albumina 3,4 e protrombina, uma vez que podem ter efeitos prejudiciais 5,6,7. Finalmente, o BBB protege o cérebro de neurotoxinas que circulam na periferia, como xenobióticos de alimentos ou do meio ambiente1. No geral, os danos aos tecidos cerebrais são irreversíveis, e o envelhecimento que se correlaciona com baixos níveis de neurogênese8 destaca a importância da BHE na proteção e prevenção de quaisquer fatores que acelerem o processo neurodegenerativo.
Na dolicoectasia (ou dilatação dos grandes vasos sanguíneos), observa-se uma diminuição na elasticidade dos vasos, o que resulta em alterações morfológicas nos vasos, tornando-os disfuncionais9 e levando à redução do fluxo sanguíneo no cérebro. Essa redução no fluxo sanguíneo subsequentemente diminui o suprimento de oxigênio e glicose, desencadeando danos à BHE por meio da ativação de astrócitos reativos10. Quando a lâmina de elastina interna dos vasos é danificada por dolicoectasia11, a estimulação repetida do fator de crescimento endotelial vascular (VEGF) é necessária para a angiogênese. Isso pode levar à formação de vasos permeáveis e, em última instância, resultar em angiogênese patológica, caracterizada pelo desenvolvimento de vasos defeituosos12. Durante a angiogênese patológica, quando os vasos sanguíneos se tornam defeituosos, um mecanismo compensatório parece restaurar a integridade do vaso regulando positivamente as proteínas da junção apertada. No entanto, esse processo pode inadvertidamente interromper a BHE quando a integridade estrutural de um vaso sanguíneo é perdida13. Isso pode ocorrer por meio de uma maior interrupção da BHE e da promoção da produção de placa amilóide14. Além disso, o vazamento da periferia pode causar neuroinflamação15, o que resulta em degeneração neuronal e subsequente perda de memória.
Estruturalmente, a proteção que o BBB fornece é através das junções apertadas que impedem que os agentes xenobióticos entrem no sangue no cérebro. Ao permitir que certas substâncias entrem no cérebro, o BBB o faz principalmente por meio de dois processos principais, difusão passiva ou canais específicos (como canais iônicos e transportadores)1. Na DA, a pesquisa demonstrou que um sistema vascular disfuncional desempenha um papel significativo na progressão da condição12,13. A formação de placas beta-amiloide (Aβ) e a neurodegeneração podem resultar da quebra da BHE12,13 e de distúrbios no fluxo sanguíneo cerebral16. A redução do fluxo sanguíneo cerebral pode ser observada em idosos com diagnóstico de demência vascular e DA17,18. Danos à barreira hematoencefálica (BHE), juntamente com um fluxo sanguíneo cerebral disfuncional (FSC), podem contribuir para o aumento da produção da concentração de Aβ no cérebro, acompanhada pela infiltração de materiais estranhos da circulação periférica19.
Para investigar a patogênese de doenças neurológicas como DA e demência vascular (DV), modelos são desenvolvidos para replicar a doença. Os modelos in vitro são amplamente utilizados, mas carecem do ambiente biológico para modelagem extensiva de doenças, como a população de células mistas, necessitando assim da importância dos modelos in vivo. Os camundongos são comumente usados devido à sua facilidade de manipulação genética na geração de propriedades semelhantes às humanas (por exemplo, patologia) na doença. Com a progressão que foi feita até agora, ainda há uma necessidade contínua de modelos aprimorados para emular fenótipos de doenças, como dilatação de grandes vasos e seu papel na DA. Para tanto, vimos uma oportunidade e modificamos uma técnica que envolvia a injeção de elastase na Cisterna magna de camundongos20,21. A elastase é uma enzima que demonstrou quebrar a elastina no tecido conjuntivo22 e nas junções apertadas circundantes23. A Cisterna magna foi escolhida como ponto de injeção por estar localizada diretamente acima do círculo de Willis, o maior vaso sanguíneo do cérebro. Ao injetar elastase na Cisterna magna, podemos comprometer a BHE e os vasos sanguíneos, rompendo as junções apertadas e induzindo a dilatação dos vasos sanguíneos (círculo de Willis)24,25. A combinação dessa técnica com o uso de um modelo de patologia de camundongo com DA, para melhorar a compreensão da patogênese do componente vascular da DA, pode fornecer informações valiosas sobre as complexas interações e influências entre essas duas patologias distintas.
Estudos anteriores demonstraram casos em que os pacientes apresentam características patológicas de DA e DV, uma condição tipicamente referida como demência mista26,27. Assim, entender os mecanismos interconectados entre as duas condições pode oferecer uma perspectiva mais abrangente sobre a progressão e manifestação desses distúrbios neurodegenerativos, aumenta nossa compreensão dos mecanismos subjacentes e das possíveis estratégias terapêuticas. Para isso, demonstramos a aplicação da elastase em um modelo de camundongo com patologia da DA (APPNL-F) para identificar alterações vasculares.
Protocolo
Camundongos AppNL-F(3 meses de idade) que expressam placa amilóide humana em nível fisiológico foram usados para este estudo, embora este sistema possa ser usado com qualquer modelo de roedor. Todos os procedimentos em animais foram aprovados pelo Comitê de Cuidados com Animais do CAMH (Protocolo # 843) e estavam de acordo com os padrões éticos das diretrizes do Conselho Canadense de Cuidados com Animais. Os camundongos foram criados internamente e mantidos em um ciclo claro-escuro de 12 horas com acesso ad libitum a ração e água.
1. Procedimento para injeção de Cisterna magna (CM)
- Procedimento cirúrgico
- Coloque o mouse (APPNL-F, ambos os sexos, 3 meses) em uma câmara de indução anestésica por 1 min.
NOTA: Lave a câmara com isoflurano a 5% misturado com oxigênio a 1% por pelo menos 1 min. - Depois que o camundongo estiver anestesiado, remova o animal da câmara e coloque-o em uma nova cortina cirúrgica e mantenha a anestesia (isoflurano, 2,5% -3%) colocando um cone nasal sobre o nariz.
NOTA: Verifique a profundidade da anestesia beliscando o dedo do pé para garantir que não haja reflexos. - Aplique pomada oftálmica para evitar o ressecamento. Em seguida, injetar por via subcutânea 0,1 mL de bupivacaína (anestésico local; 1-2 mg/kg 0,125%, com uma razão de diluição de 1:2) no local da incisão e Metacam (analgésico; 5 mg/kg, com uma razão de diluição de 1:10). Mantenha o animal hidratado injetando 0,5 mL de solução salina por via subcutânea antes de fazer o procedimento para compensar qualquer perda potencial de sangue durante a cirurgia.
- Para um local de incisão claro, raspe o pescoço na base do osso occipital, limpe a superfície com PBS estéril e transfira o sujeito para a estrutura estereotáxica na posição prona.
NOTA: Certifique-se de que a anestesia seja mantida através do cone estereotáxico do nariz. - Coloque a barra nasal da estrutura estereotáxica na parte superior do mouse para fornecer estabilidade e garantir que os dentes superiores estejam presos.
- Posicione a cabeça do animal em um ângulo de 120° em relação ao corpo para elevar e distender a nuca para expor a área cirúrgica de interesse.
- Limpe o local da cirurgia com esfoliante Betadine 3x, etanol 70% 3x e solução betadine 1x com gaze estéril de 2 polegadas x 2 polegadas.
- Dobre a pele suavemente com a ajuda de uma pinça e faça uma pequena incisão (1 cm) usando uma tesoura cirúrgica.
NOTA: Isso deve revelar a linha média da nuca. - Passe cuidadosamente o bisturi ao longo da linha média para cortar os músculos. Em seguida, usando uma pinça, separe suavemente os músculos, separando-os para a esquerda e para a direita.
NOTA: Isso deve revelar a Cisterna magna (triângulo invertido) que está localizada abaixo da base do crânio (Figura 1).
- Coloque o mouse (APPNL-F, ambos os sexos, 3 meses) em uma câmara de indução anestésica por 1 min.
- Preparação de elastase
NOTA: O pacote de elastase (forma de pó) que foi encomendado continha 250 unidades (U). A quantidade de elastase a injetar em cada animal é de 2,5 μL. A quantidade de elastase que deve estar em 2,5 μL deve ser de 15 miliunidades mU.- Primeiro calcule a concentração da solução a ser injetada.
Concentração = massa/volume
= 15 mU/2,5 μL
= 6 mU/μL
Portanto, a concentração necessária é de 6 mU/μL. - A quantidade de elastase é de 250 U e o estudo trabalha com miliUnits, então converta as unidades em miliUnits, o que dá 250000 mU.
- Depois de ter uma massa de 250000 mU e concentração de 6 mU/uL, descubra o volume (PBS) que exigiria diluir a elastase e manter uma concentração de 6 mU/uL.
- Usando a mesma fórmula acima, reorganize para resolver o volume:
Volume = massa/Conc.
= 250000 mU/ 6 mU/μL
= 41666.67 μL - Como é difícil pipetar 41666,67 μL, basta convertê-lo em mililitros dividindo-o por 1000 para obter 41,66667 mL para obter uma solução 1x.
- Para tornar a solução mais concentrada, aumente-a em 10x ou 100x.
- Crie uma solução 10x, pois é mais simples de trabalhar (veja abaixo).
Solução 10x ---------- 4,166667 mL (conc.)
- Coloque os 250 U em um tubo de alíquota de 5 mL e adicione 4,167 mL de PBS estéril no tubo de alíquota para fazer a solução estoque 10x.
- Pipetar 10 μL de solução-mãe e colocar em 100 tubos alíquotas dando 1000 μL da solução-mãe de 4,167 ml. Armazene os tubos a -20 °C.
- Conservar o resto da solução-mãe em tubos alíquotas a 100 μl por tubo e conservar no congelador a -20 °C.
NOTA: As soluções são estáveis a -20 °C por até 6 meses, sem perda significativa de atividade. Além disso, é importante observar que o congelamento e descongelamento excessivos da elastase podem reduzir a estabilidade. Portanto, para evitar que isso aconteça, a solução estoque pode ser dividida antes do congelamento, de modo que apenas uma amostra precise ser descongelada por vez para injeção. - Depois de descongelar um dos tubos de alíquota que contém 10 μL de uma solução 10x, adicione 90 μL de PBS estéril para obter uma solução 1x de 100 μL.
- Se o tubo alíquota que contém 100 μL de uma solução 10x foi descongelado, basta adicionar 900 μL de PBS para obter 1000 μL, que é uma solução 1x. Conservar qualquer uma das soluções a 4 °C durante 1 semana.
- Primeiro calcule a concentração da solução a ser injetada.
- Injetando na Cisterna Magna
NOTA: Limpe a seringa Hamilton antes de carregar com elastase, carregando e aspirando com água destilada 5x, depois etanol 5x e, finalmente, água destilada 5x.- Carregue a seringa Hamilton com 2.5 μL de elastase (concentração de 15 mU) e certifique-se de que não haja bolhas de ar.
- Insira lentamente a seringa com o chanfro voltado para cima no centro da Cisterna magna.
NOTA: Evite perfurar quaisquer vasos sanguíneos que atravessem a Cisterna magna. - Após a perfuração, remova o chanfro. Isso facilitará a liberação de uma pequena quantidade de líquido cefalorraquidiano (LCR). Use um cotonete estéril para absorver o excesso de LCR.
- Reinsira o chanfro no local da punção, injete lentamente elastase ou veículo por mais de 1 min na Cisterna magna e deixe a agulha no lugar por 1 min para evitar qualquer vazamento de elastase.
- Após a remoção do chanfro, feche o local da incisão com uma sutura cirúrgica não absorvível (#4-0 com agulha de 3/8") e desligue o anestésico.
- Retirar o animal da estrutura estereotáxica e colocá-lo sobre uma almofada térmica quente regulada para 37 °C até que o sujeito recupere.
NOTA: Outra dose de Metacam é recomendada após a cirurgia para ajudar com a dor durante a recuperação pós-cirúrgica.
2. Injeção de composto de borracha de silicone e colheita de tecido
- Anestesifique o animal com uma overdose de avertin (1 mL, 125-250 mg / kg).
NOTA: Aperte o dedo do pé para garantir que os reflexos cessem. - Coloque o animal em uma fralda e prenda todos os membros com fita cirúrgica com a cavidade torácica voltada para cima
- Abra a cavidade torácica usando uma pinça e uma tesoura para expor o coração.
- Insira uma agulha romba de 23 G no ventrículo esquerdo do coração e perfunda com PBS infundido com heparina (100 U / mL) por 4 min para limpar os vasos sanguíneos usando uma bomba de microperfusão.
- Substitua o frasco tampão por um contendo 4% de paraformaldeído (PFA) (feito em PBS) e perfunda por mais 4 min.
- Prepare a solução de composto de borracha de silicone (amarelo) combinando 5 mL de composto com 5 mL do diluente em um tubo de 50 mL. Misture bem antes de usar.
- Encha uma seringa de 10 mL com 10 mL de composto de borracha de silicone. Conecte a seringa à mangueira conectada a uma agulha cega de 23 G e injete cuidadosamente a solução manualmente no coração.
NOTA: Devido à alta viscosidade do composto de borracha de silicone, é importante usar uma seringa de cilindro maior ou a pressão será muito grande para empurrar o êmbolo. - Remova a cabeça do mouse após a injeção e armazene a 4 °C durante a noite, permitindo que o composto de borracha de silicone cure nos recipientes.
- No dia seguinte, remova suavemente o crânio do camundongo (de preferência usando uma pinça fina), extraia o cérebro e incube em PFA a 4% durante a noite em temperatura ambiente (TR).
- Após uma incubação de 24 horas em PFA, lave o cérebro em PBS 3x, coloque em sacarose a 30% e armazene a 4 ° C.
3. Análise quantitativa
- Para capturar imagens de alta qualidade do Círculo de Willis em todo o cérebro (Figura 3):
- Remova o cérebro da solução de sacarose. Seque bem o cérebro usando uma toalha de papel para absorver a umidade da superfície.
- Posicione o cérebro em um cortador de cérebro. Coloque o cortador de cérebro sob um microscópio de luz equipado com uma câmera.
- Focalize o microscópio em uma resolução clara e de alta resolução do Círculo de Willis.
- Use um software de análise de imagem com uma referência de régua de 10 cm para medir aproximadamente 1 cm e anotar a contagem de pixels. Defina a escala de 1 cm com base nessa medida e, em seguida, meça a espessura da artéria basilar horizontalmente para encontrar seu diâmetro.
- Use um software de densitometria de pixel padrão para analisar a imagem. Meça (em centímetros) cinco leituras separadas da artéria basilar usando um software de análise de imagem e calcule a média para obter uma representação precisa do diâmetro da artéria basilar.
- Use uma análise de variância (ANOVA) de 2 vias para comparar a mudança média no diâmetro entre a elastase e o grupo controle.
- Calcule a variação percentual no diâmetro usando a fórmula abaixo 21:
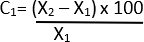
C = variação relativa
X1 = Valor inicial (Veículo)
X2 = Valor final (elastase)
Considere valores de P menores que 0,05 estatisticamente significativos. Realize todas as análises estatísticas usando um software de análise estatística.
- Calcule a variação percentual no diâmetro usando a fórmula abaixo 21:
4. Remoção do composto de borracha de silicone usando desidratação com álcool
NOTA: É importante desidratar o cérebro para ajudar a remover o excesso de composto de borracha de silicone do vaso sanguíneo, o que pode potencialmente melhorar a qualidade da imunocoloração.
- Lave os cérebros 3x com PBS para remover a sacarose.
- Coloque o cérebro em etanol a 25%, 50%, 75%, 95% e absoluto por 24 h em cada concentração, por um tempo total de 5 dias.
- Após a desidratação do tecido, coloque o tecido em salicilato de metila (conc. ≤100%) por 12-24 h. O etanol e o salicilato de metila permitirão a remoção do excesso de silicone no tecido.
- Lave o cérebro em PBS 3x para remover produtos químicos residuais e deixe durante a noite em um balancim a 4 ° C em PBS fresco.
- Colocar o cérebro em sacarose e conservá-lo a 4 °C antes da secção e imunocoloração.
5. Coloração imuno-histoquímica
- Seccionamento de cérebros
- Antes da imunosecção, permita que o cérebro se acomode no fundo do tubo cheio de sacarose.
- Congele o cérebro na plataforma de micrótomo usando o composto de temperatura de corte ideal (OCT) cercado por gelo seco. Corte o cérebro em seções de 40 μm usando a lâmina do micrótomo.
- Transfira cada seção para uma placa de 96 poços contendo crioprotetor para evitar o congelamento usando um pincel de ponta fina.
- Sele firmemente a placa de 96 poços com filme plástico. Armazene a placa selada em um freezer a -20 °C.
- Coloração por imunofluorescência (usando NeuN como exemplo)
- Coloque as seções em uma placa de 24 poços. Realize três lavagens com PBS para eliminar o crioprotetor.
- Para evitar a ligação inespecífica, incubar por 1 h em RT usando uma solução de bloqueio contendo 2% de soro de cabra, 0,1% de Triton-X 100 e 1% de BSA.
- Prepare todos os componentes no PBS.
NOTA: O anticorpo primário usado incluiu anti-NeuN monoclonal de camundongo com diluição de 1: 500. O anticorpo secundário usado incluiu o anti-camundongo policlonal de cabra 568 com diluição de 1:200. - Diluir o anti-NeuN monoclonal de ratinho na solução de bloqueio acima mencionada.
- Adicione o anticorpo diluído a cada poço. Incubar durante a noite a 4 °C, protegido da luz por papel alumínio.
- Após a incubação primária, lave as seções 3x com PBS. Diluir o anti-rato de cabra policlonal 568 na mesma solução de bloqueio.
- Adicione o anticorpo diluído a cada poço. Incubar durante 2 h à temperatura ambiente, protegido da luz por papel alumínio.
- Lave as seções 3x com PBS após a incubação secundária.
- Prepare-se para a montagem transferindo lentamente as seções para os slides usando pincéis finos. Deixe todas as seções secarem.
- Aplique 125-150 μL de mídia de montagem anti-desbotamento assim que as seções estiverem secas. Coloque delicadamente as lamínulas.
- Deixe as lâminas secarem por 24 h em RT no escuro, selando as bordas com esmalte. Capture imagens fluorescentes usando software de imagem.
Resultados
Conseguimos localizar a Cisterna magna abaixo da região occipital do crânio depois de posicionar cuidadosamente o camundongo na estrutura estereotáxica e dissecar os músculos. Essa estrutura anatômica, semelhante a um triângulo invertido e destacada em amarelo, está situada abaixo da base do crânio (Figura 1). Para garantir a precisão e evitar qualquer dano ao tecido cerebral, 1-2 mm do bisel da seringa Hamilton foram inseridos suavemente na Cisterna magna.
Discussão
Este artigo demonstra um protocolo aprimorado para dilatação cerebrovascular, fornecendo uma abordagem precisa e direta para injeção de elastase na Cisterna magna de camundongos. Este ponto anatômico serve como uma porta de entrada direta para o líquido cefalorraquidiano, oferecendo um caminho valioso para a investigação de diferentes doenças neurológicas. Uma das principais vantagens desta técnica modificada é que a injeção de uma dose única de elastase na Cisterna magna de camundongos foi capaz de causar...
Divulgações
Não há conflito de interesses.
Agradecimentos
Este estudo foi possível graças às contribuições inestimáveis de Stephanie Tam, que forneceu suporte no auxílio nas cirurgias. Estendemos nossa sincera gratidão por sua ajuda. Os Institutos Nacionais de Saúde (AG066162) pelo apoio a esta pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
Referências
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados