需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种诱导小鼠脑裂症以模拟大血管介导的脑血管功能障碍的视觉方法
摘要
我们证明了化学诱导小鼠大血管扩张作为研究脑血管功能障碍的模型,可用于血管性痴呆和阿尔茨海默病建模。我们还演示了通过注射硅橡胶化合物来可视化脉管系统,并为测量血管大小的变化提供清晰的视觉指导。
摘要
血脑 (BBB) 是一个重要的系统,它调节与外围的选择性大脑循环,例如,允许必要的营养物质进入并从大脑中排出过多的氨基酸或毒素。 为了模拟 BBB 在血管性痴呆 (VaD) 或阿尔茨海默病 (AD) 等疾病中如何受损,研究人员开发了模拟血管扩张的新方法。在这些疾病状态下,受损的 BBB 可能是有害的,并导致 BBB 失调,从而导致影响大脑功能的不良和病理后果。我们能够修改一种现有技术,使我们能够直接注射到大脑池 (CM) 中,以使用弹性蛋白酶诱导血管扩张,并破坏 BBB 的紧密连接 (TJ)。使用这种方法,我们能够看到与以前技术相比的各种成功指标,包括一致的血管扩张、降低死亡率或提高恢复率,以及改进填充剂/遮光剂(一种硅橡胶化合物)用于标记血管以进行扩张分析的递送。这种改进的微创方法取得了可喜的结果,注射后 2 周至 3 个月小鼠大血管的持续扩张增加了 19%-32%。这种改善与以前的研究形成鲜明对比,以前的研究显示仅在 2 周标记时扩张增加。其他数据表明,即使在 9.5 个月后,该病仍持续扩张。通过比较弹性蛋白酶和载体注射组的血管直径来证实这种增加。总体而言,这项技术对于使用动物模型研究影响中枢神经系统 (CNS) 的病理疾病很有价值。
引言
排列在脑毛细血管上的微血管内皮细胞是形成血脑屏障 (BBB)1 的主要成分,该屏障在调节进出外周大脑循环的物质方面起着至关重要的作用。神经组织所需的必需营养素被允许进入 BBB,而一些必需氨基酸(如谷氨酸)被从大脑中排出,因为高浓度会对脑组织造成永久性的神经兴奋性损伤2。在正常生理条件下,BBB 限制了白蛋白 3,4 和凝血酶原等血浆蛋白的数量进入大脑,因为它们可能会产生有害影响 5,6,7。最后,BBB 保护大脑免受外周循环的神经毒素的侵害,例如食物或环境中的外源性物质1。总体而言,对脑组织的损伤是不可逆的,与低水平神经发生8 相关的衰老突出了 BBB 在保护和防止任何因素加速神经退行性过程方面的重要性。
在多脂扩张症(或大血管扩张)中,观察到血管弹性降低,这导致血管发生形态变化,从而使它们功能失调9 并导致大脑中的血流减少。这种血流量的减少随后减少了氧气和葡萄糖的供应,最终通过激活反应性星形胶质细胞触发对 BBB 的损伤10。当血管的内部弹性蛋白层因多脂扩张症11 而受损时,血管内皮生长因子 (VEGF) 的重复刺激对于血管生成是必要的。这可能导致渗漏血管的形成,并最终导致病理性血管生成,其特征是发育有缺陷的血管12。在病理性血管生成过程中,当血管变得有缺陷时,似乎有一种代偿机制通过上调紧密连接蛋白来恢复血管完整性。然而,当血管的结构完整性丧失时,这个过程可能会无意中破坏 BBB13。这可能是通过进一步破坏 BBB 和促进淀粉样蛋白斑块的产生来实现的14。此外,外周渗漏可引起神经炎症15,从而导致神经元变性和随后的记忆丧失。
从结构上讲,BBB 提供的保护是通过紧密的连接,防止外源性物质从血液进入大脑。当允许某些物质进入大脑时,BBB 主要通过两个主要过程进行,即被动扩散或特定通道(如离子通道和转运蛋白)1。在 AD 中,研究表明,功能失调的血管系统在病情进展中起着重要作用12,13。β 淀粉样蛋白 (Aβ) 斑块的形成和神经退行性变可能是由 BBB12,13 的分解和脑血流紊乱16 引起的。在被诊断患有血管性痴呆和 AD 的老年人中可以看到脑血流量减少17,18。血脑屏障 (BBB) 的损伤以及脑血流 (CBF) 功能障碍会导致大脑中 Aβ 浓度的产生增加,并伴有外周循环异物的浸润19。
为了研究 AD 和血管性痴呆 (VaD) 等神经系统疾病的发病机制,开发了复制该疾病的模型。体外模型被广泛使用,但缺乏用于广泛疾病建模(如混合细胞群)的生物环境,因此需要体内模型的重要性。小鼠之所以被广泛使用,是因为它们在疾病中易于产生类似人类的特性(例如,病理学)的基因操作。随着迄今为止取得的进展,仍然需要改进的模型来模拟大血管扩张等疾病表型及其在 AD 中的作用。为此,我们看到了一个机会,并修改了一种技术,该技术涉及将弹性蛋白酶注射到小鼠的大脑池中20,21。弹性蛋白酶是一种酶,已被证明可以分解结缔组织22 和周围紧密连接23 中的弹性蛋白。选择大脑池作为注射点是因为它位于大脑中最大的血管威利斯环的正上方。通过将弹性蛋白酶注射到大脑池,我们可以通过打破紧密的连接并诱导血管扩张来损害 BBB 和血管(Willis 环)24,25。将这项技术与 AD 小鼠病理学模型的使用相结合,以更好地了解 AD 血管成分的发病机制,可以为这两种不同病理之间的复杂相互作用和影响提供有价值的见解。
以前的研究表明,患者同时表现出 AD 和 VaD 的病理特征,这种情况通常被称为混合性痴呆26,27。因此,了解这两种情况之间的相互关联机制可以为这些神经退行性疾病的进展和表现提供更全面的视角,增强我们对潜在机制和潜在治疗策略的理解。为此,我们展示了弹性蛋白酶在 AD 病理小鼠模型 (AppNL-F) 中用于识别血管变化的应用。
研究方案
本研究使用在生理水平上表达人淀粉样蛋白斑块的 AppNL-F小鼠 (3 个月大),尽管该系统可用于任何啮齿动物模型。所有动物程序均已获得 CAMH 动物护理委员会(协议 #843)的批准,并符合加拿大动物护理委员会指南的道德标准。小鼠在内部饲养并保持 12 小时的明暗循环, 随意 获取食物和水。
1. 大脑池 (CM) 注射程序
- 手术
- 将小鼠(APPNL-F,两性,3 个月)置于麻醉诱导室中 1 分钟。
注:用 5% 异氟醚和 1% 氧气混合冲洗腔室至少 1 分钟。 - 麻醉小鼠后,将动物从腔室中取出,将其放在新的手术单上,并通过将鼻锥放在鼻子上来保持麻醉(异氟醚,2.5%-3%)。
注意:通过捏住脚趾检查麻醉深度,以确保没有反射。 - 涂抹眼药膏以防止干燥。然后,皮下注射 0.1 mL 布比卡因(局部麻醉剂;1-2 mg/kg 0.125%,稀释比为 1:2)到切口部位和 Metacam(镇痛剂;5 mg/kg,稀释比为 1:10)。在进行手术前皮下注射 0.5 mL 生理盐水以保持动物水分,以补偿手术过程中任何潜在的失血。
- 为了获得清晰的切口部位,剃掉枕骨底部的颈部,用无菌 PBS 擦拭表面,然后将受试者转移到俯卧位的立体定位框架上。
注意:确保通过立体定位鼻锥维持麻醉。 - 将立体定位框架的鼻杆放在鼠标顶部,以提供稳定性并确保上牙固定。
- 将动物头部与身体成 120° 角放置,以抬高和扩张颈背,以露出感兴趣的手术区域。
- 用 3 倍优碘磨砂膏、3 倍 70% 乙醇和 1 倍优碘溶液和无菌 2 英寸 x 2 英寸纱布清洁手术部位。
- 用镊子轻轻折叠皮肤,然后用手术剪刀做一个小切口(1 厘米)。
注意:这应该露出颈背的中线。 - 小心地将手术刀沿中线划过肌肉。然后,使用镊子将肌肉向左和向右拉开,轻轻地将它们分开。
注意:这应该会显示位于颅底下方的大 Cisterna(倒三角形)(图 1)。
- 将小鼠(APPNL-F,两性,3 个月)置于麻醉诱导室中 1 分钟。
- 弹性蛋白酶的制备
注意:订购的弹性蛋白酶(粉末形式)包装包含 250 单位 (U)。每只动物注射的弹性蛋白酶量为 2.5 μL。2.5 μL 的弹性蛋白酶量应为 15 毫单位 mU。- 首先计算要注入的溶液的浓度。
浓度 = 质量/体积
= 15 mU/2.5 μL
= 6 mU/μL
因此,所需的浓度为 6 mU/μL。 - 弹性蛋白酶的数量为 250 U,该研究使用 milliUnits,因此将单位转换为 milliUnits,得到 250000 mU。
- 在质量为 250000 mU 且浓度为 6 mU/uL 后,计算出需要稀释弹性蛋白酶并保持 6 mU/uL 浓度的体积 (PBS)。
- 使用上述相同的公式,重新排列以求解体积:
体积 = 质量/浓度
= 250000 毫微升/ 6 毫微升
= 41666.67 微升 - 由于难以移液 41666.67 μL,只需将其除以 1000 换算成毫升,得到 41.66667 mL,得到 1x 溶液。
- 为了使溶液更浓缩,请将其增加 10 倍或 100 倍。
- 创建一个 10x 解决方案,因为它更易于使用(见下文)。
10 倍溶液 ---------- 4.166667 mL(浓缩)
- 将 250 U 放入 5 mL 等分管中,向等分管中加入 4.167 mL 无菌 PBS,制成 10x 储备液。
- 吸取 10 μL 储备液,放入 100 个等分管中,得到 1000 μL 的 4.167 mL 储备液。将试管储存在 -20 °C。
- 将剩余的储备液以每管 100 μL 的等分试样储存在等分管中,并储存在 -20 °C 的冰箱中。
注:溶液在 -20 °C 下可稳定保存长达 6 个月,且无显著活性损失。此外,重要的是要注意弹性蛋白酶的过度冷冻和解冻会降低稳定性。因此,为防止这种情况发生,可以在冷冻前将储备液分开,以便一次只需解冻一个样品进行注射。 - 解冻其中一根含有 10 μL 10x 溶液的等分管后,加入 90 μL 无菌 PBS 以获得 100 μL 1x 溶液。
- 如果解冻了含有 100 μL 10x 溶液的等分管,则只需添加 900 μL PBS 即可得到 1000 μL,即 1x 溶液。将任一溶液在 4 °C 下储存 1 周。
- 首先计算要注入的溶液的浓度。
- 注入 Cisterna magna
注意:在加载弹性蛋白酶之前,通过加载和吸出蒸馏水 5 次,然后用乙醇 5 倍,最后用蒸馏水 5 倍加载和吸出来 Hamilton 注射器。- 向 Hamilton 注射器中加入 2.5 μL 弹性蛋白酶(浓度为 15 mU),确保没有气泡。
- 慢慢地将注射器插入 Cisterna magna 的中心,斜面朝上。
注意:避免刺穿穿过大脑池的任何血管。 - 穿刺后,去除斜面。这将促进少量脑脊液 (CSF) 的释放。使用无菌棉签吸收多余的 CSF。
- 将斜面重新插入穿刺部位,在 1 分钟内缓慢将弹性蛋白酶或载体注入 Cisterna magna,并将针头留在原位 1 分钟以防止弹性蛋白酶泄漏。
- 去除斜面后,用不可吸收的手术缝合线(#4-0 带 3/8 英寸针)闭合切口部位,然后关闭麻醉剂。
- 将动物从立体定位框架中取出,并放在设置为 37 °C 的温暖加热垫上,直到受试者恢复。
注意:建议在手术后使用另一剂 Metacam,以帮助缓解术后恢复期间的疼痛。
2. 硅橡胶化合物注射和组织收获
- 用过量的 avertin (1 mL, 125-250 mg/kg) 麻醉动物。
注意:捏住脚趾以确保反射停止。 - 将动物放在尿布上,并用手术胶带固定所有肢体,胸腔朝上
- 用镊子和剪刀打开胸腔,露出心脏。
- 将 23 G 钝针插入心脏左心室,用输注肝素 (100 U/mL) 的 PBS 灌注 4 分钟,以使用微型灌注泵清理血管。
- 用含有 4% 多聚甲醛 (PFA)(在 PBS 中配制)的缓冲瓶更换缓冲瓶,然后再灌注 4 分钟。
- 通过在 50 mL 试管中混合 5 mL 化合物和 5 mL 稀释剂来制备硅橡胶化合物(黄色)溶液。使用前充分混合。
- 在 10 mL 注射器中加入 10 mL 硅橡胶混合物。将注射器连接到连接到 23 G 钝针的软管上,然后小心地手动将溶液注射到心脏中。
注意:由于硅橡胶化合物的高粘度,使用较大的桶式注射器很重要,否则压力太大而无法推动柱塞。 - 注射后取出小鼠的头部并在 4 °C 下储存过夜,让硅橡胶化合物在容器中固化。
- 第二天,轻轻去除小鼠的头骨(最好使用细镊子),提取大脑,并在室温 (RT) 下在 4% PFA 中孵育过夜。
- 在 PFA 中孵育 24 小时后,在 PBS 中洗涤大脑 3 次,置于 30% 蔗糖中,并在 4 °C 下储存。
3. 定量分析
- 要在整个大脑中捕获 Willis 环的高质量图像(图 3):
- 从蔗糖溶液中取出大脑。用纸巾彻底擦干大脑,以吸走表面水分。
- 将大脑放置在大脑切片器中。将脑切片机放在配备摄像头的光学显微镜下。
- 将显微镜聚焦到清晰、高分辨率的威利斯圆。
- 使用带有 10 厘米标尺参考的图像分析软件测量大约 1 厘米并记下像素数。根据此测量值设置 1 厘米刻度,然后水平测量基底动脉的厚度以找到其直径。
- 使用标准像素密度测量软件分析图像。使用图像分析软件测量(以厘米为单位)基底动脉的五个单独读数,并计算平均值以获得基底动脉直径的准确表示。
- 使用 2 因子方差分析 (ANOVA) 比较弹性蛋白酶组和对照组之间的平均直径变化。
- 使用以下公式计算直径变化的百分比 21:
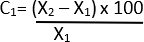
C = 相对变化
X1 = 初始值 (Vehicle)
X2 = 最终值(弹性蛋白酶)
考虑小于 0.05 的 P 值具有统计显著性。使用统计分析软件执行所有统计分析。
- 使用以下公式计算直径变化的百分比 21:
4. 使用酒精脱水去除硅橡胶化合物
注意:重要的是使大脑脱水以帮助从血管中去除多余的硅橡胶化合物,这可能会提高免疫染色的质量。
- 用 PBS 清洗大脑 3 次以去除蔗糖。
- 将大脑置于 25%、50%、75%、95% 和无水乙醇中以每种浓度放置 24 小时,总时间为 5 天。
- 组织脱水后,将组织置于水杨酸甲酯(浓度 ≤100%)中 12-24 小时。乙醇和水杨酸甲酯将允许去除组织中多余的硅胶。
- 用 PBS 3 次洗涤大脑以去除残留的化学物质,并在 4 °C 的摇床上用新鲜 PBS 放置过夜。
- 将大脑置于蔗糖中,并在切片和免疫染色前储存在 4 °C。
5. 免疫组化染色
- 大脑切片
- 在免疫切片之前,让大脑沉淀在充满蔗糖的试管底部。
- 使用冰包围的最佳切割温度 (OCT) 化合物在切片机上冷冻大脑。使用切片机刀片将大脑切成 40 μm 切片。
- 使用细尖画笔将每个切片转移到含有冷冻保护剂的 96 孔板中,以防止冻结。
- 用保鲜膜牢固密封 96 孔板。将密封板存放在-20°C冰箱中。
- 免疫荧光染色(以 NeuN 为例)
- 将切片置于 24 孔板中。用 PBS 进行 3 次洗涤以消除冷冻保护剂。
- 为防止非特异性结合,使用含有 2% 山羊血清、0.1% Triton-X 100 和 1% BSA 的封闭溶液在 RT 下孵育 1 小时。
- 在 PBS 中准备所有组件。
注:使用的一抗包括稀释度为 1:500 的单克隆小鼠抗 NeuN。使用的二抗包括 1:200 稀释度的多克隆山羊抗小鼠 568。 - 在上述封闭溶液中稀释单克隆小鼠抗 NeuN。
- 向每个孔中加入稀释的抗体。在 4 °C 下孵育过夜,用箔纸避光。
- 初次孵育后,用 PBS 洗涤切片 3 次。在相同的封闭溶液中稀释多克隆山羊抗小鼠 568。
- 向每个孔中加入稀释的抗体。在室温下孵育 2 小时,用箔纸避光。
- 二次孵育后用 PBS 洗涤切片 3 次。
- 使用细画笔将切片缓慢转移到载玻片上,为安装做准备。让所有部分干燥。
- 切片干燥后,涂抹 125-150 μL 抗褪色封片剂。轻轻放置盖玻片。
- 让载玻片在黑暗中在 RT 下干燥 24 小时,用指甲油密封边缘。使用成像软件捕获荧光图像。
结果
在小心地将鼠标放在立体定位框架上并解剖肌肉后,我们成功地在颅骨枕部区域下方找到了 Cisterna magna。这种解剖结构类似于一个倒三角形并以黄色突出显示,位于颅底下方(图 1)。为确保精度并防止对脑组织造成任何损伤,将 1-2 mm 的 Hamilton 注射器斜面轻轻插入 Cisterna magna。
弹性蛋白酶注射后,以三个不同的时间间隔用 PBS 和 4% PFA 灌注动物:2 周、...
讨论
本文展示了一种改进的脑血管扩张方案,为将弹性蛋白酶注射到小鼠的大脑池中提供了一种精确而直接的方法。这个解剖点是通往脑脊液的直接门户,为研究不同的神经系统疾病提供了宝贵的途径。这种改良技术的主要优点之一是,将单剂量的弹性蛋白酶注射到小鼠的大脑池中能够引起并维持大血管扩张至少 3 个月,而无需重复注射或植入套管。将弹性蛋白酶施用到 AD 小鼠模型中的方法是另一个...
披露声明
没有利益冲突。
致谢
这项研究得益于 Stephanie Tam 的宝贵贡献,她为协助手术提供了支持。我们对她的帮助表示衷心的感谢。美国国立卫生研究院 (AG066162) 支持这项研究。
材料
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
参考文献
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。