A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
גישה חזותית לגרימת דוליכואקטזיה בעכברים כדי למדל תפקוד לקוי של כלי דם גדולים בתיווך כלי דם במוח
In This Article
Summary
אנו מדגימים התרחבות כימית של כלי דם גדולים בעכברים כמודל לחקר תפקוד לקוי של כלי הדם במוח, אשר יכול לשמש עבור מודלים של דמנציה וסקולרית ואלצהיימר. אנו גם מדגימים הדמיה של כלי הדם על ידי הזרקת תרכובת גומי סיליקון ומתן הדרכה חזותית ברורה למדידת שינויים בגודל כלי הדם.
Abstract
הדם-מוח (BBB) היא מערכת חיונית המסדירה את זרימת המוח הסלקטיבית עם הפריפריה, כדוגמה, ומאפשרת לחומרים מזינים הדרושים להיכנס ולגרש חומצות אמינו מוגזמות או רעלים מהמוח. כדי להדגים כיצד BBB יכול להיפגע במחלות כמו דמנציה וסקולרית (VaD) או מחלת אלצהיימר (AD), חוקרים פיתחו שיטות חדשניות למדל הרחבת כלי דם. פגיעה ב-BBB במצבי מחלה אלה עלולה להיות מזיקה ולגרום לחוסר ויסות של BBB המוביל לתוצאות לא נעימות ופתולוגיות המשפיעות על תפקוד המוח. הצלחנו לשנות טכניקה קיימת שאפשרה לנו להזריק ישירות לתוך Cisterna magna (CM) כדי לגרום להרחבת כלי הדם באמצעות אלסטאז, ולשבש את הצמתים הצפופים (TJ) של BBB. בשיטה זו, הצלחנו לראות מדדים שונים של הצלחה על פני טכניקות קודמות, כולל הרחבת כלי דם עקבית, תמותה מופחתת או התאוששות משופרת, ושיפור חומר המילוי/אופציפיקציה, תרכובת גומי סיליקון, משלוח לתיוג כלי דם לניתוח הרחבה. שיטה זעיר פולשנית זו הניבה תוצאות מבטיחות, עם עלייה של 19%-32% בהתרחבות מתמשכת של כלי דם גדולים בעכברים בין שבועיים לשלושה חודשים לאחר ההזרקה. שיפור זה עומד בניגוד למחקרים קודמים, שהראו התרחבות מוגברת רק לאחר שבועיים. נתונים נוספים מצביעים על התרחבות מתמשכת גם לאחר 9.5 חודשים. עלייה זו אושרה על ידי השוואת קוטר כלי הדם של האלסטאז וקבוצת הרכב המוזרק. בסך הכל, טכניקה זו היא בעלת ערך לחקר הפרעות פתולוגיות המשפיעות על מערכת העצבים המרכזית (CNS) באמצעות מודלים של בעלי חיים.
Introduction
תאי אנדותל מיקרו-וסקולריים המרפדים את נימי המוח הם המרכיבים העיקריים ליצירת מחסום הדם-מוח (BBB)1, אשר ממלא תפקיד מכריע בוויסות מה שנכנס או יוצא ממחזור הדם במוח עם הפריפריה. חומרים מזינים חיוניים הדרושים לרקמת העצבים מורשים להיכנס ל- BBB, בעוד שכמה חומצות אמינו חיוניות כמו גלוטמט מגורשות מהמוח, שכן ריכוזים גבוהים עלולים לגרום נזק עצבי מעורר קבוע לרקמת המוח2. בתנאים פיזיולוגיים רגילים, BBB מגביל את כמות חלבוני הפלזמה כמו אלבומין 3,4 ופרותרומבין מלהיכנס למוח, שכן אלה יכולים להיות בעלי השפעות מזיקות 5,6,7. לבסוף, BBB מגן על המוח מפני נוירוטוקסינים המסתובבים בפריפריה, כגון קסנוביוטיקה ממזון או מהסביבה1. באופן כללי, נזק לרקמות המוח הוא בלתי הפיך, והזדקנות המתואמת עם רמות נמוכות של נוירוגנזה8 מדגישה את החשיבות של BBB בהגנה ומניעה של גורמים כלשהם מאיץ את התהליך הנוירודגנרטיבי.
ב dolichoectasia (או הרחבת כלי דם גדולים) נצפתה ירידה בגמישות כלי הדם, אשר גורמת לכלי הדם לעבור שינויים מורפולוגיים, ובכך להפוך אותם לבלתי מתפקדים9 ולהוביל לזרימת דם מופחתת במוח. הפחתה זו בזרימת הדם מפחיתה לאחר מכן את אספקת החמצן והגלוקוז, ובסופו של דבר גורמת נזק ל-BBB באמצעות הפעלת אסטרוציטים תגובתיים10. כאשר למינה אלסטין פנימית של כלי ניזוק מ dolichoectasia11, גירוי חוזר של גורם הצמיחה אנדותל כלי הדם (VEGF) הוא הכרחי עבור אנגיוגנזה. זה יכול להוביל להיווצרות של כלי דולף ובסופו של דבר לגרום אנגיוגנזה פתולוגית, המאופיינת על ידי התפתחות של כלי פגום12. במהלך אנגיוגנזה פתולוגית, כאשר כלי הדם פגומים, נראה כי מנגנון פיצוי מחזיר את שלמות כלי הדם על ידי ויסות חלבוני צומת הדוק. עם זאת, תהליך זה יכול לשבש בשוגג את BBB כאשר שלמות מבנית של כלי דם אובדת13. זה עלול להתרחש באמצעות שיבוש נוסף של BBB וקידום הייצור של רובד עמילואיד14. בנוסף, דליפה מהפריפריה עלולה לגרום לדלקת עצבית15, מה שגורם לניוון עצבי ולאובדן זיכרון לאחר מכן.
מבחינה מבנית, ההגנה שה-BBB מספק היא דרך הצמתים הצפופים שמונעים מחומרים קסנוביוטיים להיכנס למוח. כאשר מאפשרים לחומרים מסוימים להיכנס למוח, ה-BBB עושה זאת בעיקר באמצעות שני תהליכים עיקריים, דיפוזיה פסיבית, או ערוצים ספציפיים (כמו תעלות יונים וטרנספורטרים)1. באלצהיימר, מחקרים הוכיחו כי מערכת כלי דם לא מתפקדת ממלאת תפקיד משמעותי בהתקדמות המצב12,13. היווצרות של רבדים עמילואיד-בטא (Aβ) וניוון עצבי יכולים לנבוע מפירוק BBB12,13 והפרעות בזרימת הדם במוח16. ירידה בזרימת הדם המוחית ניתן לראות אצל קשישים שאובחנו עם דמנציה וסקולרית ואלצהיימר17,18. נזק למחסום הדם-מוח (BBB) יחד עם זרימת דם מוחית לא מתפקדת (CBF) יכולים לתרום לייצור מוגבר של ריכוז Aβ במוח, מלווה בחדירה של חומרים זרים ממחזור הדם ההיקפי19.
כדי לחקור את הפתוגנזה של מחלות נוירולוגיות כמו אלצהיימר ודמנציה וסקולרית (VaD), מפתחים מודלים כדי לשכפל את המחלה. מודלים במבחנה נמצאים בשימוש נרחב אך חסרים את הסביבה הביולוגית למודלים נרחבים של מחלות כמו אוכלוסיית תאים מעורבת, ולכן מחייבים את החשיבות של מודלים in vivo. עכברים משמשים בדרך כלל בשל קלות המניפולציה הגנטית שלהם ביצירת תכונות דמויות אדם (למשל, פתולוגיה) במחלות. עם ההתקדמות שנעשתה עד כה, עדיין יש צורך מתמשך במודלים משופרים כדי לחקות פנוטיפים של מחלות כמו הרחבת כלי דם גדולים ותפקידם באלצהיימר. לשם כך, זיהינו הזדמנות ושינינו טכניקה שכללה הזרקת אלסטאז לתוך Cisterna magna של עכברים20,21. אלסטאז הוא אנזים שהוכח כמפרק אלסטין ברקמת חיבור22 ובצמתים הדוקים23. ה- Cisterna magna נבחר כנקודת ההזרקה בשל מיקומו ישירות מעל המעגל של וויליס, כלי הדם הגדול ביותר במוח. על ידי הזרקת אלסטאז לתוך מגננת ציסטרנה אנו יכולים לסכן את BBB וכלי הדם על ידי פירוק הצמתים הצפופים וגרימת התרחבות של כלי הדם (מעגל וויליס)24,25. שילוב טכניקה זו עם שימוש במודל עכבר אלצהיימר של פתולוגיה, לשיפור ההבנה של הפתוגנזה עבור מרכיב כלי הדם של אלצהיימר, יכול לספק תובנות חשובות לגבי האינטראקציות וההשפעות המורכבות בין שתי פתולוגיות נפרדות אלה.
מחקרים קודמים הדגימו מקרים שבהם חולים מציגים הן את המאפיינים הפתולוגיים של אלצהיימר והן של VaD, מצב המכונה בדרך כלל דמנציה מעורבת26,27. לפיכך, הבנת המנגנונים הקשורים זה בזה בין שני התנאים יכולה להציע נקודת מבט מקיפה יותר על ההתקדמות והביטוי של הפרעות נוירודגנרטיביות אלה, משפרת את הבנתנו את המנגנונים הבסיסיים ואת האסטרטגיות הטיפוליות הפוטנציאליות. לשם כך, אנו מדגימים את היישום של אלסטאז במודל עכבר פתולוגיה של אלצהיימר (AppNL-F) לזיהוי שינויים בכלי הדם.
Protocol
עכבריNL-F(בני 3 חודשים) המבטאים רובד עמילואיד אנושי ברמה פיזיולוגית שימשו למחקר זה, אם כי ניתן להשתמש במערכת זו עם כל מודל מכרסמים. כל הנהלים בבעלי חיים אושרו על ידי הוועדה לטיפול בבעלי חיים של CAMH (פרוטוקול #843) והיו בהתאם לסטנדרטים האתיים של המועצה הקנדית לטיפול בבעלי חיים. עכברים גודלו בבית והוחזקו במחזור אור-חושך של 12 שעות עם גישה ל-ad libitum לצ'או ולמים.
1. הליך הזרקת Cisterna magna (CM)
- הליך כירורגי
- הניחו את העכבר (APPNL-F, שני המינים, 3 חודשים) בתא זירוז הרדמה למשך דקה אחת.
הערה: יש לשטוף את התא עם 5% איזופלורן מעורבב עם 1% חמצן למשך דקה אחת לפחות. - לאחר שהעכבר מורדם, הוציאו את בעל החיים מהחדר והניחו אותו על וילון כירורגי טרי ושמרו על הרדמה (איזופלורן, 2.5%-3%) על ידי הנחת חרוט אף מעל האף.
הערה: בדוק את עומק ההרדמה על ידי צביטת הבוהן כדי לוודא שאין רפלקסים. - יש למרוח משחה אופתלמית למניעת יובש. לאחר מכן, להזריק תת עורית 0.1 מ"ל של bupivacaine (הרדמה מקומית; 1-2 מ"ג / ק"ג 0.125%, עם יחס דילול של 1: 2) לאתר החתך Metacam (משכך כאבים; 5 מ"ג / ק"ג, עם יחס דילול של 1:10). שמור על בעל החיים hydrated על ידי הזרקת 0.5 מ"ל של מלוחים תת עורית לפני ביצוע ההליך כדי לפצות על כל אובדן דם פוטנציאלי במהלך הניתוח.
- לקבלת אתר חתך ברור, לגלח את הצוואר בבסיס העצם העורפית, לנגב את פני השטח עם PBS סטרילי ולהעביר את הנושא למסגרת סטריאוטקסית במצב נוטה.
הערה: ודא שההרדמה נשמרת דרך חרוט האף הסטריאוטקסי. - הנח את מוט האף מהמסגרת הסטריאוטקסית על גבי העכבר כדי לספק יציבות ולוודא שהשיניים העליונות מהודקות.
- מקם את ראש החיה בזווית של 120° מהגוף כדי להרים ולהרחיק את העורף כדי לחשוף את אזור העניין הניתוחי.
- נקו את אתר הניתוח עם Betadine scrub 3x, 70% אתנול 3x ותמיסת בטאדין 1x עם גזה סטרילית בגודל 2 אינץ' x 2 אינץ'.
- קפלו את העור בעדינות בעזרת פינצטה ובצעו חתך קטן (1 ס"מ) באמצעות מספריים כירורגיים.
הערה: זה אמור לחשוף את קו האמצע של העורף. - בזהירות לרוץ את אזמל לאורך קו האמצע לחתוך דרך השרירים. לאחר מכן, באמצעות פינצטה להפריד בעדינות את השרירים על ידי משיכת אותם בנפרד שמאלה וימינה.
הערה: זה אמור לחשוף את ה-Cisterna magna (משולש הפוך) שנמצא מתחת לבסיס הגולגולת (איור 1).
- הניחו את העכבר (APPNL-F, שני המינים, 3 חודשים) בתא זירוז הרדמה למשך דקה אחת.
- הכנת אלסטאז
הערה: חבילת האלסטאז (צורת אבקה) שהוזמנה הכילה 250 יחידות (U). כמות האלסטאז שיש להזריק לכל חיה היא 2.5 μL. כמות האלסטאז שאמורה להיות ב 2.5 μL צריכה להיות 15 מילייחידות mU.- ראשית לחשב את ריכוז הפתרון להיות מוזרק.
ריכוז = מסה/נפח
= 15 mU/2.5 μL
= 6 mU/μL
לכן, הריכוז הנדרש הוא 6 mU / μL. - כמות האלסטאז היא 250 U והמחקר עובד עם milliUnits, אז המירו את היחידות למילי-יחידות שנותנות 250000 mU.
- לאחר מסה של 250000 mU וריכוז של 6 mU / uL, להבין את נפח (PBS) שידרוש דילול האלסטאז ושמירה על ריכוז של 6 mU / uL.
- באמצעות אותה נוסחה לעיל, סדר מחדש כדי לפתור עבור אמצעי אחסון:
נפח = מסה/Conc.
= 250000 mU / 6 mU / μL
= 41666.67 μL - מאז קשה פיפטה 41666.67 μL, פשוט להמיר אותו מיליליטר על ידי חלוקת אותו על ידי 1000 כדי לקבל 41.66667 מ"ל כדי לקבל פתרון 1x.
- כדי להפוך את הפתרון מרוכז יותר,להגדיל אותו על ידי 10x או 100x.
- צור פתרון 10x מכיוון שפשוט יותר לעבוד איתו (ראה להלן).
תמיסה 10x ---------- 4.166667 מ"ל (conc.)
- מקם את 250 U בצינור aliquot 5 מ"ל והוסף 4.167 מ"ל של PBS סטרילי לתוך צינור aliquot כדי ליצור את פתרון מלאי 10x.
- פיפטה 10 μL של תמיסת מלאי ומניחים ב 100 צינורות aliquot נותן 1000 μL של תמיסת מלאי 4.167 מ"ל. אחסנו את הצינורות בטמפרטורה של -20°C.
- אחסנו את שארית תמיסת המלאי בצינורות aliquot ב-100 μL לצינור ואחסנו במקפיא ב-20°C-.
הערה: התמיסות יציבות בטמפרטורה של -20°C למשך עד 6 חודשים ללא אובדן פעילות משמעותי. בנוסף, חשוב לציין כי הקפאה מוגזמת והפשרה של האלסטאז עלולה להפחית את היציבות. לכן, כדי למנוע זאת, ניתן לחלק את תמיסת המלאי לפני ההקפאה כך שיהיה צורך להפשיר רק דגימה אחת בכל פעם להזרקה. - לאחר הפשרת אחד מצינורות aliquot המכיל 10 μL של תמיסה 10x, להוסיף 90 μL של PBS סטרילי כדי לקבל 100 μL 1x פתרון.
- אם צינור aliquot המכיל 100 μL של תמיסה 10x הופשר במקום, פשוט להוסיף 900 μL של PBS כדי לקבל 1000 μL, שהוא פתרון 1x. אחסנו כל תמיסה בטמפרטורה של 4°C למשך שבוע אחד.
- ראשית לחשב את ריכוז הפתרון להיות מוזרק.
- הזרקה לתוך Cisterna magna
הערה: נקו את מזרק המילטון לפני העמסתו באלסטאז על ידי העמסה ושאיפה במים מזוקקים 5x, לאחר מכן אתנול 5x, ולבסוף מים מזוקקים 5x.- העמיסו על מזרק המילטון 2.5 מיקרוליטר אלסטאז (ריכוז של 15 mU) וודאו שאין בועות אוויר.
- הכניסו באיטיות את המזרק כשהשיפוע פונה כלפי מעלה למרכז המגנה של צ'יסטרנה.
הערה: יש להימנע מניקוב כלי דם העוברים על פני מגננת צ'יסטרנה. - לאחר הנקב, הסר את השיקוע. זה יקל על שחרור של כמות קטנה של נוזל השדרה (CSF). השתמש בצמר גפן סטרילי כדי לספוג את עודף CSF.
- הכנס מחדש את השיקוע לאתר הנקב, הזריק לאט אלסטאז או רכב במשך דקה לתוך המגנה Cisterna והשאר את המחט במקומה למשך דקה אחת כדי למנוע דליפה של אלסטאז.
- לאחר הסרת השיפוע, סגור את אתר החתך עם תפר כירורגי שאינו נספג (#4-0 עם מחט "3/8), וכבה את חומר ההרדמה.
- הסר את החיה מהמסגרת הסטריאוטקסית והניחו על כרית חום חמה המוגדרת על 37 מעלות צלזיוס עד שהנבדק מתאושש.
הערה: מינון נוסף של Metacam מומלץ לאחר הניתוח כדי לעזור עם כאב במהלך התאוששות לאחר הניתוח.
2. הזרקת תרכובת גומי סיליקון וקציר רקמות
- להרדים את החיה עם מנת יתר של avertin (1 מ"ל, 125-250 מ"ג / ק"ג).
הערה: צבוט את הבוהן כדי להבטיח שהרפלקסים ייפסקו. - הניחו את בעל החיים על חיתול ואבטחו את כל הגפיים בעזרת סרט כירורגי כאשר חלל החזה פונה כלפי מעלה
- פתח את חלל החזה באמצעות פינצטה ומספריים כדי לחשוף את הלב.
- יש להחדיר מחט קהה במשקל 23 גרם לחדר השמאלי של הלב ולנקב עם PBS עם הפרין (100 U/mL) למשך 4 דקות כדי לנקות את כלי הדם באמצעות משאבת מיקרו-זילוח.
- החליפו את בקבוק החיץ בבקבוק המכיל 4% פרפורמלדהיד (PFA) (מורכב מ-PBS) ובצעו מחורר למשך 4 דקות נוספות.
- הכינו את תמיסת תרכובת גומי הסיליקון (צהוב) על ידי שילוב של 5 מ"ל תרכובת עם 5 מ"ל של המדלל בצינור 50 מ"ל. יש לערבב היטב לפני השימוש.
- ממלאים מזרק 10 מ"ל עם 10 מ"ל של סיליקון גומי compo und. חברו את המזרק לצינור המחובר למחט קהה 23 גרם, והזריקו בזהירות את התמיסה ידנית ללב.
הערה: בשל הצמיגות הגבוהה של תרכובת גומי הסיליקון, חשוב להשתמש במזרק חבית גדול יותר או שהלחץ יהיה גדול מכדי לדחוף את הבוכנה. - הסירו את ראש העכבר לאחר ההזרקה ואחסנו בטמפרטורה של 4°C למשך הלילה, מה שמאפשר לתרכובת גומי הסיליקון להירפא בכלי הדם.
- למחרת, הסירו בעדינות את גולגולת העכבר (רצוי באמצעות פינצטה עדינה), חלצו את המוח ודגרו ב-4% PFA למשך הלילה בטמפרטורת החדר (RT).
- לאחר דגירה של 24 שעות ב-PFA, שטפו את המוח ב-PBS 3x, הכניסו 30% סוכרוז ואחסנו בטמפרטורה של 4°C.
3. ניתוח כמותי
- כדי לצלם תמונות באיכות גבוהה של מעגל וויליס במוח כולו (איור 3):
- הסר את המוח מתמיסת הסוכרוז. יבשו היטב את המוח באמצעות מגבת נייר כדי לנדף את לחות פני השטח.
- מקמו את המוח בכלי פריסה במוח. הניחו את כלי הפריסה במוח מתחת למיקרוסקופ אור המצויד במצלמה.
- מקדו את המיקרוסקופ לרזולוציה ברורה ברזולוציה גבוהה של מעגל וויליס.
- השתמש בתוכנה לניתוח תמונות עם הפניה לסרגל של 10 ס"מ כדי למדוד כ- 1 ס"מ ולשים לב לספירת הפיקסלים. הגדר את קנה המידה של 1 ס"מ בהתבסס על מדידה זו, ולאחר מכן מדוד את עובי העורק הבזילרי אופקית כדי למצוא את קוטרו.
- השתמש בתוכנה סטנדרטית לצפיפות פיקסלים כדי לנתח את התמונה. למדוד (בסנטימטרים) חמש קריאות נפרדות של העורק הבזילרי באמצעות תוכנת ניתוח תמונה ולחשב את הממוצע כדי לקבל ייצוג מדויק של קוטר העורק הבזילרי.
- השתמש בניתוח דו-כיווני של שונות (ANOVA) כדי להשוות את השינוי הממוצע בקוטר בין האלסטאז לקבוצת הביקורת.
- חשב את אחוז השינוי בקוטר באמצעות הנוסחה שלהלן 21:
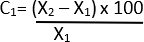
C = שינוי יחסי
X1 = ערך התחלתי (רכב)
X2 = ערך סופי (Elastase)
שקול ערכי P פחות מ- 0.05 מובהקים סטטיסטית. בצע את כל הניתוחים הסטטיסטיים באמצעות תוכנת ניתוח סטטיסטי.
- חשב את אחוז השינוי בקוטר באמצעות הנוסחה שלהלן 21:
4. הסרת תרכובת גומי סיליקון באמצעות התייבשות אלכוהול
הערה: חשוב לייבש את המוח כדי לעזור להסיר את תרכובת גומי הסיליקון העודפת מכלי הדם, מה שעשוי לשפר את איכות הכתמים החיסוניים.
- שטפו את המוח 3x עם PBS כדי להסיר את הסוכרוז.
- הכניסו את המוח ל-25%, 50%, 75%, 95% ואתנול מוחלט למשך 24 שעות בכל ריכוז, למשך זמן כולל של 5 ימים.
- לאחר התייבשות הרקמה, מניחים את הרקמה במתיל סליצילאט (conc. ≤100%) למשך 12-24 שעות. אתנול ומתיל סליצילאט יאפשרו הסרת עודפי סיליקון ברקמה.
- שטפו את המוח ב-PBS 3x כדי להסיר שאריות כימיקלים והשאירו למשך הלילה על נדנדה בטמפרטורה של 4°C ב-PBS טרי.
- הכניסו את המוח לסוכרוז ואחסנו בטמפרטורה של 4°C לפני החתך והחיסון.
5. צביעה אימונוהיסטוכימית
- חתך מוחות
- לפני immunosectioning, לאפשר למוח להתיישב בתחתית הצינור מלא סוכרוז.
- הקפיאו את המוח על פלטפורמת המיקרוטום באמצעות תרכובת טמפרטורת חיתוך אופטימלית (OCT) המוקפת בקרח יבש. חתכו את המוח למקטעים של 40 מיקרומטר באמצעות להב המיקרוטום.
- העבירו כל חלק לצלחת בת 96 בארות המכילה חומר מגן קריופרוטקטיבי למניעת קיפאון בעזרת מברשת צבע עדינה.
- אטמו היטב את הצלחת בעלת 96 הבארות בניילון נצמד. אחסנו את הצלחת האטומה במקפיא בטמפרטורה של -20°C.
- צביעת Immunofluorescence (באמצעות NeuN כדוגמה)
- מניחים את החלקים בצלחת של 24 בארות. בצע שלוש שטיפות עם PBS כדי לחסל את cryoprotectant.
- כדי למנוע קשירה לא ספציפית, יש לדגור במשך שעה אחת ב-RT באמצעות תמיסת חסימה המכילה 2% סרום עיזים, 0.1% Triton-X 100 ו-1% BSA.
- הכן את כל הרכיבים ב- PBS.
הערה: הנוגדן העיקרי ששימש כלל עכבר חד שבטי anti-NeuN עם דילול 1: 500. הנוגדן המשני בו נעשה שימוש כלל עז רב-שבטית נגד עכבר 568 עם דילול של 1:200. - לדלל את העכבר חד שבטי anti-NeuN בתמיסת החסימה שהוזכרה לעיל.
- מוסיפים את הנוגדן המדולל לכל באר. יש לדגור למשך הלילה בטמפרטורה של 4°C, מוגן מפני אור על ידי נייר כסף.
- לאחר הדגירה הראשונית, שטפו את המקטעים 3x עם PBS. לדלל את העז הרב-שבטית נגד עכבר 568 באותה תמיסת חסימה.
- מוסיפים את הנוגדן המדולל לכל באר. יש לדגור במשך שעתיים בטמפרטורת החדר, מוגן מפני אור בנייר כסף.
- שטפו את המקטעים 3x עם PBS לאחר הדגירה המשנית.
- התכוננו להרכבה על ידי העברה איטית של מקטעים לשקופיות באמצעות מברשות צבע עדינות. הניחו לכל החלקים להתייבש.
- יש למרוח 125-150 μL של אמצעי הרכבה נגד דהייה לאחר ייבוש המקטעים. הניחו בעדינות את הכיסויים.
- אפשר לשקופיות להתייבש במשך 24 שעות ב-RT בחושך, ואטם את הקצוות עם לק. צלם תמונות פלורסנט באמצעות תוכנת הדמיה.
תוצאות
הצלחנו לאתר את ה- Cisterna magna מתחת לאזור העורפי של הגולגולת לאחר מיקמנו בזהירות את העכבר על המסגרת הסטריאוטקסית וניתחנו את השרירים. המבנה האנטומי הזה, שדומה למשולש הפוך ומודגש בצהוב, ממוקם מתחת לבסיס הגולגולת (איור 1). כדי להבטיח דיוק ולמנוע נזק לרקמת המוח, 1-2 מ"מ של שיפוע מזרק המ...
Discussion
מאמר זה מדגים פרוטוקול משופר להרחבת כלי הדם במוח, ומספק גישה מדויקת ופשוטה להזרקת אלסטאז לתוך Cisterna magna של עכברים. נקודה אנטומית זו משמשת שער ישיר לנוזל השדרה, ומציעה אפיק רב ערך לחקר מחלות נוירולוגיות שונות. אחד היתרונות העיקריים של טכניקה שונה זו הוא כי הזרקת מנה אחת של אלסטאז לתוך Cisterna magna...
Disclosures
אין ניגוד עניינים.
Acknowledgements
מחקר זה התאפשר הודות לתרומות שלא יסולא בפז של סטפני טאם שסיפקה תמיכה בסיוע בניתוחים. אנו מודים לה מקרב לב על עזרתה. המכונים הלאומיים לבריאות (AG066162) לתמיכה במחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
References
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved