Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Büyük Damar Aracılı Serebrovasküler Disfonksiyonu Modellemek için Farelerde Dolichoectaziyi İndüklemek İçin Görsel Bir Yaklaşım
Bu Makalede
Özet
Vasküler demans ve Alzheimer hastalığı modellemesi için kullanılabilecek serebrovasküler disfonksiyonu araştırmak için bir model olarak farelerde kimyasal olarak indüklenen büyük kan damarı dilatasyonunu gösteriyoruz. Ayrıca, silikon kauçuk bileşiği enjekte ederek ve kan damarı boyutundaki değişiklikleri ölçmek için net bir görsel rehberlik sağlayarak damar sistemini görselleştirmeyi de gösteriyoruz.
Özet
Kan-beyin (BBB), örneğin çevre ile seçici beyin dolaşımını düzenleyen, gerekli besinlerin beyinden aşırı amino asitlere veya toksinlere girmesine ve dışarı atılmasına izin veren çok önemli bir sistemdir. Vasküler demans (VaD) veya Alzheimer hastalığı (AD) gibi hastalıklarda BBB'nin nasıl tehlikeye atılabileceğini modellemek için araştırmacılar, damar dilatasyonunu modellemek için yeni yöntemler geliştirdiler. Bu hastalık durumlarında tehlikeye atılmış bir BBB zararlı olabilir ve BBB'nin düzensizliğine neden olabilir ve bu da beyin fonksiyonunu etkileyen istenmeyen ve patolojik sonuçlara yol açabilir. Elastaz kullanarak kan damarlarının dilatasyonunu indüklemek ve BBB'nin sıkı bağlantılarını (TJ) bozmak için doğrudan Cisterna magna'ya (CM) enjekte etmemizi sağlayan mevcut bir tekniği değiştirebildik. Bu yöntemle, tutarlı kan damarı dilatasyonu, azaltılmış mortalite veya daha iyi iyileşme ve bir silikon kauçuk bileşiği olan dolgu / opaklaştırıcı ajanın iyileştirilmesi, dilatasyon analizi için kan damarlarını etiketlemek için teslimat dahil olmak üzere önceki tekniklere göre çeşitli başarı ölçütleri görebildik. Bu modifiye minimal invaziv yöntem, farelerde enjeksiyondan 2 hafta ila 3 ay sonra büyük kan damarlarının sürekli genişlemesinde %19-32'lik bir artışla umut verici sonuçlar vermiştir. Bu iyileşme, yalnızca 2 haftalık işarette artan dilatasyon gösteren önceki çalışmalarla çelişmektedir. Ek veriler, 9,5 ay sonra bile genişlemenin devam ettiğini gösteriyor. Bu artış, elastaz ve araç enjekte edilen grubun kan damarlarının çapı karşılaştırılarak doğrulandı. Genel olarak, bu teknik, hayvan modelleri kullanarak merkezi sinir sistemini (CNS) etkileyen patolojik bozuklukları incelemek için değerlidir.
Giriş
Serebral kılcal damarları kaplayan mikrovasküler endotel hücreleri, beyin dolaşımına çevre ile neyin girdiğini veya neyin çıktığını düzenlemede çok önemli bir rol oynayan kan-beyin bariyerini (BBB)1 oluşturmak için ana bileşenlerdir. Sinir dokusu için gerekli olan temel besin maddelerinin BBB'ye girmesine izin verilirken, glutamat gibi bazı esansiyel amino asitler beyinden atılır, çünkü yüksek konsantrasyonlar beyin dokusunda kalıcı nörouyarıcı hasara neden olabilir2. Normal fizyolojik koşullar altında, BBB, albümin 3,4 ve protrombin gibi plazma proteinlerinin beyne girmesini sınırlar, çünkü bunlar zararlı etkilere sahip olabilir 5,6,7. Son olarak, BBB beyni, gıda veya çevreden gelen ksenobiyotikler gibi periferde dolaşan nörotoksinlerden korur1. Genel olarak, beyin dokularına verilen hasar geri döndürülemez ve düşük nörojenezseviyeleri 8 ile ilişkili yaşlanma, BBB'nin nörodejeneratif süreci hızlandıran herhangi bir faktörün korunmasında ve önlenmesinde önemini vurgulamaktadır.
Dolichoectasia'da (veya büyük kan damarı dilatasyonunda), damar elastikiyetinde bir azalma gözlenir, bu da damarların morfolojik değişikliklere uğramasına neden olur, böylece onları işlevsiz hale getirir9 ve beyindeki kan akışının azalmasına neden olur. Kan akışındaki bu azalma daha sonra oksijen ve glikoz kaynağını azaltır ve sonuçta reaktif astrositlerin10 aktivasyonu yoluyla BBB'ye zarar verir. Damarların iç elastin laminası dolikoektazi11'den hasar gördüğünde, anjiyogenez için vasküler endotelyal büyüme faktörünün (VEGF) tekrar tekrar uyarılması gereklidir. Bu, sızdıran damarların oluşumuna yol açabilir ve sonuçta kusurlu damarların gelişimi ile karakterize edilen patolojik anjiyogenez ile sonuçlanabilir12. Patolojik anjiyogenez sırasında, kan damarları kusurlu hale geldiğinde, sıkı bağlantı proteinlerini yukarı regüle ederek damar bütünlüğünü yeniden sağlamak için telafi edici bir mekanizma ortaya çıkar. Bununla birlikte, bu işlem, bir kan damarının yapısal bütünlüğü kaybolduğunda yanlışlıkla BBB'yi bozabilir13. Bu, BBB'yi daha da bozarak ve amiloid plak14 üretimini teşvik ederek ortaya çıkabilir. Ek olarak, çevreden sızıntı nöroinflamasyona15 neden olabilir, bu da nöronal dejenerasyon ve ardından hafıza kaybı ile sonuçlanır.
Yapısal olarak BBB'nin sağladığı koruma, ksenobiyotik ajanların kandan beyne girmesini önleyen sıkı bağlantılardan geçer. Belirli maddelerin beyne girmesine izin verirken, BBB bunu esas olarak iki ana süreç, pasif difüzyon veya belirli kanallar (iyon kanalları ve taşıyıcılar gibi) yoluyla yapar1. AD'de araştırmalar, işlevsiz bir vasküler sistemin durumun ilerlemesinde önemli bir rol oynadığını göstermiştir12,13. Amiloid-beta (Aβ) plaklarının oluşumu ve nörodejenerasyon, BBB'nin12,13 parçalanmasından ve serebral kan akışındaki16 bozukluklardan kaynaklanabilir. Vasküler demans tanısı alan ve AD17,18 tanısı alan yaşlı bireylerde serebral kan akımında azalma görülebilir. Disfonksiyonel bir serebral kan akışı (CBF) ile birlikte kan-beyin bariyerinin (BBB) hasar görmesi, periferik dolaşımdan yabancı maddelerin sızması ile birlikte beyinde Aβ konsantrasyonunun artmasına katkıda bulunabilir19.
AH ve vasküler demans (VaD) gibi nörolojik hastalıkların patogenezini araştırmak için, hastalığı tekrarlamak için modeller geliştirilmiştir. İn vitro modeller yaygın olarak kullanılmaktadır, ancak karışık hücre popülasyonu gibi kapsamlı hastalık modellemesi için biyolojik ortamdan yoksundur, bu nedenle in vivo modellerin önemini gerektirir. Fareler, hastalıkta insan benzeri özellikler (örneğin patoloji) oluşturmada genetik manipülasyon kolaylığı nedeniyle yaygın olarak kullanılmaktadır. Şimdiye kadar kaydedilen ilerlemeyle birlikte, büyük damar dilatasyonu ve bunların AH'deki rolü gibi hastalık fenotiplerini taklit etmek için geliştirilmiş modellere hala ihtiyaç duyulmaktadır. Bu amaçla, bir fırsat gördük ve farelerin Cisterna magna'sına elastaz enjeksiyonunu içeren bir tekniği değiştirdik20,21. Elastaz, bağ dokusunda22 ve çevredeki sıkı bağlantılarda23 elastini parçaladığı gösterilen bir enzimdir. Cisterna magna, beyindeki en büyük kan damarı olan Willis çemberinin hemen üzerinde yer alması nedeniyle enjeksiyon noktası olarak seçildi. Cisterna magna'ya elastaz enjekte ederek, sıkı bağlantıları parçalayarak ve kan damarlarının genişlemesini indükleyerek (Willis çemberi) BBB ve kan damarlarını tehlikeye atabiliriz24,25. AD'nin vasküler bileşeninin patogenezinin daha iyi anlaşılması için bu tekniğin bir AD fare patoloji modelinin kullanımıyla birleştirilmesi, bu iki farklı patoloji arasındaki karmaşık etkileşimler ve etkiler hakkında değerli bilgiler sağlayabilir.
Önceki çalışmalar, hastaların tipik olarak karışık demans olarak adlandırılan bir durum olan AD ve VaD'nin hem patolojik özelliklerini sergilediği durumları göstermiştir26,27. Bu nedenle, her iki durum arasındaki birbirine bağlı mekanizmaları anlamak, bu nörodejeneratif bozuklukların ilerlemesi ve tezahürü hakkında daha kapsamlı bir bakış açısı sunabilir, altta yatan mekanizmaları ve potansiyel terapötik stratejileri anlamamızı geliştirir. Bu amaçla, vasküler değişiklikleri tanımlamak için bir AD patoloji fare modelinde (AppNL-F) elastaz uygulamasını gösteriyoruz.
Protokol
Bu çalışma için insan amiloid plağını fizyolojik düzeyde eksprese eden AppNL-Ffareleri (3 aylık) kullanıldı, ancak bu sistem herhangi bir kemirgen modelinde kullanılabilir. Tüm hayvan prosedürleri, CAMH Hayvan Bakım Komitesi (Protokol # 843) tarafından onaylandı ve Kanada Hayvan Bakımı Konseyi yönergelerinin etik standartlarına uygun oldu. Fareler şirket içinde yetiştirildi ve yem ve suya ad libitum erişimi ile 12 saatlik bir aydınlık-karanlık döngüsünde tutuldu.
1. Cisterna magna (CM) enjeksiyonu prosedürü
- Cerrahi prosedür
- Fareyi (APPNL-F, her iki cinsiyet, 3 ay) 1 dakika boyunca bir anestezi indüksiyon odasına yerleştirin.
NOT: Hazneyi en az 1 dakika boyunca% 1 oksijen ile karıştırılmış% 5 izofluran ile yıkayın. - Fare uyuşturulduktan sonra, hayvanı odadan çıkarın ve yeni bir cerrahi örtü üzerine yerleştirin ve burnun üzerine bir burun konisi yerleştirerek anesteziyi koruyun (izofluran,% 2.5 -% 3).
NOT: Refleks olmadığından emin olmak için ayak parmağınızı sıkıştırarak anestezi derinliğini kontrol edin. - Kuruluğu önlemek için oftalmik merhem sürün. Daha sonra, deri altından 0.1 mL bupivakain (lokal anestezik; 1-2 mg / kg% 0.125, 1: 2 seyreltme oranı ile) insizyon bölgesine ve Metacam'a (analjezik; 5 mg / kg, 1:10 seyreltme oranı ile) enjekte edin. Ameliyat sırasında olası kan kaybını telafi etmek için prosedürü yapmadan önce deri altına 0,5 mL salin enjekte ederek hayvanı nemli tutun.
- Net bir insizyon bölgesi için, oksipital kemiğin tabanındaki boynu tıraş edin, yüzeyi steril PBS ile silin ve konuyu yüzüstü pozisyonda stereotaksik çerçeveye aktarın.
NOT: Anestezinin stereotaksik burun konisinden sağlandığından emin olun. - Stabilite sağlamak ve üst dişlerin sabitlendiğinden emin olmak için burun çubuğunu stereotaksik çerçeveden farenin üzerine yerleştirin.
- Cerrahi ilgi alanını ortaya çıkarmak için enseyi yükseltmek ve şişirmek için hayvan kafasını vücuttan 120°'lik bir açıyla konumlandırın.
- Cerrahi bölgeyi Betadine ovma 3x,% 70 etanol 3x ve betadin solüsyonu 1x steril 2 inç x 2 inç gazlı bez ile temizleyin.
- Cildi cımbız yardımıyla nazikçe katlayın ve cerrahi makas kullanarak küçük bir kesi (1 cm) yapın.
NOT: Bu, ense orta hattını ortaya çıkarmalıdır. - Kasları kesmek için neşteri orta hat boyunca dikkatlice çalıştırın. Daha sonra cımbız kullanarak kasları sola ve sağa çekerek nazikçe ayırın.
NOT: Bu, kafatasının tabanının altında bulunan Cisterna magna'yı (ters üçgen) ortaya çıkarmalıdır (Şekil 1).
- Fareyi (APPNL-F, her iki cinsiyet, 3 ay) 1 dakika boyunca bir anestezi indüksiyon odasına yerleştirin.
- Elastaz hazırlanması
NOT: Sipariş edilen elastaz (toz form) paketi 250 Birim (U) içeriyordu. Her bir hayvana enjekte edilecek elastaz miktarı 2,5 μL'dir. 2.5 μL'de olması gereken elastaz miktarı 15 miliUnits mU olmalıdır.- İlk önce enjekte edilecek çözeltinin konsantrasyonunu hesaplayın.
Konsantrasyon = kütle / hacim
= 15 mU/2,5 μL
= 6 mU/μL
Bu nedenle, gerekli konsantrasyon 6 mU / μL'dir. - Elastaz miktarı 250 U'dur ve etüt milliUnits ile çalışır, bu nedenle birimleri 250000 mU veren milliUnits'e dönüştürün.
- 250000 mU'luk bir kütleye ve 6 mU/uL'lik bir konsantrasyona sahip olduktan sonra, elastazın seyreltilmesini ve 6 mU/uL'lik bir konsantrasyonun korunmasını gerektirecek hacmi (PBS) hesaplayın.
- Yukarıdaki formülün aynısını kullanarak, hacmi çözmek için yeniden düzenleyin:
Hacim = kütle/Conc.
= 250000 mU/ 6 mU/μL
= 41666.67 μL - 41666.67 μL'yi pipetlemek zor olduğundan, 1x çözelti elde etmek için 41.66667 mL elde etmek için 1000'e bölerek mililitreye dönüştürün.
- Çözeltiyi daha konsantre hale getirmek için 10 kat veya 100 kat artırın.
- Çalışması daha basit olduğu için 10x'lik bir çözüm oluşturun (aşağıya bakın).
10x çözelti ---------- 4.166667 mL (konsantre)
- 250 U'yu 5 mL'lik bir alikot tüpüne yerleştirin ve 10x stok çözeltisini yapmak için alikot tüpüne 4.167 mL steril PBS ekleyin.
- 10 μL stok solüsyonunu pipetleyin ve 1000 μL'lik 4.167 mL stok solüsyonu veren 100 alikot tüpüne yerleştirin. Tüpleri -20 °C'de saklayın.
- Stok çözeltisinin geri kalanını alikot tüplerde tüp başına 100 μL'de saklayın ve dondurucuda -20 °C'de saklayın.
NOT: Çözeltiler -20 °C'de 6 aya kadar stabildir ve önemli bir aktivite kaybı olmaz. Ek olarak, elastazın aşırı donmasının ve çözülmesinin stabiliteyi azaltabileceğine dikkat etmek önemlidir. Bu nedenle, bunun olmasını önlemek için, stok çözeltisi dondurulmadan önce, enjeksiyon için bir seferde yalnızca bir numunenin çözülmesi gerekecek şekilde bölünebilir. - 10 μL 10x çözelti içeren alikot tüplerinden birini çözdürdükten sonra, 100 μL 1x çözelti elde etmek için 90 μL steril PBS ekleyin.
- Bunun yerine 100 μL 10x çözelti içeren alikot tüpü çözüldüyse, 1x çözelti olan 1000 μL elde etmek için 900 μL PBS eklemeniz yeterlidir. Her iki çözeltiyi de 1 hafta boyunca 4 ° C'de saklayın.
- İlk önce enjekte edilecek çözeltinin konsantrasyonunu hesaplayın.
- Cisterna magna'ya enjekte etmek
NOT: Hamilton şırıngasını elastaz ile yüklemeden önce damıtılmış su 5x, ardından etanol 5x ve son olarak damıtılmış su 5x ile yükleyerek ve aspire ederek temizleyin.- Hamilton şırıngasını 2,5 μL elastaz (15 mU konsantrasyon) ile doldurun ve hava kabarcığı olmadığından emin olun.
- Şırıngayı, eğim yukarı bakacak şekilde yavaşça Sarnıç magnasının ortasına yerleştirin.
NOT: Cisterna magna'dan geçen kan damarlarını delmekten kaçının. - Delinmeden sonra eğimi çıkarın. Bu, az miktarda beyin omurilik sıvısının (BOS) salınmasını kolaylaştıracaktır. Fazla BOS'u emmek için steril bir pamuklu çubuk kullanın.
- Eğimi delinme bölgesine tekrar yerleştirin, elastazı veya aracı 1 dakikadan fazla yavaşça Cisterna magna'ya enjekte edin ve herhangi bir elastaz sızıntısını önlemek için iğneyi 1 dakika yerinde bırakın.
- Eğimi çıkardıktan sonra, insizyon bölgesini emilmeyen bir cerrahi sütürle (3/8" iğne ile # 4-0) kapatın ve anesteziyi kapatın.
- Hayvanı stereotaksik çerçeveden çıkarın ve konu iyileşene kadar 37 °C'ye ayarlanmış ılık bir ısı yastığının üzerine koyun.
NOT: Ameliyat sonrası iyileşme sırasında ağrıya yardımcı olmak için ameliyattan sonra başka bir Metacam dozu önerilir.
2. Silikon kauçuk bileşiği enjeksiyonu ve doku hasadı
- Hayvanı aşırı dozda avertin (1 mL, 125-250 mg / kg) ile uyuşturun.
NOT: Reflekslerin durduğundan emin olmak için ayak parmağınızı sıkıştırın. - Hayvanı bir bebek bezine yerleştirin ve göğüs boşluğu yukarı bakacak şekilde tüm uzuvları cerrahi bantla sabitleyin
- Kalbi ortaya çıkarmak için cımbız ve makas kullanarak göğüs boşluğunu açın.
- Kalbin sol ventrikülüne 23 G'lik künt bir iğne yerleştirin ve bir mikro perfüzyon pompası kullanarak kan damarlarını temizlemek için 4 dakika boyunca heparin (100 U / mL) ile infüzyon edilmiş PBS ile perfüze edin.
- Tampon şişesini %4 paraformaldehit (PFA) (PBS'de yapılmış) içeren bir şişeyle değiştirin ve 4 dakika daha perfüz.
- 50 mL'lik bir tüpte 5 mL bileşiği 5 mL seyreltici ile birleştirerek silikon kauçuk bileşiği (sarı) çözeltisini hazırlayın. Kullanmadan önce iyice karıştırın.
- 10 mL'lik bir şırıngayı 10 mL silikon kauçuk bileşimi ile doldurun. Şırıngayı 23 G künt iğneye bağlı hortuma takın ve çözeltiyi dikkatlice kalbe manuel olarak enjekte edin.
NOT: Silikon kauçuk bileşiğinin yüksek viskozitesi nedeniyle, daha büyük bir namlu şırınga kullanmak önemlidir, aksi takdirde basınç pistonu itmek için çok büyük olacaktır. - Enjeksiyondan sonra farenin kafasını çıkarın ve gece boyunca 4 °C'de saklayın, böylece silikon kauçuk bileşiğinin kaplarda sertleşmesine izin verin.
- Ertesi gün, farenin kafatasını nazikçe çıkarın (tercihen ince cımbız kullanarak), beyni çıkarın ve gece boyunca oda sıcaklığında (RT) %4 PFA'da inkübe edin.
- PFA'da 24 saatlik bir inkübasyondan sonra, beyni PBS 3x'te yıkayın,% 30 sükroz içine koyun ve 4 ° C'de saklayın.
3. Kantitatif analiz
- Willis Çemberi'nin tüm beyindeki yüksek kaliteli görüntülerini yakalamak için (Şekil 3):
- Beyni sükroz çözeltisinden çıkarın. Yüzey nemini emmek için bir kağıt havlu kullanarak beyni iyice kurulayın.
- Beyni bir beyin dilimleyiciye yerleştirin. Beyin dilimleyiciyi bir kamera ile donatılmış bir ışık mikroskobu altına yerleştirin.
- Mikroskobu, Willis Çemberi'nin net, yüksek çözünürlüklü bir çözünürlüğüne odaklayın.
- Yaklaşık 1 cm ölçmek ve piksel sayısını not etmek için 10 cm cetvel referanslı görüntü analiz yazılımı kullanın. Bu ölçüme göre 1 cm'lik ölçeği ayarlayın, ardından çapını bulmak için baziler arterin kalınlığını yatay olarak ölçün.
- Görüntüyü analiz etmek için standart bir piksel dansitometri yazılımı kullanın. Bir görüntü analiz yazılımı kullanarak baziler arterin beş ayrı okumasını (santimetre cinsinden) ölçün ve baziler arter çapının doğru bir temsilini elde etmek için ortalamayı hesaplayın.
- Elastaz ve kontrol grubu arasındaki ortalama çap değişimini karşılaştırmak için 2 yönlü bir varyans analizi (ANOVA) kullanın.
- Aşağıdaki 21'i kullanarak çaptaki yüzde değişimini hesaplayın:
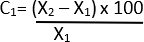
C = bağıl değişim
X1 = Başlangıç değeri (Araç)
X2 = Son değer (Elastaz)
0,05'ten küçük P değerlerini istatistiksel olarak anlamlı olarak kabul edin. Tüm istatistiksel analizleri bir istatistiksel analiz yazılımı kullanarak gerçekleştirin.
- Aşağıdaki 21'i kullanarak çaptaki yüzde değişimini hesaplayın:
4. Alkol dehidrasyonu kullanılarak silikon kauçuk bileşiğinin çıkarılması
NOT: Fazla silikon kauçuk bileşiğinin kan damarından uzaklaştırılmasına yardımcı olmak için beyni kurutmak önemlidir, bu da immün boyamanın kalitesini potansiyel olarak artırabilir.
- Sükrozu çıkarmak için beyinleri PBS ile 3 kez yıkayın.
- Beyni, toplam 5 gün boyunca her konsantrasyonda 24 saat boyunca %25, %50, %75, %95 ve mutlak etanole yerleştirin.
- Dokunun dehidrasyonundan sonra, dokuyu 12-24 saat boyunca metil salisilata (konsantre% ≤100) yerleştirin. Etanol ve metil salisilat, dokudaki fazla silikonun çıkarılmasına izin verecektir.
- Artık kimyasalları uzaklaştırmak için beyni PBS 3x'te yıkayın ve gece boyunca taze PBS'de 4 °C'de bir külbütörde bırakın.
- Beyni sükroz içine yerleştirin ve kesit alma ve immün boyamadan önce 4 ° C'de saklayın.
5. İmmünohistokimyasal boyama
- Beyinlerin bölümlere ayrılması
- İmmünoseksiyondan önce, beynin sakarozla dolu tüpün dibine yerleşmesine izin verin.
- Kuru buzla çevrili optimum kesme sıcaklığı (OCT) bileşiği kullanarak beyni mikrotom platformunda dondurun. Mikrotom bıçağını kullanarak beyni 40 μm'lik bölümlere ayırın.
- İnce uçlu bir boya fırçası kullanarak donmayı önlemek için her bölümü kriyoprotektan içeren 96 oyuklu bir plakaya aktarın.
- 96 oyuklu plakayı plastik sargı ile güvenli bir şekilde kapatın. Kapalı plakayı -20 °C dondurucuda saklayın.
- İmmünofloresan boyama (örnek olarak NeuN kullanılarak)
- Bölümleri 24 oyuklu bir plakaya yerleştirin. Kriyoprotektanı ortadan kaldırmak için PBS ile üç yıkama yapın.
- Spesifik olmayan bağlanmayı önlemek için,% 2 keçi serumu,% 0.1 Triton-X 100 ve% 1 BSA içeren bir blokaj çözeltisi kullanarak RT'de 1 saat inkübe edin.
- Tüm bileşenleri PBS'de hazırlayın.
NOT: Kullanılan birincil antikor, 1: 500 seyreltme ile monoklonal fare anti-NeuN'yi içeriyordu. Kullanılan ikincil antikor, 1:200 seyreltme ile poliklonal keçi anti-fare 568'i içeriyordu. - Monoklonal fare anti-NeuN'yi yukarıda belirtilen bloke edici çözelti içinde seyreltin.
- Seyreltilmiş antikoru her bir oyuğa ekleyin. Gece boyunca 4 °C'de inkübe edin, ışıktan folyo ile korunun.
- Birincil inkübasyondan sonra, bölümleri 3x PBS ile yıkayın. Poliklonal keçi anti-fare 568'i aynı engelleme çözeltisi içinde seyreltin.
- Seyreltilmiş antikoru her bir oyuğa ekleyin. Oda sıcaklığında 2 saat inkübe edin, folyo ile ışıktan korunun.
- İkincil inkübasyondan sonra bölümleri 3x PBS ile yıkayın.
- İnce boya fırçaları kullanarak bölümleri slaytlara yavaşça aktararak montaja hazırlanın. Tüm bölümlerin kurumasını bekleyin.
- Bölümler kuruduktan sonra 125-150 μL solmaya karşı dayanıklı montaj ortamı uygulayın. Lamelleri nazikçe yerleştirin.
- Slaytların karanlıkta RT'de 24 saat kurumasına izin verin, kenarları oje ile kapatın. Görüntüleme yazılımı kullanarak floresan görüntüler yakalayın.
Sonuçlar
Fareyi stereotaksik çerçeveye dikkatlice yerleştirdikten ve kasları diseksiyon ettikten sonra Cisterna magna'yı kafatasının oksipital bölgesinin altına yerleştirmede başarılı olduk. Ters üçgeni andıran ve sarı renkle vurgulanan bu anatomik yapı, kafatasının tabanının altında yer almaktadır (Şekil 1). Hassasiyeti sağlamak ve beyin dokusuna herhangi bir zarar gelmesini önlemek için, Hamilton şırınga eğiminin 1-2 mm'si Cisterna magna'ya nazikçe yerleştirildi.
Tartışmalar
Bu makale, farelerin Cisterna magna'sına elastaz enjeksiyonu için kesin ve basit bir yaklaşım sağlayan serebrovasküler dilatasyon için geliştirilmiş bir protokolü göstermektedir. Bu anatomik nokta, beyin omurilik sıvısına doğrudan bir geçit görevi görür ve farklı nörolojik hastalıkların araştırılması için değerli bir yol sunar. Bu modifiye tekniğin ana avantajlarından biri, farelerin Cisterna magna'sına tek bir doz elastaz enjekte edilmesinin, tekrarlanabilir enjeksiyona veya bir kanül im...
Açıklamalar
Çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, ameliyatlara yardımcı olma konusunda destek sağlayan Stephanie Tam'ın paha biçilmez katkılarıyla mümkün olmuştur. Kendisine yardımları için en içten şükranlarımızı sunarız. Bu araştırmayı desteklemek için Ulusal Sağlık Enstitüleri (AG066162).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
Referanslar
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır