JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
A visual approach for inducing dolichoectasia in mice to model large vessel-mediated cerebrovascular dysfunction(대혈관 매개 뇌혈관 기능 장애를 모델링하기 위해 마우스에서 백우절충증을 유도하기 위한 시각적 접근법)
요약
뇌혈관 기능 장애를 조사하기 위한 모델로 생쥐의 대혈관 확장을 화학적으로 유도하는 것을 시연하고 있으며, 이는 혈관성 치매 및 알츠하이머병 모델링에 사용할 수 있습니다. 또한 실리콘 고무 화합물을 주입하여 혈관 구조를 시각화하고 혈관 크기의 변화를 측정하기 위한 명확한 시각적 지침을 제공하는 방법을 보여줍니다.
초록
혈액-뇌(BBB)는 말초와 함께 선택적 뇌 순환을 조절하는 중요한 시스템으로, 필요한 영양소가 뇌로 들어가 과도한 아미노산이나 독소를 배출할 수 있도록 합니다. 혈관성 치매(VaD) 또는 알츠하이머병(AD)과 같은 질병에서 BBB가 어떻게 손상될 수 있는지 모델링하기 위해 연구원들은 혈관 확장을 모델링하는 새로운 방법을 개발했습니다. 이러한 질병 상태에서 손상된 BBB는 해로울 수 있으며 BBB의 조절 장애를 초래하여 뇌 기능에 영향을 미치는 바람직하지 않고 병리적인 결과를 초래할 수 있습니다. 우리는 Cisterna magna(CM)에 직접 주입하여 엘라스타아제를 사용하여 혈관 확장을 유도하고 BBB의 단단한 접합부(TJ)를 파괴할 수 있는 기존 기술을 수정할 수 있었습니다. 이 방법을 통해 일관된 혈관 확장, 사망률 감소 또는 회복 개선, 실리콘 고무 화합물인 충전제/불투명제, 확장 분석을 위한 혈관 라벨링을 위한 전달 개선 등 이전 기술에 비해 다양한 성공 지표를 확인할 수 있었습니다. 이 수정된 최소 침습 방법은 주입 후 2주에서 3개월까지 마우스의 대형 혈관의 지속적인 확장이 19%-32% 증가하여 유망한 결과를 얻었습니다. 이러한 개선은 이전 연구에서 2주째에만 확장이 증가한 것으로 나타났던 것과 대조를 이룹니다. 추가 데이터에 따르면 9.5개월 후에도 지속적인 확장을 시사합니다. 이러한 증가는 엘라스타제(elastase)와 차량 주입 그룹의 혈관 직경을 비교함으로써 확인되었다. 전반적으로 이 기술은 동물 모델을 사용하여 중추신경계(CNS)에 영향을 미치는 병리학적 장애를 연구하는 데 유용합니다.
서문
대뇌 모세혈관을 둘러싸고 있는 미세혈관 내피 세포는 혈액뇌장벽(BBB)1을 형성하는 주요 구성 요소로, 뇌 순환을 통해 말초부로 들어오고 나가는 것을 조절하는 데 중요한 역할을 합니다. 신경 조직에 필요한 필수 영양소는 BBB로 들어갈 수 있으며, 글루타메이트와 같은 일부 필수 아미노산은 뇌에서 배출되는데, 이는 고농도가 뇌 조직에 영구적인 신경 흥분성 손상을 일으킬 수 있기 때문입니다2. 정상적인 생리적 조건에서 BBB는 알부민 3,4 및 프로트롬빈과 같은 혈장 단백질이 뇌로 들어가는 것을 제한하는데, 이는 해로운 영향을 미칠 수 있기 때문입니다 5,6,7. 마지막으로, BBB는 음식이나 환경의 생체 이물(xenobiotics)과 같이 주변부에서 순환하는 신경독으로부터 뇌를 보호한다1. 전반적으로, 뇌 조직의 손상은 돌이킬 수 없으며, 낮은 수준의 신경 발생과 상관관계가 있는 노화는 신경 퇴행성 과정을 가속화하는 모든 요인을 보호하고 예방하는 데 있어 BBB의중요성을 강조한다.
백운확장증(dolichoectasia, 또는 대혈관 확장)에서는 혈관 탄력성의 감소가 관찰되며, 이로 인해 혈관의 형태학적 변화가 일어나 혈관이 기능 장애를 일으키고9 뇌의 혈류를 감소시킨다. 이러한 혈류의 감소는 산소와 포도당 공급을 감소시키고, 궁극적으로 반응성 성상세포(reactive astrocyte)의 활성화를 통해 BBB에 손상을 유발한다10. 혈관의 내부 엘라스틴층이 백구확장증에 의해 손상된 경우혈관신생을 위해 혈관내피성장인자(VEGF)의 반복적인 자극이 필요하다. 이는 누출 혈관의 형성으로 이어질 수 있으며 궁극적으로 결함이 있는 혈관의 발달을 특징으로 하는 병리학적 혈관 신생을 초래할 수 있다12. 병리학적 혈관신생 중에 혈관에 결함이 생기면 보상 메커니즘이 단단한 접합 단백질을 상향 조절하여 혈관 무결성을 복원하는 것으로 보입니다. 그러나 이 과정은 혈관의 구조적 무결성이 손실될 때 의도치 않게 BBB를 방해할 수 있다13. 이는 BBB를 더욱 파괴하고 아밀로이드 플라크(amyloid plaque)의 생성을 촉진함으로써 발생할 수있다 14. 또한, 말초로부터의 누출은 신경 염증을 유발할 수 있으며,15 이는 신경 세포 퇴화와 그에 따른 기억 상실을 초래합니다.
구조적으로 BBB가 제공하는 보호는 혈액 이종이뇌로 유입되는 생체 이물질을 막는 단단한 접합부를 통해 이루어집니다. 특정 물질이 뇌에 들어갈 수 있도록 할 때, BBB는 주로 두 가지 주요 과정, 즉 수동 확산 또는 특정 채널(예: 이온 채널 및 수송체)을 통해 이를 수행합니다1. 알츠하이머병의 경우, 연구에 따르면 혈관 시스템의 기능 장애가 질환의 진행에 중요한 역할을 한다는 것이 밝혀졌습니다12,13. 아밀로이드-베타(Aβ) 플라크의 형성과 신경 퇴행은 BBB12,13의 파괴와 대뇌 혈류의 장애로 인해 발생할 수 있다16. 뇌혈류의 감소는 혈관성 치매와 AD17,18 진단을 받은 노인에서 볼 수 있습니다. 대뇌 혈류(CBF)의 기능 장애와 함께 혈액-뇌 장벽(BBB)의 손상은 말초 순환계로부터의 이물질의 침투를 동반하여 뇌에서 Aβ 농도의 증가에 기여할 수 있다19.
알츠하이머병 및 혈관성 치매(VaD)와 같은 신경 질환의 발병 기전을 조사하기 위해 질병을 복제하는 모델을 개발합니다. In vitro 모델은 광범위하게 사용되지만 혼합 세포 집단과 같은 광범위한 질병 모델링을 위한 생물학적 환경이 부족하여 in vivo 모델의 중요성이 필요합니다. 마우스는 질병에서 인간과 유사한 특성(예: 병리학)을 생성하는 데 있어 유전자 조작이 용이하기 때문에 일반적으로 사용됩니다. 지금까지의 진전으로 인해 대혈관 확장과 같은 질병 표현형과 알츠하이머병에서의 역할을 모방하기 위한 개선된 모델에 대한 지속적인 필요성이 있습니다. 이를 위해 우리는 기회를 보고 생쥐20,21의 Cisterna magna에 엘라스타제를 주입하는 기술을 수정했습니다. 엘라스타제(Elastase)는 결합 조직(22)과 주변의 단단한 연접(23)에서 엘라스틴을 분해하는 것으로 나타난 효소이다. Cisterna magna는 뇌에서 가장 큰 혈관인 Willis의 원 바로 위에 위치하기 때문에 주사 지점으로 선택되었습니다. Cisterna magna에 엘라스타제를 주입함으로써 단단한 접합부를 파괴하고 혈관의 확장을 유도하여 BBB와 혈관을 손상시킬 수 있습니다(Willis의 원)24,25. 알츠하이머병의 혈관 구성 요소에 대한 발병 기전에 대한 이해를 높이기 위해 이 기술을 AD 마우스 병리학 모델과 결합하면 이 두 가지 별개의 병리학 간의 복잡한 상호 작용과 영향에 대한 귀중한 통찰력을 제공할 수 있습니다.
이전 연구에서는 환자가 알츠하이머병과 내수능의 병리학적 특징을 모두 보이는 사례를 보여주었는데, 이는 일반적으로 혼합성 치매라고 불리는 상태이다26,27. 따라서 두 질환 사이의 상호 연결된 메커니즘을 이해하면 이러한 신경퇴행성 질환의 진행과 발현에 대한 보다 포괄적인 관점을 제공할 수 있으며, 기본 메커니즘과 잠재적인 치료 전략에 대한 이해를 높일 수 있습니다. 이를 위해 AD 병리학 마우스 모델(AppNL-F)에서 엘라스타제를 적용하여 혈관 변화를 식별하는 방법을 시연합니다.
프로토콜
이 연구에는 인간 아밀로이드 플라크를 생리학적 수준에서 발현하는 앱NL-F마우스(3개월령)가 사용되었지만, 이 시스템은 모든 설치류 모델과 함께 사용할 수 있습니다. 모든 동물 시술은 CAMH의 동물 보호 위원회(프로토콜 #843)의 승인을 받았으며 캐나다 동물 보호 위원회의 윤리 기준에 따라 진행되었습니다. 생쥐는 사내에서 사육되었으며 차우와 물에 대한 임시 접근 과 함께 12 시간의 밝음-어두운 주기로 유지되었습니다.
1. Cisterna magna (CM) 주입 절차
- 수술
- 마우스(APPNL-F, 남녀 모두, 3개월)를 마취 유도실에 1분 동안 놓습니다.
알림: 5% 산소와 1% 산소가 혼합된 1% 이소플루란으로 챔버를 최소 1분 동안 세척합니다. - 마우스를 마취한 후 챔버에서 동물을 제거하고 새 수술용 드레이프에 놓고 코에 비강 원뿔을 배치하여 마취(이소플루란, 2.5%-3%)를 유지합니다.
알림: 반사 신경이 없는지 확인하기 위해 발가락을 꼬집어 마취 깊이를 확인하십시오. - 건조를 방지하기 위해 안과 연고를 바르십시오. 그런 다음 절개 부위에 bupivacaine 0.1mL(국소 마취제, 1-2mg/kg 0.125%, 희석 비율 1:2)와 Metacam(진통제, 5mg/kg, 희석 비율 1:10)을 피하 주사합니다. 수술 중 발생할 수 있는 출혈을 보상하기 위해 시술을 하기 전에 0.5mL의 식염수를 피하로 주입하여 동물에 수분을 공급하십시오.
- 명확한 절개 부위를 위해 후두골 기저부의 목을 면도하고 멸균 PBS로 표면을 닦은 다음 피사체를 엎드린 자세의 입체 프레임으로 옮깁니다.
알림: 입체 노즈 콘을 통해 마취가 유지되는지 확인하십시오. - 입체 프레임의 코 막대를 마우스 위에 놓아 안정성을 제공하고 윗니가 고정되었는지 확인합니다.
- 동물의 머리를 몸에서 120° 각도로 배치하여 목덜미를 들어 올리고 펴서 수술 관심 부위를 노출시킵니다.
- 베타딘 스크럽 3회, 70% 에탄올 3회, 베타딘 용액 1회를 멸균 2인치 x 2인치 거즈로 수술 부위를 청소합니다.
- 핀셋을 사용하여 피부를 부드럽게 접고 수술 용 가위를 사용하여 작은 절개 (1cm)를합니다.
알림: 이렇게 하면 목덜미의 정중선이 드러나야 합니다. - 근육을 자르기 위해 정중선을 따라 메스를 조심스럽게 실행합니다. 그런 다음 핀셋을 사용하여 근육을 좌우로 당겨 부드럽게 분리합니다.
참고: 이렇게 하면 두개골 기저부 아래에 위치한 Cisterna magna(역삼각형)가 드러납니다(그림 1).
- 마우스(APPNL-F, 남녀 모두, 3개월)를 마취 유도실에 1분 동안 놓습니다.
- 엘라스타제의 제조
참고: 주문한 엘라스타제(분말 형태) 패키지에는 250개(U)가 포함되어 있습니다. 각 동물에 주입되는 엘라스타제의 양은 2.5μL입니다. 2.5μL에 있어야 하는 엘라스타제의 양은 15milliUnits mU여야 합니다.- 먼저 주입할 용액의 농도를 계산합니다.
농도 = 질량 / 부피
= 15mU/2.5μL
= 6mU/μL
따라서 필요한 농도는 6mU/μL입니다. - 엘라스타제의 양은 250U이고 연구는 milliUnits로 작동하므로 단위를 milliUnits로 변환하면 250000mU가 됩니다.
- 250000mU의 질량과 6mU/uL의 농도를 얻은 후 엘라스타제를 희석하고 6mU/uL의 농도를 유지해야 하는 부피(PBS)를 파악합니다.
- 위와 동일한 공식을 사용하여 볼륨을 해결하도록 재정렬합니다.
부피 = 질량/Conc.
= 250000 mU/ 6 mU/μL
= 41666.67 마이크로리터 - 41666.67 μL를 피펫팅하는 것은 어렵기 때문에 1000으로 나누어 밀리리터로 변환하면 41.66667 mL가 얻어져 1x 용액을 얻을 수 있습니다.
- 용액을 더 농축하려면 10배 또는 100배로 늘리십시오.
- 작업하기가 더 간단하므로 10x 솔루션을 만드십시오(아래 참조).
용액 10x ---------- 4.166667mL(계속)
- 250U를 5mL 분취액 튜브에 넣고 4.167mL의 멸균 PBS를 분취액 튜브에 넣어 10x 원액액을 만듭니다.
- 10 μL의 원액을 피펫팅하고 1000 μL의 4.167 mL 원액을 제공하는 분취액 튜브에 넣습니다. 튜브를 -20 °C에서 보관하십시오.
- 나머지 원액은 튜브당 100μL의 부분 표본 튜브에 보관하고 -20°C의 냉동고에 보관합니다.
참고: 용액은 -20°C에서 최대 6개월 동안 안정하며 심각한 활성 손실 없이 유지됩니다. 또한 엘라스타제의 과도한 동결 및 해동은 안정성을 감소시킬 수 있다는 점에 유의하는 것이 중요합니다. 따라서 이러한 일이 발생하지 않도록 하기 위해 동결 전에 원액을 분할하여 주입을 위해 한 번에 하나의 샘플만 해동하면 되도록 할 수 있습니다. - 10x 용액 10μL가 포함된 부분 표본 튜브 중 하나를 해동한 후 90μL의 멸균 PBS를 추가하여 100μL 1x 용액을 얻습니다.
- 100μL의 10x 용액이 포함된 부분 표본 튜브를 대신 해동한 경우 900μL의 PBS를 추가하기만 하면 1x 용액인 1000μL가 됩니다. 두 용액 중 하나를 4°C에서 1주일 동안 보관합니다.
- 먼저 주입할 용액의 농도를 계산합니다.
- Cisterna magna에 주입
알림: 엘라스타제를 적재하기 전에 증류수 5배, 에탄올 5배, 마지막으로 증류수 5배를 장전하고 흡입하여 Hamilton 주사기를 청소합니다.- Hamilton 주사기에 2.5μL의 엘라스타제(농도 15mU)를 주입하고 기포가 없는지 확인합니다.
- 베벨이 위쪽을 향하도록 주사기를 Cisterna magna의 중앙에 천천히 삽입합니다.
알림: Cisterna magna를 가로지르는 혈관에 구멍을 뚫지 마십시오. - 펑크 후 베벨을 제거하십시오. 이것은 소량의 뇌척수액(CSF)의 방출을 촉진합니다. 멸균 면봉을 사용하여 과도한 CSF를 흡수하십시오.
- 베벨을 천자 부위에 다시 삽입하고 엘라스타제 또는 차량을 Cisterna magna에 1분 이상 천천히 주입하고 엘라스타아제의 누출을 방지하기 위해 바늘을 1분 동안 제자리에 두십시오.
- 베벨을 제거한 후 비흡수성 수술용 봉합사(3/8" 바늘이 있는 #4-0)로 절개 부위를 봉합하고 마취제를 끕니다.
- 입체적 틀에서 동물을 제거하고 피험자가 회복될 때까지 37°C로 설정된 따뜻한 열 패드에 놓습니다.
참고: 수술 후 회복 중 통증을 완화하기 위해 수술 후 Metacam을 한 번 더 복용하는 것이 좋습니다.
2. 실리콘고무 화합물 주입 및 조직 수확
- 아베르틴(1mL, 125-250mg/kg)을 과다 투여하여 동물을 마취시킵니다.
알림: 반사가 멈추도록 발가락을 꼬집습니다. - 동물을 기저귀에 앉히고 흉강이 위를 향하도록 수술용 테이프로 모든 팔다리를 고정합니다.
- 핀셋과 가위를 사용하여 흉강을 열어 심장을 노출시킵니다.
- 23G의 뭉툭한 바늘을 심장의 좌심실에 삽입하고 헤파린(100U/mL)이 주입된 PBS를 4분 동안 관류하여 미세 관류 펌프를 사용하여 혈관을 청소합니다.
- 버퍼 병을 4% 파라포름알데히드(PFA)(PBS로 구성)가 포함된 병으로 교체하고 4분 더 관류합니다.
- 50mL 튜브에 5mL의 화합물과 5mL의 희석제를 결합하여 실리콘 고무 화합물(노란색) 용액을 준비합니다. 사용하기 전에 철저히 섞으십시오.
- 10mL 주사기에 10mL의 실리콘 고무 압축기를 채웁니다. 23G의 뭉툭한 바늘에 연결된 호스에 주사기를 부착하고 용액을 심장에 수동으로 조심스럽게 주입합니다.
알림: 실리콘 고무 화합물의 점도가 높기 때문에 더 큰 배럴 주사기를 사용하는 것이 중요하며 그렇지 않으면 압력이 너무 커서 플런저를 밀 수 없습니다. - 주입 후 마우스의 머리를 제거하고 실리콘 고무 화합물이 용기에서 경화될 수 있도록 4°C에서 밤새 보관합니다.
- 다음 날, 쥐의 두개골을 부드럽게 제거하고(가급적 미세한 핀셋 사용) 뇌를 추출한 다음 실온(RT)에서 밤새 4% PFA로 배양합니다.
- PFA에서 24시간 배양한 후 PBS 3x에서 뇌를 세척하고 30% 자당을 넣고 4°C에서 보관합니다.
3. 정량 분석
- 뇌 전체에서 Circle of Willis의 고품질 이미지를 캡처하려면(그림 3):
- 자당 용액에서 뇌를 제거합니다. 표면 수분을 흡수하기 위해 종이 타월을 사용하여 뇌를 완전히 말리십시오.
- 뇌 슬라이서에 뇌를 배치합니다. 카메라가 장착된 광학 현미경 아래에 뇌 슬라이서를 놓습니다.
- Circle of Willis의 선명한 고해상도 해상도로 현미경의 초점을 맞춥니다.
- 10cm 눈금자 참조와 함께 이미지 분석 소프트웨어를 사용하여 약 1cm를 측정하고 픽셀 수를 확인합니다. 이 측정을 기반으로 1cm 눈금을 설정한 다음 기저동맥의 두께를 수평으로 측정하여 직경을 찾습니다.
- 표준 픽셀 밀도 측정 소프트웨어를 사용하여 이미지를 분석합니다. 이미지 분석 소프트웨어를 사용하여 기저 동맥의 5개 개별 판독값을 측정(센티미터 단위)하고 평균을 계산하여 기저 동맥 직경을 정확하게 표현합니다.
- 2-way 분산 분석(ANOVA)을 사용하여 엘라스타제와 대조군 간의 평균 직경 변화를 비교합니다.
- 아래 21 공식을 사용하여 직경의 백분율 변화를 계산하십시오.
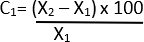
C = 상대적 변화
X1 = 초기값(차량)
X2 = 최종 값(엘라스타제)
통계적으로 유의한 0.05 미만의 P 값을 고려합니다. 통계 분석 소프트웨어를 사용하여 모든 통계 분석을 수행합니다.
- 아래 21 공식을 사용하여 직경의 백분율 변화를 계산하십시오.
4. 알코올 탈수를 이용한 실리콘 고무 화합물 제거
참고: 혈관에서 과도한 실리콘 고무 화합물을 제거하는 데 도움이 되도록 뇌를 탈수하는 것이 중요하며, 이는 잠재적으로 면역염색의 품질을 향상시킬 수 있습니다.
- PBS로 뇌를 3번 씻어 자당을 제거합니다.
- 뇌를 25%, 50%, 75%, 95% 및 절대 에탄올에 각 농도에서 24시간 동안 총 5일 동안 배치합니다.
- 조직을 탈수한 후 조직을 메틸 살리실레이트(conc. ≤100%)에 12-24시간 동안 넣습니다. 에탄올과 메틸 살리실레이트는 조직에서 과도한 실리콘을 제거할 수 있습니다.
- PBS 3x로 뇌를 씻어 잔류 화학 물질을 제거하고 신선한 PBS에서 4 ° C의 로커에서 밤새 그대로 두십시오.
- 뇌를 자당에 넣고 절편 및 면역염색 전에 4°C에서 보관합니다.
5. 면역조직화학적 염색
- 뇌의 절편
- 면역 절편술을 하기 전에, 뇌가 자당으로 채워진 튜브의 바닥에 가라앉도록 합니다.
- 드라이아이스로 둘러싸인 최적 절단 온도(OCT) 화합물을 사용하여 마이크로톰 플랫폼에서 뇌를 동결합니다. 마이크로톰 블레이드를 사용하여 뇌를 40μm 섹션으로 자릅니다.
- 끝이 가는 붓을 사용하여 동결을 방지하기 위해 동결 보호제가 들어 있는 96웰 플레이트에 각 섹션을 옮깁니다.
- 96웰 플레이트를 플라스틱 랩으로 단단히 밀봉합니다. 밀봉된 플레이트를 -20 °C 냉동고에 보관하십시오.
- 면역형광 염색(NeuN을 예로 사용)
- 섹션을 24웰 플레이트에 놓습니다. 동결 보호제를 제거하기 위해 PBS로 세 번 세척하십시오.
- 비특이적 결합을 방지하기 위해 2% 염소 혈청, 0.1% Triton-X 100 및 1% BSA를 함유한 차단 용액을 사용하여 RT에서 1시간 동안 배양합니다.
- PBS에서 모든 구성 요소를 준비합니다.
참고: 사용된 주요 항체에는 1:500 희석된 단클론 마우스 anti-NeuN이 포함되었습니다. 사용된 2차 항체에는 1:200 희석된 다클론 염소 항-마우스 568이 포함되었습니다. - 위에서 언급한 차단 용액에 단클론 마우스 anti-NeuN을 희석합니다.
- 희석된 항체를 각 웰에 추가합니다. 4 °C에서 호일로 빛으로부터 차폐된 상태에서 밤새 배양합니다.
- 1차 배양 후 PBS로 절편을 3번 세척합니다. polyclonal goat anti-mouse 568을 동일한 차단 용액에 희석합니다.
- 희석된 항체를 각 웰에 추가합니다. 호일로 빛으로부터 차폐된 실온에서 2시간 동안 배양합니다.
- 2차 배양 후 PBS로 절편을 3회 세척합니다.
- 가는 붓을 사용하여 섹션을 슬라이드로 천천히 옮겨 장착을 준비합니다. 모든 섹션이 건조되도록 합니다.
- 섹션이 건조되면 125-150 μL의 페이드 방지 장착 매체를 적용합니다. 커버슬립을 부드럽게 놓습니다.
- 슬라이드를 어두운 곳에서 RT에서 24시간 동안 건조시키고 매니큐어로 가장자리를 밀봉합니다. 이미징 소프트웨어를 사용하여 형광 이미지를 캡처합니다.
결과
우리는 쥐를 입체 프레임에 조심스럽게 배치하고 근육을 해부한 후 두개골의 후두부 아래에 있는 Cisterna magna를 찾는 데 성공했습니다. 역삼각형을 닮고 노란색으로 강조된 이 해부학적 구조는 두개골 기저 아래에 있습니다(그림 1). 정밀도를 보장하고 뇌 조직의 손상을 방지하기 위해 Hamilton 주사기 베벨 1-2mm를 Cisterna magna에 부드럽게 삽입했습니다.
엘라...
토론
이 논문은 뇌혈관 확장을 위한 개선된 프로토콜을 보여주며, 생쥐의 Cisterna magna에 엘라스타제 주입을 위한 정확하고 간단한 접근 방식을 제공합니다. 이 해부학적 지점은 뇌척수액으로 가는 직접적인 관문 역할을 하여 다양한 신경 질환을 조사할 수 있는 귀중한 길을 제공합니다. 이 수정된 기술의 주요 장점 중 하나는 생쥐의 Cisterna 마그나에 엘라스타제의 단일 용량을 주입하면 반복 가능한 주?...
공개
이해 상충이 없습니다.
감사의 말
이 연구는 수술을 지원한 Stephanie Tam의 귀중한 기여 덕분에 가능했습니다. 우리는 그녀의 도움에 진심으로 감사를 표합니다. 이 연구를 지원한 미국 국립보건원(National Institutes of Health, AG066162).
자료
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
참고문헌
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유