È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un approccio visivo per indurre la dolicoectasia nei topi per modellare la disfunzione cerebrovascolare mediata da grandi vasi
In questo articolo
Riepilogo
Dimostriamo l'induzione chimica della dilatazione dei grandi vasi sanguigni nei topi come modello per lo studio della disfunzione cerebrovascolare, che può essere utilizzato per la demenza vascolare e la modellazione del morbo di Alzheimer. Dimostriamo anche la visualizzazione del sistema vascolare iniettando un composto di gomma siliconica e fornendo una chiara guida visiva per misurare i cambiamenti nelle dimensioni dei vasi sanguigni.
Abstract
Il emato-encefalo (BEE) è un sistema cruciale che regola la circolazione selettiva del cervello con la periferia, ad esempio, consentendo ai nutrienti necessari di entrare ed espellere gli aminoacidi o le tossine in eccesso dal cervello. Per modellare il modo in cui la BBB può essere compromessa in malattie come la demenza vascolare (VaD) o il morbo di Alzheimer (AD), i ricercatori hanno sviluppato nuovi metodi per modellare la dilatazione dei vasi. Una BBB compromessa in questi stati patologici può essere dannosa e provocare una disregolazione della BBB che porta a conseguenze spiacevoli e patologiche che influiscono sulla funzione cerebrale. Siamo stati in grado di modificare una tecnica esistente che ci ha permesso di iniettare direttamente nella Cisterna magna (CM) per indurre la dilatazione dei vasi sanguigni utilizzando l'elastasi e interrompere le giunzioni strette (TJ) della BEE. Con questo metodo, siamo stati in grado di vedere varie metriche di successo rispetto alle tecniche precedenti, tra cui la dilatazione costante dei vasi sanguigni, la riduzione della mortalità o il miglioramento del recupero e il miglioramento dell'agente di riempimento/opacizzante, un composto di gomma siliconica, per l'etichettatura dei vasi sanguigni per l'analisi della dilatazione. Questo metodo minimamente invasivo modificato ha avuto risultati promettenti, con un aumento del 19%-32% della dilatazione sostenuta dei grandi vasi sanguigni nei topi da 2 settimane a 3 mesi dopo l'iniezione. Questo miglioramento contrasta con gli studi precedenti, che hanno mostrato un aumento della dilatazione solo a 2 settimane. Ulteriori dati suggeriscono un'espansione sostenuta anche dopo 9,5 mesi. Questo aumento è stato confermato confrontando il diametro dei vasi sanguigni dell'elastasi e del gruppo con veicolo iniettato. Nel complesso, questa tecnica è preziosa per studiare i disturbi patologici che colpiscono il sistema nervoso centrale (SNC) utilizzando modelli animali.
Introduzione
Le cellule endoteliali microvascolari che rivestono i capillari cerebrali sono i componenti principali per la formazione della barriera emato-encefalica (BBB)1, che svolge un ruolo cruciale nella regolazione di ciò che entra o esce dalla circolazione cerebrale con la periferia. I nutrienti essenziali necessari per il tessuto nervoso possono entrare nella BEE, mentre alcuni aminoacidi essenziali come il glutammato vengono espulsi dal cervello, poiché alte concentrazioni possono causare danni neuroeccitatori permanenti al tessuto cerebrale2. In condizioni fisiologiche normali, la BBB limita l'ingresso nel cervello della quantità di proteine plasmatiche come l'albumina 3,4 e la protrombina poiché queste possono avere effetti dannosi 5,6,7. Infine, la BBB protegge il cervello dalle neurotossine che circolano in periferia, come gli xenobiotici provenienti dal cibo o dall'ambiente1. Nel complesso, il danno ai tessuti cerebrali è irreversibile e l'invecchiamento correlato a bassi livelli di neurogenesi8 evidenzia l'importanza della BBB nel proteggere e prevenire qualsiasi fattore che acceleri il processo neurodegenerativo.
Nella dolicoectasia (o dilatazione dei grandi vasi sanguigni), si osserva una diminuzione dell'elasticità dei vasi, che si traduce in cambiamenti morfologici dei vasi, rendendoli così disfunzionali9 e portando a una riduzione del flusso sanguigno nel cervello. Questa riduzione del flusso sanguigno diminuisce successivamente l'apporto di ossigeno e glucosio, innescando in ultima analisi il danno alla BBB attraverso l'attivazione degli astrociti reattivi10. Quando la lamina interna dei vasi sanguigni è danneggiata dalla dolicoectasia11, per l'angiogenesi è necessaria una stimolazione ripetuta del fattore di crescita dell'endotelio vascolare (VEGF). Ciò può portare alla formazione di vasi che perdono e, infine, portare ad un'angiogenesi patologica, caratterizzata dallo sviluppo di vasi difettosi12. Durante l'angiogenesi patologica, quando i vasi sanguigni diventano difettosi, sembra che un meccanismo compensatorio ripristini l'integrità dei vasi sovraregolando le proteine della giunzione stretta. Tuttavia, questo processo può inavvertitamente interrompere la BBB quando l'integrità strutturale di un vaso sanguigno viene persa13. Ciò può verificarsi attraverso un'ulteriore interruzione della BBB e la promozione della produzione di placca amiloide14. Inoltre, le perdite dalla periferia possono causare neuroinfiammazione15, che provoca degenerazione neuronale e conseguente perdita di memoria.
Strutturalmente, la protezione fornita dalla BBB avviene attraverso le giunzioni strette che impediscono agli agenti xenobiotici del sangue di entrare nel cervello. Quando consente a determinate sostanze di entrare nel cervello, la BEE lo fa principalmente attraverso due processi principali, la diffusione passiva o canali specifici (come i canali ionici e i trasportatori)1. Nell'AD, la ricerca ha dimostrato che un sistema vascolare disfunzionale svolge un ruolo significativo nella progressione della condizione12,13. La formazione di placche di amiloide-beta (Aβ) e la neurodegenerazione possono derivare dalla rottura della BBB 12,13 e da disturbi del flusso sanguigno cerebrale16. Una riduzione del flusso sanguigno cerebrale può essere osservata in individui anziani con diagnosi di demenza vascolare e AD17,18. Il danno alla barriera emato-encefalica (BBB) insieme a un flusso sanguigno cerebrale disfunzionale (CBF) può contribuire all'aumento della produzione di concentrazione di Aβ nel cervello, accompagnata dall'infiltrazione di materiali estranei dalla circolazione periferica19.
Per studiare la patogenesi di malattie neurologiche come l'AD e la demenza vascolare (VaD), vengono sviluppati modelli per replicare la malattia. I modelli in vitro sono ampiamente utilizzati, ma mancano dell'ambiente biologico per un'ampia modellazione delle malattie come la popolazione cellulare mista, rendendo così necessaria l'importanza dei modelli in vivo. I topi sono comunemente usati per la loro facilità di manipolazione genetica nel generare proprietà simili a quelle umane (ad esempio, patologia) nella malattia. Con i progressi compiuti finora, c'è ancora un continuo bisogno di modelli migliorati per emulare i fenotipi della malattia come la dilatazione dei grandi vasi e il loro ruolo nell'AD. A tal fine, abbiamo visto un'opportunità e modificato una tecnica che prevedeva l'iniezione di elastasi nella Cisterna magna dei topi20,21. L'elastasi è un enzima che ha dimostrato di smontare l'elastina nel tessuto connettivo22 e nelle giunzioni strette circostanti23. La Cisterna magna è stata scelta come punto di iniezione perché si trova direttamente sopra il cerchio di Willis, il più grande vaso sanguigno del cervello. Iniettando elastasi nella Cisterna magna, possiamo compromettere la BBB e i vasi sanguigni rompendo le giunzioni strette e inducendo la dilatazione dei vasi sanguigni (circolo di Willis)24,25. La combinazione di questa tecnica con l'uso di un modello murino di patologia dell'AD, per una migliore comprensione della patogenesi della componente vascolare dell'AD, può fornire preziose informazioni sulle complesse interazioni e influenze tra queste due distinte patologie.
Studi precedenti hanno dimostrato casi in cui i pazienti mostrano sia le caratteristiche patologiche dell'AD che del VaD, una condizione tipicamente indicata come demenza mista26,27. Pertanto, la comprensione dei meccanismi interconnessi tra le due condizioni può offrire una prospettiva più completa sulla progressione e la manifestazione di queste malattie neurodegenerative, migliorando la nostra comprensione dei meccanismi sottostanti e delle potenziali strategie terapeutiche. A tal fine, dimostriamo l'applicazione dell'elastasi in un modello murino di patologia AD(APP NL-F) per identificare i cambiamenti vascolari.
Protocollo
Per questo studio sono stati utilizzati topiNL-F(3 mesi) che esprimono la placca amiloide umana a livello fisiologico, sebbene questo sistema possa essere utilizzato con qualsiasi modello di roditore. Tutte le procedure per gli animali sono state approvate dal Comitato per la cura degli animali del CAMH (Protocollo #843) ed erano conformi agli standard etici del Canadian Council on Animal Care guidelines. I topi sono stati allevati internamente e mantenuti in un ciclo luce-buio di 12 ore con accesso ad libitum a cibo e acqua.
1. Procedura per l'iniezione di Cisterna magna (CM)
- Procedura chirurgica
- Posizionare il topo (APPNL-F, entrambi i sessi, 3 mesi) in una camera di induzione dell'anestesia per 1 minuto.
NOTA: Lavare la camera con isoflurano al 5% miscelato con ossigeno all'1% per almeno 1 minuto. - Dopo che il topo è stato anestetizzato, rimuovere l'animale dalla camera e posizionarlo su un telo chirurgico fresco e mantenere l'anestesia (isoflurano, 2,5%-3%) posizionando un cono nasale sul naso.
NOTA: Controllare la profondità dell'anestesia pizzicando la punta del piede per assicurarsi che non ci siano riflessi. - Applicare un unguento oftalmico per prevenire la secchezza. Quindi, iniettare per via sottocutanea 0,1 ml di bupivacaina (anestetico locale; 1-2 mg/kg 0,125%, con un rapporto di diluizione di 1:2) nel sito di incisione e Metacam (analgesico; 5 mg/kg, con un rapporto di diluizione di 1:10). Mantenere l'animale idratato iniettando 0,5 ml di soluzione fisiologica per via sottocutanea prima di eseguire la procedura per compensare qualsiasi potenziale perdita di sangue durante l'intervento chirurgico.
- Per un sito di incisione chiaro, radere il collo alla base dell'osso occipitale, pulire la superficie con PBS sterile e trasferire il soggetto nel telaio stereotassico in posizione prona.
NOTA: Assicurarsi che l'anestesia sia mantenuta attraverso il cono del naso stereotassico. - Posiziona la barra nasale dal telaio stereotassico sulla parte superiore del mouse per fornire stabilità e garantire che i denti superiori siano fissati.
- Posizionare la testa dell'animale a un angolo di 120° rispetto al corpo per sollevare e distendere la nuca per esporre l'area chirurgica di interesse.
- Pulire il sito chirurgico con scrub Betadine 3x, etanolo al 70% 3x e soluzione di betadine 1x con garza sterile da 2 pollici x 2 pollici.
- Piegare delicatamente la pelle con l'aiuto di una pinzetta e praticare una piccola incisione (1 cm) utilizzando le forbici chirurgiche.
NOTA: Questo dovrebbe rivelare la linea mediana della nuca. - Fai scorrere con cautela il bisturi lungo la linea mediana per tagliare i muscoli. Quindi, usando una pinzetta, separa delicatamente i muscoli separandoli a sinistra e a destra.
NOTA: Questo dovrebbe rivelare la Cisterna magna (triangolo rovesciato) che si trova sotto la base del cranio (Figura 1).
- Posizionare il topo (APPNL-F, entrambi i sessi, 3 mesi) in una camera di induzione dell'anestesia per 1 minuto.
- Preparazione dell'elastasi
NOTA: La confezione di elastasi (in polvere) ordinata conteneva 250 unità (U). La quantità di elastasi da iniettare in ciascun animale è di 2,5 μL. La quantità di elastasi che si suppone sia nei 2,5 μL dovrebbe essere di 15 milliUnità mU.- Per prima cosa calcolare la concentrazione della soluzione da iniettare.
Concentrazione = massa/volume
= 15 mU/2,5 μL
= 6 mU/μL
Pertanto, la concentrazione richiesta è di 6 mU/μL. - La quantità di elastasi è 250 U e lo studio funziona con milliUnità, quindi converti le unità in milliUnità che danno 250000 mU.
- Dopo aver ottenuto una massa di 250000 mU e una concentrazione di 6 mU/uL, calcolare il volume (PBS) che richiederebbe la diluizione dell'elastasi e il mantenimento di una concentrazione di 6 mU/uL.
- Usando la stessa formula sopra, riorganizza per risolvere il volume:
Volume = massa/Conc.
= 250000 mU/ 6 mU/μL
= 41666,67 μl - Poiché è difficile pipettare 41666,67 μL, è sufficiente convertirlo in millilitri dividendolo per 1000 per ottenere 41,66667 mL per ottenere una soluzione 1x.
- Per rendere la soluzione più concentrata, aumentarla di 10 o 100 volte.
- Crea una soluzione 10x poiché è più semplice da usare (vedi sotto).
Soluzione 10x ---------- 4,166667 mL (conc.)
- Posizionare 250 U in una provetta aliquota da 5 mL e aggiungere 4,167 mL di PBS sterile nella provetta aliquote per ottenere la soluzione madre 10x.
- Pipettare 10 μL di soluzione madre e metterli in 100 provette aliquote per ottenere 1000 μL della soluzione madre da 4,167 mL. Conservare le provette a -20 °C.
- Conservare il resto della soluzione madre in provette aliquote a 100 μl per provetta e conservare in congelatore a -20 °C.
NOTA: Le soluzioni sono stabili a -20 °C per un massimo di 6 mesi senza perdite significative di attività. Inoltre, è importante notare che un eccessivo congelamento e scongelamento dell'elastasi può ridurre la stabilità. Pertanto, per evitare che ciò accada, la soluzione madre può essere divisa prima del congelamento in modo tale che sia necessario scongelare un solo campione alla volta per l'iniezione. - Dopo aver scongelato una delle provette aliquote che contiene 10 μl di una soluzione 10x, aggiungere 90 μl di PBS sterile per ottenere una soluzione 1x da 100 μl.
- Se invece la provetta aliquota che contiene 100 μl di una soluzione 10x è stata scongelata, è sufficiente aggiungere 900 μl di PBS per ottenere 1000 μl, che è una soluzione 1x. Conservare entrambe le soluzioni a 4 °C per 1 settimana.
- Per prima cosa calcolare la concentrazione della soluzione da iniettare.
- Iniezione nella Cisterna magna
NOTA: Pulire la siringa Hamilton prima di caricarla con l'elastasi caricandola e aspirandola con acqua distillata 5 volte, poi etanolo 5 volte e infine acqua distillata 5 volte.- Caricare la siringa Hamilton con 2,5 μL di elastasi (concentrazione di 15 mU) e assicurarsi che non vi siano bolle d'aria.
- Inserire lentamente la siringa con lo smusso rivolto verso l'alto al centro della Cisterna magna.
NOTA: Evitare di perforare i vasi sanguigni che attraversano la Cisterna magna. - Dopo la foratura, rimuovere lo smusso. Ciò faciliterà il rilascio di una piccola quantità di liquido cerebrospinale (CSF). Utilizzare un batuffolo di cotone sterile per assorbire l'eccesso di liquido cerebrospinale.
- Reinserire lo smusso nel sito di puntura, iniettare lentamente l'elastasi o il veicolo per oltre 1 minuto nella Cisterna magna e lasciare l'ago in posizione per 1 minuto per evitare qualsiasi fuoriuscita di elastasi.
- Dopo aver rimosso lo smusso, chiudere il sito dell'incisione con una sutura chirurgica non assorbibile (#4-0 con ago da 3/8") e spegnere l'anestetico.
- Rimuovere l'animale dalla cornice stereotassica e posizionarlo su un termoforo caldo impostato a 37 °C fino a quando il soggetto non si riprende.
NOTA: Si raccomanda un'altra dose di Metacam dopo l'intervento chirurgico per alleviare il dolore durante il recupero post-operatorio.
2. Iniezione di mescola di gomma siliconica e raccolta dei tessuti
- Anestetizzare l'animale con un sovradosaggio di avertina (1 ml, 125-250 mg/kg).
NOTA: Pizzica la punta del piede per assicurarti che i riflessi cessino. - Metti l'animale su un pannolino e fissa tutti gli arti con del nastro chirurgico con la cavità toracica rivolta verso l'alto
- Apri la cavità toracica usando una pinzetta e le forbici per esporre il cuore.
- Inserire un ago smussato da 23 G nel ventricolo sinistro del cuore e perfondere con PBS infuso con eparina (100 U/mL) per 4 minuti per liberare i vasi sanguigni utilizzando una pompa di microperfusione.
- Sostituire il flacone tampone con uno contenente il 4% di paraformaldeide (PFA) (composto in PBS) e perfondere per altri 4 minuti.
- Preparare la soluzione di composto di gomma siliconica (gialla) combinando 5 mL di composto con 5 mL di diluente in una provetta da 50 mL. Mescolare accuratamente prima dell'uso.
- Riempire una siringa da 10 mL con 10 mL di composto di gomma siliconica. Collegare la siringa al tubo flessibile collegato a un ago smussato da 23 G e iniettare con cautela la soluzione manualmente nel cuore.
NOTA: A causa dell'elevata viscosità della mescola di gomma siliconica, è importante utilizzare una siringa a cilindro più grande o la pressione sarà troppo grande per spingere lo stantuffo. - Rimuovere la testa del topo dopo l'iniezione e conservarla a 4 °C per una notte lasciando indurire la mescola di gomma siliconica nei vasi.
- Il giorno successivo, rimuovere delicatamente il cranio del topo (preferibilmente usando una pinzetta sottile), estrarre il cervello e incubare in PFA al 4% per una notte a temperatura ambiente (RT).
- Dopo un'incubazione di 24 ore in PFA, lavare il cervello in PBS 3x, immergerlo nel saccarosio al 30% e conservare a 4 °C.
3. Analisi quantitativa
- Per catturare immagini di alta qualità del Cerchio di Willis nell'intero cervello (Figura 3):
- Rimuovi il cervello dalla soluzione di saccarosio. Asciugare accuratamente il cervello usando un tovagliolo di carta per assorbire l'umidità superficiale.
- Posiziona il cervello in un'affettatrice. Posizionare l'affettacere cerebrale sotto un microscopio ottico dotato di fotocamera.
- Focalizzare il microscopio su una risoluzione chiara e ad alta risoluzione del Cerchio di Willis.
- Utilizzare un software di analisi delle immagini con un righello di riferimento da 10 cm per misurare circa 1 cm e annotare il numero di pixel. Imposta la scala di 1 cm in base a questa misura, quindi misura lo spessore dell'arteria basilare orizzontalmente per trovarne il diametro.
- Utilizzare un software di densitometria pixel standard per analizzare l'immagine. Misura (in centimetri) cinque letture separate dell'arteria basilare utilizzando un software di analisi delle immagini e calcola la media per ottenere una rappresentazione accurata del diametro dell'arteria basilare.
- Utilizzare un'analisi della varianza a 2 vie (ANOVA) per confrontare la variazione media del diametro tra l'elastasi e il gruppo di controllo.
- Calcolare la variazione percentuale del diametro utilizzando la formula seguente 21:
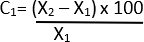
C = variazione relativa
X1 = Valore iniziale (veicolo)
X2 = Valore finale (Elastasi)
Considera i valori P inferiori a 0,05 statisticamente significativi. Esegui tutte le analisi statistiche utilizzando un software di analisi statistica.
- Calcolare la variazione percentuale del diametro utilizzando la formula seguente 21:
4. Rimozione della mescola di gomma siliconica mediante disidratazione alcolica
NOTA: È importante disidratare il cervello per aiutare a rimuovere il composto di gomma siliconica in eccesso dal vaso sanguigno che può potenzialmente migliorare la qualità dell'immunocolorazione.
- Lavare il cervello 3 volte con PBS per rimuovere il saccarosio.
- Mettere il cervello in etanolo al 25%, 50%, 75%, 95% e assoluto per 24 ore ad ogni concentrazione, per un tempo totale di 5 giorni.
- Dopo la disidratazione del tessuto, porre il tessuto in salicilato di metile (conc. ≤100%) per 12-24 ore. L'etanolo e il salicilato di metile consentiranno la rimozione del silicone in eccesso nel tessuto.
- Lavare il cervello in PBS 3 volte per rimuovere le sostanze chimiche residue e lasciare per una notte su un bilanciere a 4 °C in PBS fresco.
- Mettere il cervello nel saccarosio e conservarlo a 4 °C prima del sezionamento e dell'immunocolorazione.
5. Colorazione immunoistochimica
- Sezionamento del cervello
- Prima dell'immunosezione, lasciare che il cervello si depositi sul fondo del tubo riempito di saccarosio.
- Congelare il cervello sulla piattaforma del microtomo utilizzando un composto a temperatura di taglio ottimale (OCT) circondato da ghiaccio secco. Taglia il cervello in sezioni da 40 μm usando la lama del microtomo.
- Trasferire ogni sezione in una piastra a 96 pozzetti contenente crioprotettore per evitare il congelamento utilizzando un pennello a punta fine.
- Sigillare saldamente la piastra a 96 pozzetti con pellicola trasparente. Conservare la piastra sigillata in un congelatore a -20 °C.
- Colorazione in immunofluorescenza (utilizzando NeuN come esempio)
- Posizionare le sezioni in una piastra a 24 pozzetti. Eseguire tre lavaggi con PBS per eliminare il crioprotettore.
- Per evitare il legame aspecifico, incubare per 1 ora a RT utilizzando una soluzione bloccante contenente il 2% di siero di capra, lo 0,1% di Triton-X 100 e l'1% di BSA.
- Prepara tutti i componenti in PBS.
NOTA: L'anticorpo primario utilizzato includeva un anti-NeuN monoclonale di topo con una diluizione di 1:500. L'anticorpo secondario utilizzato includeva un anti-topo policlonale di capra 568 con una diluizione 1:200. - Diluire l'anti-NeuN monoclonale di topo nella soluzione bloccante sopra menzionata.
- Aggiungere l'anticorpo diluito a ciascun pozzetto. Incubare per una notte a 4 °C, al riparo dalla luce mediante un foglio.
- Dopo l'incubazione primaria, lavare le sezioni 3 volte con PBS. Diluire il policlonale di capra anti-topo 568 nella stessa soluzione bloccante.
- Aggiungere l'anticorpo diluito a ciascun pozzetto. Incubare per 2 ore a temperatura ambiente, al riparo dalla luce con un foglio.
- Lavare le sezioni 3 volte con PBS dopo l'incubazione secondaria.
- Preparati per il montaggio trasferendo lentamente le sezioni sui vetrini utilizzando pennelli fini. Lasciare asciugare tutte le sezioni.
- Applicare 125-150 μl di terreno di montaggio anti-sbiadimento una volta che le sezioni sono asciutte. Posizionare delicatamente i vetrini coprioggetti.
- Lasciare asciugare i vetrini per 24 ore a RT al buio, sigillando i bordi con smalto per unghie. Cattura immagini fluorescenti utilizzando il software di imaging.
Risultati
Siamo riusciti a localizzare la Cisterna magna sotto la regione occipitale del cranio dopo aver posizionato attentamente il topo sulla struttura stereotassica e sezionato i muscoli. Questa struttura anatomica, simile a un triangolo rovesciato ed evidenziata in giallo, si trova sotto la base del cranio (Figura 1). Per garantire la precisione e prevenire danni al tessuto cerebrale, 1-2 mm dello smusso della siringa di Hamilton sono stati inseriti delicatamente nella Cisterna magna.
Discussione
Questo articolo dimostra un protocollo migliorato per la dilatazione cerebrovascolare, fornendo un approccio preciso e diretto per l'iniezione di elastasi nella Cisterna magna dei topi. Questo punto anatomico funge da porta d'accesso diretta al liquido cerebrospinale, offrendo una preziosa via per l'indagine di diverse malattie neurologiche. Uno dei principali vantaggi di questa tecnica modificata è che l'iniezione di una singola dose di elastasi nella Cisterna magna dei topi è stata in grado di causare e sostenere la ...
Divulgazioni
Non vi è alcun conflitto di interessi.
Riconoscimenti
Questo studio è stato reso possibile dal prezioso contributo di Stephanie Tam che ha fornito supporto nell'assistenza agli interventi chirurgici. Le esprimiamo la nostra sincera gratitudine per il suo aiuto. Il National Institutes of Health (AG066162) per il sostegno a questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
Riferimenti
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon