A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياسات تخطيط كهربية الدماغ في Marmosets مستيقظا الاستماع إلى أصوات محددة
In This Article
Summary
لدراسة تطور اللغة ، من المهم مقارنة آليات الدماغ لدى البشر مع تلك الموجودة في الرئيسيات غير البشرية. لقد طورنا طريقة لقياس تخطيط كهربية الدماغ (EEG) للحيوانات المستيقظة بشكل غير جراحي. يسمح لنا بمقارنة بيانات EEG مباشرة بين البشر على المدى الطويل دون الإضرار بهم.
Abstract
يلعب التواصل الصوتي دورا حاسما في التفاعلات الاجتماعية للقرود ، لا سيما في البقاء والتنظيم الاجتماعي. طور البشر استراتيجية اتصال صوتي فريدة ومتقدمة في شكل لغة. لدراسة تطور اللغة البشرية ، من الضروري التحقيق في الآليات العصبية الكامنة وراء المعالجة الصوتية لدى البشر ، وكذلك لفهم كيفية تطور آليات الدماغ من خلال مقارنتها بتلك الموجودة في الرئيسيات غير البشرية. هنا ، قمنا بتطوير طريقة لقياس تخطيط كهربية الدماغ (EEG) بشكل غير جراحي للرئيسيات غير البشرية المستيقظة. تسمح طريقة التسجيل هذه بإجراء دراسات طويلة الأجل دون الإضرار بالحيوانات ، والأهم من ذلك أنها تسمح لنا بمقارنة بيانات EEG غير البشرية مباشرة مع البيانات البشرية ، مما يوفر نظرة ثاقبة لتطور اللغة البشرية. في الدراسة الحالية ، استخدمنا طريقة تسجيل EEG لفروة الرأس للتحقيق في نشاط الدماغ استجابة للأصوات الخاصة بالأنواع في marmosets. تقدم هذه الدراسة رؤى جديدة باستخدام تخطيط كهربية الدماغ لفروة الرأس لالتقاط التمثيلات العصبية واسعة الانتشار في marmosets أثناء الإدراك الصوتي ، وسد الفجوات في المعرفة الحالية.
Introduction
تستخدم الرئيسيات أصواتا خاصة بالأنواع لنقل معلومات مهمة بيولوجيا ، مثل الحالة العاطفية للمتصل أو نيته في الحفاظ على الروابط الاجتماعية ، أو وجود المفترسة ، أو المواقف الخطرة الأخرى. قد يزودنا التحقيق في الآليات العصبية الكامنة وراء إدراك النطق في الرئيسيات غير البشرية الغنية بالصوت بأدلة مهمة لفهم الأصول التطورية للغة البشرية بشكل أفضل.
marmosets الشائعة هي الرئيسيات الصغيرة الأصلية في أمريكا الجنوبية. في السنوات الأخيرة ، تم استخدام marmosets بشكل متزايد كحيوانات نموذجية ، جنبا إلى جنب مع المكاك ، بسبب إنتاجيتها العالية ، وسهولة استخدامها بسبب صغر حجمها ، وتطوير تقنيات معدلة وراثيا مفيدة1،2،3. بالإضافة إلى فائدتها كنماذج للمرض ، فإن التواصل الصوتي الغني داخل المجموعات هو سمة فريدة أخرى لهذا النوع4،5،6،7. تتبادل Marmosets بشكل روتيني الإشارات الصوتية للتواصل مع خصوصيات غير مرئية في الغابة. من خلال فحص نشاط الدماغ المتضمن في الإدراك الصوتي والإنتاج في marmosets ، يمكننا تحديد كيفية معالجة المعلومات السمعية الخاصة بهم أو المكالمات المحددة في الدماغ وتحديد الدوائر العصبية المعنية. أظهرت الدراسات السابقة نشاطا عصبيا في القشرة السمعية الأولية8،9،10،11،12 والقشرة الأمامية13،14 تشارك في الإنتاج الصوتي في marmosets. علاوة على ذلك ، تم تعديل هذه الاستجابات العصبية المتحمسة والمكبوتة من خلال التفاعلات السمعية الصوتية في القشرة السمعية الأولية 8,10. قدمت هذه الدراسات بيانات مفصلة عن النشاط العصبي على مستوى الخلايا العصبية المفردة باستخدام طرق التسجيل الغازية. وقد درست العديد من الدراسات كذلك النشاط العصبي الذي ينطوي عليه الإنتاج الصوتي marmoset. ومع ذلك ، لا يزال الإدراك الصوتي غير مفهومبشكل جيد 15,16.
أوضحت العديد من دراسات تصوير الدماغ غير الغازية الآليات العصبية للمعالجة الصوتية في marmosets17،18،19. تعد دقتها المكانية العالية ميزة ، ومع ذلك ، فإن إبقاء في حالة اليقظة أثناء المسح يتطلب تقنيات متقدمة. ومع ذلك ، في الآونة الأخيرة ، حدد جعفري وآخرون المناطق الأمامية الصدغية المشاركة في الإدراك الصوتي في marmosets مستيقظا باستخدام التصوير بالرنين المغناطيسي الوظيفي (fMRI) 19. أجريت جميع التجارب تقريبا لتوضيح وظائف الدماغ المشاركة في الإدراك الصوتي والإنتاج لدى البشر باستخدام طرق غير جراحية ، مثل تخطيط كهربية الدماغ لفروة الرأس (EEG) ، وتخطيط الدماغ المغناطيسي (MEG) 20،21 ، و fMRI22،23،24. بحثت العديد من الدراسات التي أجريت على البشر في نشاط الدماغ المتعلق بالإدراك الصوتي باستخدام EEG. ركزت معظم هذه الدراسات على المعلومات العاطفية25،26،27 وبروز الكلمات العاطفية28 ، مع الكشف عن النتائج عن تغييرات في الإمكانات المتعلقة بالحدث أثناء الإدراك الصوتي29. تم إجراء تخطيط كهربية القلب (ECoG) وتسجيلات الخلايا العصبية المفردة باستخدام أقطاب كهربائية مزروعة داخل الجمجمة في البشر فقط في عدد محدود من التجارب على المرضى الذين يخضعون لعلاج جراحة الأعصاب30,31.
يعد المنظور التطوري الذي يقارن البشر بالقرود أمرا مهما عند فهم الآليات العصبية الفريدة الكامنة وراء الإدراك الصوتي والإنتاج الذي تطور لدى البشر. لمقارنة الآليات العصبية المشاركة في إدراك الكلام والنطق في الرئيسيات غير البشرية الغنية صوتيا ، مثل المرموسيت ، مع البشر ، من المهم مقارنة البيانات بين النوعين باستخدام نفس الطريقة. يسمح التصوير بالرنين المغناطيسي الوظيفي بتصوير الدماغ بالكامل وله دقة مكانية عالية. لديها ميزة تسجيل النشاط عموديا على الجمجمة أو في المناطق العميقة التي يصعب تسجيلها باستخدام EEG أو MEG. ومع ذلك ، فإن جهاز التصوير بالرنين المغناطيسي مكلف في التركيب والصيانة ، وهناك العديد من القيود على المنبهات التي يمكن تقديمها بسبب طبيعة الجهاز. وبالمقارنة ، فإن EEG والإمكانات المتعلقة بالأحداث (ERPs) و MEG لها دقة زمنية عالية ، مما يجعلها مفيدة لتحليل المعالجة الصوتية للسلاسل الزمنية. على وجه الخصوص ، يتمتع EEG بمزايا التنقل العالي والقدرة على استخدامه في مجموعة متنوعة من الإعدادات التجريبية ، والتكلفة المنخفضة نسبيا ، ومتطلبات مشغل واحد فقط.
نظرا لأنه تم بالفعل الحصول على كمية كبيرة من بيانات EEG في البشر ، فهناك حاجة إلى طرق قياس EEG باستخدام نماذج غير جراحية للرئيسيات غير البشرية. طورت مجموعتنا البحثية طريقة فريدة لتسجيل EEG غير الباضعة باستخدام الأنابيب32 لقرود المكاك والمرموسيت. هنا ، نبلغ عن العديد من النتائج الجديدة المتعلقة بالمعالجة السمعية في الرئيسيات غير البشرية33،34،35،36،37. لتوصيف نشاط الدماغ استجابة للأصوات الخاصة بالأنواع في marmosets ، قمنا ببناء نظام تجريبي لتسجيل نشاط الدماغ بشكل غير جراحي باستخدام أقطاب كهربائية موضوعة على فروة الرأس. في هذه الدراسة ، وصفنا طريقة قياس EEG ل marmosets.
Protocol
تمت الموافقة على جميع التجارب من قبل لجنة التجارب على في EHUB (رقم 2022-003 ، 2023-104) وأجريت وفقا لدليل رعاية واستخدام الرئيسيات المختبرية التي نشرتها EHUB. تم استخدام تسعة شائعة (Callithrix jacchus ، ستة ذكور وثلاث إناث ، 2-12 سنة ، وزنها 330-490 جم) للتجربة.
1.
- قم بإيواء المرموسيت في أقفاص مفردة مجهزة بصناديق عش ، وعلياء خشبية ، وأجهزة تخصيب أخرى.
- حافظ على الغرف تحت دورة 12 ساعة من الضوء والظلام ، مع الحفاظ على درجة الحرارة والرطوبة عند 28 ± 2 درجة مئوية و 40 ± 20٪ على التوالي.
- إطعام 14 غرام من كريات العالم الجديد مرتين في اليوم ، مع استكمال الطعام مثل الصمغ العربي وديدان الوجبة. توفير المياه الإعلانية.
- قم بإجراء جميع التجارب في صندوق مخفف للصوت في غرفة تجريبية.
2. المعدات (الشكل 1 ب وجدول المواد)
- استخدم أقطاب كهربائية فضية 4 مم. يمنع طلاء AgCl الموجود على سطح القطب الاستقطاب ويضمن التسجيل المستقر.
- استخدم مكبر للصوت لتسجيل إشارات EEG. مرشح تمرير النطاق (0.016-250 هرتز) وأخذ عينات من البيانات عند 1000 هرتز.
- قم بتوصيل صندوق إدخال قطب كهربائي مكون من 64 قناة بمكبر الصوت ، وضعه أمام الهدف.
- ضع السماعة على بعد 30 سم من رأس المرموسيت وتحكم في مستوى الصوت عند 65-75 ديسيبل ، كما تم قياسه في موضع الأذن. قم بتوصيل المحفزات السمعية عبر هذا السماعة.
- ضع الكاميرا أمام الهدف لمراقبة حالته أثناء تسجيل EEG.
- كرسي الرئيسيات مصنوع من ألواح الأكريليك وأعمدة الراتنج الاصطناعية. بالنسبة للتجارب ، اطلب من الباحث حمل أثناء جلوسها على صفيحة القدم. في هذه المرحلة ، أدخل قطعة عنق وثبتها على لوحة الرقبة ، وقم بإدخال قطعة الخصر وتثبيتها على لوحة الخصر. تأكد من أن كامل جسم كل مارموسيت مؤمن بشكل فضفاض.
3. التخدير
- تخدير بالحقن العضلي للفاكسالون (6-8 ملغم/كغم) والأتروبين (0.05 ملغم/كغم). يسمح هذا البروتوكول بالحفاظ على التخدير لمدة 20 دقيقة تقريبا. تطبيق جرعات إضافية من الفاكسالون لإطالة مدة التخدير إذا كان الإجراء أطول. يجب أيضا تطبيق العوامل المضادة للقىء (Maropitant 1 ملغ/كغ، الحقن تحت الجلد) مسبقا لمواجهة الغثيان، وهو أحد الآثار الجانبية لعقار ألفاكسالون.
ملاحظة: يجب أن يكون Marmosets تحت التخدير عن طريق الحقن أو الاستنشاق أثناء الإجراءات ويجب السماح له بالتعافي فورا بعد حلاقة الشعر. - راقب العناصر الحيوية باستخدام مقياس التأكسج النبضي وقم بتطبيق خليط الأكسجين والهواء (O2 0.5 لتر / دقيقة ، الهواء 0.5 لتر / دقيقة) إذا لزم الأمر.
- حافظ على درجة حرارة الغرفة فوق 27 درجة مئوية ، ولف قطعة قماش دافئة حول جسم المرموسيت لمنع انخفاض حرارة الجسم.
4. إزالة الشعر
- حلق الرأس بالكامل (بما في ذلك خلف الأذن) باستخدام ماكينة حلاقة كهربائية.
- ضعي كريم إزالة الشعر على البشرة الحساسة. امسح الكريم بشاش مبلل بعد 5 دقائق.
5. إعداد قناع
- قم بمعالجة قناع لدن بالحرارة مسبقا ليناسب حجم كرسي. على وجه التحديد ، قم بحفر جزء الظهر الذي يبرز من الطول الرأسي للكرسي بأربعة ثقوب لولبية بحيث يمكن تثبيته على لوحة عنق الكرسي.
ملاحظة: أقنعة اللدائن الحرارية آمنة ويمكن استخدامها لشل حركة الرأس أثناء العلاج الإشعاعي لدى المرضى. استخدمنا قناعا صغيرا مصمما للأطفال وقطعناه ليناسب حجم المرموسيت. يلين هذا القناع عند وضعه في ماء دافئ عند 75 درجة مئوية ويتصلب مع انخفاض درجة الحرارة عند إزالته من الماء. - للتجارب ، ضع على كرسي الرئيسيات. دعم المخدر باستخدام لوحات الرقبة والخصر وتأمين وهذه اللوحات على الكرسي.
- قم بتسخين القناع بالماء الساخن ثم قم بتشكيله ليناسب رأس المرموسيت. بعد إزالة القناع من الماء الدافئ ، انتظر حتى تنخفض درجة الحرارة (تقريبا في نطاق 50 درجة مئوية) لمنع الحروق ، ثم ضعه على رأس الشخص لتشكيل القناع.
- بعد التبريد والتصلب ، افصل القناع عن واقطع الجزء العلوي من أجزاء الرأس والأذن من القناع لفضح المنطقة لإعداد القطب.
ملاحظة: بمجرد صنع هذا القناع ، يمكن استخدامه على أفراد آخرين.
6. تكييف الكرسي والقناع (30 دقيقة / يوم لمدة 3 أيام)
- تعويد على الكرسي في ظل ظروف مستيقظة عن طريق وضعه على كرسي ومكافأته لمدة 30 دقيقة تقريبا. كرر هذا الإجراء لمدة 3 أيام.
- تعويد على تثبيت الرأس باستخدام القناع لمدة 2 أيام.
ملاحظة: تم تخصيص عملية التكيف هذه وفقا لحالة الفرد. بعد التكيف ، قد تقاوم مؤقتا أثناء وضع الالتقاط وقناع الرأس ، ولكن بمجرد جلوسها على الكرسي وتثبيت رأسها ، تصبح هادئة. - أثناء تكيف الكرسي ، قم بتقييم المعلمات السلوكية التالية: أ) انبعاث أصوات قلقة أو مزعجة ، ب) رفض المكافأة المقدمة ، و ج) حركات عنيفة. إذا لوحظ أي من هذه السلوكيات ، فقم بإنهاء الجلسة لذلك اليوم ، مما يسمح للمارموسيت بالتكيف تدريجيا مع البيئة التجريبية.
7. تسجيل EEG (2 ساعة / يوم)
- إعداد الموضوع
- قم بتوصيل قفص نقل بنافذة صغيرة من قفص المنزل وانقل المرموسيت من قفص المنزل إلى قفص النقل ، عادة بمفرده. قم بتغطية قفص الحمل بقطعة قماش ونقله إلى الغرفة التجريبية.
- تثبيت الرأس
- التقاط marmoset باستخدام قفازات واقية ووضعها في كرسي خاص.
- ضع القناع المحضر على رأس المرموسيت. مرر جسم المسمار المتصل بالكرسي من خلال الفتحة الموجودة في القناع وقم بإصلاحه باستخدام مسامير الإبهام.
- ثبت الرأس والقناع برفق باستخدام شريط أسفل الصدر مباشرة.
ملاحظة: لم يكن رأس الشخص بحاجة إلى أن يكون ثابتا تماما طالما لم تتم إزالة الأقطاب الكهربائية عن طريق الحركة. لذلك ، استخدمنا نفس القناع في جميع المواد.
- تعريف موقع الأقطاب الكهربائية
- استخدم nasion و inion وشحمة الأذن كمعالم تشريحية لتحديد موقع الأقطاب الكهربائية وفقا للطريقة الدولية 10-2032،33،34،35،36،37. قم بقياس المسافة بين nasion و inion في خط المنتصف باستخدام شريط قياس. حدد موقع Cz في منتصف المسافة. ضع الأقطاب الكهربائية الأخرى (Fz أو Pz أو Oz أو F3 أو F4) مع 20٪ من طول النيون النيون كتباعد بين القطب. ضع علامة على مواضع القطب على فروة الرأس باستخدام جهاز تصوير الجلد القائم على الزيت.
- إعداد الجلد
- افركي المنطقة المحددة بقطعة قطن رقيقة مغموسة في الكحول المحمر لإزالة الأوساخ والزهم من فروة الرأس.
- إعدادات القطب
ملاحظة: قم بتنفيذ الخطوات من 7.2.1 إلى 7.2.3 في جميع مواضع الأقطاب الكهربائية لوضع الأقطاب الكهربائية في Fz و Cz و C3 و C4 و Pz و A1 و A2 و F3 (أو F4).- باستخدام قاطع الأنبوب ، قم بقطع قطعة من أنابيب السيليكون بقطر داخلي 4 مم وقطر خارجي 7 مم بطول 20 مم تقريبا.
- ضع مادة لاصقة على حواف الأنبوب المقطوع وألصقها بفروة الرأس.
- املأ الجزء الداخلي من الأنبوب بجل EEG باستخدام حقنة وإبرة حقنة غير مدببة.
- قم بتوصيل القطب المرجعي ب Pz والأقطاب الكهربائية الأرضية ب F3 أو F4 (الشكل 1C).
- أدخل أقطاب كهربائية في الأنبوب وقم بتوصيل كابل القطب بصندوق الإدخال.
- قم بتشغيل تطبيق تسجيلات EEG لقياس مقاومة القطب ، وضبط المعلمات للتأكد من أن جميع الأقطاب الكهربائية أقل من 5 كيلو أوم.
- قم بتجميع كابلات القطب لتقليل الضوضاء.
- أعط مكافآت أثناء إجراء تثبيت الرأس وبين جلسات العمل عن طريق إعطاء 1-3 مل يدويا من المكافأة السائلة (العلكة أو التغذية) باستخدام حقنة.
- حدد الملف المراد حفظه على برنامج تسجيل EEG واضغط على زر بدء التسجيل . قم بتشغيل البرنامج النصي لعرض التحفيز مباشرة بعد بدء تسجيل EEG. اضغط على زر الإيقاف في تسجيل EEG عند اكتمال تنفيذ البرنامج النصي لعرض التحفيز لإنهاء جميع التسجيلات. عند اكتمال التسجيل ، قم بإزالة الأقطاب الكهربائية وقناع الرأس.
- القبض على وإعادتها إلى أقفاص حملها. اترك الأنابيب على فروة الرأس. سقطت جميع الأنابيب بشكل طبيعي في حوالي 1 يوم.
ملاحظة: في الفترات المبكرة ، استخدمنا الأسيتون لإذابة الغراء اللاصق وإزالة الأنبوب بعد جلسات التسجيل ؛ ومع ذلك ، كانت هناك حالات إصابة جلدية. لذلك ، أعدنا بعد ذلك إلى أقفاصهم المنزلية دون إزالة الأنبوب. في عشرات التجارب التي أجريناها حتى الآن ، لم تظهر أي اهتمام بالأنابيب التي تمت إزالتها ، ولم يحدث أي ابتلاع عرضي على الإطلاق. - التحفيز
- سجل المكالمات الطبيعية البسيطة والمركبة في الغرفة الأسيرة أو التجريبية من marmosets التي لا تستخدم في تسجيلات EEG اللاحقة. قم باستخراج ثلاث مكالمات بسيطة ومركبة خاصة بالأنواع (مكالمات Phee و Tsik-Ek و Tsik-String5 ) من الملفات المسجلة.
- بالإضافة إلى محفزات الاتصال ، قم بإنشاء ضوضاء بيضاء باستخدام وظيفة في برنامج البرمجة واستخدمها كحافز.
- لاتباع هذا البروتوكول ، استخدم ثلاثة ملفات سمعية (16 بت ، 48 كيلو هرتز) لمكالمات marmoset في التجربة. التحكم في المهمة باستخدام برنامج نصي مخصص.
ملاحظة: تحتوي كل كتلة على 50 مكالمة لكل محفز ، ليصبح المجموع 200 مكالمة. ستستمر كل كتلة تسجيل حوالي 10 دقائق. يجب على كل مشارك أداء كتلتين. الفاصل الزمني بين المكالمات هو 3 ثوان. من بين ملفات التحفيز الصوتي الأربعة (انظر الملف التكميلي 1) ، كان طول حافز استدعاء Phee حوالي 2 ثانية ، بينما كان طول الثلاثة الأخرى حوالي 1 ثانية. كان هذا لأن مكالمة Phee واحدة لا تزال مكالمة طويلة الأمد (الشكل 1D). - في كل ملف تحفيز صوتي ، تحتوي القناة اليمنى على مكالمة marmoset أو بيانات الضوضاء ، وتحتوي القناة اليسرى على إشارة الزناد لبداية التحفيز. أرسل إشارة الزناد هذه إلى نظام تسجيل EEG عبر جهاز مزامنة وقم بتسجيلها كوقت للحدث.
8. تحليل البيانات
ملاحظة: تم استخدام الكود الأصلي المكتوب في برنامج البرمجة وصندوق الأدوات لمعالجة بيانات EEG ، كما هو موضح أدناه (الملف التكميلي 2) 37.
- تجهيزها
- إعادة الإشارة إلى مرجع الأذن المرتبط.
- مرشح الترددات العالية عند 2 هرتز.
- الحقبة من 100 مللي ثانية قبل إلى 1000 مللي ثانية بعد بداية التحفيز.
- خط الأساس الصحيح لمتوسط فترة التحفيز 100 مللي ثانية. رفض القطع الأثرية باستخدام معيار ±150 μV.
- تخطيط الإمكانات المتعلقة بالحدث (ERP)
- متوسط جميع بيانات التجربة لكل موضوع.
- احصل على أشكال موجية متوسطة للمجموعة عن طريق حساب متوسط جميع الموضوعات.
- لمقارنة متوسط ERPs بين أنواع المكالمات ومحفزات الضوضاء ، قم بتطبيق تحليل أحادي الاتجاه للتباين (ANOVA) مع المحفزات كعامل بين الموضوعات في استجابة Cz.
- تطبيق تحليل المقارنة المتعددة بعد مخصص مع طريقة توكي.
- تخطيط الاضطراب الطيفي المرتبط بالحدث (ERSP)
- احسب ERSP لتصور متوسط التغير المرتبط بالحدث في القدرة الطيفية بمرور الوقت في نطاق تردد واسع باستخدام المعادلة (1). Fk (f,t) هو التقدير الطيفي للتجربة k عند التردد f والوقت t:
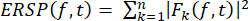 (1)
(1) - تطبيق تحلل التردد الزمني على الأنشطة باستخدام تحويلات المويجات الجيبية ، مع ثلاث دورات من الطول عند أدنى تردد (10 هرتز) ، وزيادة خطيا بتردد يصل إلى 32 دورة عند أعلى تردد (120 هرتز).
- حدد الاستجابات الأولية والعابرة في فترة 150 مللي ثانية بعد بداية التحفيز عند 2-30 هرتز ، والاستجابات المستمرة في فترة 800 مللي ثانية من 151 إلى 950 مللي ثانية بعد بداية التحفيز عند 40-100 ساعة.
- لاختبار الاختلافات في الاستجابات الأولية والمستدامة في Fz و Cz بين أعمار الموضوعات وأنواع المكالمات ، قم بإجراء ANOVA ثنائي الاتجاه باستخدام نوع المكالمة كعامل داخل الموضوع والأعمار كعامل بين الموضوع.
- احسب ERSP لتصور متوسط التغير المرتبط بالحدث في القدرة الطيفية بمرور الوقت في نطاق تردد واسع باستخدام المعادلة (1). Fk (f,t) هو التقدير الطيفي للتجربة k عند التردد f والوقت t:
النتائج
أولا ، رسمنا متوسط الإمكانات المرتبطة بالحدث (ERPs) لكل محفز سمعي في marmosets (الشكل 2). كانت الإمكانات السمعية المستثارة (AEP) بارزة في حالة الضوضاء ، مما يعكس البداية الواضحة للمنبهات (انظر الشكل 1 د). لمقارنة متوسط ERPs بين أنواع المكالمات ومحفزات الضوضاء ، قمنا...
Discussion
نقاط يجب ملاحظتها حول التخدير
تمت محاولة إعطاء كل من الكيتامين والزيلازين ، وعلى الرغم من أنها مسكنة وبالتالي مناسبة للمهام المؤلمة الطويلة ، تميل المرموسيت إلى تجربة انخفاض في مستويات الأكسجين في الدم دون استنشاق الأكسجين44. باختصار ، ربما يكون alfaxalon هو الأنسب للم...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل مشروع هاكوبي بجامعة كيوتو ، ومنحة المعونة للبحوث الصعبة (الرائدة) (رقم 22K18644) ، ومنحة المعونة للبحث العلمي (C) (رقم 22K12745) ، ومنحة المعونة للبحث العلمي (B) (رقم 21H02851) ، ومنحة المعونة للبحث العلمي (A) (رقم 19H01039). نود أن نشكر Editage (www.editage.jp) على تحرير اللغة الإنجليزية.
Materials
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
References
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved