このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
覚醒したマーモセットにおける脳波測定 同種の発声を聞く
要約
言語の進化を研究するためには、ヒトの脳のメカニズムとヒト以外の霊長類の脳のメカニズムを比較することが重要です。私たちは、覚醒状態の動物の脳波を非侵襲的に測定する方法を開発しました。これにより、人間と動物に害を与えることなく、長期的に人間と動物の脳波データを直接比較することができます。
要約
音声コミュニケーションは、霊長類の社会的相互作用、特に生存と社会組織において重要な役割を果たします。人間は、言語という形でユニークで高度な音声コミュニケーション戦略を開発しました。ヒトの言語の進化を研究するためには、ヒトの発声処理の根底にある神経メカニズムを解明するとともに、ヒト以外の霊長類と比較することで脳のメカニズムがどのように進化してきたのかを理解する必要があります。本研究では、覚醒状態にあるヒト以外の霊長類の脳波計(EEG)を非侵襲的に測定する方法を開発した。この記録方法により、動物を傷つけることなく長期的な研究が可能になるだけでなく、重要なことに、ヒト以外の霊長類の脳波データとヒトのデータを直接比較することができ、ヒトの言語の進化に関する洞察を得ることができます。本研究では、頭皮脳波記録法を用いて、マーモセットの種特異的な発声に対する脳活動を調査しました。この研究は、頭皮EEGを使用して、音声知覚中のマーモセットの広範な神経表現を捕捉することにより、新しい洞察を提供し、既存の知識のギャップを埋めます。
概要
霊長類は、種固有の発声を使用して、発信者の感情状態や社会的絆を維持する意図、捕食者の存在、またはその他の危険な状況など、生物学的に重要な情報を伝えます。発声が豊富な非ヒト霊長類の発声知覚の根底にある神経メカニズムの調査は、ヒト言語の進化的起源をよりよく理解するための重要な手がかりを提供する可能性があります。
コモンマーモセットは南アメリカ原産の小さな霊長類です。近年、マーモセットは、その高い再現性、小型化による使い勝手の良さ、有用なトランスジェニック技術の開発などから、マカクザルと並んでモデル動物として利用されることが増えている1,2,3。疾患モデルとしての有用性に加えて、グループ内の豊かな発声コミュニケーションは、この種の別のユニークな特徴です4,5,6,7。マーモセットは、森の見えない同種とコミュニケーションをとるために、日常的に音声信号を交換しています。マーモセットの発声知覚と発声に関与する脳活動を調べることで、マーモセットが脳内で自分自身または同種の鳴き声の聴覚情報をどのように処理しているかを特定し、どの神経回路が関与しているかを特定できます。これまでの研究では、マーモセットの発声に関与する一次聴覚野8,9,10,11,12および前頭皮質13,14の神経活動が実証されている。さらに、これらの興奮および抑制されたニューロン応答は、一次聴覚皮質8,10における聴覚-発声相互作用によって調節された。これらの研究は、侵襲的な記録方法を使用して、単一ニューロンレベルでの詳細な神経活動データを提供しました。マーモセットの発声に関与する神経活動については、数多くの研究がさらに調査されています。しかし、声の知覚は依然として十分に理解されていません15,16。
いくつかの非侵襲的脳イメージング研究により、マーモセットの発声処理の神経メカニズムが解明されました17,18,19;その高い空間分解能は利点ですが、スキャン中に動物を覚醒状態に保つには高度な技術が必要です。しかし、最近では、Jafariらは、機能的磁気共鳴画像法(fMRI)を用いて、覚醒状態のマーモセットの発声知覚に関与する前頭側頭領域を同定した19。ヒトの音声知覚や発声に関与する脳機能を解明するための実験は、ほとんどすべて、頭皮脳波計(EEG)、脳磁図(MEG)20,21、fMRI22,23,24などの非侵襲的な方法を用いて行われてきました。人間を対象とした数多くの研究で、EEGを使用して音声知覚に関連する脳活動が調査されています。これらの研究のほとんどは、感情情報25,26,27と感情的な言葉28の顕著性に焦点を当てており、その結果、音声知覚29における事象関連の可能性の変化が明らかになった。ヒトの頭蓋内埋め込み電極を用いた皮質電気検査(ECoG)および単一ニューロン記録は、脳神経外科治療を受けている患者を対象とした限られた数の実験でしか行われていない30,31。
人間とサルを比較する進化論的視点は、人間が発達した声の知覚と発声の根底にあるユニークな神経メカニズムを理解する上で重要です。マーモセットのような発声能力の高いヒト以外の霊長類の音声知覚と発声に関与する神経メカニズムをヒトと直接比較するには、同じ方法を使用して2つの種間のデータを比較することが重要です。機能的MRIは、全脳イメージングを可能にし、高い空間分解能を備えています。頭蓋骨に対して垂直な活動や、脳波やMEGでは記録が困難な深部での活動を記録できるという利点があります。ただし、MRI装置は設置と保守に費用がかかり、デバイスの性質上、提示できる刺激には多くの制限があります。これに対し、脳波、ERP(イベント関連電位)、MEGは時間分解能が高いため、時系列の音声処理の解析に有用です。特に、脳波は、高い移動性、さまざまな実験環境で使用できること、比較的低コストであること、そして1人のオペレーターで済むという利点があります。
ヒトでは既に大量の脳波データが得られているため、ヒト以外の霊長類に対しては、非侵襲的なパラダイムを用いた脳波測定法が求められています。私たちの研究グループは、マカクザルやマーモセットに対して、チューブ32を用いた独自の非侵襲的な脳波記録法を開発しました。ここでは、非ヒト霊長類33,34,35,36,37における聴覚処理に関するいくつかの新しい知見を報告する。マーモセットの種特異的な発声に対する脳活動の特徴を明らかにするために、頭皮に電極を装着して脳活動を非侵襲的に記録する実験系を構築しました。本研究では、マーモセットの脳波測定方法について述べる。
プロトコル
すべての実験は、EHUBの動物実験委員会(No.2022-003、2023-104)によって承認され、EHUBが発行した実験霊長類のケアと使用に関するガイドに従って実施されました。実験には、9種類の一般的なマーモセット(Callithrix jacchus、オス6匹、メス3匹、2〜12歳、体重330〜490g)を使用しました。
1. 動物たち
- マーモセットは、巣箱、木製の止まり木、その他の強化装置を備えた単一のケージに収容します。
- 部屋を12時間の明暗サイクルの下に維持し、温度と湿度をそれぞれ28±2°Cと40±20%に維持します。
- 動物に1日2回、アラビアガムやミールワームなどの食物を補給した新世界のサルペレット14gを与えます。 水を自由に提供します。
- 実験室の音響減衰ボックス内ですべての実験を行います。
2. 設備(図1B ・資料表)
- 4mmの銀電極を使用します。電極表面のAgClコーティングにより分極を防ぎ、安定した記録を実現します。
- 使用する amplifier脳波信号を記録するために。バンドパスフィルター(0.016-250Hz)を使用し、1,000Hzでデータをサンプリングします。
- 64チャンネルの電極入力ボックスをに接続します amplifier、被写体の前に置きます。
- スピーカーをマーモセットヘッドから30cm離して置き、耳の位置で測定したサウンドレベルを65〜75dBに制御します。このスピーカーを介して聴覚刺激を伝えます。
- カメラを被験者の前に置き、EEG記録中の被験者の状態を監視します。
- 霊長類の椅子はアクリル板と合成樹脂製の支柱で構成されています。実験では、研究者に動物をフットプレートに座らせます。このとき、ネックピースを差し込んでネックパネルに固定し、ウエストピースをウエストパネルに差し込んで固定します。各マーモセットの全身が緩く固定されていることを確認してください。
3.麻酔
- アルファキサロン(6-8 mg / kg)とアトロピン(0.05 mg / kg)の筋肉内注射で動物に麻酔をかけます。このプロトコルにより、麻酔を約20分間維持することができます。処置が長い場合は、麻酔の持続時間を延長するためにアルファキサロンを追加投与します。また、事前に制吐剤(マロピタント1mg/kg、皮下注射)を投与することで、アルファキサロンの副作用である吐き気を抑えてください。
注:マーモセットは、施術中は注射または吸入麻酔を受けている必要があり、剃毛後すぐに回復する必要があります。 - パルスオキシメータでバイタルをモニターし、必要に応じて酸素と空気の混合物(O2 0.5 L/min、空気0.5 L/min)を投与します。
- 室温を27°C以上に保ち、マーモセットの体に温めた布を巻き付けて低体温症を防ぎます。
4.脱毛
- 電気シェーバーで頭全体(耳介の後ろを含む)を剃ります。
- 敏感肌用の脱毛クリームを塗ります。5分後に濡れたガーゼでクリームを拭き取ります。
5. マスクの準備
- 熱可塑性マスクをモンキーチェアのサイズに合わせて事前に加工します。具体的には、背もたれの縦の長さからはみ出している部分を4つのネジ穴でドリルで開け、椅子の首プレートに固定できるようにします。
注:熱可塑性マスクは安全で、患者の放射線治療中に頭部を固定するために使用できます。子供用の小さなマスクを使用し、マーモセットのサイズに合わせてカットしました。このマスクは、75°Cの温水に入れると柔らかくなり、水から取り出すと温度が下がると固まります。 - 実験のために、動物を霊長類の椅子に置きます。麻酔をかけた動物を首と腰のプレートで支え、動物とこれらのプレートを椅子に固定します。
- マスクをお湯で温めてから、マーモセットの頭にフィットするように成形します。マスクを温水から取り出した後、火傷を防ぐために温度が下がるのを待って(約50°Cの範囲)、被験者の頭に置いてマスクを成形します。
- 冷却して硬化させた後、マスクを動物から取り外し、マスクの頭と耳の部分の上部を切り取り、電極設定の領域を露出させます。
注:このマスクが作成されると、他の人に使用できるようになりました。
6. 椅子とマスクの適応(3日間、1日30分)
- 動物を椅子に座らせ、約30分間ご褒美を与えることにより、動物を目覚めた状態で椅子に慣れさせます。この手順を3日間繰り返します。
- 動物をマスクを使用して2日間頭部固定に慣らします。
注:この適応プロセスは、個々の状態に合わせてカスタマイズされました。適応後、動物は捕獲やヘッドマスクの設定中に一時的に抵抗することがありますが、椅子に座って頭が固定されると、落ち着きます。 - 椅子の適応中に、次の行動パラメーターを評価します:i)不安または警戒心のある音の放出、ii)提供された報酬の拒否、およびiii)激しい動き。これらの挙動のいずれかが観察された場合は、その日のセッションを終了し、マーモセットが実験環境に徐々に適応できるようにします。
7. 脳波記録(2時間/日)
- 課題の準備
- ホームケージの小さな窓にトランスファーケージを取り付け、通常は単独でマーモセットをホームケージからトランスファーケージに移動します。キャリングケージを布で覆い、実験室に移します。
- 頭部固定
- 保護手袋を使用してマーモセットを捕獲し、専用の椅子に置きます。
- 用意したマスクをマーモセットの頭にのせます。椅子に取り付けられているネジ本体をマスクの穴に通し、つまみネジで固定します。
- 頭を固定し、鼻のすぐ下のバンドで軽くマスクします。
注:電極が動きによって取り外されない限り、被験者の頭部を完全に固定する必要はありませんでした。そのため、すべての被写体で同じマスクを使用しました。
- 電極の位置の定義
- 鼻腔、イニオン、耳たぶを解剖学的ランドマークとして使用して、International 10-20法32,33,34,35,36,37に従って電極の位置を決定します。正中線のナシオンとイニオンの間の距離を巻尺で測定します。距離の中央にある Cz の位置を定義します。他の電極(Fz、Pz、Oz、F3、またはF4)を、電極間隔としてinion-neion長の20%に配置します。油性ダーマトグラフを使用して頭皮の電極位置に印を付けます。
- 皮膚の準備
- マークした部分を消毒用アルコールに浸した細い綿棒でこすり、頭皮の汚れや皮脂を取り除きます。
- 電極設定
注意: すべての電極位置で手順7.2.1〜7.2.3を実行して、Fz、Cz、C3、C4、Pz、A1、A2、およびF3(またはF4)に電極を配置します。- チューブカッターを使用して、内径4 mm、外径7 mmのシリコンチューブを約20 mmの長さに切断します。
- カットしたチューブの端に接着剤を塗布し、頭皮に接着します。
- シリンジと先の尖っていないシリンジ針を使用して、チューブの内側にEEGゲルを充填します。
- 参照電極をPzに接続し、接地電極をF3またはF4に接続します(図1C)。
- 電極をチューブに挿入し、電極ケーブルを入力ボックスに接続します。
- EEG記録のアプリケーションを起動して電極インピーダンスを測定し、すべての電極が5kΩ未満になるようにパラメータを調整します。
- 電極ケーブルを束ねてノイズを減らします。
- 頭部固定手順中およびタスクセッションの合間に、注射器を使用して1〜3mLの液体報酬(ガムまたは栄養)を手動で投与することにより、報酬を与えます。
- EEG記録ソフトウェアに保存するファイルを指定し、 録音開始 ボタンを押します。EEG記録が開始された直後に、刺激提示のスクリプトを実行します。刺激提示スクリプトの実行が完了したら、EEG記録の 停止 ボタンを押して、すべての記録を終了します。録音が完了したら、電極とヘッドマスクを取り外します。
- 動物を捕まえて、キャリーケージに戻します。チューブを頭皮に残します。約1日ですべてのチューブが自然に抜け落ちました。
注:初期の段階では、アセトンを使用して接着接着剤を溶解し、録音セッション後にチューブを取り外しました。しかし、皮膚に損傷を与えるケースもありました。そのため、その後、チューブを抜かずに動物を自宅のケージに戻しました。これまでに数十回の実験を行ってきましたが、取り出したチューブにマーモセットは興味を示さず、誤飲も一度も発生していません。 - 刺激
- キャプティブルームまたは実験室で、その後のEEG録音で使用されないマーモセットからの自然で単純な通話と複合的な通話を録音します。記録されたファイルから、3 つの種固有の単純呼び出しと複合呼び出し (Phee、Tsik-Ek、 および Tsik-String5 呼び出し) を抽出します。
- コール刺激に加えて、プログラミングソフトウェアの機能を使用してホワイトノイズを作成し、それを刺激として使用します。
- このプロトコルに従うには、実験でマーモセットの鳴き声の3つの聴覚ファイル(16ビット、48kHz)を使用します。カスタムスクリプトを使用してタスクを制御します。
注:各ブロックには、各刺激に対して50のコール、合計200のコールが含まれています。各録画ブロックは約10分間続きます。各参加者は2つのブロックを実行する必要があります。インターコール間隔は 3 秒です。4つの音声刺激ファイル( 補足ファイル1参照)のうち、 Phee コール刺激の長さは約2秒であったのに対し、他の3つの音声刺激の長さは約1秒であった。これは、1 回の Phee コールが依然として長時間続くコールであるためです(図 1D)。 - 各サウンド刺激ファイルでは、右のチャンネルにはマーモセットの鳴き声またはノイズデータが含まれ、左のチャンネルには刺激の開始のトリガー信号が含まれます。このトリガー信号を同期装置を介して脳波記録システムに送信し、イベント時間として記録します。
8. データ分析
注:プログラミングソフトウェアとツールボックスに記述された元のコードは、以下に概説するようにEEGデータの後処理に使用されました(補足ファイル2)37。
- 前処理
- リンクされたイヤーリファレンスに再度参照します。
- 2Hzのハイパスフィルター。
- 刺激開始の100ms前から1000ms後までのエポック。
- 100 ミリ秒の刺激前期間の平均にベースライン補正します。±150 μV の基準を使用してアーティファクトをリジェクトします。
- イベント関連電位 (ERP) のプロット
- 各被験者のすべての試行データを平均化します。
- すべての被験者を平均化することにより、グループ平均化された波形を取得します。
- 通話タイプとノイズ刺激の平均ERPを比較するには、Cz応答の被験者間因子として刺激を使用した一元配置分散分析(ANOVA)を適用します。
- テューキーの方法による事後多重比較分析を適用します。
- イベント関連スペクトル摂動(ERSP)のプロット
- 式 (1) を使用して、広い周波数範囲でのスペクトル パワーの時間経過に伴う平均イベント関連の変化を視覚化するために ERSP を計算します。 Fk (f,t) は、周波数 f と時間 t における試行 k のスペクトル推定値です。
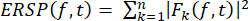 (1)
(1) - 正弦波ウェーブレット変換を使用して、最小周波数 (10 Hz) で 3 サイクルの長さで、最高周波数 (120 Hz) で周波数 32 サイクルまで線形に増加する、正弦波ウェーブレット変換を使用してアクティビティに時間-周波数分解を適用します。
- 2〜30 Hzでの刺激開始後150ミリ秒の初期応答と過渡応答、および40〜100時間での刺激開始後151〜950ミリ秒の800ミリ秒期間の持続応答を定義します。
- 被験者の年齢と通話タイプ間でのFzとCzの初期応答と持続応答の違いをテストするには、被験者内因子として通話タイプを使用し、被験者間因子として 年齢 を使用して二元配置分散分析を実行します。
- 式 (1) を使用して、広い周波数範囲でのスペクトル パワーの時間経過に伴う平均イベント関連の変化を視覚化するために ERSP を計算します。 Fk (f,t) は、周波数 f と時間 t における試行 k のスペクトル推定値です。
結果
まず、マーモセットの各聴覚刺激の平均イベント関連電位(ERP)をプロットしました(図2)。聴覚誘発電位(AEP)は 、刺激 の明確な開始を反映して、ノイズ条件で顕著でした( 図1Dを参照)。通話タイプとノイズ刺激の平均ERPを比較するために、Cz応答の被験者間因子として刺激を使用した一元配置分散分析(ANOVA)を適用しました。刺激開始後13-18 ms、...
ディスカッション
麻酔の注意点
ケタミンとキシラジンの両方の投与が試みられており、これらは鎮痛剤であり、したがって長時間の痛みを伴う作業に適していますが、マーモセットは酸素吸入なしで血中酸素レベルの低下を経験する傾向があります44。要するに、アルファキサロンは、シェービングやマスク作りなど、痛みのない作業に最も適しているのではないでしょうか?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
本研究は、京都大学白眉プロジェクト、科学研究費補助金挑戦的研究(開拓)(課題22K18644)、科学研究費基盤研究(C)(課題22K12745)、基盤研究(B)(課題番号21H02851)、科学研究費基盤研究(A)(課題番号19H01039)の支援を受けて行われました。英語の編集をしてくださった エディテージ (www.editage.jp)に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
参考文献
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved