Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Электроэнцефалографические измерения у бодрствующих игрунок, слушающих конвидовые вокализации
В этой статье
Резюме
Для изучения эволюции языка важно сравнить механизмы работы мозга человека с механизмами работы мозга у приматов. Мы разработали метод неинвазивного измерения электроэнцефалографии (ЭЭГ) у бодрствующих животных. Это позволяет нам напрямую сравнивать данные ЭЭГ между людьми и животными в долгосрочной перспективе, не причиняя им вреда.
Аннотация
Голосовая коммуникация играет решающую роль в социальных взаимодействиях приматов, особенно в выживании и социальной организации. Люди разработали уникальную и продвинутую стратегию голосовой коммуникации в форме языка. Чтобы изучить эволюцию человеческого языка, необходимо исследовать нейронные механизмы, лежащие в основе обработки голоса у человека, а также понять, как развивались механизмы мозга, сравнивая их с таковыми у нечеловекообразных приматов. В данной работе мы разработали метод неинвазивного измерения электроэнцефалографии (ЭЭГ) бодрствующих нечеловекообразных приматов. Этот метод записи позволяет проводить долгосрочные исследования без вреда для животных и, что важно, позволяет нам напрямую сравнивать данные ЭЭГ приматов с данными человека, что дает представление об эволюции человеческого языка. В данном исследовании мы использовали метод записи ЭЭГ кожи головы для изучения активности мозга в ответ на видоспецифичные вокализации у мартышек. Это исследование дает новые идеи за счет использования ЭЭГ кожи головы для захвата широко распространенных нейронных представлений у мартышек во время голосового восприятия, заполняя пробелы в существующих знаниях.
Введение
Приматы используют видоспецифичные вокализации для передачи биологически важной информации, такой как эмоциональное состояние звонящего или намерение поддерживать социальные связи, присутствие хищников или другие опасные ситуации. Исследование нейронных механизмов, лежащих в основе восприятия вокализации у богатых голосом нечеловекообразных приматов, может дать нам важные ключи к лучшему пониманию эволюционного происхождения человеческого языка.
Обыкновенные игрунки – это небольшие приматы, обитающие в Южной Америке. В последние годы мартышки все чаще используются в качестве модельных животных, наряду с макаками, из-за их высокой репродуктивности, простоты использования благодаря их небольшому размеру и развития полезных трансгенных методов 1,2,3. В дополнение к их полезности в качестве моделей заболеваний, богатая голосовая коммуникация в группах является еще одной уникальной характеристикой этого вида 4,5,6,7. Мартышки регулярно обмениваются голосовыми сигналами для общения с невидимыми сородичами в лесу. Изучая мозговую активность, участвующую в вокальном восприятии и производстве у мартышек, мы можем определить, как они обрабатывают слуховую информацию своих собственных или родственных звуков в мозге, и определить, какие нейронные цепи задействованы. Предыдущие исследования продемонстрировали нейронную активность в первичной слуховой коре 8,9,10,11,12 и лобной коре 13,14, участвующих в производстве вокала у мартышек. Кроме того, эти возбужденные и подавленные нейронные реакции модулировались слухово-вокальными взаимодействиями в первичной слуховой коре 8,10. Эти исследования предоставили подробные данные о нейронной активности на уровне одного нейрона с использованием инвазивных методов записи. Многочисленные исследования дополнительно изучили нейронную активность, участвующую в производстве голоса мартышки; Тем не менее, вокальное восприятие остается плохо изученным15,16.
Несколько неинвазивных исследований визуализации мозга пролили свет на нейронные механизмы обработки голоса у мартышек 17,18,19; Их высокое пространственное разрешение является преимуществом, однако поддержание животных в бодрствующем состоянии во время сканирования требует передовых технологий. Однако совсем недавно Jafari et al. идентифицировали лобно-височные области, участвующие в голосовом восприятии у бодрствующих мартышек, с помощью функциональной магнитно-резонансной томографии (фМРТ)19. Почти все эксперименты по выяснению функций мозга, участвующих в восприятии и воспроизведении голоса у человека, проводились с использованием неинвазивных методов, таких как электроэнцефалография скальпа (ЭЭГ), магнитоэнцефалография (МЭГ)20,21 и фМРТ 22,23,24. Многочисленные исследования на людях изучали активность мозга, связанную с голосовым восприятием с помощью ЭЭГ. Большинство этих исследований были сосредоточены на эмоциональной информации 25,26,27 и значимости эмоциональных слов28, при этом результаты выявили изменения в потенциалах, связанных с событиями, во время вокального восприятия29. Электрокортикография (ЭКоГ) и запись однонейронов с использованием внутричерепно имплантированных электродов у людей проводились только в ограниченном числе экспериментов у пациентов, проходящих нейрохирургическое лечение30,31.
Эволюционная перспектива, сравнивающая людей с обезьянами, важна для понимания уникальных нейронных механизмов, лежащих в основе восприятия и производства голоса, которые развились у людей. Чтобы напрямую сравнить нейронные механизмы, участвующие в восприятии речи и вокализации у богатых голосом приматов, таких как мартышки, с людьми, важно сравнить данные между двумя видами с использованием одного и того же метода. Функциональная МРТ позволяет визуализировать весь мозг и имеет высокое пространственное разрешение. Его преимущество заключается в том, что он регистрирует активность перпендикулярно черепу или в глубоких областях, которые трудно зарегистрировать с помощью ЭЭГ или МЭГ. Тем не менее, аппарат МРТ дорог в установке и обслуживании, и существует множество ограничений на стимулы, которые могут быть предъявлены из-за особенностей устройства. Для сравнения, ЭЭГ, потенциалы, связанные с событиями (ERPs) и МЭГ имеют высокое временное разрешение, что делает их полезными для анализа обработки голоса во временных рядах. В частности, ЭЭГ обладает такими преимуществами, как высокая мобильность и возможность использования в различных экспериментальных условиях, относительно низкая стоимость и потребность всего в одном операторе.
Поскольку на людях уже получен большой объем данных ЭЭГ, для нечеловекообразных приматов необходимы методы измерения ЭЭГ с использованием неинвазивных парадигм. Наша исследовательская группа разработала уникальный неинвазивный метод записи ЭЭГ с использованием трубок32 для макак и мартышек. Здесь мы сообщаем о нескольких новых открытиях относительно обработки слуховой информации у нечеловекообразных приматов 33,34,35,36,37. Чтобы охарактеризовать активность мозга в ответ на видоспецифичные вокализации у мартышек, мы создали экспериментальную систему для неинвазивной регистрации активности мозга с помощью электродов, размещенных на коже головы. В данном исследовании мы описываем метод измерения ЭЭГ для мартышек.
протокол
Все эксперименты были одобрены Комитетом по экспериментам на животных EHUB (No.2022-003, 2023-104) и проведены в соответствии с Руководством по уходу и использованию лабораторных приматов, опубликованным EHUB. Для эксперимента использовали девять обыкновенных игрунок (Callithrix jacchus, шесть самцов и три самки, 2-12 лет, массой 330-490 г).
1. Животные
- Размещайте мартышек в одиночных клетках, оборудованных скворечниками, деревянными насестами и другими приспособлениями для обогащения.
- Поддерживайте в помещениях 12-часовой цикл свет-темнота, при этом температура и влажность поддерживались на уровне 28 ± 2 °C и 40 ± 20% соответственно.
- Кормите животных 14 г обезьяньих гранул Нового Света два раза в день, дополняя их такими кормами, как гуммиарабик и мучные черви. Обеспечьте водой в неограниченном количестве.
- Проведите все эксперименты в звукоизолированной коробке в экспериментальной комнате.
2. Оборудование (рисунок 1Б и таблица материалов)
- Используйте серебряные электроды диаметром 4 мм. Покрытие AgCl на поверхности электрода предотвращает поляризацию и обеспечивает стабильную запись.
- Используйте усилитель для записи сигналов ЭЭГ. Полосовой фильтр (0,016-250 Гц) и выборка данных с частотой 1 000 Гц.
- Подключите к усилителю 64-канальную входную коробку электродов, расположив ее перед объектом.
- Расположите колонку на расстоянии 30 см от головы мартышки и контролируйте уровень звука на уровне 65-75 дБ, измеренный в положении уха. Подавайте слуховые стимулы через этот динамик.
- Поместите камеру перед объектом съемки, чтобы контролировать его состояние во время записи ЭЭГ.
- Стул примата изготовлен из акриловых пластин и штифтов из синтетической смолы. Для экспериментов попросите исследователя держать животных, когда они сидят на подножке; На этом этапе вставьте ожерелье и закрепите его на шейной панели, а также вставьте и закрепите поясную часть на поясной панели. Убедитесь, что все тело каждой мартышки закреплено неплотно.
3. Анестезия
- Обезболивают животных внутримышечными инъекциями алфаксолона (6-8 мг/кг) и атропина (0,05 мг/кг). Этот протокол позволяет поддерживать анестезию в течение примерно 20 минут. Введите дополнительные дозы Алфаксолона, чтобы продлить продолжительность анестезии, если процедура более длительная. Также предварительно введите противорвотные средства (маропитант 1 мг/кг, подкожное введение) для борьбы с тошнотой, которая является побочным эффектом алфаксолона.
ПРИМЕЧАНИЕ: Мартышки должны находиться под инъекционной или ингаляционной анестезией во время процедур и должны восстановиться сразу после бритья волос. - Контролируйте жизненно важные показатели с помощью пульсоксиметра и при необходимости вводите кислородно-воздушную смесь (O2 0,5 л/мин, воздух 0,5 л/мин).
- Поддерживайте температуру в помещении выше 27 °C, а вокруг тела мартышки оберните согревающую ткань, чтобы предотвратить переохлаждение.
4. Эпиляция
- Побрейте всю голову (в том числе за ушной раковиной) электробритвой.
- Нанесите крем для удаления волос для чувствительной кожи. Сотрите крем влажной марлей через 5 минут.
5. Подготовка маски
- Заранее обработайте термопластичную маску, чтобы она подходила по размеру к обезьяньему креслу. В частности, просверлите часть спинки, выступающую из вертикальной длины стула, с четырьмя отверстиями для винтов, чтобы ее можно было закрепить на шейной пластине стула.
ПРИМЕЧАНИЕ: Термопластичные маски безопасны и могут использоваться для иммобилизации головы во время лучевой терапии у пациентов. Мы использовали небольшую маску, предназначенную для детей, и вырезали ее по размеру мартышек. Эта маска размягчается при помещении в теплую воду при температуре 75 °C и затвердевает при снижении температуры при извлечении из воды. - Для проведения экспериментов посадите животных в кресло примата. Поддержите животное, находящееся под наркозом, с помощью пластин для шеи и талии и закрепите животное и эти пластины на стуле.
- Нагрейте маску в горячей воде, а затем сформируйте ее по размеру головы мартышки. Вынув маску из теплой воды, дождитесь снижения температуры (примерно в диапазоне 50 °C), чтобы предотвратить ожоги, а затем наденьте ее на голову субъекта, чтобы слепить маску.
- После охлаждения и затвердевания отсоедините маску от животного и вырежьте верхнюю часть головы и ушные части маски, чтобы обнажить область для установки электрода.
ПРИМЕЧАНИЕ: Как только эта маска была изготовлена, ее можно было использовать на других людях.
6. Адаптация кресла и маски (30 мин/день в течение 3 дней)
- Приучите животное к стулу в бодрствующем состоянии, посадив его на стул и вознаграждая его в течение примерно 30 минут. Повторяйте эту процедуру в течение 3 дней.
- Приучайте животное к фиксации головы с помощью маски в течение 2 дней.
ПРИМЕЧАНИЕ: Этот процесс адаптации был адаптирован к состоянию человека. После адаптации животные могут временно сопротивляться во время отлова и надевания маски, но как только они садятся в кресло и их голова фиксируется, они становятся спокойными. - Во время адаптации к креслу оценивайте следующие поведенческие параметры: i) издание тревожных или тревожных шумов, ii) отказ от предложенного вознаграждения и iii) резкие движения. Если наблюдается какое-либо из этих поведений, прекратите сеанс на этот день, позволив мартышке постепенно адаптироваться к экспериментальной среде.
7. Запись ЭЭГ (2 ч/день)
- Предметная подготовка
- Прикрепите клетку для переноса к небольшому окну домашней клетки и переместите мартышку из домашней клетки в клетку для переноса, обычно в одиночку. Накройте клетку для переноски тканью и перенесите ее в экспериментальное помещение.
- Фиксация головы
- Поймайте мартышку с помощью защитных перчаток и поместите ее в специальное кресло.
- Наденьте подготовленную маску на голову мартышки. Проденьте винтовой корпус, прикрепленный к креслу, через отверстие в маске и зафиксируйте его винтами с накатанной головкой.
- Закрепите голову и слегка замаскируйте лентой чуть ниже носа.
ПРИМЕЧАНИЕ: Голову испытуемого не нужно было полностью фиксировать, если электроды не удалялись движением. Поэтому мы использовали одну и ту же маску для всех объектов.
- Определение расположения электродов
- Используйте назой, инион и мочки ушей в качестве анатомических ориентиров для определения расположения электродов по методу International 10-20 32,33,34,35,36,37. Измерьте расстояние между насионом и инионом по средней линии с помощью рулетки. Определите местоположение Cz в середине расстояния. Расположите другие электроды (Fz, Pz, Oz, F3 или F4) так, чтобы расстояние между электродами составляло 20% от длины инион-нейон. Отметьте положение электродов на коже головы с помощью дерматографа на масляной основе.
- Подготовка кожи
- Разотрите отмеченный участок тонким ватным тампоном, смоченным в медицинском спирте, чтобы удалить грязь и кожный жир с кожи головы.
- Настройка электродов
ПРИМЕЧАНИЕ: Выполните шаги 7.2.1-7.2.3 во всех положениях электродов, чтобы разместить электроды в точках Fz, Cz, C3, C4, Pz, A1, A2 и F3 (или F4).- С помощью труборезов отрежьте кусок силиконовой трубки с внутренним диаметром 4 мм и внешним диаметром 7 мм на длину примерно 20 мм.
- Нанесите клей на края отрезанной трубки и приклейте его к коже головы.
- Заполните внутреннюю часть трубки гелем ЭЭГ с помощью шприца и иглы шприца без заострения.
- Подсоедините электрод сравнения к Pz, а заземляющие электроды к F3 или F4 (Рисунок 1C).
- Вставьте электроды в трубку и подключите электродный кабель к входной коробке.
- Запустите приложение для записи ЭЭГ для измерения импеданса электродов и отрегулируйте параметры, чтобы убедиться, что все электроды имеют сопротивление ниже 5 кОм.
- Соедините электродные кабели в пучок для снижения шума.
- Давайте вознаграждение во время процедуры иммобилизации головы и между сеансами выполнения заданий, вручную вводя 1-3 мл жидкого вознаграждения (жевательной резинки или питания) с помощью шприца.
- Укажите файл, который необходимо сохранить в программе для записи ЭЭГ, и нажмите кнопку « Начать запись ». Запустите сценарий предъявления стимула сразу после начала записи ЭЭГ. Нажмите кнопку «Стоп » на записи ЭЭГ, когда выполнение сценария презентации стимула будет завершено, чтобы завершить все записи. Когда запись будет завершена, снимите электроды и маску для головы.
- Ловите животных и возвращайте их в клетки для переноски. Оставьте трубки на коже головы; Все трубки отпали естественным путем примерно за 1 день.
ПРИМЕЧАНИЕ: В ранние периоды мы использовали ацетон для растворения клеевого клея и удаления трубки после сессий записи; Однако были случаи травмирования кожи; Поэтому впоследствии мы вернули животных в домашние клетки, не снимая трубку. В десятках экспериментов, которые мы провели до сих пор, мартышки не проявили никакого интереса к удаленным трубкам, и ни разу не произошло случайного проглатывания. - Стимул
- Записывайте естественные простые и сложные крики в невольной или экспериментальной комнате от мартышек, которые не используются в последующих записях ЭЭГ. Извлеките три видоспецифичных простых и составных крика (Phee, Tsik-Ek и Tsik-String5 ) из записанных файлов.
- В дополнение к сигнальным стимулам создайте белый шум с помощью функции в программном обеспечении и используйте его в качестве стимула.
- Чтобы следовать этому протоколу, используйте в эксперименте три звуковых файла (16 бит, 48 кГц) звуков мартышек. Управляйте задачей с помощью пользовательского скрипта.
ПРИМЕЧАНИЕ: Каждый блок содержит 50 вызовов для каждого стимула, всего 200 вызовов. Каждый блок записи будет длиться примерно 10 минут. Каждый участник должен выполнить два блока. Интервал между вызовами составляет 3 с. Из четырех файлов звуковых стимулов (см. Дополнительный файл 1) сигнальный стимул Phee был длиной примерно 2 с, в то время как остальные три имели длину примерно 1 с. Это произошло потому, что один крик Phee по-прежнему является длительным (рис. 1D). - В каждом файле звукового стимула правый канал содержит данные о крике или шуме мартышки, а левый канал содержит сигнал запуска для начала действия стимула. Отправьте этот сигнал запуска в систему регистрации ЭЭГ через устройство синхронизации и запишите его как время события.
8. Анализ данных
ПРИМЕЧАНИЕ: Оригинальный код, написанный в программном обеспечении и наборе инструментов для программирования, был использован для постобработки данных ЭЭГ, как описано ниже (Дополнительный файл 2)37.
- Предварительная обработка
- Повторная ссылка на привязанный артикул уха.
- Фильтр верхних частот на частоте 2 Гц.
- Эпоха от 100 мс до 1000 мс после появления стимула.
- Исходный уровень — скорректирован до среднего значения 100-миллисекундного периода до стимула. Отбраковка артефактов по критерию ±150 мкВ.
- Построение графиков потенциала, связанного с событиями (ERP)
- Усредните все данные испытаний по каждому субъекту.
- Получение усредненных по группе осциллограмм путем усреднения всех объектов.
- Чтобы сравнить усредненные ERP между типами вызовов и шумовыми стимулами, примените односторонний дисперсионный анализ (ANOVA) со стимулами в качестве межсубъектного фактора в ответе Cz.
- Примените апостериорный множественный сравнительный анализ с помощью метода Тьюки.
- Построение графиков спектральных возмущений, связанных с событиями (ERSP)
- Рассчитайте ERSP для визуализации среднего изменения спектральной мощности с течением времени в широком диапазоне частот с помощью уравнения (1). Fk (f,t) — спектральная оценка испытания k на частоте f и в момент времени t:
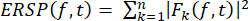 (1)
(1) - Примените частотно-временную декомпозицию к упражнениям с использованием синусоидальных вейвлет-преобразований, с тремя циклами длины на самой низкой частоте (10 Гц), линейно увеличивающейся с частотой до 32 циклов на самой высокой частоте (120 Гц).
- Определите начальную и переходную реакцию в период 150 мс после появления стимула при частоте 2–30 Гц, а устойчивую реакцию — в период 800 мс от 151 до 950 мс после начала стимула при частоте 40–100 Гц.
- Чтобы проверить различия в начальных и устойчивых ответах в Fz и Cz между возрастами испытуемых и типами вызовов, выполните двустороннюю ANOVA с использованием типа вызова в качестве внутрисубъектного фактора и возраста в качестве межсубъектного фактора.
- Рассчитайте ERSP для визуализации среднего изменения спектральной мощности с течением времени в широком диапазоне частот с помощью уравнения (1). Fk (f,t) — спектральная оценка испытания k на частоте f и в момент времени t:
Результаты
Во-первых, мы построили график средних потенциалов, связанных с событиями (ERP) для каждого слухового стимула у мартышек (рис. 2). Слуховой вызванный потенциал (AEP) был заметен в состоянии шума , отражая четкое начало стимулов (см. рисунок 1D). Чтобы сравнит...
Обсуждение
На что следует обратить внимание при анестезии
Были предприняты попытки введения как кетамина, так и ксилазина, и хотя они являются обезболивающими и поэтому подходят для длительных болезненных задач, мартышки, как правило, испытывают снижение уровня кислорода в крови без
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана проектом Хакуби Киотского университета, Грант на сложные исследования (пионерство) (No 22K18644), Грант на научные исследования (C) (No 22K12745), Грант на научные исследования (B) (No 21H02851) и Грант на научные исследования (A) (No 19H01039). Мы хотели бы поблагодарить Editage (www.editage.jp) за редактирование на английском языке.
Материалы
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
Ссылки
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены