Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mediciones electroencefalográficas en titíes despiertos escuchando vocalizaciones conespecíficas
En este artículo
Resumen
Para estudiar la evolución del lenguaje, es importante comparar los mecanismos cerebrales de los humanos con los de los primates no humanos. Desarrollamos un método para medir de forma no invasiva la electroencefalografía (EEG) de animales despiertos. Nos permite comparar directamente los datos de EEG entre humanos y animales a largo plazo sin dañarlos.
Resumen
La comunicación vocal juega un papel crucial en las interacciones sociales de los primates, particularmente en la supervivencia y la organización social. Los seres humanos han desarrollado una estrategia de comunicación vocal única y avanzada en forma de lenguaje. Para estudiar la evolución del lenguaje humano, es necesario investigar los mecanismos neuronales que subyacen al procesamiento vocal en los humanos, así como comprender cómo han evolucionado los mecanismos cerebrales comparándolos con los de los primates no humanos. En este trabajo, desarrollamos un método para medir de forma no invasiva la electroencefalografía (EEG) de primates no humanos despiertos. Este método de registro permite realizar estudios a largo plazo sin dañar a los animales y, lo que es más importante, nos permite comparar directamente los datos de EEG de primates no humanos con los datos humanos, lo que proporciona información sobre la evolución del lenguaje humano. En el estudio actual, utilizamos el método de registro de EEG del cuero cabelludo para investigar la actividad cerebral en respuesta a vocalizaciones específicas de la especie en titíes. Este estudio proporciona nuevos conocimientos mediante el uso de EEG del cuero cabelludo para capturar representaciones neuronales generalizadas en titíes durante la percepción vocal, llenando los vacíos en el conocimiento existente.
Introducción
Los primates utilizan vocalizaciones específicas de cada especie para transmitir información biológicamente importante, como el estado emocional de la persona que llama o su intención de mantener los lazos sociales, la presencia de depredadores u otras situaciones peligrosas. La investigación de los mecanismos neuronales que subyacen a la percepción de la vocalización en primates no humanos ricos en voz puede proporcionarnos pistas críticas para comprender mejor los orígenes evolutivos del lenguaje humano.
Los titíes comunes son pequeños primates nativos de América del Sur. En los últimos años, los titíes han sido cada vez más utilizados como animales modelo, junto con los monos macacos, debido a su alta reproductividad, facilidad de uso debido a su pequeño tamaño y el desarrollo de técnicas transgénicas útiles 1,2,3. Además de su utilidad como modelos de enfermedades, la rica comunicación vocal dentro de los grupos es otra característica única de esta especie 4,5,6,7. Los titíes intercambian señales vocales de forma rutinaria para comunicarse con congéneres invisibles en el bosque. Al examinar la actividad cerebral involucrada en la percepción y producción vocal en los titíes, podemos determinar cómo procesan la información auditiva de sus propias llamadas o llamadas conespecíficas en el cerebro e identificar qué circuitos neuronales están involucrados. Estudios previos han demostrado actividad neuronal en la corteza auditiva primaria 8,9,10,11,12 y la corteza frontal13,14 involucrada en la producción vocal en titíes. Además, estas respuestas neuronales excitadas y suprimidas fueron moduladas por interacciones auditivo-vocales en la corteza auditiva primaria 8,10. Estos estudios proporcionaron datos detallados de la actividad neuronal a nivel de una sola neurona utilizando métodos de registro invasivos. Numerosos estudios han examinado más a fondo la actividad neuronal implicada en la producción vocal de los titíes; Sin embargo, la percepción vocal sigue siendo poco conocida15,16.
Varios estudios de imagen cerebral no invasivos han dilucidado los mecanismos neuronales del procesamiento vocal en titíes 17,18,19; Su alta resolución espacial es una ventaja, sin embargo, mantener a los animales en estado despierto durante el escaneo requiere técnicas avanzadas. Sin embargo, más recientemente, Jafari et al. identificaron regiones frontotemporales implicadas en la percepción vocal en titíes despiertos utilizando imágenes de resonancia magnética funcional (fMRI)19. Casi todos los experimentos para dilucidar las funciones cerebrales involucradas en la percepción y producción vocal en humanos se han realizado utilizando métodos no invasivos, como la electroencefalografía (EEG) del cuero cabelludo, la magnetoencefalografía (MEG)20,21 y la fMRI 22,23,24. Numerosos estudios en humanos han investigado la actividad cerebral relacionada con la percepción vocal mediante EEG. La mayoría de estos estudios se han centrado en la información emocional 25,26,27 y en la prominencia de las palabras emocionales28, y los resultados revelan cambios en los potenciales relacionados con eventos durante la percepción vocal 29. La electrocorticografía (ECoG) y los registros de una sola neurona utilizando electrodos implantados intracranealmente en humanos solo se han realizado en un número limitado de experimentos en pacientes sometidos a tratamiento neuroquirúrgico30,31.
Una perspectiva evolutiva que compare a los humanos con los monos es importante para comprender los mecanismos neuronales únicos que subyacen a la percepción y producción vocal que se han desarrollado en los humanos. Para comparar directamente los mecanismos neuronales implicados en la percepción del habla y la vocalización de primates no humanos ricos en voz, como el tití, con los humanos, es importante comparar los datos entre las dos especies utilizando el mismo método. La resonancia magnética funcional permite obtener imágenes de todo el cerebro y tiene una alta resolución espacial. Tiene la ventaja de registrar la actividad perpendicular al cráneo o en regiones profundas que son difíciles de registrar con EEG o MEG. Sin embargo, la máquina de resonancia magnética es costosa de instalar y mantener, y existen muchas restricciones sobre los estímulos que se pueden presentar debido a la naturaleza del dispositivo. En comparación, el EEG, los potenciales relacionados con eventos (ERP) y el MEG tienen una alta resolución temporal, lo que los hace útiles para analizar el procesamiento vocal de series temporales. En particular, el EEG tiene las ventajas de una alta movilidad y la capacidad de ser utilizado en una variedad de entornos experimentales, un costo relativamente bajo y el requisito de un solo operador.
Dado que ya se ha obtenido una gran cantidad de datos de EEG en humanos, se necesitan métodos de medición de EEG que utilicen paradigmas no invasivos para primates no humanos. Nuestro grupo de investigación desarrolló un método único de registro de EEG no invasivo utilizando tubos32 para macacos y titíes. Aquí, reportamos varios hallazgos novedosos sobre el procesamiento auditivo en primates no humanos 33,34,35,36,37. Para caracterizar la actividad cerebral en respuesta a las vocalizaciones específicas de la especie en titíes, construimos un sistema experimental para registrar la actividad cerebral de forma no invasiva utilizando electrodos colocados en el cuero cabelludo. En este estudio, describimos el método de medición EEG para titíes.
Protocolo
Todos los experimentos fueron aprobados por el Comité de Experimentación Animal del EHUB (No.2022-003, 2023-104) y se llevaron a cabo de acuerdo con la Guía para el Cuidado y Uso de Primates de Laboratorio publicada por el EHUB. Para el experimento se utilizaron nueve titíes comunes (Callithrix jacchus, seis machos y tres hembras, de 2 a 12 años, con un peso de 330 a 490 g).
1. Animales
- Aloje a los titíes en jaulas individuales equipadas con cajas nido, perchas de madera y otros dispositivos de enriquecimiento.
- Mantener las habitaciones bajo un ciclo de luz-oscuridad de 12 h, con una temperatura y humedad de 28 ± 2 °C y de 40 ± 20%, respectivamente.
- Alimente a los animales con 14 g de gránulos de mono del Nuevo Mundo dos veces al día, complementados con alimentos como goma arábiga y gusanos de la harina. Proporcionar agua ad libitum.
- Realice todos los experimentos en una caja con atenuación de sonido en una sala de experimentación.
2. Equipo (Figura 1B y tabla de materiales)
- Utilice electrodos de plata de 4 mm. El recubrimiento de AgCl en la superficie del electrodo evita la polarización y garantiza una grabación estable.
- Utilice un amplificador para registrar las señales de EEG. Filtro de paso de banda (0,016-250 Hz) y muestreo de los datos a 1.000 Hz.
- Conecte una caja de entrada de electrodo de 64 canales al amplificador, colocándola frente al sujeto.
- Coloque el altavoz a 30 cm de la cabeza del tití y controle el nivel de sonido a 65-75 dB, medido en la posición del oído. Transmita los estímulos auditivos a través de este altavoz.
- Coloque la cámara frente al sujeto para monitorear su condición durante la grabación del EEG.
- La silla primate está construida con placas acrílicas y postes de resina sintética. Para los experimentos, haga que el investigador sostenga a los animales mientras se sientan en el reposapiés; En este punto, inserte una pieza para el cuello y asegúrela al panel del cuello, e inserte y asegure la pieza de la cintura al panel de la cintura. Asegúrese de que todo el cuerpo de cada tití esté asegurado sin apretar.
3. Anestesia
- Anestesiar a los animales con una inyección intramuscular de alfaxalona (6-8 mg/kg) y atropina (0,05 mg/kg). Este protocolo permite mantener la anestesia durante aproximadamente 20 min. Administre dosis adicionales de alfaxalona para prolongar la duración de la anestesia si el procedimiento es más largo. Administrar también agentes antieméticos (Maropitant 1 mg/kg, inyección subcutánea) de antemano para contrarrestar las náuseas, que son un efecto secundario de la alfaxona.
NOTA: Los titíes deben estar bajo anestesia inyectable o inhalatoria durante los procedimientos y se les debe permitir recuperarse inmediatamente después del afeitado del cabello. - Controle los signos vitales con un oxímetro de pulso y administre una mezcla de oxígeno y aire (Ø2 0,5 L/min, aire 0,5 L/min) si es necesario.
- Mantenga la temperatura ambiente por encima de 27 °C y envuelva el cuerpo del tití con un paño caliente para evitar la hipotermia.
4. Depilación
- Afeita toda la cabeza (incluso detrás de la auricularia) con una afeitadora eléctrica.
- Aplicar crema depilatoria para pieles sensibles. Limpie la crema con una gasa húmeda después de 5 minutos.
5. Preparación de la mascarilla
- Procese una mascarilla termoplástica con anticipación para que se ajuste al tamaño de la silla de mono. En concreto, taladre la parte del respaldo que sobresale de la longitud vertical de la silla con cuatro orificios para tornillos de modo que pueda fijarse a la placa del cuello de la silla.
NOTA: Las mascarillas termoplásticas son seguras y se pueden usar para inmovilizar la cabeza durante la radioterapia en los pacientes. Utilizamos una pequeña mascarilla diseñada para niños y la cortamos para que se ajustara al tamaño de los titíes. Esta mascarilla se ablanda cuando se coloca en agua tibia a 75 °C y se endurece a medida que la temperatura se reduce cuando se retira del agua. - Para los experimentos, coloque a los animales en una silla de primates. Apoye al animal anestesiado usando placas para el cuello y la cintura y asegure al animal y estas placas a la silla.
- Calienta la mascarilla en agua caliente y luego moldea para que se ajuste a la cabeza del tití. Después de retirar la mascarilla del agua tibia, espere a que baje la temperatura (aproximadamente en el rango de 50 °C) para evitar quemaduras, y luego colóquela en la cabeza del sujeto para moldear la mascarilla.
- Después de enfriar y endurecer, separe la máscara del animal y corte la parte superior de la cabeza y las orejas de la máscara para exponer el área para el ajuste del electrodo.
NOTA: Una vez hecha esta mascarilla, podría ser utilizada en otros individuos.
6. Adaptación de silla y mascarilla (30 min/día durante 3 días)
- Habitúe al animal a la silla en condiciones de vigilia colocándolo en una silla y recompensándolo durante aproximadamente 30 minutos. Repita este procedimiento durante 3 días.
- Habituar al animal a la fijación de la cabeza con la mascarilla durante 2 días.
NOTA: Este proceso de adaptación se adaptó a la condición del individuo. Después de la adaptación, los animales pueden resistir temporalmente durante la captura y la colocación de la mascarilla, pero una vez que están sentados en la silla y su cabeza está fija, se calman. - Durante la adaptación de la silla, evalúe los siguientes parámetros conductuales: i) emisión de ruidos ansiosos o alarmantes, ii) rechazo de la recompensa ofrecida, y iii) movimientos violentos. Si se observa alguno de estos comportamientos, se da por terminada la sesión de ese día, permitiendo que el tití se adapte gradualmente al entorno experimental.
7. Registro de EEG (2 h/día)
- Preparación de la asignatura
- Coloque una jaula de transferencia en una pequeña ventana de la jaula de la casa y mueva el tití de la jaula de la casa a la jaula de transferencia, generalmente solo. Cubra la jaula de transporte con un paño y transfiérala a la sala experimental.
- Fijación de la cabeza
- Capture el tití con guantes protectores y colóquelo en la silla especial.
- Coloque la máscara preparada en la cabeza del tití. Pase el cuerpo del tornillo unido a la silla a través del orificio de la máscara y fíjelo con tornillos de mariposa.
- Asegure la cabeza y la mascarilla ligeramente con una banda justo debajo de la nasión.
NOTA: No fue necesario fijar completamente la cabeza del sujeto, siempre y cuando los electrodos no se retiraran con movimiento. Por lo tanto, utilizamos la misma mascarilla en todos los sujetos.
- Definición de la ubicación de los electrodos
- Utilice la nasión, el inión y los lóbulos de las orejas como puntos de referencia anatómicos para determinar la ubicación de los electrodos de acuerdo con el método International 10-20 32,33,34,35,36,37. Mide la distancia entre el nasion y el inion en la línea media con una cinta métrica. Defina la ubicación de Cz en el centro de la distancia. Coloque los otros electrodos (Fz, Pz, Oz, F3 o F4) con el 20% de la longitud inion-neion como espaciado entre electrodos. Marque las posiciones de los electrodos en el cuero cabelludo con un dermatógrafo a base de aceite.
- Preparación de la piel
- Frote el área marcada con un hisopo de algodón fino humedecido en alcohol isopropílico para eliminar la suciedad y el sebo del cuero cabelludo.
- Ajustes de electrodos
NOTA: Realice los pasos 7.2.1-7.2.3 en todas las posiciones de los electrodos para colocar los electrodos en Fz, Cz, C3, C4, Pz, A1, A2 y F3 (o F4).- Con un cortador de tubos, corte un trozo de tubo de silicona con un diámetro interior de 4 mm y un diámetro exterior de 7 mm en una longitud de aproximadamente 20 mm.
- Aplique adhesivo en los bordes del tubo cortado y adhiéralo al cuero cabelludo.
- Llene el interior del tubo con gel para electroencefalograma utilizando una jeringa y una aguja de jeringa no puntiaguda.
- Conecte el electrodo de referencia a Pz y los electrodos de tierra a F3 o F4 (Figura 1C).
- Inserte los electrodos en el tubo y conecte el cable del electrodo a la caja de entrada.
- Inicie la aplicación de registros de EEG para medir la impedancia de los electrodos y ajuste los parámetros para garantizar que todos los electrodos estén por debajo de 5 kΩ.
- Agrupe los cables de los electrodos para reducir el ruido.
- Dé recompensas durante el procedimiento de inmovilización de la cabeza y entre sesiones de tareas administrando manualmente 1-3 ml de la recompensa líquida (goma de mascar o nutrición) con una jeringa.
- Especifique el archivo que se guardará en el software de registro de EEG y presione el botón Iniciar grabación . Ejecute el script para la presentación del estímulo inmediatamente después de que se inicie el registro del EEG. Presione el botón de parada en la grabación de EEG cuando se complete la ejecución del script de presentación de estímulo para finalizar todas las grabaciones. Cuando se complete la grabación, retire los electrodos y la máscara para la cabeza.
- Captura a los animales y devuélvelos a sus jaulas de transporte. Deje las trompas en el cuero cabelludo; Todos los tubos se cayeron naturalmente en aproximadamente 1 día.
NOTA: En los primeros períodos, usamos acetona para disolver el pegamento adhesivo y quitar el tubo después de las sesiones de grabación; sin embargo, hubo casos de lesiones cutáneas; Por lo tanto, posteriormente devolvimos a los animales a sus jaulas de origen sin quitar el tubo. En las docenas de experimentos que hemos realizado hasta ahora, los titíes no han mostrado ningún interés en los tubos extraídos, y nunca se ha producido ninguna ingestión accidental. - Estímulo
- Registre las llamadas naturales, simples y compuestas en la sala cautiva o experimental de titíes que no se utilicen en grabaciones de EEG posteriores. Extraiga tres llamadas simples y compuestas específicas de la especie (llamadas Phee, Tsik-Ek y Tsik-String5 ) de los archivos grabados.
- Además de los estímulos de llamada, cree ruido blanco utilizando una función en el software de programación y utilícelo como estímulo.
- Para seguir este protocolo, utilice tres archivos auditivos (16 bits, 48 kHz) de llamadas de tití en el experimento. Controle la tarea mediante un script personalizado.
NOTA: Cada bloque contiene 50 llamadas para cada estímulo, para un total de 200 llamadas. Cada bloque de grabación tendrá una duración aproximada de 10 min. Cada participante debe realizar dos bloques. El intervalo entre llamadas es de 3 s. De los cuatro archivos de estímulo de audio (ver Archivo Suplementario 1), el estímulo de la llamada de Phee tenía una duración aproximada de 2 s, mientras que los otros tres tenían una duración aproximada de 1 s. Esto se debe a que una sola llamada de Phee sigue siendo una llamada de larga duración (Figura 1D). - En cada archivo de estímulo sonoro, el canal derecho contiene la llamada de tití o los datos de ruido, y el canal izquierdo contiene la señal de activación para el inicio del estímulo. Envíe esta señal de activación al sistema de registro de EEG a través de un dispositivo de sincronización y regístrela como tiempo de evento.
8. Análisis de datos
NOTA: El código original escrito en el software y la caja de herramientas de programación se utilizó para el posprocesamiento de los datos del EEG, como se describe a continuación (Archivo complementario 2)37.
- Preprocesamiento
- Vuelva a hacer referencia a la referencia de oído vinculado.
- Filtro de paso alto a 2 Hz.
- Época desde 100 ms antes hasta 1000 ms después del inicio del estímulo.
- Valor basal: correcto a la media del período de prestimulus de 100 ms. Rechace los artefactos utilizando un criterio de ±150 μV.
- Trazado del potencial relacionado con eventos (ERP)
- Promedie todos los datos de los ensayos para cada sujeto.
- Obtenga formas de onda promediadas por grupo promediando todos los sujetos.
- Para comparar los ERPs promediados entre los tipos de llamada y los estímulos de ruido, se aplique un análisis de varianza unidireccional (ANOVA) con los estímulos como factor entre sujetos en la respuesta Cz.
- Aplicar el análisis de comparación múltiple post hoc con el método de Tukey.
- Representación gráfica de la perturbación espectral relacionada con eventos (ERSP)
- Calcule el ERSP para visualizar el cambio medio relacionado con el evento en la potencia espectral a lo largo del tiempo en un amplio rango de frecuencias utilizando la ecuación (1). Fk (f,t) es la estimación espectral de la prueba k en la frecuencia f y el tiempo t:
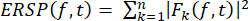 (1)
(1) - Aplique la descomposición de tiempo-frecuencia a las actividades utilizando transformadas de ondículas sinusoidales, con tres ciclos de longitud a la frecuencia más baja (10 Hz), aumentando linealmente con la frecuencia hasta 32 ciclos a la frecuencia más alta (120 Hz).
- Defina las respuestas iniciales y transitorias en un período de 150 ms después del inicio del estímulo a 2-30 Hz, y las respuestas sostenidas en un período de 800 ms de 151 a 950 ms después del inicio del estímulo a las 40-100 H.
- Para probar las diferencias en las respuestas iniciales y sostenidas en Fz y Cz entre las edades de los sujetos y los tipos de llamadas, realice un ANOVA de dos factores utilizando el tipo de llamada como factor dentro del sujeto y las edades como factor entre sujetos.
- Calcule el ERSP para visualizar el cambio medio relacionado con el evento en la potencia espectral a lo largo del tiempo en un amplio rango de frecuencias utilizando la ecuación (1). Fk (f,t) es la estimación espectral de la prueba k en la frecuencia f y el tiempo t:
Resultados
En primer lugar, trazamos los potenciales promedio relacionados con eventos (ERP) para cada estímulo auditivo en los titíes (Figura 2). El potencial evocado auditivo (AEP) fue prominente en la condición de ruido , reflejando el inicio claro de los estímulos (ver Figura 1D). Para comparar los ERPs promediados entre los tipos de llamada y los estímulos de ruido, aplicamos un análisis de varianza unidireccional (ANOVA) con los estímulos como factor ...
Discusión
Puntos a tener en cuenta sobre la anestesia
Se ha intentado la administración de ketamina y xilacina, y si bien estos son analgésicos y, por lo tanto, adecuados para tareas dolorosas prolongadas, los titíes tienden a experimentar disminuciones en los niveles de oxígeno en la sangre sin inhalación de oxígeno44. En resumen, el alfaxalon es probablemente el más adecuado para tareas indoloras como el afeitado o la fabricación de mascarillas. Además, para el afeitado, que d...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue apoyado por el Proyecto Hakubi de la Universidad de Kyoto, Grant-in-Aid for Challenging Research (Pioneering) (No.22K18644), Grant-in-Aid for Scientific Research (C) (No. 22K12745 ), Grant-in-Aid for Scientific Research (B) (No. 21H02851) y Grant-in-Aid for Scientific Research (A) (No. 19H01039). Nos gustaría agradecer a Editage (www.editage.jp) por la edición en inglés.
Materiales
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
Referencias
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados