需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
清醒狨猴的脑电图测量:聆听同种发声
摘要
为了研究语言的进化,比较人类和非人类灵长类动物的大脑机制很重要。我们开发了一种无创测量清醒动物脑电图 (EEG) 的方法。它使我们能够直接长期比较人类和动物之间的脑电图数据,而不会伤害它们。
摘要
声音交流在灵长类动物的社交互动中起着至关重要的作用,尤其是在生存和社会组织中。人类以语言的形式发展出一种独特而先进的声音交流策略。要研究人类语言的进化,有必要研究人类发声处理背后的神经机制,并通过将它们与非人类灵长类动物的机制进行比较来了解大脑机制是如何进化的。在此,我们开发了一种无创测量清醒非人灵长类动物脑电图 (EEG) 的方法。这种记录方法允许在不伤害动物的情况下进行长期研究,重要的是,它允许我们直接将非人类灵长类动物的脑电图数据与人类数据进行比较,从而深入了解人类语言的进化。在目前的研究中,我们使用头皮脑电图记录方法来研究大脑活动对狨猴物种特异性发声的反应。本研究通过使用头皮脑电图捕捉狨猴在声音感知过程中的广泛神经表征,填补了现有知识的空白,从而提供了新的见解。
引言
灵长类动物使用物种特异性的发声来传达生物学上重要的信息,例如呼叫者的情绪状态或维持社会纽带的意图、捕食者的存在或其他危险情况。对声音丰富的非人类灵长类动物发声感知背后的神经机制的研究可能为我们提供关键线索,以更好地理解人类语言的进化起源。
普通狨猴是原产于南美洲的小型灵长类动物。近年来,狨猴越来越多地与猕猴一起被用作模式动物,因为它们的繁殖能力高,体型小,易于使用,以及有用的转基因技术的发展 1,2,3。除了作为疾病模型的实用性外,群体内丰富的声音交流是该物种的另一个独特特征 4,5,6,7。狨猴经常交换声音信号,与森林中看不见的同种动物交流。通过检查狨猴发声感知和产生所涉及的大脑活动,我们可以确定它们如何处理大脑中自身或同种呼叫的听觉信息,并确定涉及哪些神经回路。先前的研究表明,初级听觉皮层8、9、10、11、12 和额叶皮层13、14 的神经活动参与狨猴的声音产生。此外,这些兴奋和抑制的神经元反应受到初级听觉皮层中听觉-声音相互作用的调节 8,10。这些研究使用侵入性记录方法提供了单神经元水平的详细神经活动数据。许多研究进一步检查了狨猴发声产生所涉及的神经活动;然而,对声音感知的理解仍然知之甚少15,16。
几项无创脑成像研究阐明了狨猴发声处理的神经机制 17,18,19;它们的高空间分辨率是一个优势,但是,在扫描过程中使动物保持清醒状态需要先进的技术。然而,最近,Jafari 等人使用功能性磁共振成像 (fMRI) 确定了清醒狨猴参与声音感知的额颞区19。几乎所有阐明人类参与发声感知和产生的大脑功能的实验都是使用无创方法进行的,例如头皮脑电图 (EEG)、脑磁图 (MEG)20,21 和 fMRI 22,23,24。许多人类研究调查了使用 EEG 与声音感知相关的大脑活动。这些研究大多集中在情绪信息 25,26,27 和情绪词的显著性 28 上,结果揭示了声音感知过程中事件相关电位的变化29。使用颅内植入电极的人体皮层电图 (ECoG) 和单神经元记录仅在接受神经外科治疗的患者中进行了有限数量的实验30,31。
在了解人类发声感知和产生背后的独特神经机制时,将人类与猴子进行比较的进化观点非常重要。为了直接比较声音丰富的非人类灵长类动物(如狨猴)与人类的语音感知和发声所涉及的神经机制,使用相同的方法比较两个物种之间的数据非常重要。功能性 MRI 允许全脑成像并具有很高的空间分辨率。它的优点是可以记录垂直于颅骨或难以用 EEG 或 MEG 记录的深部区域的活动。然而,MRI 机器的安装和维护成本很高,并且由于设备的性质,可以呈现的刺激存在许多限制。相比之下,EEG、事件相关电位 (ERP) 和 MEG 具有较高的时间分辨率,使其可用于分析时间序列声音处理。特别是,脑电图具有移动性高、能够在各种实验环境中使用、成本相对较低以及只需要一名操作员的优势。
由于已经在人类身上获得了大量的脑电图数据,因此非人类灵长类动物需要使用非侵入性范式的脑电图测量方法。我们的研究小组开发了一种独特的无创脑电图记录方法,使用32 号管对猕猴和狨猴进行记录。在这里,我们报告了有关非人灵长类动物听觉处理的几项新发现 33,34,35,36,37。为了表征响应狨猴物种特异性发声的大脑活动,我们构建了一个实验系统,使用放置在头皮上的电极无创记录大脑活动。在这项研究中,我们描述了狨猴的脑电图测量方法。
研究方案
所有实验均经 EHUB 动物实验委员会(No.2022-003、2023-104)批准,并按照 EHUB 发布的《实验室灵长类动物护理和使用指南》进行。实验使用了 9 只普通狨猴 (Callithrix jacchus,6 只雄性和 3 只雌性,2-12 岁,体重 330-490 g)。
1. 动物
- 将狨猴安置在配备巢箱、木制栖木和其他丰富装置的单个笼子中。
- 将房间保持在 12 小时的光暗循环下,温度和湿度分别保持在 28 ± 2 °C 和 40 ± 20%。
- 每天两次给动物喂食 14 克新世界猴子颗粒,并辅以阿拉伯树胶和黄粉虫等食物。 随意提供水。
- 在实验室的消音箱中进行所有实验。
2. 设备(图 1B 和材料表)
- 使用 4 mm 银电极。电极表面的 AgCl 涂层可防止极化并确保稳定记录。
- 使用放大器记录脑电图信号。带通滤波器 (0.016-250 Hz) 并以 1,000 Hz 对数据进行采样。
- 将 64 通道电极输入盒连接到放大器,将其放置在被摄体前面。
- 将扬声器放置在距离狨猴头部 30 厘米处,并将声级控制在 65-75 分贝,如在耳朵位置测量的那样。通过此扬声器传递听觉刺激。
- 将摄像头放在拍摄对象前面,以在脑电图记录期间监测他们的状况。
- 灵长类动物椅子由亚克力板和合成树脂柱制成。对于实验,让研究人员抱着坐在脚踏板上的动物;此时,插入颈件并将其固定到颈板上,然后将腰件插入并固定到腰板上。确保每只狨猴的整个身体都松散地固定。
3. 麻醉
- 通过肌肉注射阿法沙酮 (6-8 mg/kg) 和阿托品 (0.05 mg/kg) 麻醉动物。该方案允许麻醉维持约 20 分钟。如果手术时间较长,则给予额外剂量的阿法沙隆以延长麻醉持续时间。还要事先给予止吐药(Maropitant 1 mg/kg,皮下注射)以对抗恶心,这是阿法沙酮的副作用。
注意:狨猴在手术过程中必须接受注射或吸入麻醉,并且应在剃毛后立即恢复。 - 使用脉搏血氧仪监测生命体征,必要时给予氧气-空气混合物(O2 0.5 L/min,空气 0.5 L/min)。
- 将室温保持在 27 °C 以上,并在狨猴的身体周围包裹一块温暖的布,以防止体温过低。
4. 脱毛
- 用电动剃须刀剃光整个头部(包括耳廓后面)。
- 为敏感皮肤涂抹脱毛霜。5 分钟后用湿纱布擦去乳霜。
5. 掩模准备
- 提前加工热塑性口罩以适合猴椅的尺寸。具体来说,在从椅子的垂直长度突出的靠背部分钻上四个螺丝孔,使其可以固定在椅子的颈板上。
注意:热塑性面罩是安全的,可用于在患者放射治疗期间固定头部。我们使用了一个专为儿童设计的小面具,并将其剪裁成适合狨猴的大小。这种面罩在 75 °C 的温水中时会变软,从水中取出时会随着温度的降低而变硬。 - 对于实验,将动物放在灵长类动物的椅子上。使用颈板和腰板支撑麻醉的动物,并将动物和这些板固定在椅子上。
- 在热水中加热面膜,然后将其成型以适合狨猴的头部。从温水中取出口罩后,等待温度下降(大约在 50s °C 范围内)以防止烫伤,然后将其放在受试者的头上以塑造口罩。
- 冷却和硬化后,从动物身上取下面罩,切出面罩的头部和耳朵部分,露出电极设置的区域。
注意:一旦制作了这个面具,它就可以用于其他人。
6. 椅子和面罩适应(30 分钟/天,持续 3 天)
- 在清醒的情况下,将动物放在椅子上并奖励它大约 30 分钟,使它适应于椅子上。重复此过程 3 天。
- 使用面罩使动物习惯于头部固定 2 天。
注意:这个适应过程是根据个人的情况定制的。适应后,动物在捕捉和戴头罩时可能会暂时抵抗,但一旦它们坐在椅子上并固定头部,它们就会变得平静。 - 在椅子适应期间,评估以下行为参数:i) 发出焦虑或警报的声音,ii) 拒绝提供的奖励,以及 iii) 剧烈运动。如果观察到这些行为中的任何一个,请终止当天的会话,让狨猴逐渐适应实验环境。
7. 脑电图记录(2 小时/天)
- 科目准备
- 将转运笼连接到家笼的小窗户上,通常自己将狨猴从家笼移动到转运笼。用布盖住携带笼,将其转移到实验室。
- 头部固定
- 使用防护手套捕捉狨猴并将其放在特殊的椅子上。
- 将准备好的面膜放在狨猴的头上。将连接到椅子上的螺钉体穿过面罩上的孔,并使用翼形螺钉固定。
- 用鼻孔下方的带子轻轻固定头部和面罩。
注意:只要电极不因移动而移开,就不需要完全固定受试者的头部。因此,我们在所有受试者中使用相同的掩码。
- 电极位置的定义
- 使用鼻、鼻和耳垂作为解剖标志,根据国际 10-20 方法32、33、34、35、36、37 确定电极的位置。用卷尺测量中线 nasion 和 inion 之间的距离。定义 Cz 在距离中间的位置。将其他电极(Fz、Pz、Oz、F3 或 F4)定位为离子-离子长度的 20% 作为电极间距。使用油性皮肤图标记头皮上的电极位置。
- 皮肤准备
- 用蘸有外用酒精的细棉签擦拭标记区域,以去除头皮上的污垢和皮脂。
- 电极设置
注:在所有电极位置执行步骤 7.2.1-7.2.3,将电极放置在 Fz、Cz、C3、C4、Pz、A1、A2 和 F3(或 F4)处。- 使用切管器,将一根内径为 4 mm、外径为 7 mm 的硅胶管切割成约 20 mm 的长度。
- 将粘合剂涂在切割管的边缘并将其粘附在头皮上。
- 使用注射器和非尖头注射器针头用 EEG 凝胶填充管内。
- 将参比电极连接到 Pz,将接地电极连接到 F3 或 F4(图 1C)。
- 将电极插入管中,并将电极电缆连接到输入框。
- 启动 EEG 记录应用程序以测量电极阻抗,并调整参数以确保所有电极均低于 5 kΩ。
- 捆绑电极电缆以降低噪音。
- 通过使用注射器手动施用 1-3 mL 液体奖励(口香糖或营养品),在头部固定程序期间和任务会话之间给予奖励。
- 指定要保存在 EEG 记录软件上的文件,然后按 Start Recording 按钮 。在 EEG 记录开始后立即运行刺激呈现脚本。刺激呈现脚本执行完成后,按下 EEG 记录上的 停止 按钮以结束所有记录。录制完成后,取下电极和头罩。
- 捕捉动物并将它们放回它们的笼子里。将管子留在头皮上;所有管子在大约 1 天内自然脱落。
注意:在早期,我们使用丙酮溶解胶粘剂,并在录音后取出管子;然而,也有皮肤损伤的案例;因此,我们随后将动物放回了它们的家笼中,没有取下管子。在我们迄今为止进行的数十次实验中,狨猴对取出的试管没有表现出任何兴趣,也从未发生过意外摄入。 - 刺激物
- 在圈养室或实验室中记录狨猴的自然、简单和复合呼叫,这些呼叫在后续的脑电图记录中未使用。从录制的文件中提取三种物种特异性的简单和复合调用(Phee、Tsik-Ek 和 Tsik-String5 调用)。
- 除了呼叫刺激之外,使用编程软件中的函数创建白噪声并将其用作刺激。
- 要遵循此协议,请在实验中使用三个 marmoset 调用的听觉文件(16 位,48 kHz)。使用自定义脚本控制任务。
注意:每个区块包含每个刺激的 50 个调用,总共 200 个调用。每个记录块将持续大约 10 分钟。每个参与者必须执行两个模块。呼叫间隔为 3 秒。在四个音频刺激文件中(参见 补充文件 1), Phee 呼叫刺激大约是 2 秒长,而其他三个大约是 1 秒长。这是因为单个 Phee 调用仍然是一个持久的调用(图 1D)。 - 在每个声音刺激文件中,右声道包含狨猴叫声或噪声数据,左声道包含刺激开始的触发信号。通过同步设备将此触发信号发送到脑电图记录系统,并将其记录为事件时间。
8. 数据分析
注意:在编程软件和工具箱中编写的原始代码用于对 EEG 数据进行后处理,如下所述(补充文件 2)37。
- 预处理
- 重新引用链接的耳朵引用。
- 2 Hz 的高通滤波器。
- 从刺激开始前 100 毫秒到刺激开始后 1000 毫秒的纪元。
- 基线校正到 100 毫秒刺激前期的平均值。使用 ±150 μV 的标准拒绝伪影。
- 绘制事件相关电位 (ERP)
- 每个受试者的所有试验数据的平均值。
- 通过对所有受试者求平均值来获得组平均波形。
- 要比较呼叫类型和噪声刺激之间的平均 ERP,请应用单因素方差分析 (ANOVA),将刺激作为 Cz 响应中的主体间因子。
- 使用 Tukey 方法应用事后多重比较分析。
- 绘制事件相关频谱扰动 (ERSP)
- 使用公式 (1) 计算 ERSP,以可视化在宽频率范围内随时间变化的频谱功率平均事件相关变化。 Fk (f,t) 是频率 f 和时间 t 处试验 k 的频谱估计值:
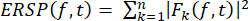 (1)
(1) - 使用正弦小波变换将时频分解应用于活动,在最低频率 (10 Hz) 处具有三个长度周期,在最高频率 (120 Hz) 处,长度随频率线性增加,最高可达 32 个周期。
- 定义 2-30 Hz 刺激开始后 150 ms 周期内的初始和瞬态响应,以及 40-100 H 刺激开始后 151 至 950 ms 期间 800 ms 周期内的持续响应。
- 要检验受试者年龄和呼叫类型之间 Fz 和 Cz 的初始响应和持续响应的差异,请使用呼叫类型作为主体内因子,使用 年龄 作为主体间因子来执行双向方差分析。
- 使用公式 (1) 计算 ERSP,以可视化在宽频率范围内随时间变化的频谱功率平均事件相关变化。 Fk (f,t) 是频率 f 和时间 t 处试验 k 的频谱估计值:
结果
首先,我们绘制了狨猴中每种听觉刺激的平均事件相关电位 (ERP)(图 2)。听觉诱发电位 (AEP) 在 噪声 条件下很突出,反映了刺激的清晰开始(见 图 1D)。为了比较呼叫类型和噪声刺激之间的平均 ERP,我们应用了单因素方差分析 (ANOVA),将刺激作为 Cz 响应中的受试者间因子。我们发现刺激分别在刺激开始后 13-18 ms、28-36 ms 和 45-88 ms 对 C...
讨论
关于麻醉的注意事项
氯胺酮和甲苯噻嗪给药都已被尝试过,虽然它们是镇痛剂,因此适用于长时间的痛苦任务,但狨猴在没有吸氧的情况下往往会出现血氧水平降低44。简而言之,alfaxalon 可能最适合剃须或制作面膜等无痛任务。此外,对于仅需 10-15 分钟的剃须,吸入麻醉将是最合适的。由于异氟醚持续时间短且浓度低 (约 1%),因此在插管期间未使用。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了京都大学白尾项目、挑战研究补助金(先锋)(No.22K18644)、科学研究补助金 (C) (No. 22K12745)、科学研究补助金 (B) (No. 21H02851) 和科学研究补助金 (A) (No. 19H01039) 的支持。感谢 意得辑 (www.editage.jp) 的英文编辑工作。
材料
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
参考文献
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。