È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazioni dell'elettroencefalografia in uistitì svegli che ascoltano vocalizzazioni conspecifiche
In questo articolo
Riepilogo
Per studiare l'evoluzione del linguaggio, è importante confrontare i meccanismi cerebrali negli esseri umani con quelli dei primati non umani. Abbiamo sviluppato un metodo per misurare in modo non invasivo l'elettroencefalografia (EEG) degli animali svegli. Ci consente di confrontare direttamente i dati EEG tra esseri umani e animali a lungo termine senza danneggiarli.
Abstract
La comunicazione vocale svolge un ruolo cruciale nelle interazioni sociali dei primati, in particolare nella sopravvivenza e nell'organizzazione sociale. Gli esseri umani hanno sviluppato una strategia di comunicazione vocale unica e avanzata sotto forma di linguaggio. Per studiare l'evoluzione del linguaggio umano, è necessario indagare i meccanismi neurali alla base dell'elaborazione vocale negli esseri umani, nonché capire come si sono evoluti i meccanismi cerebrali confrontandoli con quelli dei primati non umani. In questo articolo, abbiamo sviluppato un metodo per misurare in modo non invasivo l'elettroencefalografia (EEG) di primati non umani svegli. Questo metodo di registrazione consente studi a lungo termine senza danneggiare gli animali e, soprattutto, ci consente di confrontare direttamente i dati EEG dei primati non umani con i dati umani, fornendo informazioni sull'evoluzione del linguaggio umano. Nel presente studio, abbiamo utilizzato il metodo di registrazione EEG del cuoio capelluto per studiare l'attività cerebrale in risposta alle vocalizzazioni specie-specifiche negli uistitì. Questo studio fornisce nuove intuizioni utilizzando l'EEG del cuoio capelluto per catturare rappresentazioni neurali diffuse negli uistitì durante la percezione vocale, colmando le lacune nelle conoscenze esistenti.
Introduzione
I primati usano vocalizzazioni specie-specifiche per trasmettere informazioni biologicamente importanti, come lo stato emotivo del chiamante o l'intenzione di mantenere legami sociali, la presenza di predatori o altre situazioni pericolose. L'indagine sui meccanismi neurali alla base della percezione della vocalizzazione nei primati non umani ricchi di voce può fornirci indizi critici per comprendere meglio le origini evolutive del linguaggio umano.
Gli uistitì comuni sono piccoli primati originari del Sud America. Negli ultimi anni, gli uistitì sono stati sempre più utilizzati come animali modello, insieme ai macachi, a causa della loro elevata riproduttività, della facilità d'uso dovuta alle loro piccole dimensioni e dello sviluppo di utili tecniche transgeniche 1,2,3. Oltre alla loro utilità come modelli di malattia, la ricca comunicazione vocale all'interno dei gruppi è un'altra caratteristica unica di questa specie 4,5,6,7. Gli uistitì si scambiano abitualmente segnali vocali per comunicare con i conspecifici invisibili nella foresta. Esaminando l'attività cerebrale coinvolta nella percezione e nella produzione vocale negli uistitì, possiamo determinare come elaborano le informazioni uditive dei loro richiami o conspecifici nel cervello e identificare quali circuiti neurali sono coinvolti. Studi precedenti hanno dimostrato l'attività neurale nella corteccia uditiva primaria 8,9,10,11,12 e nella corteccia frontale13,14 coinvolta nella produzione vocale negli uistitì. Inoltre, queste risposte neuronali eccitate e soppresse sono state modulate dalle interazioni uditivo-vocali nella corteccia uditiva primaria 8,10. Questi studi hanno fornito dati dettagliati sull'attività neurale a livello di singolo neurone utilizzando metodi di registrazione invasivi. Numerosi studi hanno ulteriormente esaminato l'attività neurale coinvolta nella produzione vocale dell'uistitì; Tuttavia, la percezione vocale rimane poco compresa 15,16.
Diversi studi di imaging cerebrale non invasivi hanno chiarito i meccanismi neurali dell'elaborazione vocale negli uistitì 17,18,19; La loro elevata risoluzione spaziale è un vantaggio, tuttavia, mantenere gli animali in stato di veglia durante la scansione richiede tecniche avanzate. Tuttavia, più recentemente, Jafari et al. hanno identificato le regioni frontotemporali coinvolte nella percezione vocale negli uistitì svegli utilizzando la risonanza magnetica funzionale (fMRI)19. Quasi tutti gli esperimenti per chiarire le funzioni cerebrali coinvolte nella percezione e nella produzione vocale negli esseri umani sono stati condotti utilizzando metodi non invasivi, come l'elettroencefalografia del cuoio capelluto (EEG), la magnetoencefalografia (MEG)20,21 e la fMRI 22,23,24. Numerosi studi sull'uomo hanno studiato l'attività cerebrale correlata alla percezione vocale utilizzando l'EEG. La maggior parte di questi studi si è concentrata sulle informazioni emotive 25,26,27 e sulla salienza delle parole emotive 28, con i risultati che rivelano cambiamenti nei potenziali correlati agli eventi durante la percezione vocale29. L'elettrocorticografia (ECoG) e le registrazioni di singoli neuroni utilizzando elettrodi impiantati per via intracranica nell'uomo sono state condotte solo in un numero limitato di esperimenti in pazienti sottoposti a trattamento neurochirurgico30,31.
Una prospettiva evolutiva che confronta gli esseri umani con le scimmie è importante per comprendere i meccanismi neurali unici alla base della percezione e della produzione vocale che si sono sviluppati negli esseri umani. Per confrontare direttamente i meccanismi neurali coinvolti nella percezione del parlato e nella vocalizzazione nei primati non umani ricchi di voce, come l'uistitì, con gli esseri umani, è importante confrontare i dati tra le due specie utilizzando lo stesso metodo. La risonanza magnetica funzionale consente l'imaging dell'intero cervello e ha un'alta risoluzione spaziale. Ha il vantaggio di registrare l'attività perpendicolarmente al cranio o in regioni profonde che sono difficili da registrare con EEG o MEG. Tuttavia, la macchina per la risonanza magnetica è costosa da installare e mantenere e ci sono molte restrizioni sugli stimoli che possono essere presentati a causa della natura del dispositivo. In confronto, l'EEG, i potenziali evento-correlati (ERP) e il MEG hanno un'alta risoluzione temporale, il che li rende utili per analizzare l'elaborazione vocale delle serie temporali. In particolare, l'EEG presenta i vantaggi di un'elevata mobilità e della capacità di essere utilizzato in una varietà di contesti sperimentali, di un costo relativamente basso e della necessità di un solo operatore.
Poiché una grande quantità di dati EEG è già stata ottenuta nell'uomo, per i primati non umani sono necessari metodi di misurazione EEG che utilizzano paradigmi non invasivi. Il nostro gruppo di ricerca ha sviluppato un metodo di registrazione EEG non invasivo unico nel suo genere utilizzando i tubi32 per macachi e uistitì. Qui, riportiamo diverse nuove scoperte riguardanti l'elaborazione uditiva nei primati non umani 33,34,35,36,37. Per caratterizzare l'attività cerebrale in risposta alle vocalizzazioni specie-specifiche negli uistitì, abbiamo costruito un sistema sperimentale per registrare in modo non invasivo l'attività cerebrale utilizzando elettrodi posizionati sul cuoio capelluto. In questo studio, descriviamo il metodo di misurazione EEG per gli uistitì.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti gli esperimenti sono stati approvati dal Comitato per la sperimentazione animale dell'EHUB (n. 2022-003, 2023-104) e condotti in conformità con la Guida per la cura e l'uso dei primati da laboratorio pubblicata dall'EHUB. Per l'esperimento sono stati utilizzati nove uistitì comuni (Callithrix jacchus, sei maschi e tre femmine, di età compresa tra 2 e 12 anni, del peso di 330-490 g).
1. Animali
- Alloggia gli uistitì in gabbie singole dotate di cassette nido, posatoi in legno e altri dispositivi di arricchimento.
- Mantenere gli ambienti sotto un ciclo luce-buio di 12 ore, con temperatura e umidità mantenute rispettivamente a 28 ± 2 °C e 40 ± 20%.
- Nutri gli animali con 14 g di pellet di scimmia del Nuovo Mondo due volte al giorno, integrati con cibo come gomma arabica e vermi della farina. Fornire acqua ad libitum.
- Esegui tutti gli esperimenti in una scatola insonorizzata in una stanza sperimentale.
2. Attrezzatura (Figura 1B e Tabella dei materiali)
- Utilizzare elettrodi d'argento da 4 mm. Il rivestimento AgCl sulla superficie dell'elettrodo impedisce la polarizzazione e garantisce una registrazione stabile.
- Utilizzare un amplificatore per registrare i segnali EEG. Filtro passa-banda (0,016-250 Hz) e campiona i dati a 1.000 Hz.
- Collegare una scatola di ingresso elettrodi a 64 canali all'amplificatore, posizionandolo di fronte al soggetto.
- Posizionare l'altoparlante a 30 cm dalla testa dell'uistitì e controllare il livello sonoro a 65-75 dB, misurato nella posizione dell'orecchio. Fornisci gli stimoli uditivi tramite questo altoparlante.
- Posizionare la telecamera di fronte al soggetto per monitorare le sue condizioni durante la registrazione EEG.
- La sedia per primati è costruita con lastre acriliche e montanti in resina sintetica. Per gli esperimenti, chiedi al ricercatore di tenere gli animali mentre si siedono sulla pedana; A questo punto, inserire un collare e fissarlo al pannello del collo, quindi inserire e fissare il girovita al pannello della vita. Assicurarsi che l'intero corpo di ogni uistitì sia fissato in modo lasco.
3. Anestesia
- Anestetizzare gli animali con un'iniezione intramuscolare di alfaxsolo (6-8 mg/kg) e atropina (0,05 mg/kg). Questo protocollo consente di mantenere l'anestesia per circa 20 minuti. Somministrare dosi aggiuntive di alfaxalone per prolungare la durata dell'anestesia se la procedura è più lunga. Somministrare preventivamente anche agenti antiemetici (Maropitant 1 mg/kg, iniezione sottocutanea) per contrastare la nausea, che è un effetto collaterale dell'alfaxalone.
NOTA: Gli uistitì devono essere sottoposti ad anestesia per iniezione o inalazione durante le procedure e devono essere lasciati guarire immediatamente dopo la rasatura dei peli. - Monitorare i parametri vitali con un pulsossimetro e somministrare una miscela ossigeno-aria (O2 0,5 L/min, aria 0,5 L/min) se necessario.
- Mantenere la temperatura ambiente al di sopra dei 27 °C e avvolgere un panno riscaldante intorno al corpo dell'uistitì per prevenire l'ipotermia.
4. Depilazione
- Radere l'intera testina (anche dietro l'auricolare) con un rasoio elettrico.
- Applicare la crema depilatoria per pelli sensibili. Asciugare la crema con una garza bagnata dopo 5 minuti.
5. Preparazione della maschera
- Elabora in anticipo una maschera termoplastica per adattarla alle dimensioni della sedia della scimmia. Nello specifico, forare la parte dello schienale che sporge dalla lunghezza verticale della sedia con quattro fori per le viti in modo che possa essere fissata alla piastra del collo della sedia.
NOTA: Le maschere termoplastiche sono sicure e possono essere utilizzate per immobilizzare la testa durante la radioterapia nei pazienti. Abbiamo usato una piccola maschera pensata per i bambini e l'abbiamo tagliata per adattarla alle dimensioni degli uistitì. Questa maschera si ammorbidisce se posta in acqua tiepida a 75 °C e si indurisce quando la temperatura si riduce quando viene rimossa dall'acqua. - Per gli esperimenti, posiziona gli animali su una sedia per primati. Sostieni l'animale anestetizzato usando le piastre per il collo e la vita e fissa l'animale e queste piastre alla sedia.
- Scaldare la maschera in acqua calda e poi modellarla per adattarla alla testa dell'uistitì. Dopo aver rimosso la maschera dall'acqua calda, attendere che la temperatura scenda (approssimativamente nell'intervallo di 50 °C) per evitare ustioni, quindi posizionarla sulla testa del soggetto per modellare la maschera.
- Dopo il raffreddamento e l'indurimento, staccare la maschera dall'animale e ritagliare la parte superiore della testa e le parti dell'orecchio della maschera per esporre l'area per l'impostazione dell'elettrodo.
NOTA: Una volta realizzata questa maschera, potrebbe essere utilizzata su altri individui.
6. Adattamento della sedia e della maschera (30 min/giorno per 3 giorni)
- Abituare l'animale alla sedia in condizioni di veglia mettendolo su una sedia e premiandolo per circa 30 minuti. Ripetere questa procedura per 3 giorni.
- Abituare l'animale alla fissazione della testa utilizzando la maschera per 2 giorni.
NOTA: Questo processo di adattamento è stato personalizzato in base alle condizioni dell'individuo. Dopo l'adattamento, gli animali possono resistere temporaneamente durante la cattura e l'impostazione della maschera, ma una volta che si sono seduti sulla sedia e la loro testa è fissa, si calmano. - Durante l'adattamento alla sedia, valutare i seguenti parametri comportamentali: i) emissione di rumori ansiosi o allarmanti, ii) rifiuto della ricompensa offerta e iii) movimenti violenti. Se si osserva uno di questi comportamenti, terminare la sessione per quel giorno, consentendo all'uistitì di adattarsi gradualmente all'ambiente sperimentale.
7. Registrazione EEG (2 ore al giorno)
- Preparazione della materia
- Attacca una gabbia di trasferimento a una piccola finestra della gabbia di casa e sposta l'uistitì dalla gabbia di casa alla gabbia di trasferimento, di solito da solo. Coprire la gabbia di trasporto con un panno e trasferirla nella sala sperimentale.
- Fissaggio della testa
- Cattura l'uistitì usando guanti protettivi e posizionalo sull'apposita sedia.
- Posiziona la maschera preparata sulla testa dell'uistitì. Far passare il corpo della vite fissato alla sedia attraverso il foro della maschera e fissarlo utilizzando le viti a testa zigrinata.
- Fissare leggermente la testa e la maschera con una fascia appena sotto la nasione.
NOTA: Non è stato necessario fissare completamente la testa del soggetto finché gli elettrodi non sono stati rimossi con il movimento. Pertanto, abbiamo utilizzato la stessa maschera per tutti i soggetti.
- Definizione della posizione degli elettrodi
- Utilizzare la nasion, l'inione e i lobi delle orecchie come punti di riferimento anatomici per determinare la posizione degli elettrodi secondo il metodo internazionale 10-20 32,33,34,35,36,37. Misurare la distanza tra la nasion e l'inion nella linea mediana con un metro a nastro. Definisce la posizione di Cz al centro della distanza. Posizionare gli altri elettrodi (Fz, Pz, Oz, F3 o F4) con il 20% della lunghezza inion-neion come spaziatura degli elettrodi. Segnare le posizioni degli elettrodi sul cuoio capelluto utilizzando un dermatografo a base di olio.
- Preparazione della pelle
- Strofina l'area contrassegnata con un batuffolo di cotone sottile imbevuto di alcol denaturato per rimuovere lo sporco e il sebo dal cuoio capelluto.
- Impostazioni degli elettrodi
NOTA: Eseguire i passaggi 7.2.1-7.2.3 in tutte le posizioni degli elettrodi per posizionare gli elettrodi su Fz, Cz, C3, C4, Pz, A1, A2 e F3 (o F4).- Utilizzando un tagliatubi, tagliare un pezzo di tubo in silicone con un diametro interno di 4 mm e un diametro esterno di 7 mm in una lunghezza di circa 20 mm.
- Applicare l'adesivo sui bordi del tubo tagliato e farlo aderire al cuoio capelluto.
- Riempire l'interno del tubo con gel EEG utilizzando una siringa e un ago per siringa non appuntito.
- Collegare l'elettrodo di riferimento a Pz e gli elettrodi di terra a F3 o F4 (Figura 1C).
- Inserire gli elettrodi nel tubo e collegare il cavo dell'elettrodo alla scatola di ingresso.
- Avvia l'applicazione per le registrazioni EEG per misurare l'impedenza degli elettrodi e regola i parametri per assicurarti che tutti gli elettrodi siano inferiori a 5 kΩ.
- Raggruppare i cavi degli elettrodi per ridurre il rumore.
- Premia durante la procedura di immobilizzazione della testa e tra le sessioni di attività somministrando manualmente 1-3 ml di ricompensa liquida (gomma o nutrizione) utilizzando una siringa.
- Specificare il file da salvare sul software di registrazione EEG e premere il pulsante Avvia registrazione . Eseguire lo script per la presentazione dello stimolo subito dopo l'avvio della registrazione EEG. Premere il pulsante di arresto sulla registrazione EEG quando l'esecuzione dello script di presentazione dello stimolo è completa per terminare tutte le registrazioni. Al termine della registrazione, rimuovere gli elettrodi e la maschera per la testa.
- Cattura gli animali e riportali nelle loro gabbie. Lasciare i tubi sul cuoio capelluto; Tutti i tubi sono caduti naturalmente in circa 1 giorno.
NOTA: Nei primi periodi, abbiamo usato l'acetone per sciogliere la colla adesiva e rimuovere il tubo dopo le sessioni di registrazione; tuttavia, ci sono stati casi di lesioni cutanee; Pertanto, abbiamo successivamente riportato gli animali nelle loro gabbie domestiche senza rimuovere il tubo. Nelle decine di esperimenti che abbiamo condotto finora, gli uistitì non hanno mostrato alcun interesse per le tube rimosse, e non si è mai verificata alcuna ingestione accidentale. - Stimolo
- Registra i richiami naturali, semplici e composti nella stanza in cattività o sperimentale dagli uistitì che non vengono utilizzati nelle successive registrazioni EEG. Estrai tre richiami semplici e composti specie-specifici (Phee, Tsik-Ek e Tsik-String5 ) dai file registrati.
- Oltre agli stimoli di chiamata, crea rumore bianco utilizzando una funzione nel software di programmazione e usala come stimolo.
- Per seguire questo protocollo, utilizzare tre file uditivi (16 bit, 48 kHz) di richiami di uistitì nell'esperimento. Controllare l'attività utilizzando uno script personalizzato.
NOTA: Ogni blocco contiene 50 chiamate per ogni stimolo, per un totale di 200 chiamate. Ogni blocco di registrazione durerà circa 10 minuti. Ogni partecipante deve eseguire due blocchi. L'intervallo tra le chiamate è di 3 s. Dei quattro file di stimolo audio (vedi File supplementare 1), lo stimolo di chiamata Phee era lungo circa 2 secondi, mentre gli altri tre erano lunghi circa 1 secondo. Ciò è dovuto al fatto che un singolo richiamo di Phee è ancora un richiamo di lunga durata (Figura 1D). - In ogni file di stimolo sonoro, il canale destro contiene i dati relativi al richiamo dell'uistitì o al rumore e il canale sinistro contiene il segnale di attivazione per l'inizio dello stimolo. Inviare questo segnale di attivazione al sistema di registrazione EEG tramite un dispositivo di sincronizzazione e registrarlo come ora dell'evento.
8. Analisi dei dati
NOTA: Il codice originale scritto nel software di programmazione e nella cassetta degli attrezzi è stato utilizzato per la post-elaborazione dei dati EEG, come descritto di seguito (File supplementare 2)37.
- Preelaborazione
- Rifare riferimento al riferimento dell'orecchio collegato.
- Filtro passa-alto a 2 Hz.
- Epoca da 100 ms prima a 1000 ms dopo l'insorgenza dello stimolo.
- Basale corretto rispetto alla media del periodo di prestimolo di 100 ms. Scartare gli artefatti utilizzando un criterio di ±150 μV.
- Rappresentazione grafica del potenziale evento-correlato (ERP)
- Calcola la media di tutti i dati dello studio per ciascun soggetto.
- Ottieni forme d'onda medie di gruppo calcolando la media di tutti i soggetti.
- Per confrontare gli ERP medi tra i tipi di chiamata e gli stimoli di rumore, applicare un'analisi della varianza unidirezionale (ANOVA) con gli stimoli come fattore tra i soggetti nella risposta Cz.
- Applicare l'analisi di confronto multiplo post hoc con il metodo di Tukey.
- Rappresentazione grafica della perturbazione spettrale correlata agli eventi (ERSP)
- Calcolare l'ERSP per visualizzare la variazione media correlata all'evento della potenza spettrale nel tempo in un'ampia gamma di frequenze utilizzando l'equazione (1). Fk (f,t) è la stima spettrale della prova k alla frequenza f e al tempo t:
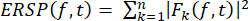 (1)
(1) - Applicare la scomposizione tempo-frequenza alle attività utilizzando trasformate wavelet sinusoidali, con tre cicli di lunghezza alla frequenza più bassa (10 Hz), aumentando linearmente con la frequenza fino a 32 cicli alla frequenza più alta (120 Hz).
- Definire le risposte iniziali e transitorie in un periodo di 150 ms dopo l'insorgenza dello stimolo a 2-30 Hz e le risposte sostenute in un periodo di 800 ms da 151 a 950 ms dopo l'insorgenza dello stimolo a 40-100 H.
- Per testare le differenze nelle risposte iniziali e sostenute in Fz e Cz tra l'età del soggetto e i tipi di chiamata, eseguire un'ANOVA bidirezionale utilizzando il tipo di chiamata come fattore all'interno del soggetto e l'età come fattore tra i soggetti.
- Calcolare l'ERSP per visualizzare la variazione media correlata all'evento della potenza spettrale nel tempo in un'ampia gamma di frequenze utilizzando l'equazione (1). Fk (f,t) è la stima spettrale della prova k alla frequenza f e al tempo t:
Access restricted. Please log in or start a trial to view this content.
Risultati
In primo luogo, abbiamo tracciato i potenziali medi correlati agli eventi (ERP) per ogni stimolo uditivo negli uistitì (Figura 2). Il potenziale evocato uditivo (AEP) era prominente nella condizione di rumore , riflettendo la chiara insorgenza degli stimoli (vedi Figura 1D). Per confrontare gli ERP medi tra i tipi di chiamata e gli stimoli di rumore, abbiamo applicato un'analisi unidirezionale della varianza (ANOVA) con gli stimoli come fattore tra i s...
Access restricted. Please log in or start a trial to view this content.
Discussione
Punti da notare sull'anestesia
Sono state tentate sia la somministrazione di ketamina che quella di xilazina e, sebbene queste siano analgesiche e quindi adatte a compiti lunghi e dolorosi, gli uistitì tendono a sperimentare diminuzioni dei livelli di ossigeno nel sangue senza inalazione di ossigeno44. In breve, l'alfaxalon è probabilmente più adatto per attività indolori come la rasatura o la creazione di maschere. Inoltre, per la rasatura, che richiede solo 10-15 minuti, ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Progetto Hakubi dell'Università di Kyoto, Grant-in-Aid for Challenging Research (Pioneering) (No.22K18644), Grant-in-Aid for Scientific Research (C) (No. 22K12745), Grant-in-Aid for Scientific Research (B) (No. 21H02851) e Grant-in-Aid for Scientific Research (A) (No. 19H01039). Vorremmo ringraziare Editage (www.editage.jp) per l'editing in lingua inglese.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
Riferimenti
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093(2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -h, et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126(2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950(2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526(2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659(2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744(2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116(2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103(2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630(2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229(2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210(2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422(2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon