Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesures d’électroencéphalographie chez les ouistitis éveillés à l’écoute des vocalisations conspécifiques
Dans cet article
Résumé
Pour étudier l’évolution du langage, il est important de comparer les mécanismes cérébraux chez les humains avec ceux des primates non humains. Nous avons développé une méthode pour mesurer de manière non invasive l’électroencéphalographie (EEG) d’animaux éveillés. Il nous permet de comparer directement les données EEG entre les humains et les animaux à long terme sans leur nuire.
Résumé
La communication vocale joue un rôle crucial dans les interactions sociales des primates, en particulier dans la survie et l’organisation sociale. Les humains ont développé une stratégie de communication vocale unique et avancée sous forme de langage. Pour étudier l’évolution du langage humain, il est nécessaire d’étudier les mécanismes neuronaux sous-jacents au traitement vocal chez l’homme, ainsi que de comprendre comment les mécanismes cérébraux ont évolué en les comparant à ceux des primates non humains. Ici, nous avons développé une méthode pour mesurer de manière non invasive l’électroencéphalographie (EEG) de primates non humains éveillés. Cette méthode d’enregistrement permet des études à long terme sans nuire aux animaux et, surtout, nous permet de comparer directement les données EEG des primates non humains avec les données humaines, fournissant ainsi des informations sur l’évolution du langage humain. Dans la présente étude, nous avons utilisé la méthode d’enregistrement EEG du cuir chevelu pour étudier l’activité cérébrale en réponse à des vocalisations spécifiques à l’espèce chez les ouistitis. Cette étude fournit de nouvelles informations en utilisant l’EEG du cuir chevelu pour capturer des représentations neuronales répandues chez les ouistitis pendant la perception vocale, comblant ainsi les lacunes des connaissances existantes.
Introduction
Les primates utilisent des vocalisations spécifiques à l’espèce pour transmettre des informations biologiquement importantes, telles que l’état émotionnel de l’appelant ou son intention de maintenir des liens sociaux, la présence de prédateurs ou d’autres situations dangereuses. L’étude des mécanismes neuronaux sous-jacents à la perception de la vocalisation chez les primates non humains riches en voix peut nous fournir des indices essentiels pour mieux comprendre les origines évolutives du langage humain.
Les ouistitis communs sont de petits primates originaires d’Amérique du Sud. Ces dernières années, les ouistitis ont été de plus en plus utilisés comme animaux modèles, aux côtés des singes macaques, en raison de leur grande reproductivité, de leur facilité d’utilisation grâce à leur petite taille et du développement de techniques transgéniques utiles 1,2,3. En plus de leur utilité en tant que modèles de maladie, une communication vocale riche au sein des groupes est une autre caractéristique unique de cette espèce 4,5,6,7. Les ouistitis échangent régulièrement des signaux vocaux pour communiquer avec leurs congénères invisibles dans la forêt. En examinant l’activité cérébrale impliquée dans la perception et la production vocales chez les ouistitis, nous pouvons déterminer comment ils traitent les informations auditives de leurs propres appels ou de leurs appels conspécifiques dans le cerveau et identifier les circuits neuronaux impliqués. Des études antérieures ont démontré une activité neuronale dans le cortex auditif primaire 8,9,10,11,12 et le cortex frontal13,14 impliqués dans la production vocale chez les ouistitis. De plus, ces réponses neuronales excitées et supprimées ont été modulées par les interactions auditives-vocales dans le cortex auditif primaire 8,10. Ces études ont fourni des données détaillées sur l’activité neuronale au niveau du neurone unique à l’aide de méthodes d’enregistrement invasives. De nombreuses études ont examiné plus en détail l’activité neuronale impliquée dans la production vocale du ouistiti ; Cependant, la perception vocale reste mal comprise15,16.
Plusieurs études non invasives d’imagerie cérébrale ont élucidé les mécanismes neuronaux du traitement vocal chez les ouistitis 17,18,19 ; Leur haute résolution spatiale est un avantage, cependant, maintenir les animaux en état d’éveil pendant le balayage nécessite des techniques avancées. Cependant, plus récemment, Jafari et al. ont identifié des régions frontotemporales impliquées dans la perception vocale chez les ouistitis éveillés à l’aide de l’imagerie par résonance magnétique fonctionnelle (IRMf)19. Presque toutes les expériences visant à élucider les fonctions cérébrales impliquées dans la perception et la production vocales chez l’homme ont été menées à l’aide de méthodes non invasives, telles que l’électroencéphalographie du cuir chevelu (EEG), la magnétoencéphalographie (MEG)20,21 et l’IRMf 22,23,24. De nombreuses études chez l’homme ont étudié l’activité cérébrale liée à la perception vocale à l’aide de l’EEG. La plupart de ces études se sont concentrées sur les informations émotionnelles 25,26,27 et la saillance des mots émotionnels 28, les résultats révélant des changements dans les potentiels liés aux événements pendant la perception vocale29. L’électrocorticographie (ECoG) et l’enregistrement de neurones uniques à l’aide d’électrodes implantées intracrâniennes chez l’homme n’ont été réalisés que dans un nombre limité d’expériences chez des patients subissant un traitement neurochirurgical30,31.
Une perspective évolutionniste comparant les humains aux singes est importante pour comprendre les mécanismes neuronaux uniques sous-jacents à la perception et à la production vocales qui se sont développés chez les humains. Pour comparer directement les mécanismes neuronaux impliqués dans la perception de la parole et la vocalisation chez les primates non humains riches en voix, tels que le ouistiti, avec les humains, il est important de comparer les données entre les deux espèces en utilisant la même méthode. L’IRM fonctionnelle permet l’imagerie de l’ensemble du cerveau et a une résolution spatiale élevée. Il a l’avantage d’enregistrer l’activité perpendiculairement au crâne ou dans des régions profondes difficiles à enregistrer avec l’EEG ou la MEG. Cependant, l’appareil d’IRM est coûteux à installer et à entretenir, et il existe de nombreuses restrictions sur les stimuli qui peuvent être présentés en raison de la nature de l’appareil. En comparaison, l’EEG, les potentiels liés aux événements (ERP) et le MEG ont une résolution temporelle élevée, ce qui les rend utiles pour analyser le traitement vocal des séries temporelles. En particulier, l’EEG présente les avantages d’une grande mobilité et de la possibilité d’être utilisé dans une variété de contextes expérimentaux, d’un coût relativement faible et de la nécessité d’un seul opérateur.
Étant donné qu’une grande quantité de données EEG a déjà été obtenue chez l’homme, des méthodes de mesure EEG utilisant des paradigmes non invasifs sont nécessaires pour les primates non humains. Notre groupe de recherche a mis au point une méthode unique d’enregistrement EEG non invasive utilisant des tubes32 pour les macaques et les ouistitis. Ici, nous rapportons plusieurs nouvelles découvertes concernant le traitement auditif chez les primates non humains 33,34,35,36,37. Pour caractériser l’activité cérébrale en réponse à des vocalisations spécifiques à l’espèce chez les ouistitis, nous avons construit un système expérimental permettant d’enregistrer de manière non invasive l’activité cérébrale à l’aide d’électrodes placées sur le cuir chevelu. Dans cette étude, nous décrivons la méthode de mesure EEG pour les ouistitis.
Protocole
Toutes les expériences ont été approuvées par le Comité d’expérimentation animale de l’EHUB (n°2022-003, 2023-104) et menées conformément au Guide de soins et d’utilisation des primates de laboratoire publié par l’EHUB. Neuf ouistitis communs (Callithrix jacchus, six mâles et trois femelles, âgés de 2 à 12 ans, pesant de 330 à 490 g) ont été utilisés pour l’expérience.
1. Animaux
- Hébergez les ouistitis dans des cages individuelles équipées de nichoirs, de perchoirs en bois et d’autres dispositifs d’enrichissement.
- Maintenez les pièces sous un cycle lumière-obscurité de 12 heures, avec une température et une humidité maintenues à 28 ± 2 °C et 40 ± 20 %, respectivement.
- Donnez aux animaux 14 g de granulés de singe du Nouveau Monde deux fois par jour, complétés par de la nourriture telle que de la gomme arabique et des vers de farine. Fournir de l’eau à volonté.
- Réalisez toutes les expériences dans une boîte insonorisée dans une salle d’expérimentation.
2. Équipement (figure 1B et tableau des matériaux)
- Utilisez des électrodes en argent de 4 mm. Le revêtement AgCl sur la surface de l’électrode empêche la polarisation et assure un enregistrement stable.
- Utilisez un amplificateur pour enregistrer les signaux EEG. Filtre passe-bande (0,016-250 Hz) et échantillonnez les données à 1 000 Hz.
- Connectez un boîtier d’entrée d’électrode à 64 canaux à l’amplificateur, en le plaçant devant le sujet.
- Placez le haut-parleur à 30 cm de la tête du ouistiti et contrôlez le niveau sonore à 65-75 dB, mesuré dans la position de l’oreille. Délivrez les stimuli auditifs via ce haut-parleur.
- Placez la caméra devant le sujet pour surveiller son état pendant l’enregistrement EEG.
- La chaise primate est construite à partir de plaques acryliques et de poteaux en résine synthétique. Pour les expériences, demandez au chercheur de tenir les animaux pendant qu’ils sont assis sur le repose-pieds ; À ce stade, insérez un collier et fixez-le au panneau du cou, et insérez et fixez la taille au panneau de taille. Assurez-vous que tout le corps de chaque ouistiti est bien fixé.
3. Anesthésie
- Anesthésier les animaux avec une injection intramusculaire d’alfaxalone (6-8 mg/kg) et d’atropine (0,05 mg/kg). Ce protocole permet de maintenir l’anesthésie pendant environ 20 min. Administrer des doses supplémentaires d’alfaxalone pour prolonger la durée de l’anesthésie si la procédure est plus longue. Administrez également des agents antiémétiques (Maropitant 1 mg/kg, injection sous-cutanée) au préalable pour contrer les nausées, qui sont un effet secondaire de l’alfaxalone.
REMARQUE : Les ouistitis doivent être sous anesthésie par injection ou inhalation pendant les procédures et doivent être autorisés à récupérer immédiatement après le rasage des cheveux. - Surveillez les signes vitaux à l’aide d’un oxymètre de pouls et administrez un mélange oxygène-air (O2 0,5 L/min, air 0,5 L/min) si nécessaire.
- Maintenez la température ambiante au-dessus de 27 °C et enroulez un chiffon chauffant autour du corps du ouistiti pour prévenir l’hypothermie.
4. L’épilation
- Rasez toute la tête (y compris derrière l’auriculaire) avec un rasoir électrique.
- Appliquez une crème dépilatoire pour les peaux sensibles. Essuyez la crème avec une gaze humide au bout de 5 min.
5. Préparation du masque
- Manipulez un masque thermoplastique à l’avance pour l’adapter à la taille de la chaise de singe. Plus précisément, percez la partie du dossier qui dépasse de la longueur verticale de la chaise avec quatre trous de vis afin qu’elle puisse être fixée à la plaque de cou de la chaise.
REMARQUE : Les masques thermoplastiques sont sûrs et peuvent être utilisés pour immobiliser la tête pendant la radiothérapie chez les patients. Nous avons utilisé un petit masque conçu pour les enfants et l’avons coupé pour l’adapter à la taille des ouistitis. Ce masque se ramollit lorsqu’il est placé dans de l’eau tiède à 75 °C et durcit lorsque la température baisse lorsqu’il est retiré de l’eau. - Pour les expériences, placez les animaux dans une chaise pour primates. Soutenez l’animal anesthésié à l’aide de plaques de cou et de taille et fixez l’animal et ces plaques à la chaise.
- Réchauffez le masque dans de l’eau chaude puis moulez-le pour qu’il s’adapte à la tête du ouistiti. Après avoir retiré le masque de l’eau tiède, attendez que la température baisse (environ dans la plage des 50 °C) pour éviter les brûlures, puis placez-le sur la tête du sujet pour mouler le masque.
- Après refroidissement et durcissement, détachez le masque de l’animal et découpez le haut de la tête et des oreilles du masque pour exposer la zone de réglage de l’électrode.
REMARQUE : Une fois ce masque fabriqué, il pourrait être utilisé sur d’autres individus.
6. Adaptation de la chaise et du masque (30 min/jour pendant 3 jours)
- Habituez l’animal à la chaise dans des conditions d’éveil en le plaçant sur une chaise et en le récompensant pendant environ 30 min. Répétez cette procédure pendant 3 jours.
- Habituez l’animal à la fixation de la tête à l’aide du masque pendant 2 jours.
REMARQUE : Ce processus d’adaptation a été adapté à l’état de la personne. Après l’adaptation, les animaux peuvent résister temporairement pendant la capture et la pose du masque, mais une fois qu’ils sont assis sur la chaise et que leur tête est fixe, ils deviennent calmes. - Lors de l’adaptation de la chaise, évaluez les paramètres comportementaux suivants : i) émission de bruits anxieux ou alarmants, ii) rejet de la récompense offerte, et iii) mouvements violents. Si l’un de ces comportements est observé, mettez fin à la séance pour ce jour-là, permettant au ouistiti de s’adapter progressivement à l’environnement expérimental.
7. Enregistrement EEG (2 h/jour)
- Préparation du sujet
- Fixez une cage de transfert à une petite fenêtre de la cage d’accueil et déplacez le ouistiti de la cage d’accueil à la cage de transfert, généralement tout seul. Couvrez la cage de transport avec un chiffon et transférez-la dans la salle d’expérimentation.
- Fixation de la tête
- Capturez le ouistiti à l’aide de gants de protection et placez-le dans la chaise spéciale.
- Placez le masque préparé sur la tête du ouistiti. Passez le corps de la vis fixé à la chaise à travers le trou du masque et fixez-le à l’aide de vis à oreilles.
- Fixez légèrement la tête et le masque avec une bande juste en dessous de la nasion.
REMARQUE : La tête du sujet n’avait pas besoin d’être complètement fixée tant que les électrodes n’étaient pas retirées par le mouvement. Par conséquent, nous avons utilisé le même masque pour tous les sujets.
- Définition de l’emplacement des électrodes
- Utilisez la nasion, l’inion et les lobes d’oreille comme repères anatomiques pour déterminer l’emplacement des électrodes selon la méthode internationale 10-20 32,33,34,35,36,37. Mesurez la distance entre la nasion et l’inion sur la ligne médiane avec un ruban à mesurer. Définissez l’emplacement de Cz au milieu de la distance. Positionnez les autres électrodes (Fz, Pz, Oz, F3 ou F4) avec 20 % de la longueur inion-néion comme espacement des électrodes. Marquez les positions des électrodes sur le cuir chevelu à l’aide d’un dermatographe à base d’huile.
- Préparation de la peau
- Frottez la zone marquée avec un coton-tige fin trempé dans de l’alcool à friction pour éliminer la saleté et le sébum du cuir chevelu.
- Réglages des électrodes
REMARQUE : Effectuez les étapes 7.2.1-7.2.3 à toutes les positions d’électrode pour placer les électrodes à Fz, Cz, C3, C4, Pz, A1, A2 et F3 (ou F4).- À l’aide d’un coupe-tube, coupez un morceau de tube en silicone d’un diamètre intérieur de 4 mm et d’un diamètre extérieur de 7 mm en une longueur d’environ 20 mm.
- Appliquez de l’adhésif sur les bords du tube coupé et collez-le sur le cuir chevelu.
- Remplissez l’intérieur du tube avec du gel EEG à l’aide d’une seringue et d’une aiguille de seringue non pointue.
- Connectez l’électrode de référence à Pz et les électrodes de masse à F3 ou F4 (Figure 1C).
- Insérez les électrodes dans le tube et connectez le câble d’électrode au boîtier d’entrée.
- Lancez l’application d’enregistrement EEG pour mesurer l’impédance des électrodes et ajustez les paramètres pour vous assurer que toutes les électrodes sont inférieures à 5 kΩ.
- Regroupez les câbles d’électrodes pour réduire le bruit.
- Donnez des récompenses pendant la procédure d’immobilisation de la tête et entre les séances de tâches en administrant manuellement 1 à 3 ml de récompense liquide (gomme ou nutrition) à l’aide d’une seringue.
- Spécifiez le fichier à enregistrer sur le logiciel d’enregistrement EEG et appuyez sur le bouton Démarrer l’enregistrement . Exécutez le script de présentation du stimulus immédiatement après le démarrage de l’enregistrement EEG. Appuyez sur le bouton d’arrêt de l’enregistrement EEG lorsque l’exécution du script de présentation du stimulus est terminée pour mettre fin à tous les enregistrements. Une fois l’enregistrement terminé, retirez les électrodes et le masque de tête.
- Capturez les animaux et ramenez-les dans leurs cages de transport. Laissez les tubes sur le cuir chevelu ; Tous les tubes sont tombés naturellement en environ 1 jour.
REMARQUE : Dans les premières périodes, nous utilisions de l’acétone pour dissoudre la colle adhésive et retirer le tube après les sessions d’enregistrement ; cependant, il y a eu des cas de lésions cutanées ; Par conséquent, nous avons ensuite renvoyé les animaux dans leurs cages d’origine sans retirer le tube. Dans les dizaines d’expériences que nous avons menées jusqu’à présent, les ouistitis n’ont montré aucun intérêt pour les tubes retirés et aucune ingestion accidentelle n’a jamais eu lieu. - Stimulus
- Enregistrez des appels naturels, simples et composés dans la salle captive ou expérimentale à partir de ouistitis qui ne sont pas utilisés dans les enregistrements EEG ultérieurs. Extrayez trois appels simples et composés spécifiques à l’espèce (appels Phee, Tsik-Ek et Tsik-String5 ) à partir des fichiers enregistrés.
- En plus des stimuli d’appel, créez un bruit blanc à l’aide d’une fonction du logiciel de programmation et utilisez-la comme stimulus.
- Pour suivre ce protocole, utilisez trois fichiers auditifs (16 bits, 48 kHz) de cris de ouistitis dans l’expérience. Contrôlez la tâche à l’aide d’un script personnalisé.
REMARQUE : Chaque bloc contient 50 appels pour chaque stimulus, pour un total de 200 appels. Chaque bloc d’enregistrement durera environ 10 min. Chaque participant doit effectuer deux blocs. L’intervalle entre les appels est de 3 s. Sur les quatre fichiers de stimulus audio (voir le fichier supplémentaire 1), le stimulus d’appel Phee durait environ 2 s, tandis que les trois autres avaient une longueur d’environ 1 s. En effet, un seul cri de Phee est toujours un cri de longue durée (figure 1D). - Dans chaque fichier de stimulus sonore, le canal droit contient l’appel du ouistiti ou les données de bruit, et le canal gauche contient le signal de déclenchement pour le début du stimulus. Envoyez ce signal de déclenchement au système d’enregistrement EEG via un dispositif de synchronisation et enregistrez-le en tant qu’heure d’événement.
8. Analyse des données
REMARQUE : Le code original écrit dans le logiciel de programmation et la boîte à outils a été utilisé pour post-traiter les données EEG, comme indiqué ci-dessous (Fichier supplémentaire 2)37.
- Prétraitement
- Re-référence à la référence d’oreille liée.
- Filtre passe-haut à 2 Hz.
- Époque de 100 ms avant à 1000 ms après le début du stimulus.
- Conforme à la ligne de base à la moyenne de la période de pré-stimulus de 100 ms. Rejeter les artefacts en utilisant un critère de ±150 μV.
- Cartographie du potentiel lié à l’événement (ERP)
- Faites la moyenne de toutes les données de l’essai pour chaque sujet.
- Obtenez des formes d’onde moyennées par groupe en faisant la moyenne de tous les sujets.
- Pour comparer les PAR moyennés entre les types d’appels et les stimuli sonores, appliquez une analyse de variance à un facteur (ANOVA) avec les stimuli comme facteur inter-sujets dans la réponse Cz.
- Appliquez une analyse de comparaison multiple a posteriori avec la méthode de Tukey.
- Tracé de la perturbation spectrale liée à un événement (ERSP)
- Calculez l’ERSP pour visualiser la variation moyenne de la puissance spectrale liée à l’événement au fil du temps dans une large gamme de fréquences à l’aide de l’équation (1). Fk (f,t) est l’estimation spectrale de l’essai k à la fréquence f et au temps t :
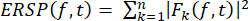 (1)
(1) - Appliquez la décomposition temps-fréquence aux activités à l’aide de transformées en ondelettes sinusoïdales, avec trois cycles de durée à la fréquence la plus basse (10 Hz), augmentant linéairement avec la fréquence jusqu’à 32 cycles à la fréquence la plus élevée (120 Hz).
- Définissez les réponses initiales et transitoires dans une période de 150 ms après le début du stimulus à 2-30 Hz, et les réponses soutenues dans une période de 800 ms de 151 à 950 ms après le début du stimulus à 40-100 H.
- Pour tester les différences entre les réponses initiales et soutenues dans les Fz et Cz entre les âges et les types d’appels des sujets, effectuez une ANOVA à deux facteurs en utilisant le type d’appel comme facteur intra-sujet et les âges comme facteur inter-sujet.
- Calculez l’ERSP pour visualiser la variation moyenne de la puissance spectrale liée à l’événement au fil du temps dans une large gamme de fréquences à l’aide de l’équation (1). Fk (f,t) est l’estimation spectrale de l’essai k à la fréquence f et au temps t :
Résultats
Tout d’abord, nous avons tracé les potentiels moyens liés aux événements (ERP) pour chaque stimulus auditif chez les ouistitis (Figure 2). Le potentiel évoqué auditif (AEP) était proéminent dans la condition de bruit , reflétant le début clair des stimuli (voir Figure 1D). Pour comparer les ERP moyennés entre les types d’appels et les stimuli sonores, nous avons appliqué une analyse de variance à un facteur (ANOVA) avec les stimuli comm...
Discussion
Points à noter sur l’anesthésie
L’administration de kétamine et de xylazine a été tentée, et bien qu’elles soient analgésiques et donc adaptées aux tâches longues et douloureuses, les ouistitis ont tendance à ressentir une diminution des niveaux d’oxygène dans le sang sans inhalation d’oxygène44. En bref, l’alfaxalon est probablement le mieux adapté pour des tâches indolores telles que le rasage ou la fabrication de masques. De plus, pour le rasage, qu...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par le projet Hakubi de l’Université de Kyoto, la subvention pour la recherche stimulante (pionnière) (n° 22K18644), la subvention pour la recherche scientifique (C) (n° 22K12745), la subvention pour la recherche scientifique (B) (n° 21H02851) et la subvention pour la recherche scientifique (A) (n° 19H01039). Nous tenons à remercier Editage (www.editage.jp) pour l’édition en anglais.
matériels
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
Références
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon