É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medidas de eletroencefalografia em saguis acordados ouvindo vocalizações coespecíficas
Neste Artigo
Resumo
Para estudar a evolução da linguagem, é importante comparar os mecanismos cerebrais em humanos com os de primatas não humanos. Desenvolvemos um método para medir de forma não invasiva o eletroencefalografia (EEG) de animais acordados. Isso nos permite comparar diretamente os dados de EEG entre humanos e animais a longo prazo sem prejudicá-los.
Resumo
A comunicação vocal desempenha um papel crucial nas interações sociais dos primatas, particularmente na sobrevivência e na organização social. Os humanos desenvolveram uma estratégia de comunicação vocal única e avançada na forma de linguagem. Para estudar a evolução da linguagem humana, é necessário investigar os mecanismos neurais subjacentes ao processamento vocal em humanos, bem como entender como os mecanismos cerebrais evoluíram, comparando-os com os de primatas não humanos. Aqui, desenvolvemos um método para medir de forma não invasiva o eletroencefalografia (EEG) de primatas não humanos acordados. Esse método de registro permite estudos de longo prazo sem prejudicar os animais e, mais importante, nos permite comparar diretamente os dados de EEG de primatas não humanos com os dados humanos, fornecendo informações sobre a evolução da linguagem humana. No presente estudo, usamos o método de gravação de EEG do couro cabeludo para investigar a atividade cerebral em resposta a vocalizações específicas da espécie em saguis. Este estudo fornece novos insights usando o EEG do couro cabeludo para capturar representações neurais generalizadas em saguis durante a percepção vocal, preenchendo lacunas no conhecimento existente.
Introdução
Os primatas usam vocalizações específicas da espécie para transmitir informações biologicamente importantes, como o estado emocional do chamador ou a intenção de manter laços sociais, a presença de predadores ou outras situações perigosas. A investigação dos mecanismos neurais subjacentes à percepção da vocalização em primatas não humanos ricos em vocais pode nos fornecer pistas críticas para entender melhor as origens evolutivas da linguagem humana.
Os saguis-comuns são pequenos primatas nativos da América do Sul. Nos últimos anos, os saguis têm sido cada vez mais utilizados como animais modelo, ao lado dos macacos, devido à sua alta reprodutividade, facilidade de uso devido ao seu pequeno tamanho e desenvolvimento de técnicas transgênicas úteis 1,2,3. Além de sua utilidade como modelos de doenças, a rica comunicação vocal dentro dos grupos é outra característica única dessa espécie 4,5,6,7. Os saguis rotineiramente trocam sinais vocais para se comunicar com coespecíficos invisíveis na floresta. Ao examinar a atividade cerebral envolvida na percepção e produção vocal em saguis, podemos determinar como eles processam as informações auditivas próprias ou de chamadas coespecíficas no cérebro e identificar quais circuitos neurais estão envolvidos. Estudos anteriores demonstraram atividade neural no córtex auditivo primário8,9,10,11,12 e no córtex frontal13,14 envolvidos na produção vocal em saguis. Além disso, essas respostas neuronais excitadas e suprimidas foram moduladas por interações auditivo-vocais no córtex auditivo primário 8,10. Esses estudos forneceram dados detalhados de atividade neural no nível de um único neurônio usando métodos de registro invasivos. Numerosos estudos examinaram ainda mais a atividade neural envolvida na produção vocal do sagui; no entanto, a percepção vocal permanece pouco compreendida15,16.
Vários estudos não invasivos de imagem cerebral elucidaram os mecanismos neurais do processamento vocal em saguis 17,18,19; Sua alta resolução espacial é uma vantagem, no entanto, manter os animais acordados durante a varredura requer técnicas avançadas. No entanto, mais recentemente, Jafari et al. identificaram regiões frontotemporais envolvidas na percepção vocal em saguis acordados por meio de ressonância magnética funcional (fMRI)19. Quase todos os experimentos para elucidar as funções cerebrais envolvidas na percepção e produção vocal em humanos foram conduzidos usando métodos não invasivos, como eletroencefalografia do couro cabeludo (EEG), magnetoencefalografia (MEG)20,21 e fMRI22,23,24. Numerosos estudos em humanos investigaram a atividade cerebral relacionada à percepção vocal usando EEG. A maioria desses estudos tem se concentrado na informação emocional 25,26,27 e na saliência das palavras emocionais 28, com os resultados revelando mudanças nos potenciais relacionados a eventos durante a percepção vocal29. A eletrocorticografia (ECoG) e os registros de neurônios únicos usando eletrodos implantados intracranialmente em humanos foram conduzidos apenas em um número limitado de experimentos em pacientes submetidos a tratamento neurocirúrgico30,31.
Uma perspectiva evolutiva comparando humanos com macacos é importante para entender os mecanismos neurais únicos subjacentes à percepção e produção vocal que se desenvolveram em humanos. Para comparar diretamente os mecanismos neurais envolvidos na percepção da fala e vocalização em primatas não humanos ricos em vocais, como o sagui, com humanos, é importante comparar os dados entre as duas espécies usando o mesmo método. A ressonância magnética funcional permite imagens de todo o cérebro e tem uma alta resolução espacial. Tem a vantagem de registrar a atividade perpendicular ao crânio ou em regiões profundas que são difíceis de registrar com EEG ou MEG. No entanto, a máquina de ressonância magnética é cara de instalar e manter, e há muitas restrições nos estímulos que podem ser apresentados devido à natureza do dispositivo. Em comparação, EEG, potenciais relacionados a eventos (ERPs) e MEG têm alta resolução temporal, tornando-os úteis para analisar o processamento vocal de séries temporais. Em particular, o EEG tem as vantagens de alta mobilidade e a capacidade de ser usado em uma variedade de ambientes experimentais, custo relativamente baixo e a necessidade de apenas um único operador.
Uma vez que uma grande quantidade de dados de EEG já foi obtida em humanos, métodos de medição de EEG usando paradigmas não invasivos são necessários para primatas não humanos. Nosso grupo de pesquisa desenvolveu um método único de gravação de EEG não invasivo usando tubos32 para macacos e saguis. Aqui, relatamos vários novos achados sobre o processamento auditivo em primatas não humanos 33,34,35,36,37. Para caracterizar a atividade cerebral em resposta a vocalizações específicas da espécie em saguis, construímos um sistema experimental para registrar de forma não invasiva a atividade cerebral usando eletrodos colocados no couro cabeludo. Neste estudo, descrevemos o método de medição de EEG para saguis.
Protocolo
Todos os experimentos foram aprovados pelo Comitê de Experimentação Animal do EHUB (nº 2022-003, 2023-104) e conduzidos de acordo com o Guia de Cuidados e Uso de Primatas de Laboratório publicado pelo EHUB. Nove saguis comuns (Callithrix jacchus, seis machos e três fêmeas, de 2 a 12 anos, pesando 330-490 g) foram utilizados para o experimento.
1. Animais
- Alojar os saguis em gaiolas individuais equipadas com caixas-ninho, poleiros de madeira e outros dispositivos de enriquecimento.
- Manter as divisões em ciclo claro-escuro de 12 h, com temperatura e humidade mantidas a 28 ± 2 °C e 40 ± 20%, respetivamente.
- Alimente os animais com 14 g de pellets de macaco do Novo Mundo duas vezes ao dia, complementados com alimentos como goma arábica e larvas de farinha. Forneça água ad libitum.
- Realize todos os experimentos em uma caixa com atenuação de som em uma sala experimental.
2. Equipamento (Figura 1B e Tabela de Materiais)
- Use eletrodos de prata de 4 mm. O revestimento AgCl na superfície do eletrodo evita a polarização e garante uma gravação estável.
- Use um amplificador para gravar os sinais de EEG. Filtro passa-banda (0,016-250 Hz) e amostra dos dados a 1.000 Hz.
- Conecte uma caixa de entrada de eletrodo de 64 canais ao amplificador, colocando-o na frente do assunto.
- Coloque o alto-falante a 30 cm da cabeça do sagui e controle o nível de som em 65-75 dB, conforme medido na posição do ouvido. Forneça os estímulos auditivos por meio deste alto-falante.
- Coloque a câmera na frente do sujeito para monitorar sua condição durante a gravação do EEG.
- A cadeira primata é construída com placas de acrílico e postes de resina sintética. Para os experimentos, peça ao pesquisador que segure os animais enquanto eles se sentam na plataforma; Neste ponto, insira um colar e prenda-o ao painel do pescoço e insira e prenda o Certifique-se de que todo o corpo de cada sagui esteja frouxamente preso.
3. Anestesia
- Anestesiar os animais com uma injeção intramuscular de alfaxalona (6-8 mg/kg) e atropina (0,05 mg/kg). Este protocolo permite que a anestesia seja mantida por aproximadamente 20 min. Administre doses adicionais de alfaxalona para prolongar a duração da anestesia se o procedimento for mais longo. Administre também agentes antieméticos (Maropitant 1 mg / kg, injeção subcutânea) antes para combater a náusea, que é um efeito colateral da alfaxalona.
NOTA: Os saguis devem estar sob injeção ou anestesia inalatória durante os procedimentos e devem se recuperar imediatamente após o barbear do cabelo. - Monitore os sinais vitais com um oxímetro de pulso e administre uma mistura de oxigênio-ar (Ø2 0,5 L/min, ar 0,5 L/min) se necessário.
- Mantenha a temperatura ambiente acima de 27 °C e enrole um pano de aquecimento ao redor do corpo do sagui para evitar hipotermia.
4. Depilação
- Raspe toda a cabeça (inclusive atrás da auricularia) com um barbeador elétrico.
- Aplique creme depilatório para peles sensíveis. Limpe o creme com uma gaze úmida após 5 min.
5. Preparação da máscara
- Processe uma máscara termoplástica com antecedência para caber no tamanho da cadeira de macaco. Especificamente, perfure a parte das costas que se projeta do comprimento vertical da cadeira com quatro orifícios para parafusos, de modo que possa ser fixada na placa do pescoço da cadeira.
NOTA: As máscaras termoplásticas são seguras e podem ser usadas para imobilizar a cabeça durante a radioterapia em pacientes. Usamos uma pequena máscara projetada para crianças e a cortamos para caber no tamanho dos saguis. Esta máscara amolece quando colocada em água morna a 75 °C e endurece à medida que a temperatura diminui quando é removida da água. - Para os experimentos, coloque os animais em uma cadeira de primata. Apoie o animal anestesiado usando placas de pescoço e cintura e prenda o animal e essas placas na cadeira.
- Aqueça a máscara em água quente e molde-a para caber na cabeça do sagui. Depois de retirar a máscara da água morna, espere que a temperatura caia (aproximadamente na faixa de 50 °C) para evitar queimaduras e, em seguida, coloque-a na cabeça do sujeito para moldar a máscara.
- Após o resfriamento e endurecimento, retire a máscara do animal e corte a parte superior da cabeça e as partes da orelha da máscara para expor a área para a fixação do eletrodo.
NOTA: Uma vez que esta máscara foi feita, ela pode ser usada em outras pessoas.
6. Adaptação da cadeira e da máscara (30 min/dia durante 3 dias)
- Habitue o animal à cadeira em condições de vigília, colocando-o em uma cadeira e recompensando-o por aproximadamente 30 minutos. Repita este procedimento por 3 dias.
- Habituar o animal à fixação da cabeça com a máscara durante 2 dias.
NOTA: Este processo de adaptação foi personalizado para a condição do indivíduo. Após a adaptação, os animais podem resistir temporariamente durante a captura e a colocação da máscara de cabeça, mas uma vez que estão sentados na cadeira e sua cabeça está fixa, eles ficam calmos. - Durante a adaptação da cadeira, avaliar os seguintes parâmetros comportamentais: i) emissão de ruídos ansiosos ou alarmantes, ii) rejeição da recompensa oferecida e iii) movimentos violentos. Se algum desses comportamentos for observado, encerre a sessão daquele dia, permitindo que o sagui se adapte gradualmente ao ambiente experimental.
7. Gravação de EEG (2 h/dia)
- Preparação do assunto
- Prenda uma gaiola de transferência a uma pequena janela da gaiola doméstica e mova o sagui da gaiola doméstica para a gaiola de transferência, geralmente sozinho. Cubra a gaiola de transporte com um pano e transfira-a para a sala experimental.
- Fixação da cabeça
- Capture o sagui usando luvas de proteção e coloque-o na cadeira especial.
- Coloque a máscara preparada na cabeça do sagui. Passe o corpo do parafuso preso à cadeira pelo orifício da máscara e fixe-o com parafusos de aperto manual.
- Prenda a cabeça e a máscara levemente com uma faixa logo abaixo do násio.
NOTA: A cabeça do sujeito não precisava ser completamente fixada, desde que os eletrodos não fossem removidos pelo movimento. Portanto, usamos a mesma máscara em todos os sujeitos.
- Definição da localização dos eletrodos
- Use o násio, o íon e os lóbulos das orelhas como marcos anatômicos para determinar a localização dos eletrodos de acordo com o método Internacional 10-20 32,33,34,35,36,37. Meça a distância entre o násio e o íon na linha média com uma fita métrica. Defina a localização de Cz no meio da distância. Posicione os outros eletrodos (Fz, Pz, Oz, F3 ou F4) com 20% do comprimento do ion-neion como espaçamento do eletrodo. Marque as posições dos eletrodos no couro cabeludo usando um dermatograma à base de óleo.
- Preparação da pele
- Esfregue a área marcada com um cotonete fino embebido em álcool isopropílico para remover a sujeira e o sebo do couro cabeludo.
- Configurações do eletrodo
NOTA: Execute as etapas 7.2.1-7.2.3 em todas as posições dos eletrodos para colocar os eletrodos em Fz, Cz, C3, C4, Pz, A1, A2 e F3 (ou F4).- Usando um cortador de tubo, corte um pedaço de tubo de silicone com um diâmetro interno de 4 mm e um diâmetro externo de 7 mm em um comprimento de aproximadamente 20 mm.
- Aplique adesivo nas bordas do tubo cortado e cole-o no couro cabeludo.
- Encha o interior do tubo com gel de EEG usando uma seringa e uma agulha de seringa não pontiaguda.
- Conecte o eletrodo de referência a Pz e os eletrodos de aterramento a F3 ou F4 (Figura 1C).
- Insira os eletrodos no tubo e conecte o cabo do eletrodo à caixa de entrada.
- Inicie o aplicativo para gravações de EEG para medir a impedância do eletrodo e ajuste os parâmetros para garantir que todos os eletrodos estejam abaixo de 5 kΩ.
- Agrupe os cabos do eletrodo para reduzir o ruído.
- Dê recompensas durante o procedimento de imobilização da cabeça e entre as sessões de tarefas, administrando manualmente 1-3 mL da recompensa líquida (goma ou nutrição) usando uma seringa.
- Especifique o arquivo a ser salvo no software de gravação EEG e pressione o botão Iniciar gravação . Execute o script para apresentação do estímulo imediatamente após o início da gravação do EEG. Pressione o botão de parada na gravação do EEG quando a execução do script de apresentação do estímulo estiver concluída para encerrar todas as gravações. Quando a gravação estiver concluída, remova os eletrodos e a máscara de cabeça.
- Capture os animais e devolva-os às gaiolas de transporte. Deixe as trompas no couro cabeludo; Todos os tubos caíram naturalmente em aproximadamente 1 dia.
NOTA: Nos períodos iniciais, usamos acetona para dissolver a cola adesiva e remover o tubo após as sessões de gravação; no entanto, houve casos de lesão cutânea; portanto, posteriormente devolvemos os animais às gaiolas de suas casas sem remover o tubo. Nas dezenas de experimentos que realizamos até agora, os saguis não demonstraram interesse nos tubos removidos e nenhuma ingestão acidental ocorreu. - Estímulo
- Grave chamadas naturais simples e compostas na sala cativa ou experimental de saguis que não são usados em gravações de EEG subsequentes. Extraia três chamadas simples e compostas específicas da espécie (chamadas Phee, Tsik-Ek e Tsik-String5 ) dos arquivos gravados.
- Além dos estímulos de chamada, crie ruído branco usando uma função no software de programação e use-o como estímulo.
- Para seguir este protocolo, use três arquivos auditivos (16 bits, 48 kHz) de chamadas de saguis no experimento. Controle a tarefa usando um script personalizado.
NOTA: Cada bloco contém 50 chamadas para cada estímulo, para um total de 200 chamadas. Cada bloco de gravação durará aproximadamente 10 min. Cada participante deve realizar dois blocos. O intervalo entre chamadas é de 3 s. Dos quatro arquivos de estímulo de áudio (ver Arquivo Suplementar 1), o estímulo de chamada Phee tinha aproximadamente 2 s de comprimento, enquanto os outros três tinham aproximadamente 1 s de comprimento. Isso ocorreu porque uma única chamada Phee ainda é uma chamada de longa duração (Figura 1D). - Em cada arquivo de estímulo sonoro, o canal direito contém os dados de chamada ou ruído do sagui e o canal esquerdo contém o sinal de disparo para o início do estímulo. Envie este sinal de disparo para o sistema de gravação de EEG por meio de um dispositivo de sincronização e registre-o como hora do evento.
8. Análise dos dados
NOTA: O código original escrito no software de programação e na caixa de ferramentas foi usado para pós-processar os dados do EEG, conforme descrito abaixo (Arquivo Suplementar 2)37.
- Pré-processamento
- Refaça referência à referência de orelha vinculada.
- Filtro passa-alta a 2 Hz.
- Época de 100 ms antes a 1000 ms após o início do estímulo.
- Linha de base correta para a média do período pré-estímulo de 100 ms. Rejeite artefatos usando um critério de ±150 μV.
- Plotagem do potencial relacionado a eventos (ERP)
- Calcule a média de todos os dados do estudo para cada sujeito.
- Obtenha formas de onda médias de grupo calculando a média de todos os assuntos.
- Para comparar os ERPs médios entre tipos de chamada e estímulos de ruído, aplique uma análise de variância unidirecional (ANOVA) com estímulos como o fator entre os sujeitos na resposta Cz.
- Aplicar análise de comparação múltipla post hoc com o método de Tukey.
- Plotagem de perturbação espectral relacionada a eventos (ERSP)
- Calcule o ERSP para visualizar a mudança média relacionada ao evento na potência espectral ao longo do tempo em uma ampla faixa de frequência usando a Equação (1). Fk (f,t) é a estimativa espectral do ensaio k na frequência f e no tempo t:
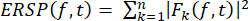 Características (1)
Características (1) - Aplicar a decomposição tempo-frequência às atividades utilizando transformadas wavelet senoidais, com três ciclos de duração na frequência mais baixa (10 Hz), aumentando linearmente com frequência até 32 ciclos na frequência mais alta (120 Hz).
- Defina as respostas iniciais e transitórias em um período de 150 ms após o início do estímulo em 2-30 Hz, e as respostas sustentadas em um período de 800 ms de 151 a 950 ms após o início do estímulo em 40-100 H.
- Para testar as diferenças nas respostas iniciais e sustentadas em Fz e Cz entre as idades dos sujeitos e os tipos de chamada, realize uma ANOVA bidirecional usando o tipo de chamada como o fator dentro do sujeito e as idades como o fator entre os sujeitos.
- Calcule o ERSP para visualizar a mudança média relacionada ao evento na potência espectral ao longo do tempo em uma ampla faixa de frequência usando a Equação (1). Fk (f,t) é a estimativa espectral do ensaio k na frequência f e no tempo t:
Resultados
Primeiramente, plotamos os potenciais médios relacionados a eventos (ERPs) para cada estímulo auditivo nos saguis (Figura 2). O potencial evocado auditivo (PEA) foi proeminente na condição Ruído , refletindo o início claro dos estímulos (ver Figura 1D). Para comparar os ERPs médios entre tipos de chamada e estímulos de ruído, aplicamos uma análise de variância unidirecional (ANOVA) com estímulos como o fator entre os sujeitos na resposta Cz...
Discussão
Pontos a serem observados sobre anestesia
Tanto a administração de cetamina quanto a xilazina foram tentadas e, embora sejam analgésicas e, portanto, adequadas para tarefas longas e dolorosas, os saguis tendem a apresentar diminuição nos níveis de oxigênio no sangue sem inalação de oxigênio44. Em suma, o alfaxalon é provavelmente mais adequado para tarefas indolores, como barbear ou fazer máscaras. Além disso, para o barbear, que leva apenas 10-15 min, a anestesia ...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Projeto Hakubi da Universidade de Kyoto, Subsídio de Ajuda para Pesquisa Desafiadora (Pioneiro) (No.22K18644), Subsídio de Ajuda para Pesquisa Científica (C) (Nº 22K12745), Subsídio de Ajuda para Pesquisa Científica (B) (Nº 21H02851) e Subsídio de Ajuda para Pesquisa Científica (A) (Nº 19H01039). Gostaríamos de agradecer à Editage (www.editage.jp) pela edição em inglês.
Materiais
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
Referências
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados