JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Electroencephalography Measurements in Awake Marmosets Listening to Conspecific Vocalizations
요약
언어의 진화를 연구하기 위해서는 인간의 뇌 메커니즘과 비인간 영장류의 뇌 메커니즘을 비교하는 것이 중요하다. 우리는 깨어 있는 동물의 뇌파(EEG)를 비침습적으로 측정하는 방법을 개발했습니다. 이를 통해 인간과 동물 간의 EEG 데이터를 장기적으로 해를 끼치지 않고 직접 비교할 수 있습니다.
초록
음성 의사 소통은 영장류의 사회적 상호 작용, 특히 생존 및 사회 조직에서 중요한 역할을합니다. 인간은 언어의 형태로 독특하고 발전된 음성 의사 소통 전략을 개발했습니다. 인간 언어의 진화를 연구하기 위해서는 인간의 음성 처리의 기저에 있는 신경 메커니즘을 조사하고, 인간이 아닌 영장류의 메커니즘과 비교하여 뇌 메커니즘이 어떻게 진화해 왔는지 이해하는 것이 필요합니다. 여기에서 우리는 깨어 있는 비인간 영장류의 뇌파검사(EEG)를 비침습적으로 측정하는 방법을 개발했습니다. 이 기록 방법을 사용하면 동물에게 해를 끼치지 않고 장기적인 연구를 할 수 있으며, 중요한 것은 비인간 영장류의 EEG 데이터를 인간 데이터와 직접 비교할 수 있어 인간 언어의 진화에 대한 통찰력을 제공할 수 있습니다. 이번 연구에서는 마모셋의 종 특이적 발성에 대한 반응으로 뇌 활동을 조사하기 위해 두피 EEG 기록 방법을 사용했습니다. 이 연구는 두피 EEG를 사용하여 음성 인식 중 마모셋의 광범위한 신경 표현을 포착하여 기존 지식의 격차를 메움으로써 새로운 통찰력을 제공합니다.
서문
영장류는 종 특유의 발성을 사용하여 발신자의 감정 상태나 사회적 유대를 유지하려는 의도, 포식자의 존재 또는 기타 위험한 상황과 같은 생물학적으로 중요한 정보를 전달합니다. 목소리가 풍부한 비인간 영장류의 발성 인식에 대한 인식의 기저에 있는 신경 메커니즘에 대한 연구는 인간 언어의 진화적 기원을 더 잘 이해할 수 있는 중요한 단서를 제공할 수 있습니다.
일반적인 마모셋은 남아메리카가 원산지인 작은 영장류입니다. 최근 몇 년 동안 마모셋은 높은 번식력, 작은 크기로 인한 사용 용이성, 유용한 형질전환 기술의 개발 때문에 마카크 원숭이와 함께 모델 동물로 점점 더 많이 사용되고 있습니다 1,2,3. 질병 모델로서의 유용성 외에도 그룹 내 풍부한 음성 의사 소통은이 종의 또 다른 독특한 특성입니다 4,5,6,7. 마모셋은 숲에서 보이지 않는 동족 개체와 의사 소통하기 위해 정기적으로 음성 신호를 교환합니다. 마모셋의 음성 지각 및 생성에 관여하는 뇌 활동을 조사함으로써, 우리는 마모셋이 뇌에서 자신의 또는 동족 호출의 청각 정보를 어떻게 처리하는지 확인하고 어떤 신경 회로가 관련되어 있는지 식별할 수 있습니다. 이전 연구에서는 마모셋의 발성 생성에 관여하는 일차 청각 피질 8,9,10,11,12 및 전두엽 피질 13,14의 신경 활동이 입증되었습니다. 더욱이, 이러한 흥분되고 억제된 신경 세포 반응은 일차 청각 피질(primary auditory cortex 8,10)의 청각-음성 상호 작용에 의해 조절되었습니다. 이 연구는 침습적 기록 방법을 사용하여 단일 뉴런 수준에서 자세한 신경 활동 데이터를 제공했습니다. 수많은 연구에서 마모셋 발성 생성과 관련된 신경 활동을 추가로 조사했습니다. 그러나 음성 인식은 여전히 잘 이해되지 않고 있다 15,16.
여러 비침습적 뇌 영상 연구는 마모셋에서 음성 처리의 신경 메커니즘을 설명했습니다 17,18,19; 높은 공간 해상도는 장점이지만 스캔하는 동안 동물을 깨어 있는 상태로 유지하려면 고급 기술이 필요합니다. 그러나 보다 최근에는 Jafari et al.이 기능적 자기 공명 영상(fMRI)을 사용하여 깨어 있는 마모셋의 음성 인식에 관여하는 전두측두엽 영역을 확인했습니다19. 인간의 음성 인식 및 생성에 관여하는 뇌 기능을 규명하기 위한 거의 모든 실험은 두피 뇌파검사(EEG), 자기뇌파검사(MEG)20,21 및 fMRI 22,23,24와 같은 비침습적 방법을 사용하여 수행되었습니다. 인간을 대상으로 한 수많은 연구에서 EEG를 사용하여 음성 인식과 관련된 뇌 활동을 조사했습니다. 이러한 연구의 대부분은 감정 정보25,26,27 및 감정 단어의 현저성28에 초점을 맞추고 있으며, 그 결과 음성 지각29 동안 사건 관련 잠재력의 변화가 밝혀졌다. 인간에서 두개내 이식된 전극을 사용한 피질전기검사(ECoG) 및 단일 뉴런 기록은 신경외과적 치료를 받는 환자를 대상으로 한 제한된 수의 실험에서만 수행되었습니다30,31.
인간과 원숭이를 비교하는 진화론적 관점은 인간에서 발달한 음성 인식 및 생성의 기저에 있는 독특한 신경 메커니즘을 이해하는 데 중요합니다. 마모셋과 같이 목소리가 풍부한 비인간 영장류의 언어 인식 및 발성과 관련된 신경 메커니즘을 인간과 직접 비교하려면 동일한 방법을 사용하여 두 종 간의 데이터를 비교하는 것이 중요합니다. 기능적 MRI는 전뇌 영상이 가능하며 공간 해상도가 높습니다. 두개골에 수직이거나 EEG 또는 MEG로 기록하기 어려운 깊은 영역의 활동을 기록하는 장점이 있습니다. 그러나 MRI 기계는 설치 및 유지 관리 비용이 많이 들고 장치의 특성으로 인해 제시될 수 있는 자극에 많은 제한이 있습니다. 이에 비해 EEG, ERP(Event-Related Potentials) 및 MEG는 시간적 해상도가 높기 때문에 시계열 음성 처리를 분석하는 데 유용합니다. 특히, EEG는 이동성이 높고 다양한 실험 환경에서 사용할 수 있으며 상대적으로 비용이 저렴하며 단일 작업자만 필요하다는 장점이 있습니다.
인간에서 이미 많은 양의 EEG 데이터가 얻어졌기 때문에 비인간 영장류에 대해서는 비침습적 패러다임을 사용한 EEG 측정 방법이 필요합니다. 우리 연구 그룹은 원숭이와 마모셋에 대해 튜브32를 사용하여 독특한 비침습적 EEG 기록 방법을 개발했습니다. 여기에서 우리는 비인간 영장류 33,34,35,36,37의 청각 처리에 관한 몇 가지 새로운 발견을 보고합니다. 마모셋의 종 특이적 발성에 대한 반응으로 뇌 활동을 특성화하기 위해 우리는 두피에 부착된 전극을 사용하여 뇌 활동을 비침습적으로 기록하는 실험 시스템을 구축했습니다. 이 연구에서는 마모셋에 대한 EEG 측정 방법을 설명합니다.
프로토콜
모든 실험은 EHUB 동물실험위원회(No.2022-003, 2023-104)의 승인을 받았으며, EHUB에서 발행한 실험용 영장류 관리 및 사용 가이드에 따라 진행되었습니다. 실험에는 9 마리의 일반적인 마모셋 (Callithrix jacchus, 6 마리의 수컷과 3 마리의 암컷, 2-12 세, 체중 330-490g)이 사용되었습니다.
1. 동물
- 마모셋을 둥지 상자, 나무 횃대 및 기타 풍부 장치가 장착된 단일 케이지에 수용합니다.
- 온도와 습도는 각각 12± 2°C 및 2± 20%로 유지되며 실내를 2시간 명암 주기로 유지합니다.
- 하루에 두 번 신세계 원숭이 펠릿 14g을 동물에게 먹이고 아라비아 고무와 밀웜과 같은 음식을 보충하십시오. 물 adlibitum을 제공하십시오.
- 실험실의 소음 감쇠 상자에서 모든 실험을 수행하십시오.
2. 장비(그림 1B 및 재료 표)
- 4mm 은 전극을 사용하십시오. 전극 표면의 AgCl 코팅은 편광을 방지하고 안정적인 기록을 보장합니다.
- 증폭기를 사용하여 EEG 신호를 기록합니다. 대역통과 필터(0.016-250Hz)를 사용하고 1,000Hz에서 데이터를 샘플링합니다.
- 64채널 전극 입력 상자를 앰프에 연결하여 피사체 앞에 놓습니다.
- 스피커를 마모셋 헤드에서 30cm 떨어진 곳에 놓고 귀 위치에서 측정한 대로 65-75dB로 사운드 레벨을 제어합니다. 이 스피커를 통해 청각 자극을 전달합니다.
- 카메라를 피사체 앞에 놓아 EEG 기록 중 피사체의 상태를 모니터링합니다.
- 영장류 의자는 아크릴 판과 합성 수지 기둥으로 구성됩니다. 실험을 위해 연구원이 발판에 앉은 동물을 안도록 합니다. 이때 목부분을 삽입하여 목판에 고정하고 허리편을 허리판에 삽입하여 고정합니다. 각 마모셋의 몸체 전체가 느슨하게 고정되었는지 확인하십시오.
3. 마취
- 알팍살론(6-8mg/kg)과 아트로핀(0.05mg/kg)의 근육 주사로 동물을 마취합니다. 이 프로토콜을 사용하면 약 20분 동안 마취를 유지할 수 있습니다. 절차가 더 긴 경우 마취 기간을 연장하기 위해 alfaxalone을 추가로 투여합니다. 또한 항구토제(마로피탄제 1mg/kg, 피하 주사)를 사전에 투여하여 알팍살로의 부작용인 메스꺼움에 대응합니다.
알림: 마모셋은 시술 중 주사 또는 흡입 마취를 받아야 하며 수염 면도 후 즉시 회복될 수 있도록 해야 합니다. - 맥박 산소 측정기로 바이탈을 모니터링하고 필요한 경우 산소-공기 혼합물(O2 0.5L/min, 공기 0.5L/min)을 투여합니다.
- 실내 온도를 27 °C 이상으로 유지하고 마모셋 몸체를 따뜻한 천으로 감싸 저체온증을 방지하십시오.
4. 제모
- 전기 면도기로 머리 전체(귀 뒤 포함)를 면도합니다.
- 민감한 피부를 위해 제모 크림을 바릅니다. 5분 후 젖은 거즈로 크림을 닦아냅니다.
5. 마스크 준비
- 원숭이 의자의 크기에 맞게 열가소성 마스크를 미리 가공하십시오. 구체적으로, 의자의 수직 길이에서 돌출 된 등받이 부분에 4 개의 나사 구멍을 뚫어 의자의 넥 플레이트에 고정 할 수 있습니다.
참고: 열가소성 마스크는 안전하며 환자의 방사선 치료 중 머리를 고정하는 데 사용할 수 있습니다. 우리는 어린이를 위해 고안된 작은 마스크를 사용하여 마모셋의 크기에 맞게 자릅니다. 이 마스크는 75°C의 따뜻한 물에 넣으면 부드러워지고 물에서 꺼낼 때 온도가 내려가면서 굳어집니다. - 실험을 위해 동물을 영장류 의자에 앉힙니다. 목과 허리 플레이트를 사용하여 마취된 동물을 지지하고 동물과 이 플레이트를 의자에 고정합니다.
- 마스크를 뜨거운 물에 따뜻하게 한 후 마모셋의 머리에 맞게 성형합니다. 따뜻한 물에서 마스크를 제거한 후 화상을 방지하기 위해 온도가 떨어질 때까지(약 50s °C 범위) 기다린 다음 피험자의 머리에 올려 마스크를 성형합니다.
- 냉각 및 경화 후 동물에서 마스크를 분리하고 마스크의 머리 윗부분과 귀 부분을 잘라내어 전극 설정 영역을 노출시킵니다.
참고: 이 마스크가 만들어지면 다른 사람에게 사용할 수 있습니다.
6. 의자 및 마스크 적응 (3일간 하루 30분)
- 깨어 있는 상태에서 동물을 의자에 앉히고 약 30분 동안 보상하여 의자에 앉히는 습관을 들입니다. 이 절차를 3일 동안 반복합니다.
- 2 일 동안 마스크를 사용하여 동물을 머리에 고정하는 습관을 들입니다.
참고: 이 적응 과정은 개인의 상태에 맞게 조정되었습니다. 적응 후 동물들은 포획 및 머리 마스크 착용 시 일시적으로 저항할 수 있지만 의자에 앉고 머리를 고정하면 진정됩니다. - 의자에 적응하는 동안 다음과 같은 행동 매개변수를 평가하십시오: i) 불안하거나 놀라운 소음의 방출, ii) 제공된 보상에 대한 거부, iii) 격렬한 움직임. 이러한 행동 중 하나라도 관찰되면 해당 날짜의 세션을 종료하여 마모셋이 실험 환경에 점차적으로 적응할 수 있도록 합니다.
7. EEG 기록 (2 시간 / 일)
- 과목 준비
- 이송 케이지를 홈 케이지의 작은 창에 부착하고 마모셋을 홈 케이지에서 이송 케이지로 일반적으로 단독으로 이동합니다. 운반 케이지를 천으로 덮고 실험실로 옮깁니다.
- 머리 고정
- 보호 장갑을 사용하여 마모셋을 포획하고 특수 의자에 앉힙니다.
- 준비된 마스크를 마모셋의 머리에 씌웁니다. 의자에 부착된 나사 본체를 마스크의 구멍에 통과시키고 나비 나사를 사용하여 고정합니다.
- 머리와 마스크를 네이션 바로 아래에 있는 밴드로 가볍게 고정합니다.
참고: 피험자의 머리는 전극이 움직임에 의해 제거되지 않는 한 완전히 고정될 필요가 없었다. 따라서 모든 피사체에 동일한 마스크를 사용했습니다.
- 전극의 위치 정의
- International 10-20 방법 32,33,34,35,36,37에 따라 전극의 위치를 결정하기 위해 nasion, inion 및 earlobe를 해부학적 지표로 사용합니다. 줄자로 정중선에서 nasion과 inion 사이의 거리를 측정합니다. 거리의 중간에서 Cz의 위치를 정의합니다. 다른 전극(Fz, Pz, Oz, F3 또는 F4)을 이온-네이온 길이의 20%를 전극 간격으로 배치합니다. 유성 피부조영술을 사용하여 두피의 전극 위치를 표시합니다.
- 피부 준비
- 소독용 알코올을 적신 얇은 면봉으로 표시된 부위를 문질러 두피의 먼지와 피지를 제거합니다.
- 전극 설정
알림: 모든 전극 위치에서 7.2.1-7.2.3단계를 수행하여 Fz, Cz, C3, C4, Pz, A1, A2 및 F3(또는 F4)에 전극을 배치합니다.- 튜브 커터를 사용하여 내경이 4mm, 외경이 7mm인 실리콘 튜브 조각을 약 20mm 길이로 자릅니다.
- 절단된 튜브의 가장자리에 접착제를 바르고 두피에 밀착시킵니다.
- 주사기와 뾰족하지 않은 주사기 바늘을 사용하여 튜브 내부를 EEG 젤로 채웁니다.
- 기준 전극을 Pz에 연결하고 접지 전극을 F3 또는 F4에 연결합니다(그림 1C).
- 튜브에 전극을 삽입하고 전극 케이블을 입력 상자에 연결합니다.
- EEG 기록용 응용 프로그램을 실행하여 전극 임피던스를 측정하고 매개변수를 조정하여 모든 전극이 5kΩ 미만이 되도록 합니다.
- 소음을 줄이기 위해 전극 케이블을 번들로 묶습니다.
- 주사기를 사용하여 액체 보상(껌 또는 영양제) 1-3mL를 수동으로 투여하여 머리 고정 절차 중 및 작업 세션 사이에 보상을 제공합니다.
- EEG 기록 소프트웨어에 저장할 파일을 지정하고 기록 시작 버튼을 누릅니다. EEG 기록이 시작된 직후 자극 제시를 위한 스크립트를 실행합니다. 자극 제시 스크립트 실행이 완료되면 EEG 기록의 중지 버튼을 눌러 모든 기록을 종료합니다. 녹음이 완료되면 전극과 헤드 마스크를 제거합니다.
- 동물을 포획하여 운반 중인 우리로 돌려보내십시오. 두피에 튜브를 남겨 두십시오. 모든 튜브는 약 1일 만에 자연적으로 떨어졌습니다.
참고: 초기에는 아세톤을 사용하여 접착 접착제를 녹이고 녹음 세션 후 튜브를 제거했습니다. 그러나 피부 손상의 사례가있었습니다. 따라서 우리는 튜브를 제거하지 않고 동물들을 집으로 돌려보냈습니다. 지금까지 우리가 실시한 수십 번의 실험에서 마모셋은 제거된 튜브에 관심을 보이지 않았으며 우발적인 섭취가 발생한 적이 없습니다. - 자극
- 후속 EEG 기록에 사용되지 않는 마모셋의 캡티브 또는 실험실에서 자연스럽고 단순하며 복합적인 통화를 녹음합니다. 기록된 파일에서 3개의 종별 단순 및 복합 호출(Phee, Tsik-Ek 및 Tsik-String5 호출)을 추출합니다.
- 호출 자극 외에도 프로그래밍 소프트웨어의 기능을 사용하여 백색 소음을 생성하고 이를 자극으로 사용합니다.
- 이 프로토콜을 따르려면 실험에서 마모셋 호출의 청각 파일(16비트, 48kHz) 3개를 사용합니다. 사용자 지정 스크립트를 사용하여 작업을 제어합니다.
참고: 각 블록에는 각 자극에 대한 50개의 호출이 포함되어 총 200개의 호출이 있습니다. 각 녹음 블록은 약 10분 동안 지속됩니다. 각 참가자는 두 개의 블록을 수행해야 합니다. 호출 간 간격은 3초입니다. 4개의 오디오 자극 파일( 보충 파일 1 참조) 중 Phee 호출 자극은 약 2초의 길이인 반면, 다른 3개의 파일은 약 1초의 길이였습니다. 이는 단일 Phee 호출이 여전히 오래 지속되는 호출이기 때문입니다(그림 1D). - 각 사운드 자극 파일에서 오른쪽 채널에는 마모셋 호출 또는 잡음 데이터가 포함되고 왼쪽 채널에는 자극 시작에 대한 트리거 신호가 포함됩니다. 동기화 장치를 통해 이 트리거 신호를 EEG 기록 시스템으로 보내고 이벤트 시간으로 기록합니다.
8. 데이터 분석
참고: 프로그래밍 소프트웨어 및 도구 상자에 작성된 원본 코드는 아래에 설명된 대로 EEG 데이터를 후처리하는 데 사용되었습니다(보충 파일 2)37.
- 전처리
- 연결된 귀 참조를 다시 참조합니다.
- 2Hz의 고역 통과 필터.
- 자극 시작 전 100ms부터 자극 시작 후 1000ms까지 Epoch.
- 100-ms prestimulus 기간의 평균으로 기준선이 정확합니다. ±150 μV의 기준을 사용하여 아티팩트를 리젝트합니다.
- 이벤트 관련 잠재력(ERP) 플로팅
- 각 피험자에 대한 모든 임상시험 데이터의 평균을 구합니다.
- 모든 피사체의 평균을 구하여 그룹 평균 파형을 구합니다.
- 통화 유형과 소음 자극 간의 평균 ERP를 비교하려면 Cz 응답의 피험자 간 요인으로 자극을 사용하는 일원 분산 분석(ANOVA)을 적용합니다.
- Tukey의 방법을 사용하여 사후 다중 비교 분석을 적용합니다.
- 이벤트 관련 스펙트럼 섭동(ERSP) 플로팅
- 방정식 (1)을 사용하여 넓은 주파수 범위에서 시간 경과에 따른 스펙트럼 전력의 평균 이벤트 관련 변화를 시각화하기 위해 ERSP를 계산합니다. Fk (f,t) 는 주파수 f와 시간 t에서 시행 k의 스펙트럼 추정값입니다.
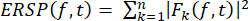 (1)
(1) - 가장 낮은 주파수(10Hz)에서 3주기 길이로 정현파 웨이블릿 변환을 사용하여 가장 높은 주파수(120Hz)에서 최대 32주기까지 주파수에 따라 선형적으로 증가하는 시간-주파수 분해를 활동에 적용합니다.
- 2-30Hz에서 자극 시작 후 150ms 기간의 초기 및 과도 응답을 정의하고, 40-100H에서 자극 시작 후 151에서 950ms까지 800ms 기간 동안 지속적인 응답을 정의합니다.
- 피험자 연령 및 호출 유형 간의 Fz 및 Cz의 초기 및 지속 응답의 차이를 테스트하려면 호출 유형을 피험자 내 요인으로 사용하고 연령 을 피험자 간 요인으로 사용하여 양방향 분산 분석을 수행합니다.
- 방정식 (1)을 사용하여 넓은 주파수 범위에서 시간 경과에 따른 스펙트럼 전력의 평균 이벤트 관련 변화를 시각화하기 위해 ERSP를 계산합니다. Fk (f,t) 는 주파수 f와 시간 t에서 시행 k의 스펙트럼 추정값입니다.
결과
먼저, 마모셋의 각 청각 자극에 대한 평균 이벤트 관련 전위(ERP)를 그래프로 표시했습니다(그림 2). 청각 유발 전위(AEP)는 소음 조건에서 두드러졌으며, 이는 자극의 명확한 시작을 반영합니다( 그림 1D 참조). 통화 유형과 소음 자극 간의 평균 ERP를 비교하기 위해 Cz 응답에서 자극을 피험자 간 요인으로 사용하는 일원 분산 분석(ANOVA)을 적용했습니...
토론
마취에 관한 주의점
케타민(ketamine)과 자일라진(xylazine) 투여가 모두 시도되었는데, 이들은 진통제이므로 장시간 고통스러운 작업에 적합하지만, 마모셋은 산소 흡입 없이 혈중 산소 농도가 감소하는 경향이 있다44. 요컨대, alfaxalon은 아마도 면도나 마스크 만들기와 같은 고통이 없는 작업에 가장 적합할 것입니다. 또한 10-15분 밖에 걸리지 않는 면도의 경우 흡입 마...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 교토 대학의 하쿠비 프로젝트, 도전적 연구(개척) 보조금(No.22K18644), 과학 연구 지원(C)(No. 22K12745), 과학 연구 지원(B)(No. 21H02851) 및 Grant-in-Aid for Scientific Research(A)(No. 19H01039)의 지원을 받았습니다. 영어 편집을 담당해 주신 에디티지 (www.editage.jp)에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
참고문헌
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유