Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Elektroenzephalographie-Messungen bei wachen Weißbüschelaffen, die den Lautäußerungen von Artgenossen lauschen
In diesem Artikel
Zusammenfassung
Um die Evolution der Sprache zu untersuchen, ist es wichtig, die Mechanismen des Gehirns beim Menschen mit denen bei nichtmenschlichen Primaten zu vergleichen. Wir haben eine Methode entwickelt, um die Elektroenzephalographie (EEG) von wachen Tieren nicht-invasiv zu messen. Es ermöglicht uns, EEG-Daten zwischen Mensch und Tier langfristig direkt zu vergleichen, ohne ihnen zu schaden.
Zusammenfassung
Die vokale Kommunikation spielt eine entscheidende Rolle in den sozialen Interaktionen von Primaten, insbesondere beim Überleben und der sozialen Organisation. Der Mensch hat eine einzigartige und fortschrittliche vokale Kommunikationsstrategie in Form von Sprache entwickelt. Um die Evolution der menschlichen Sprache zu untersuchen, ist es notwendig, die neuronalen Mechanismen zu untersuchen, die der Stimmverarbeitung beim Menschen zugrunde liegen, sowie zu verstehen, wie sich die Mechanismen des Gehirns entwickelt haben, indem man sie mit denen von nichtmenschlichen Primaten vergleicht. In dieser Arbeit haben wir eine Methode entwickelt, um die Elektroenzephalographie (EEG) von wachen nichtmenschlichen Primaten nichtinvasiv zu messen. Diese Aufzeichnungsmethode ermöglicht Langzeitstudien, ohne die Tiere zu schädigen, und ermöglicht es uns, EEG-Daten von nichtmenschlichen Primaten direkt mit menschlichen Daten zu vergleichen, was Einblicke in die Evolution der menschlichen Sprache gibt. In der aktuellen Studie haben wir die EEG-Aufzeichnungsmethode der Kopfhaut verwendet, um die Gehirnaktivität als Reaktion auf artspezifische Lautäußerungen bei Weißbüschelaffen zu untersuchen. Diese Studie liefert neue Erkenntnisse, indem sie mithilfe von Kopfhaut-EEG weit verbreitete neuronale Repräsentationen bei Weißbüschelaffen während der Stimmwahrnehmung erfasst und Lücken im bestehenden Wissen schließt.
Einleitung
Primaten verwenden artspezifische Lautäußerungen, um biologisch wichtige Informationen zu übermitteln, wie z. B. den emotionalen Zustand des Rufers oder die Absicht, soziale Bindungen aufrechtzuerhalten, die Anwesenheit von Raubtieren oder andere gefährliche Situationen. Die Untersuchung der neuronalen Mechanismen, die der Wahrnehmung der Lautäußerung bei stimmreichen nichtmenschlichen Primaten zugrunde liegen, kann uns entscheidende Hinweise liefern, um die evolutionären Ursprünge der menschlichen Sprache besser zu verstehen.
Weißbüschelaffen sind kleine Primaten, die in Südamerika beheimatet sind. In den letzten Jahren wurden Weißbüschelaffen aufgrund ihrer hohen Fortpflanzung, ihrer Benutzerfreundlichkeit aufgrund ihrer geringen Größe und der Entwicklung nützlicher transgener Techniken zunehmend als Modelltiere neben Makaken eingesetzt 1,2,3. Neben ihrem Nutzen als Krankheitsmodell ist die reichhaltige vokale Kommunikation innerhalb von Gruppen ein weiteres einzigartiges Merkmal dieser Art 4,5,6,7. Weißbüschelaffen tauschen routinemäßig Stimmsignale aus, um mit unsichtbaren Artgenossen im Wald zu kommunizieren. Durch die Untersuchung der Gehirnaktivität, die an der Stimmwahrnehmung und -produktion bei Weißbüschelaffen beteiligt ist, können wir feststellen, wie sie die auditiven Informationen ihrer eigenen oder artverwandten Rufe im Gehirn verarbeiten und welche neuronalen Schaltkreise daran beteiligt sind. Frühere Studien haben gezeigt, dass die neuronale Aktivität im primären auditorischen Kortex 8,9,10,11,12 und im frontalen Kortex 13,14 an der Stimmproduktion bei Weißbüschelaffen beteiligt ist. Darüber hinaus wurden diese erregten und unterdrückten neuronalen Reaktionen durch auditiv-vokale Interaktionen im primären auditorischen Kortex moduliert 8,10. Diese Studien lieferten detaillierte Daten zur neuronalen Aktivität auf der Ebene einzelner Neuronen mit invasiven Aufzeichnungsmethoden. Zahlreiche Studien haben die neuronale Aktivität, die an der Stimmproduktion von Weißbüschelaffen beteiligt ist, weiter untersucht. Die stimmliche Wahrnehmung ist jedoch nach wie vor wenig verstanden15,16.
Mehrere nicht-invasive bildgebende Studien des Gehirns haben die neuronalen Mechanismen der Stimmverarbeitung bei Weißbüschelaffen aufgeklärt 17,18,19; Ihre hohe räumliche Auflösung ist ein Vorteil, aber um die Tiere während des Scannens im wachen Zustand zu halten, sind fortschrittliche Techniken erforderlich. In jüngerer Zeit identifizierten Jafari et al. jedoch frontotemporale Regionen, die an der Stimmwahrnehmung bei wachen Weißbüschelaffen beteiligt sind, mithilfe der funktionellen Magnetresonanztomographie (fMRT)19. Fast alle Experimente zur Aufklärung der Gehirnfunktionen, die an der Stimmwahrnehmung und -produktion beim Menschen beteiligt sind, wurden mit nicht-invasiven Methoden wie der Kopfhaut-Elektroenzephalographie (EEG), der Magnetenzephalographie (MEG)20,21 und der fMRT 22,23,24 durchgeführt. Zahlreiche Studien am Menschen haben die Gehirnaktivität im Zusammenhang mit der stimmlichen Wahrnehmung mittels EEG untersucht. Die meisten dieser Studien konzentrierten sich auf emotionale Informationen 25,26,27 und die Salienz emotionaler Wörter28, wobei die Ergebnisse Veränderungen der ereigniskorrelierten Potenziale während der stimmlichen Wahrnehmung zeigten29. Elektrokortikographie (ECoG) und Einzelneuronenaufnahmen mit intrakraniell implantierten Elektroden beim Menschen wurden bisher nur in einer begrenzten Anzahl von Experimenten an Patienten durchgeführt, die sich einer neurochirurgischen Behandlung unterzogenhaben 30,31.
Eine evolutionäre Perspektive, die Menschen mit Affen vergleicht, ist wichtig, um die einzigartigen neuronalen Mechanismen zu verstehen, die der Stimmwahrnehmung und -produktion zugrunde liegen und sich beim Menschen entwickelt haben. Um die neuronalen Mechanismen, die an der Sprachwahrnehmung und Lautäußerung bei stimmreichen nichtmenschlichen Primaten wie dem Weißbüschelaffen beteiligt sind, direkt mit denen des Menschen zu vergleichen, ist es wichtig, die Daten zwischen den beiden Arten mit der gleichen Methode zu vergleichen. Die funktionelle MRT ermöglicht die Bildgebung des gesamten Gehirns und hat eine hohe räumliche Auflösung. Es hat den Vorteil, dass es die Aktivität senkrecht zum Schädel oder in tiefen Regionen aufzeichnet, die mit EEG oder MEG nur schwer aufzuzeichnen sind. Das MRT-Gerät ist jedoch teuer in der Installation und Wartung, und es gibt viele Einschränkungen bei den Reizen, die aufgrund der Art des Geräts dargestellt werden können. Im Vergleich dazu haben EEG, ereigniskorrelierte Potentiale (ERPs) und MEG eine hohe zeitliche Auflösung, was sie für die Analyse der stimmlichen Verarbeitung von Zeitreihen nützlich macht. EEG hat insbesondere die Vorteile einer hohen Mobilität und der Möglichkeit, in einer Vielzahl von Versuchsumgebungen eingesetzt zu werden, relativ niedrige Kosten und die Notwendigkeit eines einzigen Bedieners.
Da bereits eine große Menge an EEG-Daten beim Menschen gewonnen wurde, sind EEG-Messmethoden mit nicht-invasiven Paradigmen für nicht-menschliche Primaten erforderlich. Unsere Forschungsgruppe hat eine einzigartige nicht-invasive EEG-Aufzeichnungsmethode mit Röhrchen32 für Makaken und Weißbüschelaffen entwickelt. Hier berichten wir über mehrere neue Erkenntnisse zur auditiven Verarbeitung bei nichtmenschlichen Primaten 33,34,35,36,37. Um die Gehirnaktivität als Reaktion auf artspezifische Lautäußerungen bei Weißbüschelaffen zu charakterisieren, haben wir ein experimentelles System zur nichtinvasiven Aufzeichnung der Gehirnaktivität mit Hilfe von Elektroden auf der Kopfhaut konstruiert. In dieser Studie beschreiben wir die EEG-Messmethode für Weißbüschelaffen.
Protokoll
Alle Versuche wurden vom Tierversuchsausschuss des EHUB (Nr. 2022-003, 2023-104) genehmigt und in Übereinstimmung mit dem von EHUB veröffentlichten Leitfaden für die Pflege und Verwendung von Laborprimaten durchgeführt. Für das Experiment wurden neun Weißbüschelaffen (Callithrix jacchus, sechs Männchen und drei Weibchen, 2-12 Jahre alt, mit einem Gewicht von 330-490 g) verwendet.
1. Tiere
- Halten Sie die Weißbüschelaffen in Einzelkäfigen, die mit Nistkästen, Holzstangen und anderen Bereicherungsvorrichtungen ausgestattet sind.
- Halten Sie die Räume unter einem 12-stündigen Hell-Dunkel-Zyklus, wobei Temperatur und Luftfeuchtigkeit bei 28 ± 2 °C bzw. 40 ± 20 % gehalten werden.
- Füttern Sie die Tiere zweimal täglich mit 14 g Pellets von Neuweltaffen, ergänzt durch Futter wie Gummi arabicum und Mehlwürmer. Stellen Sie Wasser ad libitum zur Verfügung.
- Führen Sie alle Experimente in einer schallgedämpften Box in einem Experimentierraum durch.
2. Ausrüstung (Abbildung 1B und Materialtabelle)
- Verwenden Sie 4 mm Silberelektroden. Die AgCl-Beschichtung auf der Elektrodenoberfläche verhindert eine Polarisation und sorgt für eine stabile Aufnahme.
- Verwenden Sie einen Verstärker, um die EEG-Signale aufzuzeichnen. Bandpassfilter (0,016-250 Hz) und Abtastung der Daten bei 1.000 Hz.
- Schließen Sie eine 64-Kanal-Elektrodeneingangsbox an den Verstärker an und platzieren Sie sie vor dem Motiv.
- Platzieren Sie den Lautsprecher 30 cm vom Weißbüschelaffenkopf entfernt und regeln Sie den Schallpegel auf 65-75 dB, gemessen in der Ohrposition. Geben Sie die auditiven Reize über diesen Lautsprecher ab.
- Platzieren Sie die Kamera vor dem Probanden, um seinen Zustand während der EEG-Aufzeichnung zu überwachen.
- Der Primatenstuhl besteht aus Acrylplatten und Kunstharzpfosten. Lassen Sie den Forscher bei den Experimenten die Tiere so halten, wie sie auf der Fußplatte sitzen. Setzen Sie an dieser Stelle ein Halsteil ein und befestigen Sie es an der Halspartie, und setzen Sie das Hüftstück ein und befestigen Sie es an der Hüftpartie. Stellen Sie sicher, dass der gesamte Körper jedes Weißbüschelaffen locker befestigt ist.
3. Anästhesie
- Betäuben Sie die Tiere mit einer intramuskulären Injektion von Alfaxalon (6-8 mg/kg) und Atropin (0,05 mg/kg). Dieses Protokoll ermöglicht es, die Anästhesie für ca. 20 Minuten aufrechtzuerhalten. Verabreichen Sie zusätzliche Dosen von Alfaxalone, um die Dauer der Anästhesie zu verlängern, wenn der Eingriff länger dauert. Verabreichen Sie vorher auch Antiemetika (Maropitant 1 mg/kg, subkutane Injektion), um der Übelkeit entgegenzuwirken, die eine Nebenwirkung von Alfaxalone ist.
HINWEIS: Weißbüschelaffen müssen während der Eingriffe unter Injektions- oder Inhalationsnarkose stehen und sollten sich sofort nach der Haarrasur erholen können. - Überwachen Sie die Vitalwerte mit einem Pulsoximeter und verabreichen Sie bei Bedarf ein Sauerstoff-Luft-Gemisch (Ø2 0,5 l/min, Luft 0,5 l/min).
- Halten Sie die Raumtemperatur über 27 °C und wickeln Sie ein wärmendes Tuch um den Körper des Weißbüschelaffen, um eine Unterkühlung zu vermeiden.
4. Haarentfernung
- Rasieren Sie den gesamten Kopf (auch hinter den Ohrmuscheln) mit einem Elektrorasierer.
- Tragen Sie Haarentfernungscreme für empfindliche Haut auf. Wischen Sie die Creme nach 5 min mit einer feuchten Gaze ab.
5. Vorbereitung der Maske
- Verarbeiten Sie vorab eine thermoplastische Maske, die auf die Größe des Affenstuhls passt. Bohren Sie insbesondere den Teil der Rückenlehne, der aus der vertikalen Länge des Stuhls herausragt, mit vier Schraubenlöchern, so dass er an der Nackenplatte des Stuhls befestigt werden kann.
HINWEIS: Thermoplastische Masken sind sicher und können verwendet werden, um den Kopf während der Strahlentherapie bei Patienten zu immobilisieren. Wir haben eine kleine Maske für Kinder verwendet und sie auf die Größe der Weißbüschelaffen zugeschnitten. Diese Maske wird weich, wenn sie in warmes Wasser bei 75 °C gelegt wird, und härtet aus, wenn die Temperatur sinkt, wenn sie aus dem Wasser genommen wird. - Für die Experimente setzen Sie die Tiere auf einen Primatenstuhl. Stützen Sie das anästhesierte Tier mit Hals- und Hüftplatten ab und befestigen Sie das Tier und diese Platten auf dem Stuhl.
- Erwärmen Sie die Maske in heißem Wasser und formen Sie sie dann so, dass sie zum Kopf des Weißbüschelaffen passt. Nachdem Sie die Maske aus dem warmen Wasser genommen haben, warten Sie, bis die Temperatur gesunken ist (ca. im Bereich von 50 °C), um Verbrennungen zu vermeiden, und legen Sie sie dann auf den Kopf des Motivs, um die Maske zu formen.
- Nehmen Sie die Maske nach dem Abkühlen und Aushärten vom Tier ab und schneiden Sie die Oberseite des Kopf- und Ohrteils der Maske aus, um den Bereich für die Elektrodeneinstellung freizulegen.
HINWEIS: Sobald diese Maske hergestellt wurde, kann sie bei anderen Personen verwendet werden.
6. Stuhl- und Maskenanpassung (30 min/Tag für 3 Tage)
- Gewöhnen Sie das Tier im Wachzustand an den Stuhl, indem Sie es auf einen Stuhl setzen und es ca. 30 Minuten lang belohnen. Wiederholen Sie diesen Vorgang 3 Tage lang.
- Gewöhnen Sie das Tier 2 Tage lang an die Kopffixierung mit der Maske.
HINWEIS: Dieser Anpassungsprozess wurde an den individuellen Zustand angepasst. Nach der Anpassung können die Tiere während des Fangens und des Setzens der Kopfmaske vorübergehend Widerstand leisten, aber sobald sie auf dem Stuhl sitzen und ihr Kopf fixiert ist, werden sie ruhig. - Bewerten Sie während der Stuhlanpassung die folgenden Verhaltensparameter: i) Abgabe von ängstlichen oder alarmierenden Geräuschen, ii) Ablehnung der angebotenen Belohnung und iii) heftige Bewegungen. Wenn eines dieser Verhaltensweisen beobachtet wird, beenden Sie die Sitzung für diesen Tag, damit sich der Weißbüschelaffe allmählich an die Versuchsumgebung anpassen kann.
7. EEG-Aufzeichnung (2 h/Tag)
- Vorbereitung des Themas
- Befestigen Sie einen Transferkäfig an einem kleinen Fenster des Heimkäfigs und bringen Sie den Weißbüschelaffen aus dem Heimkäfig in den Transferkäfig, normalerweise von selbst. Decken Sie den Tragekäfig mit einem Tuch ab und bringen Sie ihn in den Experimentierraum.
- Fixierung des Kopfes
- Fangen Sie den Weißbüschelaffen mit Schutzhandschuhen ein und setzen Sie ihn auf den speziellen Stuhl.
- Lege die vorbereitete Maske auf den Kopf des Weißbüschelaffen. Führen Sie den am Stuhl befestigten Schraubenkörper durch das Loch in der Maske und fixieren Sie ihn mit Rändelschrauben.
- Befestigen Sie den Kopf und die Maske leicht mit einem Band direkt unter der Nase.
HINWEIS: Der Kopf des Probanden musste nicht vollständig fixiert werden, solange die Elektroden nicht durch Bewegung entfernt wurden. Daher haben wir bei allen Probanden die gleiche Maske verwendet.
- Definition der Position der Elektroden
- Verwenden Sie das Nasion, das Inion und die Ohrläppchen als anatomische Orientierungspunkte, um die Position der Elektroden gemäß der Internationalen 10-20-Methode zu bestimmen 32,33,34,35,36,37. Messen Sie den Abstand zwischen Nasion und Inion in der Mittellinie mit einem Maßband. Definieren Sie die Position von Cz in der Mitte der Entfernung. Positionieren Sie die anderen Elektroden (Fz, Pz, Oz, F3 oder F4) mit 20 % der Inion-Neionen-Länge als Elektrodenabstand. Markieren Sie die Elektrodenpositionen auf der Kopfhaut mit einem Dermatographen auf Ölbasis.
- Vorbereitung der Haut
- Reiben Sie die markierte Stelle mit einem dünnen, in Reinigungsalkohol getauchten Wattestäbchen ab, um Schmutz und Talg von der Kopfhaut zu entfernen.
- Elektroden-Einstellungen
HINWEIS: Führen Sie die Schritte 7.2.1 bis 7.2.3 an allen Elektrodenpositionen aus, um Elektroden an Fz, Cz, C3, C4, Pz, A1, A2 und F3 (oder F4) zu platzieren.- Schneiden Sie mit einem Rohrschneider ein Stück Silikonschlauch mit einem Innendurchmesser von 4 mm und einem Außendurchmesser von 7 mm in eine Länge von ca. 20 mm.
- Tragen Sie Klebstoff auf die Ränder der geschnittenen Röhre auf und kleben Sie ihn auf die Kopfhaut.
- Füllen Sie das Innere des Röhrchens mit EEG-Gel mit einer Spritze und einer nicht spitzen Spritzennadel.
- Verbinden Sie die Referenzelektrode mit Pz und die Masseelektroden mit F3 oder F4 (Abbildung 1C).
- Führen Sie Elektroden in das Rohr ein und verbinden Sie das Elektrodenkabel mit der Eingangsbox.
- Starten Sie die Anwendung für EEG-Aufzeichnungen, um die Elektrodenimpedanz zu messen, und passen Sie die Parameter an, um sicherzustellen, dass alle Elektroden unter 5 kΩ liegen.
- Bündeln Sie die Elektrodenkabel, um das Rauschen zu reduzieren.
- Belohnen Sie während der Ruhigstellung des Kopfes und zwischen den Aufgabensitzungen, indem Sie 1-3 ml der flüssigen Belohnung (Kaugummi oder Nahrung) manuell mit einer Spritze verabreichen.
- Geben Sie die zu speichernde Datei in der EEG-Aufzeichnungssoftware an und drücken Sie die Schaltfläche Aufzeichnung starten . Führen Sie das Skript für die Stimuluspräsentation sofort nach dem Start der EEG-Aufzeichnung aus. Drücken Sie die Stopp-Taste an der EEG-Aufzeichnung, wenn die Ausführung des Stimulus-Präsentationsskripts abgeschlossen ist, um alle Aufzeichnungen zu beenden. Wenn die Aufnahme abgeschlossen ist, entfernen Sie die Elektroden und die Kopfmaske.
- Fange die Tiere ein und bringe sie in ihre Tragekäfige zurück. Lassen Sie die Röhren auf der Kopfhaut; Alle Schläuche fielen auf natürliche Weise in etwa 1 Tag ab.
HINWEIS: In der Anfangszeit haben wir Aceton verwendet, um den Kleber aufzulösen und die Tube nach den Aufnahmesessions zu entfernen. Es gab jedoch auch Fälle von Hautverletzungen; Daher brachten wir die Tiere anschließend in ihre Heimatkäfige zurück, ohne den Schlauch zu entfernen. In den Dutzenden von Experimenten, die wir bisher durchgeführt haben, haben Weißbüschelaffen kein Interesse an den entfernten Röhren gezeigt, und es hat nie eine versehentliche Einnahme gegeben. - Reiz
- Zeichnen Sie natürliche, einfache und zusammengesetzte Rufe im Gefangenschafts- oder Versuchsraum von Weißbüschelaffen auf, die in nachfolgenden EEG-Aufzeichnungen nicht verwendet werden. Extrahieren Sie drei speziesspezifische einfache und zusammengesetzte Aufrufe (Phee-, Tsik-Ek- und Tsik-String5-Aufrufe ) aus den aufgezeichneten Dateien.
- Erzeugen Sie zusätzlich zu den Rufreizen mit einer Funktion in der Programmiersoftware weißes Rauschen und verwenden Sie dieses als Stimulus.
- Um diesem Protokoll zu folgen, verwenden Sie im Experiment drei auditive Dateien (16 Bit, 48 kHz) mit Weißbüschelaffen-Rufen. Steuern Sie die Aufgabe mit einem benutzerdefinierten Skript.
HINWEIS: Jeder Block enthält 50 Aufrufe für jeden Stimulus, also insgesamt 200 Aufrufe. Jeder Aufnahmeblock dauert ca. 10 Minuten. Jeder Teilnehmer muss zwei Blöcke absolvieren. Das Intervall zwischen den Anrufen beträgt 3 s. Von den vier Audio-Stimulus-Dateien (siehe Ergänzende Datei 1) war der Phee-Ruf-Stimulus ungefähr 2 s lang, während die anderen drei ungefähr 1 s lang waren. Dies lag daran, dass ein einzelner Phee-Ruf immer noch ein lang anhaltender Anruf ist (Abbildung 1D). - In jeder Sound-Stimulus-Datei enthält der rechte Kanal den Weißbüschelaffen-Ruf oder die Geräuschdaten, und der linke Kanal enthält das Triggersignal für den Beginn des Stimulus. Senden Sie dieses Triggersignal über ein Synchronisationsgerät an das EEG-Aufzeichnungssystem und zeichnen Sie es als Ereigniszeit auf.
8. Datenanalyse
HINWEIS: Der ursprüngliche Code, der in der Programmiersoftware und der Toolbox geschrieben wurde, wurde zur Nachbearbeitung der EEG-Daten verwendet, wie unten beschrieben (Ergänzende Datei 2)37.
- Vorverarbeitung
- Erneuter Verweis auf die verknüpfte Ohrreferenz.
- Hochpassfilter bei 2 Hz.
- Epoche von 100 ms vor bis 1000 ms nach Stimulusbeginn.
- Baseline-Korrektur auf den Mittelwert der 100-ms-Prästimulus-Periode. Lehnen Sie Artefakte mit einem Kriterium von ±150 μV ab.
- Darstellung von ereigniskorrelierten Potenzialen (ERP)
- Mittelwerten Sie alle Studiendaten für jeden Probanden.
- Erhalten Sie gruppengemittelte Wellenformen, indem Sie den Durchschnitt aller Probanden bilden.
- Um die gemittelten ERPs zwischen Ruftypen und Geräuschstimuli zu vergleichen, wenden Sie eine unidirektionale Varianzanalyse (ANOVA) an, bei der Stimuli als Faktor zwischen den Probanden für die Cz-Reaktion verwendet werden.
- Wenden Sie die Post-hoc-Mehrfachvergleichsanalyse mit der Tukey-Methode an.
- Darstellung der ereigniskorrelierten spektralen Störung (ERSP)
- Berechnen Sie den ERSP, um die mittlere ereignisbezogene Änderung der spektralen Leistung über die Zeit in einem breiten Frequenzbereich unter Verwendung von Gleichung (1) zu visualisieren. Fk (f,t) ist die spektrale Schätzung des Versuchs k bei der Frequenz f und der Zeit t:
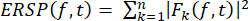 (1)
(1) - Wenden Sie die Zeit-Frequenz-Zerlegung auf die Aktivitäten an, indem Sie sinusförmige Wavelet-Transformationen verwenden, mit drei Zyklen Länge bei der niedrigsten Frequenz (10 Hz), die linear mit der Frequenz bis zu 32 Zyklen bei der höchsten Frequenz (120 Hz) ansteigt.
- Definieren Sie die anfänglichen und transienten Reaktionen in einem Zeitraum von 150 ms nach Stimulusbeginn bei 2-30 Hz und die anhaltenden Reaktionen in einem Zeitraum von 800 ms von 151 bis 950 ms nach Stimulusbeginn bei 40-100 H.
- Um die Unterschiede in den anfänglichen und anhaltenden Reaktionen in Fz und Cz zwischen dem Alter der Probanden und den Ruftypen zu testen, führen Sie eine bidirektionale ANOVA durch, bei der der Ruftyp als Faktor innerhalb des Subjekts und das Alter als Faktor zwischen den Probanden verwendet wird.
- Berechnen Sie den ERSP, um die mittlere ereignisbezogene Änderung der spektralen Leistung über die Zeit in einem breiten Frequenzbereich unter Verwendung von Gleichung (1) zu visualisieren. Fk (f,t) ist die spektrale Schätzung des Versuchs k bei der Frequenz f und der Zeit t:
Ergebnisse
Zuerst haben wir die durchschnittlichen ereigniskorrelierten Potentiale (ERPs) für jeden auditiven Stimulus bei den Weißbüschelaffen aufgetragen (Abbildung 2). Das auditiv evozierte Potential (AEP) war in der Geräuschbedingung ausgeprägt, was den deutlichen Beginn der Reize widerspiegelt (siehe Abbildung 1D). Um die gemittelten ERPs zwischen Ruftypen und Lärmreizen zu vergleichen, haben wir eine unidirektionale Varianzanalyse (ANOVA) mit Stimuli a...
Diskussion
Zu beachtende Punkte zur Anästhesie
Sowohl die Verabreichung von Ketamin als auch von Xylazin wurde versucht, und obwohl diese schmerzlindernd sind und daher für lange, schmerzhafte Aufgaben geeignet sind, neigen Weißbüschelaffen dazu, ohne Sauerstoffinhalation eine Abnahme des Blutsauerstoffgehalts zu erfahren44. Kurz gesagt, Alfaxalon eignet sich wahrscheinlich am besten für schmerzfreie Aufgaben wie die Rasur oder die Herstellung von Masken. Darüber hinaus wäre für d...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt durch das Hakubi-Projekt der Universität Kyoto, Grant-in-Aid for Challenging Research (Pioneering) (Nr. 22K18644), Grant-in-Aid for Scientific Research (C) (Nr. 22K12745), Grant-in-Aid for Scientific Research (B) (Nr. 21H02851) und Grant-in-Aid for Scientific Research (A) (Nr. 19H01039). Wir bedanken uns bei Editage (www.editage.jp) für das Lektorat in englischer Sprache.
Materialien
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
Referenzen
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten