A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفراش المحدود والتعشيش كنموذج للشدائد المبكرة في الفئران
In This Article
Summary
يصف هذا البروتوكول نموذجا حيوانيا لدراسة كيفية تأثير الشدائد المبكرة في الحياة ، التي تثيرها البيئة الفقيرة ورعاية الأم التي لا يمكن التنبؤ بها خلال فترة ما بعد الولادة المبكرة ، على نمو الدماغ وخطر الاضطرابات العقلية في المستقبل.
Abstract
الشدائد المبكرة (ELA) ، مثل سوء المعاملة والإهمال ونقص الموارد والبيئة المنزلية التي لا يمكن التنبؤ بها ، هي عامل خطر معروف للإصابة باضطرابات عصبية نفسية مثل الاكتئاب. تم استخدام النماذج الحيوانية ل ELA لدراسة تأثير الإجهاد المزمن على نمو الدماغ ، وعادة ما تعتمد على التلاعب بجودة و / أو كمية رعاية الأم ، لأن هذا هو المصدر الرئيسي لتجارب الحياة المبكرة في الثدييات ، بما في ذلك البشر. هنا ، يتم توفير بروتوكول مفصل لاستخدام نموذج الفراش والتعشيش المحدود (LBN) في الفئران. يحاكي هذا النموذج بيئة منخفضة الموارد ، مما يثير أنماطا مجزأة وغير متوقعة لرعاية الأم خلال نافذة تنموية حرجة (أيام ما بعد الولادة 2-9) عن طريق الحد من كمية مواد التعشيش المعطاة للسد لبناء عش لصغارها وفصل الفئران عن الفراش عبر منصة شبكية في القفص. يتم توفير بيانات تمثيلية لتوضيح التغيرات في سلوك الأم ، بالإضافة إلى انخفاض أوزان الجرو والتغيرات طويلة الأجل في مستويات الكورتيكوستيرون القاعدية ، والتي تنتج عن نموذج LBN. كبالغين ، تبين أن النسل الذي نشأ في بيئة LBN يظهر استجابة شاذة للإجهاد ، وعجز معرفي ، وسلوك يشبه anhedonia. لذلك ، يعد هذا النموذج أداة مهمة لتحديد كيفية تغيير نضج دوائر الدماغ الحساسة للإجهاد بواسطة ELA ويؤدي إلى تغييرات سلوكية طويلة الأجل تمنح التعرض للاضطرابات العقلية.
Introduction
فترة ما بعد الولادة المبكرة هي نافذة تنموية حرجة يمكن للتأثيرات البيئية من خلالها تغيير مسار التنمية. على سبيل المثال ، يمكن أن تغير الشدائد المبكرة (ELA) نمو الدماغ لإحداث تغييرات طويلة المدى في الوظيفة المعرفية والعاطفية. تشمل أمثلة ELA الإساءة الجسدية أو العاطفية ، والإهمال ، وعدم كفاية الموارد ، والبيئة المنزلية غير المتوقعة التي تحدث أثناء الطفولة أو المراهقة1. من المعروف أن ELA هو عامل خطر للإصابة باضطرابات مثل الاكتئاب واضطراب تعاطي المخدرات واضطراب ما بعد الصدمة (PTSD) والقلق2،3،4،5. هذا مهم بالنظر إلى أن مستويات فقر الأطفال في الولايات المتحدة قد تضاعفت مؤخرا ، من 5.2٪ في عام 2021 إلى 12.4٪ في عام 20226 ، وعلى الرغم من أن الفقر نفسه ليس بالضرورة ELA ، إلا أنه يزيد من احتمال الإصابة بأنواع مختلفة من ELA7.
لطالما كانت النماذج الحيوانية ضرورية لفهم آثار الإجهاد في وقت مبكر من الحياة على نمو الدماغ ونتائج البالغين. النموذجان الحيوانيان الرئيسيان المستخدمان في السنوات الأخيرة لتشريح هذه الظاهرة هما انفصال الأمهات (MS) والبيئة الفقيرة الناجمة عن محدودية الفراش ومواد التعشيش (LBN). تم تطوير مرض التصلب العصبي المتعدد كنموذج للحرمان الأبوي8. في ذلك ، يتم أخذ سدود القوارض بعيدا عن صغارها ، عادة لعدة ساعات ، كل يوم حتى الفطام8. تم العثور على نموذج مرض التصلب العصبي المتعدد ليؤدي إلى سلوكيات شبيهة بالاكتئاب والقلق في مرحلة البلوغ9 ، بالإضافة إلى استجابة شاذة للإجهاد المزمن10,11. من ناحية أخرى ، فإن نموذج LBN ، الذي تم تطويره لأول مرة في مختبر Baram12 ، لا يفصل السد عن الجراء ، بل يعدل البيئة التي يتم فيها تربية الجراء ، محاكيا بيئة منخفضة الموارد12,13. يؤدي تقليل كمية مواد التعشيش ومنع الوصول المباشر إلى الفراش في هذا النموذج إلى تعطل رعاية الأم من السدود3. نظرا لأن رعاية الأم القوية والتي يمكن التنبؤ بها مطلوبة للتطوير السليم لدوائر الدماغ المعرفية والعاطفية14 ، يمكن أن تؤدي رعاية الأم المجزأة من LBN إلى مجموعة من النتائج ، بما في ذلك محور الغدة النخامية والغدة الكظرية (HPA) مفرط النشاط ، وتحول التوازن المثبط المثير في مناطق متعددة من الدماغ ، وزيادة مستويات الهرمون المطلق للكورتيكوتروبين (CRH) ، والسلوك الشبيه بالاكتئاب في النسل13 ، 15,16,17,18,19.
الآلية الدقيقة التي يؤدي بها ELA إلى زيادة خطر الإصابة بالاضطرابات العصبية والنفسية ليست مفهومة تماما. يعتقد أنه مرتبط بالتغيرات في دائرة محور HPA19،20 ، وتظهر الأدلة الحديثة أن هذا قد يكون ناتجا عن التغيرات في التقليم المشبكي الدبقي الصغير19. لقد ثبت أن نموذج LBN أداة حاسمة لفهم تأثير البيئة المحيطة بالولادة على نمو الدماغ والنتائج السلوكية طويلة الأجل. على الرغم من أن هذا النموذج تم تطويره في البداية للفئران ، فقد تم تكييفه أيضا للفئران من أجل الاستفادة من الأدوات المعدلة وراثيا الموجودة12,13. والجدير بالذكر أن النموذج مشابه جدا في كلا النوعين ويثير نتائج متقاربة للغاية ، مثل التغيرات في محور HPA ، والعجز المعرفي ، والسلوك الشبيه بالاكتئاب ، مما يسلط الضوء على فائدته عبر الأنواع وإمكاناته الانتقالية. ستقدم هذه المقالة وصفا تفصيليا لكيفية استخدام نموذج الفراش والتعشيش المحدود في الفئران ، وجمع وتحليل سلوك الأم ونتائج النسل للتحقق من فعالية النموذج والنتائج المتوقعة.
Protocol
تم تنفيذ جميع الإجراءات المتعلقة بالحيوانات وفقا لدليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر ، وتمت الموافقة عليها من قبل اللجنة المؤسسية لرعاية واستخدام من جامعة ولاية جورجيا (رقم الموافقة A24011). تم تربية الفئران وصيانتها في مرافق في جامعة ولاية جورجيا. أجريت التجارب على سلالة C57BL / 6J خلال فترة ما حول الولادة (يوم ما بعد الولادة [P] 2-10) وشملت الذكور والإناث. الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. إعداد المواد
- قطع مقسم الشبكة وفقا لأبعاد القفص ، وترك فائض 3 سم على الجوانب الأطول.
ملاحظة: يتم قطع الشبكة المتوفرة في جدول المواد من قبل الشركة المصنعة. - قم بطي الحواف ، بما في ذلك الفائض ، بطريقة تخلق منصة مثبتة بدقة على حواف القفص وبارتفاع ~ 2.5 سم فوق الأرض. سيسمح ذلك للبول والبراز بالمرور عبر مقسم الشبكة دون أن تتمكن الحيوانات من استرداد فراش كوز الذرة. أخيرا ، تأكد من طي جميع الحواف الحادة لأسفل لمنع أي ضرر للحيوانات.
ملاحظة: الفواصل الشبكية قابلة لإعادة الاستخدام ويجب تنظيفها جيدا بين الاستخدامات بالماء الساخن والصابون ، يليها الرش بنسبة 70٪ من الإيثانول. - قم بإعداد الكاميرات على حوامل ثلاثية القوائم وقم بإعداد نظام التسجيل.
ملاحظة: يوصى باستخدام برنامج إدارة الفيديو. ينتج عن هذه التسجيلات ملفات .mp4 يتم تثبيتها تلقائيا في مقاطع 1 ساعة. - اضبط الإعدادات على التسجيل المستمر.
ملاحظة: الإعدادات الإضافية الموصى بها هي دقة 1920 × 1080 و 30 إطارا / ثانية. - اضبط ملفات .mp4 الناتجة لتقسيمها إلى مقاطع 1 ساعة إذا لم يتم ذلك تلقائيا بواسطة برنامج إدارة الفيديو.
- في حالة تحليل فترة إطفاء الأنوار ، استخدم إضاءة الأشعة تحت الحمراء.
ملاحظة: لتقليل وهج التسجيل على جانب القفص ، يوصى بتعطيل الأشعة تحت الحمراء (IR) من الكاميرا. بدلا من ذلك ، استخدم الأضواء الكاشفة بالأشعة تحت الحمراء في الغرفة أثناء تسجيل المرحلة المظلمة.
2. نموذج الفراش والتعشيش المحدود (LBN)
- زوج 1-4 إناث مع مربي ذكر واحد.
ملاحظة: العمر الموصى به لأول اقتران في الإناث التجريبية هو P75. يعد استخدام الإناث غير المتجانسة أمرا مثاليا ، ولكن في الحالات التي لا يكون فيها ذلك ممكنا ، كما هو الحال مع سلالات الفئران المعدلة وراثيا القيمة ، قد تستمر الإناث متعددة الأزواج في التكاثر لمدة أربعة أشهر تقريبا بعد ذلك. يوصى ، على الرغم من أنه ليس مطلوبا ، بالتحقق من وجود سدادات مهبلية يوميا لتأكيد يوم التزاوج (اليوم الجنيني [E] 0).- بمجرد أن تصبح السدود حاملا ، حافظ على الاضطرابات في حدها الأدنى.
ملاحظة: يمكن إعادة استخدام الإناث متعددة الأزواج بشكل عام لإنتاج ما يصل إلى خمسة لترات قبل انخفاض الخصوبة. إذا تم إعادة استخدام السدود للتجربة ، فيجب استخدامها بشكل تفضيلي لنفس الحالة في كل مرة أو تحويلها فقط من Control إلى LBN ، ولكن ليس العكس ، من أجل تجنب أي آثار متبقية طويلة الأجل ل LBN على السد.
- بمجرد أن تصبح السدود حاملا ، حافظ على الاضطرابات في حدها الأدنى.
- في E17 (أو إذا لم يتم فحص المقابس ، كلما بدت الإناث حاملا بشكل واضح) ، افصل الإناث في قفص زجاجي قياسي خاص بهن وامنحهن عشا قطنيا واحدا (5 × 5 سم) لبناء عش.
ملاحظة: من الأفضل نقل الإناث المنفصلات إلى غرفة صغيرة هادئة بعيدا عن غرفة المستعمرة الرئيسية مع دورة ضوء / مظلمة لمدة 12 ساعة والحد الأدنى من الاضطرابات من الأفراد لإعداد التحكم و LBN. - سجل تاريخ الميلاد (حوالي E19).
- في P2 ، عد الجراء وجنسهم. قم بتعيين الفضلات بشكل عشوائي إلى LBN أو ظروف التحكم (إذا كانت القمامة الأولى للسد). يجب أن يكتمل هذا التفاعل مع الجراء بين 1 و 4 ساعات بعد تشغيل الأنوار.
- ضع الجراء بعناية في قفص جديد ونظيف ليتم فرزها حسب الجنس. المسافة الشرجية التناسلية بين فتحة الشرج والأعضاء التناسلية أكبر في الذكور منها في الإناث ويمكن استخدامها كمعرف.
- افصل الذكور والإناث إلى مجموعات لعدهم.
- إعدام الفضلات مع أكثر من 8 الجراء وتجاهل الفضلات مع أقل من 4. حجم القمامة الأمثل هو 4-8 جراء ، لأن أي شيء خارج هذا النطاق يمكن أن يتداخل مع توزيع رعاية الأم أثناء الدراسة.
ملاحظة: المتغيرات التي يمكن أن تتأثر بسبب حجم القمامة هي وزن الجرو ، وفرصة التغذية ، والتفاعلات بين الأم والجرو ، مما قد يربك التجربة. من الناحية المثالية ، لن يتم تعزيز الفئران لأنها أقل عرضة للبقاء على قيد الحياة من الفئران.
- قم بإعداد شروط التحكم وLBN كما هو موضح في الشكل 1.
- التحكم: استخدم قفص صندوق أحذية الماوس بحجم قياسي (19.4 سم × 13.0 سم × 38.1 سم) مع ~ 220 جم من فراش كوز الذرة (اعتمادا على أبعاد القفص ، بهدف ارتفاع ~ 1 سم) ونستله قطن مربع قياسي (5 × 5 سم).
- لمساعدة الفئران على التأقلم مع هذه البيئة غير المألوفة ، ضع إحدى كرياتها البرازية من قفصها القديم في كل ركن من أركان القفص الجديد. بالإضافة إلى ذلك ، ضع كمية صغيرة (بحجم الدايم) من نستله القطن المستخدم من القفص السابق فوق نستله الجديد.
- LBN: ضع المقسم الشبكي المعد مسبقا في قفص صندوق أحذية قياسي مع ~ 110 جم من فراش كوز الذرة (يهدف إلى ارتفاع ~ 0.5 سم). يجب أن تمنع الشبكة الاتصال المباشر بين الفئران وفراش كوز الذرة.
- أخيرا ، أضف نصف مربع نستلة قطني (2.5 × 5 سم). كرر جميع الخطوات المذكورة أعلاه للمساعدة في التأقلم.
ملاحظة: يوصى بالحفاظ على أقفاص علب الأحذية على رفوف قياسية غير مهواة لأنه ثبت أن هذا الإعداد هادئ ولا يسبب انخفاض حرارة الجسم في الجراء التي يتم تربيتها في أقفاص LBN21. ومع ذلك ، قد لا يكون هذا هو الحال مع زيادة تدفق الهواء في أقفاص التهوية ؛ لذلك ، يجب على الباحثين قياس مستويات الضوضاء ودرجات حرارة الجرو الأساسية في نظامهم إذا كانوا يستخدمون أقفاصا جيدة التهوية.
- أخيرا ، أضف نصف مربع نستلة قطني (2.5 × 5 سم). كرر جميع الخطوات المذكورة أعلاه للمساعدة في التأقلم.
- التحكم: استخدم قفص صندوق أحذية الماوس بحجم قياسي (19.4 سم × 13.0 سم × 38.1 سم) مع ~ 220 جم من فراش كوز الذرة (اعتمادا على أبعاد القفص ، بهدف ارتفاع ~ 1 سم) ونستله قطن مربع قياسي (5 × 5 سم).
- أضف الجراء إلى القفص المخصص لهم وضعهم فوق العش. بعد ذلك ، ضع السد في القفص المواجه للجراء ، لأن ذلك سيساعدها على ملاحظة وجودها بسرعة أكبر. تأكد من تضمين ما يكفي من الطعام والماء لمدة 8 أيام على الأقل لتجنب إزعاج القفص حتى نهاية التجربة في P10.
- ضع كاميرا على حامل ثلاثي القوائم أمام القفص ، مما يسمح برؤية جانبية واضحة للسد وصغارها. اختياريا ، ضع المرايا حول القفص لالتقاط جميع الزوايا بشكل أفضل. على الرغم من أن 1 ساعة فقط من تسجيل الفيديو يوميا تحتاج إلى تحليل ، فقد تم إعداد الكاميرا لتسجيل 24/7 باستمرار أثناء التجربة بحيث يمكن مراقبة الاضطرابات.
ملاحظة: يمكن أيضا ملاحظة الفئران شخصيا ، ويمكن تسجيل سلوك الأم يدويا ، على الرغم من أنه يفضل تسجيل الفيديو لمنع أي اضطرابات بسبب وجود المجرب في الغرفة. إذا تم استخدام رفوف جيدة التهوية ، فقد يكون من الضروري أيضا استخدام إجراء مختلف لترتيب كاميرات لتسجيل رعاية الأم عن ذلك الموضح هنا. - في صباح يوم P10 ، أعد جميع إلى ظروف الأقفاص القياسية (مطابقة بشكل مثالي لحالة التحكم أعلاه) وقم بوزن الجراء.
- عامل جميع الجراء بنفس الطريقة وافطم P21 إلى مجموعات من 2-5 من زملاء القمامة من نفس الجنس.
ملاحظة: اهدف إلى إيواء رفقاء القمامة من نفس الجنس معا كلما أمكن ذلك ، ولكن إذا لزم الأمر ، قم بإيواء ذرية من نفس الجنس من فضلات مختلفة في نفس الحالة معا. يوصى بتجنب التحكم في السكن ونسل LBN معا (انظر Yang et al. لتأثير تكوين cagemate على الأنماط الظاهرية السلوكية22).

الشكل 1: مثال على إعداد القفص. يظهر القفص الموجود على الجانب الأيسر من الصورة قفصا قياسيا للتحكم (CTL) يحتوي على كمية كاملة من الفراش وعش كامل. يظهر القفص الموجود على الجانب الأيمن إعدادا محدودا للفراش والتعشيش (LBN) بنصف كمية الفراش ونصف عش ومقسم شبكي لفصل عن الفراش. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تسجيل سلوك الأم
- على الرغم من جمع التسجيلات المستمرة في هذا الإعداد ، قم بتحليل 1 ساعة فقط من P3 إلى P6. يوصى بتحليل مقاطع الفيديو المسجلة في موعد لا يتجاوز 1 ساعة بعد تغيير الأضواء للسماح بالتعود وتحليل مقاطع الفيديو من وقت ثابت كل يوم.
ملاحظة: تحتوي الفترة من P3 إلى P6 عادة على أكبر الاختلافات في رعاية الأم بسبب LBN. لذلك ، من الضروري فقط تحليل هذه الأيام. يسمح وقت المراقبة / التسجيل المقترح بالتقاط النشاط بعد الانتقال من الدورة النشطة إلى الدورة غير النشطة أو العكس. ومع ذلك ، فإن المرحلة غير النشطة هي عندما يكون من المرجح أن يشارك السد في رعاية الأم وقد ثبت سابقا أنه يحتوي على أكبر اختلافات المجموعة في سلوك الأم3.
ملاحظة: التقط تسجيلات P2 في وقت متأخر عن الأيام الأخرى لأن الفئران تحتاج إلى 1 ساعة على الأقل لتعتاد على تغيير القفص. ما لم يكن هذا متغيرا مثيرا للاهتمام ، تجاهل هذا اليوم من التحليل. - سجل جميع السلوكيات كما هو موضح في الجدول 1. عادة ، يتم تسجيل السلوكيات لأول 50 دقيقة بعد بدء وقت جمع البيانات.
ملاحظة: يمكن القيام بذلك يدويا أو إلكترونيا باستخدام البرنامج التفاعلي لأبحاث المراقبة السلوكية (BORIS، وهو برنامج مفتوح المصدر)، أو نوع مماثل من البرامج. التعليمات أدناه مخصصة لتسجيل النقاط باليد ويمكن تكييفها لأي برنامج يتم اختياره. - في جدول مطبوع ، سجل السلوك المرصود باستخدام الاختصار ووقت البدء ومدة النوبة وأي ملاحظات وصفية. على سبيل المثال ، إذا كان السد يرضع بنشاط ثم يغادر العش ولكن الجراء لا يزالون مرتبطين بها ، لاحظ هذا على أنه AN، متبوعا ب O. يجب الاحتفاظ بوصف الجراء (وعددها) الذي لا يزال مرفقا كملاحظة على الجانب في حالة الحاجة إلى ذلك لاحقا.
ملاحظة: لا يتم تحليل أي سلوك أقل من 3 ثوان. تساعد هذه القاعدة في تصفية السلوكيات اللحظية بسبب الاضطرابات الخارجية ، مثل الضوضاء البيئية. يتم إجراء استثناء عندما يكون هناك انقطاع مرئي لنوبة AN (مثل حركة كبيرة أو امتداد) يتم استئنافها بسرعة. في هذه الحالة ، السلوك الملاحظ هو AN، متبوعا ب N-AN، كما هو موضح في الجدول 1. - في حالة حدوث سلوكيات متعددة في وقت واحد ، سجل السلوك الأكثر نشاطا. مثال على ذلك هو إذا كان السد منخفضا في التمريض ولكنه يبدأ لاحقا في اللعق والاستمالة ، ويلاحظ أن التمريض المنخفض يتوقف ، ويجب وضع علامة على السلوك التالي على أنه LG مع ملاحظة أن هذا حدث أثناء LN.
| نوع السلوك | اختصار | وصف | ||||
| لعق / الاستمالة | ال جي | يشارك السد في لعق / استمالة صغارها. | ||||
| التمريض النشط | و | يرضع السد صغارها واقفين ، بينما ظهرها مقوس. | ||||
| تمريض نشط جديد | ن-آن | يستخدم هذا السلوك على وجه التحديد عندما يقطع السد التمريض ولكنه يستأنف بسرعة. هذا استثناء لقاعدة 3s. | ||||
| انخفاض التمريض | ل ن | يرضع السد صغارها بنشاط ، لكن ظهرها منخفض أو مسطح تقريبا. يتبع هذا السلوك عادة AN بعد فترة من الزمن. | ||||
| التمريض الجانبي | إس إن | السد ملقى على جانبها عند الرضاعة (المعروف أيضا باسم التمريض السلبي). | ||||
| خارج العش | O | السد ليس على العش ، وهي لا تأكل / تشرب. يمكن ملاحظة ذلك في مشيها حول القفص أو استكشافها. | ||||
| الأكل / الشرب | E | السد خارج العش يأكل أو يشرب. | ||||
| الاستمالة الذاتية | اس جي | السد يهيئ نفسها. | ||||
| حمل الجراء | C | يحمل السد الجراء ، عادة لنقلهم مرة أخرى إلى العش. | ||||
| بناء عش | ملحوظه | يقوم السد بنشاط ببناء أو نقل العش. | ||||
| التحرك على العش | M | السد يتحرك على العش. يظهر هذا مع تفاعل السد مع الجراء بطريقة مختلفة عن LG أو أي نوع من التمريض ، مثل الاستنشاق أو التربية أو الدوس على الجراء. | ||||
الجدول 1: وصف سلوكيات رعاية الأم.
4. تحليل بيانات سلوك الأم
- تجميع نتائج التسجيل في جدول بيانات.
- إذا تم تحليل مقاطع الفيديو إلكترونيا ، فاحذف السلوكيات ذات النوبات التي تقل عن 3 ثوان ، كما هو موضح في الخطوة 3.
- احسب متوسط طول النوبة ومتوسط التكرار والمدة الإجمالية لللعق والاستمالة لكل يوم من أيام المراقبة.
ملاحظة: يمكن إجراء الإحصائيات الوصفية على أي من السلوكيات المسجلة ، ولكن اللعق والاستمالة عادة ما يمثلان الاضطراب الأكثر وضوحا من حيث التجزئة بواسطة LBN (أي نوبات أقصر وأكثر تكرارا). يمكن تحليل هذه المتغيرات كمتوسط عبر P3-P6 ، أو كمقاييس متكررة يوميا للبحث عن أي تغييرات بمرور الوقت إذا كان هذا مهما.
5. حساب الإنتروبيا
ملاحظة: يتم حساب الإنتروبيا ، أو عدم القدرة على التنبؤ ، لسلوكيات رعاية الأم بناء على الطريقة التي اقترحها Vegetabile et al.23. تعتمد هذه الطريقة على افتراض أن سلوكيات رعاية الأم تعمل كسلسلة ماركوف ، والتي يمكن استخدامها لتقدير معدل الإنتروبيا للتسلسل السلوكي. يتميز تسلسل سلوكيات كل سد باستخدام مصفوفة الانتقال التجريبية ij> i,j = 1 ... 7 من الاحتمالات الشرطية للانتقال من سلوك (i) إلى سلوك آخر (j) ، ويتم حساب معدل الإنتروبيا من هذا كما هو موضح سابقا 3,23 وكما يلي: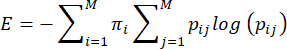
حيث pij هو الاحتمال الشرطي أن السلوك j يتم ملاحظته بعد ملاحظة السد يؤدي السلوك i ، πi هو التردد الذي لوحظ به السلوك i ، و M (= 7) هو العدد الإجمالي للسلوكيات المختلفة. تتم إحالة القارئ إلى Vegetabile et al.23 لمناقشة الأسس النظرية للمعادلات. هنا ، ينصب التركيز على كيفية تطبيق الطريقة في نموذج LBN.
- لحساب ذلك ، قم بترتيب التنسيق المطلوب للتحليل.
- اجمع بين AN و LN و SN و N-AN في متغير واحد يسمى N عن طريق جمع الأوقات معا ، لأنها جميعا تتضمن التمريض.
ملاحظة: راجع الجدول 1 لوصف سلوكيات رعاية الأم. - أضف السلوكيات التي لا تتعلق بالسلوكيات الذاتية أو الموجهة للجرو (M و O) إلى O.
- أدخل LG و E و SG و C و NB بشكل منفصل لينتج عنه إجمالي 7 سلوكيات.
- اجمع بين AN و LN و SN و N-AN في متغير واحد يسمى N عن طريق جمع الأوقات معا ، لأنها جميعا تتضمن التمريض.
- أنشئ جدول بيانات بأعمدة باتباع هذا الترتيب: معرف الماوس ومعرف القمامة والقمامة # والمعالجة واليوم والوقت والسلوك والحالة.
- في معرف الماوس ، أضف خط الماوس / النمط الجيني للسد.
- في معرف القمامة ، استخدم معرف السد متبوعا برقم القمامة.
- في القمامة # ، أشر إلى عدد الفضلات التي يمتلكها السد.
- تأكد من أن العلاج هو LBN أو التحكم ، وفقا للظروف التي تم وضع فيها.
- أشر إلى اليوم باعتباره يوم ما بعد الولادة المقابل الذي تم تحليله.
- حدد الوقت كطابع زمني في الفيديو عندما بدأ السلوك وانتهى (بالنسبة إلى بداية التسجيل).
- حدد السلوك من السبعة الموصوفة سابقا (N و O و LG و E و SG و C و NB) (الجدول 1).
- حدد نوعي الحالات ، START و STOP. لذلك ، سيظهر كل سلوك مرتين ؛ يشير الترميز الأول إلى البداية ، والثاني يشير إلى التوقف.
- باتباع هذا التنسيق ، قم بتضمين معلومات جميع الأيام التي تم تحليلها.
- في بيئة R، قم باستيراد مجموعات البيانات التي تم تنسيقها على النحو الوارد أعلاه.
- قم بتثبيت الحزم المتوفرة في https://github.com/bvegetabile/entropyRate.
ملاحظة: تشغيل هذا الرمز يؤدي إلى مجلد باسم LBN; بغض النظر عن الشرط ، يحتوي هذا المجلد على الإنتروبيا المحسوبة. بالإضافة إلى ذلك ، يمكن بعد ذلك حساب متوسط إنتروبيا كل يوم حسب موضوع P3-P6 ومقارنتها بين الظروف.
النتائج
توضح النتائج التمثيلية كيف يؤثر ELA ، الذي تفرضه بيئة فقيرة في أقفاص LBN ، على رعاية الأمهات من السدود والنتائج الفسيولوجية للنسل. الإنتروبيا اليومية في سلوك رعاية الأم أعلى في LBN عبر الأيام P3-P6 (F1,58 = 7.21 ، p = 0.0094; الشكل 2 أ) ، وكذلك متوسط إنتروبيا كل سد من هذه الفترة الز?...
Discussion
توفر هذه المقالة بروتوكولا مفصلا لتطبيق نموذج LBN في الفئران. هذا النموذج هو أداة مهمة لفهم كيف يساهم شكل من أشكال الإجهاد المزمن ذي الصلة من الناحية الأخلاقية والتحويلية في الحياة المبكرة في تطور الاضطرابات العصبية والنفسية في النسل13. كما أنه مفيد لدراسة سلوك الأم وأي تغييرا?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل NIMH K99 / R00 Pathway to Independence Award #MH120327 ، ومنحة مؤسسة Whitehall # 2022-08-051 ، ومنحة NARSAD Young Investigator Grant # 31308 من مؤسسة أبحاث الدماغ والسلوك ومؤسسة جون وبولي سباركس. يود المؤلفون أن يشكروا قسم الموارد الحيوانية في جامعة ولاية جورجيا على توفير رعاية استثنائية لحيواناتنا., وريان سليث لدعمه الفني الممتاز في إعداد وصيانة نظام إدارة الفيديو لدينا. يود الدكتور بولتون أيضا أن يشكر الدكتورة تالي ز. بارام على التدريب الممتاز في التنفيذ السليم لنموذج LBN خلال زمالة ما بعد الدكتوراه.
Materials
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
References
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113 (2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702 (2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865 (2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. . Poverty in the United States: 2022. , 60 (2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426 (2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212 (2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736 (2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543 (2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484 (2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464 (2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600 (2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30 (2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167 (2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263 (2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49 (2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763 (2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437 (2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507 (2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655 (2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472 (2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120 (2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996 (2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161 (2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098 (2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277 (2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved