Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cama y anidación limitadas como modelo de adversidad temprana en ratones
En este artículo
Resumen
Este protocolo describe un modelo animal para estudiar cómo la adversidad en los primeros años de vida, provocada por un entorno empobrecido y un cuidado materno impredecible durante el período postnatal temprano, afecta el desarrollo del cerebro y el riesgo futuro de trastornos mentales.
Resumen
La adversidad en los primeros años de vida, como el abuso, la negligencia, la falta de recursos y un entorno familiar impredecible, es un factor de riesgo conocido para desarrollar trastornos neuropsiquiátricos como la depresión. Los modelos animales de ELA se han utilizado para estudiar el impacto del estrés crónico en el desarrollo del cerebro y, por lo general, se basan en la manipulación de la calidad y/o cantidad de la atención materna, ya que esta es la principal fuente de experiencias tempranas en la vida de los mamíferos, incluidos los humanos. Aquí, se proporciona un protocolo detallado para emplear el modelo de Cama y Anidamiento Limitado (LBN) en ratones. Este modelo imita un entorno de bajos recursos, que provoca patrones fragmentados e impredecibles de cuidado materno durante una ventana crítica de desarrollo (días postnatales 2-9) al limitar la cantidad de materiales de anidación que se le dan a la madre para construir un nido para sus cachorros y separar a los ratones de la ropa de cama a través de una plataforma de malla en la jaula. Se proporcionan datos representativos para ilustrar los cambios en el comportamiento materno, así como la disminución del peso de las crías y los cambios a largo plazo en los niveles basales de corticosterona, que resultan del modelo LBN. En la edad adulta, se ha demostrado que las crías criadas en el entorno LBN exhiben una respuesta aberrante al estrés, déficits cognitivos y un comportamiento similar a la anhedonia. Por lo tanto, este modelo es una herramienta importante para definir cómo la maduración de los circuitos cerebrales sensibles al estrés se ve alterada por el ELA y da lugar a cambios de comportamiento a largo plazo que confieren vulnerabilidad a los trastornos mentales.
Introducción
El período postnatal temprano es una ventana crítica del desarrollo en la que las influencias ambientales pueden cambiar la trayectoria del desarrollo. Por ejemplo, la adversidad temprana de la vida (ELA, por sus siglas en inglés) puede alterar el desarrollo del cerebro para provocar cambios a largo plazo en la función cognitiva y emocional. Ejemplos de ELA incluyen abuso físico o emocional, negligencia, recursos inadecuados y un ambiente familiar impredecible que ocurredurante la infancia o la adolescencia. Se sabe que el ELA es un factor de riesgo para el desarrollo de trastornos como la depresión, el trastorno por consumo de sustancias, el trastorno de estrés postraumático (TEPT) y la ansiedad 2,3,4,5. Esto es importante dado que los niveles de pobreza infantil en los EE. UU. se han más que duplicado recientemente, del 5,2% en 2021 al 12,4% en 20226, y aunque la pobreza en sí misma no es necesariamente ELA, aumenta la probabilidad de varios tipos de ELA7.
Los modelos animales han sido esenciales durante mucho tiempo para comprender los efectos del estrés en los primeros años de vida en el desarrollo del cerebro y los resultados en la edad adulta. Los dos principales modelos animales utilizados en los últimos años para diseccionar este fenómeno son la separación materna (EM) y un entorno empobrecido inducido por materiales de cama y anidación limitados (LBN). La EM fue desarrollada como un modelo de privación parental8. En él, las madres de roedores se alejan de sus crías, generalmente durante varias horas, todos los días hasta el destete8. Se ha descubierto que el paradigma de la EM da lugar a comportamientos depresivos y similares a la ansiedad en la edad adulta9, así como a una respuesta aberrante al estrés crónico10,11. Por otro lado, el modelo LBN, desarrollado por primera vez en el laboratorio de Baram12, no separa la madre de las crías, sino que modifica el ambiente en el que se crían las crías, imitando un ambiente de bajos recursos12,13. La disminución de la cantidad de material de anidación y la prevención del acceso directo al lecho en este modelo resulta en una interrupción del cuidado materno de las madres3. Dado que se requiere una atención materna robusta y predecible para el desarrollo adecuado de los circuitos cerebrales cognitivos y emocionales14, la atención materna fragmentada de la LBN puede dar lugar a una variedad de resultados, incluido un eje hipotálamo-hipófisis-suprarrenal (HPA) hiperactivo, cambios en el equilibrio excitatorio-inhibidor en múltiples regiones del cerebro, aumento de los niveles de hormona liberadora de corticotropina (CRH) y comportamiento depresivo en la descendencia13, 15,16,17,18,19.
El mecanismo exacto por el cual el ELA resulta en un mayor riesgo de trastornos neuropsiquiátricos no se comprende completamente. Se cree que está relacionado con alteraciones en los circuitos del eje HPA 19,20, y la evidencia reciente muestra que esto puede ser causado por cambios en la poda sináptica microglial19. Se ha demostrado que el modelo LBN es una herramienta crucial para comprender el impacto del entorno perinatal en el desarrollo del cerebro y los resultados conductuales a largo plazo. A pesar de que este modelo fue desarrollado inicialmente para ratas, también ha sido adaptado para ratones con el fin de aprovechar las herramientas transgénicas existentes 12,13. Cabe destacar que el modelo es muy similar en ambas especies y provoca resultados altamente convergentes, como alteraciones en el eje HPA, déficits cognitivos y comportamiento depresivo, lo que pone de manifiesto su utilidad interespecie y su potencial traslacional. Este artículo proporcionará una descripción detallada de cómo emplear el modelo de cama y anidación limitada en ratones, recopilando y analizando el comportamiento materno y los resultados de la descendencia para validar la eficacia del modelo y los resultados esperados.
Protocolo
Todos los procedimientos con animales se realizaron de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud, y fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Georgia (número de aprobación A24011). Los ratones fueron criados y mantenidos en las Instalaciones de Animales de la Universidad Estatal de Georgia. Los experimentos se realizaron en una cepa C57BL/6J durante el período perinatal (día postnatal [P] 2-10) e incluyeron hombres y mujeres. Los reactivos y equipos utilizados para este estudio se enumeran en la Tabla de Materiales.
1. Configuración del material
- Corta el divisor de malla según las dimensiones de la jaula, dejando un exceso de 3 cm en los lados más largos.
NOTA: La malla proporcionada en la tabla de materiales es cortada por el fabricante. - Dobla los bordes, incluido el exceso, de forma que se cree una plataforma ajustada con precisión a los bordes de la jaula y con ~2,5 cm de altura sobre el suelo. Esto permitirá que la orina y las heces pasen a través del divisor de malla sin que los animales puedan recuperar el lecho de mazorcas de maíz. Finalmente, asegúrese de que todos los bordes afilados estén doblados hacia abajo para evitar cualquier daño a los animales.
NOTA: Los divisores de malla son reutilizables y deben limpiarse a fondo entre usos con agua caliente y jabón, seguido de rociar con etanol al 70%. - Coloque las cámaras en trípodes y prepare el sistema de grabación.
NOTA: Se recomienda utilizar un software de gestión de vídeo. Estas grabaciones dan como resultado .mp4 archivos que se agrupan automáticamente en segmentos de 1 h. - Ajuste la configuración a grabación continua.
NOTA: Los ajustes adicionales recomendados son una resolución de 1920 x 1080 y 30 fotogramas/s. - Configure los archivos de .mp4 resultantes para que se dividan en segmentos de 1 h si no lo hace automáticamente el software de gestión de vídeo.
- Si analiza el período de apagado de las luces, use iluminación infrarroja.
NOTA: Para reducir el resplandor de la grabación en el lateral de la jaula, se recomienda desactivar los infrarrojos (IR) de la cámara. En su lugar, utilice focos IR en la habitación durante la grabación de la fase oscura.
2. Paradigma de cama y anidación limitada (LBN)
- Empareje de 1 a 4 hembras con un macho reproductor.
NOTA: La edad recomendada para el primer apareamiento en hembras experimentales es P75. El uso de hembras nulíparas es ideal, pero en situaciones en las que esto no es factible, como con valiosas líneas de ratones transgénicos, las hembras multíparas pueden continuar reproduciéndose durante aproximadamente cuatro meses después. Se recomienda, aunque no es obligatorio, comprobar diariamente si hay tapones vaginales para confirmar el día de apareamiento (día embrionario [E]0).- Una vez que las madres estén preñadas, mantenga las molestias al mínimo.
NOTA: Las hembras multíparas generalmente se pueden reutilizar para producir hasta cinco camadas antes de que disminuya la fertilidad. Si las presas se reutilizan para el experimento, deben usarse preferentemente para la misma condición cada vez o solo cambiarse de Control a LBN, pero nunca al revés, para evitar cualquier efecto residual a largo plazo de LBN en la presa.
- Una vez que las madres estén preñadas, mantenga las molestias al mínimo.
- En E17 (o si no se revisaron los tapones, siempre que las hembras parezcan evidentemente embarazadas), separe a las hembras en su propia jaula de plexiglás estándar y déles un nido de algodón (5 x 5 cm) para construir un nido.
NOTA: Es óptimo trasladar a las hembras separadas a una habitación pequeña y tranquila lejos de la sala principal de la colonia con un ciclo de luz/oscuridad de 12 h y mínimas interrupciones por parte del personal para la configuración de Control y LBN. - Registre la fecha de nacimiento (alrededor de E19).
- En P2, cuente y sexie a los cachorros. Asigne aleatoriamente las camadas a LBN o a condiciones de control (si es la primera camada de la madre). Esta interacción con los cachorros debe completarse entre 1 y 4 h después de que se enciendan las luces.
- Coloque a los cachorros con cuidado en una jaula nueva y limpia para clasificarlos por sexo. La distancia anogenital entre el ano y los genitales es mayor en los hombres que en las mujeres y puede utilizarse como identificador.
- Separe a los machos y las hembras en grupos para contarlos.
- Descarte las camadas con más de 8 cachorros y deseche las camadas con menos de 4. El tamaño óptimo de la camada es de 4 a 8 cachorros, ya que cualquier cosa fuera de este rango puede interferir con la distribución del cuidado materno durante el estudio.
NOTA: Las variables que pueden verse afectadas debido al tamaño de la camada son el peso de la cría, la oportunidad de alimentación y las interacciones madre-cachorro, lo que podría confundir el experimento. Idealmente, los ratones no serán adoptados de forma cruzada, ya que tienen menos probabilidades de sobrevivir que las ratas.
- Configure las condiciones de control y LBN como se muestra en la Figura 1.
- Control: Utilice una jaula de caja de zapatos para ratones de tamaño estándar (19,4 cm x 13,0 cm x 38,1 cm) con ~220 g de lecho de mazorcas de maíz (dependiendo de las dimensiones de la jaula, con el objetivo de ~1 cm de altura) y un nido de algodón cuadrado estándar (5 x 5 cm).
- Para ayudar a los ratones a aclimatarse a este entorno desconocido, coloque una de sus bolitas fecales de su antigua jaula en cada esquina de la nueva jaula. Además, coloque una pequeña cantidad (del tamaño de una moneda de diez centavos) de nido de algodón usado de la jaula anterior sobre el nuevo nidón.
- LBN: Coloque el divisor de malla previamente preparado en una jaula de caja de zapatos estándar con ~ 110 g de lecho de mazorca de maíz (con el objetivo de ~ 0,5 cm de altura). La malla debe evitar el contacto directo entre los ratones y el lecho de mazorcas de maíz.
- Por último, añade la mitad de un cuadrado de algodón (2,5 x 5 cm). Repita todos los pasos anteriores para ayudar con la aclimatación.
NOTA: Se recomienda mantener las jaulas de las cajas de zapatos en bastidores estándar no ventilados porque se ha demostrado que esta configuración es silenciosa y no induce hipotermia en cachorros criados en jaulas LBN21. Sin embargo, este puede no ser el caso con el aumento del flujo de aire en las jaulas ventiladas; Por lo tanto, los investigadores deben medir los niveles de ruido y las temperaturas centrales de los cachorros en su sistema si están utilizando jaulas ventiladas.
- Por último, añade la mitad de un cuadrado de algodón (2,5 x 5 cm). Repita todos los pasos anteriores para ayudar con la aclimatación.
- Control: Utilice una jaula de caja de zapatos para ratones de tamaño estándar (19,4 cm x 13,0 cm x 38,1 cm) con ~220 g de lecho de mazorcas de maíz (dependiendo de las dimensiones de la jaula, con el objetivo de ~1 cm de altura) y un nido de algodón cuadrado estándar (5 x 5 cm).
- Agregue a los cachorros a su jaula designada y colóquelos encima del nido. A continuación, coloque la madre en la jaula frente a los cachorros, ya que esto le ayudará a notar que están presentes más rápidamente. Asegúrese de incluir suficiente comida y agua durante al menos 8 días para evitar perturbar la jaula hasta el final del experimento en P10.
- Coloque una cámara en un trípode frente a la jaula, lo que permite una vista lateral clara de la madre y sus cachorros. Opcionalmente, coloque espejos alrededor de la jaula para capturar mejor todos los ángulos. Aunque solo es necesario analizar 1 hora de grabación de video por día, la cámara está configurada para grabar continuamente las 24 horas del día, los 7 días de la semana durante el experimento para que se puedan monitorear las perturbaciones.
NOTA: Los ratones también se pueden observar en persona, y el comportamiento materno se puede calificar a mano, aunque es preferible grabar en video para evitar interrupciones debidas a la presencia del experimentador en la habitación. Si se utilizan bastidores ventilados, también puede ser necesario utilizar un procedimiento diferente para organizar las cámaras para la grabación del cuidado materno que el descrito aquí. - En la mañana de P10, devuelva a todos los animales a las condiciones estándar de jaula (idealmente idénticas a la condición de control anterior) y pese a los cachorros.
- Trate a todos los cachorros por igual y destete a P21 en grupos de 2 a 5 compañeros de camada del mismo sexo.
NOTA: Trate de alojar juntos a los compañeros de camada del mismo sexo siempre que sea posible, pero si es necesario, aloje juntos a los descendientes del mismo sexo de diferentes camadas en la misma condición. Se recomienda evitar el control del alojamiento y la descendencia LBN conjuntamente (véase Yang et al. para el efecto de la composición del compañero de jaula en los fenotipos de comportamiento22).

Figura 1: Ejemplo de configuración de jaula. La jaula en el lado izquierdo de la imagen muestra una jaula de control estándar (CTL) que contiene una cantidad completa de ropa de cama y un nido completo. La jaula del lado derecho muestra una configuración limitada de cama y anidación (LBN) con la mitad de la cantidad de ropa de cama, la mitad de un nido y un divisor de malla para separar a los animales de la cama. Haga clic aquí para ver una versión más grande de esta figura.
3. Puntuación del comportamiento materno
- Aunque en esta configuración se recopilan grabaciones continuas, analice solo 1 h de P3 a P6. Se recomienda analizar los videos grabados no antes de 1 hora después del cambio de luces para permitir la habituación y analizar los videos a una hora constante cada día.
NOTA: El período de P3 a P6 suele contener las mayores diferencias en la atención materna debido a la LBN; Por lo tanto, solo es necesario analizar estos días. El tiempo de observación/registro sugerido permite la captura de la actividad después de la transición del ciclo activo al inactivo o viceversa. Sin embargo, la fase inactiva es cuando es más probable que la madre se dedique al cuidado materno y se ha demostrado previamente que contiene las mayores diferencias de grupo en el comportamiento materno3.
NOTA: Capture las grabaciones de P2 más tarde que en otros días porque los ratones necesitan al menos 1 h para habituarse al cambio de jaula. A menos que se trate de una variable de interés, descarte este día del análisis. - Puntúe todos los comportamientos como se presenta en la Tabla 1. Por lo general, los comportamientos se puntúan durante los primeros 50 minutos después de que haya comenzado el tiempo de recopilación de datos.
NOTA: Esto se puede hacer a mano o electrónicamente utilizando el Software Interactivo de Investigación de Observación del Comportamiento (BORIS, un software de código abierto), o un tipo de software similar. Las instrucciones a continuación son para la puntuación manual y se pueden adaptar a cualquier software que se elija. - En una tabla impresa, registre el comportamiento observado usando la abreviatura, la hora de inicio y la duración del combate, y cualquier nota descriptiva. Por ejemplo, si la madre está amamantando activamente y luego abandona el nido, pero los cachorros todavía están unidos a ella, anótelo como AN, seguido de O. La descripción de los cachorros (y cuántos) que aún están unidos debe mantenerse como una nota en el costado en caso de que esto sea necesario más adelante.
NOTA: Cualquier comportamiento de menos de 3 s de duración no se analiza. Esta regla ayuda a filtrar los comportamientos momentáneos debidos a perturbaciones externas, como el ruido ambiental. Se hace una excepción cuando hay una interrupción visible de un combate de AN (por ejemplo, por un gran movimiento o estiramiento) que se reanuda rápidamente. En este caso, el comportamiento observado es AN, seguido de N-AN, como se describe en la Tabla 1. - En el caso de que ocurran varios comportamientos a la vez, registre el más activo. Un ejemplo de esto es si la madre está amamantando bajo, pero más tarde comienza a lamer y acicalarse, se observa que la lactancia baja se detiene, y el siguiente comportamiento debe marcarse como LG con una nota de que esto ocurrió durante LN.
| Tipo de comportamiento | Abreviatura | Descripción | ||||
| Lamer / aseo | LG | La madre se dedica a lamer/acicalar a sus cachorros. | ||||
| Enfermería activa | UN | La madre amamanta a sus cachorros de pie, mientras su espalda está arqueada. | ||||
| Nueva enfermería activa | N-AN | Este comportamiento se utiliza específicamente cuando la madre interrumpe la lactancia, pero se reanuda rápidamente. Esta es una excepción a la regla de las 3s. | ||||
| Baja enfermería | EN | La madre está amamantando activamente a sus cachorros, pero su espalda está baja o casi plana. Este comportamiento suele seguir a AN después de un período de tiempo. | ||||
| Enfermería Lateral | SN | La madre está acostada de lado mientras amamanta (también conocida como lactancia pasiva). | ||||
| Fuera del nido | O | La madre no está en el nido y no está comiendo ni bebiendo. Esto se puede observar en ella caminando alrededor de la jaula o explorando. | ||||
| Comer/beber | E | La madre está fuera del nido comiendo o bebiendo. | ||||
| Aseo personal | SG | La presa se está acicalando a sí misma. | ||||
| Llevar cachorros | C | La madre transporta a los cachorros, generalmente para reubicarlos de regreso al nido. | ||||
| Construcción de nidos | NB | La presa está construyendo o reubicando activamente el nido. | ||||
| Muévete en el nido | M | La presa se mueve en el nido. Esto se presenta con la madre interactuando con los cachorros de una manera diferente a la LG o cualquier tipo de lactancia, como olfatear, criar o pisar a los cachorros. | ||||
Tabla 1: Descripción de las conductas de cuidado materno.
4. Análisis de datos de comportamiento materno
- Compila los resultados de la puntuación en una hoja de cálculo.
- Si los videos se analizaron electrónicamente, elimine los comportamientos con episodios de menos de 3 s, como se describe en el paso 3.
- Calcule la duración promedio de la pelea, la frecuencia promedio y la duración total del lamido y el aseo para cada día de observación.
NOTA: Se pueden realizar estadísticas descriptivas sobre cualquiera de los comportamientos puntuados, pero el lamido y el acicalamiento suelen presentar la interrupción más evidente en términos de fragmentación por LBN (es decir, episodios más cortos y frecuentes). Estas variables se pueden analizar como un promedio entre P3 y P6, o como medidas repetidas por día para buscar cambios a lo largo del tiempo si esto es de interés.
5. Cálculo de la entropía
NOTA: La entropía, o imprevisibilidad, de las conductas de cuidado materno se calcula con base en el método propuesto por Vegetabile et al.23. Este método se basa en la suposición de que las conductas de cuidado materno actúan como una cadena de Markov, que se puede utilizar para estimar la tasa de entropía de una secuencia conductual. La secuencia de comportamientos de cada presa se caracteriza utilizando la matriz de transición empírica ij> i,j = 1... 7 de probabilidades condicionales de pasar de un comportamiento (i) a otro comportamiento (j), y la tasa de entropía se calcula a partir de esto como se describió anteriormente 3,23 y de la siguiente manera: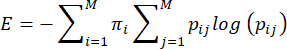
donde pij es la probabilidad condicional de que el comportamiento j se observe después de que se observe una presa realizando el comportamiento i, πi es la frecuencia con la que se observa el comportamiento i, y M (=7) es el número total de comportamientos diferentes. Se remite al lector a Vegetabile et al.23 para una discusión de los fundamentos teóricos de las ecuaciones; aquí, la atención se centra en cómo aplicar el método en el modelo LBN.
- Para calcular esto, organice el formato requerido para el análisis.
- Combine AN, LN, SN y N-AN en una sola variable llamada N sumando los tiempos, ya que todos involucran enfermería.
NOTA: Consulte la Tabla 1 para la descripción de las conductas de cuidado materno. - Agregue los comportamientos que no están relacionados con comportamientos dirigidos por sí mismo o por cachorros (M y O) en O.
- Ingrese LG, E, SG, C y NB por separado para dar como resultado 7 comportamientos en total.
- Combine AN, LN, SN y N-AN en una sola variable llamada N sumando los tiempos, ya que todos involucran enfermería.
- Cree una hoja de cálculo con columnas siguiendo este orden: ID de ratón, ID de camada, # de camada, Tratamiento, Día, Hora, Comportamiento y Estado.
- En el ID del ratón, agregue la línea/genotipo del ratón de la presa.
- En la identificación de la camada, use el identificador de la madre seguido del número de camada.
- En la camada #, indique el número de camadas que ha tenido la madre.
- Asegurar que el tratamiento sea LBN o Control, de acuerdo a las condiciones en las que se colocaron los animales.
- Indicar el día como el día postnatal correspondiente analizado.
- Indique la hora como marca de tiempo en el vídeo cuando se inició y finalizó el comportamiento (en relación con el inicio de la grabación).
- Seleccione el comportamiento de los siete descritos anteriormente (N, O, LG, E, SG, C y NB) (Tabla 1).
- Marque los dos tipos de estados, START y STOP. Por lo tanto, cada comportamiento aparecerá dos veces; La primera notación marca el inicio y la segunda marca la parada.
- Siguiendo este formato, incluye la información de todos los días analizados.
- En el entorno de R, importe los conjuntos de datos a los que se les ha dado el formato anterior.
- Instale los paquetes disponibles en https://github.com/bvegetabile/entropyRate.
NOTA: La ejecución de este código da como resultado una carpeta denominada LBN; Independientemente de la condición, esta carpeta contiene la entropía calculada. Además, el sujeto puede promediar la entropía de cada día para P3-P6 y compararla entre condiciones.
Resultados
Los resultados representativos demuestran cómo la ELA, impuesta por un ambiente empobrecido en las jaulas LBN, afecta el cuidado materno de las madres y los resultados fisiológicos de la descendencia. La entropía diaria en el comportamiento de cuidado materno es mayor en LBN entre los días P3-P6 (F1,58 = 7,21, p = 0,0094; Figura 2A), así como la entropía promedio de cada presa de este período de tiempo (t15 = 3.03, p = 0.0085;
Discusión
Este artículo proporciona un protocolo detallado para aplicar el modelo LBN en ratones. Este modelo es una herramienta importante para comprender cómo una forma de estrés crónico etológica y traslacionalmente relevante en los primeros años de vida contribuye al desarrollo de trastornos neuropsiquiátricos en la descendencia13. También es útil para estudiar el comportamiento materno y cualquier cambio en el cerebro de las madres desde una perspectiva molecular, neuroendocrina o basada en ci...
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo contó con el apoyo de la #MH120327 del Premio NIMH K99/R00 Camino a la Independencia, la Subvención de la Fundación Whitehall #2022-08-051 y la Subvención para Jóvenes Investigadores de NARSAD #31308 de la Fundación de Investigación del Cerebro y el Comportamiento y la Fundación John y Polly Sparks. Los autores desean agradecer a la División de Recursos Animales de la Universidad Estatal de Georgia por brindar un cuidado excepcional a nuestros animales, y a Ryan Sleeth por su excelente apoyo técnico en la configuración y mantenimiento de nuestro sistema de gestión de video. La Dra. Bolton también desea agradecer a la Dra. Tallie Z. Baram por su excelente capacitación en la implementación adecuada del modelo LBN durante su beca postdoctoral.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
Referencias
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113 (2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702 (2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865 (2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. . Poverty in the United States: 2022. , 60 (2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426 (2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212 (2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736 (2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543 (2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484 (2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464 (2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600 (2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30 (2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167 (2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263 (2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49 (2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763 (2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437 (2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507 (2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655 (2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472 (2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120 (2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996 (2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161 (2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098 (2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277 (2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados