Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde Erken Yaşam Sıkıntısı için Bir Model Olarak Sınırlı Yatak Takımı ve Yuvalama
Bu Makalede
Özet
Bu protokol, doğum sonrası erken dönemde yoksul bir çevre ve öngörülemeyen anne bakımının neden olduğu erken yaşam sıkıntılarının beyin gelişimini ve gelecekteki zihinsel bozukluk riskini nasıl etkilediğini incelemek için bir hayvan modelini açıklamaktadır.
Özet
İstismar, ihmal, kaynak eksikliği ve öngörülemeyen bir ev ortamı gibi erken yaşam sıkıntıları (ELA), depresyon gibi nöropsikiyatrik bozuklukların gelişmesi için bilinen bir risk faktörüdür. ELA için hayvan modelleri, kronik stresin beyin gelişimi üzerindeki etkisini incelemek için kullanılmıştır ve tipik olarak, insanlar da dahil olmak üzere memelilerde erken yaşam deneyimlerinin ana kaynağı olduğundan, anne bakımının kalitesini ve / veya miktarını manipüle etmeye dayanır. Burada, farelerde Sınırlı Yataklama ve Yuvalama (LBN) modelini kullanmak için ayrıntılı bir protokol sağlanmıştır. Bu model, yavruları için bir yuva inşa etmek için baraja verilen yuvalama malzemelerinin miktarını sınırlayarak ve fareleri kafesteki bir ağ platformu aracılığıyla yataktan ayırarak, kritik bir gelişimsel pencerede (doğum sonrası 2-9. günler) parçalanmış ve öngörülemeyen anne bakımı kalıplarını kışkırtan düşük kaynaklı bir ortamı taklit eder. LBN modelinden kaynaklanan anne davranışındaki değişikliklerin yanı sıra azalan yavru ağırlıklarını ve bazal kortikosteron seviyelerindeki uzun vadeli değişiklikleri göstermek için temsili veriler sağlanmıştır. Yetişkinler olarak, LBN ortamında yetiştirilen yavruların anormal bir stres tepkisi, bilişsel eksiklikler ve anhedoni benzeri davranışlar sergilediği gösterilmiştir. Bu nedenle, bu model, strese duyarlı beyin devrelerinin olgunlaşmasının ELA tarafından nasıl değiştirildiğini ve zihinsel bozukluklara karşı savunmasızlık sağlayan uzun vadeli davranış değişikliklerine yol açtığını tanımlamak için önemli bir araçtır.
Giriş
Doğum sonrası erken dönem, çevresel etkilerin gelişimin yörüngesini değiştirebileceği kritik bir gelişimsel penceredir. Örneğin, erken yaşam sıkıntısı (ELA), bilişsel ve duygusal işlevlerde uzun vadeli değişikliklere neden olmak için beyin gelişimini değiştirebilir. ELA örnekleri arasında fiziksel veya duygusal istismar, ihmal, yetersiz kaynaklar ve çocukluk veya ergenlik döneminde meydana gelen öngörülemeyen bir ev ortamı yer alır1. ELA'nın depresyon, madde kullanım bozukluğu, travma sonrası stres bozukluğu (TSSB) ve anksiyete gibi bozuklukların gelişimi için bir risk faktörü olduğu bilinmektedir 2,3,4,5. Bu, ABD'deki çocukluk çağı yoksulluğu düzeylerinin 2021'de %5,2'den 2022'de %12,4'e çıkarak son zamanlarda iki kattan fazla arttığı göz önüne alındığındaönemlidir 6 ve yoksulluğun kendisi mutlaka ELA olmasa da, çeşitli ELA türlerinin olasılığını artırır7.
Hayvan modelleri, erken yaşam stresinin beyin gelişimi ve yetişkin sonuçları üzerindeki etkilerini anlamak için uzun zamandır gerekli olmuştur. Son yıllarda bu fenomeni incelemek için kullanılan iki ana hayvan modeli, anne ayrılması (MS) ve sınırlı yatak ve yuvalama malzemelerinin (LBN) neden olduğu yoksul bir ortamdır. MS, ebeveyn yoksunluğunun bir modeli olarak geliştirilmiştir8. İçinde, kemirgen barajları, sütten kesilene kadar her gün birkaç saat boyunca, genellikle birkaç saat yavrularından alınır8. MS paradigmasının yetişkinliktedepresif ve anksiyete benzeri davranışlara 9 ve kronik strese karşı anormal bir tepkiyeneden olduğu bulunmuştur 10,11. Öte yandan, ilk olarak Baram laboratuvarında12 geliştirilen LBN modeli, barajı yavrulardan ayırmaz, bunun yerine yavruların yetiştirildiği ortamı değiştirerek düşük kaynaklı bir ortamı taklit eder12,13. Bu modelde yuvalama materyali miktarının azaltılması ve yataklara doğrudan erişimin engellenmesi, barajlardan kaynaklanan anne bakımının aksamasına neden olur3. Bilişsel ve duygusal beyin devrelerinin14 düzgün gelişimi için sağlam ve öngörülebilir anne bakımı gerektiğinden, LBN'den parçalanmış anne bakımı, aşırı aktif Hipotalamik-Hipofiz-Adrenal (HPA) ekseni, çoklu beyin bölgelerinde kaydırılmış uyarıcı-inhibitör denge, artmış kortikotropin salgılayan hormon (CRH) seviyeleri ve yavrularda depresif benzeri davranış13, 15,16,17,18,19.
ELA'nın nöropsikiyatrik bozukluklar için artmış riskle sonuçlandığı kesin mekanizma tam olarak anlaşılamamıştır. HPA eksen devresindeki(19,20) değişikliklerle ilgili olduğu düşünülmektedir ve son kanıtlar bunun mikroglial sinaptik budama19'daki değişikliklerden kaynaklanabileceğini göstermektedir. LBN modelinin, perinatal ortamın beyin gelişimi ve uzun vadeli davranışsal sonuçlar üzerindeki etkisini anlamak için çok önemli bir araç olduğu gösterilmiştir. Bu model başlangıçta sıçanlar için geliştirilmiş olsa da, mevcut transgenik araçlardan yararlanmak için fareler için de uyarlanmıştır12,13. Özellikle, model her iki türde de çok benzerdir ve HPA eksenindeki değişiklikler, bilişsel eksiklikler ve depresif benzeri davranışlar gibi oldukça yakınsak sonuçlara neden olur, böylece türler arası faydasını ve translasyon potansiyelini vurgular. Bu makale, farelerde sınırlı yatak ve yuvalama modelinin nasıl kullanılacağına, modelin etkinliğini ve beklenen sonuçları doğrulamak için anne davranışı ve yavru sonuçlarının nasıl toplanacağına ve analiz edileceğine dair ayrıntılı bir açıklama sağlayacaktır.
Protokol
Hayvanlarla ilgili tüm prosedürler, Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak gerçekleştirildi ve Georgia Eyalet Üniversitesi'nden Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı (onay numarası A24011). Fareler, Georgia Eyalet Üniversitesi'ndeki Hayvan Tesislerinde yetiştirildi ve bakımı yapıldı. Deneyler, perinatal dönemde (doğum sonrası gün [P] 2-10) bir C57BL / 6J suşu üzerinde gerçekleştirildi ve erkekleri ve kadınları içeriyordu. Bu çalışma için kullanılan reaktifler ve ekipman Malzeme Tablosunda listelenmiştir.
1. Malzeme kurulumu
- Ağ bölücüyü kafesin boyutlarına göre kesin, uzun kenarlarda 3 cm fazla bırakın.
NOT: Malzeme tablosunda sağlanan ağ, üretici tarafından kesilir. - Fazlalık da dahil olmak üzere kenarları, kafesin kenarlarına tam olarak oturan ve zeminden ~2,5 cm yüksekliğinde bir platform oluşturacak şekilde katlayın. Bu, hayvanlar mısır koçanı yatağını geri alamadan idrar ve dışkının ağ bölücüden geçmesine izin verecektir. Son olarak, hayvanlara herhangi bir zarar vermemek için tüm keskin kenarların katlandığından emin olun.
NOT: Ağ bölücüler tekrar kullanılabilir ve kullanımlar arasında sıcak su ve sabunla iyice temizlenmeli ve ardından %70 etanol püskürtülmelidir. - Kameraları tripodlara kurun ve kayıt sistemini hazırlayın.
NOT: Video yönetim yazılımı kullanmanız önerilir. Bu kayıtlar, otomatik olarak 1 saatlik segmentlere bağlanan .mp4 dosyalarıyla sonuçlanır. - Ayarları sürekli kayıt için ayarlayın.
NOT: Önerilen ek ayarlar 1920 x 1080 çözünürlük ve 30 kare/sn'dir. - Elde edilen .mp4 dosyalarını, video yönetim yazılımı tarafından otomatik olarak yapılmazsa 1 saatlik bölümlere ayrılacak şekilde ayarlayın.
- Işıkların kapalı kalma süresini analiz ediyorsanız, kızılötesi aydınlatma kullanın.
NOT: Kafesin yan tarafındaki kayıt parlamasını azaltmak için, kameradan kızılötesini (IR) devre dışı bırakmanız önerilir. Bunun yerine, karanlık faz kaydı sırasında odadaki IR projektörleri kullanın.
2. Sınırlı yataklama ve yuvalama (LBN) paradigması
- 1-4 dişiyi tek evli bir erkek yetiştirici ile eşleştirin.
NOT: Deney dişilerinde ilk eşleşme için önerilen yaş P75'tir. Nullipar dişilerin kullanılması idealdir, ancak değerli transgenik fare çizgileri gibi bunun mümkün olmadığı durumlarda, multipar dişiler yaklaşık dört ay sonra üremeye devam edebilir. Zorunlu olmasa da, çiftleşme gününü doğrulamak için vajinal tıkaçları günlük olarak kontrol etmeniz önerilir (embriyonik gün [E]0).- Barajlar hamile kaldığında, rahatsızlıkları minimumda tutun.
NOT: Multipar dişiler genellikle doğurganlık azalmadan önce beş litreye kadar üretmek için yeniden kullanılabilir. Barajlar deney için yeniden kullanılırsa, tercihen her seferinde aynı koşul için kullanılmalı veya sadece Kontrolden LBN'ye geçirilmelidir, ancak LBN'nin baraj üzerindeki uzun vadeli etkilerini önlemek için asla tersi olmamalıdır.
- Barajlar hamile kaldığında, rahatsızlıkları minimumda tutun.
- E17'de (veya tıkaçlar kontrol edilmediyse, dişiler açıkça hamile göründüğünde), dişileri kendi standart pleksiglas kafeslerine ayırın ve bir yuva yapmaları için onlara bir pamuklu yuvacık (5 x 5 cm) verin.
NOT: Ayrılmış dişileri, 12 saatlik bir aydınlık/karanlık döngüsü ve Kontrol ve LBN kurulumu için personelden minimum kesinti ile ana koloni odasından uzakta sessiz, küçük bir odaya taşımak en uygunudur. - Doğum tarihini kaydedin (E19 civarında).
- P2'de yavruları sayın ve cinsiyetlendirin. Çöpleri rastgele LBN veya Kontrol koşullarına atayın (barajın ilk çöpüyse). Yavrularla olan bu etkileşim, ışıklar açıldıktan sonra 1 ila 4 saat arasında tamamlanmalıdır.
- Yavruları cinsiyete göre sıralanacak yeni ve temiz bir kafese dikkatlice yerleştirin. Anüs ve cinsel organlar arasındaki anogenital mesafe erkeklerde kadınlardan daha fazladır ve tanımlayıcı olarak kullanılabilir.
- Erkekleri ve dişileri saymak için gruplara ayırın.
- 8'den fazla yavru olan yavruları itlaf edin ve 4'ten az yavru olan yavruları atın. En uygun altlık boyutu 4-8 yavrudur, çünkü bu aralığın dışındaki herhangi bir şey çalışma sırasında anne bakımının dağılımına müdahale edebilir.
NOT: Altlık büyüklüğü nedeniyle etkilenebilecek değişkenler, yavru ağırlığı, beslenme fırsatı ve anne-yavru etkileşimleridir ve bu da deneyi karıştırabilir. İdeal olarak, fareler, sıçanlardan daha az hayatta kalma olasılıkları olduğu için çapraz beslenmeyecektir.
- Kontrol ve LBN koşullarını Şekil 1'de gösterildiği gibi ayarlayın.
- Kontrol: ~220 g mısır koçanı yatağı (kafes boyutlarına bağlı olarak, ~1 cm yüksekliği hedefleyen) ve bir standart kare pamuklu yuvacık (19,4 cm x 13,0 cm x 38,1 cm) ile standart boyutlu bir fare ayakkabı kutusu kafesi (5 x 5 cm) kullanın.
- Farelerin bu alışılmadık ortama alışmasına yardımcı olmak için, eski kafeslerindeki dışkı peletlerinden birini yeni kafesin her köşesine yerleştirin. Ek olarak, önceki kafesten küçük (kuruş boyutunda) bir miktar kullanılmış pamuklu yuvayı yeni yuvanın üzerine yerleştirin.
- LBN: Önceden hazırlanmış ağ bölücüyü, ~110 g mısır koçanı yatağı olan (~0,5 cm yüksekliği hedefleyen) standart bir ayakkabı kutusu kafesine yerleştirin. Ağ, fareler ve mısır koçanı yatağı arasında doğrudan teması önlemelidir.
- Son olarak, bir pamuk yuvacık karesinin yarısını (2,5 x 5 cm) ekleyin. Alışmaya yardımcı olması için yukarıdaki tüm adımları tekrarlayın.
NOT: Ayakkabı kutusu kafeslerinin standart, havalandırılmayan raflarda tutulması önerilir, çünkü bu kurulumun sessiz olduğu ve LBN kafeslerinde21 yetiştirilen yavrularda hipotermiye neden olmadığı gösterilmiştir. Bununla birlikte, havalandırmalı kafeslerde artan hava akışı ile durum böyle olmayabilir; Bu nedenle, araştırmacılar havalandırmalı kafesler kullanıyorlarsa sistemlerindeki gürültü seviyelerini ve yavru çekirdek sıcaklıklarını ölçmelidir.
- Son olarak, bir pamuk yuvacık karesinin yarısını (2,5 x 5 cm) ekleyin. Alışmaya yardımcı olması için yukarıdaki tüm adımları tekrarlayın.
- Kontrol: ~220 g mısır koçanı yatağı (kafes boyutlarına bağlı olarak, ~1 cm yüksekliği hedefleyen) ve bir standart kare pamuklu yuvacık (19,4 cm x 13,0 cm x 38,1 cm) ile standart boyutlu bir fare ayakkabı kutusu kafesi (5 x 5 cm) kullanın.
- Yavruları belirlenen kafeslerine ekleyin ve yuvanın üzerine yerleştirin. Daha sonra, barajı yavrulara bakacak şekilde kafese yerleştirin, çünkü bu, onların daha hızlı bir şekilde mevcut olduklarını fark etmesine yardımcı olacaktır. P10'daki deneyin sonuna kadar kafesi rahatsız etmemek için en az 8 gün boyunca yeterli yiyecek ve su içerdiğinden emin olun.
- Kafesin önündeki bir tripoda bir kamera yerleştirin, böylece barajın ve yavrularının net bir şekilde yandan görülmesini sağlayın. İsteğe bağlı olarak, tüm açıları daha iyi yakalamak için kafesin etrafına aynalar yerleştirin. Günde sadece 1 saatlik video kaydının analiz edilmesi gerekmesine rağmen, kamera, bozulmaların izlenebilmesi için deney sırasında 7/24 sürekli kayıt yapacak şekilde ayarlanmıştır.
NOT: Fareler şahsen de gözlemlenebilir ve annenin davranışı elle puanlanabilir, ancak deneycinin odada bulunmasından kaynaklanan herhangi bir aksaklığı önlemek için video kaydı tercih edilir. Havalandırmalı raflar kullanılıyorsa, kameraları anne bakımı kaydı için düzenlemek üzere burada açıklanandan farklı bir prosedür kullanmak da gerekebilir. - P10 sabahı, tüm hayvanları standart kafes koşullarına (ideal olarak yukarıdaki kontrol koşullarıyla aynı) geri getirin ve yavruları tartın.
- Tüm yavrulara aynı şekilde davranın ve P21'de 2-5 aynı cinsiyetten yavrudan oluşan gruplar halinde sütten kesin.
NOT: Mümkün olduğunca aynı cinsiyetten yavruları bir arada barındırmayı hedefleyin, ancak gerekirse aynı durumdaki farklı yavrulardan aynı cinsiyetten yavruları birlikte barındırın. Konut kontrolü ve LBN yavrularının birlikte önlenmesi önerilir (kafes eşi kompozisyonunun davranışsal fenotipler üzerindeki etkisi için Yang ve ark.'ya bakınız22).

Şekil 1: Kafes kurulum örneği. Görüntünün sol tarafındaki kafes, tam miktarda yatak takımı ve tam bir yuva içeren standart bir kontrol (CTL) kafesini göstermektedir. Sağ taraftaki kafes, yatak takımının yarısı, yarısı yuvacık ve hayvanları yatak takımlarından ayırmak için bir ağ bölücü ile sınırlı bir yatak takımı ve yuvalama (LBN) kurulumunu göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Anne davranışı puanlaması
- Bu kurulumda sürekli kayıtlar toplansa da, P3'ten P6'ya kadar yalnızca 1 saat analiz edin. Alışmaya izin vermek için ışıklar değiştikten en geç 1 saat sonra kaydedilen videoların analiz edilmesi ve videoların her gün tutarlı bir saatten analiz edilmesi önerilir.
NOT: P3'ten P6'ya kadar olan dönem tipik olarak LBN'ye bağlı anne bakımında en büyük farklılıkları içerir; Bu nedenle, sadece bu günleri analiz etmek gerekiyor. Önerilen gözlem/kayıt süresi, aktif döngüden inaktif döngüye veya tam tersine geçiş yaptıktan sonra aktivitenin yakalanmasına izin verir. Bununla birlikte, inaktif faz, barajın anne bakımına katılma olasılığının en yüksek olduğu ve daha önce anne davranışındaki en büyük grup farklılıklarını içerdiği gösterildiği zamandır3.
NOT: Farelerin kafes değişimine alışması için en az 2 saate ihtiyacı olduğundan, P1 kayıtlarını diğer günlerden daha geç yakalayın. Bu bir ilgi değişkeni değilse, bu günü analizden çıkarın. - Tüm davranışları Tablo 1'de gösterildiği gibi puanlayın. Tipik olarak, davranışlar veri toplama süresi başladıktan sonraki ilk 50 dakika için puanlanır.
NOT: Bu, Davranışsal Gözlem Araştırma Etkileşimli Yazılımı (BORIS, açık kaynaklı bir yazılım) veya benzer bir yazılım türü kullanılarak elle veya elektronik olarak yapılabilir. Aşağıdaki talimatlar elle puanlama içindir ve seçilen herhangi bir yazılım için uyarlanabilir. - Yazdırılan bir tabloda, kısaltmayı, maçın başlangıç zamanını ve süresini ve tüm açıklayıcı notları kullanarak gözlemlenen davranışı kaydedin. Örneğin, baraj aktif olarak emziriyorsa ve daha sonra yuvayı terk ediyorsa, ancak yavrular hala ona bağlıysa, bunu AN ve ardından O olarak not edin. Yavruların açıklaması (ve kaç tanesinin) hala takılı olduğu, daha sonra ihtiyaç duyulması ihtimaline karşı yan tarafta bir not olarak tutulmalıdır.
NOT: 3 saniyenin altındaki herhangi bir davranış analiz edilmez. Bu kural, çevresel gürültü gibi dış rahatsızlıklardan kaynaklanan anlık davranışların filtrelenmesine yardımcı olur. Hızlı bir şekilde devam ettirilen bir AN maçında (büyük bir hareket veya esneme gibi) gözle görülür bir kesinti olduğunda bir istisna yapılır. Bu durumda, not edilen davranış Tablo 1'de açıklandığı gibi AN'dir ve ardından N-AN gelir. - Aynı anda birden fazla davranışın gerçekleşmesi durumunda, en aktif olanı kaydedin. Bunun bir örneği, barajın düşük emzirme olması ancak daha sonra yalamaya ve tımar etmeye başlaması, düşük emzirmenin durduğu not edilir ve bir sonraki davranışın, bunun LN sırasında meydana geldiğine dair bir notla LG olarak işaretlenmesi gerektiğidir.
| Davranış türü | Kısaltma | Açıklama | ||||
| Yalama / tımar | LG | Baraj, yavrularını yalamak/tımar etmekle meşgul. | ||||
| Aktif hemşirelik | BİR | Baraj, sırtı kemerliyken yavrularını ayakta emziriyor. | ||||
| Yeni aktif hemşirelik | N-AN | Bu davranış, özellikle baraj hemşireliği kesintiye uğrattığında kullanılır, ancak hızlı bir şekilde devam eder. Bu, 3s kuralının bir istisnasıdır. | ||||
| Düşük emzirme | LN (Türkçe) | Baraj aktif olarak yavrularını emziriyor, ancak sırtı düşük veya neredeyse düz. Bu davranış genellikle bir süre sonra AN'yi takip eder. | ||||
| Side Hemşireliği | SN (İngilizce) | Baraj emzirirken (pasif hemşirelik olarak da bilinir) yan yatıyor. | ||||
| Yuva dışı | O | Baraj yuvada değil ve o bir şey yiyip içmiyor. Bu, kafesin etrafında yürürken veya keşfederken gözlemlenebilir. | ||||
| Yeme/içme | E | Baraj yuvadan uzakta, yemek yemek ya da içmek. | ||||
| Kendi kendine bakım | SG | Baraj kendini tımar ediyor. | ||||
| Yavru köpek taşımak | C | Baraj, yavruları genellikle yuvaya geri yerleştirmek için taşır. | ||||
| Yuva yapımı | NB | Baraj aktif olarak yuvayı inşa ediyor veya yerini değiştiriyor. | ||||
| Yuvaya devam et | M | Baraj yuva üzerinde hareket ediyor. Bu, barajın yavrularla LG'den veya yavruları koklama, yetiştirme veya üzerine basma gibi herhangi bir hemşirelik türünden farklı bir şekilde etkileşime girmesiyle ortaya çıkar. | ||||
Tablo 1: Anne bakım davranışlarının tanımı.
4. Anne davranışı veri analizi
- Puanlama sonuçlarını bir elektronik tabloda derleyin.
- Videolar elektronik olarak analiz edildiyse, 3. adımda açıklandığı gibi 3 saniyeden kısa nöbetlere sahip davranışları silin.
- Her gözlem günü için ortalama maç uzunluğunu, ortalama sıklığı ve toplam yalama ve tımar süresini hesaplayın.
NOT: Puanlanan davranışlardan herhangi biri üzerinde tanımlayıcı istatistikler gerçekleştirilebilir, ancak yalama ve tımar etme tipik olarak LBN tarafından parçalanma açısından en belirgin bozulmayı (yani, daha kısa, daha sık nöbetler) sunacaktır. Bu değişkenler, P3-P6 arasında bir ortalama olarak veya ilgi çekiciyse, zaman içinde herhangi bir değişiklik aramak için gün içinde tekrarlanan ölçümler olarak analiz edilebilir.
5. Entropinin hesaplanması
NOT: Anne bakım davranışlarının entropisi veya öngörülemezliği, Vegetabile ve ark.23 tarafından önerilen yönteme göre hesaplanmıştır. Bu yöntem, anne bakımı davranışlarının, bir davranış dizisinin entropi oranını tahmin etmek için kullanılabilecek bir Markov zinciri gibi davrandığı varsayımına dayanmaktadır. Her barajın davranış dizisi, ampirik geçiş matrisi kullanılarak karakterize edilir ij> i,j = 1... Bir davranıştan (i) başka bir davranışa (j) geçmenin koşullu olasılıklarının 7'si ve entropi oranı bundan daha önce açıklandığı gibihesaplanır 3,23 ve aşağıdaki gibi: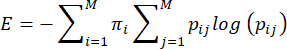
burada pij , bir dam gözlemlendikten sonra j davranışının gözlemlenmesinin koşullu olasılığıdır, πi , davranışı i'nin gözlemlenme sıklığıdır ve M (=7) farklı davranışların toplam sayısıdır. Okuyucu, denklemlerin teorik temellerinin tartışılması için Vegetabile ve ark.23'e yönlendirilir; burada odak noktası, yöntemin LBN modelinde nasıl uygulanacağıdır.
- Bunu hesaplamak için, analiz için gereken formatı düzenleyin.
- AN, LN, SN ve N-AN'ı, hepsi hemşireliği içerdiğinden, zamanları bir araya getirerek N adlı tek bir değişkende birleştirin.
NOT: Anne bakım davranışlarının tanımı için Tablo 1'e bakınız. - Kendine veya yavruya yönelik davranışlarla (M ve O) ilgili olmayan davranışları O'ya ekleyin.
- Toplam 7 davranışla sonuçlanmak için LG, E, SG, C ve NB'yi ayrı ayrı girin.
- AN, LN, SN ve N-AN'ı, hepsi hemşireliği içerdiğinden, zamanları bir araya getirerek N adlı tek bir değişkende birleştirin.
- Şu sırayı izleyen sütunlarla bir elektronik tablo oluşturun: Fare Kimliği, Çöp Kimliği, Çöp #, Tedavi, Gün, Saat, Davranış ve Durum.
- Fare kimliğinde, barajın fare çizgisini/genotipini ekleyin.
- Çöp kimliğinde, barajın tanımlayıcısını ve ardından çöp numarasını kullanın.
- Çöp #'de, barajın sahip olduğu çöp sayısını belirtin.
- Hayvanların yerleştirildiği koşullara göre tedavinin LBN veya Kontrol olduğundan emin olun.
- Günü, analiz edilen ilgili doğum sonrası gün olarak belirtin.
- Davranışın başladığı ve sona erdiği videodaki zaman damgası olarak zamanı belirtin (kaydın başlangıcına göre).
- Daha önce açıklanan yedi davranıştan (N, O, LG, E, SG, C ve NB) birini seçin (Tablo 1).
- BAŞLAT ve DURDUR olmak üzere iki tür durumu işaretleyin. Bu nedenle, her davranış iki kez görünecektir; İlk gösterim başlangıcı, ikincisi ise durağı işaretler.
- Bu formatı takiben, analiz edilen tüm günlerin bilgilerini ekleyin.
- R ortamında, yukarıdaki gibi biçimlendirilmiş veri kümelerini içeri aktarın.
- https://github.com/bvegetabile/entropyRate'da bulunan paketleri yükleyin.
NOT: Bu kodu çalıştırmak, LBN adlı bir klasöre neden olur; Koşuldan bağımsız olarak, bu klasör hesaplanan entropiyi içerir. Ek olarak, her günün entropisi daha sonra denek tarafından P3-P6 için ortalama alınabilir ve koşullar arasında karşılaştırılabilir.
Sonuçlar
Temsili sonuçlar, LBN kafeslerinde yoksul bir çevre tarafından uygulanan ELA'nın, barajlardan ve yavruların fizyolojik sonuçlarından kaynaklanan anne bakımını nasıl etkilediğini göstermektedir. Anne bakım davranışındaki günlük entropi, P3-P6 günlerinde LBN'de daha yüksektir (F1,58 = 7.21, p = 0.0094; Şekil 2A) ve bu zaman periyodundan itibaren her bir barajın ortalama entropisi (t15 = 3.03, p = 0.0085; Şekil...
Tartışmalar
Bu makale, farelerde LBN modelini uygulamak için ayrıntılı bir protokol sağlar. Bu model, erken yaşamda etolojik ve translasyonel olarak ilgili bir kronik stres biçiminin yavrularda nöropsikiyatrik bozuklukların gelişimine nasıl katkıda bulunduğunu anlamak için önemli bir araçtır13. Anne davranışını ve barajların beynindeki herhangi bir değişikliği moleküler, nöroendokrin veya devre tabanlı bir bakış açısıyla incelemek için de yararlıdır24
Açıklamalar
Yazarların herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Beyin ve Davranış Araştırma Vakfı ve John ve Polly Sparks Vakfı'ndan NIMH K99/R00 Bağımsızlığa Giden Yol Ödülü #MH120327, Whitehall Vakfı Hibe #2022-08-051 ve NARSAD Genç Araştırmacı Hibe #31308 tarafından desteklenmiştir. Yazarlar, hayvanlarımıza olağanüstü bakım sağladıkları için Georgia Eyalet Üniversitesi Hayvan Kaynakları Bölümü'ne ve video yönetim sistemimizin kurulması ve sürdürülmesindeki mükemmel teknik desteği için Ryan Sleeth'e teşekkür eder. Dr. Bolton ayrıca, doktora sonrası bursu sırasında LBN modelinin uygun şekilde uygulanması konusunda mükemmel eğitim için Dr. Tallie Z. Baram'a teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
Referanslar
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113 (2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702 (2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865 (2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. . Poverty in the United States: 2022. , 60 (2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426 (2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212 (2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736 (2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543 (2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484 (2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464 (2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600 (2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30 (2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167 (2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263 (2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49 (2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763 (2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437 (2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507 (2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655 (2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472 (2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120 (2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996 (2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161 (2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098 (2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277 (2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır