A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מצע וקינון מוגבלים כמודל למצוקות בגיל צעיר בעכברים
In This Article
Summary
פרוטוקול זה מתאר מודל של בעלי חיים לחקר האופן שבו מצוקה בגיל צעיר, הנגרמת על ידי סביבה ענייה וטיפול אימהי בלתי צפוי במהלך התקופה המוקדמת שלאחר הלידה, משפיעה על התפתחות המוח ועל הסיכון העתידי להפרעות נפשיות.
Abstract
מצוקה בגיל צעיר (ELA), כגון התעללות, הזנחה, מחסור במשאבים וסביבה ביתית בלתי צפויה, היא גורם סיכון ידוע לפיתוח הפרעות נוירופסיכיאטריות כגון דיכאון. מודלים של בעלי חיים עבור ELA שימשו לחקר ההשפעה של לחץ כרוני על התפתחות המוח, ובדרך כלל מסתמכים על מניפולציה של איכות ו / או כמות הטיפול האימהי, שכן זהו המקור העיקרי לחוויות חיים מוקדמות אצל יונקים, כולל בני אדם. כאן מסופק פרוטוקול מפורט לשימוש במודל Limited Bedding and Nesting (LBN) בעכברים. מודל זה מחקה סביבה דלת משאבים, המעוררת דפוסים מקוטעים ובלתי צפויים של טיפול אימהי במהלך חלון התפתחותי קריטי (ימים 2-9 לאחר הלידה) על ידי הגבלת כמות חומרי הקינון הניתנים לסכר לבניית קן לגורים והפרדת העכברים מהמצעים באמצעות פלטפורמת רשת בכלוב. נתונים מייצגים מסופקים כדי להמחיש את השינויים בהתנהגות האימהית, כמו גם את הירידה במשקל הגור והשינויים ארוכי הטווח ברמות הקורטיקוסטרון הבסיסי, הנובעים ממודל LBN. כבוגרים, צאצאים שגדלו בסביבת LBN הוכחו כמפגינים תגובת דחק חריגה, ליקויים קוגניטיביים והתנהגות דמוית אנהדוניה. לכן, מודל זה הוא כלי חשוב להגדיר כיצד ההבשלה של מעגלי מוח רגישים ללחץ משתנה על ידי ELA וגורמת לשינויים התנהגותיים ארוכי טווח המקנים פגיעות להפרעות נפשיות.
Introduction
התקופה המוקדמת שלאחר הלידה היא חלון התפתחותי קריטי שבו השפעות סביבתיות יכולות לשנות את מסלול ההתפתחות. לדוגמה, מצוקה בגיל צעיר (ELA) יכולה לשנות את התפתחות המוח כדי לעורר שינויים ארוכי טווח בתפקוד הקוגניטיבי והרגשי. דוגמאות של ELA כוללות התעללות פיזית או רגשית, הזנחה, משאבים לא מספיקים, וסביבה ביתית בלתי צפויה המתרחשת במהלך הילדות או ההתבגרות1. ידוע כי ELA הוא גורם סיכון להתפתחות הפרעות כגון דיכאון, הפרעת שימוש בחומרים, הפרעת דחק פוסט טראומטית (PTSD) וחרדה 2,3,4,5. זה חשוב בהתחשב בכך שרמות העוני בקרב ילדים בארה"ב יותר מהכפילו את עצמן לאחרונה, מ-5.2% ב-2021 ל-12.4% ב-20226, ולמרות שהעוני עצמו אינו בהכרח ELA, הוא כן מגדיל את ההסתברות לסוגים שונים של ELA7.
מודלים של בעלי חיים היו חיוניים זה מכבר להבנת ההשפעות של לחץ נפשי בגיל צעיר על התפתחות המוח ועל התוצאות של מבוגרים. שני המודלים העיקריים של בעלי חיים המשמשים בשנים האחרונות לניתוח התופעה הם הפרדה אימהית (MS) וסביבה ענייה הנגרמת על ידי מצע מוגבל וחומרי קינון (LBN). טרשת נפוצה פותחה כמודל של חסך הורי8. בתוכו, סכרי מכרסמים נלקחים מהגורים שלהם, בדרך כלל למספר שעות, כל יום עד לגמילה8. פרדיגמת הטרשת הנפוצה נמצאה כגורמת להתנהגויות דיכאוניות וחרדתיות בבגרות9, כמו גם לתגובה חריגה ללחץ כרוני10,11. לעומת זאת, מודל LBN, שפותח לראשונה במעבדת ברעם12, אינו מפריד את הסכר מהגורים, אלא משנה את הסביבה שבה מגדלים את הגורים, ומחקה סביבה דלת משאבים12,13. הפחתת כמות חומר הקינון ומניעת גישה ישירה למצעים בדגם זה גורמת לשיבוש הטיפול האימהי מהסכרים3. מאחר שטיפול אימהי חזק וצפוי נדרש להתפתחות תקינה של מעגלי מוח קוגניטיביים ורגשיים14, טיפול אימהי מקוטע מ-LBN יכול לגרום למגוון תוצאות, כולל ציר פעיל יתר על המידה של היפותלמוס-יותרת המוח-יותרת הכליה (HPA), שינוי איזון מעכב-עירור באזורים מרובים במוח, רמות מוגברות של הורמון משחרר קורטיקוטרופין (CRH) והתנהגות דמוית דיכאון בצאצאים13, 15,16,17,18,19.
המנגנון המדויק שבו ELA גורם לסיכון מוגבר להפרעות נוירופסיכיאטריות אינו מובן לחלוטין. הוא חשב להיות קשור לשינויים במעגלי ציר HPA19,20, וראיות אחרונות מראות כי זה עשוי להיגרם על ידי שינויים בגיזום סינפטי מיקרוגליאלי19. מודל LBN הוכח ככלי חיוני להבנת השפעת הסביבה הפרינטלית על התפתחות המוח ותוצאות התנהגותיות ארוכות טווח. למרות שמודל זה פותח בתחילה עבור חולדות, הוא הותאם גם לעכברים על מנת לנצל את הכלים הטרנסגניים הקיימים 12,13. יש לציין כי המודל דומה מאוד בשני המינים ומעורר תוצאות מתכנסות מאוד, כגון שינויים בציר HPA, ליקויים קוגניטיביים והתנהגות דמוית דיכאון, ובכך מדגיש את התועלת חוצת המינים שלו ואת הפוטנציאל התרגומי שלו. מאמר זה יספק תיאור מפורט של אופן השימוש במודל המצע והקינון המוגבל בעכברים, איסוף וניתוח התנהגות אימהית ותוצאות צאצאים כדי לאמת את יעילות המודל ואת התוצאות הצפויות.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ההליכים המערבים בעלי חיים בוצעו בהתאם למדריך המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה, ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים מאוניברסיטת מדינת ג'ורג'יה (אישור מספר A24011). העכברים גודלו והוחזקו במתקני בעלי חיים באוניברסיטת מדינת ג'ורג'יה. הניסויים בוצעו על זן C57BL/6J במהלך התקופה הפרינטלית (יום לאחר הלידה [P] 2-10) וכללו זכרים ונקבות. הריאגנטים והציוד ששימשו למחקר זה מפורטים בטבלת החומרים.
1. הגדרת חומרים
- חותכים את מחיצת הרשת בהתאם למידות הכלוב, ומשאירים עודף של 3 ס"מ בצדדים הארוכים יותר.
הערה: הרשת המסופקת בטבלת החומרים נחתכת על-ידי היצרן. - מקפלים את הקצוות, כולל העודפים, באופן שיוצר פלטפורמה המותאמת בדיוק לשולי הכלוב ובגובה ~2.5 ס"מ מעל הרצפה. זה יאפשר לשתן וצואה לעבור דרך מחיצת הרשת מבלי שהחיות יוכלו לשלוף את מצע קלחי התירס. לבסוף, ודא שכל הקצוות החדים מקופלים כלפי מטה כדי למנוע נזק לבעלי החיים.
הערה: מחיצות הרשת ניתנות לשימוש חוזר ויש לנקות אותן היטב בין השימושים עם מים חמים וסבון, ולאחר מכן ריסוס באתנול 70%. - הציבו את המצלמות על חצובות והכינו את מערכת ההקלטה.
הערה: מומלץ להשתמש בתוכנת ניהול וידאו. הקלטות אלה גורמות לקבצי .mp4 שנאגדים אוטומטית למקטעים של שעה אחת. - התאם את ההגדרות להקלטה רציפה.
הערה: הגדרות מומלצות נוספות הן רזולוציה של 1920 x 1080 ו- 30 מסגרות לשנייה. - הגדר את קבצי .mp4 המתקבלים להתחלק למקטעים של שעה אחת אם לא נעשה באופן אוטומטי על ידי תוכנת ניהול וידאו.
- אם אתה מנתח את תקופת כיבוי האורות, השתמש בתאורת אינפרא אדום.
הערה: כדי להפחית את סנוור ההקלטה בצד הכלוב, מומלץ להשבית את האינפרא-אדום (IR) מהמצלמה. במקום זאת, השתמש בזרקורים IR בחדר במהלך הקלטת שלב החשיכה.
2. פרדיגמת מצע וקינון מוגבלת (LBN)
- זוג 1-4 נקבות עם מגדל זכר יחיד.
הערה: הגיל המומלץ לזיווג הראשון בנקבות ניסוי הוא P75. שימוש בנקבות אפסיות הוא אידיאלי, אך במצבים שבהם הדבר אינו אפשרי, כגון עם קווי עכברים טרנסגניים יקרי ערך, נקבות מרובות יכולות להמשיך להתרבות במשך כארבעה חודשים לאחר מכן. מומלץ, אם כי לא חובה, לבדוק אטמים בנרתיק מדי יום כדי לאשר את יום ההזדווגות (יום עוברי [E]0).- ברגע שהסכרים נכנסים להריון, שמרו על הפרעות מינימליות.
הערה: בדרך כלל ניתן לעשות שימוש חוזר בנקבות מרובות כדי לייצר עד חמש המלטות לפני ירידה בפוריות. אם נעשה שימוש חוזר בסכרים לצורך הניסוי, יש להעדיף להשתמש בהם לאותו מצב בכל פעם או רק לעבור מבקרה ל-LBN, אך לעולם לא להיפך, על מנת למנוע השפעות ארוכות טווח של LBN על הסכר.
- ברגע שהסכרים נכנסים להריון, שמרו על הפרעות מינימליות.
- ב-E17 (או אם לא נבדקו תקעים, בכל פעם שהנקבות נראות בהריון), הפרידו את הנקבות לכלוב פרספקס סטנדרטי משלהן ותנו להן קן כותנה אחד (5X5 ס"מ) לבניית קן.
הערה: אופטימלי להעביר נקבות מופרדות לחדר שקט וקטן הרחק מחדר המושבה הראשי עם מחזור אור/חושך של 12 שעות ומינימום הפרעות מצד הצוות למערך הבקרה וה- LBN. - רשום את תאריך הלידה (בסביבות E19).
- ב-P2, ספרו וסקסו את הגורים. הקצו המלטות באופן אקראי לתנאי LBN או בקרה (אם זו ההמלטה הראשונה של הסכר). אינטראקציה זו עם הגורים צריכה להסתיים בין שעה ל -4 שעות לאחר שהאורות נדלקים.
- הכניסו את הגורים בזהירות לכלוב חדש ונקי למיון לפי מין. המרחק האנוגניטלי בין פי הטבעת לאיברי המין גדול יותר אצל זכרים מאשר אצל נקבות וניתן להשתמש בו כמזהה.
- הפרידו זכרים ונקבות לקבוצות כדי לספור אותם.
- גורים גורים עם יותר מ-8 גורים ומשליכים המלטות עם פחות מ-4. גודל ההמלטה האופטימלי הוא 4-8 גורים, מכיוון שכל דבר מחוץ לטווח זה יכול להפריע לחלוקת הטיפול האימהי במהלך המחקר.
הערה: המשתנים שיכולים להיות מושפעים עקב גודל ההמלטה הם משקל הגור, הזדמנות האכלה ואינטראקציות בין האם לגור, שעלולות לבלבל את הניסוי. באופן אידיאלי, עכברים לא יטופחו בהצלבה מכיוון שיש להם סיכוי נמוך יותר לשרוד מאשר חולדות.
- הגדר את תנאי הבקרה וה- LBN כפי שמוצג באיור 1.
- בקרה: השתמש בכלוב קופסת נעליים עכבר בגודל סטנדרטי (19.4 ס"מ x 13.0 ס"מ x 38.1 ס"מ) עם ~ 220 גרם של מצעי קלחי תירס (בהתאם למידות הכלוב, מכוון לגובה ~ 1 ס"מ) וקן כותנה מרובע סטנדרטי אחד (5 x 5 ס"מ).
- כדי לעזור לעכברים להתאקלם בסביבה לא מוכרת זו, הניחו את אחת מכדורי הצואה שלהם מהכלוב הישן בכל פינה של הכלוב החדש. בנוסף, הניחו כמות קטנה (בגודל אגורה) של קן כותנה משומש מהכלוב הקודם מעל הקן החדש.
- LBN: הניחו את מחיצת הרשת שהוכנה בעבר בכלוב קופסת נעליים סטנדרטי עם ~110 גרם מצע קלחי תירס (מכוון לגובה ~0.5 ס"מ). הרשת אמורה למנוע מגע ישיר בין העכברים למצע קלחי התירס.
- לבסוף, להוסיף חצי ריבוע כותנה nestlet (2.5 x 5 ס"מ). חזור על כל השלבים לעיל כדי לסייע בהתאקלמות.
הערה: מומלץ להחזיק כלובי קופסאות נעליים על מתלים סטנדרטיים שאינם מאווררים מכיוון שהוכח כי מערך זה שקט ואינו גורם להיפותרמיה בגורים המגודלים בכלובי LBN21. עם זאת, זה לא יכול להיות המקרה עם זרימת האוויר המוגברת בכלובים מאווררים; לכן, חוקרים צריכים למדוד את רמות הרעש ואת טמפרטורות הליבה של גורים במערכת שלהם אם הם משתמשים בכלובים מאווררים.
- לבסוף, להוסיף חצי ריבוע כותנה nestlet (2.5 x 5 ס"מ). חזור על כל השלבים לעיל כדי לסייע בהתאקלמות.
- בקרה: השתמש בכלוב קופסת נעליים עכבר בגודל סטנדרטי (19.4 ס"מ x 13.0 ס"מ x 38.1 ס"מ) עם ~ 220 גרם של מצעי קלחי תירס (בהתאם למידות הכלוב, מכוון לגובה ~ 1 ס"מ) וקן כותנה מרובע סטנדרטי אחד (5 x 5 ס"מ).
- הוסיפו את הגורים לכלוב המיועד להם והניחו אותם על גבי הקן. לאחר מכן, הניחו את הסכר בכלוב מול הגורים, מכיוון שזה יעזור לה להבחין שהם נוכחים מהר יותר. ודא כי מספיק מזון ומים כלולים לפחות 8 ימים כדי למנוע הפרעה לכלוב עד סוף הניסוי ב P10.
- הניחו מצלמה על חצובה מול הכלוב, ואפשרו מבט צדדי ברור על הסכר ועל הגורים שלו. לחלופין, מקם מראות סביב הכלוב כדי לצלם טוב יותר את כל הזוויות. למרות שיש לנתח רק שעה אחת של הקלטת וידאו ביום, המצלמה מוגדרת להקליט ברציפות 24/7 במהלך הניסוי, כך שניתן יהיה לפקח על הפרעות.
הערה: עכברים ניתן לצפות גם באופן אישי, ואת ההתנהגות האימהית ניתן להבקיע ביד, אם כי עדיף להקליט וידאו כדי למנוע הפרעות עקב נוכחותו של הנסיין בחדר. אם נעשה שימוש במתלים מאווררים, ייתכן שיהיה צורך להשתמש בהליך שונה כדי לארגן מצלמות להקלטת טיפול אימהי מזה המתואר כאן. - בבוקר P10, החזירו את כל בעלי החיים לתנאי כלוב סטנדרטיים (זהים באופן אידיאלי למצב הבקרה לעיל) ושקלו את הגורים.
- התייחסו לכל הגורים באותו אופן ונגמלו ב-P21 לקבוצות של 2-5 בני אותו מין.
הערה: השתדלו לשכן יחד צאצאים חד-מיניים במידת האפשר, אך במידת הצורך, לשכן יחד צאצאים חד-מיניים מהמלטות שונות באותו מצב. מומלץ להימנע מבקרת דיור ומצאצאי LBN יחד (ראו Yang et al. להשפעת הרכב הקגמט על פנוטיפים התנהגותיים22).

איור 1: דוגמה להגדרת כלוב. הכלוב בצד שמאל של התמונה מציג כלוב בקרה סטנדרטי (CTL) המכיל כמות מלאה של מצעים ומיקום מלא. הכלוב בצד ימין מציג מערך מצעים וקינון מוגבל (LBN) עם מחצית מכמות המצעים, חצי קינון ומחיצת רשת להפרדת בעלי החיים מהמצעים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. ניקוד התנהגות אימהית
- למרות הקלטות רציפות נאספים בהגדרה זו, לנתח רק 1 שעה מ P3 ל P6. מומלץ לנתח סרטונים שצולמו לא לפני שעה לאחר החלפת האורות כדי לאפשר התרגלות ולנתח סרטונים מזמן קבוע בכל יום.
הערה: התקופה שבין P3 ל- P6 מכילה בדרך כלל את ההבדלים הגדולים ביותר בטיפול האימהי עקב LBN; לכן, יש צורך רק לנתח בימים אלה. זמן התצפית/הקלטה המוצע מאפשר ללכוד את הפעילות לאחר המעבר מהמחזור הפעיל ללא פעיל או להיפך. עם זאת, השלב הלא פעיל הוא השלב שבו הסכר הוא בעל הסבירות הגבוהה ביותר לעסוק בטיפול אימהי, והוכח בעבר כי הוא מכיל את ההבדלים הקבוצתיים הגדולים ביותר בהתנהגות האימהית3.
הערה: צלם הקלטות P2 מאוחר יותר מאשר בימים אחרים מכיוון שעכברים זקוקים לפחות שעה אחת כדי להתרגל לשינוי הכלוב. אלא אם כן מדובר במשתנה מעניין, השליכו את היום הזה מהניתוח. - ציון כל ההתנהגויות כפי שהן מוצגות בטבלה 1. בדרך כלל, התנהגויות מקבלות ניקוד במשך 50 הדקות הראשונות לאחר תחילת זמן איסוף הנתונים.
הערה: ניתן לעשות זאת ביד או באופן אלקטרוני באמצעות התוכנה האינטראקטיבית Behavioral Observation Research (BORIS, תוכנת קוד פתוח), או סוג דומה של תוכנה. ההוראות להלן הן לניקוד ידני וניתן להתאים אותן לכל תוכנה שתבחר. - בטבלה מודפסת, רשום את ההתנהגות שנצפתה באמצעות הקיצור, שעת ההתחלה ומשך ההתקף וכל הערות תיאוריות. לדוגמה, אם הסכר יונק באופן פעיל ולאחר מכן עוזב את הקן אך הגורים עדיין מחוברים אליו, ציין זאת כ- AN, ואחריו O. תיאור הגורים (וכמה) שעדיין מחוברים צריך להישמר כפתק בצד למקרה שיהיה צורך בכך מאוחר יותר.
הערה: כל התנהגות שאורכה פחות מ-3 שניות אינה מנותחת. כלל זה מסייע לסנן התנהגויות רגעיות עקב הפרעות חיצוניות, כגון רעש סביבתי. חריגה נעשית כאשר יש הפרעה נראית לעין להתקף AN (כגון על ידי תנועה גדולה או מתיחה) המתחדשת במהירות. במקרה זה, ההתנהגות שצוינה היא AN, ואחריה N-AN, כמתואר בטבלה 1. - במקרה של התנהגויות מרובות המתרחשות בבת אחת, רשום את ההתנהגות הפעילה ביותר. דוגמה לכך היא אם הסכר הוא סיעוד נמוך אבל מאוחר יותר מתחיל ליקוק וטיפוח, הנקה נמוכה הוא ציין להפסיק, ואת ההתנהגות הבאה יש לסמן כמו LG עם הערה כי זה קרה במהלך LN.
| סוג ההתנהגות | קיצור | תיאור | ||||
| ליקוק / טיפוח | LG | הסכר עוסק בליקוק/טיפוח הגורים שלה. | ||||
| סיעוד פעיל | א | הסכר יונק את הגורים שלה בעמידה, בעוד גבה מקושת. | ||||
| סיעוד פעיל חדש | נ-אן | התנהגות זו משמשת במיוחד כאשר הסכר קטע את הסיעוד, אך מתחדש במהירות. זהו חריג לכלל 3s. | ||||
| סיעוד נמוך | ל.נ. | הסכר יונק באופן פעיל את הגורים שלה, אבל הגב שלה נמוך או כמעט שטוח. אופן פעולה זה בדרך כלל עוקב אחר AN לאחר פרק זמן מסוים. | ||||
| סיעוד צד | ס"נ | הסכר שוכב על צדה בעת הנקה (הידוע גם בשם סיעוד פסיבי). | ||||
| מחוץ לקן | O | הסכר לא נמצא על הקן, והיא לא אוכלת/שותה. ניתן לראות זאת כשהיא מסתובבת בכלוב או חוקרת. | ||||
| אכילה/שתייה | E | הסכר נמצא מחוץ לקן לאכול או לשתות. | ||||
| טיפוח עצמי | SG | הסכר מטפח את עצמה. | ||||
| נשיאת גורים | C | הסכר נושא את הגורים, בדרך כלל כדי להעביר אותם בחזרה לקן. | ||||
| בניין קן | נ.ב. | הסכר בונה או מעביר את הקן באופן פעיל. | ||||
| מעבר לקן | M | הסכר נע על הקן. זה מציג את הסכר אינטראקציה עם הגורים בצורה שונה LG או כל סוג של הנקה, כגון רחרוח, גידול, או דריכה על הגורים. | ||||
טבלה 1: תיאור התנהגויות הטיפול של האם.
4. ניתוח נתוני התנהגות אימהית
- חבר את תוצאות הניקוד לגיליון אלקטרוני.
- אם הסרטונים נותחו באופן אלקטרוני, מחק את ההתנהגויות עם התקפים קצרים מ- 3 שניות, כמתואר בשלב 3.
- חשב את אורך ההתקף הממוצע, התדירות הממוצעת ומשך הזמן הכולל של ליקוק וטיפוח עבור כל יום של תצפית.
הערה: ניתן לבצע סטטיסטיקה תיאורית על כל אחת מההתנהגויות שדורגו, אך ליקוק וטיפוח יציגו בדרך כלל את השיבוש הבולט ביותר במונחים של פיצול על ידי LBN (כלומר, התקפים קצרים ותכופים יותר). משתנים אלה יכולים להיות מנותחים כממוצע על פני P3-P6, או כמדדים חוזרים ונשנים ביום כדי לחפש שינויים לאורך זמן אם זה מעניין.
5. חישוב אנטרופיה
הערה: אנטרופיה, או בלתי צפויה, של התנהגויות טיפול אימהיות מחושבת על בסיס השיטה המוצעת על ידי Vegetabile et al.23. שיטה זו מבוססת על ההנחה שהתנהגויות הטיפול האימהי פועלות כשרשרת מרקוב, שניתן להשתמש בה כדי להעריך את שיעור האנטרופיה של רצף התנהגותי. רצף ההתנהגויות של כל סכר מאופיין באמצעות מטריצת המעבר האמפירית ij> i,j = 1... 7 של הסתברויות מותנות למעבר מהתנהגות אחת (i) להתנהגות אחרת (j), ושיעור האנטרופיה מחושב מזה כמתוארלעיל 3,23 וכדלקמן: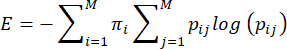
כאשר pij היא ההסתברות המותנית שהתנהגות j נצפית לאחר שנצפתה סכר מבצעת התנהגות i, πi היא התדירות שבה נצפתה התנהגות i, ו-M (=7) היא המספר הכולל של התנהגויות שונות. הקורא מופנה אל Vegetabile et al.23 לדיון ביסודות התיאורטיים של המשוואות; כאן, המוקד הוא על איך ליישם את השיטה במודל LBN.
- כדי לחשב זאת, סדר את הפורמט הדרוש לניתוח.
- שלב AN, LN, SN ו- N-AN למשתנה יחיד בשם N על ידי חיבור הזמנים יחד, מכיוון שכולם כרוכים בסיעוד.
הערה: עיין בטבלה 1 לתיאור התנהגויות הטיפול של האם. - הוסף את ההתנהגויות שאינן קשורות להתנהגויות המכוונות על ידי עצמו או גורים (M ו- O) ל- O.
- הזן LG, E, SG, C ו- NB בנפרד כדי לגרום ל- 7 התנהגויות בסך הכל.
- שלב AN, LN, SN ו- N-AN למשתנה יחיד בשם N על ידי חיבור הזמנים יחד, מכיוון שכולם כרוכים בסיעוד.
- צור גיליון אלקטרוני עם עמודות לפי סדר זה: מזהה עכבר, מזהה חול, המלטה #, טיפול, יום, שעה, התנהגות ומצב.
- במזהה העכבר, הוסף את קו העכבר / גנוטיפ של הסכר.
- במזהה המלטה, השתמש במזהה הסכר ואחריו במספר ההמלטה.
- בהמלטה #, ציין את מספר ההמלטות שהיו לסכר.
- יש לוודא כי הטיפול הוא LBN או בקרה, בהתאם לתנאים בהם הושמו בעלי החיים.
- ציין את היום כיום המתאים לאחר הלידה שניתח.
- ציין את השעה כחותמת הזמן בסרטון כאשר ההתנהגות התחילה והסתיימה (יחסית לתחילת ההקלטה).
- בחר את אופן הפעולה מתוך שבע המתוארות קודם לכן (N, O, LG, E, SG, C ו- NB) (טבלה 1).
- סמן את שני סוגי הסטטוסים, START ו- STOP. לכן, כל התנהגות תופיע פעמיים; הסימון הראשון מסמן את ההתחלה, והשני מסמן את העצירה.
- בעקבות פורמט זה, כלול את המידע של כל הימים שנותחו.
- בסביבת R, יבא את ערכות הנתונים שעוצבו כמתואר לעיל.
- התקן את החבילות הזמינות ב- https://github.com/bvegetabile/entropyRate.
הערה: הפעלת קוד זה יוצרת תיקיה בשם LBN; ללא קשר לתנאי, תיקיה זו מכילה את האנטרופיה המחושבת. בנוסף, האנטרופיה של כל יום יכולה להיות ממוצעת על ידי הנבדק עבור P3-P6 ולהשוות בין תנאים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
התוצאות המייצגות מראות כיצד ELA, שנכפה על ידי סביבה ענייה בכלובי LBN, משפיע על הטיפול האימהי מסכרים ועל התוצאות הפיזיולוגיות של הצאצאים. האנטרופיה היומית בהתנהגות הטיפול האימהי גבוהה יותר ב- LBN על פני ימים P3-P6 (F1,58 = 7.21, p = 0.0094; איור 2A), וכן האנטרופיה הממוצעת של כל סכר מת...
Access restricted. Please log in or start a trial to view this content.
Discussion
מאמר זה מספק פרוטוקול מפורט ליישום מודל LBN בעכברים. מודל זה הוא כלי חשוב להבנת האופן שבו צורה אתולוגית ותרגומית רלוונטית של לחץ כרוני בראשית החיים תורמת להתפתחות הפרעות נוירופסיכיאטריות בצאצאים13. הוא שימושי גם לחקר התנהגות אימהית וכל שינוי במוח הסכרים מנקודת מבט מולקולרית, נ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי NIMH K99/R00 Pathway to Independence Award #MH120327, מענק קרן Whitehall #2022-08-051, ומענק חוקר צעיר NARSAD #31308 מהקרן לחקר המוח וההתנהגות וקרן ג'ון ופולי ספארקס. המחברים רוצים להודות למחלקה למשאבי בעלי חיים באוניברסיטת מדינת ג'ורג'יה על מתן טיפול יוצא דופן לבעלי החיים שלנו., ולראיין סלית' על התמיכה הטכנית המצוינת שלו בהקמה ותחזוקה של מערכת ניהול הווידאו שלנו. ד"ר בולטון רוצה גם להודות לד"ר טלי ז. ברעם על הכשרה מצוינת ביישום נכון של מודל LBN במהלך הפוסט-דוקטורט שלה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
References
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113(2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702(2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865(2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. Poverty in the United States: 2022. , Washington, DC. 60(2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426(2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212(2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736(2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543(2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484(2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464(2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600(2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30(2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167(2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263(2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49(2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763(2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437(2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507(2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655(2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472(2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120(2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996(2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161(2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098(2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277(2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved