このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおける幼少期の逆境のモデルとしての限られた寝具と営巣
要約
このプロトコルは、出生後初期の貧困環境と予測不可能な母親のケアによって引き起こされる幼少期の逆境が、脳の発達と精神障害の将来のリスクにどのように影響するかを研究するための動物モデルを示しています。
要約
虐待、ネグレクト、リソースの不足、予測不可能な家庭環境などの幼少期の逆境(ELA)は、うつ病などの神経精神障害を発症する既知の危険因子です。ELAの動物モデルは、慢性的なストレスが脳の発達に及ぼす影響を研究するために使用されており、ヒトを含む哺乳類の早期の経験の主要な源泉である母親のケアの質や量を操作することに依存しているのが一般的です。ここでは、マウスにLimited Bedding and Nesting(LBN)モデルを採用するための詳細なプロトコルを提供します。このモデルは、低資源環境を模倣しており、重要な発達期間(出生後2〜9日目)に、子犬の巣を作るためにダムに与えられる巣材の量を制限し、ケージ内のメッシュプラットフォームを介してマウスを寝具から分離することにより、断片的で予測不可能な母親のケアのパターンを引き起こします。代表的なデータは、LBNモデルから生じる母親の行動の変化、子犬の体重の減少、および基礎コルチコステロンレベルの長期的な変化を示すために提供されています。LBN環境で育てられた子孫は、成人すると、異常なストレス反応、認知障害、および無快感症のような行動を示すことが示されています。したがって、このモデルは、ストレス感受性脳回路の成熟がELAによってどのように変化し、精神障害に対する脆弱性を与える長期的な行動変化をもたらすかを定義するための重要なツールです。
概要
出生後早期は、環境の影響が発達の軌道を変える可能性のある重要な発達の窓です。例えば、幼少期の逆境(ELA)は、脳の発達を変化させ、認知機能や感情機能に長期的な変化を引き起こす可能性があります。ELAの例としては、身体的または感情的な虐待、ネグレクト、不十分なリソース、および小児期または青年期に発生する予測不可能な家庭環境が含まれます1。ELAは、うつ病、物質使用障害、心的外傷後ストレス障害(PTSD)、不安などの障害を発症する危険因子であることが知られています2,3,4,5。これは、米国における子供の貧困レベルが最近、2021年の5.2%から2022年の12.4%へと2倍以上に増加していることを考えると重要です6、また、貧困自体が必ずしもELAではないものの、さまざまなタイプのELA7が発生する可能性を高めています。
動物モデルは、幼少期のストレスが脳の発達と成人の転帰に及ぼす影響を理解するために長い間不可欠でした。この現象を解剖するために近年使用されている2つの主要な動物モデルは、母性分離(MS)と、限られた寝具および営巣材料によって引き起こされる貧困環境(LBN)です。MSは、親の剥奪のモデルとして開発されました8。その中で、げっ歯類のダムは、離乳するまで毎日数時間、通常は数時間、子犬から連れ去られます。MSパラダイムは、成人期にうつ病や不安のような行動を引き起こすことがわかっています9、および慢性ストレス10,11に対する異常な反応をもたらします。一方、バラム研究所12で最初に開発されたLBNモデルは、ダムを子犬から分離するのではなく、子犬が育てられる環境を変更し、低資源環境12,13を模倣している。このモデルでは、ネスティング材の量を減らし、寝具に直接アクセスできないようにすると、ダムからの母親のケアが中断されます3。認知的および感情的な脳回路の適切な発達には、堅牢で予測可能な母親のケアが必要であるため14、LBNによる断片化された母親のケアは、視床下部-下垂体-副腎(HPA)軸の過活動、複数の脳領域における興奮性抑制性バランスのシフト、コルチコトロピン放出ホルモン(CRH)レベルの上昇、および子孫の抑うつ様行動13を含むさまざまな結果をもたらす可能性があります。15、16、17、18、19。
ELAが神経精神疾患のリスクを増加させる正確なメカニズムは完全には理解されていません。これは、HPA軸回路19,20の変化に関連していると考えられており、最近の証拠は、これがミクログリアシナプス刈り込み19の変化によって引き起こされる可能性があることを示しています。LBNモデルは、周産期環境が脳の発達と長期的な行動結果に与える影響を理解するための重要なツールであることが示されています。このモデルは当初、ラット用に開発されたが、既存のトランスジェニックツール12,13を利用するためにマウスにも適合されている。特に、このモデルは両種で非常に類似しており、HPA軸の変化、認知障害、抑うつ様行動など、非常に収束的な結果を引き起こし、その種間有用性と翻訳の可能性を強調しています。この記事では、マウスで制限付き寝床とネスティングモデルを採用し、母親の行動と子孫の結果を収集および分析して、モデルの有効性と期待される結果を検証する方法について詳しく説明します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
動物に関するすべての処置は、National Institutes of Health Guides for the Care and Use of Laboratory Animalsに準拠して実施され、ジョージア州立大学のInstitutional Animal Care and Use Committee(承認番号A24011)によって承認されました。マウスはジョージア州立大学の動物施設で飼育され、維持されました。実験は、周産期(出生後[P]2-10)にC57BL/6J株で行われ、男性と女性が含まれていました。この研究に使用した試薬と機器は、 材料表に記載されています。
1. マテリアルのセットアップ
- ケージの寸法に合わせてメッシュディバイダーをカットし、長辺に3cm余りを残します。
注意: 材料の表に記載されているメッシュは、メーカーによってカットされています。 - 余分な部分も含めて、ケージの端に正確にフィットし、床から~2.5cmの高さのプラットフォームを作るように折ります。これにより、動物がトウモロコシの穂軸の寝具を取り出すことなく、尿や糞便がメッシュの仕切りを通過することができます。最後に、動物に害が及ばないように、すべての鋭いエッジが折りたたまれていることを確認してください。
注:メッシュディバイダーは再利用可能で、使用の合間にお湯と石鹸で徹底的に洗浄し、その後70%エタノールをスプレーする必要があります。 - カメラを三脚にセットし、録画システムを準備します。
注意: ビデオ管理ソフトウェアの使用をお勧めします。これらの録音により、.mp4ファイルが自動的に 1 時間のセグメントにビン化されます。 - 設定を連続録画に調整します。
注: 追加の推奨設定は、1920 x 1080 の解像度と 30 フレーム/秒です。 - 結果の.mp4ファイルを1時間のセグメントに分割するように設定します(ビデオ管理ソフトウェアによって自動的に行われない場合)。
- 消灯期間を分析する場合は、赤外線照明を使用します。
注意: ケージの側面の録画グレアを減らすために、カメラからの赤外線(IR)を無効にすることをお勧めします。代わりに、ダークフェーズレコーディング中は部屋のIR投光器を使用してください。
2. LBN(Bedding and Nesting)パラダイムの制限
- 1〜4匹のメスとシングルハウスのオスブリーダーをペアにします。
注:実験雌の最初のペアリングの推奨年齢はP75です。未経産の雌を使用することが理想的ですが、貴重なトランスジェニックマウス系統など、これが不可能な状況では、多経産の雌はその後約4ヶ月間繁殖を続ける可能性があります。必須ではありませんが、交配日(胚の日[E]0)を確認するために、毎日膣栓をチェックすることをお勧めします。- ダムが妊娠したら、障害を最小限に抑えてください。
注:経産婦は、通常、生殖能力が低下する前に最大5匹の同腹児を生産するために再利用できます。ダムを実験に再利用する場合は、ダムに対するLBNの長期的な影響が残らないように、毎回同じ条件で優先的に使用するか、ControlからLBNにのみ切り替える必要があります。
- ダムが妊娠したら、障害を最小限に抑えてください。
- E17(またはプラグがチェックされていない場合は、メスが明らかに妊娠しているように見えるときはいつでも)、メスを自分の標準的なプレキシガラスケージに分け、巣を作るために綿の巣(5 x 5 cm)を1つ与えます。
注:分離したメスをメインコロニールームから離れた静かで小さな部屋に移動するのが最適で、12時間の明暗サイクルと、コントロールとLBNセットアップの人員からの混乱を最小限に抑えます。 - 生年月日(E19前後)を記録します。
- P2では、子犬を数えて性別を決めます。同腹児をLBNまたはコントロール条件(ダムの最初の同腹児の場合)にランダムに割り当てます。この子犬との相互作用は、ライトが点灯してから1〜4時間後に完了する必要があります。
- 子犬を新しい清潔なケージに慎重に入れて、性別ごとに分類します。肛門と性器の間の肛門性器の距離は、女性よりも男性の方が大きく、識別子として使用できます。
- 男性と女性をグループに分けて数えます。
- 8匹以上の子犬を淘汰し、4匹未満の子犬を捨てます。最適な同腹児数は4〜8匹の子犬で、この範囲外にあるものは研究中の母親のケアの分布を妨げる可能性があるためです。
注:同腹児のサイズによって影響を受ける可能性のある変数は、子犬の体重、摂食機会、および母子犬の相互作用であり、実験を混乱させる可能性があります。理想的には、マウスはラットよりも生存する可能性が低いため、クロスフォスターリングされません。
- 図 1 に示すように、制御条件と LBN 条件を設定します。
- コントロール:標準サイズのマウスシューボックスケージ(19.4 cm x 13.0 cm x 38.1 cm)と~220 gのトウモロコシの穂軸の寝具(ケージの寸法に応じて、高さ~1 cmを目指す)と標準的な正方形の綿の巣(5 x 5 cm)1つを使用します。
- マウスがこのなじみのない環境に順応するのを助けるために、古いケージからの糞便ペレットの1つを新しいケージの各コーナーに置きます。さらに、前のケージから少量の使用済み綿の巣を新しい巣の上に置きます。
- LBN:事前に準備したメッシュディバイダーを、~110 gのトウモロコシの穂軸の寝具(高さ~0.5 cmを目指す)を備えた標準の靴箱ケージに入れます。メッシュは、マウスとトウモロコシの穂軸の寝具との間の直接接触を防ぐ必要があります。
- 最後に、綿の寄り添い正方形(2.5 x 5 cm)の半分を追加します。上記のすべての手順を繰り返して、順応に役立ててください。
注:このセットアップは静かで、LBNケージ21で育てられた子犬に低体温を誘発しないことが示されているため、標準的な非換気ラックにシューボックスケージを維持することをお勧めします。ただし、換気ケージ内の空気の流れが増加すると、これは当てはまらない場合があります。したがって、研究者は、換気ケージを使用している場合は、システム内の騒音レベルとPUPコア温度を測定する必要があります。
- 最後に、綿の寄り添い正方形(2.5 x 5 cm)の半分を追加します。上記のすべての手順を繰り返して、順応に役立ててください。
- コントロール:標準サイズのマウスシューボックスケージ(19.4 cm x 13.0 cm x 38.1 cm)と~220 gのトウモロコシの穂軸の寝具(ケージの寸法に応じて、高さ~1 cmを目指す)と標準的な正方形の綿の巣(5 x 5 cm)1つを使用します。
- 子犬を指定されたケージに追加し、ネスレットの上に置きます。次に、子犬に面したケージにダムを置きます。これにより、子犬がより早く存在していることに気づくことができます。P10での実験が終了するまでケージの邪魔にならないように、少なくとも8日間は十分な餌と水が含まれていることを確認してください。
- ケージの前の三脚にカメラを置くと、ダムとその子犬の側面がはっきりと見えます。必要に応じて、ケージの周りにミラーを配置して、すべての角度をより適切にキャプチャします。1日あたり1時間のビデオ録画を分析するだけで済みますが、カメラは実験中に24時間年中無休で連続的に録画するように設定されているため、外乱を監視できます。
注:マウスは直接観察することもでき、母親の行動を手で採点することもできますが、部屋に実験者がいることによる混乱を防ぐためにビデオ録画することが望ましいです。換気ラックを使用する場合は、ここで説明するものとは異なる手順を使用して、妊産婦のケア記録用のカメラを配置する必要がある場合もあります。 - P10の朝、すべての動物を標準的なケージ条件(理想的には上記の制御条件と同一)に戻し、子犬の体重を量ります。
- すべての子犬を同じように扱い、P21で離乳して2〜5匹の同性同腹児のグループにします。
注:可能な限り同性の同腹児を一緒に収容することを目指しますが、必要に応じて、同じ状態の異なる同腹児の同性の子孫を一緒に収容します。住居制御とLBNの子孫を一緒に避けることが推奨される(行動表現型に対するケージメイト組成の影響については、Yang et al.を参照)。

図1:ケージのセットアップ例。 画像の左側のケージは、全量の寝具と全巣を含む標準制御 (CTL) ケージを示しています。右側のケージは、寝具の量が半分、巣が半分、そして動物を寝具から分離するためのメッシュ仕切りを備えた限定的な寝具と巣作り(LBN)のセットアップを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
3.母親の行動スコアリング
- この設定では連続記録が収集されますが、P3 から P6 までの 1 時間のみを分析します。照明が変わってから1時間以内に記録されたビデオを分析して、慣れを確保し、毎日一貫した時間からビデオを分析することをお勧めします。
注:P3からP6までの期間は、通常、LBNによる妊産婦ケアの最大の違いを含んでいます。したがって、最近では分析するだけで済みます。推奨される観察/記録時間により、アクティブサイクルから非アクティブサイクルに、またはその逆に移行した後のアクティビティをキャプチャできます。しかし、不活性期とは、母体が母体のケアに従事する可能性が最も高い時期であり、母体の行動において最も大きな集団差があることが以前に示されている3。
注:マウスがケージの変更に慣れるのに少なくとも1時間かかるため、P2録音は他の日よりも遅くキャプチャします。これが関心のある変数でない限り、この日を分析から破棄します。 - 表 1 に示されているすべての動作を採点します。通常、行動はデータ収集時間が開始してから最初の 50 分間にスコアリングされます。
注:これは、Behavioral Observation Research Interactive Software(BORIS、オープンソースソフトウェア)または同様のタイプのソフトウェアを使用して、手作業または電子的に行うことができます。以下の手順はハンドスコア用であり、選択したソフトウェアに適合させることができます。 - 印刷された表に、略語、試合の開始時間と期間、および説明的なメモを使用して観察された行動を記録します。たとえば、母が活発に授乳していて巣を離れるが、子犬がまだ母にくっついている場合は、これをANとし、その後にOを付けることに注意してください。まだ取り付けられている子犬の説明(および数)は、後で必要になった場合に備えて、側面にメモとして保持する必要があります。
注: 3 秒未満の動作は分析されません。このルールは、環境ノイズなどの外部の障害による瞬間的な動作を除外するのに役立ちます。ANの試合に目に見える中断(大きな動きやストレッチなど)があり、すぐに再開される場合は例外となります。この場合、 表 1 に示すように、記載されている動作は AN、その後に N-AN が続きます。 - 複数の動作が同時に発生した場合は、最もアクティブな動作を記録します。この例は、ダムの授乳が低いが、後で舐めたりグルーミングしたりし始めた場合、低哺育が停止するように通知され、次の動作はLGとしてマークされ、LN中に発生したことが通知されます。
| 行動の種類 | 略称 | 形容 | ||||
| 舐め・グルーミング | LGの | 母は彼女の子犬を舐めたり、毛づくろいをしたりしています。 | ||||
| アクティブナーシング | ひとつの | 母は立ったまま子犬を育て、背中はアーチ状になっています。 | ||||
| 新しいアクティブナーシング | N-AN(エヌアン) | この動作は、ダムが授乳を中断したが、すぐに再開する場合に特に使用されます。これは3sルールの例外です。 | ||||
| 低哺乳 | LNの | 母犬は積極的に子犬を授乳していますが、背中は低いか、ほぼ平らです。この動作は、通常、一定期間後に AN に続きます。 | ||||
| サイドナーシング | SNの | 授乳中、母は横たわっています(受動的看護とも呼ばれます)。 | ||||
| オフネスト | O | 母は巣になく、彼女は食べたり飲んだりしていません。これは、彼女がケージの周りを歩いたり、探索したりするときに観察できます。 | ||||
| 飲食 | E | ダムは巣から離れて食べたり飲んだりしています。 | ||||
| セルフグルーミング | SGの | ダムは自分自身をグルーミングしています。 | ||||
| 子犬を運ぶ | C | ダムは子犬を運び、通常は子犬を巣に戻します。 | ||||
| 巣の建物 | 備考 | ダムは巣を積極的に建設または移動しています。 | ||||
| ネストで移動 | M | ダムは巣の上を動いています。これは、LGや、匂いを嗅いだり、育てたり、子犬を踏んだりするなど、他のタイプの授乳とは異なる方法でダムが子犬と相互作用することを示しています。 | ||||
表1:母親のケア行動の説明。
4.母性行動データ分析
- スコアリング結果をスプレッドシートにまとめます。
- ビデオが電子的に分析された場合は、ステップ3で説明したように、試合が3秒未満の行動を削除します。
- 観察日ごとの平均試合時間、平均頻度、舐めとグルーミングの合計時間を計算します。
注:記述統計は、スコアリングされた行動のいずれに対しても実行できますが、舐めたりグルーミングしたりすることは、通常、LBNによる断片化(つまり、より短く、より頻繁な発作)の観点から最も明白な混乱を示します。これらの変数は、P3-P6全体の平均として分析することも、関心のある場合は時間の経過に伴う変化を探すために日ごとに繰り返される測定として分析することもできます。
5. エントロピーの計算
注:母親のケア行動のエントロピー、または予測不可能性は、Vegetabileらによって提案された方法に基づいて計算されます.23。この方法は、母親のケア行動がマルコフ連鎖として作用するという仮定に基づいており、これを使用して行動シーケンスのエントロピー率を推定できます。各ダムの一連の振る舞いは、経験的遷移行列ij> i,j = 1...ある振る舞い(i)から別の振る舞い(j)に移動する条件付き確率の7、およびエントロピー率は、これから前述のように計算され、3,23、次のように計算されます。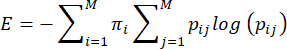
ここで、pij は、ダムが行動 i を実行していることが観察された後に、次に行動 j が観察される条件付き確率、πi は行動 i が観察される頻度、M (=7) は異なる行動の総数です。読者は、方程式の理論的基盤についての議論のためにVegetabile et al.23 を参照します。ここでは、LBNモデルでメソッドを適用する方法に焦点が当てられています。
- これを計算するには、解析に必要な形式を調整します。
- AN、LN、SN、N-AN を 1 つの変数に結合し、時間を加算して N という名前にします。これらはすべて看護に関係しているためです。
注:母親のケア行動の説明については、 表1 を参照してください。 - 自己指向行動または子犬指向行動(MおよびO)に関連しない行動をOに追加します。
- LG、E、SG、C、および NB を別々に入力すると、合計 7 つの動作が生成されます。
- AN、LN、SN、N-AN を 1 つの変数に結合し、時間を加算して N という名前にします。これらはすべて看護に関係しているためです。
- マウス ID、Litter ID、Litter #、Treatment、Day、Time、Behavior、Status の順に列を持つスプレッドシートを作成します。
- マウスIDに、ダムのマウスライン/ジェノタイプを追加します。
- [同腹児ID]には、ダムの識別子に続けて同腹児番号を使用します。
- litter #には、ダムが持っていた同腹児の数を示します。
- 動物が置かれた条件に応じて、治療がLBNまたはコントロールであることを確認してください。
- 分析された対応する出生後の日としてその日を示します。
- 動作が開始および終了したビデオのタイムスタンプとして時刻を示します (録画の開始を基準にして)。
- 前述の 7 つ (N、O、LG、E、SG、C、および NB) から動作を選択します (表 1)。
- 2 種類のステータス (START と STOP) をマークします。したがって、各動作は 2 回表示されます。最初の表記は開始を示し、2 番目の表記は停止を示します。
- この形式に従って、分析されたすべての日の情報を含めます。
- R 環境で、上記のように書式設定されたデータセットをインポートします。
- https://github.com/bvegetabile/entropyRate から入手可能なパッケージをインストールします。
注 : このコードを実行すると、LBN という名前のフォルダが作成されます。条件に関係なく、このフォルダーには計算されたエントロピーが含まれています。さらに、各日のエントロピーを被験者がP3-P6について平均化し、条件間で比較することができます。
Access restricted. Please log in or start a trial to view this content.
結果
代表的な結果は、LBNケージの劣悪な環境によって課せられたELAが、母体からの母親のケアと子孫の生理学的結果にどのように影響するかを示しています。母親のケア行動における毎日のエントロピーは、P3-P6の日間でLBNで高くなります(F1,58 = 7.21、 p = 0.0094; 図2A)、およびこの期間の各ダムの平均エントロピー(t15 = 3.03、 p = 0.0085;
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この記事では、マウスにLBNモデルを適用するための詳細なプロトコルを提供します。このモデルは、幼少期における慢性ストレスの病理学的および翻訳的に関連する形態が、子孫の神経精神障害の発症にどのように寄与するかを理解するための重要なツールである13。また、母親の行動や母親の脳の変化を分子、神経内分泌、または回路ベースの視点から研究するのにも有?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には利益相反はありません。
謝辞
この研究は、NIMH K99/R00 Pathway to Independence Award #MH120327、Whitehall Foundation Grant #2022-08-051、NARSAD Young Investigator Grant #31308 (Brain & Behavior Research FoundationおよびThe John and Polly Sparks Foundation)の支援を受けました。著者は、ジョージア州立大学の動物資源部門が動物に卓越したケアを提供してくれたこと、そしてライアン・スリースがビデオ管理システムのセットアップと保守に優れた技術サポートを提供してくれたことに感謝します。ボルトン博士はまた、タリー・Z・バラム博士がポスドクフェローシップ中にLBNモデルの適切な実装に関する優れたトレーニングを提供してくれたことに感謝したいと思います。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
参考文献
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113(2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702(2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865(2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. Poverty in the United States: 2022. , Washington, DC. 60(2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426(2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212(2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736(2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543(2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484(2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464(2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600(2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30(2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167(2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263(2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49(2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763(2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437(2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507(2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655(2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472(2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120(2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996(2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161(2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098(2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277(2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved