È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Lettiera e nidificazione limitate come modello per le avversità della prima infanzia nei topi
In questo articolo
Riepilogo
Questo protocollo descrive un modello animale per studiare come le avversità precoci della vita, provocate da un ambiente impoverito e da cure materne imprevedibili durante il primo periodo postnatale, influenzino lo sviluppo cerebrale e il rischio futuro di disturbi mentali.
Abstract
Le avversità precoci (ELA), come l'abuso, l'abbandono, la mancanza di risorse e un ambiente domestico imprevedibile, sono un noto fattore di rischio per lo sviluppo di disturbi neuropsichiatrici come la depressione. I modelli animali per l'ELA sono stati utilizzati per studiare l'impatto dello stress cronico sullo sviluppo del cervello e in genere si basano sulla manipolazione della qualità e/o della quantità delle cure materne, poiché questa è la principale fonte di esperienze di vita precoce nei mammiferi, compresi gli esseri umani. Qui, viene fornito un protocollo dettagliato per l'impiego del modello di lettiera e nidificazione limitata (LBN) nei topi. Questo modello imita un ambiente con scarse risorse, che provoca modelli frammentati e imprevedibili di cure materne durante una finestra di sviluppo critica (giorni postnatali 2-9) limitando la quantità di materiali di nidificazione dati alla madre per costruire un nido per i suoi cuccioli e separando i topi dalla lettiera tramite una piattaforma a rete nella gabbia. Vengono forniti dati rappresentativi per illustrare i cambiamenti nel comportamento materno, nonché la diminuzione del peso dei cuccioli e i cambiamenti a lungo termine nei livelli basali di corticosterone, che derivano dal modello LBN. Da adulti, è stato dimostrato che la prole allevata nell'ambiente LBN mostra una risposta aberrante allo stress, deficit cognitivi e un comportamento simile all'anedonia. Pertanto, questo modello è uno strumento importante per definire come la maturazione dei circuiti cerebrali sensibili allo stress sia alterata dall'ELA e si traduca in cambiamenti comportamentali a lungo termine che conferiscono vulnerabilità ai disturbi mentali.
Introduzione
Il primo periodo postnatale è una finestra di sviluppo critica in cui le influenze ambientali possono spostare la traiettoria dello sviluppo. Ad esempio, le avversità precoci (ELA) possono alterare lo sviluppo del cervello per provocare cambiamenti a lungo termine nella funzione cognitiva ed emotiva. Esempi di ELA includono abusi fisici o emotivi, negligenza, risorse inadeguate e un ambiente domestico imprevedibile che si verifica durante l'infanzia o l'adolescenza1. È noto che l'ELA è un fattore di rischio per lo sviluppo di disturbi come la depressione, il disturbo da uso di sostanze, il disturbo da stress post-traumatico (PTSD) e l'ansia 2,3,4,5. Questo è importante dato che i livelli di povertà infantile negli Stati Uniti sono più che raddoppiati di recente, dal 5,2% nel 2021 al 12,4% nel 20226, e sebbene la povertà in sé non sia necessariamente ELA, aumenta la probabilità di vari tipi di ELA7.
I modelli animali sono stati a lungo essenziali per comprendere gli effetti dello stress nei primi anni di vita sullo sviluppo del cervello e sugli esiti degli adulti. I due principali modelli animali utilizzati negli ultimi anni per analizzare questo fenomeno sono la separazione materna (SM) e un ambiente impoverito indotto da lettiere e materiali di nidificazione limitati (LBN). La SM è stata sviluppata come modello di deprivazione genitoriale8. In esso, le madri dei roditori vengono portate via dai loro cuccioli, di solito per diverse ore, ogni giorno fino allo svezzamento8. È stato scoperto che il paradigma della SM provoca comportamenti depressivi e ansiosi in età adulta9, nonché una risposta aberrante allo stress cronico10,11. D'altra parte, il modello LBN, sviluppato per la prima volta nel laboratorio di Baram12, non separa la madre dai cuccioli, ma piuttosto modifica l'ambiente in cui i cuccioli vengono allevati, imitando un ambiente a basse risorse12,13. La diminuzione della quantità di materiale di nidificazione e l'impedimento dell'accesso diretto alla lettiera in questo modello si traduce in un'interruzione delle cure materne da parte delle madri3. Poiché è necessaria un'assistenza materna robusta e prevedibile per il corretto sviluppo dei circuiti cerebrali cognitivi ed emotivi14, l'assistenza materna frammentata da LBN può portare a una serie di risultati, tra cui un asse ipotalamo-ipofisi-surrene (HPA) iperattivo, uno spostamento dell'equilibrio eccitatorio-inibitorio in più regioni del cervello, un aumento dei livelli dell'ormone di rilascio della corticotropina (CRH) e un comportamento simile alla depressione nella prole13, 15,16,17,18,19.
L'esatto meccanismo con cui l'ELA provoca un aumento del rischio di disturbi neuropsichiatrici non è completamente compreso. Si pensa che sia correlato ad alterazioni nel circuito dell'asse HPA 19,20, e recenti prove mostrano che ciò può essere causato da cambiamenti nella potatura sinaptica microgliale19. Il modello LBN ha dimostrato di essere uno strumento cruciale per comprendere l'impatto dell'ambiente perinatale sullo sviluppo del cervello e sui risultati comportamentali a lungo termine. Sebbene questo modello sia stato inizialmente sviluppato per i ratti, è stato adattato anche per i topi al fine di sfruttare gli strumenti transgenici esistenti12,13. In particolare, il modello è molto simile in entrambe le specie e provoca risultati altamente convergenti, come alterazioni nell'asse HPA, deficit cognitivi e comportamento depressivo, evidenziando così la sua utilità interspecie e il suo potenziale traduzionale. Questo articolo fornirà una descrizione dettagliata di come utilizzare il modello di lettiera e nidificazione limitata nei topi, raccogliendo e analizzando il comportamento materno e gli esiti della prole per convalidare l'efficacia del modello e i risultati attesi.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure che coinvolgono gli animali sono state eseguite in conformità con la Guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio e approvate dal Comitato istituzionale per la cura e l'uso degli animali della Georgia State University (numero di approvazione A24011). I topi sono stati allevati e mantenuti nelle strutture per animali della Georgia State University. Gli esperimenti sono stati eseguiti su un ceppo C57BL/6J durante il periodo perinatale (giorno postnatale [P] 2-10) e hanno incluso maschi e femmine. I reagenti e le attrezzature utilizzate per questo studio sono elencati nella Tabella dei materiali.
1. Impostazione del materiale
- Tagliare il divisorio in rete in base alle dimensioni della gabbia, lasciando un eccesso di 3 cm sui lati più lunghi.
NOTA: La rete fornita nella tabella dei materiali è tagliata dal produttore. - Piega i bordi, compreso l'eccesso, in modo da creare una piattaforma che si adatta esattamente ai bordi della gabbia e con un'altezza di ~2,5 cm dal pavimento. Ciò consentirà all'urina e alle feci di passare attraverso il divisore a rete senza che gli animali siano in grado di recuperare la lettiera della pannocchia di mais. Infine, assicurati che tutti gli spigoli vivi siano piegati verso il basso per evitare danni agli animali.
NOTA: I divisori a rete sono riutilizzabili e devono essere puliti accuratamente tra un utilizzo e l'altro con acqua calda e sapone, seguiti da una spruzzatura con etanolo al 70%. - Installa le fotocamere su treppiedi e prepara il sistema di registrazione.
NOTA: Si consiglia di utilizzare un software di gestione video. Queste registrazioni si traducono in file .mp4 che vengono automaticamente raggruppati in segmenti di 1 ora. - Regolare le impostazioni per la registrazione continua.
NOTA: Le impostazioni consigliate aggiuntive sono la risoluzione 1920 x 1080 e 30 fotogrammi/s. - Imposta i file di .mp4 risultanti in modo che vengano divisi in segmenti di 1 ora se non vengono eseguiti automaticamente dal software di gestione video.
- Se si analizza il periodo di spegnimento delle luci, utilizzare l'illuminazione a infrarossi.
NOTA: Per ridurre l'abbagliamento della registrazione sul lato della gabbia, si consiglia di disabilitare gli infrarossi (IR) dalla fotocamera. Invece, usa i proiettori IR nella stanza durante la registrazione della fase buia.
2. Paradigma di lettiera e nidificazione limitata (LBN)
- Accoppia 1-4 femmine con un riproduttore maschio alloggiato da un solo.
NOTA: L'età raccomandata per il primo accoppiamento nelle femmine sperimentali è P75. L'uso di femmine nullipare è l'ideale, ma in situazioni in cui ciò non è fattibile, come con preziose linee di topi transgenici, le femmine pluripare possono continuare a riprodursi per circa quattro mesi dopo. Si raccomanda, anche se non è obbligatorio, di controllare quotidianamente la presenza di tappi vaginali per confermare il giorno dell'accoppiamento (giorno embrionale [E]0).- Una volta che le dighe sono incinte, mantenere i disturbi minimi.
NOTA: Le femmine pluripare possono generalmente essere riutilizzate per produrre fino a cinque cucciolate prima che la fertilità diminuisca. Se le dighe vengono riutilizzate per l'esperimento, dovrebbero essere utilizzate preferibilmente per la stessa condizione ogni volta o solo per passare dal controllo al LBN, ma mai viceversa, al fine di evitare effetti residui a lungo termine del LBN sulla diga.
- Una volta che le dighe sono incinte, mantenere i disturbi minimi.
- Su E17 (o se i tappi non sono stati controllati, ogni volta che le femmine sembrano evidentemente gravide), separare le femmine nella loro gabbia di plexiglass standard e dare loro un nido di cotone (5 x 5 cm) per costruire un nido.
NOTA: È ottimale spostare le femmine separate in una stanza piccola e silenziosa, lontano dalla stanza principale della colonia, con un ciclo luce/buio di 12 ore e interruzioni minime da parte del personale per il controllo e l'impostazione LBN. - Registra la data di nascita (intorno a E19).
- A P2, conta e sessa i cuccioli. Assegna casualmente le cucciolate alle condizioni LBN o di controllo (se è la prima cucciolata della madre). Questa interazione con i cuccioli dovrebbe essere completata tra 1 e 4 ore dopo l'accensione delle luci.
- Metti con cura i cuccioli in una gabbia nuova e pulita per essere ordinati per sesso. La distanza anogenitale tra l'ano e i genitali è maggiore nei maschi che nelle femmine e può essere utilizzata come identificatore.
- Separa maschi e femmine in gruppi per contarli.
- Elimina le cucciolate con più di 8 cuccioli e scarta le cucciolate con meno di 4. La dimensione ottimale della cucciolata è di 4-8 cuccioli, poiché qualsiasi cosa al di fuori di questo intervallo può interferire con la distribuzione delle cure materne durante lo studio.
NOTA: Le variabili che possono essere influenzate a causa delle dimensioni della cucciolata sono il peso del cucciolo, l'opportunità di alimentazione e le interazioni materno-cucciolo, che potrebbero confondere l'esperimento. Idealmente, i topi non saranno allevati in modo incrociato poiché hanno meno probabilità di sopravvivere rispetto ai ratti.
- Impostare le condizioni di controllo e LBN come mostrato nella Figura 1.
- Controllo: Utilizzare una gabbia per scarpe per mouse di dimensioni standard (19,4 cm x 13,0 cm x 38,1 cm) con ~220 g di lettiera di pannocchia di mais (a seconda delle dimensioni della gabbia, puntando a ~1 cm di altezza) e un nido quadrato di cotone standard (5 x 5 cm).
- Per aiutare i topi ad acclimatarsi a questo ambiente sconosciuto, posiziona uno dei loro pellet fecali dalla loro vecchia gabbia in ogni angolo della nuova gabbia. Inoltre, posiziona una piccola quantità (delle dimensioni di una monetina) di nido di cotone usato dalla gabbia precedente sopra il nuovo nido.
- LBN: Posiziona il divisorio a rete precedentemente preparato in una gabbia standard con ~110 g di lettiera di pannocchia di mais (puntando a un'altezza di ~0,5 cm). La rete dovrebbe impedire il contatto diretto tra i topi e la lettiera della pannocchia di mais.
- Infine, aggiungere metà di un quadrato nido di cotone (2,5 x 5 cm). Ripeti tutti i passaggi precedenti per facilitare l'acclimatazione.
NOTA: Si consiglia di mantenere le gabbie delle scatole da scarpe su rastrelliere standard non ventilate perché è stato dimostrato che questa configurazione è silenziosa e non induce ipotermia nei cuccioli allevati in gabbie LBN21. Tuttavia, questo potrebbe non essere il caso dell'aumento del flusso d'aria nelle gabbie ventilate; Pertanto, i ricercatori dovrebbero misurare i livelli di rumore e le temperature interne dei cuccioli nel loro sistema se utilizzano gabbie ventilate.
- Infine, aggiungere metà di un quadrato nido di cotone (2,5 x 5 cm). Ripeti tutti i passaggi precedenti per facilitare l'acclimatazione.
- Controllo: Utilizzare una gabbia per scarpe per mouse di dimensioni standard (19,4 cm x 13,0 cm x 38,1 cm) con ~220 g di lettiera di pannocchia di mais (a seconda delle dimensioni della gabbia, puntando a ~1 cm di altezza) e un nido quadrato di cotone standard (5 x 5 cm).
- Aggiungi i cuccioli alla gabbia designata e posizionali sopra il nido. Quindi, posiziona la madre nella gabbia di fronte ai cuccioli, in quanto ciò la aiuterà a notare che sono presenti più rapidamente. Assicurarsi che siano inclusi cibo e acqua a sufficienza per almeno 8 giorni per evitare di disturbare la gabbia fino alla fine dell'esperimento a P10.
- Posiziona una fotocamera su un treppiede davanti alla gabbia, consentendo una chiara visione laterale della diga e dei suoi cuccioli. Facoltativamente, posiziona degli specchi intorno alla gabbia per catturare meglio tutti gli angoli. Sebbene sia necessario analizzare solo 1 ora di registrazione video al giorno, la telecamera è impostata per registrare continuamente 24 ore su 24, 7 giorni su 7 durante l'esperimento, in modo da poter monitorare i disturbi.
NOTA: I topi possono anche essere osservati di persona e il comportamento materno può essere valutato a mano, anche se è preferibile video-registrare per evitare interruzioni dovute alla presenza dello sperimentatore nella stanza. Se si utilizzano rack ventilati, potrebbe anche essere necessario utilizzare una procedura diversa per predisporre le telecamere per la registrazione delle cure materne rispetto a quella qui descritta. - La mattina del P10, riportare tutti gli animali nelle condizioni standard di gabbia (idealmente identiche alla condizione di controllo di cui sopra) e pesare i cuccioli.
- Tratta tutti i cuccioli allo stesso modo e svezza a P21 in gruppi di 2-5 cucciolate dello stesso sesso.
NOTA: Cerca di ospitare insieme i compagni di cucciolata dello stesso sesso quando possibile, ma se necessario, ospita insieme la prole dello stesso sesso di cucciolate diverse nella stessa condizione. Si raccomanda di evitare insieme il controllo dell'alloggiamento e la prole LBN (vedi Yang et al. per l'effetto della composizione del cagemato sui fenotipi comportamentali22).

Figura 1: Esempio di configurazione della gabbia. La gabbia sul lato sinistro dell'immagine mostra una gabbia di controllo standard (CTL) contenente una quantità completa di lettiera e un nido completo. La gabbia sul lato destro mostra una lettiera e una nidificazione limitata (LBN) con metà della quantità di lettiera, mezzo nido e un divisorio a rete per separare gli animali dalla lettiera. Clicca qui per visualizzare una versione più grande di questa figura.
3. Punteggio del comportamento materno
- Sebbene in questa configurazione vengano raccolte registrazioni continue, analizzare solo 1 ora da P3 a P6. Si consiglia di analizzare i video registrati non prima di 1 ora dopo il cambio di luce per consentire l'assuefazione e di analizzare i video da un orario costante ogni giorno.
NOTA: Il periodo da P3 a P6 contiene tipicamente le maggiori differenze nelle cure materne dovute a LBN; Pertanto, è solo necessario analizzare questi giorni. Il tempo di osservazione/registrazione suggerito consente di catturare l'attività dopo la transizione dal ciclo attivo a quello inattivo o viceversa. Tuttavia, la fase inattiva è quella in cui è più probabile che la madre si impegni nelle cure materne e in precedenza è stato dimostrato che contiene le maggiori differenze di gruppo nel comportamento materno3.
NOTA: Acquisisci le registrazioni P2 più tardi rispetto agli altri giorni perché i topi hanno bisogno di almeno 1 ora per abituarsi al cambio di gabbia. A meno che questa non sia una variabile di interesse, scartate questo giorno dall'analisi. - Assegna un punteggio a tutti i comportamenti come presentato nella Tabella 1. In genere, i comportamenti vengono valutati per i primi 50 minuti dopo l'inizio del tempo di raccolta dei dati.
NOTA: Questo può essere fatto a mano o elettronicamente utilizzando il software interattivo di ricerca sull'osservazione comportamentale (BORIS, un software open source) o un tipo di software simile. Le istruzioni riportate di seguito sono per la marcatura manuale e possono essere adattate a qualsiasi software scelto. - In una tabella stampata, registra il comportamento osservato utilizzando l'abbreviazione, l'ora di inizio e la durata dell'incontro ed eventuali note descrittive. Ad esempio, se la madre sta allattando attivamente e poi lascia il nido ma i cuccioli sono ancora attaccati a lei, annotalo come AN, seguito da O. La descrizione dei cuccioli (e quanti) ancora attaccati dovrebbe essere conservata come nota a lato nel caso in cui ciò fosse necessario in seguito.
NOTA: Qualsiasi comportamento di lunghezza inferiore a 3 s non viene analizzato. Questa regola aiuta a filtrare i comportamenti momentanei dovuti a disturbi esterni, come il rumore ambientale. Un'eccezione viene fatta quando c'è un'interruzione visibile di un incontro AN (ad esempio con un grande movimento o allungamento) che viene ripresa rapidamente. In questo caso, il comportamento notato è AN, seguito da N-AN, come descritto nella Tabella 1. - Nel caso in cui si verifichino più comportamenti contemporaneamente, registrare quello più attivo. Un esempio di ciò è se la madre sta allattando a bassa intensità ma in seguito inizia a leccare e pulire, si nota che l'allattamento basso si interrompe e il comportamento successivo dovrebbe essere contrassegnato come LG con una nota che ciò si è verificato durante la LN.
| Tipo di comportamento | Abbreviazione | Descrizione | ||||
| Leccare / Toelettatura | LG | La madre è impegnata a leccare/governare i suoi cuccioli. | ||||
| Infermieristica attiva | UN | La madre sta allattando i suoi cuccioli in piedi, mentre la sua schiena è arcuata. | ||||
| Nuova assistenza infermieristica attiva | N-AN | Questo comportamento viene utilizzato in particolare quando la madre ha interrotto l'allattamento, ma riprende rapidamente. Questa è un'eccezione alla regola dei 3. | ||||
| Bassa assistenza infermieristica | LN | La madre sta allattando attivamente i suoi cuccioli, ma la sua schiena è bassa o quasi piatta. Questo comportamento segue comunemente AN dopo un certo periodo di tempo. | ||||
| Infermieristica laterale | SN | La madre è sdraiata su un fianco durante l'allattamento (noto anche come infermieristica passiva). | ||||
| Fuori dal nido | O | La madre non è sul nido e lei non sta mangiando/bevendo. Questo può essere osservato nel suo camminare intorno alla gabbia o nell'esplorare. | ||||
| Mangiare/bere | E | La diga è fuori dal nido a mangiare o bere. | ||||
| Auto-toelettatura | SG | La madre si sta curando da sola. | ||||
| Portare cuccioli | C | La madre trasporta i cuccioli, di solito per riportarli al nido. | ||||
| Costruzione del nido | NB | La diga sta attivamente costruendo o trasferendo il nido. | ||||
| Muoviti sul nido | M | La diga si sta muovendo sul nido. Questo si presenta con la madre che interagisce con i cuccioli in un modo diverso da LG o da qualsiasi tipo di allattamento, come annusare, allevare o calpestare i cuccioli. | ||||
Tabella 1: Descrizione dei comportamenti di cura materna.
4. Analisi dei dati sul comportamento materno
- Compila i risultati del punteggio in un foglio di calcolo.
- Se i video sono stati analizzati elettronicamente, eliminare i comportamenti con attacchi inferiori a 3 s, come descritto nel passaggio 3.
- Calcola la durata media dell'attacco, la frequenza media e la durata totale del leccamento e della toelettatura per ogni giorno di osservazione.
NOTA: Statistiche descrittive possono essere eseguite su uno qualsiasi dei comportamenti segnati, ma il licking e il grooming presenteranno in genere l'interruzione più evidente in termini di frammentazione da LBN (cioè attacchi più brevi e più frequenti). Queste variabili possono essere analizzate come media tra P3 e P6 o come misure ripetute nel corso del giorno per cercare eventuali cambiamenti nel tempo, se ciò è di interesse.
5. Calcolo dell'entropia
NOTA: L'entropia, o imprevedibilità, dei comportamenti di cura materna è calcolata sulla base del metodo proposto da Vegetabile et al.23. Questo metodo si basa sul presupposto che i comportamenti di cura materna agiscano come una catena di Markov, che può essere utilizzata per stimare il tasso di entropia di una sequenza comportamentale. La sequenza di comportamenti di ogni diga è caratterizzata utilizzando la matrice di transizione empirica ij> i,j = 1... 7 di probabilità condizionali di passare da un comportamento (i) a un altro comportamento (j), e il tasso di entropia è calcolato da questo come precedentemente descritto 3,23 e come segue: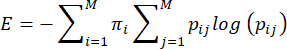
dove pij è la probabilità condizionata che il comportamento j venga osservato successivamente dopo che una diga è stata osservata mentre esegue il comportamento i, πi è la frequenza con cui il comportamento i viene osservato e M (=7) è il numero totale di comportamenti diversi. Si rimanda il lettore a Vegetabile et al.23 per una discussione delle basi teoriche delle equazioni; in questo caso, l'attenzione si concentra su come applicare il metodo nel modello LBN.
- Per calcolarlo, predisporre il formato richiesto per l'analisi.
- Combina AN, LN, SN e N-AN in un'unica variabile denominata N sommando i tempi, poiché tutti coinvolgono l'assistenza infermieristica.
NOTA: Fare riferimento alla Tabella 1 per la descrizione dei comportamenti di assistenza materna. - Aggiungi i comportamenti che non sono correlati a comportamenti autodiretti o ai cuccioli (M e O) in O.
- Inserire LG, E, SG, C e NB separatamente per ottenere 7 comportamenti totali.
- Combina AN, LN, SN e N-AN in un'unica variabile denominata N sommando i tempi, poiché tutti coinvolgono l'assistenza infermieristica.
- Crea un foglio di calcolo con le colonne che seguono questo ordine: ID topo, ID cucciolata, Cucciolata #, Trattamento, Giorno, Ora, Comportamento e Stato.
- Nell'ID del topo, aggiungere la linea del topo/genotipo della diga.
- In ID cucciolata, utilizzare l'identificatore della madre seguito dal numero della cucciolata.
- Nella cucciolata #, indicare il numero di figliate che la madre ha avuto.
- Assicurarsi che il trattamento sia LBN o di controllo, in base alle condizioni in cui sono stati posti gli animali.
- Indicare il giorno come il corrispondente giorno postnatale analizzato.
- Indicare l'ora come timestamp nel video quando il comportamento è iniziato e terminato (rispetto all'inizio della registrazione).
- Selezionare il comportamento tra i sette descritti in precedenza (N, O, LG, E, SG, C e NB) (Tabella 1).
- Contrassegnare i due tipi di stato, START e STOP. Pertanto, ogni comportamento apparirà due volte; La prima notazione segna l'inizio e la seconda segna l'interruzione.
- Seguendo questo formato, includi le informazioni di tutti i giorni analizzati.
- Nell'ambiente R importare i set di dati formattati come indicato in precedenza.
- Installare i pacchetti disponibili all'https://github.com/bvegetabile/entropyRate.
NOTA: l'esecuzione di questo codice genera una cartella denominata LBN; Indipendentemente dalla condizione, questa cartella contiene l'entropia calcolata. Inoltre, l'entropia di ogni giorno può essere mediata dal soggetto per P3-P6 e confrontata tra le condizioni.
Access restricted. Please log in or start a trial to view this content.
Risultati
I risultati rappresentativi dimostrano come l'ELA, imposta da un ambiente impoverito nelle gabbie LBN, influenzi le cure materne da parte delle madri e gli esiti fisiologici della prole. L'entropia giornaliera nel comportamento di cura materna è più alta in LBN nei giorni P3-P6 (F1,58 = 7,21, p = 0,0094; Figura 2A), così come l'entropia media di ciascuna diga di questo periodo di tempo (t15 = 3,03, p = 0,0085; Figura 2B...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo articolo fornisce un protocollo dettagliato per applicare il modello LBN nei topi. Questo modello è uno strumento importante per comprendere come una forma di stress cronico etologicamente e traslazionalmente rilevante nei primi anni di vita contribuisca allo sviluppo di disturbi neuropsichiatrici nella prole13. È anche utile per studiare il comportamento materno e qualsiasi cambiamento nel cervello delle madri da una prospettiva molecolare, neuroendocrina o circuitale24...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Questo lavoro è stato supportato dal NIMH K99/R00 Pathway to Independence Award #MH120327, dal Whitehall Foundation Grant #2022-08-051 e dal NARSAD Young Investigator Grant #31308 dalla Brain & Behavior Research Foundation e dalla John and Polly Sparks Foundation. Gli autori desiderano ringraziare la Division of Animal Resources della Georgia State University per aver fornito cure eccezionali ai nostri animali e Ryan Sleeth per il suo eccellente supporto tecnico nella configurazione e nella manutenzione del nostro sistema di gestione video. La dott.ssa Bolton desidera inoltre ringraziare la dott.ssa Tallie Z. Baram per l'eccellente formazione nella corretta implementazione del modello LBN durante la sua borsa di studio post-dottorato.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
Riferimenti
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113(2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702(2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865(2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. Poverty in the United States: 2022. , Washington, DC. 60(2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426(2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212(2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736(2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543(2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484(2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464(2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600(2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30(2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167(2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263(2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49(2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763(2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437(2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507(2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655(2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472(2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120(2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996(2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161(2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098(2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277(2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon