Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ограниченная подстилка и гнездование как модель неблагоприятных условий в раннем возрасте у мышей
В этой статье
Резюме
Этот протокол описывает животную модель для изучения того, как невзгоды в раннем возрасте, спровоцированные бедной окружающей средой и непредсказуемой материнской заботой в ранний постнатальный период, влияют на развитие мозга и будущий риск психических расстройств.
Аннотация
Неблагоприятные условия в раннем возрасте, такие как жестокое обращение, пренебрежение, нехватка ресурсов и непредсказуемая домашняя обстановка, являются известным фактором риска развития нервно-психических расстройств, таких как депрессия. Животные модели ELA использовались для изучения влияния хронического стресса на развитие мозга и, как правило, полагаются на манипулирование качеством и/или количеством материнской помощи, поскольку это основной источник опыта ранней жизни у млекопитающих, включая человека. Здесь представлен подробный протокол использования модели Limited Bedding and Nesting (LBN) на мышах. Эта модель имитирует среду с ограниченными ресурсами, которая провоцирует фрагментарные и непредсказуемые модели материнской заботы во время критического окна развития (послеродовые дни 2-9) путем ограничения количества материалов для гнездования, предоставляемых матери для строительства гнезда для ее детенышей, и отделения мышей от подстилки с помощью сетчатой платформы в клетке. Представлены репрезентативные данные, иллюстрирующие изменения в поведении матерей, а также уменьшение веса детенышей и долгосрочные изменения базальных уровней кортикостерона, которые являются результатом модели LBN. Было показано, что во взрослом возрасте потомство, выращенное в среде LBN, демонстрирует аберрантную реакцию на стресс, когнитивный дефицит и поведение, подобное ангедонии. Таким образом, эта модель является важным инструментом для определения того, как созревание чувствительных к стрессу мозговых цепей изменяется под действием ELA и приводит к долгосрочным изменениям в поведении, которые придают уязвимость к психическим расстройствам.
Введение
Ранний постнатальный период является критическим окном развития, в котором воздействие окружающей среды может изменить траекторию развития. Например, неблагоприятные обстоятельства в раннем возрасте (ЭЛА) могут изменить развитие мозга, провоцируя долгосрочные изменения в когнитивных и эмоциональных функциях. Примеры ЭЛА включают физическое или эмоциональное насилие, пренебрежение, неадекватные ресурсы и непредсказуемую домашнюю обстановку, происходящую в детстве или подростковом возрасте1. Известно, что ЭЛА является фактором риска развития таких расстройств, как депрессия, расстройство, связанное с употреблением психоактивных веществ, посттравматическое стрессовое расстройство (ПТСР) и тревога 2,3,4,5. Это важно, учитывая, что уровень детской бедности в США за последнее время вырос более чем в два раза, с 5,2% в 2021 году до 12,4% в 2022 году6, и хотя бедность сама по себе не обязательно является ELA, она действительно увеличивает вероятность различных типов ELA7.
Животные модели уже давно играют важную роль в понимании влияния стресса в раннем возрасте на развитие мозга и результаты взрослой жизни. Двумя основными животными моделями, используемыми в последние годы для анализа этого явления, являются материнское разделение (РС) и обедненная окружающая среда, вызванная ограниченным количеством подстилочных и гнездовых материалов (LBN). РС был разработан как модель родительской депривации8. В нем грызунов-самок отнимают у их детенышей, обычно на несколько часов, каждый день доотлучения от груди 8 лет. Было обнаружено, что парадигма рассеянного склероза приводит к депрессивному и тревожному поведению во взросломвозрасте, а также к аберрантной реакции на хронический стресс10,11. С другой стороны, модель LBN, впервые разработанная в лабораторииBaram 12, не отделяет самку от детенышей, а скорее модифицирует среду, в которой выращиваются детеныши, имитируя среду с низкими ресурсами12,13. Уменьшение количества гнездового материала и предотвращение прямого доступа к подстилке в этой модели приводит к нарушению материнского ухода со стороны матерей3. Поскольку для правильного развития когнитивных и эмоциональных цепей мозга требуется надежная и предсказуемая материнскаяпомощь14, фрагментарная материнская помощь со стороны LBN может привести к целому ряду исходов, включая гиперактивную гипоталамо-гипофизарно-надпочечниковую ось (HPA), смещение возбуждающе-ингибиторного баланса в нескольких областях мозга, повышение уровня кортикотропин-рилизинг-гормона (CRH) и депрессивное поведениеу потомства. 15,16,17,18,19.
Точный механизм, с помощью которого ЭЛА приводит к повышенному риску развития нервно-психических расстройств, до конца не изучен. Считается, что это связано с изменениями в схемах оси HPA19,20, и последние данные показывают, что это может быть вызвано изменениями в микроглиальном синаптическом обрезании19. Было показано, что модель LBN является важным инструментом для понимания влияния перинатальной среды на развитие мозга и долгосрочные поведенческие результаты. Хотя эта модель первоначально была разработана для крыс, она также была адаптирована для мышей, чтобы воспользоваться преимуществами существующих трансгенныхинструментов. Примечательно, что модель очень похожа у обоих видов и провоцирует очень сходящиеся результаты, такие как изменения в оси HPA, когнитивный дефицит и депрессивное поведение, тем самым подчеркивая ее межвидовую полезность и трансляционный потенциал. В этой статье будет подробно описано, как использовать модель ограниченной подстилки и гнездования у мышей, собирая и анализируя материнское поведение и исходы потомства для проверки эффективности модели и ожидаемых результатов.
протокол
Все процедуры с участием животных были выполнены в соответствии с Руководством Национального института здравоохранения по уходу и использованию лабораторных животных и одобрены Комитетом по институциональному уходу за животными и их использованию Университета штата Джорджия (номер одобрения A24011). Мышей разводили и содержали в помещениях для животных Университета штата Джорджия. Эксперименты проводились на штамме C57BL/6J в перинатальном периоде (постнатальный день [P] 2-10) и включали мужчин и женщин. Реагенты и оборудование, использованные для данного исследования, перечислены в Таблице материалов.
1. Настройка материала
- Разрежьте сетчатый разделитель в соответствии с размерами клетки, оставив лишний 3 см на более длинных сторонах.
ПРИМЕЧАНИЕ: Сетка, указанная в таблице материалов, разрезается производителем. - Загните края, включая излишки, таким образом, чтобы создать платформу, точно прилегающую к краям клетки и имеющую высоту ~2,5 см над полом. Это позволит моче и фекалиям проходить через сетчатый разделитель, при этом животные не смогут извлечь подстилку из кукурузных початков. Наконец, убедитесь, что все острые края загнуты, чтобы предотвратить причинение вреда животным.
ПРИМЕЧАНИЕ: Сетчатые разделители являются многоразовыми и должны быть тщательно очищены между использованием горячей водой с мылом с последующим распылением 70% этанола. - Установите камеры на штативы и подготовьте систему записи.
ПРИМЕЧАНИЕ: Рекомендуется использовать программное обеспечение для управления видео. В результате этих записей .mp4 файлы, которые автоматически объединяются в сегменты по 1 часу. - Настройте параметры для непрерывной записи.
ПРИМЕЧАНИЕ: Дополнительные рекомендуемые настройки: разрешение 1920 x 1080 и 30 кадров/с. - Разделите полученные .mp4 файлы на сегменты по 1 часу, если это не делается автоматически программным обеспечением для управления видео.
- Если вы анализируете период выключения света, используйте инфракрасное освещение.
ПРИМЕЧАНИЕ: Чтобы уменьшить блики при записи на боковой стороне клетки, рекомендуется отключить инфракрасное (ИК) излучение от камеры. Вместо этого используйте инфракрасные прожекторы в комнате во время записи темной фазы.
2. Парадигма ограниченной подстилки и гнездования (LBN)
- Спаривайте 1-4 самки с одноместным заводчиком-самцом.
ПРИМЕЧАНИЕ: Рекомендуемый возраст для первого спаривания у экспериментальных самок - P75. Использование нерожавших самок является идеальным, но в ситуациях, когда это невозможно, например, с ценными трансгенными линиями мышей, повторнородящие самки могут продолжать размножение в течение примерно четырех месяцев после этого. Рекомендуется, хотя и не обязательно, ежедневно проверять наличие вагинальных пробок, чтобы подтвердить день спаривания (эмбриональный день [E]0).- Как только плотины забеременеют, сведите к минимуму возмущения.
ПРИМЕЧАНИЕ: Многородящие самки, как правило, могут быть повторно использованы для производства до пяти пометов, прежде чем фертильность снизится. Если плотины используются повторно для эксперимента, их следует предпочтительно использовать для одного и того же условия каждый раз или переключать только с контрольного на LBN, но никогда наоборот, чтобы избежать любых остаточных долгосрочных эффектов LBN на плотину.
- Как только плотины забеременеют, сведите к минимуму возмущения.
- На E17 (или если пробки не были проверены, когда самки выглядят явно беременными) разделите самок в их собственную стандартную клетку из плексигласа и дайте им одно хлопчатобумажное гнездо (5 х 5 см) для постройки гнезда.
ПРИМЕЧАНИЕ: Оптимально перемещать отделенных самок в тихое, небольшое помещение вдали от основного помещения колонии с 12-часовым циклом света/темноты и минимальными помехами со стороны персонала для контроля и установки LBN. - Запишите дату рождения (около E19).
- В точке P2 посчитайте и полезуйте щенков. Случайным образом назначайте подстилки в LBN или контрольные условия (если это первая подстилка матери). Это взаимодействие со щенками должно быть завершено в период от 1 до 4 часов после включения света.
- Аккуратно поместите щенков в новую, чистую клетку, чтобы отсортировать по полу. Аногенитальное расстояние между анусом и гениталиями больше у самцов, чем у самок, и может использоваться в качестве идентификатора.
- Разделите самцов и самок на группы, чтобы сосчитать их.
- Отбраковывайте пометы с более чем 8 щенками и отбраковывайте пометы с менее чем 4 детенышами. Оптимальный размер помета – 4-8 щенков, так как все, что выходит за пределы этого диапазона, может помешать распределению материнской заботы во время исследования.
ПРИМЕЧАНИЕ: Переменные, на которые может повлиять размер помета, — это вес щенка, возможность кормления и взаимодействие матери и щенка, что может затруднить проведение эксперимента. В идеале мыши не должны подвергаться перекрестному вскармливанию, поскольку у них меньше шансов выжить, чем у крыс.
- Настройте условия Control и LBN, как показано на рисунке 1.
- Управление: Используйте клетку для обуви для мыши стандартного размера (19,4 см x 13,0 см x 38,1 см) с ~220 г подстилки из кукурузных початков (в зависимости от размеров клетки, стремясь к высоте ~1 см) и одним стандартным квадратным хлопчатобумажным гнездом (5 x 5 см).
- Чтобы помочь мышам акклиматизироваться к этой незнакомой среде, поместите по одной из их фекальных гранул из старой клетки в каждый угол новой клетки. Кроме того, поместите небольшое количество использованного хлопчатобумажного гнезда из предыдущей клетки поверх нового гнезда.
- LBN: Поместите заранее подготовленный сетчатый разделитель в стандартную клетку из-под обуви с ~110 г подстилки из кукурузных початков (стремясь к высоте ~0,5 см). Сетка должна предотвращать прямой контакт между мышами и подстилкой из кукурузных початков.
- Наконец, добавьте половину квадрата хлопчатобумажного гнезда (2,5 х 5 см). Повторите все описанные выше шаги, чтобы помочь с акклиматизацией.
ПРИМЕЧАНИЕ: Рекомендуется содержать клетки для обувных коробок на стандартных, невентилируемых стеллажах, поскольку было доказано, что такая установка бесшумна и не вызывает переохлаждения у щенков, выращенных в клеткахLBN 21. Однако это может быть не так при повышенном потоке воздуха в вентилируемых клетках; Поэтому исследователи должны измерять уровень шума и температуру ядра детенышей в своей системе, если они используют вентилируемые клетки.
- Наконец, добавьте половину квадрата хлопчатобумажного гнезда (2,5 х 5 см). Повторите все описанные выше шаги, чтобы помочь с акклиматизацией.
- Управление: Используйте клетку для обуви для мыши стандартного размера (19,4 см x 13,0 см x 38,1 см) с ~220 г подстилки из кукурузных початков (в зависимости от размеров клетки, стремясь к высоте ~1 см) и одним стандартным квадратным хлопчатобумажным гнездом (5 x 5 см).
- Посадите щенков в предназначенную для этого клетку и поместите их на вершину гнезда. Далее поместите дамбу в клетку лицом к детенышам, так как это поможет ей быстрее заметить их присутствие. Убедитесь, что в организм включено достаточное количество пищи и воды в течение как минимум 8 дней, чтобы не беспокоить клетку до конца эксперимента на уровне P10.
- Поместите камеру на штатив перед клеткой, чтобы обеспечить четкий боковой обзор плотины и ее детенышей. При необходимости разместите зеркала вокруг клетки, чтобы лучше захватить все углы. Несмотря на то, что необходимо анализировать только 1 час видеозаписи в день, камера настроена на непрерывную запись 24/7 во время эксперимента, чтобы можно было отслеживать помехи.
Примечание: За мышами также можно наблюдать лично, а поведение матери можно измерять вручную, хотя предпочтительнее видеозапись, чтобы предотвратить любые нарушения из-за присутствия экспериментатора в комнате. Если используются вентилируемые стеллажи, также может потребоваться использовать другую процедуру для установки камер для записи ухода за матерью, отличную от описанной здесь. - Утром P10 верните всех животных в стандартные условия содержания в клетке (в идеале идентичные контрольным условиям, описанным выше) и взвесьте щенков.
- Относитесь ко всем щенкам одинаково и отлучите от груди в P21 в группы по 2-5 однополых однополых однопометников.
ПРИМЕЧАНИЕ: Старайтесь по возможности размещать однополых однопометников вместе, но при необходимости размещайте однополых детей из разных пометов в одинаковых условиях. Рекомендуется избегать одновременного контроля содержания и потомства LBN (см. Yang et al. о влиянии кагематного состава на поведенческие фенотипы22).

Рисунок 1: Пример настройки каркаса. На клере в левой части изображения показана стандартная контрольная клетка (CTL), содержащая полное количество подстилки и полное гнездо. В клетке с правой стороны показана ограниченная подстилка и гнездование (LBN) с половиной количества подстилки, половиной гнезда и сетчатой перегородкой для отделения животных от подстилки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Оценка материнского поведения
- Несмотря на то, что в этой конфигурации собираются непрерывные записи, анализируйте только 1 час от P3 до P6. Рекомендуется анализировать видео, записанные не ранее, чем через 1 час после смены освещения, чтобы дать возможность привыкнуть, и анализировать видео в одно и то же время каждый день.
ПРИМЕЧАНИЕ: Период от Р3 до Р6 обычно содержит наибольшие различия в уходе за матерями из-за LBN; Поэтому стоит только проанализировать эти дни. Предлагаемое время наблюдения/регистрации позволяет фиксировать активность после перехода от активного к неактивному циклу или наоборот. Тем не менее, неактивная фаза — это когда самка с наибольшей вероятностью будет заниматься материнским уходом, и ранее было показано, что она содержит наибольшие групповые различияв поведении матерей.
ПРИМЕЧАНИЕ: Записывайте P2 позже, чем в другие дни, потому что мышам требуется не менее 1 часа, чтобы привыкнуть к смене клетки. Если эта переменная не представляет интереса, исключите этот день из анализа. - Оцените все поведения, как показано в таблице 1. Как правило, поведение оценивается в течение первых 50 минут после начала сбора данных.
ПРИМЕЧАНИЕ: Это можно сделать вручную или в электронном виде с помощью интерактивного программного обеспечения для поведенческих наблюдений (BORIS, программное обеспечение с открытым исходным кодом) или аналогичного программного обеспечения. Приведенные ниже инструкции предназначены для подсчета очков рук и могут быть адаптированы для любого выбранного программного обеспечения. - В распечатанной таблице запишите наблюдаемое поведение, используя аббревиатуру, время начала и продолжительность боя, а также любые описательные примечания. Например, если самка активно кормит грудью, а затем покидает гнездо, но к ней все еще прикреплены детеныши, обратите на это обозначение как AN, за которым следует O. Описание щенков (и их количества) следует сохранить в виде примечания сбоку на случай, если это понадобится позже.
ПРИМЕЧАНИЕ: Любое поведение длиной менее 3 секунд не анализируется. Это правило помогает отфильтровать сиюминутное поведение из-за внешних возмущений, таких как шум окружающей среды. Исключение составляют случаи, когда происходит видимое прерывание поединка с АН (например, из-за большого движения или растяжения), которое быстро возобновляется. В этом случае отмечается поведение AN, за которым следует N-AN, как описано в таблице 1. - В случае одновременного выполнения нескольких действий запишите наиболее активное из них. Примером этого может служить ситуация, когда самка плохо кормится, но позже начинает вылизывать и ухаживать за собой, отмечается, что низкий уровень кормления прекращается, и следующее поведение должно быть помечено как LG с пометкой, что это произошло во время LN.
| Тип поведения | Сокращение | Описание | ||||
| Вылизывание / груминг | ЛГ | Самка занимается вылизыванием/вылизыванием своих щенков. | ||||
| Активный уход за больными | АН | Самка кормит своих детенышей стоя, в то время как ее спина выгнута. | ||||
| Новый активный уход за больными | Н-АН | Это поведение используется в том случае, когда самка прервала кормление, но быстро возобновила его. Это исключение из правила 3s. | ||||
| Низкий уровень кормления грудью | ЛН | Самка активно выхаживает своих щенков, но спина у нее низкая или почти плоская. Такое поведение обычно следует за АН через определенный период времени. | ||||
| Уход за больными | СН | Во время кормления грудью мать лежит на боку (также известное как пассивное кормление). | ||||
| Вне гнезда | O | Самка не находится на гнезде, и она не ест/не пьет. Это можно наблюдать по тому, как она ходит по клетке или исследует. | ||||
| Еда/питье | E | Плотина находится вне гнезда, чтобы есть или пить. | ||||
| Самостоятельный уход | СГ | Мать ухаживает за собой. | ||||
| Переноска щенков | C | Самка переносит детенышей, обычно для того, чтобы переселить их обратно в гнездо. | ||||
| Строительство гнезда | Примечание | Плотина активно строит или пересаживает гнездо. | ||||
| Двигайтесь дальше гнезда | M | Плотина движется по гнезду. Это проявляется в том, что мать взаимодействует со щенками иначе, чем LG или любой другой тип кормления, например, обнюхивание, выращивание или наступание на щенков. | ||||
Таблица 1: Описание поведения по уходу за матерью.
4. Анализ данных о поведении матерей
- Сведите результаты подсчета баллов в таблицу.
- Если видео анализировались в электронном виде, удалите поведения с боями короче 3 с, как описано в шаге 3.
- Рассчитайте среднюю продолжительность схватки, среднюю частоту и общую продолжительность вылизывания и груминга для каждого дня наблюдения.
ПРИМЕЧАНИЕ: Описательная статистика может быть проведена для любого из оцененных моделей поведения, но вылизывание и груминг, как правило, представляют собой наиболее очевидное нарушение с точки зрения фрагментации LBN (т.е. более короткие и частые схватки). Эти переменные могут быть проанализированы как среднее значение по P3-P6 или как повторяющиеся измерения по дням, чтобы найти любые изменения с течением времени, если это представляет интерес.
5. Расчет энтропии
Примечание: Энтропия, или непредсказуемость, поведения матери при уходе за матерью рассчитывается на основе метода, предложенного Vegetabile et al.23. Этот метод основан на предположении, что материнское поведение действует как цепь Маркова, которая может быть использована для оценки уровня энтропии поведенческой последовательности. Последовательность поведения каждой плотины характеризуется с помощью эмпирической матрицы переходов ij> i,j = 1... 7 условных вероятностей перехода от одного поведения (i) к другому поведению (j), и из этого вычисляется коэффициент энтропии как описано ранее 3,23 и следующим образом: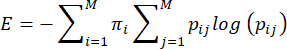
где pij — условная вероятность того, что поведение j будет наблюдаться после того, как плотина выполнит поведение i, πi — частота, с которой наблюдается поведение i, а M (=7) — общее количество различных поведений. Читатель может обратиться к Вегетабиле и др.23 для обсуждения теоретических основ уравнений; здесь основное внимание уделяется тому, как применить метод в модели LBN.
- Чтобы вычислить это, настройте формат, необходимый для анализа.
- Объедините AN, LN, SN и N-AN в одну переменную с именем N, сложив время, так как все они связаны с сестринским делом.
ПРИМЕЧАНИЕ: Обратитесь к Таблице 1 для описания поведения при оказании материнской помощи. - Добавьте в О поведения, которые не связаны с поведением, направленным на себя или щенка (М и О).
- Введите LG, E, SG, C и NB по отдельности, чтобы получить 7 вариантов поведения.
- Объедините AN, LN, SN и N-AN в одну переменную с именем N, сложив время, так как все они связаны с сестринским делом.
- Создайте таблицу со столбцами в следующем порядке: ID мыши, ID помета, Litter #, Treatment, Day, Time, Behavior и Status.
- В идентификаторе мыши добавьте линию мыши/генотип матери.
- В идентификаторе помета используйте идентификатор плотины, за которым следует номер помета.
- В помете # укажите количество пометов, которое было на плотине.
- Убедитесь, что лечение является LBN или Control, в соответствии с условиями, в которых были помещены животные.
- Укажите день как соответствующий анализируемый послеродовой день.
- Укажите время в качестве временной метки в видео, когда поведение начало и окончание (относительно начала записи).
- Выберите поведение из семи описанных ранее (N, O, LG, E, SG, C и NB) (Таблица 1).
- Отметьте два типа статусов: СТАРТ и СТОП. Следовательно, каждое поведение будет отображаться дважды; Первая нотация обозначает начало, а вторая — стоп.
- Следуя этому формату, включите информацию обо всех анализируемых днях.
- В среде R импортируйте наборы данных, которые были отформатированы как указано выше.
- Установите пакеты, доступные в https://github.com/bvegetabile/entropyRate.
ПРИМЕЧАНИЕ: Выполнение этого кода приводит к созданию папки с именем LBN; Независимо от условия, в этой папке содержится вычисленная энтропия. Кроме того, энтропия каждого дня может быть затем усреднена субъектом для P3-P6 и сравнена между условиями.
Результаты
Репрезентативные результаты демонстрируют, как ELA, вызванная бедной средой в клетках LBN, влияет на материнскую заботу со стороны матерей и физиологические исходы потомства. Суточная энтропия в поведении матери при уходе за матерью выше в LBN в дни P3-P6 (F1,58 = 7,21, p = 0,0094; ?...
Обсуждение
В этой статье представлен подробный протокол применения модели LBN на мышах. Эта модель является важным инструментом для понимания того, как этологически и трансляционно значимая форма хронического стресса в раннем возрасте способствует развитию психоневрологических расстройств
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Эта работа была поддержана премией NIMH K99/R00 Pathway to Independence Award #MH120327, грантом Фонда Уайтхолла #2022-08-051 и грантом NARSAD для молодых исследователей #31308 от Фонда исследований мозга и поведения и Фонда Джона и Полли Спаркс. Авторы хотели бы поблагодарить Отдел животных ресурсов Университета штата Джорджия за исключительную заботу о наших животных, а также Райана Слита за его отличную техническую поддержку в настройке и обслуживании нашей системы управления видео. Д-р Болтон также хотел бы поблагодарить д-ра Талли З. Барам за отличную подготовку по правильному внедрению модели LBN во время ее постдокторской стипендии.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
Ссылки
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113 (2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702 (2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865 (2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. . Poverty in the United States: 2022. , 60 (2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426 (2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212 (2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736 (2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543 (2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484 (2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464 (2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600 (2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30 (2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167 (2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263 (2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49 (2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763 (2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437 (2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507 (2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655 (2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472 (2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120 (2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996 (2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161 (2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098 (2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277 (2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены