Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Begrenztes Einstreuen und Nisten als Modell für Widrigkeiten im frühen Leben bei Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Tiermodell, um zu untersuchen, wie sich Widrigkeiten im frühen Leben, hervorgerufen durch eine verarmte Umwelt und unvorhersehbare mütterliche Fürsorge in der frühen postnatalen Phase, auf die Gehirnentwicklung und das zukünftige Risiko psychischer Störungen auswirken.
Zusammenfassung
Widrigkeiten im frühen Leben (ELA) wie Missbrauch, Vernachlässigung, Mangel an Ressourcen und ein unvorhersehbares häusliches Umfeld sind ein bekannter Risikofaktor für die Entwicklung neuropsychiatrischer Störungen wie Depressionen. Tiermodelle für ELA wurden verwendet, um die Auswirkungen von chronischem Stress auf die Gehirnentwicklung zu untersuchen, und beruhen in der Regel auf der Manipulation der Qualität und/oder Quantität der mütterlichen Versorgung, da dies die Hauptquelle für frühe Lebenserfahrungen bei Säugetieren, einschließlich des Menschen, ist. Hier wird ein detailliertes Protokoll für die Anwendung des Limited Bedding and Nesting (LBN) Modells bei Mäusen zur Verfügung gestellt. Dieses Modell ahmt eine ressourcenarme Umgebung nach, die fragmentierte und unvorhersehbare Muster der mütterlichen Fürsorge während eines kritischen Entwicklungsfensters (postnatale Tage 2-9) provoziert, indem es die Menge an Nistmaterial begrenzt, das der Muttermutter zum Bau eines Nestes für ihre Jungtiere gegeben wird, und die Mäuse über eine Netzplattform im Käfig von der Einstreu trennt. Repräsentative Daten werden zur Verfügung gestellt, um die Veränderungen im mütterlichen Verhalten sowie die verminderten Jungtiergewichte und langfristigen Veränderungen der basalen Corticosteronspiegel zu veranschaulichen, die sich aus dem LBN-Modell ergeben. Als Erwachsene hat sich gezeigt, dass Nachkommen, die in der LBN-Umgebung aufgezogen wurden, eine abweichende Stressreaktion, kognitive Defizite und anhedonieähnliches Verhalten zeigen. Daher ist dieses Modell ein wichtiges Instrument, um zu definieren, wie die Reifung stressempfindlicher Gehirnschaltkreise durch ELA verändert wird und zu langfristigen Verhaltensänderungen führt, die eine Anfälligkeit für psychische Störungen verleihen.
Einleitung
Die frühe postnatale Phase ist ein kritisches Entwicklungsfenster, in dem Umwelteinflüsse den Entwicklungsverlauf verschieben können. Zum Beispiel kann Widrigkeiten im frühen Leben (ELA) die Gehirnentwicklung verändern, um langfristige Veränderungen der kognitiven und emotionalen Funktionen hervorzurufen. Beispiele für ELA sind körperlicher oder emotionaler Missbrauch, Vernachlässigung, unzureichende Ressourcen und ein unvorhersehbares häusliches Umfeld, das in der Kindheit oder Jugend auftritt1. Es ist bekannt, dass ELA ein Risikofaktor für die Entwicklung von Störungen wie Depressionen, Substanzkonsumstörungen, posttraumatischen Belastungsstörungen (PTBS) und Angstzuständen ist 2,3,4,5. Dies ist wichtig, da sich die Kinderarmut in den USA in letzter Zeit mehr als verdoppelt hat, von 5,2 % im Jahr 2021 auf 12,4 % im Jahr 20226, und obwohl Armut an sich nicht unbedingt ELA ist, erhöht sie doch die Wahrscheinlichkeit verschiedener Arten von ELA7.
Tiermodelle sind seit langem unerlässlich, um die Auswirkungen von Stress im frühen Leben auf die Gehirnentwicklung und die Ergebnisse bei Erwachsenen zu verstehen. Die beiden wichtigsten Tiermodelle, die in den letzten Jahren verwendet wurden, um dieses Phänomen zu untersuchen, sind die mütterliche Trennung (MS) und eine verarmte Umgebung, die durch begrenztes Einstreu- und Nistmaterial (LBN) verursacht wird. MS wurde als Modell für elterliche Benachteiligung entwickelt8. Darin werden Nagetier-Muttertiere ihren Jungtieren weggenommen, in der Regel für mehrere Stunden, jeden Tag bis zur Entwöhnung8. Es wurde festgestellt, dass das MS-Paradigma zu depressiven und angstähnlichen Verhaltensweisen im Erwachsenenalter führt9 sowie zu einer abweichenden Reaktion auf chronischen Stress10,11. Auf der anderen Seite trennt das LBN-Modell, das zuerst im Baram-Labor12 entwickelt wurde, das Muttertier nicht von den Jungen, sondern modifiziert vielmehr die Umgebung, in der die Jungtiere aufgezogen werden, und ahmt eine ressourcenarme Umgebung nach12,13. Die Verringerung der Menge an Nistmaterial und die Verhinderung des direkten Zugangs zur Einstreu in diesem Modell führt zu einer Unterbrechung der mütterlichen Versorgung durch die Muttertiere3. Da eine robuste und vorhersagbare mütterliche Fürsorge für die ordnungsgemäße Entwicklung kognitiver und emotionaler Gehirnschaltkreise erforderlich ist14, kann eine fragmentierte mütterliche Fürsorge durch LBN zu einer Reihe von Ergebnissen führen, darunter eine überaktive Hypothalamus-Hypophysen-Nebennieren-Achse (HPA), ein verschobenes exzitatorisch-inhibitorisches Gleichgewicht in mehreren Hirnregionen, erhöhte Corticotropin-Releasing-Hormon (CRH)-Spiegel und depressives Verhalten bei den Nachkommen13. 15,16,17,18,19.
Der genaue Mechanismus, durch den ELA zu einem erhöhten Risiko für neuropsychiatrische Störungen führt, ist nicht vollständig verstanden. Es wird angenommen, dass es mit Veränderungen in den Schaltkreisen der HPA-Achse zusammenhängt19,20, und neuere Erkenntnisse zeigen, dass dies durch Veränderungen in der synaptischen Beschneidung der Mikroglia verursacht werden kann19. Es hat sich gezeigt, dass das LBN-Modell ein entscheidendes Instrument ist, um den Einfluss der perinatalen Umgebung auf die Gehirnentwicklung und die langfristigen Verhaltensergebnisse zu verstehen. Obwohl dieses Modell ursprünglich für Ratten entwickelt wurde, wurde es auch für Mäuse angepasst, um die Vorteile der bestehenden transgenen Werkzeuge zu nutzen 12,13. Bemerkenswert ist, dass das Modell bei beiden Spezies sehr ähnlich ist und hochgradig konvergente Ergebnisse hervorruft, wie z. B. Veränderungen in der HPA-Achse, kognitive Defizite und depressives Verhalten, was seinen speziesübergreifenden Nutzen und sein translationales Potenzial unterstreicht. In diesem Artikel wird detailliert beschrieben, wie das Modell der begrenzten Einstreu und Nistung bei Mäusen angewendet werden kann, indem das Verhalten der Mutter und die Ergebnisse der Nachkommen gesammelt und analysiert werden, um die Wirksamkeit des Modells und die erwarteten Ergebnisse zu validieren.
Protokoll
Alle Eingriffe mit Tieren wurden in Übereinstimmung mit dem National Institutes of Health Guide for the Care and Use of Laboratory Animals durchgeführt und vom Institutional Animal Care and Use Committee der Georgia State University (Zulassungsnummer A24011) genehmigt. Die Mäuse wurden in den Tierkliniken der Georgia State University gezüchtet und gehalten. Die Experimente wurden an einem C57BL/6J-Stamm während der perinatalen Periode (postnataler Tag [P] 2-10) durchgeführt und umfassten Männer und Frauen. Die für diese Studie verwendeten Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. Material-Setup
- Schneiden Sie die Netztrennwand entsprechend den Abmessungen des Käfigs zu und lassen Sie an den längeren Seiten einen Überschuss von 3 cm.
HINWEIS: Das in der Materialtabelle angegebene Netz wird vom Hersteller zugeschnitten. - Falten Sie die Kanten, einschließlich des Überschusses, so, dass eine Plattform entsteht, die genau an die Kanten des Käfigs angepasst ist und eine Höhe von ~2,5 cm über dem Boden hat. Dadurch können Urin und Kot durch die Maschentrennwand fließen, ohne dass die Tiere die Maiskolbeneinstreu zurückholen können. Stellen Sie abschließend sicher, dass alle scharfen Kanten nach unten geklappt sind, um Schäden an den Tieren zu vermeiden.
HINWEIS: Die Netztrennwände sind wiederverwendbar und sollten zwischen den Anwendungen gründlich mit heißem Wasser und Seife gereinigt und anschließend mit 70 % Ethanol besprüht werden. - Stellen Sie die Kameras auf Stative auf und bereiten Sie das Aufnahmesystem vor.
HINWEIS: Es wird empfohlen, eine Videoverwaltungssoftware zu verwenden. Diese Aufzeichnungen führen zu .mp4 Dateien, die automatisch in 1-Stunden-Segmente unterteilt werden. - Passen Sie die Einstellungen auf kontinuierliche Aufzeichnung an.
HINWEIS: Zusätzliche empfohlene Einstellungen sind eine Auflösung von 1920 x 1080 und 30 Bilder/s. - Legen Sie fest, dass die resultierenden .mp4-Dateien in 1-Stunden-Segmente unterteilt werden, wenn dies nicht automatisch von der Videoverwaltungssoftware durchgeführt wird.
- Verwenden Sie bei der Analyse der Lights-Off-Periode Infrarotbeleuchtung.
HINWEIS: Um die Blendung der Aufnahme an der Seite des Käfigs zu reduzieren, wird empfohlen, das Infrarot (IR) der Kamera zu deaktivieren. Verwenden Sie stattdessen IR-Flutlichter im Raum während der Dunkelphasenaufnahme.
2. Paradigma der begrenzten Einstreu und Verschachtelung (LBN)
- Verpaaren Sie 1-4 Hündinnen mit einem einstöckigen männlichen Züchter.
HINWEIS: Das empfohlene Alter für die erste Paarung bei Versuchsweibchen beträgt P75. Die Verwendung von nulliparen Weibchen ist ideal, aber in Situationen, in denen dies nicht möglich ist, wie z. B. bei wertvollen transgenen Mauslinien, können mehrgebärige Weibchen noch etwa vier Monate danach fortzüchten. Es wird empfohlen, obwohl nicht vorgeschrieben, täglich nach Vaginalpfropfen zu suchen, um den Tag der Paarung (Embryonaltag [E]0) zu bestätigen.- Sobald die Muttertiere trächtig sind, halten Sie die Störungen minimal.
HINWEIS: Mehrgebärende Weibchen können in der Regel wiederverwendet werden, um bis zu fünf Würfe zu zeugen, bevor die Fruchtbarkeit abnimmt. Werden die Dämme für den Versuch wiederverwendet, sollten sie bevorzugt jedes Mal für den gleichen Zustand verwendet werden oder nur von Control auf LBN umgestellt werden, niemals aber umgekehrt, um Restwirkungen von LBN auf den Damm zu vermeiden.
- Sobald die Muttertiere trächtig sind, halten Sie die Störungen minimal.
- Auf E17 (oder wenn die Stecker nicht überprüft wurden, wenn die Weibchen offensichtlich trächtig aussehen) trennen Sie die Weibchen in ihren eigenen Standard-Plexiglaskäfig und geben Sie ihnen ein Baumwollnestchen (5 x 5 cm), um ein Nest zu bauen.
HINWEIS: Es ist optimal, getrennte Weibchen in einen ruhigen, kleinen Raum abseits des Hauptraums der Kolonie zu bringen, mit einem 12-stündigen Hell-Dunkel-Zyklus und minimalen Unterbrechungen durch das Personal für die Kontroll- und LBN-Einrichtung. - Notieren Sie sich das Geburtsdatum (ca. E19).
- Bei P2 zählen Sie die Welpen und nehmen sie ein Geschlecht. Zuweisung von Würfen nach dem Zufallsprinzip zu LBN- oder Kontrollbedingungen (wenn es sich um den ersten Wurf des Damms handelt). Diese Interaktion mit den Welpen sollte zwischen 1 und 4 Stunden nach dem Einschalten der Lichter abgeschlossen sein.
- Setzen Sie die Welpen vorsichtig in einen neuen, sauberen Käfig, um sie nach Geschlecht zu sortieren. Der anogenitale Abstand zwischen Anus und Genitalien ist bei Männern größer als bei Frauen und kann als Identifikator verwendet werden.
- Trennen Sie Männchen und Weibchen in Gruppen, um sie zu zählen.
- Keulen Sie Würfe mit mehr als 8 Welpen und werfen Sie Würfe mit weniger als 4 Welpen aus. Die optimale Wurfgröße liegt bei 4-8 Jungtieren, da alles außerhalb dieses Bereichs die Verteilung der mütterlichen Versorgung während der Studie beeinträchtigen kann.
HINWEIS: Die Variablen, die aufgrund der Wurfgröße beeinflusst werden können, sind das Gewicht der Jungen, die Fütterungsmöglichkeit und die Interaktionen zwischen Mutter und Jungtier, die das Experiment verwirren könnten. Im Idealfall werden Mäuse nicht kreuzgepflegt, da sie mit geringerer Überlebenswahrscheinlichkeit überleben als Ratten.
- Richten Sie die Bedingungen "Steuerung" und "LBN" ein, wie in Abbildung 1 dargestellt.
- Kontrolle: Verwenden Sie einen Maus-Schuhkarton-Käfig in Standardgröße (19,4 cm x 13,0 cm x 38,1 cm) mit ~220 g Maiskolben-Einstreu (abhängig von den Käfigabmessungen, mit dem Ziel von ~1 cm Höhe) und einem quadratischen Standard-Nestchen aus Baumwolle (5 x 5 cm).
- Um den Mäusen zu helfen, sich an diese ungewohnte Umgebung zu gewöhnen, legen Sie eines ihrer Kotpellets aus ihrem alten Käfig in jede Ecke des neuen Käfigs. Legen Sie außerdem eine kleine (Cent-große) Menge gebrauchter Baumwolle aus dem vorherigen Käfig über das neue Nestlet.
- LBN: Legen Sie den zuvor vorbereiteten Netzteiler in einen Standard-Schuhkartonkäfig mit ~110 g Maiskolbeneinstreu (mit Ziel für ~0,5 cm Höhe). Das Netz sollte einen direkten Kontakt zwischen den Mäusen und der Maiskolbeneinstreu verhindern.
- Zum Schluss die Hälfte eines Nestlet-Quadrats aus Baumwolle (2,5 x 5 cm) hinzufügen. Wiederholen Sie alle oben genannten Schritte, um sich zu akklimatisieren.
HINWEIS: Es wird empfohlen, Schuhkartonkäfige auf standardmäßigen, nicht belüfteten Gestellen zu halten, da sich gezeigt hat, dass dieser Aufbau leise ist und bei Welpen, die in LBN-Käfigen21 aufgezogen werden, keine Unterkühlung hervorruft. Dies ist jedoch möglicherweise nicht der Fall, wenn der Luftstrom in belüfteten Käfigen erhöht wird. Daher sollten Forscher den Geräuschpegel und die PUP-Kerntemperaturen in ihrem System messen, wenn sie belüftete Käfige verwenden.
- Zum Schluss die Hälfte eines Nestlet-Quadrats aus Baumwolle (2,5 x 5 cm) hinzufügen. Wiederholen Sie alle oben genannten Schritte, um sich zu akklimatisieren.
- Kontrolle: Verwenden Sie einen Maus-Schuhkarton-Käfig in Standardgröße (19,4 cm x 13,0 cm x 38,1 cm) mit ~220 g Maiskolben-Einstreu (abhängig von den Käfigabmessungen, mit dem Ziel von ~1 cm Höhe) und einem quadratischen Standard-Nestchen aus Baumwolle (5 x 5 cm).
- Setzen Sie die Welpen in den dafür vorgesehenen Käfig und setzen Sie sie auf das Nestchen. Setze als Nächstes das Muttertier in den Käfig mit dem Gesicht zu den Welpen, da es so schneller bemerkt, dass sie da sind. Stellen Sie sicher, dass mindestens 8 Tage lang genügend Futter und Wasser enthalten sind, um eine Störung des Käfigs bis zum Ende des Versuchs bei P10 zu vermeiden.
- Platzieren Sie eine Kamera auf einem Stativ vor dem Käfig, so dass Sie eine klare Seitenansicht auf die Hündin und ihre Jungen haben. Optional können Sie Spiegel um den Käfig herum platzieren, um alle Winkel besser einzufangen. Obwohl nur 1 h Videoaufzeichnung pro Tag analysiert werden muss, ist die Kamera so eingestellt, dass sie während des Experiments 24/7 kontinuierlich aufzeichnet, so dass Störungen überwacht werden können.
HINWEIS: Mäuse können auch persönlich beobachtet werden, und das Verhalten der Mutter kann von Hand bewertet werden, obwohl es vorzuziehen ist, auf Video aufzuzeichnen, um Störungen durch die Anwesenheit des Experimentators im Raum zu vermeiden. Wenn belüftete Gestelle verwendet werden, kann es auch erforderlich sein, ein anderes Verfahren zur Anordnung von Kameras für die Aufzeichnung der Mutterpflege als das hier beschriebene zu verwenden. - Bringen Sie am Morgen von P10 alle Tiere in die Standardkäfigbedingungen zurück (idealerweise identisch mit den oben genannten Kontrollbedingungen) und wiegen Sie die Jungtiere.
- Behandeln Sie alle Welpen gleich und entwöhnen Sie sich bei P21 in Gruppen von 2-5 gleichgeschlechtlichen Wurfgeschwistern.
HINWEIS: Versuchen Sie, gleichgeschlechtliche Wurfgeschwister nach Möglichkeit zusammen unterzubringen, aber wenn nötig, halten Sie gleichgeschlechtliche Nachkommen aus verschiedenen Würfen im gleichen Zustand zusammen. Es wird empfohlen, die Haltungskontrolle und die LBN-Nachkommen zusammen zu vermeiden (siehe Yang et al. zur Wirkung der Cagemat-Zusammensetzung auf Verhaltensphänotypen22).

Abbildung 1: Beispiel für die Einrichtung eines Käfigs. Der Käfig auf der linken Seite des Bildes zeigt einen Standard-Kontrollkäfig (CTL), der eine volle Menge Einstreu und ein vollständiges Nestchen enthält. Der Käfig auf der rechten Seite zeigt eine begrenzte Einstreu- und Nisteinrichtung (LBN) mit der Hälfte der Einstreu, der Hälfte eines Nestchens und einer Netztrennwand zur Trennung der Tiere von der Einstreu. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Bewertung des mütterlichen Verhaltens
- Obwohl in diesem Setup kontinuierliche Aufzeichnungen erfasst werden, analysieren Sie nur 1 h von P3 bis P6. Es wird empfohlen, Videos zu analysieren, die frühestens 1 Stunde nach dem Wechsel der Ampel aufgenommen wurden, um eine Gewöhnung zu ermöglichen und Videos von einer konstanten Zeit pro Tag zu analysieren.
HINWEIS: Der Zeitraum von P3 bis P6 enthält in der Regel die größten Unterschiede in der mütterlichen Versorgung aufgrund von LBN; Daher ist es nur in diesen Tagen notwendig, zu analysieren. Die vorgeschlagene Beobachtungs-/Aufzeichnungszeit ermöglicht die Erfassung der Aktivität nach dem Übergang vom aktiven zum inaktiven Zyklus oder umgekehrt. Die inaktive Phase ist jedoch die Phase, in der das Muttertier am ehesten mütterliche Fürsorge in Anspruch nimmt, und es wurde bereits gezeigt, dass es die größten Gruppenunterschiede im mütterlichen Verhalten aufweist3.
HINWEIS: Erfassen Sie P2-Aufnahmen später als an anderen Tagen, da Mäuse mindestens 1 Stunde benötigen, um sich an den Käfigwechsel zu gewöhnen. Wenn es sich nicht um eine interessante Variable handelt, sollten Sie diesen Tag aus der Analyse streichen. - Bewerten Sie alle Verhaltensweisen, wie in Tabelle 1 dargestellt. In der Regel werden Verhaltensweisen in den ersten 50 Minuten nach Beginn der Datenerfassung bewertet.
HINWEIS: Dies kann von Hand oder elektronisch mit der Behavioral Observation Research Interactive Software (BORIS, einer Open-Source-Software) oder einer ähnlichen Art von Software erfolgen. Die folgenden Anweisungen gelten für die Handwertung und können für jede gewählte Software angepasst werden. - Notieren Sie in einer ausgedruckten Tabelle das beobachtete Verhalten mit der Abkürzung, der Startzeit und Dauer des Kampfes sowie allen beschreibenden Notizen. Wenn das Hündchen zum Beispiel aktiv säugt und dann das Nest verlässt, aber die Jungtiere noch an ihr hängen, notieren Sie dies als AN, gefolgt von O. Die Beschreibung der noch angehängten Welpen (und wie viele) sollte als Notiz an der Seite aufbewahrt werden, falls dies später benötigt wird.
HINWEIS: Verhaltensweisen mit einer Länge von weniger als 3 s werden nicht analysiert. Diese Regel hilft dabei, vorübergehende Verhaltensweisen herauszufiltern, die auf äußere Störungen wie Umgebungsgeräusche zurückzuführen sind. Eine Ausnahme wird gemacht, wenn es eine sichtbare Unterbrechung eines AN-Kampfes gibt (z. B. durch eine große Bewegung oder Dehnung), die schnell wieder aufgenommen wird. In diesem Fall ist das festgestellte Verhalten AN, gefolgt von N-AN, wie in Tabelle 1 beschrieben. - Falls mehrere Verhaltensweisen gleichzeitig auftreten, zeichnen Sie das aktivste auf. Ein Beispiel dafür ist, wenn das Muttertier schwach säugt, aber später mit dem Lecken und Putzen beginnt, wird festgestellt, dass das niedrige Stillen aufhört, und das nächste Verhalten sollte als LG markiert werden, mit dem Hinweis, dass dies während LN aufgetreten ist.
| Art des Verhaltens | Abkürzung | Beschreibung | ||||
| Lecken / Pflegen | LG | Die Hündin ist damit beschäftigt, ihre Jungen zu lecken/zu pflegen. | ||||
| Aktive Pflege | EIN | Die Hündin säugt ihre Jungen im Stehen, während ihr Rücken gewölbt ist. | ||||
| Neue aktive Pflege | N-AN | Dieses Verhalten wird speziell dann angewendet, wenn das Muttertier das Stillen unterbrochen hat, aber schnell wieder aufgenommen wird. Dies ist eine Ausnahme von der 3er-Regel. | ||||
| Geringe Pflege | LN | Die Hündin säugt ihre Jungen aktiv, aber ihr Rücken ist niedrig oder fast flach. Dieses Verhalten tritt in der Regel nach einer gewissen Zeit auf AN auf. | ||||
| Seitliche Pflege | SN | Die Hündin liegt beim Säugen auf der Seite (auch passives Stillen genannt). | ||||
| Aus dem Nest | O | Die Hündin ist nicht auf dem Nest und sie frisst/trinkt nicht. Dies kann man daran beobachten, dass sie um den Käfig herumläuft oder auf Erkundungstour geht. | ||||
| Essen/Trinken | E | Der Damm ist vom Nest weg und frisst oder trinkt. | ||||
| Selbstpflege | SG | Die Mutter putzt sich selbst. | ||||
| Welpen tragen | C | Das Muttertier trägt die Jungen, in der Regel, um sie zurück ins Nest zu bringen. | ||||
| Nestbau | NB | Der Damm baut oder verlegt das Nest. | ||||
| Auf Nest verschieben | M | Der Damm bewegt sich auf dem Nest. Dies zeigt sich darin, dass das Muttertier mit den Welpen auf eine andere Weise interagiert als LG oder jede Art des Säugens, wie z. B. Schnüffeln, Aufziehen oder Treten auf die Jungen. | ||||
Tabelle 1: Beschreibung des Betreuungsverhaltens von Müttern.
4. Analyse von Daten zum mütterlichen Verhalten
- Stellen Sie die Bewertungsergebnisse in einer Tabelle zusammen.
- Wenn die Videos elektronisch analysiert wurden, löschen Sie die Verhaltensweisen mit Anfällen, die kürzer als 3 s sind, wie in Schritt 3 beschrieben.
- Berechnen Sie die durchschnittliche Kampflänge, die durchschnittliche Häufigkeit und die Gesamtdauer des Leckens und Putzens für jeden Beobachtungstag.
HINWEIS: Deskriptive Statistiken können für jedes der bewerteten Verhaltensweisen durchgeführt werden, aber Lecken und Putzen stellen in der Regel die offensichtlichste Störung in Bezug auf die Fragmentierung nach LBN dar (d. h. kürzere, häufigere Kämpfe). Diese Variablen können als Durchschnitt über P3-P6 oder als wiederholte Messungen pro Tag analysiert werden, um nach Veränderungen im Laufe der Zeit zu suchen, wenn dies von Interesse ist.
5. Berechnung der Entropie
HINWEIS: Die Entropie oder Unvorhersehbarkeit des mütterlichen Betreuungsverhaltens wird auf der Grundlage der von Vegetabile et al.23 vorgeschlagenen Methode berechnet. Diese Methode basiert auf der Annahme, dass das mütterliche Pflegeverhalten als Markov-Kette wirkt, mit der die Entropierate einer Verhaltenssequenz abgeschätzt werden kann. Die Abfolge der Verhaltensweisen jedes Mutters wird mit Hilfe der empirischen Übergangsmatrix charakterisiert ij> i,j = 1... 7 der bedingten Wahrscheinlichkeiten des Übergangs von einem Verhalten (i) zu einem anderen Verhalten (j), und die Entropierate wird daraus wie zuvor beschriebenberechnet 3,23 und wie folgt: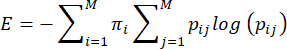
Dabei ist pij die bedingte Wahrscheinlichkeit, dass das Verhalten J als nächstes beobachtet wird, nachdem ein DAM beobachtet wurde, der das Verhalten i ausführt, πi die Häufigkeit ist, mit der das Verhalten i beobachtet wird, und M (=7) die Gesamtzahl der verschiedenen Verhaltensweisen ist. Der Leser wird auf Vegetabile et al.23 verwiesen, um die theoretischen Grundlagen der Gleichungen zu erörtern; Hier liegt der Fokus auf der Anwendung der Methode im LBN-Modell.
- Um dies zu berechnen, ordnen Sie das für die Analyse erforderliche Format an.
- Kombinieren Sie AN, LN, SN und N-AN in einer einzigen Variablen mit dem Namen N, indem Sie die Zeiten addieren, da sie alle Pflege beinhalten.
HINWEIS: In Tabelle 1 finden Sie eine Beschreibung des Betreuungsverhaltens von Müttern. - Fügen Sie die Verhaltensweisen, die nicht mit selbst- oder welpengesteuerten Verhaltensweisen (M und O) zusammenhängen, zu O hinzu.
- Geben Sie LG, E, SG, C und NB separat ein, um insgesamt 7 Verhalten zu erhalten.
- Kombinieren Sie AN, LN, SN und N-AN in einer einzigen Variablen mit dem Namen N, indem Sie die Zeiten addieren, da sie alle Pflege beinhalten.
- Erstellen Sie eine Tabelle mit Spalten in der folgenden Reihenfolge: Maus-ID, Wurf-ID, Wurf #, Behandlung, Tag, Uhrzeit, Verhalten und Status.
- Fügen Sie in der Maus-ID die Mauslinie/den Genotyp der Mutter hinzu.
- Verwenden Sie in der Wurf-ID die Kennung des Muttertiers, gefolgt von der Wurfnummer.
- Geben Sie in Wurf # die Anzahl der Würfe an, die der Damm hatte.
- Stellen Sie sicher, dass die Behandlung LBN oder Kontrolle ist, je nach den Bedingungen, unter denen die Tiere untergebracht wurden.
- Geben Sie den Tag als entsprechenden postnatalen Tag an, der analysiert wurde.
- Geben Sie die Zeit als Zeitstempel im Video an, wann das Verhalten gestartet und beendet wurde (relativ zum Beginn der Aufzeichnung).
- Wählen Sie das Verhalten aus den sieben zuvor beschriebenen Verhalten (N, O, LG, E, SG, C und NB) aus (Tabelle 1).
- Markieren Sie die beiden Statustypen START und STOP. Daher wird jedes Verhalten zweimal angezeigt. Die erste Notation markiert den Start, die zweite den Stopp.
- Fügen Sie diesem Format folgend die Informationen aller analysierten Tage hinzu.
- Importieren Sie in der R-Umgebung die Datasets, die wie oben formatiert wurden.
- Installieren Sie die Pakete, die unter https://github.com/bvegetabile/entropyRate verfügbar sind.
HINWEIS: Das Ausführen dieses Codes führt zu einem Ordner mit dem Namen LBN. Unabhängig von der Bedingung enthält dieser Ordner die berechnete Entropie. Zusätzlich kann die Entropie jedes Tages dann vom Probanden für P3-P6 gemittelt und zwischen den Bedingungen verglichen werden.
Ergebnisse
Die repräsentativen Ergebnisse zeigen, wie ELA, die durch eine verarmte Umgebung in LBN-Käfigen auferlegt wird, die mütterliche Fürsorge von Muttertieren und die physiologischen Ergebnisse der Nachkommen beeinflusst. Die tägliche Entropie im mütterlichen Betreuungsverhalten ist in LBN über die Tage P3-P6 höher (F1,58 = 7,21, p = 0,0094; Abbildung 2A) sowie die durchschnittliche Entropie jedes Damms aus diesem Zeitraum (t15 = 3,03, p = 0,0085; <...
Diskussion
Dieser Artikel enthält ein detailliertes Protokoll zur Anwendung des LBN-Modells bei Mäusen. Dieses Modell ist ein wichtiges Instrument, um zu verstehen, wie eine ethologisch und translational relevante Form von chronischem Stress im frühen Leben zur Entwicklung neuropsychiatrischer Störungen bei den Nachkommen beiträgt13. Es ist auch nützlich, um das Verhalten von Müttern und Veränderungen im Gehirn der Muttertiere aus molekularer, neuroendokriner oder schaltkreisbasierter Perspektive zu ...
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde unterstützt durch den NIMH K99/R00 Pathway to Independence Award #MH120327, den Whitehall Foundation Grant #2022-08-051 und den NARSAD Young Investigator Grant #31308 der Brain & Behavior Research Foundation und der John and Polly Sparks Foundation. Die Autoren danken der Abteilung für Tierressourcen an der Georgia State University für die außergewöhnliche Pflege unserer Tiere und Ryan Sleeth für seine hervorragende technische Unterstützung bei der Einrichtung und Wartung unseres Videomanagementsystems. Dr. Bolton möchte sich auch bei Dr. Tallie Z. Baram für die hervorragende Ausbildung in der korrekten Umsetzung des LBN-Modells während ihres Postdoc-Stipendiums bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
Referenzen
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113 (2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702 (2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865 (2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. . Poverty in the United States: 2022. , 60 (2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426 (2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212 (2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736 (2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543 (2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484 (2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464 (2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600 (2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30 (2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167 (2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263 (2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49 (2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763 (2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437 (2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507 (2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655 (2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472 (2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120 (2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996 (2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161 (2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098 (2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277 (2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten