É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cama e nidificação limitadas como modelo para adversidades no início da vida em camundongos
Neste Artigo
Resumo
Este protocolo descreve um modelo animal para estudar como a adversidade no início da vida, provocada por um ambiente empobrecido e cuidados maternos imprevisíveis durante o período pós-natal precoce, afeta o desenvolvimento do cérebro e o risco futuro de transtornos mentais.
Resumo
A adversidade no início da vida (ELA), como abuso, negligência, falta de recursos e um ambiente doméstico imprevisível, é um fator de risco conhecido para o desenvolvimento de distúrbios neuropsiquiátricos, como a depressão. Modelos animais para ELA têm sido usados para estudar o impacto do estresse crônico no desenvolvimento do cérebro e normalmente dependem da manipulação da qualidade e/ou quantidade de cuidados maternos, pois esta é a principal fonte de experiências no início da vida em mamíferos, incluindo humanos. Aqui, é fornecido um protocolo detalhado para empregar o modelo Limited Bedding and Nesting (LBN) em camundongos. Este modelo imita um ambiente de poucos recursos, que provoca padrões fragmentados e imprevisíveis de cuidados maternos durante uma janela crítica de desenvolvimento (dias pós-natais 2-9), limitando a quantidade de materiais de nidificação dados à mãe para construir um ninho para seus filhotes e separando os ratos da cama por meio de uma plataforma de malha na gaiola. Dados representativos são fornecidos para ilustrar as mudanças no comportamento materno, bem como a diminuição do peso dos filhotes e as mudanças de longo prazo nos níveis basais de corticosterona, que resultam do modelo LBN. Quando adultos, os filhotes criados no ambiente LBN demonstraram exibir uma resposta aberrante ao estresse, déficits cognitivos e comportamento semelhante à anedonia. Portanto, este modelo é uma ferramenta importante para definir como a maturação dos circuitos cerebrais sensíveis ao estresse é alterada pela ELA e resulta em mudanças comportamentais de longo prazo que conferem vulnerabilidade aos transtornos mentais.
Introdução
O período pós-natal precoce é uma janela crítica de desenvolvimento na qual as influências ambientais podem mudar a trajetória do desenvolvimento. Por exemplo, a adversidade no início da vida (ELA) pode alterar o desenvolvimento do cérebro para provocar mudanças de longo prazo na função cognitiva e emocional. Exemplos de ELA incluem abuso físico ou emocional, negligência, recursos inadequados e um ambiente doméstico imprevisível que ocorre durante a infância ou adolescência1. Sabe-se que a ELA é um fator de risco para o desenvolvimento de transtornos como depressão, transtorno por uso de substâncias, transtorno de estresse pós-traumático (TEPT) e ansiedade 2,3,4,5. Isso é importante, uma vez que os níveis de pobreza infantil nos EUA mais que dobraram recentemente, de 5,2% em 2021 para 12,4% em 20226 e, embora a pobreza em si não seja necessariamente ELA, aumenta a probabilidade de vários tipos de ELA7.
Os modelos animais têm sido essenciais para entender os efeitos do estresse no início da vida no desenvolvimento do cérebro e nos resultados adultos. Os dois principais modelos animais usados nos últimos anos para dissecar esse fenômeno são a separação materna (EM) e um ambiente empobrecido induzido por materiais de cama e nidificação limitados (LBN). A SM foi desenvolvida como um modelo de privação parental8. Nele, as mães de roedores são retiradas de seus filhotes, geralmente por várias horas, todos os dias até o desmame8. Descobriu-se que o paradigma da EM resulta em comportamentos depressivos e semelhantes à ansiedade na idade adulta9, bem como uma resposta aberrante ao estresse crônico10,11. Por outro lado, o modelo LBN, desenvolvido pela primeira vez no laboratório de Baram12, não separa a mãe dos filhotes, mas modifica o ambiente em que os filhotes são criados, mimetizando um ambiente de poucos recursos12,13. Diminuir a quantidade de material de nidificação e impedir o acesso direto à cama neste modelo resulta em cuidados maternos interrompidos pelas mães3. Uma vez que cuidados maternos robustos e previsíveis são necessários para o desenvolvimento adequado dos circuitos cerebrais cognitivos e emocionais14, o cuidado materno fragmentado da LBN pode resultar em uma série de resultados, incluindo um eixo hipotálamo-hipófise-adrenal (HPA) hiperativo, equilíbrio excitatório-inibitório alterado em várias regiões do cérebro, aumento dos níveis de hormônio liberador de corticotropina (CRH) e comportamento depressivo na prole13, 15,16,17,18,19.
O mecanismo exato pelo qual a ELA resulta em aumento do risco de distúrbios neuropsiquiátricos não é completamente compreendido. Acredita-se que esteja relacionado a alterações no circuito do eixo HPA19,20, e evidências recentes mostram que isso pode ser causado por alterações na poda sináptica microglial19. O modelo LBN demonstrou ser uma ferramenta crucial para entender o impacto do ambiente perinatal no desenvolvimento do cérebro e nos resultados comportamentais de longo prazo. Embora esse modelo tenha sido inicialmente desenvolvido para ratos, ele também foi adaptado para camundongos, a fim de aproveitar as ferramentas transgênicas existentes 12,13. Notavelmente, o modelo é muito semelhante em ambas as espécies e provoca resultados altamente convergentes, como alterações no eixo HPA, déficits cognitivos e comportamento depressivo, destacando assim sua utilidade entre espécies e potencial translacional. Este artigo fornecerá uma descrição detalhada de como empregar o modelo limitado de cama e nidificação em camundongos, coletando e analisando o comportamento materno e os resultados da prole para validar a eficácia do modelo e os resultados esperados.
Protocolo
Todos os procedimentos envolvendo animais foram realizados em conformidade com o Guia do National Institutes of Health para o Cuidado e Uso de Animais de Laboratório e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Georgia State University (número de aprovação A24011). Os ratos foram criados e mantidos nas instalações de animais da Georgia State University. Os experimentos foram realizados em uma cepa C57BL/6J durante o período perinatal (dia pós-natal [P] 2-10) e incluíram machos e fêmeas. Os reagentes e equipamentos utilizados para este estudo estão listados na Tabela de Materiais.
1. Configuração do material
- Corte a divisória de malha de acordo com as dimensões da gaiola, deixando um excesso de 3 cm nos lados mais longos.
NOTA: A malha fornecida na tabela de materiais é cortada pelo fabricante. - Dobre as bordas, incluindo o excesso, de forma a criar uma plataforma encaixada com precisão nas bordas da gaiola e com ~2,5 cm de altura acima do chão. Isso permitirá que a urina e as fezes passem pela divisória de malha sem que os animais consigam recuperar a cama de espiga de milho. Por fim, certifique-se de que todas as bordas afiadas estejam dobradas para baixo para evitar danos aos animais.
NOTA: As divisórias de malha são reutilizáveis e devem ser cuidadosamente limpas entre os usos com água quente e sabão, seguidas de pulverização com etanol 70%. - Configure as câmeras em tripés e prepare o sistema de gravação.
NOTA: Recomenda-se o uso de software de gerenciamento de vídeo. Essas gravações resultam em arquivos .mp4 que são automaticamente agrupados em segmentos de 1 h. - Ajuste as configurações para gravação contínua.
NOTA: As configurações adicionais recomendadas são resolução de 1920 x 1080 e 30 quadros/s. - Defina os arquivos de .mp4 resultantes para serem divididos em segmentos de 1 h, se não for feito automaticamente pelo software de gerenciamento de vídeo.
- Se analisar o período de apagamento, use iluminação infravermelha.
NOTA: Para reduzir o brilho de gravação na lateral da gaiola, é recomendável desativar o infravermelho (IR) da câmera. Em vez disso, use holofotes infravermelhos na sala durante a gravação em fase escura.
2. Paradigma de acamamento e nidificação limitados (LBN)
- Emparelhe 1-4 fêmeas com um criador macho de alojamento único.
NOTA: A idade recomendada para o primeiro emparelhamento em fêmeas experimentais é P75. O uso de fêmeas nulíparas é o ideal, mas em situações em que isso não é viável, como com valiosas linhagens de camundongos transgênicos, as fêmeas multíparas podem continuar se reproduzindo por aproximadamente quatro meses depois. Recomenda-se, embora não seja obrigatório, verificar se há tampões vaginais diariamente para confirmar o dia do acasalamento (dia embrionário [E]0).- Assim que as barragens estiverem grávidas, mantenha os distúrbios mínimos.
NOTA: As fêmeas multíparas geralmente podem ser reutilizadas para produzir até cinco ninhadas antes que a fertilidade diminua. Se as barragens forem reutilizadas para o experimento, elas devem ser usadas preferencialmente para a mesma condição todas as vezes ou apenas trocadas de Controle para LBN, mas nunca o contrário, a fim de evitar quaisquer efeitos residuais de longo prazo do LBN na barragem.
- Assim que as barragens estiverem grávidas, mantenha os distúrbios mínimos.
- No E17 (ou se os plugues não forem verificados, sempre que as fêmeas parecerem evidentemente grávidas), separe as fêmeas em sua própria gaiola de acrílico padrão e dê a elas um ninho de algodão (5 x 5 cm) para construir um ninho.
NOTA: É ideal mover as fêmeas separadas para uma sala pequena e silenciosa, longe da sala principal da colônia, com um ciclo claro/escuro de 12 h e interrupções mínimas do pessoal para a configuração de controle e LBN. - Registre a data de nascimento (por volta de E19).
- Em P2, conte e faça o sexo dos filhotes. Atribua aleatoriamente ninhadas às condições LBN ou Controle (se for a primeira ninhada da barragem). Essa interação com os filhotes deve ser concluída entre 1 e 4 h após o acendimento das luzes.
- Coloque os filhotes cuidadosamente em uma gaiola nova e limpa para serem classificados por sexo. A distância anogenital entre o ânus e os órgãos genitais é maior nos homens do que nas mulheres e pode ser usada como um identificador.
- Separe machos e fêmeas em grupos para contá-los.
- Abater ninhadas com mais de 8 filhotes e descartar ninhadas com menos de 4. O tamanho ideal da ninhada é de 4 a 8 filhotes, pois qualquer coisa fora dessa faixa pode interferir na distribuição dos cuidados maternos durante o estudo.
NOTA: As variáveis que podem ser afetadas devido ao tamanho da ninhada são o peso do filhote, a oportunidade de alimentação e as interações mãe-filhote, o que pode confundir o experimento. Idealmente, os camundongos não serão adotados, pois têm menos probabilidade de sobreviver do que os ratos.
- Configure as condições de controle e LBN conforme mostrado na Figura 1.
- Controle: Use uma gaiola de caixa de sapatos de mouse de tamanho padrão (19,4 cm x 13,0 cm x 38,1 cm) com ~ 220 g de cama de espiga de milho (dependendo das dimensões da gaiola, visando ~ 1 cm de altura) e um ninho de algodão quadrado padrão (5 x 5 cm).
- Para ajudar os ratos a se aclimatarem a esse ambiente desconhecido, coloque um de seus pellets fecais de sua gaiola antiga em cada canto da nova gaiola. Além disso, coloque uma pequena quantidade (do tamanho de uma moeda de dez centavos) de ninho de algodão usado da gaiola anterior sobre o novo ninho.
- LBN: Coloque o divisor de malha previamente preparado em uma gaiola de caixa de sapatos padrão com ~ 110 g de cama de espiga de milho (visando ~ 0,5 cm de altura). A malha deve evitar o contato direto entre os camundongos e a cama de espiga de milho.
- Por fim, adicione metade de um quadrado de ninho de algodão (2,5 x 5 cm). Repita todas as etapas acima para ajudar na aclimatação.
NOTA: Recomenda-se manter as gaiolas da caixa de sapatos em racks padrão e não ventilados, pois foi demonstrado que essa configuração é silenciosa e não induz hipotermia em filhotes criados em gaiolas LBN21. No entanto, este pode não ser o caso com o aumento do fluxo de ar em gaiolas ventiladas; Portanto, os pesquisadores devem medir os níveis de ruído e as temperaturas centrais dos filhotes em seu sistema se estiverem usando gaiolas ventiladas.
- Por fim, adicione metade de um quadrado de ninho de algodão (2,5 x 5 cm). Repita todas as etapas acima para ajudar na aclimatação.
- Controle: Use uma gaiola de caixa de sapatos de mouse de tamanho padrão (19,4 cm x 13,0 cm x 38,1 cm) com ~ 220 g de cama de espiga de milho (dependendo das dimensões da gaiola, visando ~ 1 cm de altura) e um ninho de algodão quadrado padrão (5 x 5 cm).
- Adicione os filhotes à gaiola designada e coloque-os em cima do ninho. Em seguida, coloque a barragem na gaiola de frente para os filhotes, pois isso a ajudará a perceber que eles estão presentes mais rapidamente. Certifique-se de que comida e água suficientes sejam incluídas por pelo menos 8 dias para evitar perturbar a gaiola até o final do experimento em P10.
- Coloque uma câmera em um tripé na frente da gaiola, permitindo uma visão lateral clara da mãe e de seus filhotes. Opcionalmente, coloque espelhos ao redor da gaiola para capturar melhor todos os ângulos. Embora apenas 1 h de gravação de vídeo por dia precise ser analisada, a câmera é configurada para gravar continuamente 24 horas por dia, 7 dias por semana, durante o experimento, para que os distúrbios possam ser monitorados.
NOTA: Os ratos também podem ser observados pessoalmente e o comportamento materno pode ser pontuado manualmente, embora seja preferível gravar em vídeo para evitar interrupções devido à presença do experimentador na sala. Se forem usados racks ventilados, também pode ser necessário usar um procedimento diferente para organizar câmeras para gravação de cuidados maternos do que o descrito aqui. - Na manhã de P10, retorne todos os animais às condições normais de gaiola (idealmente idênticas à condição de controlo acima referida) e pese as crias.
- Trate todos os filhotes da mesma forma e desmame em P21 em grupos de 2 a 5 irmãos de ninhada do mesmo sexo.
NOTA: Procure abrigar irmãos de ninhada do mesmo sexo juntos sempre que possível, mas, se necessário, abrigar filhos do mesmo sexo de ninhadas diferentes na mesma condição juntos. Recomenda-se que o controle de alojamento e a prole de LBN juntos sejam evitados (ver Yang et al. para o efeito da composição do cagemato nos fenótipos comportamentais22).

Figura 1: Exemplo de configuração da gaiola. A gaiola no lado esquerdo da imagem mostra uma gaiola de controle padrão (CTL) contendo uma quantidade total de cama e um ninho completo. A gaiola do lado direito mostra uma configuração limitada de cama e nidificação (LBN) com metade da quantidade de cama, meio ninho e uma divisória de malha para separar os animais da cama. Clique aqui para ver uma versão maior desta figura.
3. Pontuação do comportamento materno
- Embora as gravações contínuas sejam coletadas nesta configuração, analise apenas 1 h de P3 a P6. Recomenda-se analisar os vídeos gravados não antes de 1 h após a mudança das luzes para permitir a habituação e analisar os vídeos de um horário consistente todos os dias.
NOTA: O período de P3 a P6 normalmente contém as maiores diferenças nos cuidados maternos devido à LBN; Portanto, só é necessário analisar esses dias. O tempo de observação/registro sugerido permite a captura da atividade após a transição do ciclo ativo para o inativo ou vice-versa. No entanto, a fase inativa é quando a mãe tem maior probabilidade de se envolver no cuidado materno e já demonstrou conter as maiores diferenças de grupo no comportamento materno3.
NOTA: Capture as gravações P2 mais tarde do que em outros dias, pois os camundongos precisam de pelo menos 1 h para se habituar à troca de gaiola. A menos que esta seja uma variável de interesse, descarte este dia da análise. - Pontue todos os comportamentos conforme apresentado na Tabela 1. Normalmente, os comportamentos são pontuados nos primeiros 50 minutos após o início do tempo de coleta de dados.
NOTA: Isso pode ser feito manualmente ou eletronicamente usando o Software Interativo de Pesquisa de Observação Comportamental (BORIS, um software de código aberto) ou um tipo semelhante de software. As instruções abaixo são para pontuação manual e podem ser adaptadas para qualquer software escolhido. - Em uma tabela impressa, registre o comportamento observado usando a abreviação, a hora de início e a duração da luta e quaisquer notas descritivas. Por exemplo, se a mãe está amamentando ativamente e depois deixa o ninho, mas os filhotes ainda estão presos a ela, observe isso como AN, seguido por O. A descrição dos filhotes (e quantos) ainda anexados deve ser mantida como uma nota ao lado, caso seja necessário mais tarde.
NOTA: Qualquer comportamento com menos de 3 s de comprimento não é analisado. Essa regra ajuda a filtrar comportamentos momentâneos devido a distúrbios externos, como ruído ambiental. Uma exceção é feita quando há uma interrupção visível em uma luta de AN (como por um grande movimento ou alongamento) que é rapidamente retomada. Nesse caso, o comportamento observado é AN, seguido por N-AN, conforme descrito na Tabela 1. - No caso de vários comportamentos acontecerem ao mesmo tempo, registre o mais ativo. Um exemplo disso é se a mãe está com pouca mama, mas depois começa a lamber e escovar, nota-se que a baixa amamentação pára e o próximo comportamento deve ser marcado como LG com uma nota de que isso ocorreu durante a NL.
| Tipo de comportamento | Abreviação | Descrição | ||||
| Lamber / cuidar | LG | A mãe está envolvida em lamber / cuidar de seus filhotes. | ||||
| Enfermagem ativa | ANO | A mãe está amamentando seus filhotes em pé, enquanto suas costas estão arqueadas. | ||||
| Nova enfermagem ativa | N-AN | Esse comportamento é usado especificamente quando a mãe interrompeu a amamentação, mas retoma rapidamente. Esta é uma exceção à regra dos 3s. | ||||
| Baixa amamentação | EM | A mãe está amamentando ativamente seus filhotes, mas suas costas estão baixas ou quase planas. Esse comportamento geralmente segue AN após um período de tempo. | ||||
| Acompanhamento de enfermagem | SN | A mãe está deitada de lado durante a amamentação (também conhecida como amamentação passiva). | ||||
| Fora do ninho | O | A mãe não está no ninho e ela não está comendo / bebendo. Isso pode ser observado em sua caminhada ao redor da gaiola ou explorando. | ||||
| Comer/beber | E | A mãe está fora do ninho comendo ou bebendo. | ||||
| Auto-higiene | SG | A mãe está se preparando. | ||||
| Carregando filhotes | C | A mãe carrega os filhotes, geralmente para realocá-los de volta ao ninho. | ||||
| Construção de ninhos | NB | A barragem está ativamente construindo ou realocando o ninho. | ||||
| Seguir em frente ninho | M | A barragem está se movendo no ninho. Isso se apresenta com a mãe interagindo com os filhotes de uma maneira diferente de LG ou qualquer tipo de amamentação, como cheirar, empinar ou pisar nos filhotes. | ||||
Tabela 1: Descrição dos comportamentos de cuidado materno.
4. Análise de dados do comportamento materno
- Compile os resultados da pontuação em uma planilha.
- Se os vídeos foram analisados eletronicamente, exclua os comportamentos com episódios menores que 3 s, conforme descrito na etapa 3.
- Calcule a duração média da sessão, a frequência média e a duração total da lambida e da limpeza para cada dia de observação.
NOTA: Estatísticas descritivas podem ser realizadas em qualquer um dos comportamentos pontuados, mas lamber e escovar normalmente apresentam a interrupção mais evidente em termos de fragmentação por LBN (ou seja, ataques mais curtos e frequentes). Essas variáveis podem ser analisadas como uma média em P3-P6 ou como medidas repetidas por dia para procurar mudanças ao longo do tempo, se isso for de interesse.
5. Cálculo da entropia
NOTA: A entropia, ou imprevisibilidade, dos comportamentos de cuidado materno é calculada com base no método proposto por Vegetabile et al.23. Este método baseia-se na suposição de que os comportamentos de cuidado materno atuam como uma cadeia de Markov, que pode ser usada para estimar a taxa de entropia de uma sequência comportamental. A sequência de comportamentos de cada barragem é caracterizada usando a matriz de transição empírica ij> i,j = 1... 7 de probabilidades condicionais de passar de um comportamento (i) para outro comportamento (j), e a taxa de entropia é calculada a partir disso, conforme descrito anteriormente 3,23 e da seguinte forma: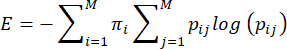
onde pij é a probabilidade condicional de que o comportamento j seja observado em seguida depois que uma mãe é observada executando o comportamento i, πi é a frequência com que o comportamento i é observado e M (= 7) é o número total de comportamentos diferentes. O leitor é encaminhado para Vegetabile et al.23 para uma discussão dos fundamentos teóricos das equações; aqui, o foco está em como aplicar o método no modelo LBN.
- Para calcular isso, organize o formato necessário para a análise.
- Combine AN, LN, SN e N-AN em uma única variável chamada N, somando os tempos, pois todos envolvem enfermagem.
NOTA: Consulte a Tabela 1 para a descrição dos comportamentos de cuidado materno. - Adicione os comportamentos que não estão relacionados a comportamentos auto-direcionados ou direcionados a filhotes (M e O) em O.
- Insira LG, E, SG, C e NB separadamente para resultar em 7 comportamentos no total.
- Combine AN, LN, SN e N-AN em uma única variável chamada N, somando os tempos, pois todos envolvem enfermagem.
- Crie uma planilha com colunas seguindo esta ordem: ID do mouse, ID da ninhada, Ninhada #, Tratamento, Dia, Hora, Comportamento e Status.
- No ID do mouse, adicione a linha/genótipo do mouse da barragem.
- No ID da serapilheira, use o identificador da barragem seguido do número da cama.
- Na ninhada #, indique o número de ninhadas que a mãe teve.
- Certifique-se de que o tratamento é LBN ou Controle, de acordo com as condições em que os animais foram colocados.
- Indique o dia como o dia pós-natal correspondente analisado.
- Indique a hora como o carimbo de data/hora no vídeo quando o comportamento começou e terminou (em relação ao início da gravação).
- Selecione o comportamento dos sete descritos anteriormente (N, O, LG, E, SG, C e NB) (Tabela 1).
- Marque os dois tipos de status, START e STOP. Portanto, cada comportamento aparecerá duas vezes; a primeira notação marca o início e a segunda marca a parada.
- Seguindo este formato, inclua as informações de todos os dias analisados.
- No ambiente R, importe os conjuntos de dados que foram formatados como acima.
- Instale os pacotes disponíveis em https://github.com/bvegetabile/entropyRate.
NOTA: A execução desse código resulta em uma pasta chamada LBN; Independentemente da condição, esta pasta contém a entropia calculada. Além disso, a entropia de cada dia pode ser calculada pela média do sujeito para P3-P6 e comparada entre as condições.
Resultados
Os resultados representativos demonstram como o ELA, imposto por um ambiente empobrecido em gaiolas LBN, afeta o cuidado materno das mães e os resultados fisiológicos da prole. A entropia diária no comportamento de cuidado materno é maior em LBN nos dias P3-P6 (F1,58 = 7,21, p = 0,0094; Figura 2A), bem como a entropia média de cada barragem a partir deste período de tempo (t15 = 3,03, p = 0,0085; Figura 2B). Notavelm...
Discussão
Este artigo fornece um protocolo detalhado para aplicar o modelo LBN em camundongos. Esse modelo é uma ferramenta importante para entender como uma forma etológica e translacionalmente relevante de estresse crônico no início da vida contribui para o desenvolvimento de distúrbios neuropsiquiátricos na prole13. Também é útil para estudar o comportamento materno e quaisquer alterações no cérebro das mães de uma perspectiva molecular, neuroendócrina ou baseada em circuitos
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pelo NIMH K99/R00 Pathway to Independence Award #MH120327, Whitehall Foundation Grant #2022-08-051 e NARSAD Young Investigator Grant #31308 da Brain & Behavior Research Foundation e The John and Polly Sparks Foundation. Os autores gostariam de agradecer à Divisão de Recursos Animais da Georgia State University por fornecer cuidados excepcionais aos nossos animais., e Ryan Sleeth por seu excelente suporte técnico na configuração e manutenção de nosso sistema de gerenciamento de vídeo. A Dra. Bolton também gostaria de agradecer à Dra. Tallie Z. Baram pelo excelente treinamento na implementação adequada do modelo LBN durante sua bolsa de pós-doutorado.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
Referências
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113 (2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702 (2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865 (2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. . Poverty in the United States: 2022. , 60 (2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426 (2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212 (2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736 (2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543 (2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484 (2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464 (2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600 (2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30 (2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167 (2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263 (2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49 (2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763 (2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437 (2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507 (2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655 (2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472 (2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120 (2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996 (2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161 (2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098 (2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277 (2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados