Method Article
في الجسم الحي تصوير الهامستر المصاب بداء الليشمانيا عن طريق تلقيح اللثة للسمستر المحوري الذي يعبر عن اللوسيفيراز
In This Article
Summary
نقدم هنا تقييما طوليا للهامستر الذهبي المصاب داخل الصفاق (IP) أو عن طريق اللثة (IG) مع L. infantum-Luc عن طريق التصوير الحيوي وتفاعل البوليميراز المتسلسل (PCR). تم تقييم الهامستر بعد يوم واحد من الإصابة (1 نقطة في البوصة) ، وأسبوع واحد بعد الإصابة (8 نقطة في البوصة) ، و 3 أسابيع بعد الإصابة (22 نقطة في البوصة) والقتل الرحيم عند 50نقطة في البوصة و 8 أشهر بعد الإصابة.
Abstract
تعتبر منظمة الصحة العالمية داء الليشمانيات الخشبي الأمريكي (ATL) وداء الليشمانيات الحشوي (VL) مهملين. يمكن أن يكون VL مميتا إذا لم يتم علاجه. الأدوية المستخدمة في العلاج سامة ، وهناك حالات مقاومة. يمكن أن تمثل الاختبارات قبل السريرية عنق الزجاجة في اكتشاف أدوية جديدة للعلاج ، اعتمادا على النموذج الحيواني ، والسلالة المستخدمة ، ومسار التلقيح. يتميز الهامستر الذهبي بقابليته العالية لأنواع الأجناس الفرعية Viannia و Leishmania ، حيث يعرض العديد من العمليات السريرية والمناعية المرضية التي لوحظت في الأمراض البشرية.
عن طريق تشريح الهامستر ، الذي له ذيل قصير وأطراف ، عادة ما يكون الطريق داخل القلب هو خيار الحقن الوريدي لمرض الليشمانيا. ومع ذلك ، فهو لقاح يمكن أن يؤدي إلى النزيف وفي النهاية موت. وبالتالي ، قمنا بتوحيد طريق تلقيح بديل عن طريق الوريد للعدوى في وريد اللثة ، وهو طفيف التوغل ، ويسمح بالوصول الوريدي السهل ، ويسبب القليل من الإصابات الموضعية والجهازية للحيوان. لذلك ، تمت متابعة الهامستر المصاب بالطريق داخل الصفاق (IP) أو داخل اللثة (IG) مع Leishmania Infantum الذي يعبر عن لوسيفيراز (Luc) لمدة 22 يوما بواسطة نظام التصوير الحيوي و 50 يوما و 8 أشهر بعد الإصابة بتفاعل البوليميراز المتسلسل (PCR).
بعد تلقيح اللثة لكل من amastigotes axenic و promastigotes من L. infantum-Luc ، تم تقييد التلألؤ البيولوجي لمدة أسبوعين على الأقل في موقع الحقن ، وهو مؤشر على العدوى في الأنسجة المحيطة بالضفيرة اللثية. أظهر الهامستر المصاب داخل الصفاق ب L. infantum-Luc تلألؤ بيولوجيا مشتتا في جميع أنحاء البطن ، كما هو متوقع. ومع ذلك ، من خلال نظام التصوير الحيوي ، انخفضت العدوى حتى 50 نقطة في البوصة ولم يكن من الممكن اكتشافها إلا عن طريق تفاعل البوليميراز المتسلسل (PCR). أظهرت الآماستيجوت المحورية عدوى أفضل من البروماتيجوت ، كما تم تقييمها بواسطة تفاعل البوليميراز المتسلسل (PCR). في الواقع ، بعد 8 أشهر من الإصابة ، تم الكشف عن الطفيليات بواسطة تفاعل البوليميراز المتسلسل في كبد الملقحة ب amasstigotes axenic عن طريق الوريد ، والتي يمكن أن تكون سمة من سمات السلالة المرجعية ل L. infantum MHOM/BR/1974/PP75 ، التي تتطور عدوتها ببطء وتظهر عبئا طفيليا منخفضا ، أقل من دقة التصوير المضيء الحيوي. وبالتالي ، يمكن أن تكون الماسستيجوت المحورية خيارا أفضل للعدوى والمتابعة من اللقاح اللثوي ، ولقاح اللثة هو طريق ممكن للحقن الوريدي لمرض الليشمانيا ومسببات الأمراض الأخرى.
Introduction
يعتبر داء الليشمانيات أمراضا مهملة وعودة للظهور يسببها أكثر من 20 نوعا من الليشمانيا ، مستوطنة في العديد من البلدان في المناطق البيئية الوبائية الوسطى الأربع: أمريكا اللاتينية وشمال وشرق إفريقيا وغرب وجنوب شرقآسيا 1. يمكن تجميعها على أنها داء الليشمانيات الحشوي (TL) ، وهو قاتل إذا لم يتم علاجه. العامل المسبب ل VL في البرازيل هو Leishmania infantum ، ويتم العلاج باستخدام مضادات القياس خماسية التكافؤ أو الأمفوتريسين B. يتم إعطاء هذه الأدوية عن طريق الوريد ، ولها سمية عالية ، وتظهر ردود فعل سلبية ، وهناك حالات مقاومة2.
وبالتالي ، من الضروري الاستثمار في البحث عن علاج كيميائي جديد. الاختبارات قبل السريرية هي ، في الواقع ، عنق الزجاجة في اكتشاف أدوية جديدة لعلاج VL ، اعتمادا على النموذج الحيواني ، والسلالة المستخدمة ، ومسار التلقيح ، والعوامل اللوجستية والتقنية والتشغيلية الأخرى. يتميز الهامستر الذهبي بقابليته العالية لأنواع الأجناس الفرعية Viannia و Leishmania ، حيث يعرض العديد من العمليات السريرية والمناعية المرضية التي لوحظت في المرض البشري كما لوحظ في الدراسات السابقة مع Leishmania braziliensis3،4. الهامستر المصاب ب L. infantum يطور أيضا معظم العمليات المناعية المرضية المميزة ل VL في البشر5 ، مثل فقر الدم ، ونقص الكريات البيض ، وقلة الصفيحات ، وتضخم الكبد والطحال. بالإضافة إلى ذلك ، فإن الهامستر الذهبي هو متناثر ولا يظهر استجابة موحدة ، مما يعيد إنتاج عدم تجانس المظاهر السريرية كما هو موضح في البشر3.
جانب آخر يجب مراعاته لنتيجة العدوى هو L . infantum سلالة وطريق التلقيح. العديد من سلالات L. infantum تختلف في الخلفية الوراثية والقابلية للعلاج2،6،7. بعض السلالات لها حمل طفيلي منخفض في الكبد والطحال بعد عدوى promastigotes8 ، ويمكن أن تكون الآماستيجوت المحورية بديلا لتحسين العدوى التي لم يتم استكشافها كثيرا. في الواقع ، يفضل الطريق عن طريق الوريد العدوى ويزيد من تواتر التي تظهر عليها علامات سريرية. لكن التلقيح داخل الصفاق هو الأكثر استخداما. الطريق داخل القلب هو خيار العدوى الوريدية ب L. infantum5،8،9. ومع ذلك ، في الهامستر ، يعد التلقيح داخل اللثة طريقا بديلا للحقن في الوريد ، ولا يوصف بأنه موقع للعدوى. على الرغم من الإبلاغ عنه ، فإن بزل الوريد اللثوي طفيف التوغل ، ويسمح بالوصول الوريدي السهل ، ويسبب القليل من الإصابات الموضعيةوالجهازية 10. يتفق ثقب وريد اللثة أكثر من غيرها مع التوصيات لزيادة جودة النتائج وقابليتها للتطبيق مع الحفاظ على رفاهية11.
يتطلب التقييم قبل السريري لمركبات VL باستخدام الطرق التقليدية المزيد من ، والتي يجب القتل الرحيم للتحليل النسيجي المرضي وتقييم حمل الطفيليات في الأنسجة. في المقابل ، يمكن لنظام التصوير الحيوي أن يسرع الدراسات قبل السريرية ويقلل من عدد. يمكن متابعة مواقع الإضاءة الحيوية في الأنسجة المصابة في الوقت الفعلي في نفس لعدة أسابيع. أظهرت العديد من الدراسات حول توحيد هذه الأداة التكنولوجية الحاسمة تطبيقها في الدراسات التي أجريت على الفئران المصابة ب المثقبية الكروزية ، الليشمانيا spp. ، و Toxoplasma gondii12،13،14،15. ومع ذلك ، اعتمادا على عبء الطفيلي في الأنسجة ، يمكن أن يتم اكتشاف التلألؤ البيولوجي بشكل كاف بواسطة نظام التصوير في الجسم الحي ، والذي يتطلب تقييما عن طريق تفاعل البوليميراز المتسلسل الكمي للأعضاء المصابة. لذلك ، نقترح تطوير منهجية تعتمد على الحقن الوريدي ل L. infantum الذي يعبر عن لوسيفيراز في الوريد اللثوي للهامستر الذهبي للمتابعة بواسطة نظام التصوير الحيوي و PCR.
Protocol
اتبعت البروتوكولات المتعلقة بالهامستر إرشادات معهد أوزوالدو كروز / لجنة الأخلاقيات في أبحاث التابعة لمعهد أوزوالدو كروز / اللجنة الأولمبية الدولية (الموافقة: CEUA / IOC L-015/2022).
1. استنساخ جين لوسيفيراز اليراع في بلازميد تعبير الليشمانيا
- هضم البلازميد pLEXSY-hyg2 مع BglII (10 U / μL) و NotI (10 U / μL) إندونوكلياز داخلي. قم بالهضم أولا باستخدام BglII: أضف 50 ميكرولتر من البلازميد (9 ميكروغرام من الحمض النووي) ، و 30 ميكرولتر من المخزن المؤقت لإنزيم التقييد ، و 3 ميكرولتر من ألبومين مصل الأبقار (BSA) ، و 3 ميكرولتر من BglII ، والماء الخالي من النوكلياز إلى الحجم النهائي البالغ 300 ميكرولتر. احتضان لمدة 3 ساعات عند 37 درجة مئوية.
- استيعاب بلازميد TOPOII / LUC مع BamHI (10 U / μL) و NotI لتحرير إطار القراءة المفتوح لوسيفيراز اليراع مع تسلسل Kozak (Kozak-LUC) ، المستنسخ في متجه TOPOII16. هضم أولا مع BamHI: امزج 100 ميكرولتر من البلازميد (8.5 ميكروغرام من الحمض النووي) مع 30 ميكرولتر من المخزن المؤقت لإنزيم التقييد. 3 ميكرولتر من BSA ، و 3 ميكرولتر من BamHI ، وماء خال من النوكلياز إلى 300 ميكرولتر من الحجم النهائي. احتضان لمدة 3 ساعات عند 37 درجة مئوية.
- قم بتنظيف كل بلازميد على غشاء السيليكا وتخلص الحمض النووي مرتين ب 50 ميكرولتر من الماء للحصول على حجم نهائي يبلغ 100 ميكرولتر.
- استيعاب مزدوج البلازميدات pLEXSY-hyg2 و TOPOII / LUC الخطية مسبقا باستخدام NotI. امزج 100 ميكرولتر من الحمض النووي المخرج من غشاء السيليكا إلى 15 ميكرولتر من المخزن المؤقت D ، و 2 ميكرولتر من NotI ، والماء الخالي من النوكلياز إلى الحجم النهائي 150 ميكرولتر. احتضان لمدة ساعة واحدة عند 37 درجة مئوية.
- جل ينقي الناقل مزدوج الهضم (pLEXSY-hyg2) وإدراج Kozak-LUC من هلام الاغاروز بنسبة 1٪ بعد الرحلان الكهربائي باستخدام المخزن المؤقت Tris-acetate EDTA (TAE). استئصال النطاقات ~ 8 كيلو بايت و 1.6 كيلو بايت بمشرط. قم بوزن الشرائح ، وأضف ثلاثة أحجام من المخزن المؤقت إلى حجم واحد من الجل ، واحتضن عند 50 درجة مئوية لإذابة الجل ، ونقله إلى غشاء السيليكا ، واغسل الحمض النووي وشطفه مرتين ب 20 ميكرولتر من الماء ، بحجم نهائي يبلغ 40 ميكرولتر.
- ربط المتجه مزدوج الهضم (pLEXSY-hyg2) والإدراج ، Kozak-LUC ، مع T4 ligase: امزج 2 ميكرولتر من الناقل وإدخاله ، كلاهما عند 55 نانوغرام / ميكرولتر ، نسبة مولية 1: 5 ؛ إضافة 5 ميكرولتر من المخزن المؤقت للربط ؛ 1 ميكرولتر من T4 DNA ligase (1U / mL) ، الحجم النهائي 10 ميكرولتر. احتضن طوال الليل عند 16 درجة مئوية.
- أضف 40 ميكرولتر من الماء الخالي من النوكلياز إلى 10 ميكرولتر من تفاعل الربط وقم بترسيب الحمض النووي ب 10 أحجام من البيوتانول. جهاز طرد مركزي بأقصى سرعة لمدة 10 دقائق في جهاز طرد مركزي دقيق ، اغسل الحبيبات بنسبة 70٪ من الإيثانول ، وجهاز الطرد المركزي بأقصى سرعة لمدة 10 دقائق ، واترك الحبيبات تجف على المقعد ، وأضف 4 ميكرولتر من الماء.
- امزج 4 ميكرولتر من تفاعل الربط مع البكتيريا ذات الكفاءة الكهربائية ، JM109 (40 ميكرولتر) ، وانقل الخليط إلى كوفيت (د = 0.2 سم) ، واحتفظ به على الجليد. التثقيب الكهربائي عند 2,500 فولت ، 200 Ω ، 25 ميكروفهرنهايت ، ضع الكوفيت في الثلج ، وأضف 1 مل من وسط LB. انقل الخليط على الفور إلى أنبوب مخروطي سعة 15 مل واحتضانه عند 37 درجة مئوية لمدة 60 دقيقة و 100 دورة في الدقيقة.
- ضعي الخليط على لوحين من أجار / أمبيسلين (100 ميكروغرام / مل): أحدهما يحتوي على 200 ميكرولتر والآخر يحتوي على البكتيريا الكاملة الكهربائية. تركيز الحجم عن طريق الطرد المركزي للبكتيريا المحولة عند 2,000 × جم لمدة 10 دقائق, أعد تعليق الحبيبات في 100 ميكرولتر, ولوحة الحجم / الحبيبات بالكامل. احتضن الألواح لمدة 24-30 ساعة عند 30 درجة مئوية وانتظر حتى تنمو المستنسخة.
- حدد المستنسخة باستخدام عود أسنان وانقلها إلى 50 مل من الأنابيب المخروطية تحتوي على 5 مل من الوسط LB / الأمبيسلين (100 ميكروغرام / مل). احتضن لمدة 20-24 ساعة عند 30 درجة مئوية و 100 دورة في الدقيقة للسماح لمزارع التحضير المصغر بالنمو.
- قم بتنقية البلازميد باستخدام مجموعة التحضير المصغر وتخلص من الحمض النووي ب 30 ميكرولتر من الماء. شاشة استنساخ تحتوي على بناء pLESXY-LUC-hyg2 عن طريق الهضم مع BamHI.
- امزج 10 ميكرولتر من الحمض النووي من miniprep ؛ 2 ميكرولتر من المخزن المؤقت لإنزيم التقييد ؛ 0.2 ميكرولتر من BSA: 1 ميكرولتر من BamHI والماء الخالي من النوكلياز إلى الحجم النهائي 20 ميكرولتر. احتضن لمدة ساعة واحدة عند 37 درجة مئوية من الأجزاء المتوقعة من المستنسخة الإيجابية في الرحلان الكهربائي لهلام الاغاروز بنسبة 1٪: 3،450 و 6،290 زوجا أساسيا.
- قم بإعداد ثقافة maxiprep لتنقية البنية pLESXY-LUC-hyg2 على نطاق أوسع. أضف Erlenmeyer (1 لتر) ، و 250 مل من وسط LB مكمل بالأمبيسيلين ، و 1 مل من JM109 المنقول miniprep واحتضانه لمدة 18-20 ساعة عند 30 درجة مئوية و 200 دورة في الدقيقة.
2. إنتاج واختيار الليشمانيا إنفانتوم الذي يعبر عن لوسيفيراز
- لتحرير كاسيت تكامل Leishmania ، قم باستيعاب البلازميد pLESXY-LUC-hyg2 حتى يكتمل مع SwaI. أضف 40 ميكرولتر من البلازميد (50 ميكروغرام) ، و 10 ميكرولتر من المخزن المؤقت سريع الهضم ، و 4 ميكرولتر من SwaI ، والماء الخالي من النوكلياز إلى الحجم النهائي 100 ميكرولتر. احتضن بين عشية وضحاها عند 30 درجة مئوية.
- قم بترسيب الإيثانول ، واغسله مرة واحدة بنسبة 70٪ من الإيثانول ، وأعد تعليقه ب 50 ميكرولتر من الماء ، واستمر في وضع الثلج.
- أجهزة الطرد المركزي Leishmania MHOM / BR / 1974 / PP75 promastigotes عند 1,000 × جم لمدة 10 دقائق في مرحلة النمو الأسي في وسط شنايدر. اغسل الحبيبات بوسط تسريب الدماغ والقلب (BHI) ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق. أعد تعليق الحبيبات إلى 108 بروماستيجوت / مل في BHI.
- امزج L. infantum promastigotes (500 ميكرولتر) مع كاسيت تكامل pLESXY-LUC-hyg2 (50 ميكروجرام) في كوفيت التثقيب الكهربائي (د = 0.4 سم) ، على الثلج. التثقيب الكهربائي بنبضتين بفواصل 1,500 فولت / 25 ميكرو فهرنهايت و 10 ثوان. بعد النبض ، اتركيه على الثلج لمدة 10 دقائق.
- انقل البروماستيجوت المنقولة إلى قارورة مع وسط شنايدر مكمل بنسبة 20٪ FCS عند 26 درجة مئوية. بعد 24 ساعة ، أضف 50 ميكروغرام / مل أولا ، ثم قم بزيادة الهيغروميسين أولا 50 ميكروغرام / مل بعد 48 ساعة ، و 150 ميكروغرام / مل بعد أسبوع واحد.
- استنساخ promastigotes من L. infantum-Luc عن طريق الحد من التخفيف في صفيحة 96 بئرا مع Schneider مكمل بنسبة 20٪ FCS و 150 ميكروغرام / مل hygromycin. احتضان عند 26 درجة مئوية لنمو الاستنساخ.
- استنساخ الشاشة لاختيار L. infantum-Luc المتجانسة وراثيا والمعبرة للغاية بواسطة وحدة التلألؤ النسبي للانبعاث الحيوي (RLU) ، في قارئ الصفيحة الدقيقة.
- باختصار ، امزج 106 بروماستيجوت في صفيحة بيضاء مكونة من 96 بئرا مع 100 ميكرولتر من الركيزة D-luciferin (300 ميكروغرام / مل) في مخزن مؤقت يتكون من 25 ملي مولار HEPES الرقم الهيدروجيني 7.8 ، 15 ملي مولار MgCl2 ، 4 ملي مولار EGTA ، 1 ملي مولار DTT ، 1 ميكروغرام / مل BSA ، 2.5 ملي مولار ATP ، 0.1٪ تريتون X-100 ، و 300 ميكرومتر الإنزيم A ، تم تقييمها على الفور في قارئ الصفيحة الدقيقة.
3. تفاعل البوليميراز المتسلسل لتقييم التكامل الجيني في موضع الريبوسومات 18S rRNA (ssu)
- تنقية الحمض النووي الجيني من promastigotes التي تعبر عن لوسيفيراز والنوع البري (108). أجهزة الطرد المركزي promastigotes عند 1,000 × جم لمدة 10 دقائق في أنابيب مخروطية سعة 15 مل ، تضيف المحلول الملحي المخزن بالفوسفات (PBS) إلى الحبيبات ، والعد بغرفة Neubauer ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق. أعد تعليق الحبيبات باستخدام محلول التحلل: 100 ملي كلوريد الصوديوم ، 10 ملي مولار تريس ، 25 ملي EDTA ، 0.5٪ SDS ، و 0.1 مجم / مل بروتيناز K بكثافة 108 / مل. احتضان طوال الليل عند 56 درجة مئوية.
- قم بإجراء دورتين من تنظيف الحمض النووي بحجم واحد من كحول الفينول / الكلوروفورم / الأيزواميل ، 25:24: 1 (حجم / حجم) ، وبحجم واحد من الكلوروفورم. بين كل دورة استخلاص ، انقل المرحلة المائية إلى أنابيب جديدة وأجهزة الطرد المركزي عند 2,000 × جم لمدة 10 دقائق.
- قم بترسيب الحمض النووي بمجلدين من الإيثانول وأجهزة الطرد المركزي عند 5,000 × جم ، 10 دقائق ، 4 درجات مئوية. أضف 1 مل من 70٪ من الإيثانول ، وانقله إلى أنبوب دقيق ، وجهاز طرد مركزي عند 15,000 × جم لمدة 5 دقائق.
- قم بإجراء غسل ثان بنسبة 70٪ من الإيثانول. بعد الطرد المركزي ، تخلص من المادة الطافية وجفف الحبيبات على المقعد.
- أعد ترطيب الحمض النووي الجيني ب 50-100 ميكرولتر من الماء عالي النقاء في حمام مائي عند 65 درجة مئوية لمدة 30 دقيقة ، وحدد كمية الحمض النووي ، وقم بتخزينه عند -20 درجة مئوية.
- إجراء تفاعل البوليميراز المتسلسل التشخيصي لتقييم تكامل كاسيت pLEXSY في جينوم الليشمانيا عن طريق إعداد تفاعل تفاعل تفاعل البوليميراز المتسلسل التالي: 10 ميكرولتر من عازلة تفاعل البوليميراز المتسلسل (PCR) ، و 0.2 ملي مولار dNTP ، و 1 وحدة من بوليميراز الحمض النووي ، و 1 ميكروغرام من الحمض النووي الجيني ، و 0.5 ميكرومتر من كل برايمر ، وماء خال من النوكلياز إلى الحجم النهائي 50 ميكرولتر.
- حدد البادئات التي تهجن في ناقل pLEXSY وجينوم الليشمانيا : (1) التمهيدي العكسي aprt A1715 5'-TATTCGTTGTCAGATGGCGCAC-3 '، التهجين في منطقة utr1 (aprt) ؛ و (2) ssu التمهيدي الأمامي F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3 '، في موضع كروموسومات الليشمانيا 18SrRNA (ssu).
- استخدم بروتوكول التضخيم التالي: دورة واحدة من التمسخ عند 94 درجة مئوية لمدة دقيقتين ؛ 30 دورة من التضخيم ، 30 ثانية عند 94 درجة مئوية ، 30 ثانية عند 60 درجة مئوية ، دقيقة واحدة عند 72 درجة مئوية ؛ تمديد نهائي لمدة 10 دقائق عند 72 درجة مئوية. الحجم المتوقع لمنتج PCR هو 1.1 كيلو بايت.
- استخدم مجموعة ثانية من الاشعال: (1) hyg forward primer A3804 5'-CCGATGGCTGTGTAGAAGTACTCG-3 ، و (2) التمهيدي العكسي ssu F3002 5'-CTGCAGGTTCACCTACAGCTAC-3 '، والتي تهجن في علامة المقاومة لناقل pLEXSY و 18SrRNA (ssu) موضع جينوم الليشمانيا . استخدم نفس بروتوكول PCR الموضح في الخطوة 3.6.2 باستثناء درجة حرارة التلدين البالغة 53 درجة مئوية ، بدلا من 60 درجة مئوية. المنتج المتوقع هو 1.8 كيلو بايت (hyg - 3'ssu).
- قم بتحليل منتجات تفاعل البوليميراز المتسلسل بواسطة الرحلان الكهربائي لهلام الاغاروز بنسبة 1٪ للتحقق مما إذا كان هناك تكامل في موضع الريبوسومي 18S rRNA في L. infantum الجينوم.
4. L. infantum- Luc promastigote metacyclic وتمايز amastigote axenic
- زراعة L. infantum-LucMHOM / BR / 1974 / PP75 ، الذي يعبر بشكل أساسي عن اللوسيفيراز ، في وسط BHI ، مكمل ب 25 مجم / لتر هيمين و 20٪ مصل عجل الجنين (FCS).
ملاحظة: تم سحب Hygromycin من وسط الشبكات المستقرة. - للحصول على promastigotes metacyclic من L. infantum-Luc ، قم بالبذور 106 / مل promastigotes في 75 سم2 قوارير ، أضف 20 مل من وسط BHI المكمل ب 20٪ FCS عند 26 درجةمئوية واحتفظ بها في الوضع الأفقي لمدة 4 أيام أو مائلة قليلا حتى المرحلة الثابتة من النمو. بعد 6-8 أيام متتالية ، تحتوي القارورة على زيادة promastigotes metacircleic. جهاز الطرد المركزي promastigotes عند 1,000 × جم لمدة 10 دقائق عند 4 درجاتمئوية.
- أعد تعليق حبيبات البروماستيجوت مع 20 مل من الجلوكوز المنخفض DMEM ، والعد باستخدام غرفة Neubauer ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق عند 4 درجاتمئوية.
- أضف DMEM منخفض الجلوكوز إلى الحبيبات بكثافة 3-5 × 107 promastigotes / مل. صب 5 مل من promastigotes على وسادة Ficoll سعة 10 مل ، مخففة في DMEM ، 2: 1 (حجم / حجم). جهاز الطرد المركزي التدرج عند 100 × جم لمدة 15 دقيقة عند 4 درجاتمئوية ، مع إيقاف تشغيل الفرامل والتسارع البطيء.
- اجمع البروماستيجوت الحلقي في الواجهة ، في الجزء العلوي من وسادة Ficoll ، وعد باستخدام غرفة Neubauer ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق عند 4 درجاتمئوية. اغسل الحبيبات باستخدام PBS لإزالة أي بقايا Ficoll ، وعد باستخدام غرفة Neubauer ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق عند 4 درجاتمئوية.
- أعد تعليق الحبيبات في PBS إلى 2 × 109 / مل. احتفظ بالبروماستيجوت على الجليد قبل التلقيح.
- تختلف promastigotes من L. infantum-Luc إلى amastigotes axenic في المختبر ، في وسط معدل ل amastigote المزروع محوريا (MAA) 17.
- تحضير MAA عن طريق إضافة 9.55 جم / لتر من متوسط 199 مع أملاح المبكر والجلوتامين ، 0.5٪ تريبتو كازين ، 3 ملي مولار ل-سيستين ، 15 ملي مولار د-جلوكوز ، 4 ملي مولار NaHCO3 ، 0.33 ملي Na2HPO4 ، 25 ملي هيبس إلى درجة حموضة نهائية 6.5 ، وتكملة مع 20٪ مصل ربلة الساق الجنينية (FCS).
- ابدأ المزارع في قوارير متوسطة (75 سم2) مع 9 مل من MAA متوسط و 1 مل من promastigotes في المرحلة الثابتة من النمو(اليوم 7 ) ، 2-3 × 107 promastigotes / مل. احتضان لمدة 24-48 ساعة عند 32 درجة مئوية للسماح بالتمايز السريع.
- احتفظ بالماستيغوت المزروعة محوريا بمقدار ممرين إلى ثلاثة ممرات في الأسبوع حتى تصل إلى كثافة 2-3 × 107 / مل.
- توسيع نطاق ثقافة amastigotes axenic لعدوى الهامستر. قم بإعداد قوارير 150 سم2 بكثافة عالية من amastigotes (5 × 106 / مل) في 20 مل من متوسط MAA مع 20٪ FCS.
- بعد 24 ساعة ، جهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق عند 4 درجاتمئوية ، واغسله بنفس حجم PBS ، وعد باستخدام غرفة Neubauer ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق عند 4 درجاتمئوية.
5.
- شراء ذكور الهامستر الذهبي في سن 4-6 أسابيع واحتفظ بها في الحجر الصحي لمدة أسبوعين. تأكد من أن عمرهم يتراوح بين 6 و 8 أسابيع ويزن 80-100 جرام عند إصابتهم ب L. infantum MHOM / BR / 1974 / PP75.
ملاحظة: ينطبق هذا البروتوكول على كل من الهامستر من الذكور والإناث. ومع ذلك ، نظرا لتوفرها في ذلك الوقت ، تم استخدام ذكور الهامستر فقط في هذه الدراسة. - قسم الهامستر إلى أربع مجموعات: المجموعة 1 ، المصابة داخل الصفاق ب amastigote (ن = 3) ؛ المجموعة 2 ، مصابة داخل الصفاق ب promastigotes (ن = 3) ؛ المجموعة 3 ، مصابة في الوريد اللثوي ب amastigote (ن = 2) ؛ المجموعة 4 ، مصابة في الوريد اللثوي ب promastigote (ن = 2) ؛ المجموعة 5 ، الهامستر غير المصاب كعنصر تحكم (ن = 2).
- احتفظ بالحيوانات في رفوف جيدة التهوية ، ومجهزة بنظام تهوية متحكم فيه (10-15 تغيير هواء / ساعة) ، ودورة إضاءة / ظلام لمدة 12 ساعة ، عند 21 ± 2 درجةمئوية و 40-60٪ رطوبة. توفير الإثراء البيئي ، مثل الورق والتبن والقطن الكارهة للماء ولفائف الورق المقوى والمياه المعقمة والطعام المجاني.
6. العدوى عبر الطريق داخل الصفاق
- قم بتقييد الهامستر جسديا على شبكة القفص ، باستخدام الإبهام والسبابة كملقط لقرص الجلد على الظهر من الجانبين بالقرب من الرأس ، وتسحب الأصابع الأخرى الجلد على طول الظهر ، في محاولة للحصول على أكبر قدر ممكن من الجلد.
- محاذاة موقع اللقاح في الربع الأيمن السفلي للبطن مع العضلات الخلفية للفخذ.
- تلقيح مع جسم مائلة 45 درجة مئوية, الرأس أقل من البطن, والإبرة وضعت في 15 درجة إلى 20 درجة.
- تلقيح amastigotes axenic أو promastigotes ، 50 ميكرولتر (108) في PBS ، بإبرة 13 × 0.45 مم مقترنة بحقنة 1 مل. أدخل 0.5 سم خارج الشطبة. بعد إدخال الإبرة في البطن ، اسحب المكبس للتأكد من عدم إدخالها في الوريد ، وحقن السائل بعناية.
7. العدوى الوريدية عن طريق تلقيح اللثة
- كبح جماح الهامستر باتباع القسم 6. يتم تطبيق خليط من 200 ملغ/كغ من هيدروكلوريد الكيتامين 10٪ و10 ملغ/كغ من هيدروكلوريد زيلازين 2٪، الحجم النهائي 1.3 مل، داخل الصفاق في حقنة 3 مل مقترنة بإبرة 13 × 0.45 مم.
- اضغط على المخلب عن طريق تثبيت القاعدة بين الأصابع للوسادة للتأكد من تخدير.
- كبح جماح الهامستر المخدر في وضع الاستلقاء بكلتا يديك واسحب الشفة السفلية برفق باستخدام الإبهام لكشف اللثة والوريد اللثوي
- ضع إبرة أرق (8 × 0.30 مم) مقترنة بحقنة سعة 1 مل أسفل القواطع السفلية على طول الخط الأوسط بين زوج الأسنان بزاوية 25 درجة ، وأدخل 2-4 مم في الوريد الشفوي للفك السفلي.
- للتأكد من أن اللقاح كان في الوريد وأن الإبرة قد تم إدخالها في الوريد الشفوي للفك السفلي ، قم بشفط الدم حتى برميل الإبرة (الجزء الأصفر).
- قم بحقن لقاح 50 ميكرولتر (10 ،8) ، ببطء وحذر ، في PBS ، على مدى 1 دقيقة ، حتى يتم تلقيح الحجم بالكامل لتجنب تسرب اللقاح والدم من الوريد إلى البيئة الخارجية ، والسماح بالتشتت في مجرى الدم.
- قبل إزالة الإبرة ، ضع ضغطا خفيفا باستخدام قطعة قطن. في الوقت نفسه ، قم بإزالة الإبرة من الوعاء عن طريق الاحتفاظ بقطعة قطن لتعزيز الإرقاء في الموقع ، والضغط الخفيف لمدة 1 دقيقة لتجنب النزيف وفقدان اللقاح
8. القتل الرحيم عن طريق البزل القلبي
- كبح جماح للتخدير ، كما هو موضح في القسم 7. قم بإجراء ثقب القلب بإبرة 20 × 0.55 مم مقترنة بحقنة سعة 5 مل ، يتم إدخالها بزاوية 45 درجة ومائلة قليلا إلى اليسار ، أسفل الغضروف الخنجري مباشرة.
- سحب 1 مل من الدم. بعد جمع الدم النهائي ، قم بإزالة المحقنة مع الحفاظ على الإبرة في القلب.
- إذا كان يتنفس بالفعل ويظهر نبضات قلب، فقم بإعطاء ثيوبنتال الصوديوم 5٪ (200 ملغم/كجم) بحقنة سعة 5 مل وقم بإقرانها بإبرة 20 × 0.55 مم الموجودة بالفعل في القلب.
- بعد 5 دقائق ، باستخدام سماعة الطبيب ، تحقق مما إذا كانت هناك أي حركات تنفسية ونبضات قلب.
9. استخراج الحمض النووي من الأعضاء والأنسجة
- بعد القتل الرحيم ، اجمع الطحال والغدد الليمفاوية المساريقية وشظايا الكبد.
- قطع الأنسجة عن طريق التجميد على الثلج الجاف والذوبان والقطع بشفرتين من مشرط. هضم 20 مجم من الأنسجة المفرومة في 600 ميكرولتر من محلول التحلل مع 17.5 ميكرولتر من البروتيناز K (20 مجم / مل) واحتضانه عند 55 درجة مئوية طوال الليل.
- جهاز طرد مركزي عند 15,000 × جم لمدة 4 دقائق لإزالة شظايا الأنسجة غير المحللة.
- أضف 200 ميكرولتر من محلول ترسيب البروتين ، واخلطه بقوة لمدة 20 ثانية ، واحتضنه لمدة 5 دقائق على الثلج ، وجهاز الطرد المركزي عند 15,000 × جم لمدة 4 دقائق.
- انقل المادة الطافية إلى أنبوب آخر ، وأضف 600 ميكرولتر من الأيزوبروبانول ، واخلطها برفق حتى ترسيب الحمض النووي. الطرد المركزي الحمض النووي عند 15,000 × غرام لمدة دقيقتين, وغسل الحبيبات مع 70٪ الإيثانول لمدة 30 دقيقة في شاكر إمالة وجهاز طرد مركزي.
- تخلص من الإيثانول وجفف الحبيبات في درجة حرارة الغرفة. أعد ترطيب الحمض النووي ب 50-200 ميكرولتر من الماء فائق النقاء عند 65 درجة مئوية لمدة 30 دقيقة ، وحدد كمية الحمض النووي وتخفيفه إلى 0.1 ميكروغرام / مل وقم بتخزينه عند -20 درجة مئوية.
10. تقييم العدوى في الأنسجة والأعضاء بواسطة تفاعل البوليميراز المتسلسل
- تقييم حمل الطفيليات في الحمض النووي الجيني للأنسجة والأعضاء بواسطة تفاعل البوليميراز المتسلسل التقليدي: 2.5 ميكرولتر من عازلة تفاعل البوليميراز المتسلسل ، 1.5 ملي مولار MgSO4 ، 0,2 ملي مولار dNTP ، 1 وحدة من بوليميراز الحمض النووي ، 300 نانوغرام من الحمض النووي الجيني ، 0.2 ميكرومتر من كل برايمر ، وماء خال من النوكلياز إلى حجم نهائي 25 ميكرولتر.
- تضخيم باستخدام بروتوكول L. infantum kDNA18: دورة واحدة من التمسخ عند 94 درجة مئوية لمدة دقيقتين ؛ 39 دورة تضخيم ، 30 ثانية عند 94 درجة مئوية ، 15 ثانية عند 60 درجة مئوية ، 30 ثانية عند 72 درجة مئوية ، تمديد نهائي لمدة 5 دقائق عند 72 درجة مئوية. الحجم المتوقع لمنتج تفاعل البوليميراز المتسلسل هو 145 نقطة أساس. (1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGGTAGG-3'; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- تضخيم الهامستر GAP DH ، التحكم الذاتي ل PCR3: دورة واحدة من التمسخ عند 94 درجة مئوية لمدة دقيقتين ، 39 دورة تضخيم ، 30 ثانية عند 94 درجة مئوية ، 15 ثانية عند 58 درجة مئوية ، 30 ثانية عند 72 درجة مئوية ، التمديد النهائي لمدة 5 دقائق عند 72 درجة مئوية. (1) Fw GAPDH الهامستر 5'- GGTTGCCAAACCTTATCAGAAATG-3 '؛ (2) Rv GAPDH الهامستر 5'- TTCACCTGTTCCACACACCCTTG -3'.
- تحليل منتجات PCR عن طريق الرحلان الكهربائي لهلام الاغاروز بنسبة 1٪.
11. متابعة الهامستر عن طريق التصوير الحيوي في الجسم الحي
- تقييم تطور العدوى بمرور الوقت عن طريق انبعاث التلألؤ البيولوجي للحيوان بأكمله في نظام التصوير الحيوي في الجسم الحي ، والذي يتكون من كاميرا مبردة مقترنة بالشحن (CCD) مثبتة على غرفة محكمة الضوء. حافظ على تخدير أثناء الحصول على الصورة من خلال توصيل مخروط الأنف.
- قبل اكتساب التلألؤ البيولوجي و 5 دقائق قبل تحفيز التخدير ، قم بحقن D-luciferin (150 مجم / كجم) داخل الصفاق في الهامستر باتباع القسم 6. قم بإعداد محلول مرق ملح البوتاسيوم D-luciferin 15 مجم / مل في PBS ، وتعقيمه بالترشيح ، وتخزينه في درجة حرارة -80 درجةمئوية.
- بعد خمس دقائق من حقن ب D-luciferin ، قم بتخديرها بنسبة 2٪ من الأيزوفلوران في غرفة تحريض غنية بالأكسجين. بعد 5 دقائق أخرى ، التقط صورا للتلألؤ البيولوجي باستخدام كاميرا CCD. الحصول على صور للهامستر في الوضع البطني بعد 2 ساعة و 24 ساعة بعد الإصابة ، بعد 8 و 22 يوما من الإصابة (نقطة في البوصة).
ملاحظة: حافظ على التخدير أثناء عملية التصوير باستخدام جهاز توصيل الأكسجين المتساوي فلور. - بناء على مستوى انبعاث التلألؤ البيولوجي ، استخدم المعلمات التالية: وقت التعرض ، الذي يتراوح من 30 ثانية إلى 5 دقائق ، Binning متوسط أو كبير ، f / stop 1 ومجال الرؤية D (12 ، 5 سم).
12. القياس الكمي للتلألؤ البيولوجي في المصابة ب L. infantum- Luc
- استخدم أداة القياس اليدوي لتحديد مناطق الاهتمام (ROI) والحجم والمساحة في رأس وجسم. تحديد التلألؤ البيولوجي الذي حصلت عليه كاميرا CCD في عائد الاستثمار المحدد.
- قم بقياس إشارة الخلفية بمتوسط عائد الاستثمار في الخلفية واطرح من انبعاث الإضاءة الحيوية التي تم الحصول عليها من عائد الاستثمار اليدوي.
- التعبير عن انبعاث التلألؤ البيولوجي في الإشعاع ، وهي وحدة طبيعية حسب الوقت والمساحة: photons.sec-1.cm-2.sr-1
النتائج
التعبير المستقر عن لوسيفيراز في L. infantum
تم إنتاج L . infantum المعدل وراثيا باستخدام بلازميد خط pLEXSY ، والذي يندمج في جينوم الليشمانيا في موضع الريبوسومات الريبوزي 18S rRNA (ssu) ، والذي يتم نسخه بواسطة بوليميراز الحمض النووي الريبي I. وهكذا ، L . infantum-Luc تم تقييم استنساخ البلازميد في جينوم الليشمانيا ، وللتعبير المستقر عن طريق انبعاث التلألؤ البيولوجي في المختبر. تم اختيار الاستنساخ عالي التعبير الذي يعرض تلألؤ حيوي >120 ضعفا فوق الخلفية لتقييم التكامل الجيني بواسطة تفاعل البوليميراز المتسلسل (PCR). انظر الشكل 1 للاطلاع على الرحلان الكهربائي لهلام الاغاروز لمنتجات تفاعل البوليميراز المتسلسل لتقييم تكامل البلازميد في الجينوم وانبعاث التلألؤ الحيوي (RLU) من promastigotes من L. infantum-Luc استنساخ. تم الحصول على أجزاء من الحجم المتوقع من كل تفاعل البوليميراز المتسلسل ؛ منتج واحد يبلغ حوالي 1,1 كيلو بايت (5'ssu - utr1) ، وآخر من 1.8 كيلو بايت (hyg- 3'ssu) تم تضخيمه من جينوم L. infantum- Luc (الشكل 1 أ) ، مما يؤكد تكامل كاسيت البلازميد وجين لوسيفيراز في موضع ssu ل L. infantum الجينوم.
تم تقييم تعبير لوسيفيراز اليراع أيضا في promastigotes من L. infantum-Luc عن طريق انبعاث التلألؤ البيولوجي (RLU) في قارئ الصفيحة الدقيقة ، كما هو موضح في البروتوكولات ، القسم 2. حتى بعد عدة مقاطع في الثقافة وفي الفئران BALB / c لمدة 5 أيام ، حافظت على مستوى التلألؤ البيولوجي. 569.3 ± 19.5 للخلفية من النوع البري ، و 59361.9 ± 2673.3 (ن = 2) للمستنسخة L. infantum- Luc (الشكل 1 ب). وهكذا ، تم استخدام استنساخ L. infantum-Luc الذي يعبر بثبات عن لوسيفيراز اليراع ، لإصابة الهامستر عبر الطرق داخل اللثة أو داخل الصفاق.
اللقاح الوريدي في الوريد اللثوي
لتلقيح الليشمانيا في مجرى دم الهامستر ، يجب توخي الحذر لتقليل ثقب الوريد والنزيف وتسرب اللقاح. وبالتالي ، يجب سحب الشفة السفلية برفق لفضح الوريد اللثوي (الشكل 2 أ) ؛ ويجب استخدام إبرة أصغر بمقياس 30 جم لتجنب الانثقاب المفرط للوريد. يجب وضع الإبرة بحيث يكون الإطار متجها لأعلى لإدخاله في الوريد بزاوية مناسبة (الشكل 2 ب). في الواقع ، للتأكد من حقن الإبرة في الوعاء الدموي - الوريد الشفوي الفكي السفلي ، يجب سحب مكبس المحقنة لأسفل حتى يتم شفط الدم في برميل الإبرة (الشكل 2 ج). قبل إزالة الإبرة ، يجب تطبيق ضغط خفيف باستخدام قطعة قطن لتعزيز الإرقاء (الشكل 2 د).
التقييم الطولي عن طريق التصوير الحيوي
تمت متابعة الهامستر المصاب داخل الصفاق (IP) أو عن طريق اللثة (IG) مع L. infantum-Luc حتى 50نقطة في البوصة وتم تقييمها عن طريق التصوير الحيوي حتى 22 نقطة في البوصة (الشكل 3). تم الحصول على الصور بعد ساعتين من العدوى داخل الصفاق مع 108 طفيليات في التجويف البريتوني; تم الحصول على الصور لمدة 30 ثانية أو 1 دقيقة من وسط تجميع العرض. كانت إشارة التلألؤ البيولوجي أكثر كثافة >65 ضعفا في البطن في المصابة ب amastigote (4.6 × 105 ± 3.7 × 105) من تلك المصابة بالبروماستيجوت (6.8 × 103 ± 3.8 × 103) (الجدول 1) ، مما يوضح أن amastigotes المتمايزة في المختبر تكون أكثر إضاءة بيولوجية من promastigotes metacyclic في المرحلة الثابتة ويتم تنقيتها في وسادة Ficoll.
بعد يوم واحد من الإصابة (1 نقطة في البوصة) ، تم الحصول على صور التلألؤ البيولوجي لمدة 3 دقائق من العرض (الشكل 3). كان هناك انخفاض بنسبة 45٪ في إشارة التلألؤ الحيوي في منطقة البطن في الهامستر المصاب بالبروماستيجوت و 70٪ تسوس في الهامستر المصاب بالبروماستيجوت (الشكل 3) ، مما يشير إلى أن الماساستيجوت قد تدهورت إلى حد أكبر من الهامستر الحلقي (الجدول 1 والشكل 4). بعد أسبوع واحد من الإصابة (8 نقطة في البوصة) ، حافظت المصابة بالبروماستيجوت على إشارة التلألؤ الأحيائي (3.3 × 103 ± 5 × 103). ومع ذلك ، انخفض انبعاث التلألؤ البيولوجي في الهامستر المصاب ب amastigote بنسبة 95٪ ، من 1.3 × 105 ± 1.1 × 105 إلى 6.7 × 103 ± 7.5 × 103 (الجدول 1) ووصل إلى نفس المستوى من الهامستر المصاب بالبروماستيجوت. بعد ثلاثة أسابيع من الإصابة (22 نقطة في البوصة) ، تم الحصول على إشارة تلألؤ بيولوجي لمدة 5 دقائق من العرض والتجميع الكبير (الشكل 3) ؛ كانت الإشارة أقل بكثير بالنسبة للحيوانات المصابة بالماسستيجوت المصابة بالأماستيجوت (الجدول 1 والشكل 4).
أصيبت مجموعة أخرى من الهامستر عن طريق داخل اللثة ب amastigotes و promastigotes من L. infantum-Luc (10، 8). لوحظ انبعاث التلألؤ البيولوجي في منطقة الفك العلوي (الشكل 3). بدأت المتابعة بعد يوم واحد من الإصابة ، وأظهر الهامستر المصاب ب amastigote إشارة وإشراق بيولوجيا (7.3 × 103 ± 4.1 × 103) من الهامستر المصاب بالبروماستيجوت (1 × 103 ± 5.7 × 102). بعد أسبوع واحد من الإصابة (8 نقاط في البوصة) ، لوحظ انخفاض بنسبة 36٪ في إشارة التلألؤ الأحيائي في المصابة بالبروماتسيجوت و 90٪ في الهامستر المصاب بالاماستيغوت. تراوحت الإشعاعات من 7.3 × 103 ± 4.1 × 103 إلى 7.8 × 102 ± 5.6 × 102 (الجدول 1). بعد ثلاثة أسابيع من الإصابة (22 نقطة في البوصة) ، تم أيضا الحصول على إشارة تلألؤ بيولوجي لمدة 5 دقائق من العرض والتجميع الكبير (الشكل 3). كانت إشارة التلألؤ البيولوجي متشابهة ومنخفضة للحيوانات المصابة بالبروماستيجوت المصابة باللثة (الجدول 1 والشكل 4) في رأس المصابة في اللثة ولم يلاحظ تشتت العدوى في منطقة البطن عن طريق إشارة التلألؤ البيولوجي.
تقييم العدوى في الأنسجة والأعضاء عن طريق تفاعل البوليميراز المتسلسل
أجرينا تفاعل البوليميراز المتسلسل التقليدي للتحقيق في العدوى في أعضاء معينة ، مثل الكبد والطحال والغدد الليمفاوية ، والتي يمكن أن تكون أقل من حد الكشف عن التصوير في الجسم الحي. كانت المنطقة المستهدفة من kDNA أكثر تحديدا لتضخيم الحمض النووي L. infantum في الأنسجة والأعضاء المصابة ، وكان تفاعل البوليميراز المتسلسل لإنزيم GAPDH من الهامستر هو التحكم في سلامة الحمض النووي وتفاعل تفاعل تفاعل البوليميراز المتسلسل . تم النظر فقط في العينات التي تم تضخيمها من أجل GAPDH في التحليل. وهكذا ، عن طريق تفاعل البوليميراز المتسلسل ، أظهر اثنان من ثلاثة هامستر مصابين عبر الطريق داخل الصفاق ب amastigotes axenic عدوى في الأنسجة والأعضاء. الثاني (A2) في الطحال الثالث (A3) في الكبد ، بدقة 50 نقطة في البوصة (الشكل 5 أ). أصيب أحد الهامستر داخل الصفاق ببرومستيجوت محوري. أظهر الثالث (A3) (الشكل 5 ب) تضخيما في العقدة الليمفاوية. لم تستطع الهامستر التي تم تلقيحها داخل اللثة باستخدام promastigotes أو amastigotes axenic عند 50 نقطة في البوصة إظهار تضخيم واضح - مجرد شريط في كبد واحد (A1) مصاب بpromastigotes (الشكل 5C). والجدير بالذكر أنه كان لدينا ثلاثة تم الاحتفاظ بها لمدة 8 أشهر تسربت لقاحها بالطريق داخل اللثة مع amastigotes بشكل طفيف أثناء الحقن. أظهر اثنان من ثلاثة عدوى واضحة في الكبد ، واحدة واثنتان (الشكل 5 د).
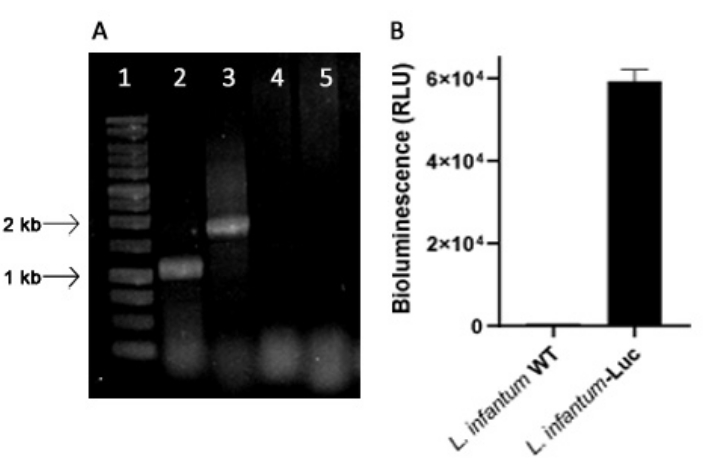
الشكل 1: تقييم استنساخ Leishmania infantum-Luc عن طريق تفاعل البوليميراز المتسلسل وانبعاث التلألؤ البيولوجي. (أ) الرحلان الكهربائي لجل الاغاروز لمنتجات تفاعل البوليميراز المتسلسل لتقييم تكامل البلازميد في الجينوم: سلم الحمض النووي 1 - 1 كيلو بايت؛ تفاعل البوليميراز المتسلسل ل L. infantum-Luc الحمض النووي الجيني ، حارة 2 - 5'ssu - utr1 (1.1 كيلو بايت) والممر 3- hyg- 3'ssu (1.8 كيلو بايت) ؛ تفاعل البوليميراز المتسلسل من L. infantum-wt الحمض النووي الجيني ، الممرات 4 و 5. (ب) انبعاث التلألؤ البيولوجي (RLU) من promastigotes من L. infantum-Luc استنساخ (106) في قارئ الصفيحة الدقيقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: حقن الليشمانيا الإنفانتوم لوك في الوريد الوريدي. (أ) وضع الهامستر في الاستلقاء الظهري، وتم سحب الشفة السفلية لأسفل. (ب) تم وضع إبرة أرق (8 × 0.30 مم) مقترنة بحقنة سعة 1 مل أسفل القواطع السفلية على طول الخط الأوسط بين زوج الأسنان بزاوية 25 درجة وتم إدخالها 2-4 مم في الوريد الشفوي السفلي. (ج) تلقيح 50 ميكرولتر (108) من الماستيجوت أو البروماستيجوت في PBS. (د) الإرقاء باستخدام قطعة قطن والضغط الخفيف على موقع التلقيح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
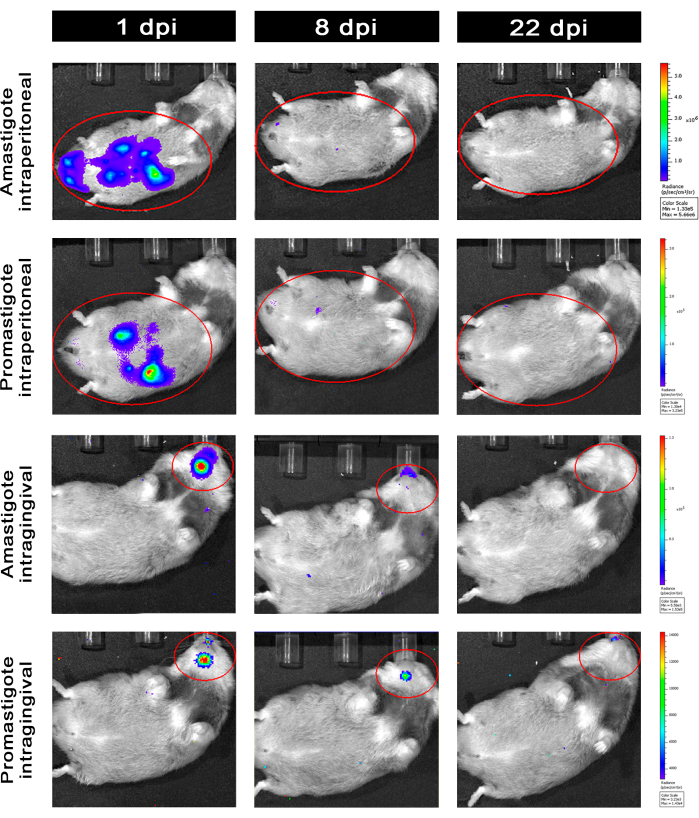
الشكل 3: متابعة التصوير الحيوي في الجسم الحي . صور تمثيلية لحيوان واحد لكل مجموعة: مصابة عن طريق داخل الصفاق (الألواح العلوية) أو داخل اللثة (الألواح السفلية) ، مع amastigotes أو promastigotes من L. infantum-Luc ، ل 1 و 8 و 22 نقطة في البوصة. عائد الاستثمار الأحمر الذي يمثل المناطق التي تم فحصها في البطن والرأس ، للعدوى داخل الصفاق أو داخل اللثة ، على التوالي. تظهر البيانات أنه عند 1 نقطة في البوصة ، أظهرت جميع إشارة تلألؤ بيولوجي في البطن أو الفك السفلي. كانت الإشارة تنخفض بعد 8 نقاط في البوصة ولم يكن من الممكن اكتشافها تقريبا في أي مجموعة عند 22 نقطة في البوصة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
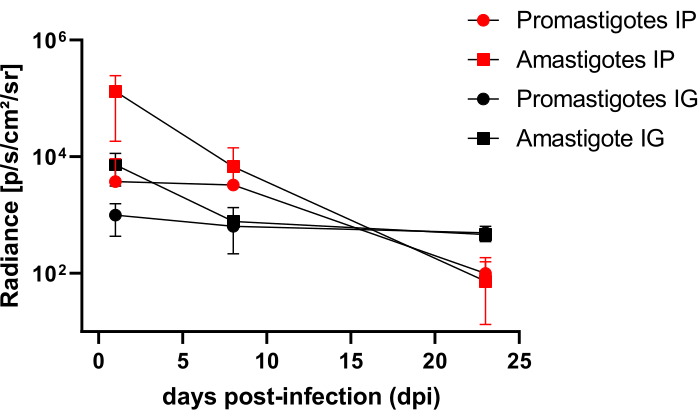
الشكل 4: تحليل مقارن للإشراق من صور التلألؤ البيولوجي. تم إجراء فوتونات القياس الكمي للإشعاع.sec-1.cm-2.sr-1 في بطن أو رأس الهامستر باستخدام أدوات قياس عائد الاستثمار اليدوية. تم طرح متوسط عائد الاستثمار في الخلفية من عائد الاستثمار للقياس لإزالة أي إشارة زائفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
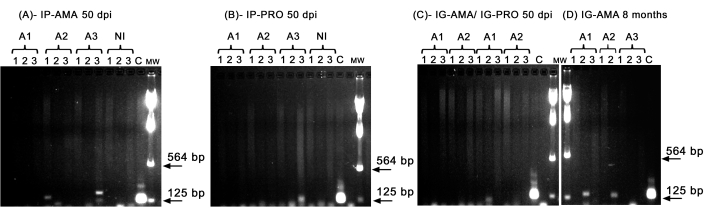
الشكل 5: تضخيم تفاعل البوليميراز المتسلسل ل kDNA. (أ) IP-AMA ، الهامستر المصاب عبر الطريق داخل الصفاق مع amastigote ، 50 نقطة في البوصة (ن = 3) ؛ (ب) IP-PRO، المصاب عن طريق الطريق داخل الصفاق ببروماتيجوت البروماتيجوت، 50 نقطة في البوصة (العدد = 3)؛ (ج) IG-AMA ، مصاب عن طريق داخل اللثة ب amastigote (ن = 2) ، IG-PRO ، مصاب عن طريق داخل اللثة ب promastigote (ن = 2) ؛ (د) IG-AMA ، مصاب عن طريق داخل اللثة ب amastigote ، بعد 8 أشهر من الإصابة (ن = 3). NI ، الهامستر غير المصاب كتحكم سلبي (ن = 2) ؛ C- الحمض النووي الجيني ل L. infantum-Luc ، التحكم الإيجابي في تفاعل البوليميراز المتسلسل (PCR). الأنسجة والأعضاء: 1- الطحال ، 2- الكبد ، 3- الغدد الليمفاوية. MW- علامة الوزن الجزيئي ، تشير الأسهم إلى نطاقات الوزن الجزيئي المنخفضة. A1- الأول، A2- الثاني، A3- الثالث. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| البوصه | Amastigotes IP | Promastigotes IP | Amastigotes IG | Promastigotes IG | ||||||||
| دني | [سد] | N | دني | [سد] | N | دني | [سد] | N | دني | [سد] | N | |
| 0 | 4.6 س 105 | 3.7 س 105 | 3 | 6.8 س 103 | 3.8 س 103 | 3 | - | - | - | - | - | - |
| 1 | 1.3 س 105 | 1.1 س 105 | 3 | 3.8 س 103 | 5.5 س 103 | 3 | 7.3 س 103 | 4.1 س 103 | 2 | 1.0 س 103 | 5.7 س 102 | 2 |
| 8 | 6.7 س 103 | 7.5 س 103 | 3 | 3.3 س 103 | 5.0 س 103 | 3 | 7.8 س 102 | 5.6 س 102 | 2 | 6.4 س 102 | 8.2 س 101 | 2 |
| 22 | 7.3 س 101 | 8.5 س 101 | 3 | 9.9 س 101 | 8.6 س 101 | 3 | 4.6 س 102 | 7.5 س 101 | 2 | 5.0 س 102 | 1.5 س 102 | 2 |
الجدول 1: البيانات الأولية من تحليل الإشعاع المقارن لصور التلألؤ الحيوي. متوسط القياس الكمي للإشعاع photons.sec-1.cm-2.sr-1 حسب المجموعة والمسار. الاختصارات: نقطة في البوصة = أيام بعد الإصابة. SD = الانحراف المعياري ؛ N = حجم العينة.
Discussion
يعد جمع الدم أو حقن المواد في الوريد في الهامستر أمرا ضروريا لمختلف الدراسات العلمية. تم تطوير عدة طرق للوصول إلى طرق التجميع أو التلقيح المختلفة المرتبطة مباشرة بأهداف البحث19. بسبب تشريح الهامستر - الذيل القصير والأطراف - عادة ما يكون الطريق داخل القلب هو الخيار للحقن الوريدي لمرض الليشمانيا. اعتمادا على السلالة المستخدمة ، أثبت المسار داخل القلب أنه مفيد مثل السلالة المرجعية L. infantum MHOM / BR / 1974 / PP75 ، التي تحدث العدوى على المدى الطويل ، 6-9 أشهر5. ومع ذلك ، فهو لقاح يمكن أن يؤدي إلى نزيف وموت. وبالتالي ، قمنا بتوحيد طريق تلقيح بديل عن طريق الوريد للعدوى في الضفيرة اللثوية ، الوريد الشفوي الفكي السفلي ، والذي يسبب ضررا أقل للحيوان. أصيبت بالسلالة المرجعية المعدلة وراثيا L. infantum MHOM / BR / 1974 / PP75 ، والتي عبرت بثبات عن لوسيفيراز اليراع حتى بعد عدة مقاطع في الثقافة والفئران (الشكل 1) ، كما هو مرتبط بأنواع الليشمانيا الأخرى المنقولة بواسطة نفس البلازميد التكاملي20.
يعد الوريد الشفوي الفكي السفلي أو الوريد اللثوي طريقا أفضل لأخذ عينات الدم ، ولجمع الدم المتعدد10،11. ومع ذلك ، هذا هو أول دليل على أن الوريد اللثوي هو موقع ممكن للعدوى الوريدية بالليشمانيا في الهامستر. على عكس أخذ عينات الدم التي تستخدم عادة إبرة عالية القياس 26 جم لتجنب انحلال الدم10 ، لم يكن مقياس الإبرة هذا مناسبا لتلقيح الليشمانيا ، بسبب ثقب الوريد والنزيف وتسرب اللقاح. بالنسبة لعدوى الليشمانيا عن طريق الوريد الفكي السفلي الفكي العلوي ، كان من الضروري استخدام إبرة أصغر بمقياس 30G. جانب آخر يميز ثقب الوريد إلى العدوى عن طريق الوريد اللثوي هو معدل الإعطاء ، بحوالي 1 ميكرولتر / ثانية. وللتأكد من أنه يتم حقنه في الوريد الشفوي الفكي السفلي ، ولا يستقر في الغشاء المخاطي ، تحت الجلد أو داخل الأدمة. نظرا لانخفاض دوران الدم في الضفيرة اللثوية ، كان لابد من تلقيح 50 ميكرولتر من لقاح عالي الكثافة من الأكسينيك أو promastigotes من L. infantum-Luc ، 2 × 109 طفيليات / مل ، ببطء (~ 1 دقيقة) ، ويجب إزالة الإبرة عن طريق إبقاء المسحة مضغوطة لمدة دقيقة واحدة للسماح بتشتت اللقاح في مجرى الدم (الشكل 2).
للتقييم الطولي للعدوى ، أصيب الهامستر داخل الصفاق (IP) أو عبر الطريق داخل اللثة (IG) باستخدام L. infantum-Luc وتمت متابعتها لمدة 50 نقطة في البوصة بواسطة نظام التصوير الحيوي حتى القتل الرحيم. وبالنظر إلى أن السلالة المرجعية PP75 يمكن أن تكون أقل ضراوة في حد ذاتها وأن التعبير الفائق عن اللوسيفيراز يمكن أن يؤثر أيضا على فعالية العدوى ويحافظ على العدوى على المدى الطويل، فقد استخدم لقاح عال من 108 طفيليات للعدوى. بعد تلقيح اللثة لكل من amastigotes و promastigotes من L. infantum-Luc والتقييم بواسطة نظام التصوير التلألؤ البيولوجي ، اقتصر التلألؤ البيولوجي على المنطقة الفكية للهامستر بعد 24 ساعة من الإصابة. في الواقع ، أظهر الهامستر المصاب داخل الصفاق ب amastigotes و promastigotes من L. infantum-Luc تلألؤ بيولوجيا مشتتا في جميع أنحاء البطن (الشكل 3 ، 1 نقطة في البوصة). كان الانخفاض المستمر في انبعاث الإضاءة الحيوية على طول الوقت ، من اليوم الأول للإصابةحتى اليوم الثامن وحتى 22نقطة في البوصة في الهامستر المصاب ب L. infantum-Luc ، كان مستقلا عن طريق التلقيح (الجدول 1 والشكل 4).
ومع ذلك ، عندما يكون عبء الطفيليات في الأنسجة الحيوانية منخفضا ، يمكن أن يكون أقل من حد الكشف عن نظام التصوير الحيوي ولكن يمكن اكتشافه وقياسه كميا عن طريق تفاعل البوليميراز المتسلسل أو qPCR. كما ذكرنا بالفعل ، فإن العدوى التي تسببها سلالة PP75 أقل بالفعل من تلك الموجودة في السلالات الأخرى5 ، ولم تظهر سوى عدد قليل من العلامات السريرية للمرض بسبب التباين الجيني للحيوانات. في هذه الدراسة ، على الرغم من قلة عدد وانخفاض ضراوة هذه السلالة ، أظهرت الآماستيجوت المحورية ميزة عند 50 نقطة في البوصة ، مما يدل على عدوى أفضل من promastigotes ، كما يتضح من تفاعل البوليميراز المتسلسل (الشكل 5). بعد ثمانية أشهر من الإصابة ب amastigotes عبر طريق اللثة ، يمكن اكتشاف الطفيليات عن طريق تفاعل البوليميراز المتسلسل في الكبد (الشكل 5) كما أظهرت انتصابا معتدلا ، وضيقا مداريا ، ووضعية مقوسة.
يمكن أن تكون الأكسينيك الآماستيجوت خيارا أفضل للعدوى والمتابعة من promastigotes21 وتتميز بأنها سهلة الإنتاج على نطاق واسع. لقاح اللثة ممكن وطريق أفضل للتلقيح الوريدي للمركبات وعدوى الليشمانيا ومسببات الأمراض الأخرى ، دون تلف أو تورم في موقع التطبيق في الفك السفلي أو لصحة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. قدمت PPSUS / Decit-MS / CNPq / SES الدعم المالي لهذا البحث. شكرا لمونيك ريبيرو دي ليما على نصيحتها حول طرق التلقيح. تم تطوير هذا المشروع بموجب اتفاقية التعاون No 258/2017 بين FIOCRUZ, والجامعة الفيدرالية في ريو دي جانيرو- UFRJ. يعرب الفريق عن امتنانه الصادق لمنتجي الفيديو ريكاردو بابتيستا شميدت وجينيلتون خوسيه فييرا من مركز تعميم العلوم (IOC) لدعمهم ومساعدتهم التي لا تقدر بثمن في تصوير البروتوكولات وإجراء المقابلات.
Materials
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
References
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved