Method Article
생체 내 루시페라아제를 발현하는 Axenic Amastigotes의 치은 접종에 의한 Leishmania infantum-infected Hamsters의 이미징
요약
여기에서는 생물 발광 이미징 및 PCR에 의해 L. infantum-Luc에 복강내(IP) 또는 치은내(IG)를 통해 감염된 골든 햄스터에 대한 종단 평가를 제시합니다. 햄스터는 감염 후 1일(1dpi), 감염 1주일(8dpi), 감염 후 3주(22dpi)에 평가를 받고 50번째 dpi와 감염 후 8개월에 안락사시켰다.
초록
미국 피막성 리슈마니아증(ATL)과 내장 리슈마니아증(VL)은 세계보건기구(WHO)에서 무시하는 것으로 간주됩니다. VL은 치료하지 않으면 치명적일 수 있습니다. 치료에 사용되는 약물은 독성이 있으며 내성이 있는 경우가 있습니다. 전임상 검사는 동물 모델, 사용된 균주 및 접종 경로에 따라 치료를 위한 새로운 약물을 발견하는 데 병목 현상이 발생할 수 있습니다. 황금 햄스터는 아속 Viannia 및 Leishmania 종에 대한 높은 감수성으로 두드러지며 인간 질병에서 관찰되는 많은 임상 및 면역 병리학적 과정을 보여줍니다.
짧은 꼬리와 팔다리를 가진 햄스터의 해부학적 구조에 의해, 심장 내 경로는 일반적으로 리슈마니아의 정맥 주사를 위해 선택됩니다. 그러나 출혈을 일으키고 결국 동물을 죽일 수 있는 예방 접종입니다. 따라서, 우리는 치은 정맥 감염에 대한 대체 정맥 접종 경로를 표준화했는데, 이는 최소 침습적이고, 정맥에 쉽게 접근할 수 있으며, 동물에게 국소 및 전신 부상을 거의 일으키지 않습니다. 따라서 루시퍼라아제(Luc)를 발현하는 리슈마니아 인판툼(Leishmania Infantum )에 복강내(IP) 또는 치은내(IG) 경로에 감염된 햄스터를 생물발광 이미징 시스템으로 22일, 감염 후 50일 및 8개월 동안 PCR로 추적했습니다.
L. infantum-Luc의 axenic amastigotes와 promastigotes에 대한 치은 접종 후, 치은총총 주변 조직의 감염 지표인 주사 부위에서 최소 2주 동안 생물 발광이 제한되었습니다. 복강내에서 L. infantum-Luc에 감염된 햄스터는 예상대로 복부 전체에 분산된 생물 발광을 보였다. 그러나 생물 발광 이미징 시스템에 의해 감염은 50dpi까지 감소했으며 PCR로만 감지할 수 있었습니다. PCR로 평가한 바에 따르면, Axenic amastigotes는 promastigotes보다 더 나은 감염을 보였다. 실제로, 감염 후 8개월 후, 정맥 주사를 통해 axenic amastigotes를 접종한 동물의 간에서 PCR에 의해 기생충이 검출되었는데, 이는 감염이 천천히 진행되고 생물 발광 이미징 해상도 이하로 낮은 기생충 부담을 보이는 L. infantum MHOM/BR/1974/PP75의 참조 균주의 특징일 수 있습니다. 따라서, axenic amastigotes는 promastigotes보다 감염 및 추적 관찰에 더 나은 선택이 될 수 있으며, 치은 접종은 Leishmania 및 기타 병원체의 정맥 주사를 위한 실현 가능한 경로입니다.
서문
리슈마니아증은 20종 이상의 리슈마니아에 의해 유발되는 방치되고 재출현하는 질병으로 간주되며, 라틴 아메리카, 북아프리카 및 동아프리카, 서아시아 및 동남아시아의 4개 중앙 생태 역학 지역의 여러 국가에서 풍토병입니다1. 이 질환은 피막증(TL)과 내장 리슈마니아증(VL)으로 분류할 수 있으며, 이는 치료하지 않으면 치명적입니다. 브라질에서 VL의 병인제는 Leishmania infantum이며, 치료는 5가 안티몬 또는 Amphotericin B를 사용하여 수행됩니다. 이러한 약물은 정맥 주사로 투여되며 독성이 높고 부작용이 나타나며 내성이 있는 경우가 있습니다2.
따라서 새로운 화학 요법을 찾는 데 투자해야 합니다. 전임상 검사는 실제로 동물 모델, 사용된 균주, 접종 경로 및 기타 물류적, 기술적, 운영적 요인에 따라 VL 치료를 위한 신약 발견에 병목 현상이 발생합니다. 황금 햄스터는 Viannia 및 Leishmania 아속 종에 대한 높은 감수성으로 두드러지며, Leishmania braziliensis에 대한 이전 연구에서 관찰 된 바와 같이 인간 질병에서 관찰 된 많은 임상 및 면역 병리학 적 과정을 보여줍니다 3,4. L. infantum에 감염된 햄스터는 또한 빈혈, 백혈구 감소증, 혈소판 감소증, 간비장 비대와 같은 인간과 개5에서 VL의 특징적인 면역병리학적 과정의 대부분을 발병합니다. 또한, 황금햄스터는 근친교배동물로 균일한 반응을 보이지 않아 인간에서 볼 수 있는 임상적 양상의 이질성을 재현한다3.
감염 결과에 대해 고려해야 할 또 다른 측면은 L. infantum 균주와 접종 경로입니다. L. infantum의 여러 균주는 유전적 배경과 치료에 대한 감수성이 다릅니다 2,6,7. 일부 균주는 promastigotes 감염후 간과 비장의 기생 부하가 낮으며, 8 axenic amastigotes는 많이 연구되지 않은 감염을 개선하기 위한 대안이 될 수 있습니다. 실제로, 정맥 주사 경로는 감염을 촉진하고 임상 징후가 있는 동물의 빈도를 증가시킵니다. 그러나 복강내 접종이 가장 많이 사용됩니다. 심장 내 경로는 L. infantum 5,8,9에 의한 정맥 내 감염을 위한 선택입니다. 그러나 햄스터의 경우, 치은내 접종은 감염 부위로 설명되지 않은 정맥 주사의 대체 경로입니다. 보고된 바에도 불구하고, 치은 정맥 천자는 최소 침습적이고, 정맥에 쉽게 접근할 수 있으며, 국소 및 전신 손상을 거의 일으키지 않는다10. 치은정맥 천자는 동물의 복지를 보존하면서 결과의 질과 적용 가능성을 극대화하기 위한 권장 사항과 가장 일치한다11.
기존 방법을 사용하여 VL에 대한 화합물의 전임상 평가에는 더 많은 동물이 필요하며, 조직 병리학적 분석 및 조직 내 기생충 부하 평가를 위해 더 많은 동물을 안락사시켜야 합니다. 반면, 생물 발광 이미징 시스템은 전임상 연구를 가속화하고 동물 수를 줄일 수 있습니다. 감염된 조직의 생물 발광 부위는 몇 주 동안 동일한 동물에서 실시간으로 추적 관찰할 수 있습니다. 이 중요한 기술 도구의 표준화에 대한 여러 연구는 Trypanosoma cruzi, Leishmania spp. 및 Toxoplasma gondii 12,13,14,15에 감염된 쥐를 대상으로 한 연구에서 그 적용을 보여주었습니다. 그러나 조직 내 기생충 부담에 따라 생체 내 이미징 시스템으로는 생물 발광이 과소 감지될 수 있으며, 이를 위해서는 영향을 받는 장기의 정량적 PCR에 의한 평가가 필요합니다. 따라서 우리는 생물 발광 이미징 시스템 및 PCR의 후속 조치를 위해 골든 햄스터의 치은 정맥에서 루시페라아제를 발현하는 L. infantum의 정맥 주사를 기반으로 하는 방법론을 개발할 것을 제안합니다.
프로토콜
햄스터와 관련된 프로토콜은 Instituto Oswaldo Cruz/IOC 동물 연구 윤리 위원회(승인: CEUA/IOC L-015/2022)의 지침을 따랐습니다.
1. Firefly luciferase 유전자를 Leishmania 발현 플라스미드로 클로닝
- 플라스미드 pLEXSY-hyg2를 BglII(10 U/μL) 및 NotI(10 U/μL) 엔도뉴클레아제로 분해합니다. BglII로 먼저 분해: 50μL의 플라스미드(DNA 9μg), 30μL의 제한 효소 완충액, 3μL의 소 혈청 알부민(BSA), 3μL의 BglII 및 뉴클레아제가 없는 물을 최종 부피 300μL에 추가합니다. 37 °C에서 3 시간 동안 배양합니다.
- BamHI (10 U/μL) 및 NotI로 TOPOII/LUC 플라스미드를 분해하여 TOPOII 벡터16으로 복제된 Kozak 서열(Kozak-LUC)로 반딧불이 루시페라제 개방형 판독 프레임을 방출합니다. BamHI로 먼저 분해: 100μL의 플라스미드(DNA 8.5μg)와 30μL의 제한 효소 완충액을 혼합합니다. 3 μL의 BSA, 3 μL의 BamHI 및 뉴클레아제가 없는 물을 300 μL의 최종 부피까지. 37 °C에서 3 시간 동안 배양합니다.
- 실리카 멤브레인에서 각 플라스미드를 세척하고 DNA를 50μL의 물로 두 번 용리하여 최종 부피는 100μL입니다.
- 이전에 선형화된 pLEXSY-hyg2 및 TOPOII/LUC 플라스미드를 NotI로 이중 분해합니다. 실리카 멤브레인에서 용출된 DNA 100μL를 15μL의 완충액 D, 2μL의 NotI 및 뉴클레아제가 없는 물을 150μL의 최종 부피에 혼합합니다. 37 °C에서 1 시간 동안 배양합니다.
- Tris-acetate EDTA(TAE) 완충액으로 전기영동 후 1% 아가로스 겔에서 이중 분해 벡터(pLEXSY-hyg2)와 삽입물 Kozak-LUC를 겔 정제합니다. 메스로 ~8kb와 1.6kb의 띠를 잘라냅니다. 슬라이스의 무게를 측정하고, 1 부피의 겔에 3 부피의 완충액을 첨가하고, 50 ° C에서 배양하여 겔을 용해하고, 실리카 멤브레인으로 옮기고, DNA를 20 μL의 물로 두 번 세척 및 용리하며, 최종 부피는 40 μL입니다.
- 이중 분해 벡터(pLEXSY-hyg2) 및 인서트 Kozak-LUC를 T4 리가아제와 접합합니다: 2 μL의 벡터와 인서트를 모두 55 ng/μL, 1:5의 몰비로 혼합합니다. 5 μL의 결찰 완충액을 추가합니다. 1 μL의 T4 DNA 리가제(1U/mL), 최종 부피 10 μL. 16 °C에서 하룻밤 동안 배양하십시오.
- 10 μL의 ligation 반응에 40 μL의 뉴클레아제가 없는 물을 첨가하고 DNA에 10 부피의 부탄올을 침전시킵니다. 마이크로 원심분리기에서 최고 속도로 10분 동안 원심분리기를 가열하고, 펠릿을 70% 에탄올로 세척하고, 최고 속도로 10분 동안 원심분리기를 진행한 다음, 벤치에서 펠릿을 건조시킨 후 물 4μL를 추가합니다.
- 4 μL의 결찰 반응을 전기 용해성 박테리아 JM109(40 μL)와 혼합하고 혼합물을 큐벳(d = 0.2 cm)으로 옮기고 얼음 위에 보관합니다. 2,500V, 200 Ω, 25μF에서 전기천공하고 큐벳을 얼음에 넣고 1mL의 LB 배지를 추가합니다. 혼합물을 즉시 15mL 코니컬 튜브에 옮기고 37°C에서 60분 및 100rpm 동안 배양합니다.
- 혼합물을 두 개의 LB 한천/암피실린(100μg/mL) 플레이트(하나는 200μL, 다른 하나는 전기천공된 전체 박테리아)에 플레이트합니다. 형질전환된 박테리아를 2,000 × g 에서 10분 동안 원심분리하여 부피를 농축하고, 펠릿을 100 μL에 다시 현탁시키고, 전체 부피/펠릿을 플레이트에 주입합니다. 30 ° C에서 24-30 시간 동안 플레이트를 배양하고 클론이 자랄 때까지 기다립니다.
- 이쑤시개로 클론을 선택하고 5mL의 LB/암피실린(100μg/mL) 배지를 포함하는 50mL 코니컬 튜브로 옮깁니다. 30°C 및 100rpm에서 20-24시간 동안 배양하여 미니프렙 배양이 자랄 수 있도록 합니다.
- miniprep kit로 플라스미드를 정제하고 30μL의 물로 DNA를 용리합니다. BamHI를 이용한 절단에 의한 pLESXY-LUC-hyg2 구조체를 함유하는 클론 스크리닝.
- miniprep에서 10 μL의 DNA를 혼합합니다. 2 μL의 제한 효소 완충액; 0.2 μL의 BSA: 1 μL의 BamHI 및 뉴클레아제가 없는 물을 20 μL의 최종 부피로. 37°C에서 1시간 동안 배양-1% 아가로스 젤 전기영동에서 양성 클론의 단편으로 예상됨: 3,450 및 6,290 염기쌍.
- pLESXY-LUC-hyg2 구축물을 더 큰 규모로 정제하기 위해 maxiprep 배양을 준비합니다. Erlenmeyer(1L), 암피실린이 보충된 LB 배지 250mL, miniprep transfectioned JM109 1mL를 추가하고 30°C 및 200rpm에서 18-20시간 동안 배양합니다.
2. 루시페라아제를 발현하는 Leishmania infantum 의 생산 및 선정
- Leishmania 통합 카세트를 릴리스하려면 플라스미드 pLESXY-LUC-hyg2를 SwaI로 완료할 때까지 제한 소화합니다. 100 μL 최종 부피에 40 μL의 플라스미드(50 μg), 10 μL의 빠른 분해 완충액, 4 μL의 SwaI 및 뉴클레아제가 없는 물을 추가합니다. 30 °C에서 밤새 배양하십시오.
- 에탄올로 침전시키고 70% 에탄올로 한 번 세척한 다음 50μL의 물로 다시 현탁하고 얼음 위에 보관하십시오.
- 원심분리기 Leishmania MHOM/BR/1974/PP75 promastigotes를 1,000 × g 에서 10분 동안 Schneider 배지의 지수 성장 단계에서 측정합니다. 펠릿을 뇌 및 심장 주입(BHI) 배지로 세척하고 1,000×g에서 10 분 동안 원 심분리기를 합니다. BHI에서 펠릿을 108 promastigotes/mL로 다시 현탁합니다.
- L. infantum promastigotes(500μL)와 pLESXY-LUC-hyg2 통합 카세트(50μg)를 전기천공(cuvette)(d = 0.4cm)의 얼음에 혼합합니다. 1,500V/25μF 및 10초 간격의 두 펄스로 전기천공합니다. 맥박이 빨라진 후 10분 동안 얼음 위에 두십시오.
- 형질주입된 promastigotes를 26°C에서 20% FCS가 보충된 Schneider's medium이 있는 플라스크로 옮깁니다. 24시간 후 하이그로마이신 첫 50μg/mL를 첨가한 다음 48시간 후 100μg/mL, 1주일 후 150μg/mL로 증가시킵니다.
- 20% FCS 및 150μg/mL hygromycin이 보충된 Schneider's로 96웰 플레이트의 희석을 제한하여 L. infantum-Luc의 transfected promastigotes를 클론 주입했습니다. 클론 성장을 위해 26 °C에서 배양합니다.
- 스크린 클론을 통해 마이크로플레이트 리더에서 생물발광 방출 상대 발광 단위(RLU)에 의해 유전적으로 균질하고 발현성이 높은 L. infantum-Luc를 선택합니다.
- 간단히 말해서, 흰색 96웰 플레이트에 106 프로마스티고트를 25mM HEPES pH 7.8, 15mM MgCl2, 4mM EGTA, 1mM DTT, 1μg/mL BSA, 2.5mM ATP, 0.1% Triton X-100 및 300μM Coenzyme A로 구성된 완충액에 100μL의 기질 D-루시페린(300μg/mL)과 혼합하고 마이크로플레이트 리더에서 즉시 평가합니다.
3. 18S rRNA (ssu) 리보솜 자리로의 게놈 통합을 평가하기 위한 PCR
- 루시페라아제 및 야생형을 발현하는 promastigotes에서 게놈 DNA를 정제합니다(10,8). 15mL 코니컬 튜브에서 1,000 × g 에서 10분 동안 원심분리 프로마스티고트를 생성하고, 펠릿에 인산염 완충 식염수(PBS)를 첨가하고, Neubauer 챔버로 계수하고, 1,000 ×g에서 10분 동안 원심분리합니다. 용해 완충액으로 펠릿을 재현탁합니다: 100 mM NaCl, 10 mM Tris, 25 mM EDTA, 0.5% SDS 및 0.1 mg/mL proteinase K를 108/mL 밀도로 재현탁합니다. 56 °C에서 밤새 배양합니다.
- 한 부피의 페놀/클로로포름/이소아밀 알코올, 25:24:1(v/v) 및 한 부피의 클로로포름으로 두 번의 DNA 세척을 수행합니다. 각 추출 주기 사이에 수성상을 새 튜브로 옮기고 10분 동안 2,000 × g 의 속도로 원심분리합니다.
- DNA를 2 부피의 에탄올과 원심 분리기로 5,000 × g, 10 분, 4 ° C에서 침전시킵니다. 70% 에탄올 1mL를 넣고 마이크로튜브에 옮긴 다음 15,000× g 에서 5분 동안 원심분리합니다.
- 70% 에탄올로 두 번째 세척을 수행합니다. 원심분리 후 상등액을 버리고 벤치에서 펠릿을 건조시킵니다.
- 65°C의 수조에서 30분 동안 50-100μL의 초순수로 게놈 DNA를 재수화하고 DNA를 정량화한 다음 -20°C에서 보관합니다.
- PCR 반응 10 μL, 0.2 mM dNTP, DNA 중합효소 1 U, 게놈 DNA 1 μg, 각 프라이머 0.5 μM 및 뉴클레아제가 없는 물을 50 μL 최종 부피까지 PCR 반응을 설정하여 리슈마니아 게놈에서 pLEXSY 카세트의 통합을 평가하기 위해 진단 PCR을 수행합니다.
- pLEXSY 벡터 및 리슈마니아 게놈에서 혼성화하는 프라이머를 선택하십시오: (1) aprt reverse primer A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', utr1 (aprt) 영역에서 혼성화; 및 (2) 리슈마니아 염색체 18SrRNA (ssu) 유전자좌에서 ssu 전방 프라이머 F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3'.
- 다음 증폭 프로토콜을 사용하십시오 : 94 ° C에서 2 분 동안 변성 1 사이클; 증폭 30 사이클, 94 ° C에서 30 초, 60 ° C에서 30 초, 72 ° C에서 1 분; 72°C에서 10분 최종 연장. PCR 산물의 예상 크기는 1.1Kb입니다.
- 두 번째 프라이머 세트를 사용하십시오: (1) hyg forward primer A3804 5'-CCGATGGCTGTGTAGAAGTACTCG-3 및 (2) pLEXSY 벡터의 resistance marker 및 Leishmania 게놈의 18SrRNA (ssu) 자리에서 hybridize하는 ssu reverse primer F3002 5'-CTGCAGGTTCACCTACAGCTAC-3'. 60°C 대신 53°C의 어닐링 온도를 제외하고 3.6.2단계에서 설명한 것과 동일한 PCR 프로토콜을 사용합니다. 예상 제품은 1.8kb(hyg - 3'ssu)입니다.
- L. infantum 게놈의 리보솜 18S rRNA 유전자 자리에 통합이 있는지 확인하기 위해 1% 아가로스 젤 전기영동으로 PCR 산물을 분석합니다.
4. L. infantum- Luc metacyclic promastigote 및 axenic amastigote 분화
- 25mg/L 헤민과 20% 태아 송아지 혈청(FCS)이 보충된 BHI 배지에서 루시페라아제를 구성적으로 발현하는 L. infantum-LucMHOM/BR/1974/PP75를 배양합니다.
참고 : Hygromycin은 안정적인 transfectants의 배지에서 철회되었습니다. - L. infantum-Luc의 메타 고리 promastigotes를 얻으려면 75cm2 플라스크에 106/mL promastigotes를 시드하고 26 oC에서 20 % FCS가 보충 된 BHI 배지 20mL를 첨가하고 4 일 동안 수평 위치를 유지하거나 성장의 정상 단계까지 약간 기울어 둡니다. 6-8일 연속으로 플라스크에는 증가된 메타고리 프로마스티고트가 포함되어 있습니다. 프로마스티고테스를 1,000 × g에서 4 oC에서 10분 동안 원심분리한다.
- 20mL의 DMEM 저포도당이 함유된 프로마스티고트 펠릿을 다시 현탁시키고, Neubauer 챔버를 사용하여 계수를 세고, 1,000 × g 에서 4 oC에서 10분 동안 원심분리합니다.
- DMEM 저포도당을 3-5 × 107 promastigotes/mL 밀도로 펠릿에 추가합니다. 5mL의 프로마스티고트를 DMEM으로 희석한 10mL Ficoll 쿠션에 2:1(v/v)로 붓습니다. 100 × g 에서 15 oC에서 4 분 동안 브레이크를 끄고 천천히 가속하는 그라디언트를 원심 분리하십시오.
- Ficoll 쿠션 상단의 계면에서 메타 고리 promastigotes를 수집하고, Neubauer 챔버를 사용하여 계수하고, 4 oC에서 10 분 동안 1,000 × g에서 원심 분리기를 사용합니다. PBS로 펠릿을 세척하여 잔류 Ficoll을 제거하고, Neubauer 챔버를 사용하여 계수하고, 4 oC에서 10 분 동안 1,000 × g에서 원심 분리합니다.
- PBS에서 펠릿을 2 × 109/mL로 다시 현탁합니다. 접종하기 전에 프로마스티고테스를 얼음 위에 두십시오.
- L. infantum-Luc의 다른 promastigotes와 axenic amastigotes, in vitro, in vitro, in modified medium for axenically grown amastigote (MAA) 17.
- Early's salts 및 glutamine, 0.5% trypto-casein, 3mM L-cysteine, 15mM D-glucose, 4mM NaHCO3, 0.33mM Na2HPO4, 25mM HEPES가 포함된 배지 199 9.55g/L를 최종 pH 6.5에 첨가하고 20% 태아 송아지 혈청(FCS)을 보충하여 MAA를 준비합니다.
- 성장의 고정상(7일)에서 9mL의 중간 MAA와 1mL의 전구 관절염을 사용하여 중간 플라스크(75cm2)에서 배양을 시작합니다(7일 기준), 2-3 × 107 전구 관절 형성체/mL. amastigote 분화를 위해 32 ° C에서 24-48 시간 동안 배양합니다.
- 축삭으로 자란 amastigotes는 2-3 × 107/mL의 밀도에 도달할 때까지 일주일에 2-3회 계대로 유지하십시오.
- 햄스터 감염에 대한 axenic amastigotes 배양을 확대합니다. 20% FCS가 보충된 20mL의 MAA 배지에 고밀도의 아마스티gotes(5 × 106/mL)를 가진 150cm2 플라스크를 준비합니다.
- 24 h 후, 4 oC에서 10 분 동안 1,000 × g에서 원심 분리기, 동일한 부피의 PBS로 세척하고 Neubauer 챔버를 사용하여 계수하고 4 oC에서 10 분 동안 1,000 × g에서 원심 분리기를 추가합니다. PBS를 첨가하여 50 μL에서 108 amastigotes의 접종물을 준비합니다.
5. 동물
- 생후 4-6주령의 수컷 골든 햄스터를 구해 2주 동안 격리한다. L. infantum MHOM/BR/1974/PP75에 감염되었을 때 생후 6-8주이고 체중이 80-100g인지 확인하십시오.
참고: 이 프로토콜은 수컷 햄스터와 암컷 햄스터 모두에게 적용됩니다. 그러나 당시에는 구할 수 있었기 때문에 이 연구에서는 수컷 햄스터만 사용되었다. - 햄스터를 4개의 그룹으로 나눕니다: 그룹 1, 복강내 아마스티고테 감염(n = 3); 그룹 2, promastigotes에 복강내 감염됨(n = 3); 그룹 3, amastigote (n = 2)로 치은 정맥에 감염됨; 그룹 4, 치은 정맥에서 promastigote (n = 2)에 감염됨; 그룹 5, 감염되지 않은 햄스터를 대조군으로 삼음(n = 2).
- 21 ± 2 oC 및 40-60% 습도에서 제어된 환기 시스템(10-15회 공기 변화/h), 12시간 명암/암흑 주기가 장착된 통풍이 잘 되는 랙에 동물을 보관하십시오. 종이, 건초, 소수성 면화, 판지 롤, 오토클레이브 물 및 식품 임시방편과 같은 환경 풍요로움을 제공합니다.
6. 복강내 경로를 통한 감염
- 엄지와 검지를 핀셋으로 사용하여 머리 근처의 측면에서 등 피부를 꼬집고 다른 손가락으로 등을 따라 피부를 당겨 가능한 한 많은 피부를 얻으려고 케이지의 격자에 햄스터를 물리적으로 제지합니다.
- 복부 오른쪽 아래 사분면의 접종 부위를 허벅지 뒤쪽 근육과 정렬합니다.
- 동물의 몸을 45º 기울이고, 머리를 복부보다 낮추고, 바늘을 15°에서 20°로 위치시켜 접종합니다.
- 1mL 주사기에 연결된 13 x 0.45mm 바늘로 PBS에 50μL(108)의 axenic amastigotes 또는 promastigotes를 접종합니다. 베벨 너머로 0.5cm 삽입합니다. 바늘을 복부에 삽입한 후 플런저를 당겨 정맥에 삽입되지 않았는지 확인하고 액체를 조심스럽게 주입합니다.
7. 치은 접종에 의한 정맥 감염
- 섹션 6에 따라 햄스터를 제지하십시오. 13 x 0.45mm 바늘에 연결된 3mL 주사기에 10% 케타민 염산염 200mg/kg과 2% 자일라진 염산염 10mg/kg의 혼합물(최종 부피 1.3mL)을 복강내로 투여합니다.
- 동물이 마취되었는지 확인하기 위해 쿠션의 디지털 간 바닥을 고정하여 발을 꼬집습니다.
- 마취된 햄스터를 누운 자세로 양손으로 구속하고 엄지손가락으로 아랫입술을 부드럽게 아래로 당겨 잇몸과 치은정맥을 노출시킵니다.
- 1mL 주사기에 연결된 더 얇은 바늘(8 x 0.30mm)을 한 쌍의 치아 사이의 중간선을 따라 아래 앞니 아래에 25º 각도로 배치하고 하악 소음순 정맥에 2-4mm를 삽입합니다.
- 접종물이 정맥 주사였는지, 바늘이 하악 순 정맥에 삽입되었는지 확인하려면 바늘 배럴(노란색 부분)까지 혈액을 흡인합니다.
- 50 μL (10,8) 아마스티고테 또는 프로마스티고트의 접종물을 전체 용량이 접종될 때까지 1분에 걸쳐 천천히 조심스럽게 주입하여 정맥에서 외부 환경으로의 접종물 및 혈액의 누출을 방지하고 혈류의 분산을 허용합니다.
- 바늘을 제거하기 전에 면봉으로 가벼운 압력을 가하십시오. 동시에 면봉을 유지하여 혈관에서 바늘을 제거하여 해당 부위의 지혈을 촉진하고 출혈 및 접종 소실을 방지하기 위해 1분 동안 가벼운 압력을 가합니다.
8. 심장 천자 출혈에 의한 안락사
- 섹션 7에 설명된 대로 동물이 마취되도록 제지합니다. 20 x 0.55mm 바늘을 5mL 주사기에 연결하고 45º 각도로 삽입하고 xiphoid 연골 바로 아래 왼쪽으로 약간 기울어 심장 천자를 수행합니다.
- 혈액 1mL를 빼냅니다. 말기 혈액 채취 후 주사기를 제거하되 바늘은 심장에 그대로 두십시오.
- 동물이 이미 숨을 쉬고 있고 심장 박동을 보이는 경우 5mL 주사기로 티오펜탈 나트륨 5%(200mg/kg)를 투여하고 이미 심장에 있는 20 x 0.55mm 바늘에 연결합니다.
- 5분 후 청진기로 호흡 움직임과 심장 박동이 있는지 확인합니다.
9. 장기 및 조직에서 DNA 추출
- 안락사 후에는 비장, 장간막 림프절 및 간 조각을 채취합니다.
- 드라이 아이스에서 얼려 해동하고 두 개의 메스 날로 잘라 조직을 자릅니다. 17.5 μL의 proteinase K(20 mg/mL)와 함께 600 μL의 용해 완충액에 20 mg의 다진 조직을 분해하고 55 °C에서 밤새 배양합니다.
- 15,000 ×g에서 4 분 동안 원 심분리기를 사용하여 용해되지 않은 조직 조각을 제거합니다.
- 단백질 침전 용액 200μL를 넣고 20초 동안 격렬하게 혼합한 다음 얼음에서 5분 동안 배양하고 15,000×g에서 4 분 동안 원 심분리합니다.
- 상등액을 다른 튜브로 옮기고 600μL의 이소프로판올을 첨가한 다음 DNA가 침전될 때까지 부드럽게 혼합합니다. DNA를 15,000 × g 에서 2분 동안 원심분리하고 틸트 쉐이커와 원심분리기에서 70% 에탄올로 펠릿을 30분 동안 세척합니다.
- 에탄올을 버리고 펠릿을 실온에서 건조시킵니다. 65°C에서 30분 동안 50-200μL의 초순수로 DNA를 재수화하고 DNA를 정량화 및 0.1μg/mL로 희석한 후 -20°C에서 보관합니다.
10. PCR에 의한 조직 및 장기 감염 평가
- 기존 PCR로 조직 및 장기의 게놈 DNA에 있는 기생충 부하를 평가합니다: 2.5 μL의 PCR 버퍼, 1.5 mM MgSO4, 0,2 mM dNTP, 1 U의 DNA 중합효소, 300 ng의 게놈 DNA, 0.2 μM의 각 프라이머 및 뉴클레아제가 없는 물을 25 μL 최종 부피까지 측정합니다.
- L. infantum kDNA18의 프로토콜을 사용하여 증폭하십시오 : 94 °C에서 2 분 동안 변성 1 사이클; 증폭 39 사이클, 94 ° C에서 30 초, 60 ° C에서 15 초, 72 ° C에서 30 초, 72 ° C에서 5 분의 최종 연장. PCR 산물의 예상 크기는 145 bp이다. (1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3'; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- PCR3의 내인성 조절인 햄스터 GAPDH를 증폭시키다: 94°C에서 변성 1주기, 증폭 39주기, 94°C에서 30초, 58°C에서 15초, 72°C에서 30초, 72°C에서 5분 최종 연장.(1) Fw GAPDH 햄스터 5'- GGTTGCCAAACCTTATCAGAAATG-3'; (2) Rv GAPDH 햄스터 5'- TTCACCTGTTCCACAGCCTTG -3'.
- 1% 아가로스 겔 전기영동으로 PCR 산물을 분석합니다.
11. 생체 내 생물 발광 이미징에 의한 햄스터 후속 조치
- 광밀폐 챔버에 장착된 냉각식 전하 결합 카메라(CCD)로 구성된 생체 내 발광 이미징 시스템에서 전체 동물의 생물 발광 방출에 의한 시간 경과에 따른 감염 진행을 평가합니다. 노즈콘 분만으로 이미지를 획득하는 동안 동물을 마취 상태로 유지합니다.
- 생물 발광을 획득하기 전과 마취를 유도하기 5분 전에 섹션 6에 따라 D-루시페린(150mg/kg)을 햄스터에 복강내 주사합니다. PBS에 15mg/mL D-루시페린 칼륨 염 원료 용액을 준비하고 필터 살균한 다음 -80 °C에서보관합니다.
- 동물에게 D-루시페린을 주입한 후 5분 후, 산소가 풍부한 유도 챔버에서 2% 이소플루란으로 마취합니다. 5분 후 CCD 카메라를 사용하여 생물 발광 이미지를 캡처합니다. 감염 후 2시간 및 24시간, 감염 후 8일 및 22일(dpi)의 복부 위치에 있는 햄스터의 이미지를 얻습니다.
참고: 이소플루오란-산소 전달 장치로 이미징 프로세스 동안 마취를 유지하십시오. - 생물 발광 방출 수준에 따라 30초에서 5분 범위의 노출 시간, 비닝 중형 또는 대형, f/stop 1 및 시야 D (12, 5cm)의 매개변수를 사용합니다.
12. L. infantum- Luc에 감염된 동물의 생물 발광 정량화
- 수동 측정 툴을 사용하여 동물의 머리와 몸통에서 ROI(관심 영역), 크기 및 면적을 식별할 수 있습니다. 선택한 ROI에서 CCD 카메라가 획득한 생물 발광을 정량화합니다.
- 평균 배경 ROI로 배경 신호를 측정하고 수동 ROI에서 얻은 생체 발광 방출에서 뺍니다.
- 생물 발광 방출을 시간과 면적에 따라 정규화된 단위인 광량으로 표현: photons.sec-1.cm-2.sr-1
결과
L. infantum에서 루시페라제의 안정적인 발현
유전자 변형 L. infantum은 18S rRNA (ssu) 리보솜 자리에서 리슈마니아의 게놈에 통합되는 pLEXSY 라인의 플라스미드를 사용하여 생산되었으며, 전사는 RNA 중합효소 I에 의해 구동됩니다. 따라서, L. infantum-Luc 클론은 리슈마니아의 게놈에서 플라스미드 통합 및 in vitro에서 생물 발광 방출에 의한 안정적인 발현을 평가했습니다. 배경 위로 생물 발광 >120 배를 표시하는 발현이 높은 클론은 PCR에 의한 게놈 통합 평가를 위해 선택되었습니다. L. infantum-Luc 클론의 promastigotes의 게놈 및 생물 발광 방출(RLU)에서 플라스미드 통합을 평가하기 위해 PCR 제품의 아가로스 젤 전기영동에 대해서는 그림 1을 참조하십시오. 예상된 크기의 단편을 각 PCR로부터 수득하였다; 약 1,1 kb (5'ssu - utr1)의 한 생성물과 1.8 kb (hyg-3'ssu)의 다른 제품을 L. infantum-Luc (그림 1A)의 게놈에서 증폭하여 L. infantum 게놈의 ssu 자리에서 플라스미드 카세트와 루시페라제 유전자의 통합을 확인했습니다.
반딧불이 루시페라아제 발현은 또한 프로토콜, 섹션 2에 설명된 바와 같이 마이크로플레이트 리더에서 생물 발광 방출(RLU)에 의해 L. infantum-Luc의 프로마스티고테스에서 평가되었습니다. 5일 동안 배양 및 BALB/c 마우스에서 여러 번 통과한 후에도 생물 발광 수준을 유지했습니다. 야생형 배경의 경우 569.3 ± 19.5, 복제된 L. infantum-Luc 의 경우 59361.9 ± 2673.3(n = 2)(그림 1B). 따라서, 반딧불이 루시페라아제를 안정적으로 발현하는 L. infantum-Luc 클론은 치은내 또는 복강내 경로를 통해 햄스터를 감염시키는 데 사용되었습니다.
치은 정맥에 정맥 접종
리슈마니아를 햄스터의 혈류에 접종하려면 정맥 천공, 출혈 및 접종 누출을 최소화하도록 주의해야 합니다. 따라서 아랫입술을 부드럽게 아래로 당겨 치은 정맥을 노출시켜야 합니다(그림 2A). 정맥의 과도한 천공을 피하기 위해 더 작은 게이지 30G 바늘을 사용해야 합니다. 바늘은 적절한 각도로 정맥에 삽입하기 위해 베젤이 위를 향하도록 위치해야 합니다(그림 2B). 실제로, 바늘이 혈관(하악 소음순 정맥)에 주입되었는지 확인하기 위해 혈액이 바늘 배럴로 흡입될 때까지 주사기 플런저를 아래로 당겨야 합니다(그림 2C). 주삿바늘을 제거하기 전에 지혈을 촉진하기 위해 면봉으로 가벼운 압력을 가해야 합니다(그림 2D).
생물발광 이미징에 의한 종단 평가
복강내(IP) 또는 치은내(IG)를 통해 L. infantum-Luc에 감염된 햄스터를50dpi까지 추적한 후 22dpi까지 생물발광 이미징으로 평가했습니다(그림 3). 이미지는 복강강에 108 기생충이 있는 복강내 감염 2시간 후에 획득되었습니다. 이미지는 30초 또는 1분 노출 비닝 매체에 대해 획득되었습니다. 생물발광 신호는 프로유방고트에 감염된 동물(×±×6.8 × 103 ± 3.8 × 103)보다 복부에서 >65배 더 강했으며(표 1), 이는 in vitro에서 분화된 amastigotes가 고정상에서 metacyclic promastigotes보다 더 생물 발광하고 Ficoll cushion에서 정제되었음을 보여줍니다.
감염 하루 후(1dpi), 3분 동안 생물 발광 이미지를 획득했습니다(그림 3). 프로마스티고테에 감염된 햄스터에서는 복부 부위의 생물발광 신호가 45% 감소했고, 아마스티고트에 감염된 햄스터에서는 70%의 붕괴가 있었는데(그림 3), 이는 아마스티고테스가 메타고리클릭 프로마스티고테스보다 더 많이 저하되었음을 시사합니다(표 1 및 그림 4). 감염 일주일 후(8dpi), 프로마스티고트에 감염된 동물은 생물발광 신호를 견뎌냈습니다(3.3 × 103 ± 5 × 103). 그러나 아마스티고트에 감염된 햄스터의 생물 발광 방출은 1.3 ×10 5 ± 1.1 ×10 5 에서 6.7 × 103 ± 7.5 × 103 으로 95% 감소했으며(표 1) 프로마스티고트에 감염된 햄스터와 동일한 수준에 도달했습니다. 감염 3주(22dpi) 후, 5분 동안 노출 및 비닝(binning) 동안 생물 발광 신호를 획득했습니다(그림 3). 신호는 promastigotes와 amastigotes에 감염된 동물의 경우 훨씬 낮았습니다(표 1 및 그림 4).
또 다른 그룹의 햄스터는 치은내 경로를 통해 L. infantum-Luc의 아마스티고테스와 프로유스티고테스에 감염되었다(10,8); 생물 발광 방출은 상악 영역에서 관찰되었습니다(그림 3). 추적 조사는 감염 1일 후부터 시작되었으며, 아마스티고트에 감염된 햄스터는 프로유방고트에 감염된 햄스터보다 더 많은 생물발광 신호와 광도를 보였다×±×(7.3 × 103 ± 4.1 × 103). 감염 일주일 후(8dpi), 프로마스티고트에 감염된 동물에서는 생물발광 신호가 36% 감소했고, 아마스티고트에 감염된 햄스터에서는 90% 감소가 관찰되었습니다. 광도는 7.3 ×10 3 ± 4.1 × 103에서 7.8 × 102 ± 5.6 × 102까지 다양했습니다 (표 1). 감염 3주(22dpi) 후, 5분 동안 노출 및 비닝을 크게 하는 동안 생물 발광 신호도 획득되었습니다(그림 3). 생물발광 신호는 치은에서 감염된 동물의 머리에서 promastigote 및 amastigote에 감염된 동물(표 1 및 그림 4)에 대해 유사하고 낮았으며, 생물 발광 신호에 의해 복부로 감염이 분산되는 것은 관찰되지 않았습니다.
PCR에 의한 조직 및 장기 감염 평가
우리는 간, 비장 및 림프절과 같은 특정 장기의 감염을 조사하기 위해 기존 PCR을 수행했으며, 이는 생체 내 이미징의 검출 한계 미만일 수 있습니다. kDNA의 표적 영역은 감염된 조직 및 장기에서 L. infantum DNA 증폭에 대해 더 특이적이었고, 햄스터의 효소 GAPDH에 대한 PCR은 DNA 무결성 및 PCR 반응의 대조군이었습니다. GAPDH 를 위해 증폭된 샘플만 분석에서 고려되었습니다. 따라서, PCR에 의해, 복강내 경로를 통해 axenic amastigotes에 감염된 3마리의 햄스터 중 2마리가 조직과 장기에 감염을 보였다. 50dpi에서 비장에 동물 2(A2)와 간에 동물 3(A3)이 있습니다(그림 5A). 한 햄스터는 복강내로 도끼 전구균에 감염되었습니다. 동물 3(A3)(그림 5B)은 림프절에서 증폭을 나타냈습니다. 50dpi에서 promastigotes나 axenic amastigotes를 치은내에 접종한 햄스터는 명확한 증폭을 나타내지 못했으며, 단지 promastigotes에 감염된 동물 1(A1)의 간에 있는 밴드일 뿐이었다(그림 5C). 특히, 8개월 동안 3마리의 동물을 사육했는데, 이 동물들은 주사 중 아마스티고테스와 함께 치은내 경로를 통해 전달된 접종물이 약간 누출되었습니다. 3마리 중 2마리, 1마리와 2마리에서 간에 명백한 감염이 나타났습니다(그림 5D).
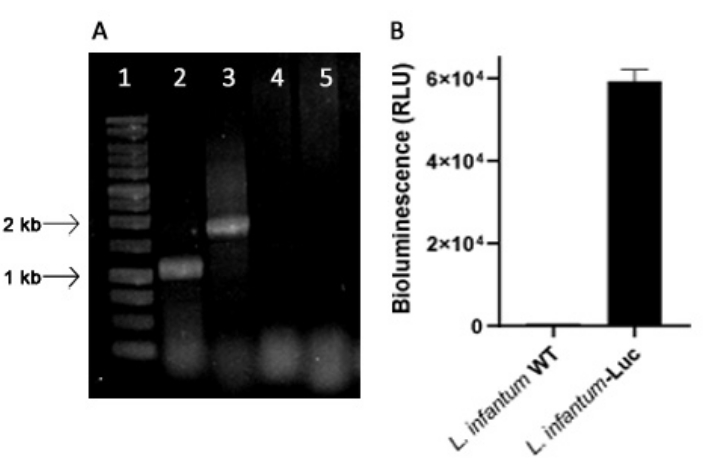
그림 1: PCR 및 생물발광 방출에 의한 Leishmania infantum-Luc 클론 평가. (A) 게놈에서 플라스미드 통합을 평가하기 위한 PCR 산물의 아가로스 겔 전기영동: lane 1 - 1 kb DNA ladder; L. infantum-Luc 게놈 DNA의 PCR, lane 2 - 5'ssu - utr1 (1.1 kb) 및 lane 3- hyg- 3'ssu (1.8 kb); L. infantum-wt 게놈 DNA의 PCR, 레인 4 및 5. (B) 마이크로플레이트 리더에서 L. infantum-Luc 클론(10,6)의 전구 유방종의 생물 발광 방출(RLU). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: Leishmania infantum-Luc를 잇몸 정맥에 정맥 주사. (A) 햄스터를 등쪽 욕창에 넣고 아랫입술을 아래로 당겼습니다. (B) 1mL 주사기에 결합된 더 얇은 바늘(8 x 0.30mm)을 한 쌍의 치아 사이의 중간선을 따라 아래 앞니 아래에 25º 각도로 배치하고 하악 소음순 정맥에 2-4mm를 삽입했습니다. (C) PBS에 50 μL (10,8)의 아마스티gotes 또는 promastigotes의 접종. (D) 면봉을 사용하여 접종 부위에 가벼운 압력을 가하는 지혈. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
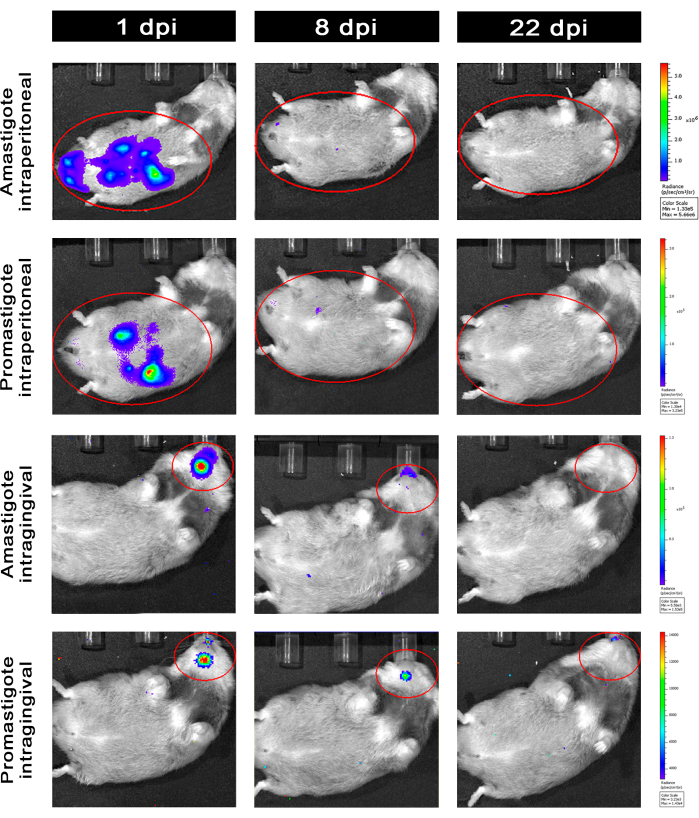
그림 3: 생체 내 생물 발광 이미징에 의한 후속 조치. 그룹당 한 동물의 대표 이미지: 복강내(상부 패널) 또는 치은내(하부 패널)를 통해 1, 8 및 22dpi의 L. infantum-Luc의 아마스티고테스 또는 프로마스티고테스에 감염됨. 복강내 또는 치은내 감염에 대해 각각 복부와 머리의 프로브된 영역을 나타내는 빨간색 ROI. 데이터에 따르면 1dpi에서 모든 동물은 복부 또는 하악골에 생물 발광 신호를 표시했습니다. 신호는 8dpi 이후 감소했으며 22dpi에서는 어떤 그룹에서도 거의 감지할 수 없었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
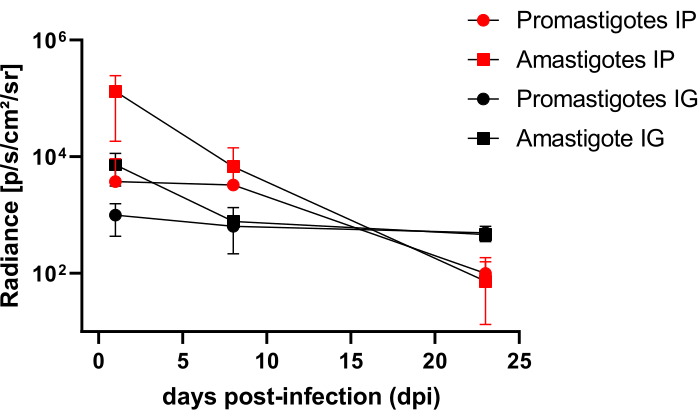
그림 4: 생물 발광 이미지의 복사 비교 분석. 광도 정량화 photons.sec-1.cm-2.sr-1은 수동 ROI 측정 도구를 사용하여 햄스터의 복부 또는 머리에서 수행되었습니다. 스퓨리어스 신호를 제거하기 위해 측정 ROI에서 평균 백그라운드 ROI를 뺍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
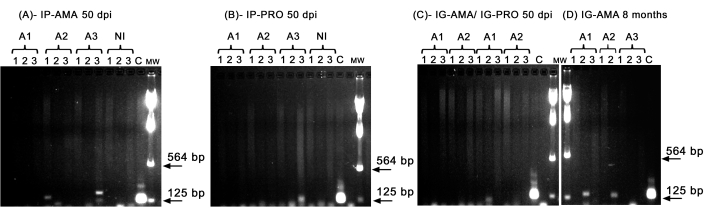
그림 5: kDNA의 PCR 증폭. (A) IP-AMA, amastigote와 복강내 경로를 통해 감염된 햄스터, 50dpi(n = 3); (B) 복강내 경로를 통해 프로유방접합체에 감염된 IP-PRO, 50dpi(n = 3); (C) IG-AMA, 아마스티고트(n=2)와 치은내 경로를 통해 감염됨, IG-PRO, 치은내 경로를 통해 프로유스티고테(n=2)와 함께 감염됨; (D) IG-AMA, 감염 후 8개월(n = 3)에 amastigote와 함께 치은내 경로를 통해 감염됨. NI, 감염되지 않은 햄스터는 음성 대조군(n = 2); L. infantum-Luc의 C- 게놈 DNA, PCR의 양성 대조군. 조직 및 기관 : 1- 비장, 2- 간, 3- 림프절. MW- 분자량 마커, 화살표는 더 낮은 분자량 대역을 나타냅니다. A1- 동물 1, A2- 동물 2, A3- 동물 3. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| dpi | 아마스티고테스 IP | 프로마스티고테스 IP | 아마스티고테스 IG | 프로마스티고테스 IG | ||||||||
| 의미하다 | 증권 시세 표시기 | N | 의미하다 | 증권 시세 표시기 | N | 의미하다 | 증권 시세 표시기 | N | 의미하다 | 증권 시세 표시기 | N | |
| 0 | 4.6 엑스 105 | 3.7 엑스 105 | 3 | 6.8 엑스 103 | 3.8 엑스 103 | 3 | - | - | - | - | - | - |
| 1 | 1.3 엑스 105 | 1.1 엑스 105 | 3 | 3.8 엑스 103 | 5.5 엑스 103 | 3 | 7.3 엑스 103 | 4.1 엑스 103 | 2 | 1.0 엑스 103 | 5.7 엑스 102 | 2 |
| 8 | 6.7 엑스 103 | 7.5 엑스 103 | 3 | 3.3 엑스 103 | 5.0 엑스 103 | 3 | 7.8 엑스 102 | 5.6 엑스 102 | 2 | 6.4 엑스 102 | 8.2 엑스 101 | 2 |
| 22 | 7.3 엑스 101 | 8.5 엑스 101 | 3 | 9.9 엑스 101 | 8.6 엑스 101 | 3 | 4.6 엑스 102 | 7.5 엑스 101 | 2 | 5.0 엑스 102 | 1.5 엑스 102 | 2 |
표 1: 생물 발광 이미지의 비교 방사도 분석에서 얻은 원시 데이터. 그룹 및 경로별 광도 정량화 평균 photons.sec-1.cm-2.sr-1. 약어: dpi = 감염 후 일수; SD = 표준 편차; N = 표본 크기.
토론
채혈 또는 햄스터에 물질을 정맥 주사하는 것은 다양한 과학적 연구에 필요합니다. 연구 목적과 직접적으로 관련된 다양한 채취 또는 접종 경로에 접근하기 위해 여러 가지 방법이 개발되었다19. 햄스터의 해부학적 구조(짧은 꼬리와 팔다리)로 인해 심장 내 경로는 일반적으로 리슈마니아의 정맥 주사를 위해 선택됩니다. 사용된 균주에 따라 심장 내 경로는 6-9개월에 걸쳐 감염되는 기준 균주 L. infantum MHOM/BR/1974/PP75로 유리한 것으로 판명되었습니다5. 그러나 그것은 동물의 출혈과 죽음으로 이어질 수 있는 예방 접종입니다. 따라서 우리는 동물에게 덜 해를 끼치는 치은총, 하악 소음순 정맥에서 감염에 대한 대체 정맥 접종 경로를 표준화했습니다. 동물은 유전자 변형 참조 균주 L. infantum MHOM/BR/1974/PP75에 감염되었으며, 이는 동일한 통합 플라스미드20에 의해 형질주입된 다른 리슈마니아 종과 관련하여 배양 및 마우스에서 여러 번의 계대 후에도 반딧불이 루시퍼라아제를 안정적으로 발현했습니다(그림 1).
하악 음순 정맥(mandibularis labialis vein 또는 치은 정맥)은 혈액 채취 및 다중 혈액 수집에 더 나은 경로입니다10,11. 그러나 이것은 치은 정맥이 햄스터의 리슈마니아에 의한 정맥 주사 감염이 가능한 부위라는 첫 번째 입증입니다. 혈액 용혈10을 피하기 위해 일반적으로 높은 게이지 26G 바늘을 사용하는 혈액 샘플링과 달리 이 바늘 게이지는 정맥 천공, 출혈 및 접종물 누출로 인해 리슈마니아 접종에 적합하지 않았습니다. 상악 하악 정맥을 통한 리슈마니아 감염의 경우 더 작은 게이지 30G 바늘이 필수적이었습니다. 치은 정맥을 통한 감염에 대한 정맥 천자를 구별하는 또 다른 측면은 약 1 μL/s의 투여 속도입니다. 그리고 그것이 혈관-하악 음순 정맥에 주입되고 점막, 피하 또는 피내에 박히지 않도록 합니다. 치은총의 낮은 혈액 회전율로 인해, 50 μL의 고밀도 축삭 아마스티gotes 또는 L. infantum-Luc의 promastigotes, 2 x 109 parasites/mL를 접종해야 했으며, 혈류에서 접종물이 분산될 수 있도록 면봉을 1분 동안 눌러 바늘을 제거해야 했습니다(그림 2).
감염에 대한 종단적 평가를 위해 햄스터를 복강내(IP) 또는 치은내(IG) 경로를 통해 L. infantum-Luc에 감염시켰고, 안락사될 때까지 생물발광 이미징 시스템으로 50dpi 추적했습니다. 참조 균주 PP75는 그 자체로 독성이 낮을 수 있고 루시페라아제의 초발현도 감염 효과에 영향을 미치고 장기간 감염을 유지할 수 있다는 점을 고려하여 108 기생충의 높은 접종물을 감염에 사용했습니다. L. infantum-Luc의 아마스티고테스와 프로마스티고테스에 대한 치은 접종 및 생물발광 이미징 시스템의 평가 후, 감염 후 24시간 후에 햄스터의 상악 부위로 생물 발광이 제한되었습니다. 실제로, L. infantum-Luc의 아마스티고테스(amastigotes)와 프로마스티고테스(promastigotes)에 복강내로 감염된 햄스터는 복부 전체에 분산된 생물 발광을 보였다(그림 3, 1 dpi). 감염 첫날부터 8일째 되는 날까지, 그리고 L. infantum-Luc에 감염된 햄스터의 22번째 dpi까지 시간에 따른 생물 발광 방출의 지속적인 감소는 접종 경로와 무관했습니다(표 1 및 그림 4).
그러나 동물 조직의 기생충 부담이 낮을 경우 생물 발광 이미징 시스템의 검출 한계 미만일 수 있지만 PCR 또는 qPCR로 검출 및 정량화할 수 있습니다. 이미 보고된 바와 같이, PP75 균주에 의한 감염은 실제로 다른 균주5에 비해 낮으며, 동물의 유전적 다양성으로 인해 질병의 임상 징후가 나타난 경우는 소수에 불과하다. 이 연구에서는 동물 수가 적고 이 균주의 독성이 낮음에도 불구하고 축색 아마스티고테스는 50dpi에서 이점을 보여주었으며 PCR에 의해 입증된 바와 같이 프로마스티고트보다 더 나은 감염을 보여주었습니다(그림 5). 치은 경로를 통해 아마스티고트에 감염된 지 8개월 후, 기생충은 간에서 PCR로 검출될 수 있었으며(그림 5) 중등도의 필로에렉션(piloerection), 안와(orbital) 압박감 및 아치형 자세를 보였다.
액세닉 아마스티고테스(axenic amastigotes)는 프로유스티고트(promastigotes)21 보다 감염 및 추적관찰에 더 나은 선택이 될 수 있으며, 대규모로 생산하기 쉽다는 장점이 있다. 치은 접종은 가능하며 화합물의 정맥 접종 및 리슈마니아 및 기타 병원체의 감염에 대한 더 나은 경로이며, 하악골의 적용 부위 또는 동물 건강에 대한 손상이나 부종 없이.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. PPSUS/Decit-MS/CNPq/SES는 이 연구를 위해 재정적 지원을 제공했습니다. 예방 접종 경로에 대한 조언을 해주신 Monique Ribeiro de Lima에게 감사드립니다. 이 프로젝트는 FIOCRUZ와 Universidade Federal do Rio de Janeiro- UFRJ 간의 협력 협정 No 258/2017에 따라 개발되었습니다. 개발팀은 프로토콜 촬영과 인터뷰 진행에 귀중한 지원과 도움을 준 과학대중화센터(IOC)의 비디오 프로듀서 Ricardo Baptista Schmidt와 Genilton José Vieira에게 진심으로 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
참고문헌
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유