Method Article
体内研究 通过牙龈接种表达荧光素酶的轴丝无毛体对 婴儿利什曼原虫感染的仓鼠进行成像
摘要
在这里,我们通过生物发光成像和 PCR 对腹膜内 (IP) 或通过牙龈内 (IG) 感染 婴儿李斯特菌-Luc 的金仓鼠进行了纵向评估。在感染后 1 天 (1 dpi) 、感染后 1 周 (8 dpi) 和感染后 3 周 (22 dpi) 对仓鼠进行评估,并在感染后第 50天 (50 dpi) 和感染后 8 个月实施安乐死。
摘要
美国皮部利什曼病 (ATL) 和内脏利什曼病 (VL) 被世界卫生组织认为被忽视。如果不治疗,VL 可能是致命的;用于治疗的药物有毒,并且有耐药病例。临床前测试可能是发现治疗新药的瓶颈,具体取决于动物模型、使用的菌株和接种途径。金仓鼠因其对 Viannia 和 Leishmania 亚属物种的高度敏感性而脱颖而出,显示出在人类疾病中观察到的许多临床和免疫病理过程。
根据仓鼠的解剖结构,其尾巴和四肢较短,心内途径通常是静脉注射 利什曼原虫的选择。然而,它是一种可导致出血并最终导致动物死亡的接种物。因此,我们为牙龈静脉感染标准化了另一种静脉接种途径,该途径是微创的,允许轻松进入静脉,并且对动物造成的局部和全身损伤很少。因此,通过生物发光成像系统对腹膜内 (IP) 或龈内 (IG) 途径感染婴儿 利什曼原虫 (Luc) 的仓鼠进行 22 天的随访,并在感染后 50 天和 8 个月通过 PCR 进行随访。
在牙龈接种 L. infantum-Luc 的轴突无鞭毛体和前鞭毛体后,在注射部位限制生物发光至少 2 周,这是牙龈丛周围组织感染的指标。正如预期的那样,腹膜内感染 L. infantum-Luc 的仓鼠表现出分散在整个腹部的生物发光。然而,通过生物发光成像系统,感染下降到第 50 dpi 并且只能通过 PCR 检测到。通过 PCR 评估,Axenic 无鞭毛体显示出比前鞭毛体更好的感染。事实上,感染后 8 个月,通过PCR在通过静脉内途径接种轴生无鞭毛肌的动物肝脏中检测到寄生虫,这可能是 婴儿李斯特菌 MHOM/BR/1974/PP75参考菌株的一个特征,其感染进展缓慢,寄生虫负荷低,低于生物发光成像分辨率。因此,轴突无鞭毛体可能是比前鞭毛体更好的感染和随访选择,牙龈接种物是静脉注射 利什曼原虫 和其他病原体的可行途径。
引言
利什曼病被认为是由 20 多种 利什曼原虫引起的被忽视和重新出现的疾病,在四个中央生态流行病学区域的几个国家流行:拉丁美洲、北非和东非以及西亚和东南亚1。它们可分为外皮型 (TL) 和内脏利什曼病 (VL),如果不治疗是致命的。巴西 VL 的病原体是 婴儿利什曼原虫,使用五价锑剂或两性霉素 B 进行治疗。这些药物是静脉内给药的,毒性高,显示不良反应,并且有耐药病例2。
因此,有必要投资于寻找新的化疗方法。事实上,临床前测试是发现 VL 治疗新药的瓶颈,具体取决于动物模型、使用的菌株、接种途径以及其他后勤、技术和作因素。金仓鼠因其对 Viannia 和 Leishmania 亚属物种的高度敏感性而脱颖而出,显示出在人类疾病中观察到的许多临床和免疫病理过程,如之前对巴西利什曼原虫 3,4 的研究中观察到的那样。感染婴儿李斯特菌的仓鼠还会出现人类和狗 VL 特有的大部分免疫病理过程5,例如贫血、白细胞减少、血小板减少和肝脾肿大。此外,金仓鼠是一种近亲繁殖的动物,没有表现出一致的反应,再现了人类临床表现的异质性3。
感染结果要考虑的另一个方面是婴儿李斯特菌菌株和接种途径。几种婴儿李斯特菌菌株在遗传背景和对治疗的易感性方面有所不同 2,6,7。一些菌株在前鞭毛体感染后肝脏和脾脏中的寄生负荷较低 8,AXENIC 无鞭毛体可以作为改善感染的替代方法,但尚未深入探索。事实上,静脉注射途径有利于感染并增加动物出现临床症状的频率;但腹膜内接种是最常用的。心内途径是婴儿李斯特菌静脉感染的选择 5,8,9。然而,在仓鼠中,龈内接种是静脉注射的替代途径,未被描述为感染部位。尽管有报道,但牙龈静脉穿刺是微创的,易于进入静脉,并且几乎不会造成局部和全身损伤10。牙龈静脉穿刺最符合建议,以最大限度地提高结果的质量和适用性,同时保护动物的福祉11。
使用传统方法对 VL 化合物进行临床前评估需要更多的动物,必须对动物实施安乐死以进行组织病理学分析和组织中寄生虫负荷的评估。相比之下,生物发光成像系统可以加快临床前研究并减少动物数量。可以在同一只动物中实时跟踪感染组织中的生物发光位点数周。关于这一关键技术工具标准化的几项研究表明,它适用于感染克氏锥虫、利什曼原虫属和刚地弓形虫的小鼠的研究 12,13,14,15。然而,根据组织中的寄生虫负荷,体内成像系统可能会检测不到生物发光,这需要通过对受影响的器官进行定量 PCR 进行评估。因此,我们建议开发一种基于在金仓鼠牙龈静脉中静脉注射表达荧光素酶的婴儿李斯特菌的方法,以便通过生物发光成像系统和 PCR 进行随访。
研究方案
涉及仓鼠的协议遵循了奥斯瓦尔多·克鲁兹研究所/国际奥委会动物研究伦理委员会的指导方针(批准:CEUA/IOC L-015/2022)。
1. 将萤火虫荧光素酶基因克隆到 利什曼原虫 表达质粒中
- 用 BglII (10 U/μL) 和 NotI (10 U/μL) 核酸内切酶消化质粒 pLEXSY-hyg2。首先用 BglII 消化:加入 50 μL 质粒(9 μg DNA)、30 μL 限制性内切酶缓冲液、3 μL 牛血清白蛋白 (BSA)、3 μL BglII 和无核酸酶的水,最终体积为 300 μL。在 37 °C 下孵育 3 小时。
- 用 BamHI (10 U/μL) 和 NotI 消化 TOPOII/LUC 质粒,以释放在 TOPOII 载体16 中克隆的带有 Kozak 序列 (Kozak-LUC) 的萤火虫荧光素酶开放阅读框。首先用 BamHI 消化:将 100 μL 质粒(8.5 μg DNA)与 30 μL 限制性内切酶缓冲液混合;3 μL BSA、3 μL BamHI 和无核酸酶水,最终体积为 300 μL。在 37 °C 下孵育 3 小时。
- 在硅胶膜上纯化每个质粒,并用 50 μL 水洗脱 DNA 两次,最终体积为 100 μL。
- 用 NotI 对先前线性化的 pLEXSY-hyg2 和 TOPOII/LUC 质粒进行双重消化。将从硅胶膜洗脱的 100 μL DNA 与 15 μL 缓冲液 D、2 μL NotI 和无核酸酶的水混合至最终体积为 150 μL。在 37 °C 下孵育 1 小时。
- 用 Tris-乙酸 EDTA (TAE) 缓冲液电泳后,从 1% 琼脂糖凝胶中凝胶纯化双消化载体 (pLEXSY-hyg2) 和插入片段 Kozak-LUC。用手术刀切除 ~8 kb 和 1.6 kb 的条带。称量切片,向 1 体积的凝胶中加入 3 体积的缓冲液,在 50 °C 下孵育以溶解凝胶,转移到硅胶膜上,然后用 20 μL 水洗涤和洗脱 DNA 两次,最终体积为 40 μL。
- 用 T4 连接酶连接双消化载体 (pLEXSY-hyg2) 和插入片段 Kozak-LUC:混合 2 μL 载体和插入片段,均为 55 ng/μL,摩尔比为 1:5;加入 5 μL 连接缓冲液;1 μL T4 DNA 连接酶 (1U/ mL),终体积为 10 μL。在 16 °C 下孵育过夜。
- 向 10 μL 连接反应物中加入 40 μL 无核酸酶的水,并用 10 体积的丁醇沉淀 DNA。在微量离心机中以最高速度离心 10 分钟,用 70% 乙醇洗涤沉淀,以最高速度离心 10 分钟,让沉淀在工作台上干燥,并加入 4 μL 水。
- 将 4 μL 连接反应物与电感受态细菌 JM109 (40 μL) 混合,将混合物转移到比色皿 (d = 0.2 cm) 中,并将其保存在冰上。在 2,500 V、200 Ω、25 μF 下电穿孔,将比色皿放入冰中,并加入 1 mL LB 培养基。立即将混合物转移到 15 mL 锥形管中,并在 37 °C 下孵育 60 分钟和 100 rpm。
- 将混合物接种在两个 LB 琼脂/氨苄青霉素 (100 μg/mL) 板上:一个装有 200 μL,另一个装有整个电穿孔细菌。通过将转化的细菌以 2,000 × g 离心 10 分钟来浓缩体积,将沉淀重悬于 100 μL 中,然后接种整个体积/沉淀。将板在 30 °C 下孵育 24-30 小时,然后等待克隆生长。
- 用牙签选择克隆,并转移至含有 5 mL LB/氨苄青霉素 (100 μg/mL) 培养基的 50 mL 锥形管中。在 30 °C 和 100 rpm 下孵育 20-24 小时,以使小量制备培养物生长。
- 用小量制备试剂盒纯化质粒,并用 30 μL 水洗脱 DNA。通过用 BamHI 消化筛选含有构建体 pLESXY-LUC-hyg2 的克隆。
- 混合 10 μL 小量制备的 DNA;2 μL 限制性内切酶缓冲液;0.2 μL BSA:1 μL BamHI 和无核酸酶水,最终体积为 20 μL。在 37 °C 下孵育 1 小时 - 在 1% 琼脂糖凝胶电泳中预期阳性克隆片段:3,450 和 6,290 个碱基对。
- 准备大量制备培养物以更大规模地纯化构建体 pLESXY-LUC-hyg2。加入一个锥形 (1 L)、250 mL 补充有氨苄青霉素的 LB 培养基和 1 mL 转染的小量制备 JM109,并在 30 °C 和 200 rpm 下孵育 18-20 小时。
2. 表达萤光素酶的婴儿利什曼原虫的生产和选择
- 为了释放 利什曼原虫 整合盒,用 SwaI 限制性消化质粒 pLESXY-LUC-hyg2 直至完成。加入 40 μL 质粒 (50 μg)、10 μL 快速消化缓冲液、4 μL SwaI 和无核酸酶的水至最终体积为 100 μL。在 30 °C 下孵育过夜。
- 用乙醇沉淀,用 70% 乙醇洗涤一次,用 50 μL 水重悬,并保持在冰上。
- 在 Schneider 培养基的指数生长期,以 1,000 × g 离心利什曼原虫 MHOM/BR/1974/PP75 前鞭毛体 10 分钟。用脑和心脏输液 (BHI) 培养基洗涤沉淀,并以 1,000 × g 离心 10 分钟。在 BHI 中将沉淀重悬至 108 个前鞭毛体/mL。
- 在冰上将 婴儿李斯特前 鞭毛体 (500 μL) 与 pLESXY-LUC-hyg2 整合盒 (50 μg) 在电穿孔比色皿 (d = 0.4 cm) 中混合。用两个 1,500 V/25 micro F 脉冲和 10 s 间隔进行电穿孔。脉冲后,在冰上保持 10 分钟。
- 将转染的前鞭毛体转移到装有 Schneider 培养基的培养瓶中,在 26 °C 下补充有 20% FCS。 24 小时后,先添加潮霉素 50 μg/mL,然后在 48 小时后增加至 100 μg/mL,1 周后增加至 150 μg/mL。
- 通过在 96 孔板中限制稀释来克隆转染的婴儿李斯特乳杆菌-Luc 前鞭毛体,其中添加了 20% FCS 和 150 μg/mL 潮霉素的 Schneider's。在 26 °C 下孵育以进行克隆生长。
- 在酶标仪中通过生物发光发射相对发光单元 (RLU) 筛选克隆以选择遗传同质且高表达的 婴儿乳杆菌-Luc。
- 简而言之,将白色 96 孔板中的 106 个前鞭毛体与 100 μL 底物 D-荧光素 (300 μg/mL) 混合在由 25 mM HEPES pH 7.8、15 mM MgCl2、4 mM EGTA、1 mM DTT、1 μg/mL BSA、2.5 mM ATP、0.1% Triton X-100 和 300 μM 辅酶 A 组成的缓冲液中,立即在酶标仪中评估。
3. PCR 评估基因组整合到 18S rRNA (ssu) 核糖体基因座中
- 从表达荧光素酶和野生型的前鞭毛体中纯化基因组 DNA (10,8)。在 15 mL 锥形管中以 1,000 × g 离心前鞭毛体 10 分钟,向沉淀中加入磷酸盐缓冲盐水 (PBS),用 Neubauer 室计数,然后以 1,000 × 离心 10 分钟。用裂解缓冲液重悬沉淀:100 mM NaCl、10 mM Tris、25 mM EDTA、0.5% SDS 和 0.1 mg/mL 蛋白酶 K,密度为 108/mL。在 56 °C 下孵育过夜。
- 使用一体积的苯酚/氯仿/异戊醇,25:24:1 (v/v) 和一体积的氯仿进行两个循环的 DNA 纯化。在每个提取周期之间,将水相转移到新试管中,并以 2,000 × g 离心 10 分钟。
- 用两种体积的乙醇沉淀 DNA,并在 5,000 × g、10 分钟、4 °C 下离心。 加入 1 mL 70% 乙醇,转移到微管中,并以 15,000 × g 离心 5 分钟。
- 用 70% 乙醇进行第二次洗涤。离心后,弃去上清液并在工作台上干燥沉淀。
- 在 65 °C 的水浴中用 50-100 μL 超纯水重新水合基因组 DNA 30 分钟,定量 DNA,并储存在 -20 °C。
- 通过设置以下 PCR 反应进行诊断 PCR,以评估 pLEXSY 盒在 利什曼原虫 基因组中的整合:10 μL PCR 缓冲液、0.2 mM dNTP、1 U DNA 聚合酶、1 μg 基因组 DNA、0.5 μM 每种引物和无核酸酶水,最终体积为 50 μL。
- 选择在 pLEXSY 载体和 利什曼原虫 基因组中杂交的引物:(1) aprt 反向引物 A1715 5'-TATTCGTTGTCAGATGGCGCAC-3',在 utr1 (aprt) 区域杂交;(2) 利 什曼原虫 染色体 18SrRNA (ssu) 基因座中的 ssu 正向引物 F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3'。
- 使用以下扩增方案:在 94 °C 下进行一次变性循环,持续 2 分钟;扩增 30 个循环,94 °C 下 30 秒,60 °C 下 30 秒,72 °C 下 1 分钟;在 72 °C 下最终延伸 10 分钟。 PCR 产物的预期大小为 1.1 Kb。
- 使用第二组引物:(1) hyg 正向引物 A3804 5'-CCGATGGCTGTAGAAGTACTCG-3,和 (2) ssu 反向引物 F3002 5'-CTGCAGGTTCACCTACAGCTAC-3',它们在 pLEXSY 载体的抗性标记物和 利什曼原虫 基因组的 18SrRNA (ssu) 基因座中杂交。使用步骤 3.6.2 中描述的相同 PCR 方案,除了退火温度为 53 °C,而不是 60 °C。 预期积为 1.8 kb (hyg - 3'ssu)。
- 通过 1% 琼脂糖凝胶电泳分析 PCR 产物,检查是否整合到 婴儿李斯特 菌基因组的核糖体 18S rRNA 位点中。
4. L. infantum- Luc 后环前鞭毛体和轴突无鞭毛体分化
- 在 BHI 培养基中培养婴儿 乳杆菌-LucMHOM/BR/1974/PP75,组成型表达荧光素酶,补充有 25 mg/L 血红素和 20% 胎牛血清 (FCS)。
注:潮霉素已从稳定转染子培养基中抽出。 - 为了获得婴儿乳杆菌-Luc 的后环前鞭毛体,在 75 cm2 烧瓶中接种 10 个6/mL 前鞭毛体,加入 20 mL 补充有 20% FCS 的 BHI 培养基,在 26 °C 下保持水平位置 4 天或略微倾斜,直到生长的静止期。连续 6-8 天后,培养瓶中含有增加的后环前鞭毛体;将前鞭毛体在 4 °C 下以 1,000 × g 离心 10 分钟。
- 用 20 mL DMEM 低葡萄糖重悬前鞭毛体沉淀,使用 Neubauer 室计数,并在 4 oC 下以 1,000 × g 离心 10 分钟。
- 将 DMEM 低葡萄糖以 3-5 × 107 个前鞭毛体/mL 的密度添加到沉淀中。将 5 mL 前鞭毛体倒入 10 mL Ficoll 垫上,以 2:1 (v/v) 的比例在 DMEM 中稀释。在 4 oC 下以 100 × g 离心梯度 15 分钟,关闭制动器并缓慢加速。
- 在 Ficoll 垫顶部的界面处收集后环前鞭毛体,使用 Neubauer 室计数,并在 4 °C 下以 1,000 × g 离心 10 分钟。用 PBS 洗涤沉淀以去除任何残留的 Ficoll,使用 Neubauer 室计数,并在 4 °C 下以 1,000 × g 离心 10 分钟。
- 将沉淀在 PBS 中重悬至 2 × 109/mL。接种前将前鞭毛体放在冰上。
- 在轴系生长无鞭毛体 (MAA) 的改性培养基中,在体外将 L. infantum-Luc 的前鞭毛体与轴系无鞭毛体不同17。
- 通过添加 9.55 g/L 培养基 199 和 Early 盐和谷氨酰胺、0.5% 胰蛋白酶-酪蛋白、3 mM L-半胱氨酸、15 mM D-葡萄糖、4 mM NaHCO3、0.33 mM Na2HPO4、25 mM HEPES 制备 MAA,最终 pH 值为 6.5,并补充 20% 胎牛血清 (FCS)。
- 在培养基培养瓶 (75 cm2) 中开始培养,在生长的稳定期(第 7 天),加入 9 mL 培养基 MAA 和 1 mL 前鞭毛体,2-3 × 107 个前鞭毛体/mL。在 32 °C 下孵育 24-48 小时以允许无鞭毛分化。
- 保持轴向生长的无鞭毛体每周 2 到 3 代,直到它们达到 2-3 × 107/mL 的密度。
- 扩大 axenic 无鞭毛体培养以治疗仓鼠感染。在 20 mL 补充有 20% FCS 的 MAA 培养基中,用高密度无鞭毛体 (5 ×10 6/mL) 制备 150 cm2 烧瓶。
- 24 小时后,在 4 °C 下以 1,000 × g 离心 10 分钟,用相同体积的 PBS 洗涤,使用 Neubauer 室计数,并在 4 °C 下以 1,000 × g 离心 10 分钟。加入 PBS 以制备 50 μL 中的 10个 8 个无鞭毛体的接种物。
5. 动物
- 在 4-6 周龄时购买雄性金仓鼠,并隔离 2 周。确保它们在感染 婴儿李斯特菌 MHOM/BR/1974/PP75 时为 6-8 周大,体重为 80-100 克。
注意:该协议适用于雄性和雌性仓鼠。然而,由于当时它们的可用性,本研究只使用了雄性仓鼠。 - 将仓鼠分为四组:第 1 组,腹膜内感染无鞭毛虫 (n = 3);第 2 组,腹膜内感染前鞭毛体 (n = 3);第 3 组,牙龈静脉无鞭毛感染 (n = 2);第 4 组,牙龈静脉感染前鞭毛体 (n = 2);第 5 组,未感染的仓鼠作为对照 (n = 2)。
- 将动物放在通风的架子上,配备受控通风系统(10-15 次换气/小时),12 小时光照/黑暗循环,在 21 ± 2 oC 和 40-60% 湿度下。提供环境富集物,例如纸张、干草、疏水棉、纸板卷、高压灭菌水和 随意食用。
6. 经腹膜内途径感染
- 用物理方式将仓鼠束缚在笼子的网格上,用拇指和食指当镊子,从靠近头部的两侧捏住背部的皮肤,其他手指沿着背部拉扯皮肤,尽量多地获得皮肤。
- 将腹部右下象限的接种部位与大腿后部肌肉对齐。
- 接种时,动物身体倾斜 45º,头部低于腹部,针头位于 15° 至 20°。
- 用 13 x 0.45 mm 针头与 1 mL 注射器耦合,接种 50 μL (108) PBS 中的轴突无鞭毛体或前鞭毛体。插入斜面外 0.5 cm。将针头插入腹部后,拉动柱塞确认未插入静脉,然后小心注入液体。
7. 牙龈接种静脉感染
- 按照第 6 节约束仓鼠。腹膜内施用 200 mg/kg 10% 盐酸氯胺酮和 10 mg/kg 2% 盐酸甲苯噻嗪的混合物,最终体积为 1.3 mL,在 3 mL 注射器中与 13 x 0.45 mm 针头相连。
- 通过夹住垫子的指间底座来捏住爪子,以确保动物被麻醉。
- 用双手将麻醉仓鼠束缚在仰卧位,用拇指轻轻拉下唇,露出牙龈和牙龈静脉
- 将一根较细的针头 (8 x 0.30 mm) 沿对齿之间的中线以 25º 的角度连接到下切牙下方的 1 mL 注射器上,然后将 2-4 mm 插入下颌唇静脉。
- 为了确认接种物是静脉注射的并且针头已插入下颌唇静脉,抽吸血液直到针筒(黄色部分)。
- 在 PBS 中缓慢小心地注射 50 μL (10,8) 无鞭毛体或前鞭毛体的接种物,持续 1 分钟,直到接种完整个体积,以避免接种物和血液从静脉泄漏到外部环境,并允许在血液中分散。
- 拔针前,用棉签轻轻按压。同时,保持棉签从血管中取出针头,以促进该部位的止血,轻压 1 分钟,以避免出血和接种物丢失
8. 心脏穿刺放血安乐死
- 约束动物麻醉,如第 7 节所述。用 20 x 0.55 毫米的针头与 5 mL 注射器相连,以 45º 角插入并略微向左倾斜,就在剑突软骨下方。
- 抽取 1 mL 血液。终末采血后,取出注射器,但将针头留在心脏中。
- 如果动物已经有呼吸并显示心跳,则用 5 mL 注射器注射 5% (200 mg/kg) 硫喷妥钠,并将其连接到已经在心脏中的 20 x 0.55 mm 针头上。
- 5 分钟后,用听诊器验证是否有任何呼吸运动和心跳。
9. 从器官和组织中提取 DNA
- 安乐死后,收集脾脏、肠系膜淋巴结和肝脏碎片。
- 通过在干冰上冷冻、解冻并用两个手术刀刀片切割来切割组织。在 600 μL 裂解缓冲液中用 17.5 μL 蛋白酶 K (20 mg/mL) 消化 20 mg 碎组织,并在 55 °C 下孵育过夜。
- 以 15,000 × g 离心 4 分钟,以去除未裂解的组织片段。
- 加入 200 μL 蛋白质沉淀溶液,剧烈混合 20 秒,在冰上孵育 5 分钟,然后以 15,000 × g 离心 4 分钟。
- 将上清液转移到另一管中,加入 600 μL 异丙醇,轻轻混匀直至 DNA 沉淀。将 DNA 以 15,000 × g 离心 2 分钟,然后在倾斜摇床中用 70% 乙醇洗涤沉淀 30 分钟并离心。
- 弃去乙醇并在室温下干燥沉淀。用 50-200 μL 超纯水在 65 °C 下再水合 DNA 30 分钟,定量并稀释 DNA 至 0.1 μg/mL,并储存在 -20 °C。
10. 通过 PCR 评估组织和器官感染
- 通过常规 PCR 评估组织和器官基因组 DNA 中的寄生虫载量:2.5 μL PCR 缓冲液、1.5 mM MgSO4、0.2 mM dNTP、1 U DNA 聚合酶、300 ng 基因组 DNA、0.2 μM 每种引物和无核酸酶水,最终体积为 25 μL。
- 使用 婴儿李斯特菌 kDNA18 的方案进行扩增:在 94 °C 下变性一个循环,持续 2 分钟;扩增 39 个循环,94 °C 下 30 秒,60 °C 下 15 秒,72 °C 下 30 秒,最后在 72 °C 下延长 5 分钟。 PCR 产物的预期大小为 145 bp。(1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3';(2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'。
- 扩增仓鼠 GAPDH,PCR3 的内源性对照:在 94 °C 下变性 1 个循环 2 分钟,扩增 39 个循环,在 94 °C 下 30 秒,在 58 °C 下 15 秒,在 72 °C 下 30 秒,在 72 °C 下最后延伸 5 分钟。(1) Fw GAPDH 仓鼠 5'- GGTTGCCAAACCTTATCAGAAATG-3';(2) Rv GAPDH 仓鼠 5'- TTCACCTGTTCCACAGCCTTG -3'。
- 通过 1% 琼脂糖凝胶电泳分析 PCR 产物。
11. 通过 体内 生物发光成像对仓鼠进行随访
- 通过生物发光 体内 成像系统中整个动物的生物发光发射来评估感染随时间的进展,该系统由安装在不透光室上的冷却电荷耦合相机 (CCD) 组成。在通过鼻锥输送进行图像采集期间保持动物麻醉。
- 在生物发光采集前和诱导麻醉前 5 分钟,按照第 6 节将 D-荧光素 (150 mg/kg) 腹膜内注射到仓鼠中。在 PBS 中制备 15 mg/mL D-荧光素钾盐储备液,过滤灭菌并储存在 -80 °C。
- 用 D-荧光素注射动物 5 分钟后,在富氧诱导室中用 2% 异氟醚麻醉它们。再过 5 分钟后,使用 CCD 相机捕获生物发光图像。在感染后 2 小时和 24 小时,感染后 8 天和 22 天 (dpi) 获得仓鼠腹侧位置的图像。
注意:在成像过程中使用异氟烷-氧气输送装置保持麻醉。 - 根据生物发光发射水平,使用以下参数: 曝光时间,范围从 30 秒到 5 分钟,中等或大像素位,f/stop 1 和 视场 D (12、5 厘米)。
12. 感染 婴儿乳杆菌 - Luc 的动物的生物发光定量
- 使用手动测量工具识别动物头部和身体的感兴趣区域 (ROI)、大小和面积。量化 CCD 相机在所选 ROI 中采集的生物发光。
- 用平均背景 ROI 测量背景信号,并从手动 ROI 获得的生物发光发射中减去。
- 以辐射度表示生物发光发射,该单位按时间和面积标准化:photons.sec-1.cm-2.sr-1
结果
婴儿乳杆菌荧光素酶的稳定表达
转基因婴儿李斯特菌是使用 pLEXSY 系的质粒生产的,该质粒整合到利什曼原虫基因组的 18S rRNA (ssu) 核糖体基因座中,其转录由 RNA 聚合酶 I 驱动。因此,评估了婴儿李斯特朗病毒克隆在利什曼原虫基因组中的质粒整合,以及通过体外生物发光发射的稳定表达.选择显示生物发光 > 120 倍于背景的高表达克隆,用于通过 PCR 评估基因组整合。参见图 1 PCR 产物的琼脂糖凝胶电泳,以评估 L. infantum-Luc 克隆前鞭毛体基因组中的质粒整合和生物发光发射 (RLU)。从每次 PCR 中获得预期大小的片段;从婴儿李斯特菌基因组中扩增出一个大约 1.1 kb 的产物 (5'ssu - UTR1) 和另一个 1.8 kb (hyg-3'ssu) 的产物(图 1A),证实了质粒盒和荧光素酶基因在婴儿李斯特菌基因组的 ssu 位点中的整合。
如方案第 2 节所述,还通过酶标仪中的生物发光发射 (RLU) 评估了 L. infantum-Luc 前鞭毛体中萤火虫荧光素酶的表达。即使在培养物和 BALB/c 小鼠中多次传代 5 天后,它仍保持生物发光水平;野生型背景为 569.3 ± 19.5,克隆婴儿 乳杆菌 - Luc 为 59361.9 ± 2673.3 (n = 2)(图 1B)。因此,稳定表达萤火虫荧光素酶的 L. infantum-Luc 克隆被用于通过龈内或腹膜内途径感染仓鼠。
牙龈静脉注射剂
为了将 利什曼原虫 接种到仓鼠的血液中,应注意尽量减少静脉穿孔、出血和接种物泄漏。因此,必须轻轻地向下拉下唇以露出牙龈静脉(图 2A);并且必须使用较小规格的 30 G 针头,以避免静脉过度穿孔。针头的位置必须使挡板朝上,以适当的角度插入静脉(图 2B)。事实上,为了确保针头被注射到血管 - 下颌唇静脉中,必须向下拉注射器柱塞,直到血液被吸入针筒中(图 2C)。在拔针之前,必须用棉签轻轻按压以促进止血(图 2D)。
通过生物发光成像进行纵向评估
对腹膜内 (IP) 或通过牙龈内 (IG) 感染 婴儿李斯特乳杆菌-Luc 的仓鼠进行随访直至第 50dpi ,并通过生物发光成像进行评估直至 22 dpi(图 3)。腹膜腔内感染 108 个寄生虫后 2 小时获取图像;图像采集 30 秒或 1 分钟的曝光像素合并介质。无鞭毛体感染的动物腹部的生物发光信号 (4.6 × 105 ± 3.7 × 105) 的腹部生物发光信号比前鞭毛体感染的动物 (6.8 × 103 ± 3.8 × 103) 强 >65 倍)(表 1),这表明 体外 分化的无鞭毛体在固定相比超环前鞭毛体更具生物发光性,并在 Ficoll 垫中被纯化。
感染后 1 天 (1 dpi),获取生物发光图像 3 分钟曝光(图 3)。前鞭毛体感染的仓鼠腹部区域的生物发光信号减少了 45%,而无鞭毛体感染的仓鼠的生物发光信号衰减了 70%(图 3),这表明无鞭毛体的降解程度比后环前鞭毛体更大(表 1 和图 4)。感染后一周 (8 dpi),前鞭毛体感染的动物维持生物发光信号 (3.3 × 103 ± 5 × 103)。然而,无鞭毛体感染仓鼠的生物发光发射下降了 95%,从 1.3 × 105 ± 1.1 × 105 到 6.7 × 103 ± 7.5 × 103,并达到了与前鞭毛体感染仓鼠相同的水平。感染后 3 周 (22 dpi),获得生物发光信号 5 分钟的曝光和大分档(图 3);前鞭毛体和无鞭毛体感染的动物的信号要低得多(表 1 和图 4)。
另一组仓鼠通过牙龈内途径感染了 L. infantum-Luc 的无鞭毛体和前鞭毛体 (10,8);在上颌区域观察到生物发光发射(图 3)。感染后 1 天开始随访,无鞭毛体感染的仓鼠比前鞭毛体感染的仓鼠表现出更多的生物发光信号和辐射 (7.3 × 103 ± 4.1 × 103) (1 × 103 ± 5.7 × 102)。感染后一周 (8 dpi),在前鞭毛体感染的动物中观察到生物发光信号下降 36%,在无鞭毛体感染的仓鼠中观察到 90% 的下降;辐射度从 7.3 × 103 ± 4.1 × 103 到 7.8 × 102 ± 5.6 × 102 不等(表 1)。感染后 3 周 (22 dpi),还获得了生物发光信号,用于 5 分钟的曝光和大分档(图 3)。对于牙龈感染的动物头部中前鞭毛体和无鞭毛体感染的动物(表 1 和 图 4),生物发光信号相似且较低,并且未观察到生物发光信号将感染分散到腹部区域。
通过 PCR 评估组织和器官感染
我们进行了常规 PCR 以调查特定器官(如肝脏、脾脏和淋巴结)的感染情况,这些器官可能低于 体内 成像的检测限。kDNA 的靶区域对感染组织和器官中婴儿 李斯特菌 DNA 扩增更具特异性,仓鼠 GAPDH 酶的 PCR 是 DNA 完整性和 PCR 反应的对照。分析仅考虑为 GAPDH 扩增的样品。因此,通过 PCR,通过腹膜内途径感染 axenic 无鞭毛肌的 3 只仓鼠中有 2 只显示组织和器官感染;脾脏中的动物 2 (A2) 和肝脏中的动物 3 (A3),为 50 dpi(图 5A)。一只仓鼠腹膜内感染了 axenic 前鞭毛体;动物 3 (A3) (图 5B) 显示淋巴结扩增。在 50 dpi 的龈内接种前鞭毛体或轴系无鞭毛体的仓鼠不能显示明显的扩增 - 只是动物一 (A1) 肝脏中感染前鞭毛体的一条带(图 5C)。值得注意的是,我们有 3 只动物维持了 8 个月,它们通过龈内途径接种的无鞭毛肌在注射过程中略微泄漏。三只动物中的两只显示出明显的肝脏感染,动物 1 和 2(图 5D)。
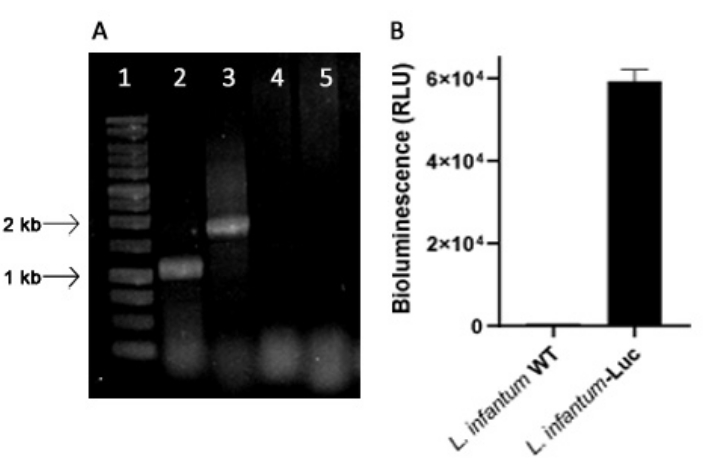
图 1:通过 PCR 和生物发光发射评估 婴儿利什曼原虫-Luc 克隆。 (A) PCR 产物的琼脂糖凝胶电泳以评估基因组中的质粒整合:泳道 1 - 1 kb DNA 分子量标准; 婴儿李斯特菌-Luc 基因组 DNA 的 PCR,泳道 2 - 5'ssu - utr1 (1.1 kb) 和泳道 3- hyg-3'ssu (1.8 kb); 婴儿李斯特菌基因组 DNA 的 PCR,泳道 4 和 5。(B) 微孔板读数仪中 L. infantum-Luc 克隆 (10,6) 前鞭毛体的生物发光发射 (RLU)。 请单击此处查看此图的较大版本。

图 2:将 利什曼原虫 (Leishmania infantum-Luc) 静脉注射到牙龈静脉中。 (A) 将仓鼠置于背侧 decubitus 中,下唇被拉下。(B) 将一根较细的针头 (8 x 0.30 mm) 连接到 1 mL 注射器,沿对牙之间的中线以 25º 的角度定位在下切牙下方,并插入下颌唇静脉 2-4 mm。(C) 在 PBS 中接种 50 μL (108) 无鞭毛体或前鞭毛体。(D) 使用棉签止血并对接种部位施加轻微压力。 请单击此处查看此图的较大版本。
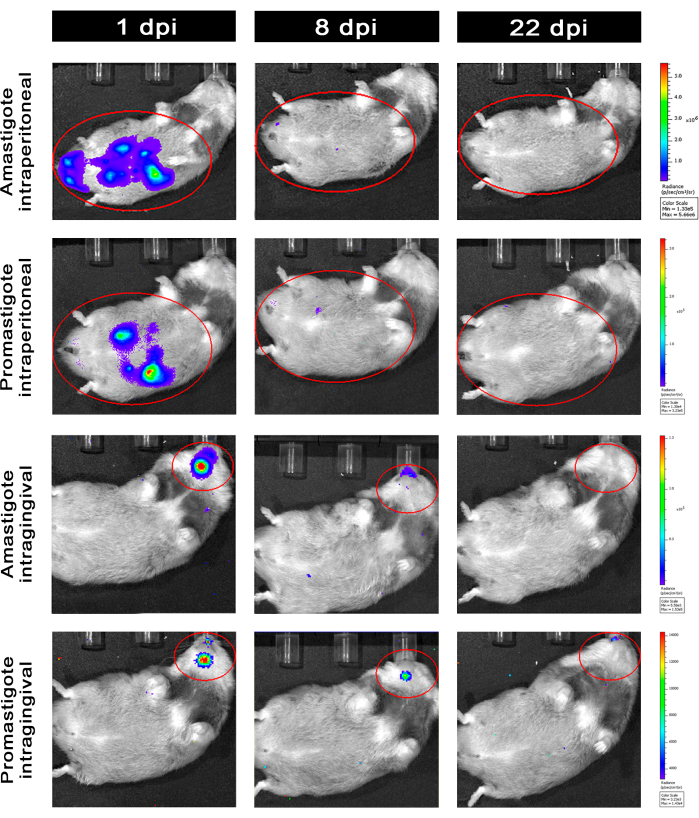
图 3:通过 体内生物 发光成像进行随访。 每组一只动物的代表性图像:通过腹膜内(上面板)或龈内(下面板)感染,用 婴儿乳杆菌-Luc 的无鞭毛体或前鞭毛体感染,持续 1、8 和 22 dpi。红色 ROI 分别代表腹部和头部的腹膜内或牙龈内感染的探测区域。数据显示,在 1 dpi 时,所有动物的腹部或下颌骨都显示生物发光信号。信号在 8 dpi 后下降,并且在 22 dpi 时在任何组中几乎无法检测到。 请单击此处查看此图的较大版本。
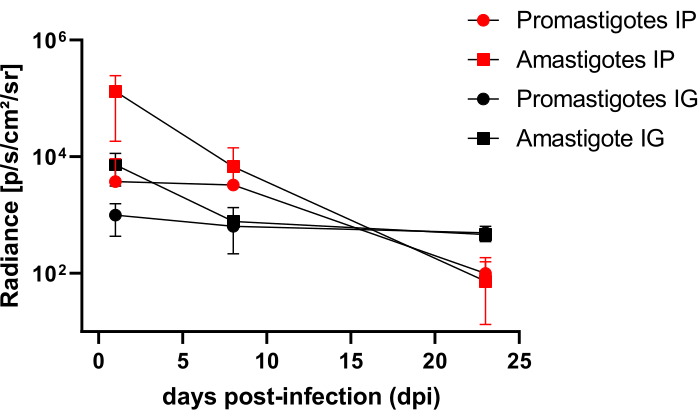
图 4:生物发光图像辐射度的比较分析。 使用手动 ROI 测量工具在仓鼠的腹部或头部进行辐射定量 photons.sec-1.cm-2.sr-1。从测量 ROI 中减去平均背景 ROI 以去除任何虚假信号。请单击此处查看此图的较大版本。
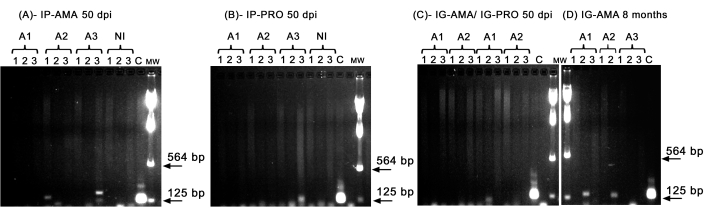
图 5:kDNA 的 PCR 扩增。 (A) IP-AMA,通过腹膜内途径用无鞭毛体感染的仓鼠,50 dpi (n = 3);(B) IP-PRO,通过腹膜内途径感染前鞭毛体,50 dpi (n = 3);(C) IG-AMA,经龈内途径感染无鞭毛体 (n = 2),IG-PRO,经龈内途径感染前鞭毛体 (n = 2);(D) IG-AMA,感染后 8 个月通过牙龈内途径感染无鞭毛体 (n = 3)。NI,未感染的仓鼠作为阴性对照 (n = 2);C- 婴儿乳杆菌-Luc 的基因组 DNA,PCR 阳性对照。组织和器官:1- 脾脏,2- 肝脏,3- 淋巴结。MW- 分子量标记,箭头表示较低的分子量条带。A1- 动物 1,A2- 动物 2,和 A3- 动物 3。 请单击此处查看此图的较大版本。
| DPI | Amastigotes IP | 前鞭毛体 IP | Amastigotes IG | 前鞭毛体 IG | ||||||||
| 意味 着 | 标清 | N | 意味 着 | 标清 | N | 意味 着 | 标清 | N | 意味 着 | 标清 | N | |
| 0 | 4.6 x 105 | 3.7 x 105 | 3 | 6.8 x 103 | 3.8 x 103 | 3 | - | - | - | - | - | - |
| 1 | 1.3 x 105 | 1.1 x 105 | 3 | 3.8 x 103 | 5.5 x 103 | 3 | 7.3 x 103 | 4.1 x 103 | 2 | 1.0 x 103 | 5.7 x 102 | 2 |
| 8 | 6.7 x 103 | 7.5 x 103 | 3 | 3.3 x 103 | 5.0 x 103 | 3 | 7.8 x 102 | 5.6 x 102 | 2 | 6.4 x 102 | 8.2 x 101 | 2 |
| 22 | 7.3 x 101 | 8.5 x 101 | 3 | 9.9 x 101 | 8.6 x 101 | 3 | 4.6 x 102 | 7.5 x 101 | 2 | 5.0 x 102 | 1.5 x 102 | 2 |
表 1:来自生物发光图像比较辐射分析的原始数据。 辐射定量平均 photons.sec-1.cm-2.sr-1 按组和路由。缩写: dpi = 感染后天数;SD = 标准差;N = 样本量。
讨论
各种科学研究都需要采血或向仓鼠静脉注射物质。已经开发了几种方法来访问与研究目标直接相关的不同收集或接种途径19。由于仓鼠的解剖结构 - 短尾巴和四肢 - 心内途径通常是静脉注射 利什曼原虫的选择。根据所使用的菌株,心内途径被证明是有利的参考菌株 婴儿李斯特菌 MHOM/BR/1974/PP75,其感染发生在长期 6-9 个月内5。然而,它是一种可导致动物出血和死亡的接种物。因此,我们标准化了牙龈丛(下颌唇静脉)感染的替代静脉接种途径,对动物造成的伤害较小。动物感染了转基因参考菌株 婴儿乳杆菌 MHOM/BR/1974/PP75,即使在培养物和小鼠中多次传代后,该菌株也能稳定地表达萤火虫荧光素酶(图 1),这与由相同整合质粒转染的其他 利什曼原虫 物种有关20。
唇下颌静脉或牙龈静脉是采血和多次采血的更好途径10,11。然而,这是首次证明牙龈静脉是仓鼠利什曼原虫静脉感染的可行部位。与通常使用高规格 26 G 针头以避免血液溶血10 的采血相比,由于静脉穿孔、出血和接种物泄漏,这种针规不适用于利什曼原虫接种。对于通过上颌下颌静脉感染利什曼原虫,较小规格的 30G 针头是必不可少的。区分静脉穿刺与通过牙龈静脉感染的另一个方面是给药速率,约为 1 μL/s;并确保它被注射到血管中 - 下颌唇静脉,而不是卡在粘膜、皮下或皮内。由于牙龈丛的血液周转率低,50 μL 的 axenic 无鞭毛体或婴儿 L. Luc 前鞭毛体的高密度接种物,2 x 109 个寄生虫/mL,必须缓慢接种(~ 1 分钟),并且必须通过保持拭子按压 1 分钟来移除针头,以允许接种物分散在血液中(图 2)。
为了对感染进行纵向评估,用婴儿 李斯特菌-Luc 腹膜内 (IP) 或通过龈内 (IG) 途径感染仓鼠,并通过生物发光成像系统随访 50 dpi,直至安乐死。考虑到参考菌株 PP75 本身 的毒性可能较低,并且荧光素酶的超表达也会影响感染效果并长期维持感染,因此使用 108 种寄生虫的高接种物进行感染。在牙龈接种婴儿 乳杆菌-Luc 的无鞭毛体和前鞭毛体并通过生物发光成像系统评估后,生物发光仅限于感染后 24 h 仓鼠的上颌区。事实上,腹膜内感染婴儿 乳杆菌和前鞭毛体的仓鼠表现出分散在整个腹部的生物发光(图 3,1 dpi)。从感染的第一天到第 8 天,直到感染 婴儿 李斯特兰克的仓鼠的第 22 个 dpi,生物发光发射随时间的持续减少与接种途径无关(表 1 和 图 4)。
然而,当动物组织中的寄生虫负荷较低时,它可能低于生物发光成像系统的检测限,但可以通过 PCR 或 qPCR 进行检测和定量。正如已经报道的那样,菌株 PP75 引起的感染确实低于其他菌株5,并且由于动物的遗传变异性,只有少数菌株出现疾病的临床症状。在这项研究中,尽管动物数量少且该菌株的毒力较低,但 axenic 无鞭毛体在 50 dpi 时表现出优势,显示出比前鞭毛体更好的感染,如 PCR 所示(图 5)。通过牙龈途径感染无毛肌 8 个月后,可以通过肝脏中的 PCR 检测到寄生虫(图 5),它们还表现出中度竖毛、眼眶紧绷和拱形姿势。
Axenic 无鞭毛体可能是比前鞭毛体21 更好的感染和随访选择,并且具有易于大规模生产的优势。牙龈接种物是可行的,并且是静脉接种化合物以及感染 利什曼原虫 和其他病原体的更好途径,不会在下颌骨应用部位或对动物健康造成损伤或肿胀。
披露声明
作者没有需要披露的利益冲突。
致谢
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT.PPSUS/Decit-MS/CNPq/SES 为本研究提供了资金支持。感谢 Monique Ribeiro de Lima 关于接种途径的建议。该项目是根据 FIOCRUZ 和里约热内卢联邦大学 - UFRJ 之间的 No 258/2017 合作协议开发的。该团队衷心感谢科学普及中心 (IOC) 的视频制作人 Ricardo Baptista Schmidt 和 Genilton José Vieira 在拍摄协议和进行采访方面的宝贵支持和帮助。
材料
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
参考文献
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。